Е.В. Бирюкова1, Н.М. Платонова2
1ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России, Москва, Россия;
2ФГБУ «Национальный медицинский исследовательский центр эндокринологии», Москва, Россия
Сахарный диабет 2-го типа (СД 2) – самое распространенное эндокринное заболевание, занимающее 4-е место среди лидирующих причин смертности. По данным Всемирной организации здравоохранения, от диабета ежегодно умирают около 5 млн человек – это больше, чем от ВИЧ-инфекции (1,5 млн), туберкулеза (1,5 млн) и малярии (0,5 млн); а в развитых странах от СД погибают 8–9% населения [1]. Область диабетологии постоянно развивается, появляются инновационные классы сахароснижающих средств, но все еще не решены многие проблемы, связанные с достижением должного метаболического контроля, равно как и с предотвращением хронических осложнений СД 2, которые приводят к ранней инвалидизации и преждевременной смертности [2].
Известно, что только к моменту диагностики СД 2 диабетические осложнения наблюдаются практически у 1/2 больных [3, 4]. Исследование CODE-2 (Cost of Diabetes in Europe – Type 2), изучавшее распространенность различных хронических осложнений у больных СД, показало, что разные осложнения имели 59% обследованных, причем у 23% было 2, а у 3% – 3 осложнения и более [5].
Совершенствование подходов к терапии СД 2 – приоритетная проблема современной медицины, и лечебная стратегия должна, прежде всего, предупреждать и сводить к минимуму риск развития хронических осложнений заболевания [6]. В настоящее время снижение гипергликемии ориентированно на достижение индивидуальных целевых уровней гликированного гемоглобина (HbA1c) [7]. С учетом новых данных доказательной медицины в 2019 г. обновлены «Алгоритмы специализированой медицинской помощи больным сахарным диабетом» [8]. Новые рекомендации Российской ассоциации эндокринологов предлагают подход для индивидуализированного выбора целей терапии по HbA1c, основанный на возрасте пациента, ожидаемой продолжительности жизни, наличии атеросклеротических сердечно-сосудистых заболеваний (АССЗ) и риска тяжелой гипогликемии (табл. 1).
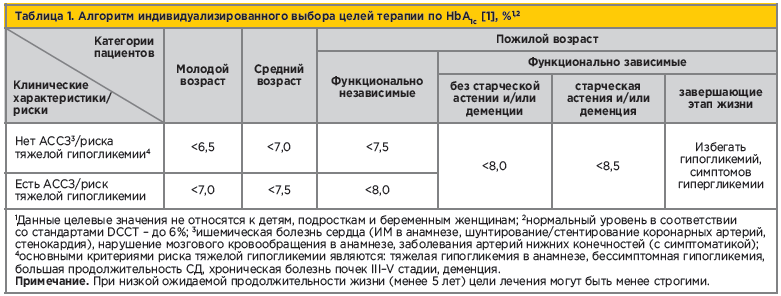
Важным новшеством стало то, что определение индивидуального уровня HbA1c у пациентов пожилого возраста основано на простом делении на функционально независимых и функционально зависимых лиц. Уровень HbA1c<7,5% рекомендован для функционально независимых пациентов пожилого возраста в случае отсутствия у них АССЗ/риска тяжелой гипогликемии; при наличии АССЗ/риска тяжелой гипогликемии следует стремиться к достижению уровня HbA1c<8,0%. Для функционально зависимых пожилых пациентов, не имеющих старческой астении и/или деменции, рекомендован целевой уровень HbA1c<8,0%, для тех, у кого есть старческая астения и/или деменция – менее 8,5%. Вместе с тем у пожилых пациентов, завершающих этап жизни, цель лечения должна заключаться не в достижении конкретной цели HbA1c, а в минимизации симптомов гипергликемии, также необходимо избегать гипогликемий.
Доказательства, полученные в крупных клинических исследованиях, четко свидетельствуют о том, что достижение эффективного гликемического контроля предотвращает или значительно снижает риск развития и прогрессирования хронических осложнений у пациентов с СД [9, 10]. Однако достижение целевого уровня HbA1c невозможно представить без регулярного самоконтроля гликемии (СКГ) со стороны пациента [11, 12].
Современное понимание СКГ подразумевает определенную кратность систематических измерений уровней глюкозы крови и является важным ориентиром, используемым как врачом, так и пациентом для оценки результата лечения и его коррекции при необходимости [11, 13].
В соответствии с Российскими клиническими рекомендациями [8] больным СД 1 необходимо ежедневно не менее 4 раз определять гликемию, периодически измеряя ее в 3 ч ночи. СКГ при СД 2 без осложнений в дебюте заболевания и при недостижении целевых уровней гликемического контроля следует осуществлять ежедневно не менее 4 раз в сутки (до еды, через 2 ч после еды, на ночь, периодически ночью). В дальнейшем его частота определяется видом проводимой сахароснижающей терапии. На диетотерапии СКГ рекомендован не менее 1 раза в неделю. В случае применения пероральной сахароснижающей терапии и/или агонистов рецепторов глюкагоноподобного пептида-1 (ГПП-1) и/или базального инсулина СКГ осуществляется не менее 1 раза в сутки в разное время и дополнительно один гликемический профиль (измерения не менее 4 раз в сутки) в неделю. На фоне терапии готовыми смесями инсулина – не менее 2 раз в сутки в разное время и дополнительно один гликемический профиль (измерения не менее 4 раз в сутки) в неделю, на интенсифицированной инсулинотерапии – ежедневно не менее 4 раз (до еды, через 2 ч после еды, на ночь, периодически ночью).
При наличии признаков хронических осложнений СД, присоединении сопутствующих заболеваний, появлении дополнительных факторов риска вопрос о частоте обследований решается индивидуально.
Роль СКГ в достижении целевого уровня HbA1c и предотвращении гипогликемий
СКГ является основой эффективности проводимой сахароснижающей терапии и профилактики гипогликемии. С позиции доказательной медицины уровень HbA1c начинает значимо улучшаться, как только пациент увеличивает частоту СКГ независимо от типа СД или вида сахароснижающей терапии [12–14]. Следует напомнить, что СКГ имеет большое значение в повышении приверженности пациента с СД рекомендованному лечению [11].
СД считается основным независимым фактором риска ССЗ, таких как острый инфаркт миокарда (ОИМ), инсульт, сердечная недостаточность, поражение периферических артерий [6, 15]. Общая смертность среди пациентов с СД выше, чем при отсутствии СД, а ССЗ по-прежнему остаются главными причинами смерти у больных СД 2 [10]. С этих позиций прогноза заболевания значимо, что систематический СКГ способствует уменьшению общей смертности, а также смертности от сердечно-сосудистой патологии у пациентов с СД [16–18]. Хорошей иллюстрацией сказанному является исследование ROSSO (Retrolective Study Self Monitoring of Blood Glucose and Outcome in people with Type 2 Diabetes), в котором анализу были подвергнуты данные 3268 пациентов (из них 1479 пациентов проводили СКГ, в то время как 1789 – его не проводили) [19]. На фоне регулярного СКГ риск развития осложнений (ОИМ, инсульт, ампутации, слепота, необходимость гемодиализа) и риск смертности от СД снижались на 32 и 51% соответственно. Результаты ROSSO обнаружили, что СКГ в состоянии заметно увеличивать продолжительность, и что немаловажно, улучшать качество жизни пациентов с СД 2, независимо от характера использованной фармакотерапии.
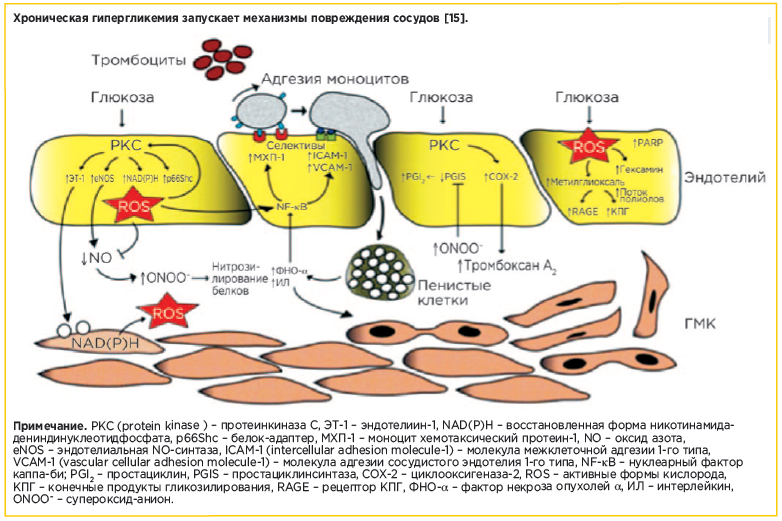
Говоря о снижение частоты сосудистых осложнений диабета у пациентов с СД, следует подчеркнуть особую роль мониторинга постпрандиальной гликемии, или гликемии через 2 ч после приема пищи, поскольку в этом промежутке достаточно часто отмечается гипергликемия, наблюдаемая даже у пациентов с целевым уровнем HbA1c. Постпрандиальная гипергликемия (ППГ), запуская каскад различных патологических механизмов (см. рисунок), влияет на развитие микро- и макрососудистых осложнений, ассоциируется с увеличением риска развития онкологических заболеваний, нарушением когнитивной функции. В частности, неблагоприятные последствия ППГ сводятся к повышению образования протеинкизазы С, падению биологической активности оксида азота, клеточному оксидативному стрессу и активации NF-kВ-рецепторов и, как следствие, развитию эндотелиальной дисфункции и атерогенеза. Последствия гипергликемии после еды включают активацию свертывающей системы крови, функции тромбоцитов, повышение активности ренин-ангиотензин-альдостероновой системы, изменения липидного профиля атерогенного характера [20, 21]. Поэтому СКГ обязательно должен включать измерение глюкозы не только натощак, но и через 2 ч после приема пищи.
Регулярный СКГ сопровождается не только дополнительным снижением уровня HbA1c (по сравнению с теми пациентами, которые его не осуществляли), но и имеет первостепенное значение в предотвращении гипогликемических состояний и позволяет избежать резких колебаний уровня глюкозы в крови. Частые гипогликемии способствуют увеличению как общей, так и сердечно-сосудистой смертности в результате развития фатальной аритмии, ишемии миокарда, мозга [22].
Снижение частоты гипогликемических эпизодов является ключевым моментом в управлении СД. Необходимо помнить, что среди врачей проблема гипогликемий чаще ассоциируется преимущественно с СД 1 и может недооцениваться при СД 2. Проводя сахароснижающую терапию, следует выявлять пациентов с высоким риском гипогликемий; возраст, патология почек и печени увеличивают его. В настоящее время во всех современных рекомендациях подчеркиваются преимущества сахароснижающих препаратов с низким риском гипогликемий [7, 8]. У больных с высоким риском гипогликемий рекомендуется рассмотреть в составе сахароснижающей терапии препараты, характеризующиеся низким риском их развития: метформин, ингибиторы дипептидилпептидазы-4, агонисты рецепторов ГПП-1, ингибиторы натрий-глюкозного котранспортера 2, тиазолидиндионы.
Симптомы гипогликемии очень неспецифичны, что может затруднить быстрое распознавание и лечение этого состояния. Следует помнить, что частые эпизоды гипогликемии, даже легкой степени, вызывают постепенное истощение контррегуляторных защитных механизмов, что приводит к утрате способности распознавать симптомы этого состояния [23, 24]. СКГ позволяет своевременно выявить гипогликемию и, соответственно, осуществить мероприятия, направленные на ее купирование [13, 14]. В ночное время гипогликемические эпизоды также могут быть бессимптомными, включая тяжелые и даже потенциально опасные для жизни пациента с СД. Поэтому крайне важно периодически контролировать и уровень гликемии в этот временной промежуток.
Особенно важен самоконтроль у больных СД, получающих инсулинотерапию. Она жизненно необходима для всех пациентов с СД 1. По мере увеличения длительности заболевания у пациентов с СД 2 прогрессирует дефицит инсулина, возникает потребность в инсулине, ибо успех любой терапии неинсулиновыми сахароснижающими препаратами зависит от остаточной функции b-клетки. Эффективность лечения инсулином связана с регулярным СКГ. В исследовании ORIGIN (Outcome Reduction With Initial Glargine Intervention) титрация дозы базального инсулина гларгин осуществлялась с помощью доступного алгоритма на основании показателей СКГ, что позволило достигнуть целевого гликемического контроля при высокой безопасности проводимой инсулинотерапии [25].
Пациенту крайне важно приобрести навыки гибкого управления дозами различных препаратов инсулина в зависимости от приема пищи, физической активности и уровня гликемии для достижения и поддержания целей терапии и предотвращения гипогликемий. Особенно это касается пациентов c СД 1, владеющих методами профилактики гипогликемий, которым можно заниматься любыми видами физической активности с учетом возможных противопоказаний и мер предосторожности. Также пациент должен пунктуально и четко заносить информацию по результатам СКГ в дневник и демонстрировать врачу.
Технические аспекты СКГ в клинической практике
Для оценки гликемического контроля используют самоконтроль глюкозы капиллярной крови с помощью глюкометров. История самоконтроля насчитывает немало лет, однако последние технологические новшества позволили повысить точность измерения глюкозы крови и максимально упростить эту процедуру измерения гликемии.
Клинический опыт показывает, что выбор качественного прибора для СКГ определяется простотой использования, удобством работы глюкометра, легкостью получения результата, что позволяет без труда осуществлять процедуру измерения глюкозы в крови пациентам любого возраста. Не менее важным моментом является достоверность полученных результатов измерения и доступность тест-полосок.
Соответствие стандартам точности – наиболее важный критерий для выбора глюкометра, поскольку полученные результаты измерения глюкозы крови являются основой для коррекции сахароснижающей терапии при необходимости. Аналитическая точность глюкометра – это близость результатов измерений концентрации глюкозы в крови в широком диапазоне, выполненных с помощью глюкометра, к результатам референтных измерений, получаемых с помощью эталонного лабораторного анализатора [26].
Вместе с тем далеко не всегда глюкометры могут гарантировать точность измерений, на которую влияют прием некоторых лекарственных средств, экзогенные (температура, влажность, парциальное давление кислорода в окружающем воздухе) и эндогенные факторы (уровень гематокрита, парциальное давление кислорода в крови, кетоацидоз, дегидратация) [27].
Современный глюкометр Контур Плюс (Contour Plus) обладает мультиимпульсной технологией: за счет многократной оценки одного образца крови минимизируется влияние различных экзо- и эндогенных факторов, повышается точность измерения, которая становится сопоставимой с лабораторной, что важно для подбора эффективного лечения. Этот прибор не только отвечает ключевым требованиям обновленного стандарта точности, но и превосходит требования ISO 15197: 2013 [28]. Высокая точность измерения глюкозы крови в системе мониторинга Контур Плюс (Contour Plus), подтвержденная результатами исследований [29, 30], была достигнута благодаря совершенствованию технологий определения гликемии.
Прибор удобен в применении, что позволяет упростить процесс измерения глюкозы [29]. В глюкометре Контур Плюс (Contour Plus) применяется технология «Без кодирования» – прибор самостоятельно считывает характеристики каждой тест-полоски при ее введении. Отпадает необходимость введения кода тест-полоски пациентом вручную, смены кодирующего чипа или кодирующей полоски, проверки кода каждой новой упаковки тест-полосок.
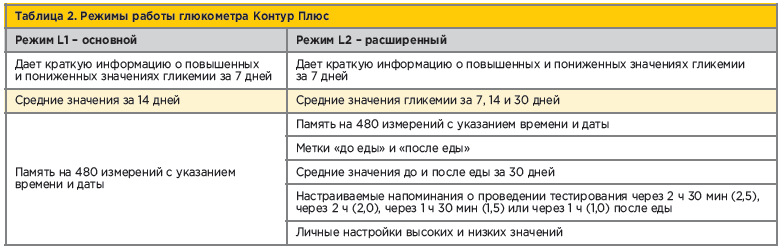
Технология «Второй шанс» позволяет при необходимости в течение 30 с нанести дополнительную каплю крови на ту же тест-полоску без повторного прокалывания пальца, если первой капли оказалось недостаточно. Глюкометр Контур Плюс (Contour Plus) имеет два режима работы, позволяющие расширить возможности контроля гликемии (табл. 2).
Примерно 1/2 пациентов, страдающих СД 2, – это лица старше 65 лет, для которых гликемический контроль является важным фактором предотвращения диабетических осложнений (часто летальных), продления жизни, а также улучшения качества жизни [31], и простота обращения с прибором для СКГ является дополнительным достоинством глюкометра у данной группы больных.
В заключение следует подчеркнуть, что наличие современных простых удобных в обращении глюкометров, умение ими правильно и регулярно пользоваться превращает пациента в активного и полноправного участника управления СД. Применение глюкометров с высокой клинически доказанной точностью измерения глюкозы крови позволит повысить эффективность и безопасность сахароснижающей терапии и улучшить прогноз заболевания.
 Список используемой литературы
Список используемой литературы
1. Botnariu G, Bulgaru-Iliescu D. Determinant factors of cardiovascular mortality in type 2 diabetic patients: literature review. Rom J Leg Med 2010; 18 (4): 309–14. DOI: 10.4323/rjlm.2010.309
2. Nickerson HD, Dutta S. Diabetic Complications: Current Challenges and Opportunities. J Cardiovasc Transl Res 2012; 5 (4): 375–9.
3. Ruigomez A, Rodrigues LA. Presence of diabetes related complication at the time of NIDDM diagnosis: an important prognostic factor. Eur J Epidemiol 1998; 14 (15): 439–45.
4. Martin S. Epidemiology of Complications and Total Treatment Costs from Diagnosis of Type 2 Diabetes in Germany. Exp Clin Endocrinol Diabetes 2007; 115 (4): 240–3. DOI: 10.1055/s-2007-970577
5. Massi-Benedetti M. The Cost of Diabetes in Europe – Type II: the CODE-2 Study. Diabetolody 2002; 45 (7): S1-4.
6. Schwartz SS, Epstein S, Corkey BE et al. A Unified pathophysiological construct of diabetes and its complications. Trends Endocrinol Metab 2017; 28 (9): 645–55. DOI: 10.1016/j.tem.2017.05.005
7. ADA Standards of Medical Care in Diabetes. Diabetes Care 2018; 41: S1-S156.
8. Алгоритмы специализированной медицинской помощи больным сахарным диабетом. Под ред. И.И.Дедова, М.В.Шестаковой, А.Ю.Майорова. 9-й вып. М., 2019.
9. Holman RR, Paul SK, Bethel MA et al. 10-year follow-up of intensive glucose control in type 2 diabetes. N Engl J Med 2008; 359: 1577–89.
10. Papatheodorou K, Papanas N, Banach M et al. Complications of Diabetes. J Diabetes Res 2016; 2016: 6989453.
11. McGeoch G, Derry S, Moore RA. Self-monitoringof blood glucose in type-2 diabetes: what is the evidence? Diabetes Metab Res Rev 2007; 23: 423–40.
12. Clar C et al. Self-monitoring of blood glucose in type 2 diabetes: systematic review. Health Technol Assess 2010; 14 (12): 6.
13. Майоров А.Ю., Мельникова О.Г., Филиппов Ю.И. Вопросы самоконтроля гликемии в практике лечения сахарного диабета. Справочник поликлинического врача. 2012; 12: 32–6.
14. Farmer A, Wade A, Goyder E et al. Impact of self monitoring of blood glucose in the management of patients with non-insulin treated diabetes: open parallel group randomised trial. BMJ 2007; 335: 13–8.
15. Paneni F, Beckman JA, Creager MA, Cosentino F. Diabetes and vascular disease: pathophysiology, clinical consequences, and medical therapy: part I. Eur Heart J 2013; 34: 2436–44.
16. Davidson MB, Castellanos M, Kain D et al. The effect of self monitoring of blood glucose concentrations on glycated hemoglobin levels in diabetic patients not taking insulin: a blinded, randomized trial. Am J Med 2005; 118: 422–5.
17. Guerci B, Drouina P, Grangéb V et al. Self-monitoring of blood glucose significantly improves metabolic control in patients with type 2 diabetes mellitus: the Auto-Surveillance Intervention Active (ASIA) study. Diabetes Metab 2003; 29: 587–94.
18. Karter AJ, Ackerson LM, Darbinian JA et al. Self-monitoring of blood glucose levels and glycemic control: the Northern California Kaiser Permanente Diabetes registry. Am J Med 2001; 111 (1): 1–9.
19. Neisser K, Weber C, Wenzel H, Schneider B. Costs of self-measurement of blood glucose (SMBG) regarding morbidity and mortality in type 2 diabetes in a reality of care setting (The ROSSO study No 6). The European Association for the Study of Diabetes. Abstract Volume 42st Annual Meeting, Copenhagen, Malmoe. 2006; p. 141.
20. Gerich JE. Clinical significance, pathogenesis, and management of postprandial hyperglycemia. Arch Intern Med 2003; 163: 1306–16.
21. Pappas C, Kandaraki EA, Tsirona S. Postprandial dysmetabolism: too early or too late? Hormones 2016; 15: 321–44.
22. Shafiee G, Mohajeri-Tehrani M, Pajouhi M, Larijani B. The importance of hypoglycemia in diabetic patients. J Diabetes Metab Disord 2012; 11: 17. DOI: 10.1186/2251-6581-11-17
23. Briscoe VJ, Davis SN. Hypoglycemia in Type 1 and Type 2 Diabetes: Physiology, Pathophysiology, and Management. Clin Diabetes 2006; 24 (3): 115–21.
24. Zammitt NN, Frier BM. Hypoglycemia in type 2 diabetes. Pathophysiology, frequency, and effects of different treatment modalities. Diabetes Care 2005; 28 (12): 2948–61.
25. ORIGIN Trial Investigators, Gerstein H, Yusuf S et al. Rationale, design, and baseline characteristics for a large international trial of cardiovascular disease prevention in people with dysglycemia: the ORIGIN Trial (Outcome Reduction with an Initial Glargine Intervention). Am Heart J 2008; 155: 26–32.
26. Тимофеев А.В., Древаль Р.О. Глюкометры: цена точности. Эндокринология/кардиология. 2012; 12 (1; Спецвып.): 1–7.
https://docplayer.ru/35458495-Glyukometry-cena-tochnosti.html
27. Freckmann G, Haug C, Heinemann L. Blutzuckerselbstmessung heute: Sindalle Geräte gleich. Diabetes Stoffwechsel Herz 2011; 20 (4): 235–41.
28. International Organization for Standardization. International Standard EN ISO 15197:2013. In Vitro diagnostic test systems: Requirements for blood-glucose monitoring systems for self-testing in managing diabetes mellitus. Second Edition 2013-05-15. International Organization for Standardization, 2013.
29. Контур Плюс. Руководство пользователя. Асцензия, 2013.
30. Dunne N, Viggiani MT, Pardo S et al. Accuracy Evaluation of CONTOUR®PLUS Compared With Four Blood Glucose Monitoring Systems. Diabetes Ther 2015; 6 (3): 377–88.
31. Yakaryılmaz FD, Öztürk ZA. Treatment of type 2 diabetes mellitus in the elderly. World J Diabetes 2017; 15; 8 (6): 278–85. DOI: 10.4239/wjd.v8.i6.278


