Психиатрия Дневник психиатра (психиатрическая газета)
Психиатрия Дневник психиатра (психиатрическая газета)
№02-04 2017
Хронотипирование: перспективы дифференцированной терапии депрессии №02-04 2017
Номера страниц в выпуске:22-24
Инновационная составляющая научных изысканий и практического здравоохранения не всегда подразумевает инвазивность, высокие экономические издержки, но всегда базируется на качественном преимуществе в понимании рассматриваемого вопроса, новом взгляде на арсенал имеющихся средств и возможностей, получении конкретного результата.
Жизнедеятельность человека подвержена ритмическим колебаниям, наиболее очевидным из которых является циркадианный ритм (околосуточный) – от лат. circa – «примерно» и diem/dies – «день» (24,85±0,05 ч), регулирующее влияние гипоталамо-гипофизарной системы на который (парные супрахиазматические ядра – СХЯ переднего гипоталамуса), тесно связанное с изменением фоторежима, реализуется через изменение концентрации мелатонина. Гормон синтезируется из незаменимой аминокислоты триптофана, которая, попав с кровотоком в эпифиз, превращается в серотонин с участием ферментов триптофангидроксилазы и 5-окситриптофандекарбоксилазы. Затем из серотонина образуется мелатонин с помощью N-ацетилтрансферазы и гидроксииндол-О-метилтрансферазы, активность которых подавляется под действием освещения, поэтому максимум образования мелатонина приходится на 2 ч ночи (the hormone of darkness).
Жизнедеятельность человека подвержена ритмическим колебаниям, наиболее очевидным из которых является циркадианный ритм (околосуточный) – от лат. circa – «примерно» и diem/dies – «день» (24,85±0,05 ч), регулирующее влияние гипоталамо-гипофизарной системы на который (парные супрахиазматические ядра – СХЯ переднего гипоталамуса), тесно связанное с изменением фоторежима, реализуется через изменение концентрации мелатонина. Гормон синтезируется из незаменимой аминокислоты триптофана, которая, попав с кровотоком в эпифиз, превращается в серотонин с участием ферментов триптофангидроксилазы и 5-окситриптофандекарбоксилазы. Затем из серотонина образуется мелатонин с помощью N-ацетилтрансферазы и гидроксииндол-О-метилтрансферазы, активность которых подавляется под действием освещения, поэтому максимум образования мелатонина приходится на 2 ч ночи (the hormone of darkness).
Инновационная составляющая научных изысканий и практического здравоохранения не всегда подразумевает инвазивность, высокие экономические издержки, но всегда базируется на качественном преимуществе в понимании рассматриваемого вопроса, новом взгляде на арсенал имеющихся средств и возможностей, получении конкретного результата.
Жизнедеятельность человека подвержена ритмическим колебаниям, наиболее очевидным из которых является циркадианный ритм (околосуточный) – от лат. circa – «примерно» и diem/dies – «день» (24,85±0,05 ч), регулирующее влияние гипоталамо-гипофизарной системы на который (парные супрахиазматические ядра – СХЯ переднего гипоталамуса), тесно связанное с изменением фоторежима, реализуется через изменение концентрации мелатонина. Гормон синтезируется из незаменимой аминокислоты триптофана, которая, попав с кровотоком в эпифиз, превращается в серотонин с участием ферментов триптофангидроксилазы и 5-окситриптофандекарбоксилазы. Затем из серотонина образуется мелатонин с помощью N-ацетилтрансферазы и гидроксииндол-О-метилтрансферазы, активность которых подавляется под действием освещения, поэтому максимум образования мелатонина приходится на 2 ч ночи (the hormone of darkness).
Индивидуальный циркадианный ритм и соответствующее суточное предпочтение рассматриваются как достаточно стабильный на протяжении всей жизни параметр. Однако при депрессии нарушаются биологические ритмы организма (десинхроноз), имеющие генерируемые изнутри или извне временные профили. Практический способ оценки предполагает установление хронотипа (circadian typology, circadian preferences) как комплексной адаптивной способности организма, в том числе с помощью опросника Morningness-Eveningness Questionnaire (MEQ), значения которого тесно коррелируют с показателем начала сумеречной секреции мелатонина (dim light melatonin on set, DLMO). Хронотип в значительной степени генетически обусловлен [PER3 polymorphism (rs228697)], тем не менее равный вклад вносят средовые, социальные (social zeitgebers, нем. zeitgeber – «времязадатель») факторы: стрессорные воздействия, работа в ночные смены, использование компьютера во время отдыха 30 ч в неделю и более. В ряде исследований было установлено, что лица с вечерним хронотипом (eveningness, non-morning) в большей степени подвержены риску развития депрессии.
В 2017 г. L.Keller указал на изменение хронотипа в период ремиссии, и, несмотря на актуальность тематики, имеющиеся данные отражают отдельные, отрывочные знания о предмете, вне связи их с проводимой психофармакотерапией.
Благодаря достижениям последних десятилетий в области нейронаук современная клиника получила доступ к полному спектру различных по природе и механизму действия фармакологических препаратов, однако до 30–40% депрессивных состояний характеризуются резистентностью или незначительной реакцией на терапию. Биологические ритмы являются уникальной характеристикой индивида, а следовательно, могут стать мишенью персонифицированного подхода.
Антидепрессанты независимо от особенностей действия обнаруживают хронобиотические свойства: стимулируют эпифиз, влияют на стриатную гиперактивность, заметно ослабляя обусловленные ею нарушения динамики циркадианного ритма и короткопериодные флюктуации поведения. Трициклические антидепрессанты (ТЦА), ограниченные в применении из-за холинолитического и седативного действия, наряду с ингибиторами моноаминоксидазы увеличивают периоды ряда свободно текущих околосуточных ритмов – локомоции, потребления пищи и воды.
На субъективные параметры сна ТЦА оказывают разное влияние: амитриптилин, тримипрамин, нортриптилин и доксепин корректируют инсомнию, тогда как имипрамин и дезипрамин, напротив, вызывают инсомнию; менее точные данные получены в отношении кломипрамина. Влияние селективных ингибиторов обратного захвата серотонина (СИОЗС) на сон также неоднозначно. Блокатор пресинаптических a-адренорецепторов и 5-НТ-рецепторов миртазапин достоверно улучшает сон, в том числе за счет антигистаминного действия.
Появление препарата нового класса, оказывающего влияние прицельно на описанный выше механизм эндогенной регуляции ритмов, – лиганда мелатониновых рецепторов со свойством агониста к М1/МТ2-рецепторам (в первую очередь в СХЯ) и антагониста серотониновых 5-НТ2С-рецепторов – агомелатина, – привело к скорой демонстрации его антидепрессивной и анксиолитической эффективности. Объективно по данным полисомнографии была показана способность препарата улучшать сон по шкале сонливости Эпворта (ESS) без увеличения уровня дневной сонливости.
Синергизм механизмов действия препарата задает новое направление для исследований: предстоит выяснить, какие еще преимущества имеют агонисты мелатонина, в чем заключается их ресинхронизирующая активность и каким образом ее можно оценить в рамках рутинной клинической практики.
Цель – на основании проведенного хронотипирования установить его роль для прогнозирования терапевтического ответа; сравнить ресинхронизирующую активность традиционно применяемых антидепрессантов (ТЦА, СИОЗС, селективных ингибиторов обратного захвата серотонина и норадреналина – СИОЗСН) и агониста мелатониновых МТ1- и МТ2-рецепторов/антагониста серотониновых 5-НТ2С-рецепторов агомелатина.
Критерии включения:
• возраст старше 18 лет;
• диагностическая оценка психического состояния по Международной классификации болезней 10-го пересмотра – единичный депрессивный эпизод (F32), рекуррентное депрессивное расстройство, текущий эпизод (F33.1–F33.3), биполярное аффективное расстройство, депрессивное состояние (F31.3–F31.5).
В исследование не включались беременные, кормящие грудью; больные шизофренией, с зависимостью от психоактивных веществ (алкоголизм, наркомания), с острой соматической или неврологической патологией, требующей неотложной терапии в специализированном стационаре. Обязательным условием было наличие письменного информированного согласия больного на участие в исследовании. Протокол исследования был одобрен локальным комитетом по этике ФГАОУ ВО «Первый МГМУ им. И.М.Сеченова».
В исследуемой группе преобладали лица женского пола: 70 (62,5%) женщин и 42 (37,5%) мужчины. Возраст пациентов составлял от 19 до 75 лет (средний возраст 41,9±16,38 года). Социодемографические характеристики выборки: состоят в браке – 46 (41%), разведены – 23 (20,5%), одиноки – 42 (37,5%); трудоустроены – 54 (48,2%), учатся – 12 (10,7%).
Выборка была разделена на 2 группы. Больные 1-й группы (n=80) принимали один из следующих антидепрессантов: ТЦА (Азафен, Мелипрамин, амитриптилин, Анафранил), СИОЗС (Ципралекс, Феварин, Адепресс, пароксетин), СИОЗСН (дулоксетин, венлафаксин) и другие (миртазапин). Выбор антидепрессанта проводился в соответствии с синдромальной структурой депрессии, соматическим состоянием больного, возрастом, индивидуальной переносимостью с учетом терапевтических доз.
Больные 2-й группы (n=32) получали монотерапию агонистом мелатониновых МТ1- и МТ2-рецепторов/антагониста серотониновых 5-НТ2C-рецепторов агомелатином, начиная со стартовой дозы 25 мг 1 раз в сутки до 50 мг (максимальная суточная) 1 раз в сутки в 20:00 в случае недостаточного эффекта. Длительность наблюдения каждого больного составляла не менее 8 нед, состояние оценивалось еженедельно.
В процессе обследования проводилась оценка психического статуса, при этом психопатологическое обследование дополнялось применением психометрических шкал: Монтгомери–Асберга для оценки депрессий (Montgomery–Asberg Depression Rating Scale, MADRS), общего клинического впечатления (Clinical Global Impression Scale, CGI), опросника для определения типа суточного ритма (Morningness-Eveningness Questionnaire, Self-Assessment Version, MEQ-SA), основанного на методике Хорна–Остберга (Horne–Östberg, 1976).
Статистический анализ данных проводили с применением пакета прикладных программ Statistica 13. Сравнение двух независимых групп по одному признаку – критерия Манна–Уитни и c2, точный критерий Фишера. Сравнение двух зависимых групп по одному признаку – критерий Уилкоксона, сравнение трех и более независимых групп по одному признаку – метод Краскела–Уоллиса. За достаточный уровень достоверности различий принималось значение p<0,05.
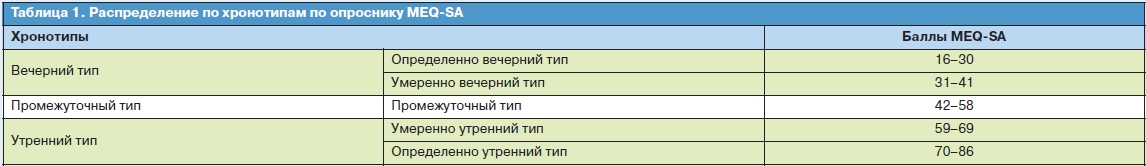
Баллы MEQ-SA на исходном уровне были нормально распределены: среднее значение и медиана были близки по своим показателям (44, 96 и 46,5), коэффицент асимметрии отрицательный, близок к нулю (-0,314), показатель хорошо описывается кривой нормального распределения (Гаусса), критерий Колмогорова–Смирнова p>0,2, критерий Шапиро-Уилка более 0,05 (p=0,55). В соответствии с утренне-вечерним предпочтением были выделены 3 группы больных: с утренним хронотипом (9,8%), промежуточным (54,5%) и вечерним (35,7%); табл. 2.
 Изучение клинико-анамнестических показателей в группах больных выявило, что в группу с утренним хронотипом были отнесены исключительно женщины (p=0,005), их средний возраст (46±13,4 года) оказался выше, чем в остальных группах. Подобная закономерность объясняется увеличением с возрастом доли лиц с утренним хронотипом и большей предрасположенностью к нему лиц женского пола. Доля респондеров (больных, чьи исходные показатели по шкале MADRS на 8-й неделе терапии уменьшились более чем на 50%) была выше среди тех, у кого был утренний тип исходно. Для больных с вечерним хронотипом были характерны, по сравнению с группой с утренним/промежуточным, большее число перенесенных эпизодов, более высокая средняя продолжительность эпизода в анамнезе, более тяжелое состояние исходно в рамках настоящего депрессивного эпизода, полученные результаты соотносятся с данными иностранной литературы.
Изучение клинико-анамнестических показателей в группах больных выявило, что в группу с утренним хронотипом были отнесены исключительно женщины (p=0,005), их средний возраст (46±13,4 года) оказался выше, чем в остальных группах. Подобная закономерность объясняется увеличением с возрастом доли лиц с утренним хронотипом и большей предрасположенностью к нему лиц женского пола. Доля респондеров (больных, чьи исходные показатели по шкале MADRS на 8-й неделе терапии уменьшились более чем на 50%) была выше среди тех, у кого был утренний тип исходно. Для больных с вечерним хронотипом были характерны, по сравнению с группой с утренним/промежуточным, большее число перенесенных эпизодов, более высокая средняя продолжительность эпизода в анамнезе, более тяжелое состояние исходно в рамках настоящего депрессивного эпизода, полученные результаты соотносятся с данными иностранной литературы.
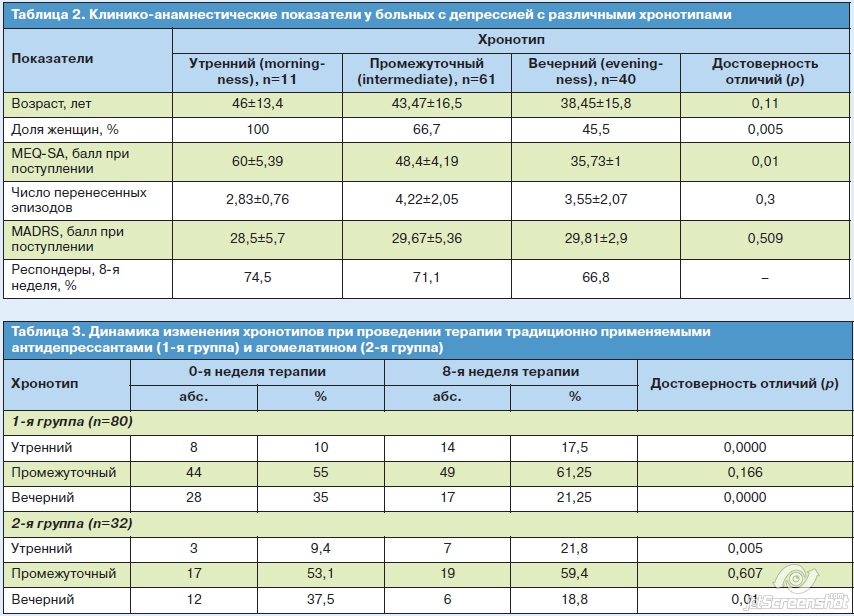
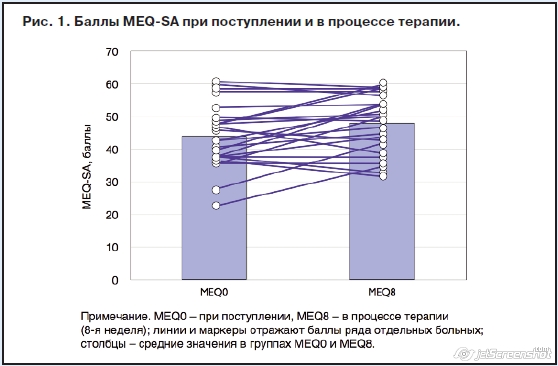
В обеих группах больных, принимавших традиционно назначаемые антидепрессанты (n=80) и мелатонинергический препарат агомелатин (n=32), распределение по хронотипам различалось исходно (Н0) и после 8 нед терапии (Н8); рис. 1. В каждой из групп в процессе терапии увеличилось число лиц с утренним хронотипом (p=0,0000 и 0,005) и уменьшилось с вечерним (p=0,0000 и p=0,01), во 2-й группе данная динамика на фоне снижения баллов MADRS оказалась более выраженной, что достоверно отражает тенденцию к ресинхронизации – восстановлению нарушенных биологических ритмов (рис. 2, табл. 3).Баллы MEQ больше выросли у респондентов: даже с учетом того, что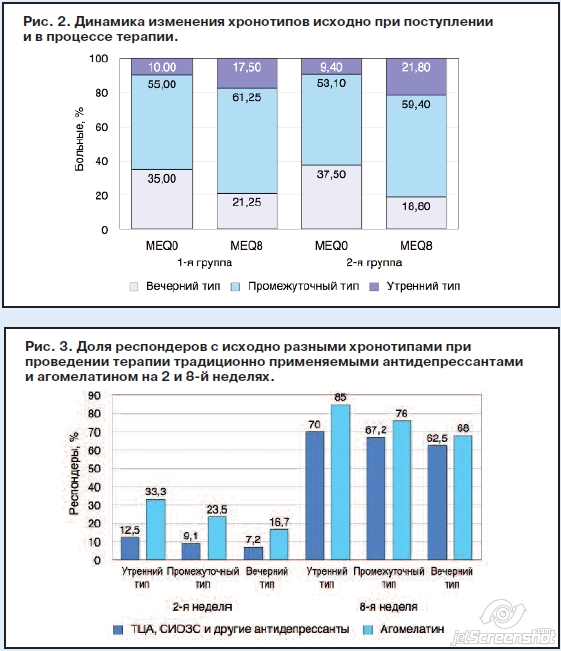 диапазон значений в каждой категории в MEQ-SA достаточно широк, после 8 нед лечения среди респондеров хронотип изменился на более «раннюю» категорию (вечерний на промежуточный, промежуточный на утренний) – у 17,6%, тогда как у нон-респондеров – лишь на 7,4%. Процент респондеров был выше среди тех, у кого был утренний тип исходно.
диапазон значений в каждой категории в MEQ-SA достаточно широк, после 8 нед лечения среди респондеров хронотип изменился на более «раннюю» категорию (вечерний на промежуточный, промежуточный на утренний) – у 17,6%, тогда как у нон-респондеров – лишь на 7,4%. Процент респондеров был выше среди тех, у кого был утренний тип исходно.
В целом доля респондеров на терапии агомелатином соотносилась с данными, полученными в других отечественных исследованиях: Н1 – 10,2%; Н2 – 45,8%; Н3 – 64,4% (М.Г.Полуэктов, Я.И.Левин, 2013); Н2 – 9,4%, Н6 – 71,9% (А.А.Прибытков, 2013); Н6 – 90% (А.С.Бобров, 2010); Н8 – 54,1% (Е.В.Чернова, 2016); Н8 – 90,9% (В.А.Солдаткин, 2013).
Однако впервые в рамках данного исследования была предпринята попытка сравнить ресинхронизирующую активность препаратов с помощью инструмента, непосредственно оценивающего нарушения биологических ритмов организма при депрессии. Число ранних респондеров (early responders, Н2), определяемых как больные, у которых на фоне лечения отмечалось снижение баллов MADRS на 50% и более от исходного значения ко 2-й неделе, составило в 1-й группе в среднем 9,6%, во 2-й, при терапии агомелатином, – 24,5%. К концу 8-й недели 66,6% в 1-й группе и 76,3% во 2-й соответствовали критериям респондеров (рис. 3). Прицельная оценка с учетом хронотипирования также продемонстрировала более выраженный ресинхронизирующий эффект при терапии агомелатином, больные с утренним хронотипом значимо быстрее отвечали на лечение (Н2 – 33,3%; Н8 – 85%).
Сравнение больных с депрессией с исходно разными хронотипами показало ряд отличий: утренний был независимым маркером ответа на терапию, характерен для лиц женского пола, старших возрастных групп. Выявление вечернего хронотипа, показателя тяжести состояния, сопровождалось большим числом перенесенных эпизодов в анамнезе. Таким образом, хронотип больного может отображать его состояние исходно и в процессе психофармакотерапии.
В ходе настоящего исследования продемонстрированы клинически значимые преимущества агониста мелатониновых МТ1- и МТ2-рецепторов/антагониста серотониновых 5-НТ2C-рецепторов агомелатина: за счет патогенетически обусловленного механизма действия он продемонстрировал более выраженную ресинхронизирующую активность в сравнении с традиционно применяемыми антидепрессантами (ТЦА, СИОЗС, СИОЗСН). Учитывая, что влияние биологических ритмов при депрессии крайне разнообразно (нарушение сна, суточные колебания настроения, сезонность, хронопатология рецидивов и т.д.), назначение препарата представляется крайне целесообразным. n
Жизнедеятельность человека подвержена ритмическим колебаниям, наиболее очевидным из которых является циркадианный ритм (околосуточный) – от лат. circa – «примерно» и diem/dies – «день» (24,85±0,05 ч), регулирующее влияние гипоталамо-гипофизарной системы на который (парные супрахиазматические ядра – СХЯ переднего гипоталамуса), тесно связанное с изменением фоторежима, реализуется через изменение концентрации мелатонина. Гормон синтезируется из незаменимой аминокислоты триптофана, которая, попав с кровотоком в эпифиз, превращается в серотонин с участием ферментов триптофангидроксилазы и 5-окситриптофандекарбоксилазы. Затем из серотонина образуется мелатонин с помощью N-ацетилтрансферазы и гидроксииндол-О-метилтрансферазы, активность которых подавляется под действием освещения, поэтому максимум образования мелатонина приходится на 2 ч ночи (the hormone of darkness).
Индивидуальный циркадианный ритм и соответствующее суточное предпочтение рассматриваются как достаточно стабильный на протяжении всей жизни параметр. Однако при депрессии нарушаются биологические ритмы организма (десинхроноз), имеющие генерируемые изнутри или извне временные профили. Практический способ оценки предполагает установление хронотипа (circadian typology, circadian preferences) как комплексной адаптивной способности организма, в том числе с помощью опросника Morningness-Eveningness Questionnaire (MEQ), значения которого тесно коррелируют с показателем начала сумеречной секреции мелатонина (dim light melatonin on set, DLMO). Хронотип в значительной степени генетически обусловлен [PER3 polymorphism (rs228697)], тем не менее равный вклад вносят средовые, социальные (social zeitgebers, нем. zeitgeber – «времязадатель») факторы: стрессорные воздействия, работа в ночные смены, использование компьютера во время отдыха 30 ч в неделю и более. В ряде исследований было установлено, что лица с вечерним хронотипом (eveningness, non-morning) в большей степени подвержены риску развития депрессии.
В 2017 г. L.Keller указал на изменение хронотипа в период ремиссии, и, несмотря на актуальность тематики, имеющиеся данные отражают отдельные, отрывочные знания о предмете, вне связи их с проводимой психофармакотерапией.
Благодаря достижениям последних десятилетий в области нейронаук современная клиника получила доступ к полному спектру различных по природе и механизму действия фармакологических препаратов, однако до 30–40% депрессивных состояний характеризуются резистентностью или незначительной реакцией на терапию. Биологические ритмы являются уникальной характеристикой индивида, а следовательно, могут стать мишенью персонифицированного подхода.
Антидепрессанты независимо от особенностей действия обнаруживают хронобиотические свойства: стимулируют эпифиз, влияют на стриатную гиперактивность, заметно ослабляя обусловленные ею нарушения динамики циркадианного ритма и короткопериодные флюктуации поведения. Трициклические антидепрессанты (ТЦА), ограниченные в применении из-за холинолитического и седативного действия, наряду с ингибиторами моноаминоксидазы увеличивают периоды ряда свободно текущих околосуточных ритмов – локомоции, потребления пищи и воды.
На субъективные параметры сна ТЦА оказывают разное влияние: амитриптилин, тримипрамин, нортриптилин и доксепин корректируют инсомнию, тогда как имипрамин и дезипрамин, напротив, вызывают инсомнию; менее точные данные получены в отношении кломипрамина. Влияние селективных ингибиторов обратного захвата серотонина (СИОЗС) на сон также неоднозначно. Блокатор пресинаптических a-адренорецепторов и 5-НТ-рецепторов миртазапин достоверно улучшает сон, в том числе за счет антигистаминного действия.
Появление препарата нового класса, оказывающего влияние прицельно на описанный выше механизм эндогенной регуляции ритмов, – лиганда мелатониновых рецепторов со свойством агониста к М1/МТ2-рецепторам (в первую очередь в СХЯ) и антагониста серотониновых 5-НТ2С-рецепторов – агомелатина, – привело к скорой демонстрации его антидепрессивной и анксиолитической эффективности. Объективно по данным полисомнографии была показана способность препарата улучшать сон по шкале сонливости Эпворта (ESS) без увеличения уровня дневной сонливости.
Синергизм механизмов действия препарата задает новое направление для исследований: предстоит выяснить, какие еще преимущества имеют агонисты мелатонина, в чем заключается их ресинхронизирующая активность и каким образом ее можно оценить в рамках рутинной клинической практики.
Цель – на основании проведенного хронотипирования установить его роль для прогнозирования терапевтического ответа; сравнить ресинхронизирующую активность традиционно применяемых антидепрессантов (ТЦА, СИОЗС, селективных ингибиторов обратного захвата серотонина и норадреналина – СИОЗСН) и агониста мелатониновых МТ1- и МТ2-рецепторов/антагониста серотониновых 5-НТ2С-рецепторов агомелатина.
Материалы и методы
Исследование проводилось в амбулаторных и стационарных условиях в Клинике психиатрии им. С.С.Корсакова Университетской клинической больницы №3 ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М.Сеченова».Критерии включения:
• возраст старше 18 лет;
• диагностическая оценка психического состояния по Международной классификации болезней 10-го пересмотра – единичный депрессивный эпизод (F32), рекуррентное депрессивное расстройство, текущий эпизод (F33.1–F33.3), биполярное аффективное расстройство, депрессивное состояние (F31.3–F31.5).
В исследование не включались беременные, кормящие грудью; больные шизофренией, с зависимостью от психоактивных веществ (алкоголизм, наркомания), с острой соматической или неврологической патологией, требующей неотложной терапии в специализированном стационаре. Обязательным условием было наличие письменного информированного согласия больного на участие в исследовании. Протокол исследования был одобрен локальным комитетом по этике ФГАОУ ВО «Первый МГМУ им. И.М.Сеченова».
В исследуемой группе преобладали лица женского пола: 70 (62,5%) женщин и 42 (37,5%) мужчины. Возраст пациентов составлял от 19 до 75 лет (средний возраст 41,9±16,38 года). Социодемографические характеристики выборки: состоят в браке – 46 (41%), разведены – 23 (20,5%), одиноки – 42 (37,5%); трудоустроены – 54 (48,2%), учатся – 12 (10,7%).
Выборка была разделена на 2 группы. Больные 1-й группы (n=80) принимали один из следующих антидепрессантов: ТЦА (Азафен, Мелипрамин, амитриптилин, Анафранил), СИОЗС (Ципралекс, Феварин, Адепресс, пароксетин), СИОЗСН (дулоксетин, венлафаксин) и другие (миртазапин). Выбор антидепрессанта проводился в соответствии с синдромальной структурой депрессии, соматическим состоянием больного, возрастом, индивидуальной переносимостью с учетом терапевтических доз.
Больные 2-й группы (n=32) получали монотерапию агонистом мелатониновых МТ1- и МТ2-рецепторов/антагониста серотониновых 5-НТ2C-рецепторов агомелатином, начиная со стартовой дозы 25 мг 1 раз в сутки до 50 мг (максимальная суточная) 1 раз в сутки в 20:00 в случае недостаточного эффекта. Длительность наблюдения каждого больного составляла не менее 8 нед, состояние оценивалось еженедельно.
В процессе обследования проводилась оценка психического статуса, при этом психопатологическое обследование дополнялось применением психометрических шкал: Монтгомери–Асберга для оценки депрессий (Montgomery–Asberg Depression Rating Scale, MADRS), общего клинического впечатления (Clinical Global Impression Scale, CGI), опросника для определения типа суточного ритма (Morningness-Eveningness Questionnaire, Self-Assessment Version, MEQ-SA), основанного на методике Хорна–Остберга (Horne–Östberg, 1976).
Статистический анализ данных проводили с применением пакета прикладных программ Statistica 13. Сравнение двух независимых групп по одному признаку – критерия Манна–Уитни и c2, точный критерий Фишера. Сравнение двух зависимых групп по одному признаку – критерий Уилкоксона, сравнение трех и более независимых групп по одному признаку – метод Краскела–Уоллиса. За достаточный уровень достоверности различий принималось значение p<0,05.
Результаты
Хронотипирование выборки (n=112) проводилось с использованием опросника MEQ, состоящего из 19 вопросов с множественным вариантом ответа, где сумма баллов (от 16 до 86) может быть преобразована в 3 или 5 категорий (хронотипов); табл. 1.
Баллы MEQ-SA на исходном уровне были нормально распределены: среднее значение и медиана были близки по своим показателям (44, 96 и 46,5), коэффицент асимметрии отрицательный, близок к нулю (-0,314), показатель хорошо описывается кривой нормального распределения (Гаусса), критерий Колмогорова–Смирнова p>0,2, критерий Шапиро-Уилка более 0,05 (p=0,55). В соответствии с утренне-вечерним предпочтением были выделены 3 группы больных: с утренним хронотипом (9,8%), промежуточным (54,5%) и вечерним (35,7%); табл. 2.

 Изучение клинико-анамнестических показателей в группах больных выявило, что в группу с утренним хронотипом были отнесены исключительно женщины (p=0,005), их средний возраст (46±13,4 года) оказался выше, чем в остальных группах. Подобная закономерность объясняется увеличением с возрастом доли лиц с утренним хронотипом и большей предрасположенностью к нему лиц женского пола. Доля респондеров (больных, чьи исходные показатели по шкале MADRS на 8-й неделе терапии уменьшились более чем на 50%) была выше среди тех, у кого был утренний тип исходно. Для больных с вечерним хронотипом были характерны, по сравнению с группой с утренним/промежуточным, большее число перенесенных эпизодов, более высокая средняя продолжительность эпизода в анамнезе, более тяжелое состояние исходно в рамках настоящего депрессивного эпизода, полученные результаты соотносятся с данными иностранной литературы.
Изучение клинико-анамнестических показателей в группах больных выявило, что в группу с утренним хронотипом были отнесены исключительно женщины (p=0,005), их средний возраст (46±13,4 года) оказался выше, чем в остальных группах. Подобная закономерность объясняется увеличением с возрастом доли лиц с утренним хронотипом и большей предрасположенностью к нему лиц женского пола. Доля респондеров (больных, чьи исходные показатели по шкале MADRS на 8-й неделе терапии уменьшились более чем на 50%) была выше среди тех, у кого был утренний тип исходно. Для больных с вечерним хронотипом были характерны, по сравнению с группой с утренним/промежуточным, большее число перенесенных эпизодов, более высокая средняя продолжительность эпизода в анамнезе, более тяжелое состояние исходно в рамках настоящего депрессивного эпизода, полученные результаты соотносятся с данными иностранной литературы.В обеих группах больных, принимавших традиционно назначаемые антидепрессанты (n=80) и мелатонинергический препарат агомелатин (n=32), распределение по хронотипам различалось исходно (Н0) и после 8 нед терапии (Н8); рис. 1. В каждой из групп в процессе терапии увеличилось число лиц с утренним хронотипом (p=0,0000 и 0,005) и уменьшилось с вечерним (p=0,0000 и p=0,01), во 2-й группе данная динамика на фоне снижения баллов MADRS оказалась более выраженной, что достоверно отражает тенденцию к ресинхронизации – восстановлению нарушенных биологических ритмов (рис. 2, табл. 3).Баллы MEQ больше выросли у респондентов: даже с учетом того, что
 диапазон значений в каждой категории в MEQ-SA достаточно широк, после 8 нед лечения среди респондеров хронотип изменился на более «раннюю» категорию (вечерний на промежуточный, промежуточный на утренний) – у 17,6%, тогда как у нон-респондеров – лишь на 7,4%. Процент респондеров был выше среди тех, у кого был утренний тип исходно.
диапазон значений в каждой категории в MEQ-SA достаточно широк, после 8 нед лечения среди респондеров хронотип изменился на более «раннюю» категорию (вечерний на промежуточный, промежуточный на утренний) – у 17,6%, тогда как у нон-респондеров – лишь на 7,4%. Процент респондеров был выше среди тех, у кого был утренний тип исходно.В целом доля респондеров на терапии агомелатином соотносилась с данными, полученными в других отечественных исследованиях: Н1 – 10,2%; Н2 – 45,8%; Н3 – 64,4% (М.Г.Полуэктов, Я.И.Левин, 2013); Н2 – 9,4%, Н6 – 71,9% (А.А.Прибытков, 2013); Н6 – 90% (А.С.Бобров, 2010); Н8 – 54,1% (Е.В.Чернова, 2016); Н8 – 90,9% (В.А.Солдаткин, 2013).
Однако впервые в рамках данного исследования была предпринята попытка сравнить ресинхронизирующую активность препаратов с помощью инструмента, непосредственно оценивающего нарушения биологических ритмов организма при депрессии. Число ранних респондеров (early responders, Н2), определяемых как больные, у которых на фоне лечения отмечалось снижение баллов MADRS на 50% и более от исходного значения ко 2-й неделе, составило в 1-й группе в среднем 9,6%, во 2-й, при терапии агомелатином, – 24,5%. К концу 8-й недели 66,6% в 1-й группе и 76,3% во 2-й соответствовали критериям респондеров (рис. 3). Прицельная оценка с учетом хронотипирования также продемонстрировала более выраженный ресинхронизирующий эффект при терапии агомелатином, больные с утренним хронотипом значимо быстрее отвечали на лечение (Н2 – 33,3%; Н8 – 85%).
Обсуждение
Хронотипирование как способ оценки индивидуального циркадианного профиля больного с депрессией представляет собой новый прогностический инструмент для построения концептуальной модели здоровья (ex morbo convalescere).Сравнение больных с депрессией с исходно разными хронотипами показало ряд отличий: утренний был независимым маркером ответа на терапию, характерен для лиц женского пола, старших возрастных групп. Выявление вечернего хронотипа, показателя тяжести состояния, сопровождалось большим числом перенесенных эпизодов в анамнезе. Таким образом, хронотип больного может отображать его состояние исходно и в процессе психофармакотерапии.
В ходе настоящего исследования продемонстрированы клинически значимые преимущества агониста мелатониновых МТ1- и МТ2-рецепторов/антагониста серотониновых 5-НТ2C-рецепторов агомелатина: за счет патогенетически обусловленного механизма действия он продемонстрировал более выраженную ресинхронизирующую активность в сравнении с традиционно применяемыми антидепрессантами (ТЦА, СИОЗС, СИОЗСН). Учитывая, что влияние биологических ритмов при депрессии крайне разнообразно (нарушение сна, суточные колебания настроения, сезонность, хронопатология рецидивов и т.д.), назначение препарата представляется крайне целесообразным. n
Список исп. литературыСкрыть список
9 августа 2017
Количество просмотров: 1706


