Психиатрия Дневник психиатра (психиатрическая газета)
Психиатрия Дневник психиатра (психиатрическая газета)
№02 2014
Эпигенетические механизмы депрессии №02 2014
Номера страниц в выпуске:27-28
В последнее время появляется все больше доказательств в поддержку гипотезы, что эпигенетика является ключевым механизмом, с помощью которого факторы внешней среды, воздействуя на генетическую конституцию индивидуума, определяют риск развития депрессии в течение его жизни. Эпигенетика, если говорить в общем смысле, занимается изучением стабильных изменений экспрессии генов, опосредованных изменением структуры хроматина, при отсутствии изменений в последовательности нуклеотидов в молекуле ДНК. Согласно упомянутой выше гипотезе у некоторых людей с повышенной чувствительностью сильный стресс является пусковым механизмом для изменения структуры хроматина в определенных локусах генома лимбической области головного мозга, вследствие чего возникают устойчивые изменения экспрессии генов, приводящие к развитию эпизодов депрессии. Вывод, следующий из этой гипотезы, заключается в том, что подобные опосредованные стрессом генетические модификации также могут происходить и в начале жизни, благодаря чему можно определить подверженность индивидуума заболеванию в течение его жизни или оценить его устойчивость к последующим стрессовым воздействиям.
Эпигенетические механизмы могут быть задействованы в развитии депрессии еще двумя дополнительными путями. Один из них заключается в случайным образом возникающих изменениях в развитии. Другой же вовлекает эпигенетическую наследственность среди множества поколений. Как будет показано далее, вклад этих эпигенетических механизмов в формирование депрессии остается менее изученным.
Активность гена отражается в структуре окружающего его хроматина: гены, в которых хромосомы расположены в пространстве сравнительно свободно, активно транскрибируются, в то время как гены, находящиеся в плотно упакованных хромосомах, чаще являются молчащими. Эта «плотность» нуклеосомы определяется чрезвычайно сложным процессом, который включает в себя посттрансляционную модификацию гистонов (см. рисунок) и ДНК, а также накопление большого количества регуляторных белков хроматина, принимающих участие в данных модификациях.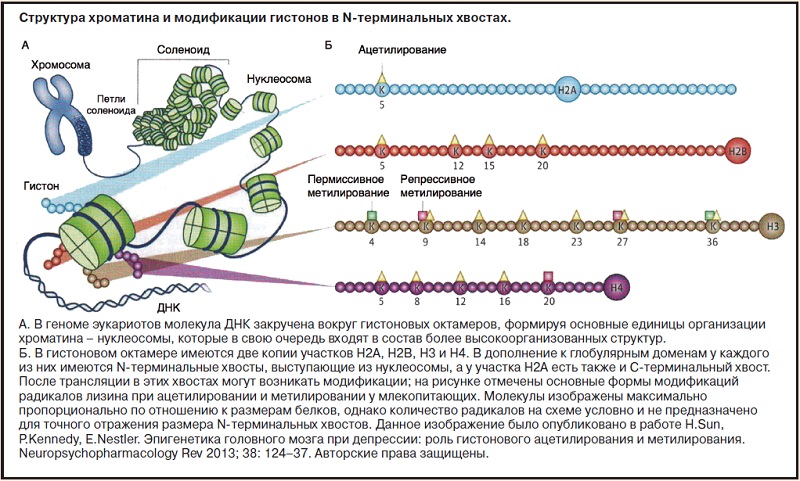
Ацетилирование гистонов, которое катализируется гистоновыми ацетилтрансферазами и реверсируется гистоновыми деацетилазами (HDACs), обычно обеспечивает более свободное (открытое) состояние хроматина и повышенную экспрессию генов. Метилирование гистонов, катализируемое гистоновыми метилтрансферазами (HMTs) и реверсируемое гистоновыми деметилазами, приводит к активизированию или подавлению генной транскрипции в зависимости от проходящего метилирование радикала аминокислоты. Метилирование ДНК, катализируемое ДНК-метилтрансферазами (DNMTs), обычно обеспечивает подавление экспрессии генов, хотя альтернативные формы метилирования ДНК (гидроксиметилирование) могут быть в большей степени связаны с активацией генов. Большое количество «считывающих» белков соединяется со всеми этими гистонами и модификациями ДНК, что приводит к изменениям в структуре хроматина и транскрипции генов. В качестве примера можно привести то, как обладающие АТФазной активностью хроматин-ремоделирующие белки регулируют плотность упаковки нуклеосом и передвигают нуклеосомы вдоль нити ДНК во время процесса транскрипции.
Существуют два основных механизма, с помощью которых факторы внешней среды, такие как стресс, оказывают влияние на эти процессы. Первый механизм заключается в регуляции с помощью синаптической передачи и
нейронной активности посредством внутриклеточных сигнальных каскадов активности и количества многочисленных факторов транскрипции, например CREB (циклический аденозинмонофосфат – ответный элементсвязывающий белок) и белков семейства Fos- и Jun-, которые наряду со множеством прочих факторов связываются с соответствующими им ответными элементами, расположенными в регуляторных генах, и запускают изменения в структуре расположенного после них хроматина. Второй механизм заключается в том, что те же внутриклеточные сигнальные пути непосредственно регулируют активность многочисленных регуляторных белков хроматина, что сразу же вызывает изменения в экспрессии генов.
В исследованиях на грызунах было обнаружено, что постоянное воздействие нескольких форм стрессовых факторов вызывает изменение структуры хроматина в головном мозге. Один вид модификаций отмечался во всех случаях: хронический стресс вызывает изменение общего клеточного уровня ацетилированных или метилированных гистонов в определенных участках лимбической области головного мозга. Эти выявляемые во всех случаях изменения, возможно, отражают общегеномный сдвиг в сторону усиления или, наоборот, ограничения уровня активности хроматина. Другой тип модификаций является характерным для определенных локусов и представляет собой изменение в ацетилировании или метилировании гистонов или в метилировании ДНК, происходящее на уровне определенного гена, опосредованное изменением его экспрессии. Интересно, что многие из этих специфических для локусов изменений являются препятствием для случайных глобальных модификаций.
Подобная эпигенетическая регуляция стрессовых реакций проиллюстрирована в нашей работе по хроническому социальному расстройству при депрессии. При хроническом социальном стрессе у мышей с повышенной восприимчивостью манифестировал депрессивноподобный синдром, в то время как у мышей с нормальной восприимчивостью симптоматика заболевания не развивалась, несмотря на подверженность тому же уровню стресса. Мы доказали, что подобный уровень восприимчивости частично регулируется изменениями в гистонном ацетилировании и репрессивной форме гистонового метилирования – диметилировании Lys9 в гистоне Н3 (Н3К9me2) – в центре удовольствия.
Повышается общий уровень ацетилирования гистонов, благодаря чему обеспечивается устойчивость к стрессу, поскольку ингибирование HDAC именно в этой области головного мозга снижает восприимчивость к социальным факторам и вызывает реакцию, сходную с действием антидепрессантов. Тотальное повышение уровня H3K9me, напротив, обладает патологическим действием: локальное ингибирование HMT, являющегося медиатором этого участка, вызывает повышение восприимчивости, в то время как его активация обладает противоположным эффектом. Мы использовали общегеномные методы исследования для определения многочисленного количества генов, отражающих изменения в этих гистонных модификациях, имея тем самым уникальную возможность увидеть молекулярную базу, на которой основывается повышенный/пониженный уровень восприимчивости к социальным факторам.
Существуют веские доказательства значимости эпигенетических модификаций, происходящих на раннем периоде жизни и вызывающих повышенную чувствительность к стрессу в течение всей жизни. В выдающихся экспериментах на крысах, проведенных Weaver и соавт., у потомков матерей, получавших недостаточное количество материнской заботы/ухода (LG), был обнаружен повышенный уровень реактивности на стресс, а также повышенный уровень тревожности во взрослом возрасте по сравнению с грызунами, получавшими высокое количество материнской заботы/ухода (HG). У крыс LG было обнаружено снижение экспрессии иРНК гиппокампального глюкокортикоидного рецептора (GR) и, соответственно, снижение ацетилирования H3K9 и повышение метилирования ДНК вокруг промоутера гена GR по сравнению с животными из группы HG. Вышеописанные различия в экспрессии GR позволяют определить уровень материнской заботы, имевшийся у этих животных, и таким образом закрепить
паттерны поведения в группах LG и HG из поколения в поколение. Существует вероятность того, что в этот процесс также вовлечена эпигенетическая регуляция множества дополнительных генов. Подобная форма передачи чувствительности к стрессу через поколения, соответственно, является формой передачи поведения и не представляет собой истинное эпигенетическое наследование.
В исследованиях влияния эпигенетических механизмов на модели стресса в течение жизни выявляется кардинально новый взгляд на ряд генов и биохимических путей передачи, которые изменяются в определенных участках головного мозга, обусловливая риск развития депрессии и обратимость симптоматики при терапии антидепрессантами. Это знание может помочь нам направить свои усилия на создание нового поколения антидепрессантов, действие которых будет направлено на моноаминовые переносчики и рецепторы.
В связи с этим возникает вопрос, являются ли эпигенетические белки сами по себе подходящими мишенями для подобного вида терапии. Как уже отмечалось в данной статье, ингибиторы HDAC в некоторых моделях на грызунах оказывают действие, схожее с эффектом антидепрессантов, и существуют доказательства, позволяющие предположить, что данные препараты могут быть также эффективны для регуляции метилирования H3K9 или даже метилирования ДНК. Однако, учитывая вездесущность в молекулах фрагментов HDACs, HMTs, HDMs и DNMTs, вероятнее всего, подобные препараты будут иметь чрезвычайно большое количество побочных эффектов при лечении депрессии. Следует выяснить, имеются ли другие способы воздействия на эти процессы, если выбирать в качестве мишеней регуляторные белки головного мозга, которые могут быть использованы при создании нового поколения антидепрессантов.
Некоторые ученые используют термин «эпигенетика» для обозначения передачи определенных признаков через поколения, в случае если отсутствуют изменения в последовательности нуклеотидов в молекуле ДНК. В самом деле, было показано, что стрессовые события в течение жизни изменяют устойчивость к стрессу в последующих поколениях. У самцов мышей, которые в раннем возрасте были отделены от матери, отмечается повышение чувствительности к стрессу в течение жизни, которое наблюдается и у нескольких поколений их потомков. Точно так же мыши-самцы, подверженные хроническому социальному стрессу во взрослом возрасте, дают потомство, более подверженное социальному стрессу, чем потомство контрольной группы мышей. Однако механизмы, лежащие в основе подобного наследования восприимчивости к стрессу через поколения, остаются спорными. Стресс вызывает эпигенетические модификации в определенных генах сперматозоидов подверженных стрессу мышей, однако точно неизвестно, приводят ли именно эти модификации к различиям в восприимчивости к стрессу у потомков.
В исследованиях экстракорпорального оплодотворения выдвигается предположение, что эпигенетические изменения в сперматозоидах могут играть лишь небольшую роль в передаче чувствительности к стрессу через поколения, что большая часть наблюдаемого наследования является бихевиоральной, поскольку у самок изменяется уровень
их материнской заботы при воспроизведении потомства от подверженных стрессу отцов.
По этой причине требуется проведение дальнейших исследований, чтобы выяснить, вносит ли эпигенетическое наследование чувствительности к стрессу вклад в обоснованное с точки зрения генетики и действия факторов внешней среды формирование у индивида чувствительности к стрессу в течение его жизни, и если вносит, то определить уровень воздействия эпигенетики.
Реферат подготовлен
Маргаритой Даниловой
Эпигенетические механизмы могут быть задействованы в развитии депрессии еще двумя дополнительными путями. Один из них заключается в случайным образом возникающих изменениях в развитии. Другой же вовлекает эпигенетическую наследственность среди множества поколений. Как будет показано далее, вклад этих эпигенетических механизмов в формирование депрессии остается менее изученным.
Механизмы эпигенетической регуляции
Молекула ДНК закручена вокруг гистоновых октамеров, формируя нуклеосомы – единицы хроматина (см. рисунок).Активность гена отражается в структуре окружающего его хроматина: гены, в которых хромосомы расположены в пространстве сравнительно свободно, активно транскрибируются, в то время как гены, находящиеся в плотно упакованных хромосомах, чаще являются молчащими. Эта «плотность» нуклеосомы определяется чрезвычайно сложным процессом, который включает в себя посттрансляционную модификацию гистонов (см. рисунок) и ДНК, а также накопление большого количества регуляторных белков хроматина, принимающих участие в данных модификациях.

Ацетилирование гистонов, которое катализируется гистоновыми ацетилтрансферазами и реверсируется гистоновыми деацетилазами (HDACs), обычно обеспечивает более свободное (открытое) состояние хроматина и повышенную экспрессию генов. Метилирование гистонов, катализируемое гистоновыми метилтрансферазами (HMTs) и реверсируемое гистоновыми деметилазами, приводит к активизированию или подавлению генной транскрипции в зависимости от проходящего метилирование радикала аминокислоты. Метилирование ДНК, катализируемое ДНК-метилтрансферазами (DNMTs), обычно обеспечивает подавление экспрессии генов, хотя альтернативные формы метилирования ДНК (гидроксиметилирование) могут быть в большей степени связаны с активацией генов. Большое количество «считывающих» белков соединяется со всеми этими гистонами и модификациями ДНК, что приводит к изменениям в структуре хроматина и транскрипции генов. В качестве примера можно привести то, как обладающие АТФазной активностью хроматин-ремоделирующие белки регулируют плотность упаковки нуклеосом и передвигают нуклеосомы вдоль нити ДНК во время процесса транскрипции.
Существуют два основных механизма, с помощью которых факторы внешней среды, такие как стресс, оказывают влияние на эти процессы. Первый механизм заключается в регуляции с помощью синаптической передачи и
нейронной активности посредством внутриклеточных сигнальных каскадов активности и количества многочисленных факторов транскрипции, например CREB (циклический аденозинмонофосфат – ответный элементсвязывающий белок) и белков семейства Fos- и Jun-, которые наряду со множеством прочих факторов связываются с соответствующими им ответными элементами, расположенными в регуляторных генах, и запускают изменения в структуре расположенного после них хроматина. Второй механизм заключается в том, что те же внутриклеточные сигнальные пути непосредственно регулируют активность многочисленных регуляторных белков хроматина, что сразу же вызывает изменения в экспрессии генов.
В исследованиях на грызунах было обнаружено, что постоянное воздействие нескольких форм стрессовых факторов вызывает изменение структуры хроматина в головном мозге. Один вид модификаций отмечался во всех случаях: хронический стресс вызывает изменение общего клеточного уровня ацетилированных или метилированных гистонов в определенных участках лимбической области головного мозга. Эти выявляемые во всех случаях изменения, возможно, отражают общегеномный сдвиг в сторону усиления или, наоборот, ограничения уровня активности хроматина. Другой тип модификаций является характерным для определенных локусов и представляет собой изменение в ацетилировании или метилировании гистонов или в метилировании ДНК, происходящее на уровне определенного гена, опосредованное изменением его экспрессии. Интересно, что многие из этих специфических для локусов изменений являются препятствием для случайных глобальных модификаций.
Подобная эпигенетическая регуляция стрессовых реакций проиллюстрирована в нашей работе по хроническому социальному расстройству при депрессии. При хроническом социальном стрессе у мышей с повышенной восприимчивостью манифестировал депрессивноподобный синдром, в то время как у мышей с нормальной восприимчивостью симптоматика заболевания не развивалась, несмотря на подверженность тому же уровню стресса. Мы доказали, что подобный уровень восприимчивости частично регулируется изменениями в гистонном ацетилировании и репрессивной форме гистонового метилирования – диметилировании Lys9 в гистоне Н3 (Н3К9me2) – в центре удовольствия.
Повышается общий уровень ацетилирования гистонов, благодаря чему обеспечивается устойчивость к стрессу, поскольку ингибирование HDAC именно в этой области головного мозга снижает восприимчивость к социальным факторам и вызывает реакцию, сходную с действием антидепрессантов. Тотальное повышение уровня H3K9me, напротив, обладает патологическим действием: локальное ингибирование HMT, являющегося медиатором этого участка, вызывает повышение восприимчивости, в то время как его активация обладает противоположным эффектом. Мы использовали общегеномные методы исследования для определения многочисленного количества генов, отражающих изменения в этих гистонных модификациях, имея тем самым уникальную возможность увидеть молекулярную базу, на которой основывается повышенный/пониженный уровень восприимчивости к социальным факторам.
Существуют веские доказательства значимости эпигенетических модификаций, происходящих на раннем периоде жизни и вызывающих повышенную чувствительность к стрессу в течение всей жизни. В выдающихся экспериментах на крысах, проведенных Weaver и соавт., у потомков матерей, получавших недостаточное количество материнской заботы/ухода (LG), был обнаружен повышенный уровень реактивности на стресс, а также повышенный уровень тревожности во взрослом возрасте по сравнению с грызунами, получавшими высокое количество материнской заботы/ухода (HG). У крыс LG было обнаружено снижение экспрессии иРНК гиппокампального глюкокортикоидного рецептора (GR) и, соответственно, снижение ацетилирования H3K9 и повышение метилирования ДНК вокруг промоутера гена GR по сравнению с животными из группы HG. Вышеописанные различия в экспрессии GR позволяют определить уровень материнской заботы, имевшийся у этих животных, и таким образом закрепить
паттерны поведения в группах LG и HG из поколения в поколение. Существует вероятность того, что в этот процесс также вовлечена эпигенетическая регуляция множества дополнительных генов. Подобная форма передачи чувствительности к стрессу через поколения, соответственно, является формой передачи поведения и не представляет собой истинное эпигенетическое наследование.
В исследованиях влияния эпигенетических механизмов на модели стресса в течение жизни выявляется кардинально новый взгляд на ряд генов и биохимических путей передачи, которые изменяются в определенных участках головного мозга, обусловливая риск развития депрессии и обратимость симптоматики при терапии антидепрессантами. Это знание может помочь нам направить свои усилия на создание нового поколения антидепрессантов, действие которых будет направлено на моноаминовые переносчики и рецепторы.
В связи с этим возникает вопрос, являются ли эпигенетические белки сами по себе подходящими мишенями для подобного вида терапии. Как уже отмечалось в данной статье, ингибиторы HDAC в некоторых моделях на грызунах оказывают действие, схожее с эффектом антидепрессантов, и существуют доказательства, позволяющие предположить, что данные препараты могут быть также эффективны для регуляции метилирования H3K9 или даже метилирования ДНК. Однако, учитывая вездесущность в молекулах фрагментов HDACs, HMTs, HDMs и DNMTs, вероятнее всего, подобные препараты будут иметь чрезвычайно большое количество побочных эффектов при лечении депрессии. Следует выяснить, имеются ли другие способы воздействия на эти процессы, если выбирать в качестве мишеней регуляторные белки головного мозга, которые могут быть использованы при создании нового поколения антидепрессантов.
Иные эпигенетические механизмы депрессии
По мере развития головного мозга, при котором образуется 100 млрд нейронов и 100 трлн синапсов, происходит бесчисленное множество случайных событий, обеспечивающих вариабельность, несмотря на стабильность генотипа и факторов окружающей среды. Примером этого явления могут послужить совершенно различные отпечатки или конфигурация извилин коры больших полушарий головного мозга у однояйцевых близнецов. Поскольку влияние на подобные явления эпигенетики носит в некоторой степени вероятностный характер, предоставить экспериментальные доказательства достаточно трудно. Например, в нашей модели социального расстройства при депрессии мы можем продемонстрировать, что у животных с идентичным генотипом, находящихся приблизительно в одинаковой внешней среде, отмечается поразительное разделение по реакции на стресс – повышенная и нормальная восприимчивость. Однако на данный момент не представляется возможным определить роль эпигенетических факторов в данном феномене, поскольку для характеристики эпигенетического состояния генов у животных до воздействия стрессовых факторов потребуются специальные инструментальные методы. Тем не менее случайно возникающие эпигенетические различия в функционировании головного мозга могут являться одной из причин, по которой возникает трудность в определении генов, отвечающих за риск развития депрессии.Некоторые ученые используют термин «эпигенетика» для обозначения передачи определенных признаков через поколения, в случае если отсутствуют изменения в последовательности нуклеотидов в молекуле ДНК. В самом деле, было показано, что стрессовые события в течение жизни изменяют устойчивость к стрессу в последующих поколениях. У самцов мышей, которые в раннем возрасте были отделены от матери, отмечается повышение чувствительности к стрессу в течение жизни, которое наблюдается и у нескольких поколений их потомков. Точно так же мыши-самцы, подверженные хроническому социальному стрессу во взрослом возрасте, дают потомство, более подверженное социальному стрессу, чем потомство контрольной группы мышей. Однако механизмы, лежащие в основе подобного наследования восприимчивости к стрессу через поколения, остаются спорными. Стресс вызывает эпигенетические модификации в определенных генах сперматозоидов подверженных стрессу мышей, однако точно неизвестно, приводят ли именно эти модификации к различиям в восприимчивости к стрессу у потомков.
В исследованиях экстракорпорального оплодотворения выдвигается предположение, что эпигенетические изменения в сперматозоидах могут играть лишь небольшую роль в передаче чувствительности к стрессу через поколения, что большая часть наблюдаемого наследования является бихевиоральной, поскольку у самок изменяется уровень
их материнской заботы при воспроизведении потомства от подверженных стрессу отцов.
По этой причине требуется проведение дальнейших исследований, чтобы выяснить, вносит ли эпигенетическое наследование чувствительности к стрессу вклад в обоснованное с точки зрения генетики и действия факторов внешней среды формирование у индивида чувствительности к стрессу в течение его жизни, и если вносит, то определить уровень воздействия эпигенетики.
Реферат подготовлен
Маргаритой Даниловой
23 июля 2014
Количество просмотров: 3634

