Клинический разбор в общей медицине №2 2023
Клинический разбор в общей медицине №2 2023
Клиническое наблюдение микст-инфекции туберкулеза и нетуберкулезного микобактериоза легких
Аннотация
Нетуберкулезный микобактериоз – инфекционное заболевание, вызываемое нетуберкулезными микобактериями с формированием в пораженных органах и тканях гранулематозного воспаления. В настоящее время описано более 200 видов нетуберкулезных микобактерий, постоянно присутствующих в окружающей среде, из которых, по данным разных авторов, от 30 до 60 штаммов способны вызывать заболевания у человека. Установлено, что пациенты с различными хроническими заболеваниями органов дыхания: хроническим бронхитом, хронической обструктивной и бронхоэктатической болезнями легких особенно привержены к микобактериозу. В последнее время все чаще появляются сообщения о сочетании туберкулеза легких и нетуберкулезного микобактериоза, что представляет особую сложность для своевременной верификации обоих процессов. Существенную помощь в диагностике этой ко-инфекции оказывает морфологическое исследование легочной ткани, позволяющее одновременно оценить признаки туберкулеза и/или нетуберкулезного микобактериоза. Приводится клинический случай микст-инфекции нетуберкулезного микобактериоза и туберкулеза легких.
Ключевые слова: микст-инфекция, нетуберкулезный микобактериоз, туберкулез легких.
Для цитирования: Саргсян А.П., Макарьянц Н.Н., Лепеха Л.Н., Демьяненко Н.Г. Клиническое наблюдение микст-инфекции туберкулеза и нетуберкулезного микобактериоза легких. Клинический разбор в общей медицине. 2023; 4 (2): 43–47. DOI: 10.47407/kr2023.4.2.00203
Нетуберкулезный микобактериоз – инфекционное заболевание, вызываемое нетуберкулезными микобактериями с формированием в пораженных органах и тканях гранулематозного воспаления. В настоящее время описано более 200 видов нетуберкулезных микобактерий, постоянно присутствующих в окружающей среде, из которых, по данным разных авторов, от 30 до 60 штаммов способны вызывать заболевания у человека. Установлено, что пациенты с различными хроническими заболеваниями органов дыхания: хроническим бронхитом, хронической обструктивной и бронхоэктатической болезнями легких особенно привержены к микобактериозу. В последнее время все чаще появляются сообщения о сочетании туберкулеза легких и нетуберкулезного микобактериоза, что представляет особую сложность для своевременной верификации обоих процессов. Существенную помощь в диагностике этой ко-инфекции оказывает морфологическое исследование легочной ткани, позволяющее одновременно оценить признаки туберкулеза и/или нетуберкулезного микобактериоза. Приводится клинический случай микст-инфекции нетуберкулезного микобактериоза и туберкулеза легких.
Ключевые слова: микст-инфекция, нетуберкулезный микобактериоз, туберкулез легких.
Для цитирования: Саргсян А.П., Макарьянц Н.Н., Лепеха Л.Н., Демьяненко Н.Г. Клиническое наблюдение микст-инфекции туберкулеза и нетуберкулезного микобактериоза легких. Клинический разбор в общей медицине. 2023; 4 (2): 43–47. DOI: 10.47407/kr2023.4.2.00203
Abstract
Nontuberculous mycobacteriosis is an infectious disease caused by nontuberculous mycobacteria (NTM) with the development of granulomatous inflammation in affected organs and tissues. By now more than 200 NTM species persisting in the environment have been described. According to different authors, 30 to 60 of strains are able to cause disease in humans. It was established that patients with different chronic lung diseases: chronic bronchitis, chronic obstructive pulmonary disease, and bronchiectatic lung disease are predisposed to mycobacteriosis. Recently, cases of pulmonary TB/NTM infection have been reported more and more frequently, which impedes timely verification of both diseases. Diagnosis of co-infection is essentially facilitated by morphological studies of lung tissue, which can simultaneously assess signs of TB and/or NTM infection. The article describes a clinical case of mixed pulmonary infection with NTM and Mycobacterium tuberculosis.
Keywords: mixed infection, nontuberculous mycobacteriosis, pulmonary TB.
For citation: Sargsyan A.P., Makaryants N.N., Lepekha L.N., Demyanenko N.G. A clinical case of a pulmonary tuberculosis/mycobacteriosis mixed infection. Clinical review for general practice. 2023; 4 (2): 43–47. DOI: 10.47407/kr2023.4.2.00203
Нетуберкулезный микобактериоз (НТМ) – инфекционное заболевание, вызываемое нетуберкулезными микобактериями (НТМБ) с формированием в пораженных органах и тканях гранулематозного воспаления [1, 2]. В настоящее время описано более 200 видов НТМБ, постоянно присутствующих в окружающей среде, из которых, по данным разных авторов, от 30 до 60 штаммов способны вызывать заболевания у человека [1–5]. Установлено, что пациенты с различными хроническими заболеваниями органов дыхания: хроническим бронхитом, хронической обструктивной и бронхоэктатической болезнями легких – особенно привержены к НТМ [5–13]. В последнее время все чаще появляются сообщения о сочетании туберкулеза легких и НТМ [3, 14], что представляет особую сложность для своевременной верификации обоих процессов. Существенную помощь в диагностике этой ко-инфекции оказывает морфологическое исследование легочной ткани, позволяющее одновременно оценить признаки туберкулеза и/или НТМ [15–17]. Приводим клинический случай сложной диагностики микст-инфекции НТМ и туберкулеза легких.
Клиническое наблюдение
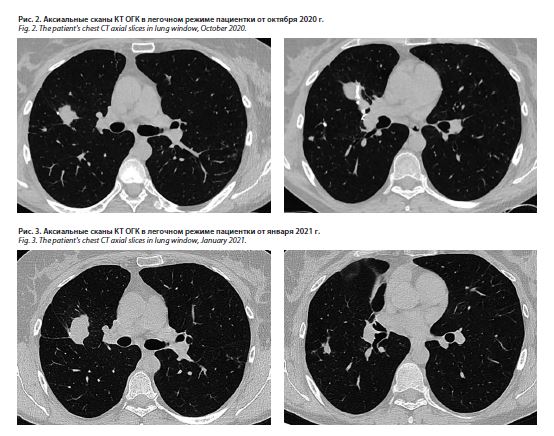
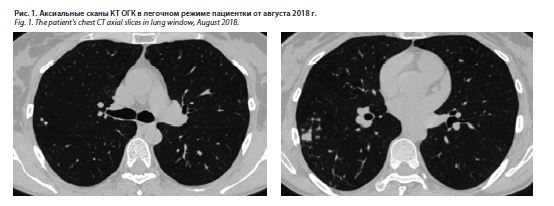 Пациентка П., 52 года, ежегодно проходила флюорографическое обследование легких, последнее – в 2016 г. Патологии выявлено не было. В анамнезе частые острые респираторные вирусные инфекции. Впервые изменения в легких выявлены при прохождении медицинского обследования в 2018 г. Выполнена компьютерная томография органов грудной клетки (КТ ОГК) в августе 2018 г., где выявлены очагово-инфильтративные изменения в обоих легких: S3, S6, S5 справа и S6 слева, единичные кальцинаты (рис. 1).
Пациентка П., 52 года, ежегодно проходила флюорографическое обследование легких, последнее – в 2016 г. Патологии выявлено не было. В анамнезе частые острые респираторные вирусные инфекции. Впервые изменения в легких выявлены при прохождении медицинского обследования в 2018 г. Выполнена компьютерная томография органов грудной клетки (КТ ОГК) в августе 2018 г., где выявлены очагово-инфильтративные изменения в обоих легких: S3, S6, S5 справа и S6 слева, единичные кальцинаты (рис. 1).
Пациентке рекомендовано обследование в противотуберкулезном диспансере по месту жительства. Проба Манту от августа 2018 г. положительная (папула 16 мм), проба с аллергеном туберкулезным рекомбинантным отрицательная. В мокроте кислотоустойчивые микобактерии (КУМ) и дезоксирибонуклеиновая кислота микобактерий туберкулеза (ДНК МБТ) не обнаружены. Выполнена фибробронхоскопия (ФБС) со взятием жидкости бронхоальвеолярного лаважа (БАЛ) и трансбронхиальной биопсии легкого (ТББЛ): в жидкости БАЛ КУМ и ДНК МБТ не обнаружены. Гистологически легочная ткань с умеренным склерозом с диффузной лимфоплазмоклеточной инфильтрацией в зоне склероза. Пациентке назначено лечение антибактериальными препаратами широкого спектра действия: амоксициллин, кларитромицин, доксициклин. При контрольном КТ-исследовании от декабря 2018 г. отмечена незначительная положительная динамика. Далее в течение года пациентка наблюдалась у пульмонолога по месту жительства. Рентгенологическая картина была стабильная, динамики не отмечалось. В январе 2020 г. консультирована торакальным хирургом, рекомендовано выполнение видеоассистированной торакоскопической (ВАТС) резекции правого легкого. В начале марта 2020 г. пациентке выполнена ВАТС средняя
лобэктомия, атипичная резекция S2. Гистологически в операционном материале эпителиоидно-клеточные казеифицированные гранулемы с гигантскими многоядерными клетками Пирогова–Лангханса, очаги казеозного некроза. По месту жительства установлен диагноз туберкулеза и начато лечение по 3-му режиму химиотерапии. Однако через несколько дней из материала БАЛ был получен рост Mycobacterium avium. Диагноз изменен на микобактериоз легких. Химиотерапия отменена.
В июне 2020 г. пациентка самостоятельно обратилась с целью консультации в ФГБНУ ЦНИИТ, где был выполнен пересмотр гистологических препаратов – картина гранулематозного воспаления по туберкулезному типу: эпителиоидно-клеточные казеифицированные гранулемы с гигантскими многоядерными клетками Пирогова–Лангханса, очаги казеозного некроза. ДНК МБТ в парафинизированном операционном материале не обнаружена. КТ ОГК от июля 2020 г. по сравнению с исследованием от августа 2019 г.: динамики не отмечалось. Пациентка была госпитализирована в отделение дифференциальной диагностики туберкулеза и экстракорпоральных методов лечения. При поступлении предъявляла жалобы на непродуктивный кашель, периодически возникающие боли в правой половине грудной клетки, сохраняющиеся после оперативного вмешательства, слабость, быструю утомляемость. При аускультации в легких дыхание везикулярное проводилось во все отделы, хрипы не выслушивались. Частота дыхательных движений – 16 в минуту. Тоны сердца были ритмичными. Частота сердечных сокращений – 78 в минуту. Артериальное давление – 130/80 мм рт. ст. Живот при пальпации мягкий, безболезненный. Печень по краю реберной дуги. Симптом поколачивания отрицательный с обеих сторон. В гемограмме все показатели были в пределах референсных значений. При исследовании функции внешнего дыхания форсированная жизненная емкость легких, объем форсированного выдоха за первую секунду и индекс Тиффно были в пределах нормы и составили 126% д.в., 108% д.в. и 85% соответственно. Выявлены обструктивные нарушения бронхиальной проходимости: мгновенная объемная скорость (МОС)75 – 53% д.в., МОС50 – 57% д.в.
Пациентке установлен диагноз: хронический бронхит с бронхоэктазами, обострение. Состояние после ВАТС средней лобэктомии, атипичной резекции S2 правого легкого от 02.03.2020. Микобактериоз легких, вызванный M. avium. КУМ (-).
Учитывая противоречивые данные, полученные при гистологическом исследовании операционного материала, с одной стороны, с другой стороны – данные посева материала БАЛ по месту жительства, пациентке проведена повторная ФБС со взятием аспирата на микробиологическое исследование. Из жидкости БАЛ вновь получен рост НТМБ M. avium с результатами лекарственной чувствительности возбудителя. При контрольном КТ-исследовании через 3 мес зарегистрирована отрицательная динамика в виде увеличения инфильтрации (до 3×2×4 см) ранее компрессированной легочной ткани в области металлического шва в S1 правого легкого, появление нового периваскулярного очага (0,4×0,5 см) в S8 правого легкого (рис. 2).
В анализе мокроты методом посева получен рост неспецифической микробной флоры Streptococcus viridans, Neisseriae spp., коагулазонегативный стафилококк, Candida albicans. Пациентке была назначена терапия с учетом чувствительности M. avium и выявленной неспецифической микрофлоры (кларитромицин, рифампицин, амикацин, этамбутол, флуконазол) с положительной клинической динамикой в виде уменьшения кашля. В условиях проводимой терапии у пациентки появилась эритроцитурия, что было связано с побочным действием рифампицина, в связи с чем лечение было отменено. Пациентка была выписана для консультации и лечения у уролога. Были даны рекомендации о проведении КТ ОГК через 2 мес для решения вопроса о целесообразности возобновления терапии по поводу НТМ.
 После проведения КТ-исследования, по данным которого вновь была зарегистрирована отрицательная динамика в области металлического шва в виде увеличения зоны инфильтрации до 41×24 мм и увеличения размеров периваскулярного очага (рис. 3), пациентка была снова госпитализирована в отделение дифференциальной диагностики туберкулеза и экстракорпоральных методов лечения и представлена на врачебный консилиум ЦНИИТ.
После проведения КТ-исследования, по данным которого вновь была зарегистрирована отрицательная динамика в области металлического шва в виде увеличения зоны инфильтрации до 41×24 мм и увеличения размеров периваскулярного очага (рис. 3), пациентка была снова госпитализирована в отделение дифференциальной диагностики туберкулеза и экстракорпоральных методов лечения и представлена на врачебный консилиум ЦНИИТ.
Исходя из противоречивых данных обследований, полученных в другом лечебном учреждении, и результатов проведенного ФБС-исследования в условиях ЦНИИТ, а также отрицательной рентгенологической динамики, не исключалось сочетание микобактериальной и туберкулезной инфекций. Актуально звучал вопрос об объеме, режимах и сроках медикаментозной терапии. Было принято решение о выполнении повторной операции. 03.03.2021 выполнена ВАТС справа, ререзекция S3 и части S6. В операционном материале обнаружена ДНК НТМ и КУМ.
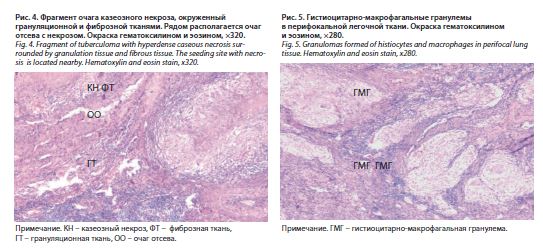
Гистологически: в препаратах присутствует несколько очагов казеозного некроза, окруженных созревающей грануляционной тканью (рис. 4). Вокруг капсулы – фиброзирующиеся гранулемы с лимфоидной периферией и признаками некротизации. В других участках легкого доминирует гранулематозная реакция гистиоцитарно-макрофагального типа без некроза (рис. 5). Гранулемы располагаются солитарно или образуют небольшие конгломераты. Прилежащая к ним легочная ткань с обширной неравномерной лимфоидной инфильтрацией. Окраска по Цилю–Нильсену: в зоне некротизирующегося гранулематоза выявляются отдельные КУМ. Заключение: картина гранулематозного воспаления туберкулезной этиологии. Имеется вероятность НТМ как вторично присоединившейся инфекции.
Пациентка вновь представлена на врачебный консилиум, где, учитывая положительную пробу Манту, наличие кальцинатов в легком по данным КТ ОГК, результаты морфологического исследования операционного материала от 03.03.2021, принято решение, что у пациентки присутствует сочетание туберкулеза и НТМ. Лечение скорректировано с учетом лекарственной чувствительности M. avium и наличия туберкулеза: линезолид, азитромицин, моксифлоксацин, рифампицин.
Заключение
Представленный клинический пример свидетельствует о трудностях дифференциальной диагностики туберкулеза и микобактериоза. В данном случае у пациентки имелось сочетание этих двух заболеваний, что видно при морфологическом исследовании операционного материала. Исключение туберкулеза после получения роста НТМБ M. avium, а также отсутствие противотуберкулезной терапии после 1-го оперативного лечения привело к отрицательной рентгенологической динамике и прогрессированию туберкулезного процесса. Объективная оценка результатов комплексного обследования, а также согласованная работа с другими подразделениями позволили нам верифицировать диагноз и назначить адекватную терапию.
В настоящее время диагностика НТМ представляет серьезную проблему для врачей. Однако все чаще появляются данные о наличии микст-патологии НТМ и туберкулеза легких. Выявление НТМБ при микробиологическом исследовании не исключает специфический процесс, особенно при морфологической его верификации, несмотря на отсутствие ДНК МБТ. Исключение туберкулезного процесса только на основании микробиологического исследования и отсутствие адекватного лечения могут привести к прогрессированию заболевания и тяжелым последствиям. Необходимы тщательное изучение и коллективная оценка всех результатов обследования.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declares that there is not conflict of interests.
Саргсян Анна Петросовна – канд. мед. наук, науч. сотр. отд. дифференциальной диагностики туберкулеза и экстракорпоральных методов лечения, ФГБНУ «ЦНИИТ». E-mail: a.sargsyan1993@mail.ru; ORCID: 0000-0001-5700-1045
Anna P. Sargsyan – Cand. Sci. (Med.), Central TB Research Institute. E-mail: a.sargsyan1993@mail.ru; ORCID: 0000-0001-5700-1045
Макарьянц Наталья Николаевна – д-р мед. наук, вед. науч. сотр., рук. отд. дифференциальной диагностики туберкулеза и экстракорпоральных методов лечения, ФГБНУ «ЦНИИТ». E-mail: Roman4000@yandex.ru; ORCID: 0000-0002-6390-8759
Natalya N. Makaryants – D. Sci. (Med.), Central TB Research Institute. E-mail: Roman4000@yandex.ru; ORCID: 0000-0002-6390-8759
Лепеха Лариса Николаевна – д-р биол. наук, проф., гл. науч. сотр. отд. патоморфологии, клеточной биологии и биохимии,
ФГБНУ «ЦНИИТ». E-mail: lep3@yandex.ru; ORCID: 0000-0002-6894-2411
Larisa N. Lepekha – D. Sci. (Biol.), Prof., Central TB Research Institute. E-mail: lep3@yandex.ru; ORCID: 0000-0002-6894-2411
Демьяненко Наталья Геннадьевна – канд. мед. наук, науч. сотр., зав. 2-го отд. дифференциальной диагностики туберкулеза
и экстракорпоральных методов лечения, ФГБНУ «ЦНИИТ». E-mail: nat.demyanencKo1015@yandex.ru; ORCID: 0000-0002-4776-189Х
Natalya G. Demyanenko – Cand. Sci. (Med.), Central TB Research Institute. E-mail: nat.demyanencKo1015@yandex.ru;
ORCID: 0000-0002-4776-189Х
Поступила в редакцию / Received: 21.02.2023
Поступила после рецензирования / Revised: 06.03.2023
Принята к публикации / Accepted: 23.03.2023
Nontuberculous mycobacteriosis is an infectious disease caused by nontuberculous mycobacteria (NTM) with the development of granulomatous inflammation in affected organs and tissues. By now more than 200 NTM species persisting in the environment have been described. According to different authors, 30 to 60 of strains are able to cause disease in humans. It was established that patients with different chronic lung diseases: chronic bronchitis, chronic obstructive pulmonary disease, and bronchiectatic lung disease are predisposed to mycobacteriosis. Recently, cases of pulmonary TB/NTM infection have been reported more and more frequently, which impedes timely verification of both diseases. Diagnosis of co-infection is essentially facilitated by morphological studies of lung tissue, which can simultaneously assess signs of TB and/or NTM infection. The article describes a clinical case of mixed pulmonary infection with NTM and Mycobacterium tuberculosis.
Keywords: mixed infection, nontuberculous mycobacteriosis, pulmonary TB.
For citation: Sargsyan A.P., Makaryants N.N., Lepekha L.N., Demyanenko N.G. A clinical case of a pulmonary tuberculosis/mycobacteriosis mixed infection. Clinical review for general practice. 2023; 4 (2): 43–47. DOI: 10.47407/kr2023.4.2.00203
Нетуберкулезный микобактериоз (НТМ) – инфекционное заболевание, вызываемое нетуберкулезными микобактериями (НТМБ) с формированием в пораженных органах и тканях гранулематозного воспаления [1, 2]. В настоящее время описано более 200 видов НТМБ, постоянно присутствующих в окружающей среде, из которых, по данным разных авторов, от 30 до 60 штаммов способны вызывать заболевания у человека [1–5]. Установлено, что пациенты с различными хроническими заболеваниями органов дыхания: хроническим бронхитом, хронической обструктивной и бронхоэктатической болезнями легких – особенно привержены к НТМ [5–13]. В последнее время все чаще появляются сообщения о сочетании туберкулеза легких и НТМ [3, 14], что представляет особую сложность для своевременной верификации обоих процессов. Существенную помощь в диагностике этой ко-инфекции оказывает морфологическое исследование легочной ткани, позволяющее одновременно оценить признаки туберкулеза и/или НТМ [15–17]. Приводим клинический случай сложной диагностики микст-инфекции НТМ и туберкулеза легких.
Клиническое наблюдение
Пациентке рекомендовано обследование в противотуберкулезном диспансере по месту жительства. Проба Манту от августа 2018 г. положительная (папула 16 мм), проба с аллергеном туберкулезным рекомбинантным отрицательная. В мокроте кислотоустойчивые микобактерии (КУМ) и дезоксирибонуклеиновая кислота микобактерий туберкулеза (ДНК МБТ) не обнаружены. Выполнена фибробронхоскопия (ФБС) со взятием жидкости бронхоальвеолярного лаважа (БАЛ) и трансбронхиальной биопсии легкого (ТББЛ): в жидкости БАЛ КУМ и ДНК МБТ не обнаружены. Гистологически легочная ткань с умеренным склерозом с диффузной лимфоплазмоклеточной инфильтрацией в зоне склероза. Пациентке назначено лечение антибактериальными препаратами широкого спектра действия: амоксициллин, кларитромицин, доксициклин. При контрольном КТ-исследовании от декабря 2018 г. отмечена незначительная положительная динамика. Далее в течение года пациентка наблюдалась у пульмонолога по месту жительства. Рентгенологическая картина была стабильная, динамики не отмечалось. В январе 2020 г. консультирована торакальным хирургом, рекомендовано выполнение видеоассистированной торакоскопической (ВАТС) резекции правого легкого. В начале марта 2020 г. пациентке выполнена ВАТС средняя
лобэктомия, атипичная резекция S2. Гистологически в операционном материале эпителиоидно-клеточные казеифицированные гранулемы с гигантскими многоядерными клетками Пирогова–Лангханса, очаги казеозного некроза. По месту жительства установлен диагноз туберкулеза и начато лечение по 3-му режиму химиотерапии. Однако через несколько дней из материала БАЛ был получен рост Mycobacterium avium. Диагноз изменен на микобактериоз легких. Химиотерапия отменена.
В июне 2020 г. пациентка самостоятельно обратилась с целью консультации в ФГБНУ ЦНИИТ, где был выполнен пересмотр гистологических препаратов – картина гранулематозного воспаления по туберкулезному типу: эпителиоидно-клеточные казеифицированные гранулемы с гигантскими многоядерными клетками Пирогова–Лангханса, очаги казеозного некроза. ДНК МБТ в парафинизированном операционном материале не обнаружена. КТ ОГК от июля 2020 г. по сравнению с исследованием от августа 2019 г.: динамики не отмечалось. Пациентка была госпитализирована в отделение дифференциальной диагностики туберкулеза и экстракорпоральных методов лечения. При поступлении предъявляла жалобы на непродуктивный кашель, периодически возникающие боли в правой половине грудной клетки, сохраняющиеся после оперативного вмешательства, слабость, быструю утомляемость. При аускультации в легких дыхание везикулярное проводилось во все отделы, хрипы не выслушивались. Частота дыхательных движений – 16 в минуту. Тоны сердца были ритмичными. Частота сердечных сокращений – 78 в минуту. Артериальное давление – 130/80 мм рт. ст. Живот при пальпации мягкий, безболезненный. Печень по краю реберной дуги. Симптом поколачивания отрицательный с обеих сторон. В гемограмме все показатели были в пределах референсных значений. При исследовании функции внешнего дыхания форсированная жизненная емкость легких, объем форсированного выдоха за первую секунду и индекс Тиффно были в пределах нормы и составили 126% д.в., 108% д.в. и 85% соответственно. Выявлены обструктивные нарушения бронхиальной проходимости: мгновенная объемная скорость (МОС)75 – 53% д.в., МОС50 – 57% д.в.
Пациентке установлен диагноз: хронический бронхит с бронхоэктазами, обострение. Состояние после ВАТС средней лобэктомии, атипичной резекции S2 правого легкого от 02.03.2020. Микобактериоз легких, вызванный M. avium. КУМ (-).
Учитывая противоречивые данные, полученные при гистологическом исследовании операционного материала, с одной стороны, с другой стороны – данные посева материала БАЛ по месту жительства, пациентке проведена повторная ФБС со взятием аспирата на микробиологическое исследование. Из жидкости БАЛ вновь получен рост НТМБ M. avium с результатами лекарственной чувствительности возбудителя. При контрольном КТ-исследовании через 3 мес зарегистрирована отрицательная динамика в виде увеличения инфильтрации (до 3×2×4 см) ранее компрессированной легочной ткани в области металлического шва в S1 правого легкого, появление нового периваскулярного очага (0,4×0,5 см) в S8 правого легкого (рис. 2).
В анализе мокроты методом посева получен рост неспецифической микробной флоры Streptococcus viridans, Neisseriae spp., коагулазонегативный стафилококк, Candida albicans. Пациентке была назначена терапия с учетом чувствительности M. avium и выявленной неспецифической микрофлоры (кларитромицин, рифампицин, амикацин, этамбутол, флуконазол) с положительной клинической динамикой в виде уменьшения кашля. В условиях проводимой терапии у пациентки появилась эритроцитурия, что было связано с побочным действием рифампицина, в связи с чем лечение было отменено. Пациентка была выписана для консультации и лечения у уролога. Были даны рекомендации о проведении КТ ОГК через 2 мес для решения вопроса о целесообразности возобновления терапии по поводу НТМ.
Исходя из противоречивых данных обследований, полученных в другом лечебном учреждении, и результатов проведенного ФБС-исследования в условиях ЦНИИТ, а также отрицательной рентгенологической динамики, не исключалось сочетание микобактериальной и туберкулезной инфекций. Актуально звучал вопрос об объеме, режимах и сроках медикаментозной терапии. Было принято решение о выполнении повторной операции. 03.03.2021 выполнена ВАТС справа, ререзекция S3 и части S6. В операционном материале обнаружена ДНК НТМ и КУМ.
Гистологически: в препаратах присутствует несколько очагов казеозного некроза, окруженных созревающей грануляционной тканью (рис. 4). Вокруг капсулы – фиброзирующиеся гранулемы с лимфоидной периферией и признаками некротизации. В других участках легкого доминирует гранулематозная реакция гистиоцитарно-макрофагального типа без некроза (рис. 5). Гранулемы располагаются солитарно или образуют небольшие конгломераты. Прилежащая к ним легочная ткань с обширной неравномерной лимфоидной инфильтрацией. Окраска по Цилю–Нильсену: в зоне некротизирующегося гранулематоза выявляются отдельные КУМ. Заключение: картина гранулематозного воспаления туберкулезной этиологии. Имеется вероятность НТМ как вторично присоединившейся инфекции.
Пациентка вновь представлена на врачебный консилиум, где, учитывая положительную пробу Манту, наличие кальцинатов в легком по данным КТ ОГК, результаты морфологического исследования операционного материала от 03.03.2021, принято решение, что у пациентки присутствует сочетание туберкулеза и НТМ. Лечение скорректировано с учетом лекарственной чувствительности M. avium и наличия туберкулеза: линезолид, азитромицин, моксифлоксацин, рифампицин.
Заключение
Представленный клинический пример свидетельствует о трудностях дифференциальной диагностики туберкулеза и микобактериоза. В данном случае у пациентки имелось сочетание этих двух заболеваний, что видно при морфологическом исследовании операционного материала. Исключение туберкулеза после получения роста НТМБ M. avium, а также отсутствие противотуберкулезной терапии после 1-го оперативного лечения привело к отрицательной рентгенологической динамике и прогрессированию туберкулезного процесса. Объективная оценка результатов комплексного обследования, а также согласованная работа с другими подразделениями позволили нам верифицировать диагноз и назначить адекватную терапию.
В настоящее время диагностика НТМ представляет серьезную проблему для врачей. Однако все чаще появляются данные о наличии микст-патологии НТМ и туберкулеза легких. Выявление НТМБ при микробиологическом исследовании не исключает специфический процесс, особенно при морфологической его верификации, несмотря на отсутствие ДНК МБТ. Исключение туберкулезного процесса только на основании микробиологического исследования и отсутствие адекватного лечения могут привести к прогрессированию заболевания и тяжелым последствиям. Необходимы тщательное изучение и коллективная оценка всех результатов обследования.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declares that there is not conflict of interests.
Саргсян Анна Петросовна – канд. мед. наук, науч. сотр. отд. дифференциальной диагностики туберкулеза и экстракорпоральных методов лечения, ФГБНУ «ЦНИИТ». E-mail: a.sargsyan1993@mail.ru; ORCID: 0000-0001-5700-1045
Anna P. Sargsyan – Cand. Sci. (Med.), Central TB Research Institute. E-mail: a.sargsyan1993@mail.ru; ORCID: 0000-0001-5700-1045
Макарьянц Наталья Николаевна – д-р мед. наук, вед. науч. сотр., рук. отд. дифференциальной диагностики туберкулеза и экстракорпоральных методов лечения, ФГБНУ «ЦНИИТ». E-mail: Roman4000@yandex.ru; ORCID: 0000-0002-6390-8759
Natalya N. Makaryants – D. Sci. (Med.), Central TB Research Institute. E-mail: Roman4000@yandex.ru; ORCID: 0000-0002-6390-8759
Лепеха Лариса Николаевна – д-р биол. наук, проф., гл. науч. сотр. отд. патоморфологии, клеточной биологии и биохимии,
ФГБНУ «ЦНИИТ». E-mail: lep3@yandex.ru; ORCID: 0000-0002-6894-2411
Larisa N. Lepekha – D. Sci. (Biol.), Prof., Central TB Research Institute. E-mail: lep3@yandex.ru; ORCID: 0000-0002-6894-2411
Демьяненко Наталья Геннадьевна – канд. мед. наук, науч. сотр., зав. 2-го отд. дифференциальной диагностики туберкулеза
и экстракорпоральных методов лечения, ФГБНУ «ЦНИИТ». E-mail: nat.demyanencKo1015@yandex.ru; ORCID: 0000-0002-4776-189Х
Natalya G. Demyanenko – Cand. Sci. (Med.), Central TB Research Institute. E-mail: nat.demyanencKo1015@yandex.ru;
ORCID: 0000-0002-4776-189Х
Поступила в редакцию / Received: 21.02.2023
Поступила после рецензирования / Revised: 06.03.2023
Принята к публикации / Accepted: 23.03.2023
Список исп. литературыСкрыть список1. Гунтупова Л.Д., Борисов С.Е., Соловьева И.П. и др. Микобактериозы во фтизиопульмонологической практике: обзор литературы и собственный опыт. Практическая медицина. 2011; 3 (51): 39–50.
[Guntupova L.D., Borisov C.E., Solovyova I.P. et al. Mycobacterioses in phthisiopulmonological practice: literature review and own experience. Practical medicine. 2011; 3 (51): 39–50 (in Russian).]
2. Литвинов В.И. Нетуберкулезные микобактерии, микобактериозы. Вестник ЦНИИТ. 2018; 2: 5–20.
[Litvinov V.I. Nontuberculous mycobacteria, mycobacterioses.
TsNIIT Bulletin. 2018; 2: 5–20 (in Russian).]
3. Степанян И.Э., Багдасарян Т.Р., Ларионова Е.Е. и др. Туберкулез и микобактериоз легких у одного пациента: особенности диагностики и лечения. Вестник Центрального научно-исследовательского института туберкулеза. 2019; 1: 84–90.
[Stepanyan I.E., Baghdasaryan T.R., Larionova E.E. et al. Tuberculosis and mycobacteriosis of the lungs in one patient: peculiarities of diagnosis and treatment. Bulletin of the Central Tuberculosis Research Institute. 2019; 1: 84–90 (in Russian).]
4. Шмелев Е.И., Ковалевская М.Н., Эргешов А.Э. и др. Микобактериозы в практике врача-пульмонолога: состояние проблемы. Практическая пульмонология. 2016; 3: 37–43.
[Shmelev E.I., Kovalevskaya M.N., Ergeshov A.E. et al. Mycobacterioses in the practice of a pulmonologist: the state of the problem. Practical pulmonology. 2016; 3: 37–43 (in Russian).]
5. Эргешов А.Э., Шмелев Е.И., Ковалевская М.Н. и др. Нетуберкулезные микобактерии у пациентов с заболеваниями органов дыхания (клинико-лабораторное исследование). Пульмонология. 2016; 26 (3): 303–8.
[Ergeshov A.E., Shmelev E.I., Kovalevskaya M.N. et al. Non-tuberculous mycobacteria in patients with respiratory diseases (clinical and laboratory study). Pulmonology. 2016; 26 (3): 303–8 (in Russian).]
6. Andréjak C, Nielsen R, Thomsen VØ et al. Chronic respiratory disease, inhaled corticosteroids and risk of non-tuberculous mycobacteriosis. Thorax 2013; 68 (3): 256–62.
7. Balavoine C, Andréjak C, Marchand-Adam S, Blanc FX. Relations entre la BPCO et les infections à mycobactéries non tuberculeuses [Relationships between COPD and nontuberculous mycobacteria pulmonary infections]. Rev Mal Respir 2017; 34 (10): 1091–7.
8. Chin KL, Sarmiento ME, Alvarez-Cabrera N et al. Pulmonary non-tuberculous mycobacterial infections: current state and future management. Eur J Clin Microbiol Infect Dis 2020; 39 (5): 799–826.
9. Marras TK, Daley CL. Epidemiology of human pulmonary infection with nontuberculous mycobacteria. Clin Chest Med 2002; 23 (3): 553–67.
10. Prevots DR, Marras TK. Epidemiology of human pulmonary infection with nontuberculous mycobacteria: a review. Clin Chest Med 2015; 36 (1): 13–34.
11. Ringshausen FC, Wagner D, de Roux A et al. Prevalence of Nontuberculous Mycobacterial Pulmonary Disease, Germany, 2009–2014. Emerg Infect Dis 2016; 22 (6): 1102–5.
12. Jeon D. Infection Source and Epidemiology of Nontuberculous Mycobacterial Lung Disease. D Jeon Tuberc Respir Dis (Seoul) 2019; 82 (2): 94–101.
13. Jones MM, Winthrop KL, Nelson SD et al. Epidemiology of nontuberculous mycobacterial infections in the U.S. Veterans Health Administration. PLoS One 2018; 13 (6): e0197976.
14. Амансахедов Р.Б., Лепеха Л.Н., Дмитриева Л.И. и др. Рентгенморфологическая семиотика нетуберкулезных микобактериозов легких. Вестник рентгенологии и радиологии. 2018; 99 (4): 184–90.
[Amansakhedov R.B., Lepekha L.N., Dmitrieva L.I. et al. X-ray morphological semiotics of non-tuberculous mycobacteriosis of the lungs. Bull Radiology Radiology 2018; 99 (4): 184–90 (in Russian).]
15. Лепеха Л.Н., Красникова Е.В., Макарьянц Н.Н. и др. Тканевые и клеточные реакции легких, вызванные различными штаммами медленнорастущих нетуберкулезных микобактерий. Вестник Центрального научно-исследовательского института туберкулеза. 2020; 4: 27–34.
[Lepekha L.N., Krasnikova E.V., Makaryants N.N. et al. Tissue and cellular lung responses caused by different strains of slow-growing nontuberculous mycobacteria. Bulletin of the Central Tuberculosis Research Institute. 2020; 4: 27–34 (in Russian).]
16. Михайловский А.М., Чуркин С.А., Пашкова Н.А., Лепеха Л.Н. Частота выявления и особенности морфологии нетуберкулезного микобактериоза у больных на поздней стадии ВИЧ-инфекции (по данным Оренбургской области). Туберкулез и болезни легких. 2016; 94 (12): 57–61.
[Mikhailovsky A.M., Churkin S.A., Pashkova N.A., Lepekha L.N. Frequency of detection and peculiarities of morphology of nontuberculous mycobacteriosis in patients at an advanced stage of HIV infection (according to the Orenburg region). Tuberculosis and lung diseases. 2016; 94 (12): 57–61 (in Russian).]
17. Саргсян А.П., Макарьянц Н.Н., Лепеха Л.Н. и др. Сложности дифференциальной диагностики микобактериоза легких, вызванного M. abscessus. Вестник Центрального научно-исследовательского института туберкулеза. 2020; 4: 81–7.
[Sargsyan A.P., Makaryants N.N., Lepekha L.N. et al. Difficulties of differential diagnosis of mycobacteriosis of the lungs caused by
M. abscessus. Bulletin of the Central Tuberculosis Research Institute. 2020; 4: 81–7 (in Russian).]
