Клинический разбор в общей медицине №8 2023
1 National Research Center Institute of Immunology, Federal Medical and Biological Agency of Russia, Moscow, Russia;
2 Yevdokimov Moscow State University of Medicine and Dentistry, Moscow, Russia;
3 Pirogov Russian National Research Medical University, Moscow, Russia
darya.mdinaradze@yandex.ru
Abstract
Background. Allergen immunotherapy (AIT) is a pathogenetic substantiated method for the allergic disease’s treatment, which allows reducing the symptom severity and decreasing the medication use. Uncontrolled severe asthma is a contraindication for AIT. The appointment of biological therapy helps to improve the asthma control, but their cancellation is impossible. The combined use of the biological therapy and AIT makes it possible to achieve the long-term symptoms control in patients with severe asthma, increase the AIT safety, and probably stop biological therapy.
Aim. To evaluate the efficacy and safety of combination therapy with dupilumab and AIT in patients with severe asthma.
Materials and methods. The study involved 30 adult patients with moderate to atopic severe asthma. Patients was randomized for 3 groups: group 1: standard therapy (0–52 weeks) + dupilumab (0–16 weeks) + AIT (12–16 weeks); group 2: standard therapy without biological therapy (0–52 weeks) + AIT (12–16 weeks); group 3: standard therapy without biological therapy, without AIT (0–52 weeks).
We evaluated the asthma control and comorbidities using questionnaires (ACQ, AQLQ, TNSS, SNOT-22, DQLQ), respiratory function (FEV1), the number of exacerbations and adverse events At control points (initially, after 12, 20 and 52 weeks).
Results. As a result of the appointment of dupilumab it was possible to quickly achieve asthma control and comorbidities (12 wk), which made it possible to successfully conduct AIT. In the first group, symptom control is maintained even after discontinuation of both dupilumab and AIT. ACQ-6 52 wk: 1 group – 0.30±0.21; 2 group – 1.62±0.51; 3 group – 2.76±0.85. FEV1 52 wk: group 1 – 81.47±7.48%; group 2 – 73.99±6.17%; group 3 – 65.02±7.23% for 3 group (р<0.01). In the first group, there weren’t adverse events that allowed complete AIT successfully, unlike for the second group, where, maximum tolerated allergen dose was lower due to development of systemic reactions.
Conclusion. Combined treatment with dupilumab and AIT allows to quickly achieve a control, decrease a background therapy and adverse events during the AIT. The control of asthma symptoms and the effect of AIT were maintained even after the end of dupilumab therapy.
Key words: asthma, atopic asthma, severe asthma, targeted therapy, monoclonal antibodies, biologicals, dupilumab, allergy immunotherapy.
For citation: Kulichenko D.S., Pavlova K.S., Kurbacheva O.M., Ilina N.I. Allergy immunotherapy in combination with biological therapy in moderate and severe asthma. Clinical review for general practice. 2023; 4 (8): 13–23 (In Russ.). DOI: 10.47407/kr2023.4.8.00326
На сегодняшний день с помощью назначения стандартной фармакотерапии БА, основой которой, согласно Федеральным клиническим рекомендациям, являются комбинированные препараты, содержащие ингаляционные глюкокортикостероиды и длительно действующие ß2-агонисты (ИГКС+ДДБА), удается достигать полного или хотя бы частичного контроля над симптомами БА у большинства пациентов [1, 2]. При этом, несмотря на регулярное применение ИГКС и других противоастматических препаратов, у части пациентов со среднетяжелым и тяжелым течением БА все же не удается достичь полного контроля над симптомами заболевания, что приводит к обострениям и необходимости назначения системных глюкокортикостероидов (сГКС) короткими курсами или в качестве постоянной терапии.
Тяжелая БА (ТБА) – это БА, которая требует лечения, соответствующего ступеням IV–V терапии по GINA (Global Initiative for Asthma – Глобальная инициатива по бронхиальной астме), – высокие дозы ИГКС в комбинации с ДДБА и/или антагонистами лейкотриеновых рецепторов, и/или длительно-действующими холинолитиками, применения сГКС в течение 6 мес и более за последний год, что необходимо для достижения и сохранения контроля, или БА, которая остается неконтролируемой, несмотря на эту терапию [1, 2].
Хотя к категории неконтролируемой ТБА относится менее 5% от числа всех пациентов с БА, именно на них приходится 50% экономических затрат, предназначенных на заболевание в целом [3]. Тяжелые обострения требуют стационарного лечения, нередко с использованием реанимационных подразделений, а для лечения любого обострения применяются сГКС, обладающие выраженными побочными действиями. В конечном итоге терапия, приводящая к снижению количества
обострений БА, является мерой, сберегающей ресурсы здравоохранения и сокращающей количество дней нетрудоспособности [4].
Последние десятилетия были посвящены открытиям и изучениям биологических эффектов моноклональных антител, которые претерпели огромную трансформацию из объектов для научных исследований в одни из самых современных и эффективных средств лечения пациентов c различной патологией. Продолжаются исследования по изучению эффективности и безопасности новых иммунобиологических препаратов, а также ранее известных генно-инженерных биологических препаратов (ГИБП) с целью расширения спектра показаний. В общей сложности шесть моноклональных антител в настоящее время одобрены для лечения ТБА: омализумаб, меполизумаб, реслизумаб, бенрализумаб, тезепелумаб и дупилумаб. Эти препараты продемонстрировали эффективность в лечении ТБА с улучшением функции легких, снижением частоты обострений и уменьшением пероральной дозы ГКС у лиц разных возрастных групп. Проблемой применения ГИБП остается высокая стоимость и необходимость долгосрочного лечения (нет данных о сроках проведения и возможности отмены данной терапии) [5–7].
Атопическая (аллергическая) БА является превалирующим фенотипом как среди пациентов с легкой, так и с тяжелой БА. Аллерген-специфическая иммунотерапия (АСИТ) представляет собой основной патогенетический вид терапии атопических заболеваний, обладает уникальным болезнь-модифицирующим эффектом – позволяет предотвратить развитие БА у пациентов с аллергическим ринитом (АР), уменьшить выраженность симптомов БА и снизить объем фармакологической терапии. Уникальность АСИТ также состоит в сохранении долгосрочного эффекта даже после завершения курса терапии. Обязательным условием для начала проведения АСИТ, согласно клиническим рекомендациям, является достижение полного контроля над симптомами БА, что возможно с использованием любых фармакологических средств, соответствующих IV–V ступени по GINA, кроме сГКС. Таким образом, тяжелая и неконтролируемая БА является противопоказанием для проведения АСИТ [8].
Сочетанное применение моноклональных антител и АСИТ представляет собой одно из перспективных терапевтических направлений. В первую очередь, такие исследования проводились с применением омализумаба, и показали синергичность положительного влияния омализумаба и АСИТ на течение БА [9]. В мировой литературе существуют единичные публикации о сочетанном применении дупилумаба и АСИТ при лечении пациентов с АР, но отсутствуют данные о применении данной схемы лечения у пациентов с БА [10]. Таким образом, на сегодняшний день в мировой литературе представлено ограниченное количество исследований, посвященных изучению сочетанного применения ГИБП и АСИТ, а также проведения АСИТ у пациентов с ТБА.
Цель – оценить эффективность и безопасность проведения сочетанной терапии дупилумабом и АСИТ у взрослых пациентов, страдающих среднетяжелой и тяжелой атопической БА.
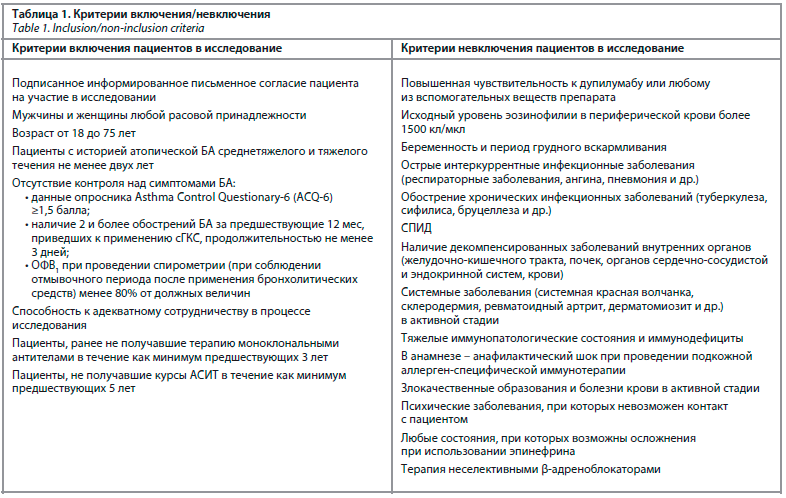
Исследование проводилось на базе отделения «Бронхиальной астмы» клиники ФГБУ «ГНЦ Институт иммунологии» ФМБА России. Протокол настоящего исследования был одобрен Комитетом по этике ФГБУ «ГНЦ Институт иммунологии» ФМБА России (протокол №11 от 25.11.2019). Участие в исследовании являлось добровольным, где набор пациентов проводился как на амбулаторном приеме, так и в условиях стационара. В соответствии с Хельсинской декларацией до включения в исследование пациенты давали свое устное и письменное согласие на участие (форма информации для больного и информированного согласия).
Формирование групп осуществлялось на основании разработанных критериев включения/невключения. Критерии предварительно были разработаны с учетом нормативной документации.
В исследовании приняли участие 30 пациентов, соответствующих критериям включения и не имевших критериев невключения (табл. 1), не достигших контроля над симптомами БА на фоне базисной терапии в соответствии с IV–V ступенями GINA [2].
После подписания информированного согласия на участие в исследовании всем добровольцам проводилось скрининговое обследование.
В рамках первого визита всем пациентам проводилась оценка параметров клинико-лабораторного обследования (клинический анализ крови с определением лейкоцитарной формулы, определение уровня общего IgE в сыворотке крови), аллергологического обследования (определение специфических IgE к респираторным аллергенам в сыворотке крови, Phadia ImmunoCAP, постановка кожных тестов с водно-солевыми экстрактами аллергенов), результатов опросника ACQ-6, исследования функции внешнего дыхания.
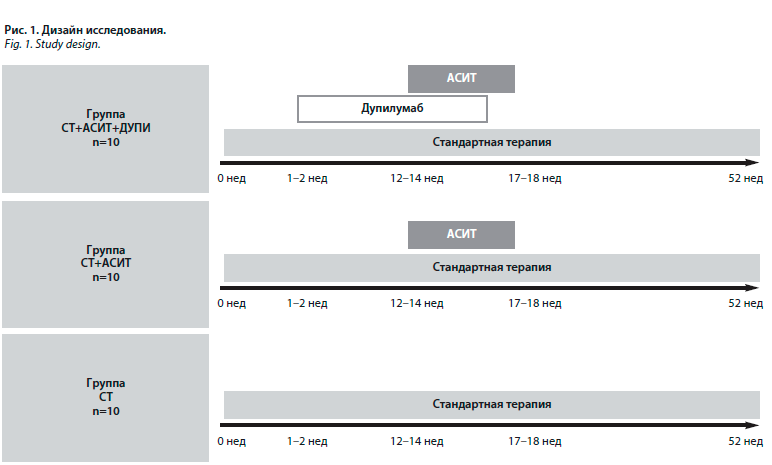
После оценки результатов обследования и при соответствии критериям включения/невключения пациенты были случайным образом рандомизированы в 3 группы по 10 добровольцев в каждой группе. Все участники исследования в течение всего периода наблюдения получали стандартную терапию в соответствии с тяжестью течения БА (IV–V ступенями GINA).
Группа 1 (СТ+АСИТ+ДУПИ): пациентам в течение 3 мес проведен короткий курс иммунобиологической терапии дупилумабом в соответствии с инструкцией, при достижении контроля БА был инициирован курс АСИТ водно-солевыми экстрактами причинно-значимых аллергенов ускоренным методом.
Группа 2 (СТ+АСИТ): в случае достижения контроля с помощью стандартной терапии (IV–V ступень GINA) без проведения иммунобиологической терапии, пациентам проведен курс АСИТ водно-солевыми экстрактами причинно-значимых аллергенов ускоренным методом.
Группа 3 (СТ): достижение контроля осуществлялось с помощью стандартной терапии (IV–V ступень GINA) без проведения иммунобиологической терапии и без проведения курса АСИТ (рис. 1).
Процедуры исследования:
1) скрининг (2 нед);
2) первый лечебный период (12 нед, от 2 нед до 14 нед);
3) второй лечебный период (2 нед, от 14 нед до 16 нед);
4) период последующего наблюдения (24 нед, от 16 нед до 52 нед).
На этапе скрининга со всеми пациентами проводилась работа над исключением ошибок техники использования ингаляционных устройств, над улучшением комплаенса, рассматривалась необходимость увеличения объема или изменения базисной терапии.
Первый лечебный период для пациентов 1-й группы (СТ+АСИТ+ДУПИ) (V1–V6) продолжался 12 нед, в течение которых каждый пациент получил 6 инъекций дупилумаба в соответствии с инструкцией (300 мг п/к каждые 2 нед) [11]. Во время второго лечебного периода для пациентов 1-й группы (V7–V21) был проведен курс АСИТ водно-солевыми экстрактами причинно-значимых аллергенов ускоренным методом с продолжающимся введением дупилумаба с интервалом 1 раз
в 2 нед. При проведении АСИТ водно-солевыми экстрактами ускоренным методом начальная доза аллергена – 10-6×0,2 мл, что соответствует 0,002 PNU (единиц белкового азота), конечная доза аллергена – 10-1×1,0 мл, что соответствует 1000 PNU. Пациенты получали инъекции аллергенов 2–3 раза в день с интервалом в 2 ч [12].
С учетом индивидуальной переносимости лечения кратность инъекций может быть сокращена до 1 в день или 1 через день с продолжающимся введением дупилумаба с интервалом 1 раз в 2 нед. В ходе визитов периода последующего наблюдения (через 2 нед после окончания терапии – V22, через 10±2 нед после окончания терапии (V23) и через 52±2 нед после окончания терапии V24) проводилась оценка контроля БА и необходимость коррекции базисной терапии.
В первый лечебный период для пациентов 2-й группы была скорректирована стандартная базисная терапия. В случае достижения контроля над симптомами БА пациентам из группы сравнения (СТ+АСИТ) проведен курс АСИТ водно-солевыми экстрактами аллергенов ускоренным методом без применения иммунобиологической терапии (по указанной выше методике) с периодом последующего наблюдения (через 2 нед после окончания терапии, через 10±2 нед после окончания терапии и через 52±2 нед после окончания терапии).
Пациенты 3-й группы получали лечение в соответствии с IV–V ступенью по GINA, исключая АСИТ и ГИБП.
Критерии оценки эффективности лечения. Критериями оценки достижения и поддержания контроля явилась динамика результатов, полученных с помощью субъективных (заполнения опросников Asthma Control Questionary-6, ACQ-6 и Asthma Questionary Quality of Life, AQLQ) и объективных методов (физикальный осмотр, включая аускультацию, исследование функции внешнего дыхания); оценка объема фармакологической нагрузки (возможность уменьшения объема базисной терапии при достижении контроля или, наоборот, необходимость назначения дополнительных препаратов), количество обострений БА, использование ресурсов здравоохранения в начале исследования и в контрольных точках.
Оценка обострений БА за наблюдаемый период. Обострение БА определялось как ухудшение астмы, характеризующееся усилением симптомов, ухудшением показателей внешнего дыхания, увеличением потребности использования ингаляционных бронхолитиков быстрого действия, признаков тахипноэ и тахикардии, снижения насыщения крови кислородом и необходимостью назначения сГКС не менее трех дней подряд или не менее чем двукратное повышение объема сГКС терапии для пациентов, исходно находившихся на оральных кортикостероидах.
Оценка влияния сопутствующих заболеваний на качество жизни. Для оценки динамики изменения качества жизни и выраженности симптомов сопутствующих заболеваний пациенты заполняли опросники, разработанные в соответствии с нозологической формой заболевания. Опросник Total Nasal Symptom Score (TNSS) – для пациентов с АР, опросник Sino-Nasal Outcome Test-22 (SNOT-22) – для пациентов, страдающих полипозным риносинуситом (ПРС), опросник для оценки индекса качества жизни у пациентов с дерматитом Dermatology Life Quality Index (DLQI) – у пациентов с сопутствующим атопическим дерматитом (АтД).
Оценка нежелательных явлений. За нежелательное явление принималось любое неблагоприятное изменение в состоянии здоровья пациента, развившееся в ходе исследования с момента подписания информированного согласия, независимо от причинно-следственной связи (с оценкой вероятности связи нежелательного явления с диагностическими и лечебными процедурами исследования).
Статистическая обработка полученных данных. Статистический анализ фактических данных проводили при помощи пакета статистических программ Graphpad prism 9.0. Данные приводили в виде «среднее арифметическое» ± «стандартное отклонение» [M±σ].
Сравнение независимых групп проводилось с помощью H-критерия Краскела–Уоллиса для оценки значимой межгрупповой изменчивости более чем в двух группах, а дальнейшее сравнение между группами проводилось с помощью U-критерия Манна–Уитни, различия считались статистически значимыми при p≤0,05.
Для выявления сенсибилизации всем пациентам было проведено аллергологическое обследование, включая кожное тестирование и определение специфических IgE (sIgE), где значимым считалось повышение уровня IgE>0,7 кМЕ/л (2-й класс реакции). В структуре сенсибилизации превалировала повышенная чувствительность к аллергенам домашней пыли (выявлена у всех 30 пациентов) у 15 человек – к аллергенам клещей домашней пыли (Dermatophagoides pteronyssinus, Dermatophagoides farinae), у 13 пациентов – к аллергенам пыльцы березы, у 16 пациентов – к эпидермальным аллергенам, у 10 пациентов – к аллергенам пыльцы злаковых трав, у 8 человек – к аллергенам пыльцы сорных трав. Клинически значимой сенсибилизацией считали наличие клинических проявлений (обострений основного заболевания), соответствующих выявленной при аллергологическом обследовании.
Пациенты были рандомизированы в 3 группы, в двух группах, согласно протоколу исследования, был проведен курс АСИТ водно-солевыми экстрактами причинно-значимыми аллергенами ускоренным методом (табл. 2).
В качестве базисной терапии все пациенты получали высокие или средние дозы иГКС в комбинации с ДДБА, 23 пациента дополнительно получали антагонист лейкотриеновых рецепторов (монтелукаст), 15 – длительно действующий М-холинолитик (тиотропия бромид).
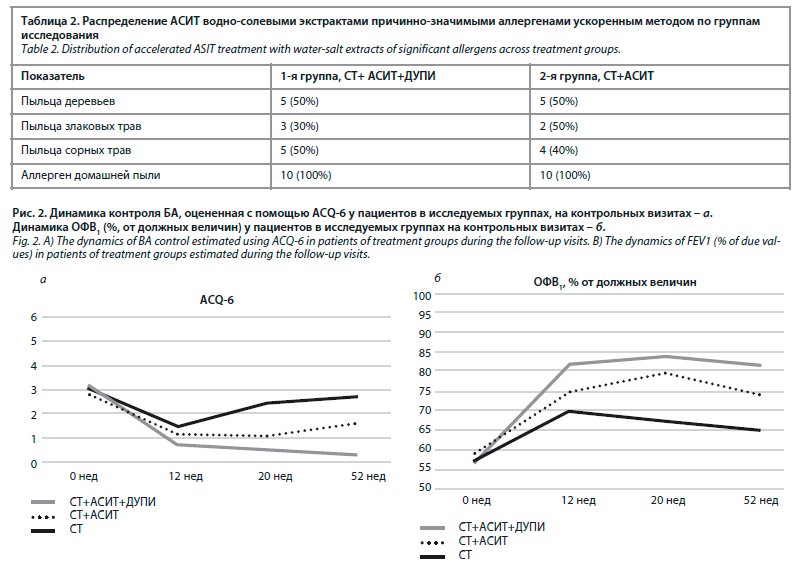
В группе СТ+ДУПИ+АСИТ повышение контроля было достигнуто за более короткие сроки, чем в других группах [ACQ-6: для группы СТ+ДУПИ+АСИТ исходно 3,20±0,79, через 12 нед 0,73±0,63 (p=0,001); для СТ+АСИТ исходно 2,87±0,70, через 12 нед 1,20±0,97 (p=0,01); для группы СТ исходно 3,04±0,79, через 12 нед 1,49±0,78 (p=0,001)].
Достижение контроля БА к 12-й неделе от включения в исследование позволило инициировать АСИТ в группах СТ+ДУПИ+АСИТ и СТ+АСИТ. В 1-й группе (СТ+ДУПИ+АСИТ) хороший контроль после завершения АСИТ сохранялся и после окончания лечения, и в период последующего наблюдения в течение 52 нед (ACQ-6: на 52-й неделе для группы СТ+ДУПИ+АСИТ 0,30±0,21; против 1,67±0,51 для СТ [p=0,05], рис. 2).
У пациентов из второй группы, которые получали АСИТ без терапии дупилумабом, некоторое время наблюдалось сохранение контроля, но потом появилась тенденция к его уменьшению (ACQ-6: исходно 2,87±0,7, через 12 нед 1,2±0,97 [p=0,002], через 20 нед 1,13±0,55 [p=0,256], через 52 нед 1,62±0,51 [p=0,105]).
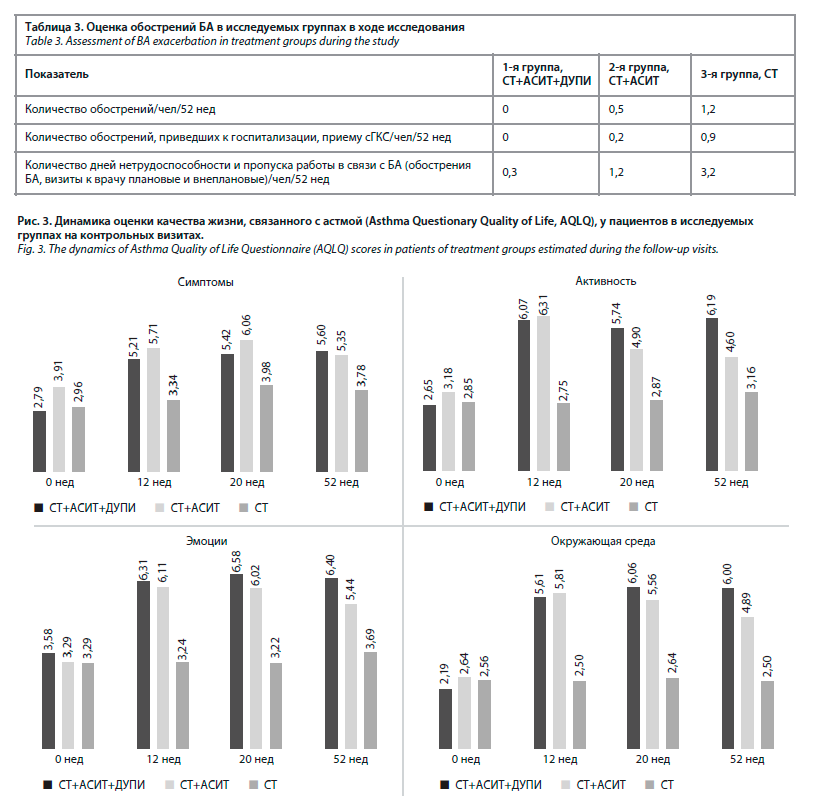
При оценке качества жизни, связанного с БА, в группе СТ+АСИТ+ДУПИ было выявлено существенное улучшение качества жизни уже через 12 нед, которое сохранялось на протяжении всего периода наблюдения (∆ AQLQ за 12 нед: шкала симптомов 2,79±0,55 [p=0,003]; шкала активности 3,42±0,34 [p=0,0001]; шкала эмоциональной составляющей 2,74±0,76 [p=0,002]; шкала влияния окружающей среды 3,45±0,70 [p=0,0001]). При этом не было получено статистически достоверных различий при оценке качества жизни, связанного с БА, в двух других группах (рис. 3).
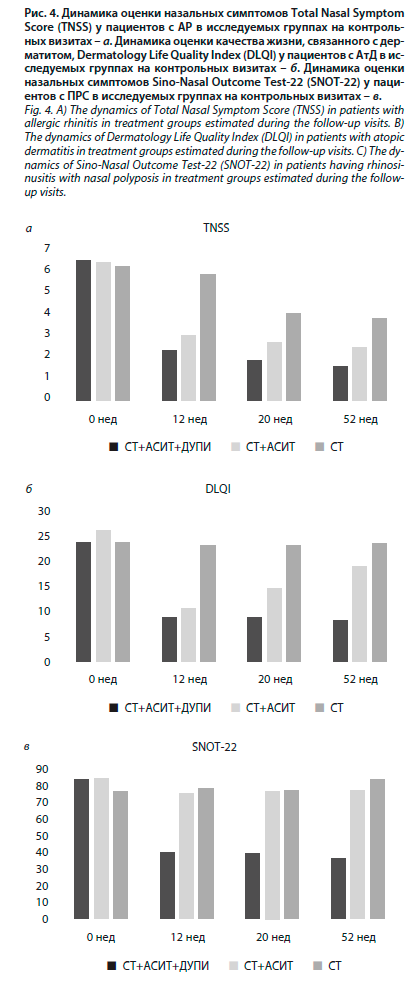 Поскольку дупилумаб обладает универсальным действием и, кроме лечения БА, имеет показание к назначению при ПРС и АтД, ожидаемо, что терапия дупилумабом может улучшить контроль данной сопутствующей патологии у пациентов 1-й группы (рис. 4). В нашем исследовании мы отметили улучшение течения АтД: ∆DLQI за 52 нед для группы СТ+ДУПИ+АСИТ составила 16,0±1,25 (p=0,001); для СТ+АСИТ 6,8±1,67 (p=0,02); для группы СТ против 0,28±1,35 (p=0,135). АСИТ положительно образом влияла на назальные симптомы у пациентов с сопутствующим АР, но в группе СТ+ДУПИ+АСИТ данные изменения были более выраженные (см. рис. 4). В группе пациентов с сопутствующим ПРС положительная динамика отмечена только в группе сочетанной терапии дупилумаба и АСИТ (∆SNOT 22 за 52 нед для группы СТ+ДУПИ+АСИТ 48,0±8,01 (p=0,00003); для СТ+АСИТ 7,3±11,6 (p=0,013); для группы СТ против 6,2±10,0 (p=0,012).
Поскольку дупилумаб обладает универсальным действием и, кроме лечения БА, имеет показание к назначению при ПРС и АтД, ожидаемо, что терапия дупилумабом может улучшить контроль данной сопутствующей патологии у пациентов 1-й группы (рис. 4). В нашем исследовании мы отметили улучшение течения АтД: ∆DLQI за 52 нед для группы СТ+ДУПИ+АСИТ составила 16,0±1,25 (p=0,001); для СТ+АСИТ 6,8±1,67 (p=0,02); для группы СТ против 0,28±1,35 (p=0,135). АСИТ положительно образом влияла на назальные симптомы у пациентов с сопутствующим АР, но в группе СТ+ДУПИ+АСИТ данные изменения были более выраженные (см. рис. 4). В группе пациентов с сопутствующим ПРС положительная динамика отмечена только в группе сочетанной терапии дупилумаба и АСИТ (∆SNOT 22 за 52 нед для группы СТ+ДУПИ+АСИТ 48,0±8,01 (p=0,00003); для СТ+АСИТ 7,3±11,6 (p=0,013); для группы СТ против 6,2±10,0 (p=0,012).
Полученные в нашем исследовании результаты согласуются с ранее опубликованными данными предшествующих клинических исследований, в которых эффективность дупилумаба у пациентов с ТБА была определена в улучшении контроля над симптомами БА, улучшении качества жизни и снижении использования сГКС. Так, у пациентов, получавших дупилумаб, было отмечено улучшение контроля БА, повышение качества жизни, а также контроля над сопутствующими заболеваниями, такими как АтД, АР, ПРС.
По данным исследования LIBERTY ASTHMA VENTURE, при терапии дупилумабом у 14% пациентов наблюдалось повышение эозинофилии в периферической крови, которая не сопровождалась дополнительными симптомами и была клинически не значимой [13]. Считается, что временное повышение уровня циркулирующих эозинофилов связано с тем, что дупилумаб ингибирует ИЛ-4/13-индуцированную миграцию эозинофилов из кровотока в ткани. Кроме того, дупилумаб не оказывает влияния на образование эозинофилов в костном мозге, что в целом может приводить к временному повышению их числа в периферической крови.
В большинстве случаев через 3–12 мес уровень эозинофилов возвращался к нормальным значениям. В нашем исследовании у 4 из 10 пациентов, получавших лечение дупилумабом, было зафиксировано повышение уровня эозинофилов периферической крови, при этом максимальный уровень составил 1810 кл/мкл, что носило транзиторный характер и не сопровождалось развитием иных клинических симптомов, соответственно, было нами расценено как клинически незначимое [14].
В остальном, препарат дупилумаб имеет благоприятный профиль безопасности, количество побочных эффектов, по данным клинических исследований, незначительное и, как правило, не отличается от плацебо [13].
На сегодняшний день не существует рекомендаций относительно продолжительности проведения ГИБП, напротив, результаты клинических исследований и пост-маркетинговых наблюдений свидетельствуют о том, что прекращение терапии моноклональными антителами через некоторое время (4–6 мес) приводят к постепенному ухудшению состояния, потере контроля и возращению к исходному уровню до назначения ГИБП [15–17]. При этом высокая стоимость моноклональных антител является поводом поиска новых методов или комбинаций, позволяющих сократить продолжительность и затраты на лечение [18, 19].
АСИТ является болезнь-модифицирующим и единственным патогенетически обоснованным методом лечения аллергических заболеваний, позволяющим уменьшить степень тяжести и снизить потребность в препаратах базисной и симптоматической терапии.
Сочетанное применение ГИБП и АСИТ представляется многообещающим направлением, позволяющим достичь контроля над симптомами у пациентов с тяжелым течением БА, повысить безопасность АСИТ и, благодаря болезнь-модифицирующему эффекту АСИТ, в перспективе отменить терапию ГИБП [20, 21].
Первым препаратом, для которого была оценена возможность сочетанного применения с АСИТ, был омализумаб. В исследованиях J. Kueher в 2002 г., C. Rolinck-Werninghaus в 2004 г., T. Casale в 2006 г. у пациентов с АР добавление омализумаба привело к снижению частоты побочных реакций в ходе проведения АСИТ [22–24].
Аналогичные эффекты омализумаба были описаны в клиническом случае при проведении АСИТ ядом перепончатокрылых [25].
В 2014 г. описан клинический случай применения сочетанного лечения АСИТ и омализумаба у 11-летнего мальчика, страдающего БА в сочетании с АР. Исходно пациент имел более двух тяжелых обострений БА в год. При аллергологическом обследовании была выявлена поливалентная сенсибилизация: к аллергенам клещей домашней пыли, аллергенам пыльцы деревьев и злаковых трав, а также плесневым аллергенам. На фоне подобранной базисной терапии удалось достичь контроля над симптомами БА, и пациенту была инициирована АСИТ подкожным методом с экстрактом клеща (Derp1 50% и Derp2 50%). На начальном этапе иммунотерапии развилась анафилаксия, потребовавшая введения эпинефрина, и АСИТ была прервана. С течением времени состояние пациента ухудшалось, отмечалось снижение показателей ОФВ1. Пациенту был назначен Омализумаб 300 мг 1 раз каждые 4 нед. Через 16 нед отмечено улучшение контроля БА, и еще через 8 нед была вновь инициирована АСИТ. На фоне продолжающейся терапии омализумаба курс АСИТ был проведен до конца без местных и системных реакций [26].
Относительно дупилумаба в мировой литературе нет данных о сочетанном применении АСИТ у пациентов с БА. Имеются ограниченные публикации о комбинированном проведении терапии дупилумаба и АСИТ у пациентов с АР, соответственно, оценивали только контроль над симптомами ринита. В своем исследовании J. Corren и соавт. не отметили положительного влияния в отношении симптомов АР при добавлении дупилумаба к АСИТ. Надо отметить, что пациенты, включенные в протокол, не отличались тяжелым течением ринита. В то же время авторы отметили, что в группе, получавших дупилумаб, пациенты быстрее достигли желаемой дозы и меньше отмечали побочных реакций в ходе проведения АСИТ. Так, у пациентов, получавших комплексное лечение АСИТ и дупилумаб, зарегистрировано меньше нежелательных явлений (7,7%), потребовавших введения адреналина (7,7%), по сравнению с группой получавших только АСИТ (19,2%). Большинство случаев преждевременного исключения из исследования были связаны с выраженными нежелательными явлениями в ходе проведения АСИТ в группе монотерапии. В ходе исследования было зарегистрировано, что дупилумаб в качестве адъюванта к АСИТ приводил к значительному снижению уровня sIgE [10].
В работе M. Kamal также отмечена возможность повышения безопасности АСИТ при дополнительном назначении дупилумаба [27].
В нашем исследовании мы смогли впервые включить в протокол АСИТ ускоренным методом пациентов с ТБА и сопутствующей патологией благодаря предварительному достижению контроля на фоне терапии дупилумабом. Проведение АСИТ на фоне продолжающего введения дупилумаба позволило снизить риски развития побочных реакций и завершить полный курс лечения согласно намеченному протоколу.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Куличенко Дарья Семеновна – мл. науч. сотр., врач-аллерголог отд-ния бронхиальной астмы, ФГБУ «ГНЦ Институт иммунологии» ФМБА России. Е-mail: darya.mdinaradze@yandex.ru; ORCID: 0000-0002-7375-1759
Dariya S. Kulichenko – Junior Research Associate, Asthma Department, National Research Center Institute of Immunology, Federal Medical and Biological Agency of Russia. Е-mail: darya.mdinaradze@yandex.ru; ORCID: 0000-0002-7375-1759
Павлова Ксения Сергеевна – канд. мед. наук, вед. науч. сотр., врач-аллерголог отд-ния бронхиальной астмы, ФГБУ «ГНЦ Институт иммунологии» ФМБА России. Е-mail: ksenimedical@gmail.com; ORCID: 0000-0002-4164-4094
Ksenia S. Pavlova – Cand. Sci. (Med.), National Research Center Institute of Immunology, Federal Medical and Biological Agency of Russia. Е-mail: ksenimedical@gmail.com;
ORCID: 0000-0002-4164-4094
Курбачева Оксана Михайловна – д-р мед. наук, проф., зав. отд-нием бронхиальной астмы, ФГБУ «ГНЦ Институт иммунологии» ФМБА России; доц. каф. клин. аллергологии и иммунологии, ФГБОУ ВО «МГМСУ им. А.И. Евдокимова». E-mail: kurbacheva@gmail.com; ORCID: 0000-0003-3250-0694
Oksana M. Kurbacheva – Dr. Sci. (Med.), Full Prof., Head of the Asthma Department, National Research Center Institute of Immunology, Federal Medical and Biological Agency of Russia; Assoc. Prof., Yevdokimov Moscow State University of Medicine and Dentistry. E-mail: kurbacheva@gmail.com; ORCID: 0000-0003-3250-0694
Ильина Наталья Ивановна – д-р мед. наук, проф., зам. директора по клинической работе, ФГБУ «ГНЦ Институт иммунологии» ФМБА России; проф. каф. клин. аллергологии и иммунологии, ФГБОУ ВО «МГМСУ им. А.И. Евдокимова»; проф. каф. иммунологии, ФГАОУ ВО «РНИМУ им. Н.И. Пирогова». E-mail: instimmun@yandex.ru; ORCID: 0000-0002-3556-969X
Natalia I. Ilina – Dr. Sci. (Med.), Full Prof., Deputy Director for Clinical Affairs, Chief Physician, National Research Center Institute of Immunology, Federal Medical and Biological Agency of Russia; Prof., Yevdokimov Moscow State University of Medicine and Dentistry; Prof., Pirogov Russian National Research Medical University. E-mail: instimmun@yandex.ru; ORCID: 0000-0002-3556-969X
Поступила в редакцию: 01.11.2023
Поступила после рецензирования: 09.11.2023
Принята к публикации: 09.11.2023
Received: 01.11.2023
Revised: 09.11.2023
Accepted: 09.11.2023
Клинический разбор в общей медицине №8 2023
Аллерген-специфическая иммунотерапия в сочетании с иммунобиологической терапией у пациентов, страдающих среднетяжелой и тяжелой бронхиальной астмой
Номера страниц в выпуске:13-23
Аннотация
Обоснование. Аллерген-специфическая иммунотерапия (АСИТ) является единственным патогенетическим методом лечения аллергических заболеваний, позволяющим уменьшить симптомы и снизить потребность в препаратах базисной и симптоматической терапии. Неконтролируемая тяжелая бронхиальная астма (ТБА) является противопоказанием для проведения АСИТ. Назначение генно-инженерных иммунобиологических препаратов (ГИБП) способствует улучшению контроля ТБА, однако их отмена не представляется возможной. Сочетанное применение ГИБП и АСИТ позволяет достичь долгосрочного контроля над симптомами у пациентов с ТБА, повысить безопасность проведения АСИТ, а в перспективе отменить терапию ГИБП.
Цель. Оценить эффективность и безопасность проведения сочетанной терапии дупилумабом и АСИТ у пациентов, страдающих ТБА.
Материалы и методы. В исследовании приняли участие 30 взрослых пациентов с атопической ТБА. Пациенты были рандомизированы на 3 группы: 1-я группа – стандартная терапия (0–52 нед) + дупилумаб (0–16 нед) + АСИТ (12–16 нед); 2-я группа – стандартная терапия без ГИБП (0–52 нед) + АСИТ (12–16 нед); 3-я группа – стандартная терапия без ГИБП, без АСИТ (0–52 нед). В контрольных точках (исходно, через 12, 20 и 52 нед) оценивали контроль БА и сопутствующих заболеваний с помощью опросников (ACQ, AQLQ, TNSS, SNOT-22, DQLQ), функции внешнего дыхания (ОФВ1), количество обострений и нежелательные явления.
Результаты. В результате назначения дупилумаба удалось быстро достичь контроля над ТБА и сопутствующей патологией (12 нед), что позволило успешно провести АСИТ. В 1-й группе контроль симптомов сохранялся после отмены как дупилумаба, так и АСИТ:
ACQ-6 на 52-й неделе – 0,30±0,21 для 1-й группы в сравнении с 1,62±0,51 для второй и 2,76±0,85 для третьей групп (p<0,01 для всех); ОФВ1 на 52-й неделе – 81,47±7,48% для 1-й группы в сравнении с 73,99±6,17% для второй и 65,02±7,23% для третьей (p<0,01). В 1-й группе не было отмечено развития побочных реакций, что позволило полностью завершить курс лечения при АСИТ, в отличие от 2-й группы, где в силу развития системных реакций максимально переносимая доза лечебного аллергена была существенно ниже.
Выводы. Сочетанное лечение дупилумабом и АСИТ позволило быстро достичь контроля БА, уменьшить объем базисной терапии и снизить риски развития системных реакций, при этом контроль над симптомами сохранялся после окончания терапии дупилумабом.
Ключевые слова: бронхиальная астма, атопическая бронхиальная астма, тяжелая бронхиальная астма, таргетная терапия, моноклональные антитела, иммунобиологическая терапия, дупилумаб, аллерген-специфическая иммунотерапия, АСИТ.
Для цитирования: Куличенко Д.С., Павлова К.С., Курбачева О.М., Ильина Н.И. Аллерген-специфическая иммунотерапия в сочетании с иммунобиологической терапией у пациентов, страдающих среднетяжелой и тяжелой бронхиальной астмой. Клинический разбор в общей медицине. 2023; 4 (8): 13–23. DOI: 10.47407/kr2023.4.8.00326
Обоснование. Аллерген-специфическая иммунотерапия (АСИТ) является единственным патогенетическим методом лечения аллергических заболеваний, позволяющим уменьшить симптомы и снизить потребность в препаратах базисной и симптоматической терапии. Неконтролируемая тяжелая бронхиальная астма (ТБА) является противопоказанием для проведения АСИТ. Назначение генно-инженерных иммунобиологических препаратов (ГИБП) способствует улучшению контроля ТБА, однако их отмена не представляется возможной. Сочетанное применение ГИБП и АСИТ позволяет достичь долгосрочного контроля над симптомами у пациентов с ТБА, повысить безопасность проведения АСИТ, а в перспективе отменить терапию ГИБП.
Цель. Оценить эффективность и безопасность проведения сочетанной терапии дупилумабом и АСИТ у пациентов, страдающих ТБА.
Материалы и методы. В исследовании приняли участие 30 взрослых пациентов с атопической ТБА. Пациенты были рандомизированы на 3 группы: 1-я группа – стандартная терапия (0–52 нед) + дупилумаб (0–16 нед) + АСИТ (12–16 нед); 2-я группа – стандартная терапия без ГИБП (0–52 нед) + АСИТ (12–16 нед); 3-я группа – стандартная терапия без ГИБП, без АСИТ (0–52 нед). В контрольных точках (исходно, через 12, 20 и 52 нед) оценивали контроль БА и сопутствующих заболеваний с помощью опросников (ACQ, AQLQ, TNSS, SNOT-22, DQLQ), функции внешнего дыхания (ОФВ1), количество обострений и нежелательные явления.
Результаты. В результате назначения дупилумаба удалось быстро достичь контроля над ТБА и сопутствующей патологией (12 нед), что позволило успешно провести АСИТ. В 1-й группе контроль симптомов сохранялся после отмены как дупилумаба, так и АСИТ:
ACQ-6 на 52-й неделе – 0,30±0,21 для 1-й группы в сравнении с 1,62±0,51 для второй и 2,76±0,85 для третьей групп (p<0,01 для всех); ОФВ1 на 52-й неделе – 81,47±7,48% для 1-й группы в сравнении с 73,99±6,17% для второй и 65,02±7,23% для третьей (p<0,01). В 1-й группе не было отмечено развития побочных реакций, что позволило полностью завершить курс лечения при АСИТ, в отличие от 2-й группы, где в силу развития системных реакций максимально переносимая доза лечебного аллергена была существенно ниже.
Выводы. Сочетанное лечение дупилумабом и АСИТ позволило быстро достичь контроля БА, уменьшить объем базисной терапии и снизить риски развития системных реакций, при этом контроль над симптомами сохранялся после окончания терапии дупилумабом.
Ключевые слова: бронхиальная астма, атопическая бронхиальная астма, тяжелая бронхиальная астма, таргетная терапия, моноклональные антитела, иммунобиологическая терапия, дупилумаб, аллерген-специфическая иммунотерапия, АСИТ.
Для цитирования: Куличенко Д.С., Павлова К.С., Курбачева О.М., Ильина Н.И. Аллерген-специфическая иммунотерапия в сочетании с иммунобиологической терапией у пациентов, страдающих среднетяжелой и тяжелой бронхиальной астмой. Клинический разбор в общей медицине. 2023; 4 (8): 13–23. DOI: 10.47407/kr2023.4.8.00326
Allergy immunotherapy in combination with biological therapy in moderate and severe asthma
Dariya S. Kulichenko1, Ksenia S. Pavlova1, Oksana M. Kurbacheva1,2, Natalia I. Ilina1,2,31 National Research Center Institute of Immunology, Federal Medical and Biological Agency of Russia, Moscow, Russia;
2 Yevdokimov Moscow State University of Medicine and Dentistry, Moscow, Russia;
3 Pirogov Russian National Research Medical University, Moscow, Russia
darya.mdinaradze@yandex.ru
Abstract
Background. Allergen immunotherapy (AIT) is a pathogenetic substantiated method for the allergic disease’s treatment, which allows reducing the symptom severity and decreasing the medication use. Uncontrolled severe asthma is a contraindication for AIT. The appointment of biological therapy helps to improve the asthma control, but their cancellation is impossible. The combined use of the biological therapy and AIT makes it possible to achieve the long-term symptoms control in patients with severe asthma, increase the AIT safety, and probably stop biological therapy.
Aim. To evaluate the efficacy and safety of combination therapy with dupilumab and AIT in patients with severe asthma.
Materials and methods. The study involved 30 adult patients with moderate to atopic severe asthma. Patients was randomized for 3 groups: group 1: standard therapy (0–52 weeks) + dupilumab (0–16 weeks) + AIT (12–16 weeks); group 2: standard therapy without biological therapy (0–52 weeks) + AIT (12–16 weeks); group 3: standard therapy without biological therapy, without AIT (0–52 weeks).
We evaluated the asthma control and comorbidities using questionnaires (ACQ, AQLQ, TNSS, SNOT-22, DQLQ), respiratory function (FEV1), the number of exacerbations and adverse events At control points (initially, after 12, 20 and 52 weeks).
Results. As a result of the appointment of dupilumab it was possible to quickly achieve asthma control and comorbidities (12 wk), which made it possible to successfully conduct AIT. In the first group, symptom control is maintained even after discontinuation of both dupilumab and AIT. ACQ-6 52 wk: 1 group – 0.30±0.21; 2 group – 1.62±0.51; 3 group – 2.76±0.85. FEV1 52 wk: group 1 – 81.47±7.48%; group 2 – 73.99±6.17%; group 3 – 65.02±7.23% for 3 group (р<0.01). In the first group, there weren’t adverse events that allowed complete AIT successfully, unlike for the second group, where, maximum tolerated allergen dose was lower due to development of systemic reactions.
Conclusion. Combined treatment with dupilumab and AIT allows to quickly achieve a control, decrease a background therapy and adverse events during the AIT. The control of asthma symptoms and the effect of AIT were maintained even after the end of dupilumab therapy.
Key words: asthma, atopic asthma, severe asthma, targeted therapy, monoclonal antibodies, biologicals, dupilumab, allergy immunotherapy.
For citation: Kulichenko D.S., Pavlova K.S., Kurbacheva O.M., Ilina N.I. Allergy immunotherapy in combination with biological therapy in moderate and severe asthma. Clinical review for general practice. 2023; 4 (8): 13–23 (In Russ.). DOI: 10.47407/kr2023.4.8.00326
Введение
Бронхиальная астма (БА) – распространенное хроническое заболевание легких, характеризующееся наличием респираторных симптомов, таких как свистящие хрипы, одышка, заложенность в груди и кашель, которые варьируют по времени и интенсивности, и проявляются вместе с вариабельной обструкцией дыхательных путей. БА является серьезной медико-социальной проблемой, связанной с высоким уровнем инвалидизации, смертности и заболеваемости населения [1].На сегодняшний день с помощью назначения стандартной фармакотерапии БА, основой которой, согласно Федеральным клиническим рекомендациям, являются комбинированные препараты, содержащие ингаляционные глюкокортикостероиды и длительно действующие ß2-агонисты (ИГКС+ДДБА), удается достигать полного или хотя бы частичного контроля над симптомами БА у большинства пациентов [1, 2]. При этом, несмотря на регулярное применение ИГКС и других противоастматических препаратов, у части пациентов со среднетяжелым и тяжелым течением БА все же не удается достичь полного контроля над симптомами заболевания, что приводит к обострениям и необходимости назначения системных глюкокортикостероидов (сГКС) короткими курсами или в качестве постоянной терапии.
Тяжелая БА (ТБА) – это БА, которая требует лечения, соответствующего ступеням IV–V терапии по GINA (Global Initiative for Asthma – Глобальная инициатива по бронхиальной астме), – высокие дозы ИГКС в комбинации с ДДБА и/или антагонистами лейкотриеновых рецепторов, и/или длительно-действующими холинолитиками, применения сГКС в течение 6 мес и более за последний год, что необходимо для достижения и сохранения контроля, или БА, которая остается неконтролируемой, несмотря на эту терапию [1, 2].
Хотя к категории неконтролируемой ТБА относится менее 5% от числа всех пациентов с БА, именно на них приходится 50% экономических затрат, предназначенных на заболевание в целом [3]. Тяжелые обострения требуют стационарного лечения, нередко с использованием реанимационных подразделений, а для лечения любого обострения применяются сГКС, обладающие выраженными побочными действиями. В конечном итоге терапия, приводящая к снижению количества
обострений БА, является мерой, сберегающей ресурсы здравоохранения и сокращающей количество дней нетрудоспособности [4].
Последние десятилетия были посвящены открытиям и изучениям биологических эффектов моноклональных антител, которые претерпели огромную трансформацию из объектов для научных исследований в одни из самых современных и эффективных средств лечения пациентов c различной патологией. Продолжаются исследования по изучению эффективности и безопасности новых иммунобиологических препаратов, а также ранее известных генно-инженерных биологических препаратов (ГИБП) с целью расширения спектра показаний. В общей сложности шесть моноклональных антител в настоящее время одобрены для лечения ТБА: омализумаб, меполизумаб, реслизумаб, бенрализумаб, тезепелумаб и дупилумаб. Эти препараты продемонстрировали эффективность в лечении ТБА с улучшением функции легких, снижением частоты обострений и уменьшением пероральной дозы ГКС у лиц разных возрастных групп. Проблемой применения ГИБП остается высокая стоимость и необходимость долгосрочного лечения (нет данных о сроках проведения и возможности отмены данной терапии) [5–7].
Атопическая (аллергическая) БА является превалирующим фенотипом как среди пациентов с легкой, так и с тяжелой БА. Аллерген-специфическая иммунотерапия (АСИТ) представляет собой основной патогенетический вид терапии атопических заболеваний, обладает уникальным болезнь-модифицирующим эффектом – позволяет предотвратить развитие БА у пациентов с аллергическим ринитом (АР), уменьшить выраженность симптомов БА и снизить объем фармакологической терапии. Уникальность АСИТ также состоит в сохранении долгосрочного эффекта даже после завершения курса терапии. Обязательным условием для начала проведения АСИТ, согласно клиническим рекомендациям, является достижение полного контроля над симптомами БА, что возможно с использованием любых фармакологических средств, соответствующих IV–V ступени по GINA, кроме сГКС. Таким образом, тяжелая и неконтролируемая БА является противопоказанием для проведения АСИТ [8].
Сочетанное применение моноклональных антител и АСИТ представляет собой одно из перспективных терапевтических направлений. В первую очередь, такие исследования проводились с применением омализумаба, и показали синергичность положительного влияния омализумаба и АСИТ на течение БА [9]. В мировой литературе существуют единичные публикации о сочетанном применении дупилумаба и АСИТ при лечении пациентов с АР, но отсутствуют данные о применении данной схемы лечения у пациентов с БА [10]. Таким образом, на сегодняшний день в мировой литературе представлено ограниченное количество исследований, посвященных изучению сочетанного применения ГИБП и АСИТ, а также проведения АСИТ у пациентов с ТБА.
Цель – оценить эффективность и безопасность проведения сочетанной терапии дупилумабом и АСИТ у взрослых пациентов, страдающих среднетяжелой и тяжелой атопической БА.
Материалы и методы
Данное исследование являлось проспективным одноцентровым открытым наблюдательным сравнительным в параллельных группах.Исследование проводилось на базе отделения «Бронхиальной астмы» клиники ФГБУ «ГНЦ Институт иммунологии» ФМБА России. Протокол настоящего исследования был одобрен Комитетом по этике ФГБУ «ГНЦ Институт иммунологии» ФМБА России (протокол №11 от 25.11.2019). Участие в исследовании являлось добровольным, где набор пациентов проводился как на амбулаторном приеме, так и в условиях стационара. В соответствии с Хельсинской декларацией до включения в исследование пациенты давали свое устное и письменное согласие на участие (форма информации для больного и информированного согласия).
Формирование групп осуществлялось на основании разработанных критериев включения/невключения. Критерии предварительно были разработаны с учетом нормативной документации.
В исследовании приняли участие 30 пациентов, соответствующих критериям включения и не имевших критериев невключения (табл. 1), не достигших контроля над симптомами БА на фоне базисной терапии в соответствии с IV–V ступенями GINA [2].

После подписания информированного согласия на участие в исследовании всем добровольцам проводилось скрининговое обследование.
В рамках первого визита всем пациентам проводилась оценка параметров клинико-лабораторного обследования (клинический анализ крови с определением лейкоцитарной формулы, определение уровня общего IgE в сыворотке крови), аллергологического обследования (определение специфических IgE к респираторным аллергенам в сыворотке крови, Phadia ImmunoCAP, постановка кожных тестов с водно-солевыми экстрактами аллергенов), результатов опросника ACQ-6, исследования функции внешнего дыхания.
После оценки результатов обследования и при соответствии критериям включения/невключения пациенты были случайным образом рандомизированы в 3 группы по 10 добровольцев в каждой группе. Все участники исследования в течение всего периода наблюдения получали стандартную терапию в соответствии с тяжестью течения БА (IV–V ступенями GINA).
Группа 1 (СТ+АСИТ+ДУПИ): пациентам в течение 3 мес проведен короткий курс иммунобиологической терапии дупилумабом в соответствии с инструкцией, при достижении контроля БА был инициирован курс АСИТ водно-солевыми экстрактами причинно-значимых аллергенов ускоренным методом.
Группа 2 (СТ+АСИТ): в случае достижения контроля с помощью стандартной терапии (IV–V ступень GINA) без проведения иммунобиологической терапии, пациентам проведен курс АСИТ водно-солевыми экстрактами причинно-значимых аллергенов ускоренным методом.
Группа 3 (СТ): достижение контроля осуществлялось с помощью стандартной терапии (IV–V ступень GINA) без проведения иммунобиологической терапии и без проведения курса АСИТ (рис. 1).

Процедуры исследования:
1) скрининг (2 нед);
2) первый лечебный период (12 нед, от 2 нед до 14 нед);
3) второй лечебный период (2 нед, от 14 нед до 16 нед);
4) период последующего наблюдения (24 нед, от 16 нед до 52 нед).
На этапе скрининга со всеми пациентами проводилась работа над исключением ошибок техники использования ингаляционных устройств, над улучшением комплаенса, рассматривалась необходимость увеличения объема или изменения базисной терапии.
Первый лечебный период для пациентов 1-й группы (СТ+АСИТ+ДУПИ) (V1–V6) продолжался 12 нед, в течение которых каждый пациент получил 6 инъекций дупилумаба в соответствии с инструкцией (300 мг п/к каждые 2 нед) [11]. Во время второго лечебного периода для пациентов 1-й группы (V7–V21) был проведен курс АСИТ водно-солевыми экстрактами причинно-значимых аллергенов ускоренным методом с продолжающимся введением дупилумаба с интервалом 1 раз
в 2 нед. При проведении АСИТ водно-солевыми экстрактами ускоренным методом начальная доза аллергена – 10-6×0,2 мл, что соответствует 0,002 PNU (единиц белкового азота), конечная доза аллергена – 10-1×1,0 мл, что соответствует 1000 PNU. Пациенты получали инъекции аллергенов 2–3 раза в день с интервалом в 2 ч [12].
С учетом индивидуальной переносимости лечения кратность инъекций может быть сокращена до 1 в день или 1 через день с продолжающимся введением дупилумаба с интервалом 1 раз в 2 нед. В ходе визитов периода последующего наблюдения (через 2 нед после окончания терапии – V22, через 10±2 нед после окончания терапии (V23) и через 52±2 нед после окончания терапии V24) проводилась оценка контроля БА и необходимость коррекции базисной терапии.
В первый лечебный период для пациентов 2-й группы была скорректирована стандартная базисная терапия. В случае достижения контроля над симптомами БА пациентам из группы сравнения (СТ+АСИТ) проведен курс АСИТ водно-солевыми экстрактами аллергенов ускоренным методом без применения иммунобиологической терапии (по указанной выше методике) с периодом последующего наблюдения (через 2 нед после окончания терапии, через 10±2 нед после окончания терапии и через 52±2 нед после окончания терапии).
Пациенты 3-й группы получали лечение в соответствии с IV–V ступенью по GINA, исключая АСИТ и ГИБП.
Критерии оценки эффективности лечения. Критериями оценки достижения и поддержания контроля явилась динамика результатов, полученных с помощью субъективных (заполнения опросников Asthma Control Questionary-6, ACQ-6 и Asthma Questionary Quality of Life, AQLQ) и объективных методов (физикальный осмотр, включая аускультацию, исследование функции внешнего дыхания); оценка объема фармакологической нагрузки (возможность уменьшения объема базисной терапии при достижении контроля или, наоборот, необходимость назначения дополнительных препаратов), количество обострений БА, использование ресурсов здравоохранения в начале исследования и в контрольных точках.
Оценка обострений БА за наблюдаемый период. Обострение БА определялось как ухудшение астмы, характеризующееся усилением симптомов, ухудшением показателей внешнего дыхания, увеличением потребности использования ингаляционных бронхолитиков быстрого действия, признаков тахипноэ и тахикардии, снижения насыщения крови кислородом и необходимостью назначения сГКС не менее трех дней подряд или не менее чем двукратное повышение объема сГКС терапии для пациентов, исходно находившихся на оральных кортикостероидах.
Оценка влияния сопутствующих заболеваний на качество жизни. Для оценки динамики изменения качества жизни и выраженности симптомов сопутствующих заболеваний пациенты заполняли опросники, разработанные в соответствии с нозологической формой заболевания. Опросник Total Nasal Symptom Score (TNSS) – для пациентов с АР, опросник Sino-Nasal Outcome Test-22 (SNOT-22) – для пациентов, страдающих полипозным риносинуситом (ПРС), опросник для оценки индекса качества жизни у пациентов с дерматитом Dermatology Life Quality Index (DLQI) – у пациентов с сопутствующим атопическим дерматитом (АтД).
Оценка нежелательных явлений. За нежелательное явление принималось любое неблагоприятное изменение в состоянии здоровья пациента, развившееся в ходе исследования с момента подписания информированного согласия, независимо от причинно-следственной связи (с оценкой вероятности связи нежелательного явления с диагностическими и лечебными процедурами исследования).
Статистическая обработка полученных данных. Статистический анализ фактических данных проводили при помощи пакета статистических программ Graphpad prism 9.0. Данные приводили в виде «среднее арифметическое» ± «стандартное отклонение» [M±σ].
Сравнение независимых групп проводилось с помощью H-критерия Краскела–Уоллиса для оценки значимой межгрупповой изменчивости более чем в двух группах, а дальнейшее сравнение между группами проводилось с помощью U-критерия Манна–Уитни, различия считались статистически значимыми при p≤0,05.
Результаты
В исследовании приняли участие 30 взрослых пациентов мужского и женского пола в возрасте от 19 до 60 лет (средний возраст составил 41,1±11,5 года), с анамнезом атопической БА среднетяжелого и тяжелого течения (IV–V стадия GINA) продолжительностью не менее 2 лет (в среднем продолжительность анамнеза заболевания составила 21,4±8,02 года), получавших высокие дозы ГКС в комбинации с ДДБА в качестве базисной терапии, при этом характеризующихся отсутствием или неполным контролем над симптомами астмы: ACQ-6 – 3,03 [2,4; 4,2] балла, объем форсированного выдоха за 1 с (ОФВ1) – 57,5 [45,2; 67,8]% от должных величин; не менее двух обострений астмы за прошедший год, потребовавших применения сГКС курсами более трех дней. Все они имели сопутствующие заболевания: 30 человек (100%) – АР, 15 человек (50%) – ПРС, 19 человек (63,3%) – АтД.Для выявления сенсибилизации всем пациентам было проведено аллергологическое обследование, включая кожное тестирование и определение специфических IgE (sIgE), где значимым считалось повышение уровня IgE>0,7 кМЕ/л (2-й класс реакции). В структуре сенсибилизации превалировала повышенная чувствительность к аллергенам домашней пыли (выявлена у всех 30 пациентов) у 15 человек – к аллергенам клещей домашней пыли (Dermatophagoides pteronyssinus, Dermatophagoides farinae), у 13 пациентов – к аллергенам пыльцы березы, у 16 пациентов – к эпидермальным аллергенам, у 10 пациентов – к аллергенам пыльцы злаковых трав, у 8 человек – к аллергенам пыльцы сорных трав. Клинически значимой сенсибилизацией считали наличие клинических проявлений (обострений основного заболевания), соответствующих выявленной при аллергологическом обследовании.
Пациенты были рандомизированы в 3 группы, в двух группах, согласно протоколу исследования, был проведен курс АСИТ водно-солевыми экстрактами причинно-значимыми аллергенами ускоренным методом (табл. 2).
В качестве базисной терапии все пациенты получали высокие или средние дозы иГКС в комбинации с ДДБА, 23 пациента дополнительно получали антагонист лейкотриеновых рецепторов (монтелукаст), 15 – длительно действующий М-холинолитик (тиотропия бромид).

Оценка эффективности терапии
На этапе скрининга со всеми пациентами проводилась работа над исключением ошибок техники использования ингаляторов, над улучшением комплаенса, рассматривалась необходимость увеличения объема базисной терапии (добавление препаратов с целью максимального достижения контроля). В результате проведенной работы с пациентами и усиления врачебного контроля над приверженностью к терапии у всех пациентов через 12 нед в той или иной степени было отмечено улучшение контроля над симптомами БА.В группе СТ+ДУПИ+АСИТ повышение контроля было достигнуто за более короткие сроки, чем в других группах [ACQ-6: для группы СТ+ДУПИ+АСИТ исходно 3,20±0,79, через 12 нед 0,73±0,63 (p=0,001); для СТ+АСИТ исходно 2,87±0,70, через 12 нед 1,20±0,97 (p=0,01); для группы СТ исходно 3,04±0,79, через 12 нед 1,49±0,78 (p=0,001)].
Достижение контроля БА к 12-й неделе от включения в исследование позволило инициировать АСИТ в группах СТ+ДУПИ+АСИТ и СТ+АСИТ. В 1-й группе (СТ+ДУПИ+АСИТ) хороший контроль после завершения АСИТ сохранялся и после окончания лечения, и в период последующего наблюдения в течение 52 нед (ACQ-6: на 52-й неделе для группы СТ+ДУПИ+АСИТ 0,30±0,21; против 1,67±0,51 для СТ [p=0,05], рис. 2).
У пациентов из второй группы, которые получали АСИТ без терапии дупилумабом, некоторое время наблюдалось сохранение контроля, но потом появилась тенденция к его уменьшению (ACQ-6: исходно 2,87±0,7, через 12 нед 1,2±0,97 [p=0,002], через 20 нед 1,13±0,55 [p=0,256], через 52 нед 1,62±0,51 [p=0,105]).
Оценка обострений БА за наблюдаемый период
Оценка обострений БА является важным критерием в оценке эффективности терапии у пациентов со среднетяжелой и тяжелой БА. Для наших пациентов критерием включения в исследование являлось наличие двух и более обострений в течение 12 предшествующих месяцев, потребовавших применения сГКС. На фоне терапии в течение 52 нед нашего исследования мы отметили существенное снижение частоты обострений, в первую очередь для пациентов, получавших сочетанное лечение дупилумабом и АСИТ. Сохранение контроля у пациентов, которые находились только на стандартной терапии, было недолгосрочным, что привело к обострениям БА, потребовавших применения сГКС (табл. 3).При оценке качества жизни, связанного с БА, в группе СТ+АСИТ+ДУПИ было выявлено существенное улучшение качества жизни уже через 12 нед, которое сохранялось на протяжении всего периода наблюдения (∆ AQLQ за 12 нед: шкала симптомов 2,79±0,55 [p=0,003]; шкала активности 3,42±0,34 [p=0,0001]; шкала эмоциональной составляющей 2,74±0,76 [p=0,002]; шкала влияния окружающей среды 3,45±0,70 [p=0,0001]). При этом не было получено статистически достоверных различий при оценке качества жизни, связанного с БА, в двух других группах (рис. 3).

 Поскольку дупилумаб обладает универсальным действием и, кроме лечения БА, имеет показание к назначению при ПРС и АтД, ожидаемо, что терапия дупилумабом может улучшить контроль данной сопутствующей патологии у пациентов 1-й группы (рис. 4). В нашем исследовании мы отметили улучшение течения АтД: ∆DLQI за 52 нед для группы СТ+ДУПИ+АСИТ составила 16,0±1,25 (p=0,001); для СТ+АСИТ 6,8±1,67 (p=0,02); для группы СТ против 0,28±1,35 (p=0,135). АСИТ положительно образом влияла на назальные симптомы у пациентов с сопутствующим АР, но в группе СТ+ДУПИ+АСИТ данные изменения были более выраженные (см. рис. 4). В группе пациентов с сопутствующим ПРС положительная динамика отмечена только в группе сочетанной терапии дупилумаба и АСИТ (∆SNOT 22 за 52 нед для группы СТ+ДУПИ+АСИТ 48,0±8,01 (p=0,00003); для СТ+АСИТ 7,3±11,6 (p=0,013); для группы СТ против 6,2±10,0 (p=0,012).
Поскольку дупилумаб обладает универсальным действием и, кроме лечения БА, имеет показание к назначению при ПРС и АтД, ожидаемо, что терапия дупилумабом может улучшить контроль данной сопутствующей патологии у пациентов 1-й группы (рис. 4). В нашем исследовании мы отметили улучшение течения АтД: ∆DLQI за 52 нед для группы СТ+ДУПИ+АСИТ составила 16,0±1,25 (p=0,001); для СТ+АСИТ 6,8±1,67 (p=0,02); для группы СТ против 0,28±1,35 (p=0,135). АСИТ положительно образом влияла на назальные симптомы у пациентов с сопутствующим АР, но в группе СТ+ДУПИ+АСИТ данные изменения были более выраженные (см. рис. 4). В группе пациентов с сопутствующим ПРС положительная динамика отмечена только в группе сочетанной терапии дупилумаба и АСИТ (∆SNOT 22 за 52 нед для группы СТ+ДУПИ+АСИТ 48,0±8,01 (p=0,00003); для СТ+АСИТ 7,3±11,6 (p=0,013); для группы СТ против 6,2±10,0 (p=0,012).Оценка безопасности терапии
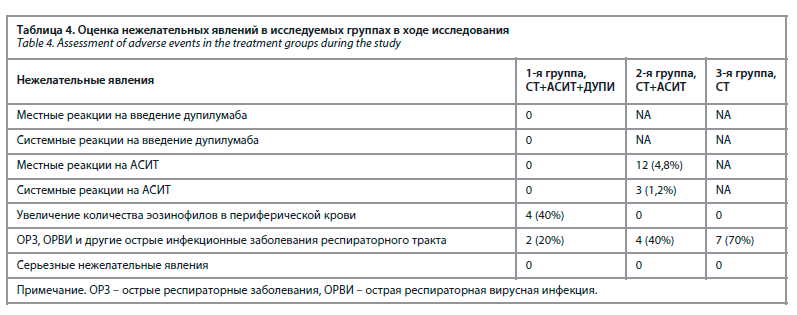
В процессе проведения нашего клинического исследования мы не зарегистрировали серьезных нежелательных явлений ни в одной группе. Мы разделяли нежелательные явления на общие (были характерны для всех трех групп) и специфичные (там, где проводилась АСИТ или дупилумаб). В ходе исследования не было отмечено никаких побочных реакций на введение дупилумаба. Увеличение количества эозинофилов периферической крови у пациентов, получавших лечение дупилумабом, выявлено у 4 пациентов, что было расценено нами как клинически незначимое (не сопровождалось клиническим ухудшением, являлось ожидаемым и описано в инструкции к препарату, что не потребовало отмены дупилумаба или корректировки дозы). Проведение АСИТ в группе, которая получала дупилумаб, характеризовалось благоприятным течением, не сопровождалось развитием местных и системных реакций на введение лечебного аллергена, что нельзя сказать про группу АСИТ без дупилумаба, где проведение терапии сопровождалось местными и даже выраженными системными реакциями (бронхоспазм, крапивница, заложенность носа), потребовавшими досрочного окончания курса АСИТ. Респираторные заболевания в течение исследования чаще регистрировались у пациентов группы стандартной терапии. Это косвенно подтверждает гипотезу о том, что при достижении контроля над симптомами БА пациенты менее подвержены интеркуррентным инфекционным заболеваниям (табл. 4).
Обсуждение
Назначение биологической терапии и точный выбор препарата, влияющего на два ключевых цитокина (интерлейкин-4 и интерлейкин-13) Т2-воспаления при БА, АтД, ПРС, позволяют добиться контроля над симптомами данных заболеваний, что приводит к сокращению количества используемых лекарственных препаратов базисной терапии, снижении числа обострений, а следовательно, уменьшению потребности в сГКС [13].Полученные в нашем исследовании результаты согласуются с ранее опубликованными данными предшествующих клинических исследований, в которых эффективность дупилумаба у пациентов с ТБА была определена в улучшении контроля над симптомами БА, улучшении качества жизни и снижении использования сГКС. Так, у пациентов, получавших дупилумаб, было отмечено улучшение контроля БА, повышение качества жизни, а также контроля над сопутствующими заболеваниями, такими как АтД, АР, ПРС.
По данным исследования LIBERTY ASTHMA VENTURE, при терапии дупилумабом у 14% пациентов наблюдалось повышение эозинофилии в периферической крови, которая не сопровождалась дополнительными симптомами и была клинически не значимой [13]. Считается, что временное повышение уровня циркулирующих эозинофилов связано с тем, что дупилумаб ингибирует ИЛ-4/13-индуцированную миграцию эозинофилов из кровотока в ткани. Кроме того, дупилумаб не оказывает влияния на образование эозинофилов в костном мозге, что в целом может приводить к временному повышению их числа в периферической крови.
В большинстве случаев через 3–12 мес уровень эозинофилов возвращался к нормальным значениям. В нашем исследовании у 4 из 10 пациентов, получавших лечение дупилумабом, было зафиксировано повышение уровня эозинофилов периферической крови, при этом максимальный уровень составил 1810 кл/мкл, что носило транзиторный характер и не сопровождалось развитием иных клинических симптомов, соответственно, было нами расценено как клинически незначимое [14].
В остальном, препарат дупилумаб имеет благоприятный профиль безопасности, количество побочных эффектов, по данным клинических исследований, незначительное и, как правило, не отличается от плацебо [13].
На сегодняшний день не существует рекомендаций относительно продолжительности проведения ГИБП, напротив, результаты клинических исследований и пост-маркетинговых наблюдений свидетельствуют о том, что прекращение терапии моноклональными антителами через некоторое время (4–6 мес) приводят к постепенному ухудшению состояния, потере контроля и возращению к исходному уровню до назначения ГИБП [15–17]. При этом высокая стоимость моноклональных антител является поводом поиска новых методов или комбинаций, позволяющих сократить продолжительность и затраты на лечение [18, 19].
АСИТ является болезнь-модифицирующим и единственным патогенетически обоснованным методом лечения аллергических заболеваний, позволяющим уменьшить степень тяжести и снизить потребность в препаратах базисной и симптоматической терапии.
Сочетанное применение ГИБП и АСИТ представляется многообещающим направлением, позволяющим достичь контроля над симптомами у пациентов с тяжелым течением БА, повысить безопасность АСИТ и, благодаря болезнь-модифицирующему эффекту АСИТ, в перспективе отменить терапию ГИБП [20, 21].
Первым препаратом, для которого была оценена возможность сочетанного применения с АСИТ, был омализумаб. В исследованиях J. Kueher в 2002 г., C. Rolinck-Werninghaus в 2004 г., T. Casale в 2006 г. у пациентов с АР добавление омализумаба привело к снижению частоты побочных реакций в ходе проведения АСИТ [22–24].
Аналогичные эффекты омализумаба были описаны в клиническом случае при проведении АСИТ ядом перепончатокрылых [25].
В 2014 г. описан клинический случай применения сочетанного лечения АСИТ и омализумаба у 11-летнего мальчика, страдающего БА в сочетании с АР. Исходно пациент имел более двух тяжелых обострений БА в год. При аллергологическом обследовании была выявлена поливалентная сенсибилизация: к аллергенам клещей домашней пыли, аллергенам пыльцы деревьев и злаковых трав, а также плесневым аллергенам. На фоне подобранной базисной терапии удалось достичь контроля над симптомами БА, и пациенту была инициирована АСИТ подкожным методом с экстрактом клеща (Derp1 50% и Derp2 50%). На начальном этапе иммунотерапии развилась анафилаксия, потребовавшая введения эпинефрина, и АСИТ была прервана. С течением времени состояние пациента ухудшалось, отмечалось снижение показателей ОФВ1. Пациенту был назначен Омализумаб 300 мг 1 раз каждые 4 нед. Через 16 нед отмечено улучшение контроля БА, и еще через 8 нед была вновь инициирована АСИТ. На фоне продолжающейся терапии омализумаба курс АСИТ был проведен до конца без местных и системных реакций [26].
Относительно дупилумаба в мировой литературе нет данных о сочетанном применении АСИТ у пациентов с БА. Имеются ограниченные публикации о комбинированном проведении терапии дупилумаба и АСИТ у пациентов с АР, соответственно, оценивали только контроль над симптомами ринита. В своем исследовании J. Corren и соавт. не отметили положительного влияния в отношении симптомов АР при добавлении дупилумаба к АСИТ. Надо отметить, что пациенты, включенные в протокол, не отличались тяжелым течением ринита. В то же время авторы отметили, что в группе, получавших дупилумаб, пациенты быстрее достигли желаемой дозы и меньше отмечали побочных реакций в ходе проведения АСИТ. Так, у пациентов, получавших комплексное лечение АСИТ и дупилумаб, зарегистрировано меньше нежелательных явлений (7,7%), потребовавших введения адреналина (7,7%), по сравнению с группой получавших только АСИТ (19,2%). Большинство случаев преждевременного исключения из исследования были связаны с выраженными нежелательными явлениями в ходе проведения АСИТ в группе монотерапии. В ходе исследования было зарегистрировано, что дупилумаб в качестве адъюванта к АСИТ приводил к значительному снижению уровня sIgE [10].
В работе M. Kamal также отмечена возможность повышения безопасности АСИТ при дополнительном назначении дупилумаба [27].
В нашем исследовании мы смогли впервые включить в протокол АСИТ ускоренным методом пациентов с ТБА и сопутствующей патологией благодаря предварительному достижению контроля на фоне терапии дупилумабом. Проведение АСИТ на фоне продолжающего введения дупилумаба позволило снизить риски развития побочных реакций и завершить полный курс лечения согласно намеченному протоколу.
Заключение
В результате проведенного открытого наблюдательного проспективного исследования сочетанного применения иммунобиологического препарата дупилумаб и АСИТ у пациентов со среднетяжелой и тяжелой атопической БА было показано, что у пациентов назначение дупилумаба способствовало более выраженному и быстрому снижению частоты дневных и ночных приступов, уменьшению потребности в препаратах симптоматической терапии, улучшению легочной функции, а последующее проведение АСИТ позволило сохранить контроль над симптомами БА при отмене ГИБП. Назначение дупилумаба позволило также достичь контроля над сопутствующими заболеваниями (АР, АтД, ПРС), что положительным образом повлияло на переносимость курса АСИТ. В группе пациентов, получавших дупилумаб, в ходе проведения АСИТ не было отмечено развития побочных реакций, что позволило завершить курс лечения, согласно протоколу (в отличие от группы сравнения, где в силу развития системных реакций максимально переносимая доза лечебного аллергена была существенно ниже).Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Куличенко Дарья Семеновна – мл. науч. сотр., врач-аллерголог отд-ния бронхиальной астмы, ФГБУ «ГНЦ Институт иммунологии» ФМБА России. Е-mail: darya.mdinaradze@yandex.ru; ORCID: 0000-0002-7375-1759
Dariya S. Kulichenko – Junior Research Associate, Asthma Department, National Research Center Institute of Immunology, Federal Medical and Biological Agency of Russia. Е-mail: darya.mdinaradze@yandex.ru; ORCID: 0000-0002-7375-1759
Павлова Ксения Сергеевна – канд. мед. наук, вед. науч. сотр., врач-аллерголог отд-ния бронхиальной астмы, ФГБУ «ГНЦ Институт иммунологии» ФМБА России. Е-mail: ksenimedical@gmail.com; ORCID: 0000-0002-4164-4094
Ksenia S. Pavlova – Cand. Sci. (Med.), National Research Center Institute of Immunology, Federal Medical and Biological Agency of Russia. Е-mail: ksenimedical@gmail.com;
ORCID: 0000-0002-4164-4094
Курбачева Оксана Михайловна – д-р мед. наук, проф., зав. отд-нием бронхиальной астмы, ФГБУ «ГНЦ Институт иммунологии» ФМБА России; доц. каф. клин. аллергологии и иммунологии, ФГБОУ ВО «МГМСУ им. А.И. Евдокимова». E-mail: kurbacheva@gmail.com; ORCID: 0000-0003-3250-0694
Oksana M. Kurbacheva – Dr. Sci. (Med.), Full Prof., Head of the Asthma Department, National Research Center Institute of Immunology, Federal Medical and Biological Agency of Russia; Assoc. Prof., Yevdokimov Moscow State University of Medicine and Dentistry. E-mail: kurbacheva@gmail.com; ORCID: 0000-0003-3250-0694
Ильина Наталья Ивановна – д-р мед. наук, проф., зам. директора по клинической работе, ФГБУ «ГНЦ Институт иммунологии» ФМБА России; проф. каф. клин. аллергологии и иммунологии, ФГБОУ ВО «МГМСУ им. А.И. Евдокимова»; проф. каф. иммунологии, ФГАОУ ВО «РНИМУ им. Н.И. Пирогова». E-mail: instimmun@yandex.ru; ORCID: 0000-0002-3556-969X
Natalia I. Ilina – Dr. Sci. (Med.), Full Prof., Deputy Director for Clinical Affairs, Chief Physician, National Research Center Institute of Immunology, Federal Medical and Biological Agency of Russia; Prof., Yevdokimov Moscow State University of Medicine and Dentistry; Prof., Pirogov Russian National Research Medical University. E-mail: instimmun@yandex.ru; ORCID: 0000-0002-3556-969X
Поступила в редакцию: 01.11.2023
Поступила после рецензирования: 09.11.2023
Принята к публикации: 09.11.2023
Received: 01.11.2023
Revised: 09.11.2023
Accepted: 09.11.2023
Список исп. литературыСкрыть список1. Федеральные клинические рекомендации по диагностике и лечению бронхиальной астмы. Российское респираторное общество. Российская ассоциация аллергологов и клинических иммунологов. Союз педиатров России. М., 2021.
Federal clinical guidelines for the diagnosis and treatment of bronchial asthma. Russian respiratory society. Russian Association of Allergists and Clinical Immunologists. Union of Pediatricians of Russia. Moscow, 2021. URL: https: //cr.minzdrav.gov.ru/recomend/359
2. Global Initiative for Asthma (GINA Report). Global Strategy for Asthma Management and Prevention. 2021. URL: https: //ginasthma.org/ gina-reports/
3. Федеральная служба государственной статистики. Здравоохранение. URL: https: //rosstat.gov.ru/folder/13721
Federal State Statistics Service. Healthcare. URL: https: //rosstat.gov.ru/ folder/13721
4. Авдеев С.Н., Ненашева Н.М., Жуденков К.В. и др. Распространенность, заболеваемость, фенотипы и другие характеристики тяжелой бронхиальной астмы в Российской Федерации. Пульмонология. 2018; 28 (3): 341–58.
Avdeev SN, Nenasheva NM, Zhudenkov KV et al. Prevalence, morbidity, phenotypes and other characteristics of severe bronchial asthma in Russian Federation. Pulmonologiya. 2018; 28 (3): 341–58. DOI: 10.18093/0869-0189-2018-28-3-341-358
5. Agache I, Beltran J, Akdis C et al. Efficacy and safety of treatment with biologicals (benralizumab, dupilumab, mepolizumab, omalizumab and reslizumab) for severe eosinophilic asthma: A systematic review for the EAACI Guidelines – recommendations on the use of biologicals in severe asthma. Allergy. 2020; 75 (5): 1023–42. DOI: 10.1111/all.14221
6. Kroes JA, Zielhuis SW, van Roon EN et al. Prediction of response to biological treatment with monoclonal antibodies in severe asthma. Biochem Pharmacol. 2020; 179: 113978. DOI: 10.1016/j.bcp. 2020.113978
7. Ненашева Н.М. Биологическая терапия тяжелой астмы: новые цели и новые возможности лечения. Медицинский совет. 2019; (15): 50–61.
Nenasheva NM. Biological treatment of severe asthma: new objectives and new treatment options. Meditsinskiy sovet = Medical Council. 2019; (15): 50–61. DOI: 10.21518/2079-701X-2019-15-50-61.
8. Тимошенко Д.О., Павлова К.С., Курбачева О.М. Аллергенспецифическая иммунотерапия и доказательства реальной клинической практики. Российский аллергологический журнал. 2022; 19 (2): 190–200.
Timoshenko D, Pavlova K, Kurbacheva O. Allergen-specific immunotherapy and real-world evidence. Rus J Allergy. 2022; 19 (2): 190–200. DOI: 10.36691/RJA1535
9. Massanari M, Nelson H, Casale T et al. Effect of pretreatment with omalizumab on the tolerability of specific immunotherapy in allergic asthma. J Allergy Clin Immunol. 2010; 125 (2): 383–9. DOI: 10.1016/j.jaci.2009.11.022
10. Corren J, Saini SS, Gagnon R et al. Short-Term Subcutaneous Allergy Immunotherapy and Dupilumab are Well Tolerated in Allergic Rhinitis: A Randomized Trial. J Asthma Allergy. 2021; 14: 1045–63. DOI: 10.2147/JAA.S318892
11. Инструкция к препарату Дупилумаб. Государственный реестр лекарственных средств.
Instructions for the drug Dupilumab. State register of medicines. URL: https: //grls.minzdrav.gov.ru/Grls_View_v2.aspx?routingGuid=3 c183489-6429-4a85-8bbc-1bd642e3874a
12. Порошина Ю.А., Полсачева О.В., Передкова Е.В. Ускоренный метод специфической иммунотерапии поллинозов (Методические рекомендации). М., 1988.
Poroshina YA, Polsacheva OV, Peredkova EV. Accelerated method of specific immunotherapy for hay fever (Methodological recommendations). Moscow, 1988.
13. Rabe KF, Nair P, Brusselle G et al. Efficacy and safety of dupilumab in glucocorticoid-dependent severe asthma. New Eng J Med. 2018; 378 (26): 2475–85. DOI: 10.1056/NEJMoa1804093
14. Курбачева О.М., Дынева М.Е., Ильина Н.И. Дупилумаб: основные аспекты применения при T2-опосредованных заболеваниях. Медицинский Совет. 2021; (16): 186–96.
Kurbacheva OM, Dyneva ME, Ilina NI. Dupilumab: basic aspects and applications to T2-mediated diseases. Meditsinskiy sovet = Medical Council. 2021; (16): 186–96. DOI: 10.21518/2079-701X-2021-16-186-196
15. Hamada K, Oishi K, Murata Y et al. Feasibility of Discontinuing Biologics in Severe Asthma: An Algorithmic Approach. J Asthma Allergy. 2021; 14: 1463–71. DOI: 10.2147/JAA.S340684
16. Noop А, Johansson SGO, Adedoyin J et al. After 6 years with Xolair; 3-year withdrawal follow-up. Allergy. 2010; 65 (1): 56–60. DOI: 10.1111/j.1398-9995.2009.02144.x
17. Silver J, Bogart M, Molfino NA et al. Factors leading to discontinuation of biologic therapy in patients with severe asthma. J Asthma. 2022; 59 (9): 1839–49. DOI: 10.1080/02770903.2021.1971700
18. Zimmermann M, Rind D, Chapman R et al. Economic Evaluation of Dupilumab for Moderate-to-Severe Atopic Dermatitis: A Cost-Utility Analysis. J Drugs Dermatol. 2018; 17 (7): 750–6.
19. Саласюк А.С., Фролов М.Ю., Барыкина И.Н. Дупилумаб при тяжелой неконтролируемой бронхиальной астме – экономические аспекты применения. Качественная Клиническая Практика. 2019; (2): 15–24.
Salasyuk AS, Frolov MYu, Barykina IN. Dupilumab in the treatment of severe non-control broncial asthma – economic aspects. Kachestvennaya Klinicheskaya Praktika = Good Clin Pract. 2019; (2): 15–24. DOI: 10.24411/2588-0519-2019-10069
20. Pfützner W, Schuppe M. Use of biologics in allergen immunotherapy. Allergol Select. 2021; (5): 108–18. DOI: 10.5414/ALX02206E
21. Lombardi, Carlo; Canonica et al. Allergen immunotherapy as add-on to biologic agents. Curr Opinion Allergy Clin Immunol. 2018; 18 (6): 502–8. DOI: 10.1097/ACI.0000000000000479
22. Kuehr J, Brauburger J, Zielen S et al. Efficacy of combination treatment with anti-IgE plus specific immunotherapy in polysensitized children and adolescents with seasonal allergic rhinitis. J Allergy Clin Immunol. 2002; 109 (2): 274–80. DOI: 10.1067/mai.2002.121949
23. Rolinck-Werninghaus C, Hamelmann E, Keil T et al. Omalizumab Rhinitis Study Group. The co-seasonal application of anti-IgE after preseasonal specific immunotherapy decreases ocular and nasal symptom scores and rescue medication use in grass pollen allergic children. Allergy. 2004; 59 (9): 973–9. DOI: 10.1111/j.1398-9995.2004.00552.x
24. Casale TB, Busse WW, Kline JN et al. Immune Tolerance Network Group. Omalizumab pretreatment decreases acute reactions after rush immunotherapy for ragweed-induced seasonal allergic rhinitis. J Allergy Clin Immunol. 2006; 117 (1): 134–40. DOI: 10.1016/j.jaci.2005.09.036
25. Schulze J, Rose M, Zielen S. Beekeepers anaphylaxis: successful immunotherapy covered by omalizumab. Allergy. 2007; 62 (8): 963–4. DOI: 10.1111/j.1398-9995.2007.01388.x
26. Stelmach I, Sztafińska A, Woicka-Kolejwa K et al. Omalizumab in the prevention of anaphylaxis during immunotherapy: a case report. Postepy Dermatol Alergol. 2014; 31 (3): 191–3. DOI: 10.5114/pdia. 2014.43192
27. Kamal MA, Franchetti Y, Lai CH et al. Pharmacokinetics and Concentration-Response of Dupilumab in Patients With Seasonal Allergic Rhinitis. J Clin Pharmacol. 2022 May; 62 (5): 689–95. DOI: 10.1002/ jcph.2004
12 декабря 2023
Количество просмотров: 1903


