Клинический разбор в общей медицине №8 2023
1 Ural State Medical University, Ekaterinburg, Russia;
2 Medical Association "New Hospital", Ekaterinburg, Russia
anastasya_pap@inbox.ru
Abstract
Rheumatoid arthritis (RA) is the most common systemic connective tissue disease and typically presents pulmonary involvement, which can be of various types. Rheumatoid nodules (RN) of the lungs are one of the most common such lesions and can be potentially dangerous for the development of complications such as pneumothorax. In addition, RN often requires differential diagnosis with other diseases represented by focal formations in the lungs. The article presents two clinical cases related to the development and complication of RN. The first case describes the development of recurrent pneumothorax in a patient with a long history of RA and risk factors for the development of lung disease. The second case is a atypical variant of the onset of RA with simultaneous involvement of the joints and the formation of nodules in the lungs. The results of RN visualization are demonstrated. The presented data are discussed.
Key words: rheumatoid arthritis, rheumatoid nodules, pneumothorax, lung damage.
For citation: Sarapulova A.V., Teplyakova O.V., Shai S.E. Rheumatoid nodules in the lungs: difficulties of diagnosis and therapy. Clinical review for general practice. 2023; 4 (8): 54–59 (In Russ.). DOI: 10.47407/kr2023.4.8.00340
Факторами риска поражения легких считаются мужской пол, средний возраст, курение, эрозивный артрит, высокие титры ревматоидного фактора и антител к циклическому цитруллинированному пептиду, наличие подкожных ревматоидных узелков, другие системные проявления РА [5].
Ревматоидные узелки (РУ), по данным рентгенографии легких, являются достаточно редким признаком РА, но при проведении биопсии частота их обнаружения резко увеличивается и достигает 32%. В отличие от самого РА, узелки в легких чаще встречаются у мужчин и могут развиваться как вследствие самого заболевания, так и вследствие базисной противоревматической и генно-инженерной терапии [5–13].
Обычно наличие РУ в легких не представляет значительной опасности для пациента, вызывая в большей степени затруднения при проведении дифференциальной диагностики с туберкулезным или опухолевым поражением. Однако в некоторых случаях они могут осложняться развитием плеврального выпота, пневмо- или гидропневмоторакса [5, 14]. Также сложности в диагностике могут быть связаны с появлением РУ до дебюта суставного синдрома [15, 16].
Целью работы является совершенствование практических знаний и повышение осведомленности врачей о нетипичных проявлениях РА и связанных с этим вопросах междисциплинарного взаимодействия, демонстрируемых на примере двух клинических случаев развития РУ в легких.
Суставной синдром беспокоил с 2017 г., в 2019 г. верифицирован РА, назначен метотрексат 10 мг/нед, с постепенным увеличением дозы до 20 мг/нед. В январе 2021 г. переведен на терапию лефлуномидом из-за развития частых респираторных вирусных инфекций, в последующем в терапию добавлен сульфасалазин 2,0 г/сут, комбинацию из которых пациент принимал до середины 2022 г. Дважды за указанный период – в апреле и октябре 2021 г. – по назначению врача при обострениях принимал метилпреднизолон 4–6 мг/сут с постепенным снижением до отмены. К апрелю 2022 г. сохранялись минимально выраженные боли в проксимальных межфаланговых суставах кистей, при объективизации активность заболевания соответствовала низкой степени (индекс DAS28=2,98).
09.06.2022 – впервые, без провоцирующих факторов у пациента резко развилась одышка и боль в грудной клетке, при осмотре – отсутствие голосового дрожания, ослабление дыхания в правой половине грудной клетки, подозрение на спонтанный пневмоторакс. На обзорной рентгенографии органов грудной клетки легкое коллабировано на 1/5 объема. Пациент госпитализирован в терапевтическое отделение по месту жительства, установлен дренаж, явления пневмоторакса разрешились. Через 5 дней после удаления дренажа – рецидив пневмоторакса, госпитализирован в ГБУЗ СО «Противотуберкулезный диспансер». Выполнена компьютерная томография (КТ): в С6-9-10 сегментах правого легкого определяются субплевральные фокусы до 20 мм в диаметре, часть из них с деструкциями и формированием бронхоплеврального свища в С6 (рис. 1).
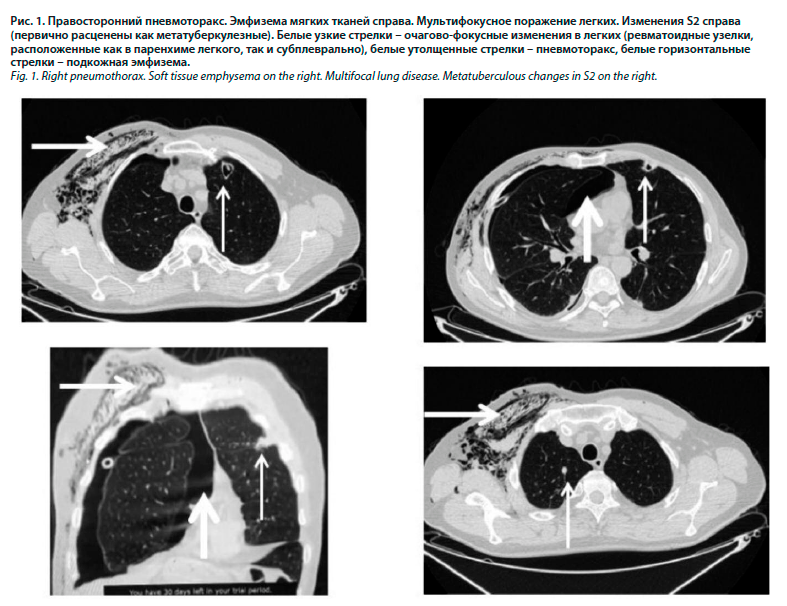
Слева также определялись подобные фокусы в С3-4-6. Изменения расценены как туберкулезное поражение легких, начата противотуберкулезная терапия (комбинированная терапия изониазидом и рифампицином).
В связи с отсутствием динамики по данным КТ, 21.07.2022 проведена открытая торакобиопсия легкого. Заключение: малоактивные кальцинированные фиброзно-казеозные туберкулезные очаги, изменения в плевре соответствуют поражению при РА. Таким образом, на биопсии были описаны оба процесса; при исследовании плевральной жидкости ДНК микобактерии туберкулеза не обнаружены. Тем не менее пациент продолжал прием противотуберкулезной терапии в том же режиме до августа 2022 г., когда у него развилась новая коронавирусная инфекция. Далее пролечен в инфекционном отделении ГКБ № 40 и переведен обратно в ГБУЗ «Противотуберкулезный диспансер», где 12.09.2022 проведена повторная торакобиопсия. Заключение: множественные ревматоидные узелки с распадом в плевре и подлежащей легочной ткани, фибринозный плеврит при РА в стадии организации. Также в протоколе патоморфологического исследования биопсийного материала описано наличие мицелия грибов рода Aspergillus в центре одного очага, представленного некротическими массами; расценено как вероятная колонизация области распада в ревматоидном узелке.
В связи с выявленными изменениями противотуберкулезная терапия прекращена, диагноз пересмотрен в пользу РА с поражением легких, осложненный развитием спонтанного рецидивирующего пневмоторакса. Пациент выписан для долечивания по месту жительства. Выявленный аспергиллез в дальнейшем в диагнозе не фигурировал, противогрибковая терапия не проводилась.
В течение осени 2022 г. пациент повторно перенес новую коронавирусную инфекцию и бактериальную пневмонию, что сопровождалось прогрессированием дыхательной недостаточности.
В связи с тем что при появлении подозрения на туберкулез пациенту была отменена базисная противоревматическая терапия, суставной синдром усилился, пациент переведен на симптоматическую терапию нестероидными противовоспалительными препаратами (НПВП), а после снятия диагноза туберкулез – на малые дозы глюкокортикоидов (4–8 мг метилпреднизолона). На данной терапии оставался до декабря 2022 г.; планируемая госпитализация в ревматологическое отделение для подбора базисной терапии (рассматривалось возможное назначение генно-инженерных препаратов) не состоялась из-за развития бактериальной пневмонии. Пневмония подтверждена рентгенологически, в течение 10 дней – прием левофлоксацина.
В январе 2023 г. пациенту однократно проводилось внутрисуставное введение глюкокортикоидов – с положительным эффектом; также вновь планировалась госпитализация в ревматологическое отделение, но при рентгенологическом обследовании легких выявлена пневмония, госпитализирован в терапевтическое отделение по месту жительства, получал комбинированную антибактериальную терапию – цефтриаксон и азитромицин.
Во время госпитализации по данному поводу развился пневмоторакс слева, в связи с чем пациент переведен в ГБУЗ СО «Противотуберкулезный диспансер», где находился до своей смерти 12.05.2023.
В динамике наблюдалось прогрессирующее ухудшение функции легких; тяжесть состояния определялась наличием двухстороннего ригидного пневмоторакса, полным коллапсом правого легкого и постепенным развитием коллапса левого легкого. Хирургическое лечение не проводилось ввиду тяжелого общего состояния больного, выраженных явлений астении и белково-энергетической недостаточности, риска присоединения инфекционных осложнений.
Анамнез заболевания: 20.02.2023 без провоцирующего фактора и жалоб со стороны органов дыхания – эпизод кровохарканья (трижды за сутки), на рентгенографии легких – без патологии, по данным КТ – шаровидное образование С6 справа с распадом неясной этиологии. Через два дня – дебют суставного синдрома – развитие синовита коленных и голеностопных суставов (ранее суставного синдрома не отмечала). Осмотрена ревматологом: данных, подтверждающих ревматологическую патологию, нет, рекомендовано дообследование у фтизиатра.
В связи с наличием в анамнезе злокачественного новообразования молочной железы в 2009 г. (состояние после мастэктомии, лучевой терапии) осмотрена онкологом: данных, подтверждающих специфический процесс, нет. При осмотре фтизиатром данных за туберкулез не выявлено.
В течение месяца получала антибактериальную терапию по месту жительства (амоксициллина клавуланат, далее – левофлоксацин) – без клинического эффекта: сохранялась слабость, повышение температуры. Суставной синдром беспокоил незначительно и контролировался пациенткой самостоятельно приемом НПВП. В общем анализе крови наблюдалось повышение СОЭ до 34–45 мм/ч. При проведении КТ (23.03.2023) – без значимой динамики, в связи с чем повторно осмотрена фтизиатром, проведены лабораторные исследования: диаскин-тест, МБТ-анализ мокроты и ДНК-анализ к микобактерии туберкулеза отрицательные. Тем не менее образования в легких расценены как туберкулез, начата терапия по I режиму (изониазид, рифампицин, пиразинамид). Биопсия легких не проводилась ввиду отказа пациентки.
На контрольной компьютерной томографии органов грудной клетки (КТ ОГК) от 17.05.2023 (рис. 2) – увеличение размеров очага в С6 справа и полости распада в нем, отмечалось сохранение высокой лабораторной активности (СОЭ на уровне 59 мм/ч) и постепенное прогрессирование суставного синдрома с вовлечением в процесс мелких суставов кистей, в связи с чем пациентка направлена на повторную консультацию ревматолога.
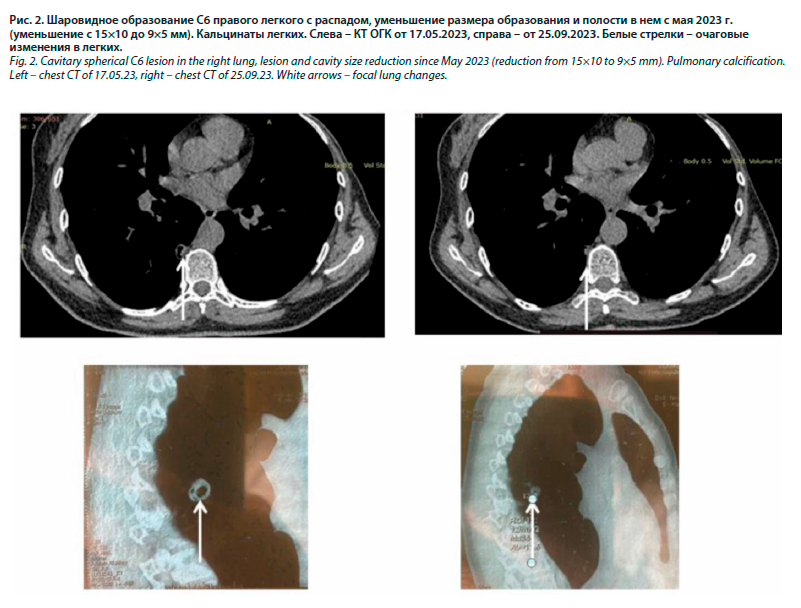
На тот момент находилась на госпитализации в Уральском научно-исследовательском институте фтизиатрии с целью уточнения диагноза; туберкулостатические препараты были отменены до приема ревматолога.
При осмотре: кожа чистая, на разгибательной поверхности предплечий – узелковые образования – подвижные, плотные, безболезненные. Дыхание везикулярное, проводится во все отделы, хрипов не выслушивается, частота дыхания – 16. Тоны сердца ритмичные, частота сердечных сокращений – 72 в минуту. Живот при осмотре не вздут, безболезненный при пальпации. Печень 10×9×8 см по Курлову, селезенка 7×5 см.
St. Localis: симметричная экссудация лучезапястных, II–III пястно-фаланговых, II–V плюсне-фаланговых, голеностопных суставов, болезненность при пальпации. Затруднено сжатие кисти в кулак, сгибание в коленных суставах.
Лабораторные данные: в общем анализе крови гемоглобин – 112 г/л, нормоцитоз, нормохромия, лейкоциты – 5,9×109/л, тромбоциты– 443×109/л, СОЭ – 59 мм/ч. Гепатиты В и С, ВИЧ – не выявлены.
Оценка пациенткой своего здоровья составила 61 балл из 100 (0 – идеальное здоровье, 100 – полная утрата здоровья).
При дообследовании: ревматоидный фактор (РФ) – 70,83 ед/мл (норма 0–14 ед/мл), антитела к циклическому цитруллинированному пептиду (АЦЦП) – 97,08 ед/мл (норма менее 17 ед/мл), антинуклеарный фактор – 1 : 320 (норма менее 1 : 160), ядерный гранулярный тип свечения, антинейтрофильные цитоплазматические антитела (АНЦА) – менее 1 : 40 (норма менее 1 : 40).
Рентгенография кистей и стоп в прямой проекции: определяется околосуставный остеопороз.
По результатам дообследования и по согласованию с пульмонологом (с учетом отсутствия убедительных данных, подтверждающих туберкулез) установлен диагноз: ревматоидный артрит, ранняя стадия, РФ (+), АЦЦП (+), активность высокая (DAS28=5,79), с внесуставными проявлениями (ревматоидные узелки кожи и легких), рентгенологическая стадия I, функциональный класс I.
Диагноз РА установлен на основании критериев EULAR/ACR, активность РА определена исходя из показателя DAS28: ниже 2,6 – ремиссия заболевания, 2,6–3,2 – низкая активность, 3,2–5,1 – умеренная активность, более 5,1 – высокая активность заболевания [17, 18].
Инициирована комбинированная терапия:
• метотрексат с эскалацией дозы от 10 до 20 мг/нед, фолиевая кислота – 10 мг/нед. Несмотря на то что метотрексат, будучи «золотым стандартом» базисной противоревматической терапии, потенциально обладает способностью инициировать образование узелков, данное осложнение не является распространенным и соотношение «польза/риск» при назначении метотрексата перевешивает возможное развитие очаговых образований легких. Кроме того, второй основной препарат базисной противоревматической терапии – лефлуномид – также не лишен данного осложнения и потому не может быть препаратом выбора [6, 11, 20].
• метилпреднизолон 12 мг/сут с постепенным снижением дозы до отмены в течение 3 мес.
В течение 1-го месяца терапии наблюдалось купирование суставного синдрома со снижением индекса активности DAS28 с 5,79 до 3,97, нормализация лабораторных показателей воспалительной активности (СОЭ – 29 мм/ч при измерении по Вестергрену), через 3 мес проведена контрольная КТ легких и выявлено уменьшение размеров очагового образования и полости в нем (см. рис. 2).
По прошествии 5 мес терапии состояние пациентки продолжает оставаться стабильным: суставной синдром не беспокоит, пациентка находится под наблюдением ревматолога и получает терапию метотрексатом.
Опасность РУ заключается в возможном развитии пневмоторакса, что было неоднократно описано в литературе [20–23]. Лечение подобных осложнений включает в себя как хирургические методы (дренирование плевральной полости, резекция легкого), так и консервативные мероприятия (подбор базисной терапии с целью стабилизации или разрешения РУ). В качестве такой терапии часто выступает группа генно-инженерных биологических препаратов (ГИБП) – тоцилизумаб или ритуксимаб [19, 22]. Такой выбор обусловлен тем, что другие ГИБП, из группы блокаторов фактора некроза опухоли-α – инфликсимаб и этанерцепт – могут потенциально вызывать развитие РУ. Этой же способностью обладают и препараты базисной терапии – метотрексат и лефлуномид [6, 10, 11].
К сожалению, в первом описанном случае постоянное рецидивирование пневмоторакса и присоединение бактериальных и вирусных инфекций не позволило начать пациенту терапию ГИБП и замедлить прогрессирование заболевания, что, в конечном итоге, привело к смертельному исходу. В свете развития подобного тяжелого осложнения актуальным представляется вопрос о влиянии лефлуномида на развитие РУ, которое подкрепляется несколькими соображениями:
• во-первых, пациент регулярно проходил флюорографическое обследование, и до 2022 г. у него не было никаких признаков поражения легких, при этом применение лефлуномида началось за год до выявления узелков – в 2021 г.;
• во-вторых, в литературе имеются сообщения о периферических и/или легочных РУ на фоне приема лефлуномида [6, 11, 20].
Безусловно, в представленном случае невозможно однозначно утверждать, что очаговые образования легких явились следствием применения препарата, так как у пациента имелись и другие признаки – факторы риска развития РУ в легких, такие как эрозивный артрит, мужской пол, наличие подкожных РУ. Однако и исключить подобное развитие событий невозможно, что подчеркивает необходимость регулярного рентгенологического обследования, ставит вопрос о целесообразности переключения пациентов на генно-инженерную биологическую терапию в случае недостаточной эффективности препаратов базисной терапии (в соответствии с клиническими рекомендациями), побуждает к более внимательному наблюдению пациентов из группы риска по развитию РУ [23].
Особенностью второго клинического случая является раннее развитие РУ – параллельно с дебютом суставного синдрома. При этом невыраженная боль в суставах в сочетании с анамнезом (новообразование молочной железы) и данными КТ, в первую очередь, навела на мысль о туберкулезном либо метастатическом процессе. Действительно, с точки зрения прогноза и течения заболевания именно две указанные группы заболеваний требуют немедленной диагностики. Однако не следует забывать о третьей группе патологий, способных вызывать очагово-фокусное поражение легких, а именно – о системных заболеваниях соединительной ткани и системных васкулитах. Для данной группы будет характерна высокая лабораторная активность без признаков бактериальной инфекции, наличие проявлений со стороны других органов и систем (суставы, почки, кожа и т.д.), специфические иммунологические показатели.
В данном случае типичный характер болевого синдрома – симметричное поражение с вовлечением суставов кистей, высокие показатели РФ и АЦЦП, отсутствие эффекта от противотуберкулезной терапии и лабораторных данных, подтверждающих наличие активной инфекции, а также – прогрессирующие в динамике изменения легких позволили верифицировать диагноз РА. Косвенным доказательством правильности установленного диагноза можно считать ответ на терапию, как с точки зрения купирования суставного синдрома, так и с точки зрения регресса очаговых образований в легких.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Сарапулова Анастасия Викторовна – канд. мед. наук, ассистент каф. поликлинической терапии, ультразвуковой и функциональной диагностики ФГБОУ ВО УГМУ; врач-ревматолог, Центр клинической ревматологии ООО МО «Новая больница». E-mail: anastasya_pap@inbox.ru; ORCID: 0000-0002-3616-2365
Anastasia V. Sarapulova – Cand. Sci. (Med.), Ural State Medical University; rheumatologist, Center for Clinical Rheumatology, Medical Association "New Hospital". E-mail: anastasya_pap@inbox.ru; ORCID: 0000-0002-3616-2365
Теплякова Ольга Вячеславовна – д-р мед. наук, проф. каф. поликлинической терапии, ультразвуковой и функциональной диагностики, ФГБОУ ВО УГМУ; руководитель Центра клинической ревматологии ООО МО «Новая больница». ORCID: 0000- 0003-2114-0419
Olga V. Teplyakova – Dr. Sc. (Med.), Prof., Ural State Medical University; Head of the Center for Clinical Rheumatology, Medical Association "New Hospital". ORCID: 0000-0003-2114-0419
Шай Семен Евгеньевич – студент 6-го курса. ФГБОУ ВО УГМУ. ORCID: 0009-0003-1199-6165
Semyon E. Shai – 6th year student, Ural State Medical University. ORCID: 0009-0003-1199-6165
Поступила в редакцию: 16.11.2023
Поступила после рецензирования: 22.11.2023
Принята к публикации: 23.11.2023
Received: 16.11.2023
Revised: 22.11.2023
Accepted: 23.11.2023
Клинический разбор в общей медицине №8 2023
Ревматоидные узелки в легких: сложности диагностики и терапии
Номера страниц в выпуске:54-59
Аннотация
Ревматоидный артрит (РА) представляет собой самое частое системное заболевание соединительной ткани, и для него типично поражение легких, которое может носить разнообразный характер. Ревматоидные узелки (РУ) легких являются одним из наиболее частых таких проявлений и могут быть потенциально опасны развитием осложнений, таких как пневмоторакс. Кроме того, РУ часто требуют дифференциальной диагностики с другими заболеваниями, представленными очагово-фокусными образованиями в легких. В статье представлены два клинических случая, связанных с развитием и осложнением течения РУ. Первый случай описывает развитие рецидивирующего пневмоторакса у пациента с длительным анамнезом РА и факторами риска развития поражения легких. Второй случай представляет собой атипичный вариант дебюта РА с одновременным вовлечением суставов и формированием узелков в легких. Демонстрируются результаты визуализации РУ. Обсуждаются представленные данные.
Ключевые слова: ревматоидный артрит, ревматоидные узелки, пневмоторакс, поражение легких.
Для цитирования: Сарапулова А.В., Теплякова О.В., Шай С.Е. Ревматоидные узелки в легких: сложности диагностики и терапии. Клинический разбор в общей медицине. 2023; 4 (8): 54–59. DOI: 10.47407/kr2023.4.8.00340
Ревматоидный артрит (РА) представляет собой самое частое системное заболевание соединительной ткани, и для него типично поражение легких, которое может носить разнообразный характер. Ревматоидные узелки (РУ) легких являются одним из наиболее частых таких проявлений и могут быть потенциально опасны развитием осложнений, таких как пневмоторакс. Кроме того, РУ часто требуют дифференциальной диагностики с другими заболеваниями, представленными очагово-фокусными образованиями в легких. В статье представлены два клинических случая, связанных с развитием и осложнением течения РУ. Первый случай описывает развитие рецидивирующего пневмоторакса у пациента с длительным анамнезом РА и факторами риска развития поражения легких. Второй случай представляет собой атипичный вариант дебюта РА с одновременным вовлечением суставов и формированием узелков в легких. Демонстрируются результаты визуализации РУ. Обсуждаются представленные данные.
Ключевые слова: ревматоидный артрит, ревматоидные узелки, пневмоторакс, поражение легких.
Для цитирования: Сарапулова А.В., Теплякова О.В., Шай С.Е. Ревматоидные узелки в легких: сложности диагностики и терапии. Клинический разбор в общей медицине. 2023; 4 (8): 54–59. DOI: 10.47407/kr2023.4.8.00340
Rheumatoid nodules in the lungs: difficulties of diagnosis and therapy
Anastasia V. Sarapulova1,2, Olga V. Teplyakova1,2, Semyon E. Shai11 Ural State Medical University, Ekaterinburg, Russia;
2 Medical Association "New Hospital", Ekaterinburg, Russia
anastasya_pap@inbox.ru
Abstract
Rheumatoid arthritis (RA) is the most common systemic connective tissue disease and typically presents pulmonary involvement, which can be of various types. Rheumatoid nodules (RN) of the lungs are one of the most common such lesions and can be potentially dangerous for the development of complications such as pneumothorax. In addition, RN often requires differential diagnosis with other diseases represented by focal formations in the lungs. The article presents two clinical cases related to the development and complication of RN. The first case describes the development of recurrent pneumothorax in a patient with a long history of RA and risk factors for the development of lung disease. The second case is a atypical variant of the onset of RA with simultaneous involvement of the joints and the formation of nodules in the lungs. The results of RN visualization are demonstrated. The presented data are discussed.
Key words: rheumatoid arthritis, rheumatoid nodules, pneumothorax, lung damage.
For citation: Sarapulova A.V., Teplyakova O.V., Shai S.E. Rheumatoid nodules in the lungs: difficulties of diagnosis and therapy. Clinical review for general practice. 2023; 4 (8): 54–59 (In Russ.). DOI: 10.47407/kr2023.4.8.00340
Введение
Ревматоидный артрит (РА) – иммуновоспалительное заболевание неизвестной этиологии, характеризующееся хроническим эрозивным артритом и системным поражением внутренних органов. Одним из наиболее частых внесуставных проявлений РА является поражение легких, протекающее в виде интерстициального заболевания, плеврита, облитерирующего бронхиолита, ревматоидных узелков, бронхоэктазов, синдрома Каплана, легочного кровотечения. Кроме того, длительная терапия стероидами и иммуносупрессивными препаратами создает предрасполагающие условия для развития инфекционных осложнений [1–4].Факторами риска поражения легких считаются мужской пол, средний возраст, курение, эрозивный артрит, высокие титры ревматоидного фактора и антител к циклическому цитруллинированному пептиду, наличие подкожных ревматоидных узелков, другие системные проявления РА [5].
Ревматоидные узелки (РУ), по данным рентгенографии легких, являются достаточно редким признаком РА, но при проведении биопсии частота их обнаружения резко увеличивается и достигает 32%. В отличие от самого РА, узелки в легких чаще встречаются у мужчин и могут развиваться как вследствие самого заболевания, так и вследствие базисной противоревматической и генно-инженерной терапии [5–13].
Обычно наличие РУ в легких не представляет значительной опасности для пациента, вызывая в большей степени затруднения при проведении дифференциальной диагностики с туберкулезным или опухолевым поражением. Однако в некоторых случаях они могут осложняться развитием плеврального выпота, пневмо- или гидропневмоторакса [5, 14]. Также сложности в диагностике могут быть связаны с появлением РУ до дебюта суставного синдрома [15, 16].
Целью работы является совершенствование практических знаний и повышение осведомленности врачей о нетипичных проявлениях РА и связанных с этим вопросах междисциплинарного взаимодействия, демонстрируемых на примере двух клинических случаев развития РУ в легких.
Клинический случай 1
Пациент, 66 лет, впервые обратился на прием ревматолога в МО «Новая больница» г. Екатеринбурга в 2021 г. с жалобами на боли воспалительного характера в пястно-фаланговых, лучезапястных, плечевых суставах, утреннюю скованность длительностью до нескольких часов.Суставной синдром беспокоил с 2017 г., в 2019 г. верифицирован РА, назначен метотрексат 10 мг/нед, с постепенным увеличением дозы до 20 мг/нед. В январе 2021 г. переведен на терапию лефлуномидом из-за развития частых респираторных вирусных инфекций, в последующем в терапию добавлен сульфасалазин 2,0 г/сут, комбинацию из которых пациент принимал до середины 2022 г. Дважды за указанный период – в апреле и октябре 2021 г. – по назначению врача при обострениях принимал метилпреднизолон 4–6 мг/сут с постепенным снижением до отмены. К апрелю 2022 г. сохранялись минимально выраженные боли в проксимальных межфаланговых суставах кистей, при объективизации активность заболевания соответствовала низкой степени (индекс DAS28=2,98).
09.06.2022 – впервые, без провоцирующих факторов у пациента резко развилась одышка и боль в грудной клетке, при осмотре – отсутствие голосового дрожания, ослабление дыхания в правой половине грудной клетки, подозрение на спонтанный пневмоторакс. На обзорной рентгенографии органов грудной клетки легкое коллабировано на 1/5 объема. Пациент госпитализирован в терапевтическое отделение по месту жительства, установлен дренаж, явления пневмоторакса разрешились. Через 5 дней после удаления дренажа – рецидив пневмоторакса, госпитализирован в ГБУЗ СО «Противотуберкулезный диспансер». Выполнена компьютерная томография (КТ): в С6-9-10 сегментах правого легкого определяются субплевральные фокусы до 20 мм в диаметре, часть из них с деструкциями и формированием бронхоплеврального свища в С6 (рис. 1).

Слева также определялись подобные фокусы в С3-4-6. Изменения расценены как туберкулезное поражение легких, начата противотуберкулезная терапия (комбинированная терапия изониазидом и рифампицином).
В связи с отсутствием динамики по данным КТ, 21.07.2022 проведена открытая торакобиопсия легкого. Заключение: малоактивные кальцинированные фиброзно-казеозные туберкулезные очаги, изменения в плевре соответствуют поражению при РА. Таким образом, на биопсии были описаны оба процесса; при исследовании плевральной жидкости ДНК микобактерии туберкулеза не обнаружены. Тем не менее пациент продолжал прием противотуберкулезной терапии в том же режиме до августа 2022 г., когда у него развилась новая коронавирусная инфекция. Далее пролечен в инфекционном отделении ГКБ № 40 и переведен обратно в ГБУЗ «Противотуберкулезный диспансер», где 12.09.2022 проведена повторная торакобиопсия. Заключение: множественные ревматоидные узелки с распадом в плевре и подлежащей легочной ткани, фибринозный плеврит при РА в стадии организации. Также в протоколе патоморфологического исследования биопсийного материала описано наличие мицелия грибов рода Aspergillus в центре одного очага, представленного некротическими массами; расценено как вероятная колонизация области распада в ревматоидном узелке.
В связи с выявленными изменениями противотуберкулезная терапия прекращена, диагноз пересмотрен в пользу РА с поражением легких, осложненный развитием спонтанного рецидивирующего пневмоторакса. Пациент выписан для долечивания по месту жительства. Выявленный аспергиллез в дальнейшем в диагнозе не фигурировал, противогрибковая терапия не проводилась.
В течение осени 2022 г. пациент повторно перенес новую коронавирусную инфекцию и бактериальную пневмонию, что сопровождалось прогрессированием дыхательной недостаточности.
В связи с тем что при появлении подозрения на туберкулез пациенту была отменена базисная противоревматическая терапия, суставной синдром усилился, пациент переведен на симптоматическую терапию нестероидными противовоспалительными препаратами (НПВП), а после снятия диагноза туберкулез – на малые дозы глюкокортикоидов (4–8 мг метилпреднизолона). На данной терапии оставался до декабря 2022 г.; планируемая госпитализация в ревматологическое отделение для подбора базисной терапии (рассматривалось возможное назначение генно-инженерных препаратов) не состоялась из-за развития бактериальной пневмонии. Пневмония подтверждена рентгенологически, в течение 10 дней – прием левофлоксацина.
В январе 2023 г. пациенту однократно проводилось внутрисуставное введение глюкокортикоидов – с положительным эффектом; также вновь планировалась госпитализация в ревматологическое отделение, но при рентгенологическом обследовании легких выявлена пневмония, госпитализирован в терапевтическое отделение по месту жительства, получал комбинированную антибактериальную терапию – цефтриаксон и азитромицин.
Во время госпитализации по данному поводу развился пневмоторакс слева, в связи с чем пациент переведен в ГБУЗ СО «Противотуберкулезный диспансер», где находился до своей смерти 12.05.2023.
В динамике наблюдалось прогрессирующее ухудшение функции легких; тяжесть состояния определялась наличием двухстороннего ригидного пневмоторакса, полным коллапсом правого легкого и постепенным развитием коллапса левого легкого. Хирургическое лечение не проводилось ввиду тяжелого общего состояния больного, выраженных явлений астении и белково-энергетической недостаточности, риска присоединения инфекционных осложнений.
Клинический случай 2
Пациентка, 57 лет, впервые обратилась на прием ревматолога в МО «Новая больница» в мае 2023 г. с жалобами на боли воспалительного характера в суставах кистей, коленных и голеностопных суставах, утреннюю скованность до 1 ч, субфебрилитет до 37,3 °С.Анамнез заболевания: 20.02.2023 без провоцирующего фактора и жалоб со стороны органов дыхания – эпизод кровохарканья (трижды за сутки), на рентгенографии легких – без патологии, по данным КТ – шаровидное образование С6 справа с распадом неясной этиологии. Через два дня – дебют суставного синдрома – развитие синовита коленных и голеностопных суставов (ранее суставного синдрома не отмечала). Осмотрена ревматологом: данных, подтверждающих ревматологическую патологию, нет, рекомендовано дообследование у фтизиатра.
В связи с наличием в анамнезе злокачественного новообразования молочной железы в 2009 г. (состояние после мастэктомии, лучевой терапии) осмотрена онкологом: данных, подтверждающих специфический процесс, нет. При осмотре фтизиатром данных за туберкулез не выявлено.
В течение месяца получала антибактериальную терапию по месту жительства (амоксициллина клавуланат, далее – левофлоксацин) – без клинического эффекта: сохранялась слабость, повышение температуры. Суставной синдром беспокоил незначительно и контролировался пациенткой самостоятельно приемом НПВП. В общем анализе крови наблюдалось повышение СОЭ до 34–45 мм/ч. При проведении КТ (23.03.2023) – без значимой динамики, в связи с чем повторно осмотрена фтизиатром, проведены лабораторные исследования: диаскин-тест, МБТ-анализ мокроты и ДНК-анализ к микобактерии туберкулеза отрицательные. Тем не менее образования в легких расценены как туберкулез, начата терапия по I режиму (изониазид, рифампицин, пиразинамид). Биопсия легких не проводилась ввиду отказа пациентки.
На контрольной компьютерной томографии органов грудной клетки (КТ ОГК) от 17.05.2023 (рис. 2) – увеличение размеров очага в С6 справа и полости распада в нем, отмечалось сохранение высокой лабораторной активности (СОЭ на уровне 59 мм/ч) и постепенное прогрессирование суставного синдрома с вовлечением в процесс мелких суставов кистей, в связи с чем пациентка направлена на повторную консультацию ревматолога.

На тот момент находилась на госпитализации в Уральском научно-исследовательском институте фтизиатрии с целью уточнения диагноза; туберкулостатические препараты были отменены до приема ревматолога.
При осмотре: кожа чистая, на разгибательной поверхности предплечий – узелковые образования – подвижные, плотные, безболезненные. Дыхание везикулярное, проводится во все отделы, хрипов не выслушивается, частота дыхания – 16. Тоны сердца ритмичные, частота сердечных сокращений – 72 в минуту. Живот при осмотре не вздут, безболезненный при пальпации. Печень 10×9×8 см по Курлову, селезенка 7×5 см.
St. Localis: симметричная экссудация лучезапястных, II–III пястно-фаланговых, II–V плюсне-фаланговых, голеностопных суставов, болезненность при пальпации. Затруднено сжатие кисти в кулак, сгибание в коленных суставах.
Лабораторные данные: в общем анализе крови гемоглобин – 112 г/л, нормоцитоз, нормохромия, лейкоциты – 5,9×109/л, тромбоциты– 443×109/л, СОЭ – 59 мм/ч. Гепатиты В и С, ВИЧ – не выявлены.
Оценка пациенткой своего здоровья составила 61 балл из 100 (0 – идеальное здоровье, 100 – полная утрата здоровья).
При дообследовании: ревматоидный фактор (РФ) – 70,83 ед/мл (норма 0–14 ед/мл), антитела к циклическому цитруллинированному пептиду (АЦЦП) – 97,08 ед/мл (норма менее 17 ед/мл), антинуклеарный фактор – 1 : 320 (норма менее 1 : 160), ядерный гранулярный тип свечения, антинейтрофильные цитоплазматические антитела (АНЦА) – менее 1 : 40 (норма менее 1 : 40).
Рентгенография кистей и стоп в прямой проекции: определяется околосуставный остеопороз.
По результатам дообследования и по согласованию с пульмонологом (с учетом отсутствия убедительных данных, подтверждающих туберкулез) установлен диагноз: ревматоидный артрит, ранняя стадия, РФ (+), АЦЦП (+), активность высокая (DAS28=5,79), с внесуставными проявлениями (ревматоидные узелки кожи и легких), рентгенологическая стадия I, функциональный класс I.
Диагноз РА установлен на основании критериев EULAR/ACR, активность РА определена исходя из показателя DAS28: ниже 2,6 – ремиссия заболевания, 2,6–3,2 – низкая активность, 3,2–5,1 – умеренная активность, более 5,1 – высокая активность заболевания [17, 18].
Инициирована комбинированная терапия:
• метотрексат с эскалацией дозы от 10 до 20 мг/нед, фолиевая кислота – 10 мг/нед. Несмотря на то что метотрексат, будучи «золотым стандартом» базисной противоревматической терапии, потенциально обладает способностью инициировать образование узелков, данное осложнение не является распространенным и соотношение «польза/риск» при назначении метотрексата перевешивает возможное развитие очаговых образований легких. Кроме того, второй основной препарат базисной противоревматической терапии – лефлуномид – также не лишен данного осложнения и потому не может быть препаратом выбора [6, 11, 20].
• метилпреднизолон 12 мг/сут с постепенным снижением дозы до отмены в течение 3 мес.
В течение 1-го месяца терапии наблюдалось купирование суставного синдрома со снижением индекса активности DAS28 с 5,79 до 3,97, нормализация лабораторных показателей воспалительной активности (СОЭ – 29 мм/ч при измерении по Вестергрену), через 3 мес проведена контрольная КТ легких и выявлено уменьшение размеров очагового образования и полости в нем (см. рис. 2).
По прошествии 5 мес терапии состояние пациентки продолжает оставаться стабильным: суставной синдром не беспокоит, пациентка находится под наблюдением ревматолога и получает терапию метотрексатом.
Обсуждение
Очаговые образования в легких при РА являются нечастым, но потенциально опасным и сложным для дифференциальной диагностики проявлением.Опасность РУ заключается в возможном развитии пневмоторакса, что было неоднократно описано в литературе [20–23]. Лечение подобных осложнений включает в себя как хирургические методы (дренирование плевральной полости, резекция легкого), так и консервативные мероприятия (подбор базисной терапии с целью стабилизации или разрешения РУ). В качестве такой терапии часто выступает группа генно-инженерных биологических препаратов (ГИБП) – тоцилизумаб или ритуксимаб [19, 22]. Такой выбор обусловлен тем, что другие ГИБП, из группы блокаторов фактора некроза опухоли-α – инфликсимаб и этанерцепт – могут потенциально вызывать развитие РУ. Этой же способностью обладают и препараты базисной терапии – метотрексат и лефлуномид [6, 10, 11].
К сожалению, в первом описанном случае постоянное рецидивирование пневмоторакса и присоединение бактериальных и вирусных инфекций не позволило начать пациенту терапию ГИБП и замедлить прогрессирование заболевания, что, в конечном итоге, привело к смертельному исходу. В свете развития подобного тяжелого осложнения актуальным представляется вопрос о влиянии лефлуномида на развитие РУ, которое подкрепляется несколькими соображениями:
• во-первых, пациент регулярно проходил флюорографическое обследование, и до 2022 г. у него не было никаких признаков поражения легких, при этом применение лефлуномида началось за год до выявления узелков – в 2021 г.;
• во-вторых, в литературе имеются сообщения о периферических и/или легочных РУ на фоне приема лефлуномида [6, 11, 20].
Безусловно, в представленном случае невозможно однозначно утверждать, что очаговые образования легких явились следствием применения препарата, так как у пациента имелись и другие признаки – факторы риска развития РУ в легких, такие как эрозивный артрит, мужской пол, наличие подкожных РУ. Однако и исключить подобное развитие событий невозможно, что подчеркивает необходимость регулярного рентгенологического обследования, ставит вопрос о целесообразности переключения пациентов на генно-инженерную биологическую терапию в случае недостаточной эффективности препаратов базисной терапии (в соответствии с клиническими рекомендациями), побуждает к более внимательному наблюдению пациентов из группы риска по развитию РУ [23].
Особенностью второго клинического случая является раннее развитие РУ – параллельно с дебютом суставного синдрома. При этом невыраженная боль в суставах в сочетании с анамнезом (новообразование молочной железы) и данными КТ, в первую очередь, навела на мысль о туберкулезном либо метастатическом процессе. Действительно, с точки зрения прогноза и течения заболевания именно две указанные группы заболеваний требуют немедленной диагностики. Однако не следует забывать о третьей группе патологий, способных вызывать очагово-фокусное поражение легких, а именно – о системных заболеваниях соединительной ткани и системных васкулитах. Для данной группы будет характерна высокая лабораторная активность без признаков бактериальной инфекции, наличие проявлений со стороны других органов и систем (суставы, почки, кожа и т.д.), специфические иммунологические показатели.
В данном случае типичный характер болевого синдрома – симметричное поражение с вовлечением суставов кистей, высокие показатели РФ и АЦЦП, отсутствие эффекта от противотуберкулезной терапии и лабораторных данных, подтверждающих наличие активной инфекции, а также – прогрессирующие в динамике изменения легких позволили верифицировать диагноз РА. Косвенным доказательством правильности установленного диагноза можно считать ответ на терапию, как с точки зрения купирования суставного синдрома, так и с точки зрения регресса очаговых образований в легких.
Заключение
РА представляет собой крайне разнородное заболевание с множеством потенциальных внесуставных проявлений, знание которых необходимо не только врачам-ревматологам, но и другим специалистам терапевтического и хирургического профиля.Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Сарапулова Анастасия Викторовна – канд. мед. наук, ассистент каф. поликлинической терапии, ультразвуковой и функциональной диагностики ФГБОУ ВО УГМУ; врач-ревматолог, Центр клинической ревматологии ООО МО «Новая больница». E-mail: anastasya_pap@inbox.ru; ORCID: 0000-0002-3616-2365
Anastasia V. Sarapulova – Cand. Sci. (Med.), Ural State Medical University; rheumatologist, Center for Clinical Rheumatology, Medical Association "New Hospital". E-mail: anastasya_pap@inbox.ru; ORCID: 0000-0002-3616-2365
Теплякова Ольга Вячеславовна – д-р мед. наук, проф. каф. поликлинической терапии, ультразвуковой и функциональной диагностики, ФГБОУ ВО УГМУ; руководитель Центра клинической ревматологии ООО МО «Новая больница». ORCID: 0000- 0003-2114-0419
Olga V. Teplyakova – Dr. Sc. (Med.), Prof., Ural State Medical University; Head of the Center for Clinical Rheumatology, Medical Association "New Hospital". ORCID: 0000-0003-2114-0419
Шай Семен Евгеньевич – студент 6-го курса. ФГБОУ ВО УГМУ. ORCID: 0009-0003-1199-6165
Semyon E. Shai – 6th year student, Ural State Medical University. ORCID: 0009-0003-1199-6165
Поступила в редакцию: 16.11.2023
Поступила после рецензирования: 22.11.2023
Принята к публикации: 23.11.2023
Received: 16.11.2023
Revised: 22.11.2023
Accepted: 23.11.2023
Список исп. литературыСкрыть список1. Esposito AJ, Chu SG, Madan R et al. Thoracic Manifestations of Rheumatoid Arthritis. Clin Chest Med. 2019; 40 (3): 545–60.
2. Dawson JK, Graham DR, Lynch MP. Lung disease in patients with rheumatoid arthritis. CPD Rheumatol. 2002; 3 (2): 38–42.
3. Gauhar UA, Gaffo AL, Alarcón GS. Pulmonary manifestations of rheumatoid arthritis. Semin Respir Crit Care Med. 2007; 28 (4): 430–40.
4. Shaw M, Collins BF, Ho LA, Raghu G. Rheumatoid arthritis-associated lung disease. Eur Respir Rev. 2015; 24 (135): 1–16.
5. Bluett J, Jani M, Symmons DPM. Practical Management of Respiratory Comorbidities in Patients with Rheumatoid Arthritis. Rheumatol Ther. 2017; 4 (2): 309–2.
6. Rosa DJ, Paula EA, Bonfante HLM, et al. Accelerated nodulosis in rheumatoid arthritis during Leflunomide therapy [Article in Portuguese]. Rev Bras Reumatol. 2007; 47 (3): 228–231.
7. van Ede A, den Broeder A, Wagenaar M, et al. Etanercept-related extensive pulmonary nodulosis in a patient with rheumatoid arthritis. J Rheumatol. 2007; 34 (7): 1590–2.
8. Yousem SA, Colby TV, Carrington CB. Lung biopsy in rheumatoid arthritis. Am Rev Respir Dis. 1985; 131 (5): 770–7.
9. Hull S, Mathews JA. Pulmonary necrobiotic nodules as a presenting feature of rheumatoid arthritis. Ann Rheumat Dis. 1982: 41 (1).
10. Akiyama N, Toyoshima M, Kono M et al. Methotrexate-induced accelerated pulmonary nodulosis. Am J Respir Critical Care Med. 2015; 192 (2): 252–3.
11 Yoshikawa GT, Dias GADS, Fujihara S et al. Formation of multiple pulmonary nodules during treatment with leflunomide. Jornal Brasileiro de Pneumologia. 2015; 41 (3): 281–284.
12. Kellet CV, Navarrete RA, Bombardieri SG, Manriquez J. Azathioprine-induced accelerated cutaneous and pulmonary nodulosis in a patient with rheumatoid arthritis. Anais Brasil Dermatol. 2015; 90 (1): 162–4.
13. Rossella Talotta R, Atzeni F, Batticciotto A. Accelerated subcutaneous nodulosis in patients with rheumatoid arthritis treated with tocilizumab: a case series. J Med Case Reports. 2018; (12): 154.
14. Sagdeo P, Gattimallanahali Y, Kakade G, Canchi B. Rheumatoid lung nodule. BMJ Case Reports. 2015; Oct 29: bcr2015213083.
15. Chirila RM, Berianu F, Abril A, Butendieck RR Jr. Extra-articular involvement of rheumatoid arthritis in three seropositive patients in the absence of initial joint involvement. Immun Inflamm Dis. 2021; 9 (4): 1613–7.
16. Karadag F, Polatli M, Senturk T et al. Cavitary necrobiotic nodule imitating malignant lung disease in a patient without articular manifestations of rheumatoid arthritis. J Clin Rheumatol. 2003; 9 (4): 246–52.
17. Aletaha D, Neogi T, Silman AJ et al. 2010 Rheumatoid arthritis classification criteria: an American College of Rheumatology/European League Against Rheumatism collaborative initiative. Arthritis Rheum. 2010; 62 (9): 2569–81.
18. Anderson JK, Zimmerman L, Caplan L, Michaud K. Measures of rheumatoid arthritis disease activity: Patient (PtGA) and Provider (PrGA) Global Assessment of Disease Activity, Disease Activity Score (DAS) and Disease Activity Score with 28-Joint Counts (DAS28), Simplified Disease Activity Index (SDAI), Clinical Disease Activity Index (CDAI), Patient Activity Score (PAS) and Patient Activity Score-II (PASII), Routine Assessment of Patient Index Data (RAPID), Rheumatoid Arthritis Disease Activity Index (RADAI) and Rheumatoid Arthritis Disease Activity Index-5 (RADAI-5), Chronic Arthritis Systemic Index (CASI), Patient-Based Disease Activity Score With ESR (PDAS1) and Patient-Based Disease Activity Score without ESR (PDAS2), and Mean Overall Index for Rheumatoid Arthritis (MOI-RA). Arthritis Care Res (Hoboken). 2011; 63 (Suppl. 11): S14–36.
19. Andres M, Vela P, Romera C. Marked improvement of lung rheumatoid nodules after treatment with tocilizumab. Rheumatology. 2012; 51 (6): 1132–4.
20. Kim SH, Yoo WH. Recurrent pneumothorax associated with pulmonary nodules after leflunomide therapy in rheumatoid arthritis: a case report and review of the literature. Rheumatol Int. 2011 Jul; 31 (7): 919–22.
21. Wickrematilake G. Complicated Rheumatoid Nodules in Lung. Case Rep Rheumatol. 2020; 2020: 6627244.
22. Shimomura M, Ishihara S, Iwasaki M. Intractable pneumothorax due to rupture of subpleural rheumatoid nodules: a case report. Surg Case Rep. 2018; 4 (1): 89.
23. Chaudhry AA, Gul M, Chaudhry AA, Moore W. Case 238: Spontaneous Pneumothorax Secondary to Intrapulmonary Necrobiotic Rheumatoid Nodule. Radiology. 2017; 282 (2): 602–8.
23. Ревматоидный артрит. Клинические рекомендации Минздрава России. М., 2021.
Rheumatoid arthritis. Clinical recommendations of the Ministry of Health of Russia. Moscow, 2021 (in Russian).


