Клинический разбор в общей медицине №8 2023
Olga V. Nikolaenko
Ural State Medical University, Ekaterinburg, Russia
nadeyulya@yandex.ru
Abstract
Relevance. Today, the search for biomarkers capable of predicting the duration of rehabilitation after CABG in patients with CAD is relevant.
Aim. To assess the features of the left cardiac chamber remodeling with regard to the levels of NT-proBNP and galectin-3 in patients with CAD after CABG.
Methods. The study involved 100 males with CAD, who underwent CABG. Group 1 included 58 patients, who started working within 4 months after intervention. Group 2 included 42 patients, whose rehabilitation period exceeded 4 months. Echocardiography was performed in all patients, the levels of galectin-3, NT-proBNP were determined 1 and 4 months after CABG.
Results. Assessment of the LV remodeling variants 1 month after CABG showed that hypertrophic variants of remodeling prevailed in group 2, while in group 1 these were reported less than in half of the cases. The increase in the rate of unfavorable LV remodeling variants by month 4 was observed in group 2. Initial comparison showed that the galectin-3 and NT-proBNP levels in group 2 were significantly higher than that in group 1 (17.95 (17.2÷19.3) vs. 11.35 (8.2÷14.7) ng/mL, p<0.01 and 372 (320.3÷445) vs. 287.5 (232.5÷391.3) pg/mL, p<0.01, respectively). These indicators showed no upward trend by month 4 in group 1, while in group 2 a significant increase in the levels of galectin-3 and NT-proBNP was reported. Positive correlations of varying strength between the galectin-l levels and the LV remodeling types, NT-proBNP levels and the LV remodeling types were revealed in both groups.
Discussion. The association of high marker (galectin-3 and NT-proBNP) levels with unfavorable LV remodeling types in the group with prolonged recovery was demonstrated during the study. The studied markers are proxy indicators for the processes underlying maladaptive morphofunctional remodeling of myocardium resulting in myocardial dysfunction, which can be the cause of prolonged recovery after the CABG surgery.
Conclusions. The correlations revealed can have clinical significance for early detection of LV remodeling in patients with CAD associated with prolonged recovery after CABG.
Key words: galectin-3, brain natriuretic peptide, coronary artery bypass grafting, remodeling.
For citation: Styazhkina Yu.A., Grishina I.F., Poletaeva N.B., Peretolchina T.F., Nikolaenko O.V. Relationship of galectin-3 and brain natriouretic peptide levels with the type of left ventricle remodeling in patients with coronary heart disease after coronary arto bypass graft. Clinical review for general practice. 2023; 4 (8): 68–73 (In Russ.). DOI: 10.47407/kr2023.4.8.00333
Одним из маркеров ремоделирования миокарда считается NT-proBNP, вырабатываемый камерами сердца в ответ на объемную перегрузку. На современном этапе уровень NT-proBNP используется при скрининге бессимптомной дисфункции желудочков сердца, для определения диагноза, прогноза и эффективности терапии при хронической сердечной недостаточности [4]. Однако имеются сведения, что уровень NT-proBNP может повышаться у больных с ИБС в результате систолической дисфункции и гибели кардиомиоцитов, потому данный показатель достаточно широко изучается в качестве предиктора смертности при инфаркте миокарда [5–8]. Но, несмотря на потенциальную важность параметра, до настоящего времени нет единого мнения, может ли данный маркер выступать также в качестве критерия эффективности проводимых реабилитационных мероприятий у пациентов с ИБС после АКШ [9].
Другой биохимический маркер – галектин-3, синтезируемый фибробластами миокарда и обладающий доказанным профибротическим эффектом, приводящим к ремоделированию миокарда, продемонстрировал в ряде работ прогностическую ценность в отношении сердечно-сосудистой и общей смертности [10, 11]. При этом сведений о возможном использовании данного показателя как предиктора эффективности кардиореабилитации в современной литературе практически нет [12]. Потому, на наш взгляд, изучение взаимосвязей неконвенционных биомаркеров NT-proBNP и галектина-3 с ремоделированием левых камер сердца у пациентов с ИБС после проведения операции АКШ с целью прогнозирования эффективности реабилитационных мероприятий на амбулаторном этапе представляет научный интерес.
Цель исследования – оценить особенности ремоделирования левых камер сердца в связи с уровнями NT-proBNP и галектина-3 у пациентов с ИБС после АКШ с различным вариантом течения восстановительного периода.
58 пациентов с установленным диагнозом ИБС, перенесших коронарное шунтирование, с быстрым восстановлением функционального состояния в ходе реабилитации и приступивших к работе через 4 мес после перенесенного оперативного вмешательства. Вторую группу составили 42 пациента с затяжным периодом восстановления, которым потребовалось продление амбулаторного этапа реабилитации на срок более 4 мес после выполнения коронарного шунтирования. Пациенты исследуемых групп были сопоставимы по возрасту, индексу массы тела (ИМТ), сопутствующей патологии, стажу курения. Клинико-функциональная характеристика исследованных больных представлена в табл. 1.
Критерии исключения из исследования: рефрактерная артериальная гипертензия, бронхиальная астма, хроническая обструктивная болезнь легких с тяжелой дыхательной недостаточностью, тяжелая печеночная или почечная недостаточность, онкологические заболевания, психические расстройства, препятствующие контакту с больными в период наблюдения.
Все пациенты получали медикаментозную терапию согласно действующим клиническим рекомендациям.
Всем пациентам проводилось эхокардиографическое исследование левых камер сердца, определения уровня галектина-3, NT-proBNP в сыворотке крови методом иммуноферментного анализа через 1 и 4 мес после перенесенного АКШ.
Ремоделирование миокарда левого желудочка (ЛЖ) оценивали в соответствии с классификацией Ganau [13]. Индекс массы миокарда левого желудочка (ИММЛЖ) рассчитывали по формуле: ИММЛЖ= ММЛЖ/ППТ тела (г/м²) [14]. Нормальными признавались значения ИММЛЖ≤95 г/м2. Относительная толщина стенки левого желудочка (ОТС ЛЖ) определялась по формуле: ОТС=(ТМЖПд+ТЗСд)/КДРЛЖ [14]. У пациентов с нормальными значениями показателя ИММЛЖ определялись следующие типы ремоделирования ЛЖ: нормальная геометрия (НГ) ЛЖ – при ОТС≤0,42; КР ЛЖ – при ОТС более 0,42. У пациентов со значениями ИММЛЖ выше нормальных выделяли два типа ремоделирования: в случае, если значение ОТС ЛЖ превышало 0,42, то верифицировали концентрическую гипертрофию (КГ) ЛЖ, если значение ОТС ЛЖ было менее 0,42 – эксцентрическую гипертрофию (ЭГ) ЛЖ [13].
Статистический анализ проводили с помощью пакета программ IBM SPSS v.26, Microsoft Excel 2016. Нормально распределенные данные представлены в виде M±SD, при распределении отличном от нормального – в виде Me (25–75%). Различия между группами по количественным показателям оценивали с использованием критерия Манна–Уитни, по качественным показателям – с помощью критерия χ2 Пирсона. Внутригрупповые различия типов ремоделирования через 4 мес оценивали с помощью критерия χ2 МакНемара. Динамика уровней биомаркеров оценивалась посредством расчета критерия Вилкоксона. Корреляционный анализ выполнен с помощью критерия Спирмена. Сила корреляций оценивалась по шкале Чеддока. За порог статистической значимости различий переменных принимали p<0,05. Протокол исследования одобрен локальным этическим комитетом ФГБОУ ВО УГМУ Минздрава России.
В отличие от группы 1 в группе затяжного восстановления нормальная геометрия встречалась лишь у 4,8% больных (2 человека), концентрическое ремоделирование – 21,4% (9 пациентов), преимущественным типом ремоделирования являлась концентрическая гипертрофия, которая была выявлена в 40,5% (17 пациентов) к 1-му месяцу наблюдения, чуть реже диагностировалась эксцентрическая гипертрофия – 33,3% (14 пациентов) (χ2=14,4, р=0,003) (рис. 1, 2).
Таким образом, было показано, что уже на начальном этапе наблюдения в группе с затяжным течением реабилитации преобладают гипертрофические варианты ремоделирования ЛЖ, в то время как в группе с быстрым восстановлением они встречаются меньше чем в 1/2 случаев (χ2=4,5, р=0,032).
К 4-му месяцу наблюдения в группе быстрого восстановления доля пациентов с различными типами ремоделирования статистически значимо не изменилась в сравнении с первым месяцем: НГ отмечалась у 13 пациентов (22,4%), КР – у 20 (34,5%), КГ – у 21 (36,2%) пациента и ЭГ – у 4 (6,9%) пациентов (χ2=0,504, р=0,478) (см. рис. 1, 2). Тогда как во 2-й группе к этому периоду количество пациентов с КГ статистически значимо возросло до 54,8% (23 пациента) за счет уменьшения доли пациентов с концентрическим ремоделированием с 21,4% (9 пациентов) до 7,1% (3 пациентов) (χ2=18,06, p<0,001). Таким образом, мы продолжили наблюдать рост прогностически неблагоприятных вариантов ремоделирования ЛЖ в группе позднего восстановления к 4-му месяцу реабилитации после АКШ (см. рис. 1, 2).
На следующем этапе работы было проведено сравнение уровней галектина-3 и NT-proBNP у пациентов исследуемых групп через 1 и 4 мес после АКШ (табл. 2.)
При первичном сравнении уровни галектина-3 и NT-proBNP в группе позднего восстановления достоверно превышали уровни в группе раннего восстановления (p=0,0001 и p=0,002 соответственно). Более высокие показатели галектина-3 и NT-proBNP у данной категории лиц уже на начальном этапе, на наш взгляд, свидетельствуют в пользу вероятного сочетания снижения эластичности и податливости стенок сердца в результате тканевой перестройки миокарда под действием профиброгенных факторов с объемной перегрузкой ЛЖ, что может приводить к развитию как диастолической, так и систолической дисфункции у данных больных.
К 4-му месяцу наблюдения в 1-й группе показатели галектина-3 и NT-proBNP имели стабильный характер без динамики к росту (p=0,538 и p=0,923 соответственно), тогда как у пациентов в группе 2 отмечался статистически значимый рост значений галектина-3 с 17,95 до 19,19 нг/мл и показателей NT-proBNP с 372 до 460 пг/мл (p=0,013 и р=0,011 соответственно), что может указывать на прогрессирование миокардиальной дисфункции, несмотря на проводимое лечение.
Далее мы попытались установить наличие взаимосвязей между уровнями биомаркеров и типами геометрии ЛЖ.
Расчет коэффициента корреляции Спирмена между уровнем галектина-3 и типами ремоделирования ЛЖ продемонстрировал в группе 1 слабую положительную корреляционную связь в 1 и 4 мес: 0,312 (p<0,05) и 0,296 (p<0,05) соответственно, в группе 2 – положительную умеренную связь в 1 мес и высокую в 4 мес: 0,496 (p<0,01) и 0,819 (p<0,01) соответственно. По всей вероятности, в связи с успешным восстановлением реперфузии, в группе 1 не наблюдалось значимого влияния галектина-3, тогда как в группе 2 роль его возрастала с течением времени, что могло косвенно указывать на активность хронического воспаления и продолжающиеся фибропластические процессы в миокарде на фоне ишемии, выступающие причиной затяжного восстановительного периода после АКШ.
При расчете коэффициента корреляции в группе быстрого восстановления была продемонстрирована заметная положительная связь между уровнем
NT-proBNP и типом ремоделирования ЛЖ в 1-й и 4-й месяц наблюдения: Rs=0,524 (p<0,01) и 0,586 (p<0,01) соответственно. У пациентов группы 2 выявленные корреляции между вышеприведенными параметрами демонстрировали умеренную и высокую положительную связь: Rs=0,681 (p<0,01) и 0,712 (p<0,01) через 1 и 4 мес соответственно.
Таким образом, полученные данные, на наш взгляд, указывают на воздействие объемной перегрузки на ЛЖ, а также возможного ряда других факторов, таких как неполное восстановление коронарной перфузии после АКШ, длительность ИБС, нейрогуморальный фон, некоторые аспекты проведения самой процедуры шунтирования. При этом влияние более значимо в группе позднего восстановления, что, по-нашему мнению, подтверждается более тесной связью между неблагоприятными типами ремоделирования ЛЖ и величиной
изучаемых маркеров.
Известно, что галектин‑3 – представитель семейства β-галактозидсвязывающих белков – прямой участник процессов воспаления и фиброза за счет стимуляции пролиферации фибробластов и выработки коллагена в экстрацеллюлярном матриксе миокарда, что является ключевым процессом в дезадаптивном ремоделировании сердца [15, 16]. Многочисленные исследования подтверждают связь галектина-3 и ремоделирования на животных моделях [17]. De Boer и соавт. были одними из первых, кто оценил потенциальную ценность галектина-3 в качестве диагностического маркера сердечной недостаточности в контексте кардиального ремоделирования в человеческой популяции [15]. В нашем исследовании у пациентов 2-й группы рост гипертрофических вариантов ремоделирования тесно соотносился с увеличением показателей галектина-3 к 4-му месяцу наблюдения, что, на наш взгляд, указывает на ценность последнего в качестве дополнительного маркера диагностики и прогноза ремоделирования сердечной мышцы.
Другой изучаемый нами маркер – NT-proBNP секретируется кардиомиоцитами в ответ на растяжение миокарда в результате возрастающей объемной перегрузки, миокардиальной гипоксии, а также нейроэндокринной стимуляции (воздействия катехоламинов, ангиотензина-2, эндотелина) [18, 19].
Повышение уровня NT-proBNP в плазме при ИБС является частью компенсаторного механизма адаптации к объемной перегрузке, которая может быть следствием снижения сократительной способности миокарда. В результате действия NT-proBNP снижается системная и почечная вазоконстрикция, уменьшается объем внеклеточной жидкости и натрия за счет угнетения ренин-ангиотензин-альдостероновой системы (РААС), что приводит к уменьшению пред- и постнагрузки на сердце и предотвращает процессы кардиоваскулярного ремоделирования [20]. Однако длительно существующая перегрузка объемом, наряду с, вероятно, сохраняющейся ишемией и гибернацией миокарда, действием РААС, приводит к структурной перестройке миокарда в виде удлинения и «урежения» сократительных кардиомиоцитов, формированию эксцентрической гипертрофии и декомпенсации механизма гетерометрической регуляции, тем самым замыкая «порочный круг». Вероятно, описанные патогенетические механизмы имеют место быть и у наших пациентов с затяжным периодом восстановления после АКШ.
Таким образом, выраженность участия тех или иных патогенетических механизмов ремоделирования камер сердца у пациентов с хронической ИБС обусловливает гетерогенность изучаемой группы. У ряда пациентов, несмотря на проведенное АКШ, можно ожидать дальнейший рост гипертрофии миокарда ЛЖ с повышением его жесткости, в совокупности приводящих к декомпенсации и прогрессированию хронической сердечной недостаточности. Нами предполагается, что для этой категории пациентов требуется особый подход к процедуре кардиореабилитации с расширением сроков и объема лечебного пособия. Подобные выводы согласуются с мнением других авторов [20], которые отмечают, что в ряде случаев функциональное восстановление после АКШ у пациентов остается не полным или замедленным и может варьировать от нескольких месяцев до года.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflicts of interests. The authors declare no conflicts of interests.
Источник финансирования. Авторы заявляют об отсутствии внешнего финансирования при проведении исследования.
Funding source. This study was not supported by any external sources of funding.
Этическая экспертиза. Исследование одобрено локальным этическим комитетом.
Ethics approval. The study complies is approved by the local ethics committee.
Информированное согласие получено у всех участников исследования.
Informed consent was obtained from all study participants.
Информация об авторах
Information about the authors
Стяжкина Юлия Александровна – ассистент каф. поликлинической терапии, ультразвуковой и функциональной диагностики, ФГБОУ ВО «Уральский государственный медицинский университет». E-mail: nadeyulya@yandex.ru; ORCID: 0009-0008-6259-4592
Yulia A. Styazhkina – Assistant, Ural State Medical University. E-mail: nadeyulya@yandex.ru; ORCID: 0009-0008-6259-4592
Гришина Ирина Федоровна – д-р мед. наук, проф., зав. каф. поликлинической терапии, ультразвуковой и функциональной диагностики, ФГБОУ ВО «Уральский государственный медицинский университет». E-mail: grishif@mail.ru; ORCID: 0009-0005-8643-1825
Irina F. Grishina – Dr. Sci. (Med.), Prof., Ural State Medical University. E-mail: grishif@mail.ru; ORCID: 0009-0005-8643-1825
Перетолчина Татьяна Федоровна – д-р мед. наук, проф., зав. каф. профилактической и семейной медицины, ФГБОУ ВО «Уральский государственный медицинский университет». E-mail: estvmed2011@mail.ru; ORCID: 0009-0001-5289-9711
Tatyana F. Peretolchina – Dr. Sci. (Med.), Prof., Ural State Medical University. E-mail: estvmed2011@mail.ru; ORCID:0009-0001-5289-9711
Полетаева Нина Борисовна – канд. мед. наук, доц. каф. поликлинической терапии, ультразвуковой и функциональной диагностики, ФГБОУ ВО «Уральский государственный медицинский университет». E-mail: ninanova@mail.ru; ORCID: 0000-0001-7674-2893
Nina B. Poletaeva – Cand. Sci. (Med.), Ural State Medical University. E-mail: ninanova@mail.ru; ORCID: 0000-0001-7674-2893
Николаенко Ольга Владимировна – канд. мед. наук, доц. каф. поликлинической терапии, ультразвуковой и функциональной диагностики, ФГБОУ ВО «Уральский государственный медицинский университет». E-mail: nickol4@yandex.ru; ORCID: 0000-0003-2364-6085
Olga V. Nikolaenko – Cand. Sci. (Med.), Ural State Medical University. E-mail: nickol4@yandex.ru; ORCID:0000-0003-2364-6085
Поступила в редакцию: 16.11.2023
Поступила после рецензирования: 17.11.2023
Принята к публикации: 23.11.2023
Received: 16.11.2023
Revised: 17.11.2023
Accepted: 23.11.2023
Клинический разбор в общей медицине №8 2023
Связь уровней галектина-3 и мозгового натрийуретического пептида с типом ремоделирования левого желудочка у пациентов с ишемической болезнью сердца после аорто-коронарного шунтирования
Номера страниц в выпуске:68-73
Аннотация
Актуальность. На сегодняшний день является актуальным поиск биомаркеров, способных прогнозировать у пациентов с ишемической болезнью сердца (ИБС) после аортокоронарного шунтирования (АКШ) длительность реабилитационного периода.
Цель исследования. Оценить особенности ремоделирования левых камер сердца в связи с уровнями NT-proBNP и галектина-3 у пациентов с ИБС после АКШ.
Материалы и методы. В исследование включено 100 мужчин с ИБС после АКШ. В группу 1 вошли 58 пациентов, приступивших к работе в течение 4 мес после вмешательства. В группу 2 вошли 42 пациента с периодом реабилитации более 4 мес. Всем пациентам проведена эхокардиография, определены уровни галектина-3, NT-proBNP через 1 и 4 мес после перенесенного АКШ.
Результаты. При оценке вариантов ремоделирования миокарда левого желудочка (ЛЖ) через 1 мес после АКШ в группе 2 преобладали гипертрофические варианты ремоделирования, в то время как в группе 1 они встречались меньше чем в 1/2 случаев. К 4-му месяцу отмечался рост неблагоприятных вариантов ремоделирования ЛЖ в группе 2. При первичном сравнении уровни галектина-3 и
NT-proBNP в группе 2 достоверно превышали уровни в группе 1 [17,95 (17,2–19,3) против 11,35 (8,2–14,7) нг/мл, p<0,01 и 372 (320,3–445) против 287,5 (232,5–391,3) пг/мл (p<0,01) соответственно]. К 4-му месяцу наблюдения в группе 1 эти показатели не имели динамики к росту, тогда как в группе 2 отмечался статистически значимый прирост галектина-3 и NT-proBNP. Выявлены положительные корреляции различной силы между уровнем галектина-3 и типами ремоделирования ЛЖ, уровнем NT-proBNP и типом ремоделирования ЛЖ в обеих группах.
Обсуждение. В ходе исследования была показана связь высоких уровней маркеров галектина-3 и NT-proBNP с неблагоприятными типами ремоделирования ЛЖ в группе затяжного восстановления. Изучаемые маркеры косвенно отражают процессы дезадаптивной морфофункциональной перестройки миокарда, приводящие к его дисфункции, что может обусловливать затяжное восстановление после операции АКШ.
Выводы. Установленные взаимосвязи могут иметь клиническое значение для раннего выявления ремоделирования ЛЖ у пациентов с ИБС, ассоциированного с затяжным восстановлением после АКШ.
Ключевые слова: галектин-3, мозговой натрийуретический пептид, аортокоронарное шунтирование, ремоделирование.
Для цитирования: Стяжкина Ю.А., Гришина И.Ф., Перетолчина Т.Ф., Полетаева Н.Б., Николаенко О.В. Связь уровней галектина-3 и мозгового натрийуретического пептида с типом ремоделирования левого желудочка у пациентов с ишемической болезнью сердца после аорто-коронарного шунтирования. Клинический разбор в общей медицине. 2023; 4 (8): 68–73. DOI: 10.47407/kr2023.4.8.00333
Актуальность. На сегодняшний день является актуальным поиск биомаркеров, способных прогнозировать у пациентов с ишемической болезнью сердца (ИБС) после аортокоронарного шунтирования (АКШ) длительность реабилитационного периода.
Цель исследования. Оценить особенности ремоделирования левых камер сердца в связи с уровнями NT-proBNP и галектина-3 у пациентов с ИБС после АКШ.
Материалы и методы. В исследование включено 100 мужчин с ИБС после АКШ. В группу 1 вошли 58 пациентов, приступивших к работе в течение 4 мес после вмешательства. В группу 2 вошли 42 пациента с периодом реабилитации более 4 мес. Всем пациентам проведена эхокардиография, определены уровни галектина-3, NT-proBNP через 1 и 4 мес после перенесенного АКШ.
Результаты. При оценке вариантов ремоделирования миокарда левого желудочка (ЛЖ) через 1 мес после АКШ в группе 2 преобладали гипертрофические варианты ремоделирования, в то время как в группе 1 они встречались меньше чем в 1/2 случаев. К 4-му месяцу отмечался рост неблагоприятных вариантов ремоделирования ЛЖ в группе 2. При первичном сравнении уровни галектина-3 и
NT-proBNP в группе 2 достоверно превышали уровни в группе 1 [17,95 (17,2–19,3) против 11,35 (8,2–14,7) нг/мл, p<0,01 и 372 (320,3–445) против 287,5 (232,5–391,3) пг/мл (p<0,01) соответственно]. К 4-му месяцу наблюдения в группе 1 эти показатели не имели динамики к росту, тогда как в группе 2 отмечался статистически значимый прирост галектина-3 и NT-proBNP. Выявлены положительные корреляции различной силы между уровнем галектина-3 и типами ремоделирования ЛЖ, уровнем NT-proBNP и типом ремоделирования ЛЖ в обеих группах.
Обсуждение. В ходе исследования была показана связь высоких уровней маркеров галектина-3 и NT-proBNP с неблагоприятными типами ремоделирования ЛЖ в группе затяжного восстановления. Изучаемые маркеры косвенно отражают процессы дезадаптивной морфофункциональной перестройки миокарда, приводящие к его дисфункции, что может обусловливать затяжное восстановление после операции АКШ.
Выводы. Установленные взаимосвязи могут иметь клиническое значение для раннего выявления ремоделирования ЛЖ у пациентов с ИБС, ассоциированного с затяжным восстановлением после АКШ.
Ключевые слова: галектин-3, мозговой натрийуретический пептид, аортокоронарное шунтирование, ремоделирование.
Для цитирования: Стяжкина Ю.А., Гришина И.Ф., Перетолчина Т.Ф., Полетаева Н.Б., Николаенко О.В. Связь уровней галектина-3 и мозгового натрийуретического пептида с типом ремоделирования левого желудочка у пациентов с ишемической болезнью сердца после аорто-коронарного шунтирования. Клинический разбор в общей медицине. 2023; 4 (8): 68–73. DOI: 10.47407/kr2023.4.8.00333
Relationship of galectin-3 and brain natriouretic peptide levels with the type of left ventricle remodeling in patients with coronary heart disease after coronary arto bypass graft
Yulia A. Styazhkina, Irina F. Grishina, Tatyana F. Peretolchina, Nina B. Poletaeva,Olga V. Nikolaenko
Ural State Medical University, Ekaterinburg, Russia
nadeyulya@yandex.ru
Abstract
Relevance. Today, the search for biomarkers capable of predicting the duration of rehabilitation after CABG in patients with CAD is relevant.
Aim. To assess the features of the left cardiac chamber remodeling with regard to the levels of NT-proBNP and galectin-3 in patients with CAD after CABG.
Methods. The study involved 100 males with CAD, who underwent CABG. Group 1 included 58 patients, who started working within 4 months after intervention. Group 2 included 42 patients, whose rehabilitation period exceeded 4 months. Echocardiography was performed in all patients, the levels of galectin-3, NT-proBNP were determined 1 and 4 months after CABG.
Results. Assessment of the LV remodeling variants 1 month after CABG showed that hypertrophic variants of remodeling prevailed in group 2, while in group 1 these were reported less than in half of the cases. The increase in the rate of unfavorable LV remodeling variants by month 4 was observed in group 2. Initial comparison showed that the galectin-3 and NT-proBNP levels in group 2 were significantly higher than that in group 1 (17.95 (17.2÷19.3) vs. 11.35 (8.2÷14.7) ng/mL, p<0.01 and 372 (320.3÷445) vs. 287.5 (232.5÷391.3) pg/mL, p<0.01, respectively). These indicators showed no upward trend by month 4 in group 1, while in group 2 a significant increase in the levels of galectin-3 and NT-proBNP was reported. Positive correlations of varying strength between the galectin-l levels and the LV remodeling types, NT-proBNP levels and the LV remodeling types were revealed in both groups.
Discussion. The association of high marker (galectin-3 and NT-proBNP) levels with unfavorable LV remodeling types in the group with prolonged recovery was demonstrated during the study. The studied markers are proxy indicators for the processes underlying maladaptive morphofunctional remodeling of myocardium resulting in myocardial dysfunction, which can be the cause of prolonged recovery after the CABG surgery.
Conclusions. The correlations revealed can have clinical significance for early detection of LV remodeling in patients with CAD associated with prolonged recovery after CABG.
Key words: galectin-3, brain natriuretic peptide, coronary artery bypass grafting, remodeling.
For citation: Styazhkina Yu.A., Grishina I.F., Poletaeva N.B., Peretolchina T.F., Nikolaenko O.V. Relationship of galectin-3 and brain natriouretic peptide levels with the type of left ventricle remodeling in patients with coronary heart disease after coronary arto bypass graft. Clinical review for general practice. 2023; 4 (8): 68–73 (In Russ.). DOI: 10.47407/kr2023.4.8.00333
Введение
В настоящее время аортокоронарное шунтирование (АКШ) является одним из эффективных методов лечения ишемической болезни сердца (ИБС), позволяющих снизить вероятность развития сердечно-сосудистых осложнений, существенно повысить качество жизни пациентов [1]. В ряде эпидемиологических исследований имеются свидетельства о вариабельности течения восстановительного периода после АКШ у пациентов с ИБС, при том, что существенная роль в этом процессе отводится степени выраженности миокардиальной недостаточности и ремоделированию левых камер сердца [2, 3].Одним из маркеров ремоделирования миокарда считается NT-proBNP, вырабатываемый камерами сердца в ответ на объемную перегрузку. На современном этапе уровень NT-proBNP используется при скрининге бессимптомной дисфункции желудочков сердца, для определения диагноза, прогноза и эффективности терапии при хронической сердечной недостаточности [4]. Однако имеются сведения, что уровень NT-proBNP может повышаться у больных с ИБС в результате систолической дисфункции и гибели кардиомиоцитов, потому данный показатель достаточно широко изучается в качестве предиктора смертности при инфаркте миокарда [5–8]. Но, несмотря на потенциальную важность параметра, до настоящего времени нет единого мнения, может ли данный маркер выступать также в качестве критерия эффективности проводимых реабилитационных мероприятий у пациентов с ИБС после АКШ [9].
Другой биохимический маркер – галектин-3, синтезируемый фибробластами миокарда и обладающий доказанным профибротическим эффектом, приводящим к ремоделированию миокарда, продемонстрировал в ряде работ прогностическую ценность в отношении сердечно-сосудистой и общей смертности [10, 11]. При этом сведений о возможном использовании данного показателя как предиктора эффективности кардиореабилитации в современной литературе практически нет [12]. Потому, на наш взгляд, изучение взаимосвязей неконвенционных биомаркеров NT-proBNP и галектина-3 с ремоделированием левых камер сердца у пациентов с ИБС после проведения операции АКШ с целью прогнозирования эффективности реабилитационных мероприятий на амбулаторном этапе представляет научный интерес.
Цель исследования – оценить особенности ремоделирования левых камер сердца в связи с уровнями NT-proBNP и галектина-3 у пациентов с ИБС после АКШ с различным вариантом течения восстановительного периода.
Материалы и методы
Исследование проведено на базе Областного центра медицинской реабилитации «Озеро Чусовское» (г. Екатеринбург) в период с 2018 по 2022 г. В анализ было включено 100 лиц мужского пола трудоспособного возраста с ИБС, перенесших операцию АКШ, подписавших информированное согласие на участие в исследовании. Согласно длительности восстановительного периода после операции АКШ все участники ретроспективно были разделены на две группы. В 1-ю группу вошли58 пациентов с установленным диагнозом ИБС, перенесших коронарное шунтирование, с быстрым восстановлением функционального состояния в ходе реабилитации и приступивших к работе через 4 мес после перенесенного оперативного вмешательства. Вторую группу составили 42 пациента с затяжным периодом восстановления, которым потребовалось продление амбулаторного этапа реабилитации на срок более 4 мес после выполнения коронарного шунтирования. Пациенты исследуемых групп были сопоставимы по возрасту, индексу массы тела (ИМТ), сопутствующей патологии, стажу курения. Клинико-функциональная характеристика исследованных больных представлена в табл. 1.

Критерии исключения из исследования: рефрактерная артериальная гипертензия, бронхиальная астма, хроническая обструктивная болезнь легких с тяжелой дыхательной недостаточностью, тяжелая печеночная или почечная недостаточность, онкологические заболевания, психические расстройства, препятствующие контакту с больными в период наблюдения.
Все пациенты получали медикаментозную терапию согласно действующим клиническим рекомендациям.
Всем пациентам проводилось эхокардиографическое исследование левых камер сердца, определения уровня галектина-3, NT-proBNP в сыворотке крови методом иммуноферментного анализа через 1 и 4 мес после перенесенного АКШ.
Ремоделирование миокарда левого желудочка (ЛЖ) оценивали в соответствии с классификацией Ganau [13]. Индекс массы миокарда левого желудочка (ИММЛЖ) рассчитывали по формуле: ИММЛЖ= ММЛЖ/ППТ тела (г/м²) [14]. Нормальными признавались значения ИММЛЖ≤95 г/м2. Относительная толщина стенки левого желудочка (ОТС ЛЖ) определялась по формуле: ОТС=(ТМЖПд+ТЗСд)/КДРЛЖ [14]. У пациентов с нормальными значениями показателя ИММЛЖ определялись следующие типы ремоделирования ЛЖ: нормальная геометрия (НГ) ЛЖ – при ОТС≤0,42; КР ЛЖ – при ОТС более 0,42. У пациентов со значениями ИММЛЖ выше нормальных выделяли два типа ремоделирования: в случае, если значение ОТС ЛЖ превышало 0,42, то верифицировали концентрическую гипертрофию (КГ) ЛЖ, если значение ОТС ЛЖ было менее 0,42 – эксцентрическую гипертрофию (ЭГ) ЛЖ [13].
Статистический анализ проводили с помощью пакета программ IBM SPSS v.26, Microsoft Excel 2016. Нормально распределенные данные представлены в виде M±SD, при распределении отличном от нормального – в виде Me (25–75%). Различия между группами по количественным показателям оценивали с использованием критерия Манна–Уитни, по качественным показателям – с помощью критерия χ2 Пирсона. Внутригрупповые различия типов ремоделирования через 4 мес оценивали с помощью критерия χ2 МакНемара. Динамика уровней биомаркеров оценивалась посредством расчета критерия Вилкоксона. Корреляционный анализ выполнен с помощью критерия Спирмена. Сила корреляций оценивалась по шкале Чеддока. За порог статистической значимости различий переменных принимали p<0,05. Протокол исследования одобрен локальным этическим комитетом ФГБОУ ВО УГМУ Минздрава России.
Результаты
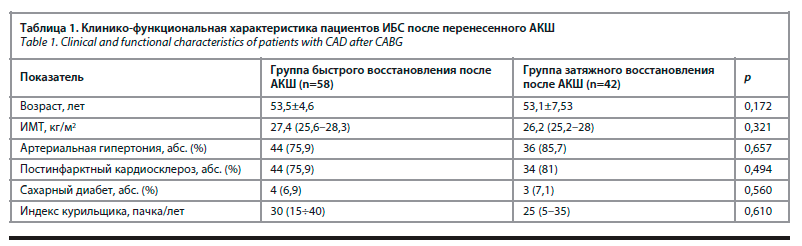
При оценке морфометрических вариантов ремоделирования миокарда ЛЖ у пациентов группы быстрого восстановления работоспособности установлено, что к 1-му месяцу после АКШ нормальную геометрию ЛЖ имели 17,2% (10 пациентов), концентрическое ремоделирование – 36,2% (21 пациент), концентрическую гипертрофию – 39,7% наблюдений (23 пациента), эксцентрическую гипертрофию – 6,9% (4 пациента) (рис. 1.1).
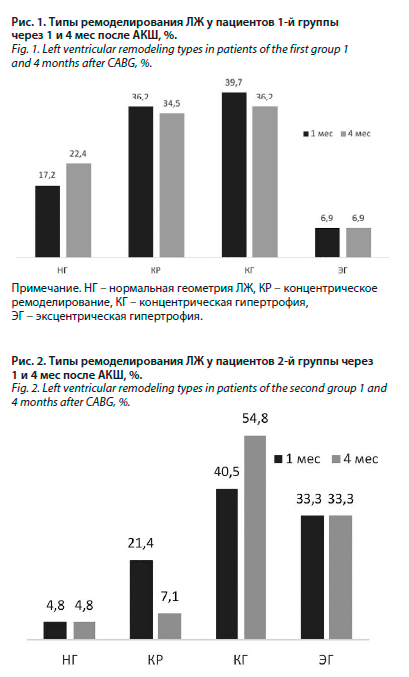
В отличие от группы 1 в группе затяжного восстановления нормальная геометрия встречалась лишь у 4,8% больных (2 человека), концентрическое ремоделирование – 21,4% (9 пациентов), преимущественным типом ремоделирования являлась концентрическая гипертрофия, которая была выявлена в 40,5% (17 пациентов) к 1-му месяцу наблюдения, чуть реже диагностировалась эксцентрическая гипертрофия – 33,3% (14 пациентов) (χ2=14,4, р=0,003) (рис. 1, 2).
Таким образом, было показано, что уже на начальном этапе наблюдения в группе с затяжным течением реабилитации преобладают гипертрофические варианты ремоделирования ЛЖ, в то время как в группе с быстрым восстановлением они встречаются меньше чем в 1/2 случаев (χ2=4,5, р=0,032).
К 4-му месяцу наблюдения в группе быстрого восстановления доля пациентов с различными типами ремоделирования статистически значимо не изменилась в сравнении с первым месяцем: НГ отмечалась у 13 пациентов (22,4%), КР – у 20 (34,5%), КГ – у 21 (36,2%) пациента и ЭГ – у 4 (6,9%) пациентов (χ2=0,504, р=0,478) (см. рис. 1, 2). Тогда как во 2-й группе к этому периоду количество пациентов с КГ статистически значимо возросло до 54,8% (23 пациента) за счет уменьшения доли пациентов с концентрическим ремоделированием с 21,4% (9 пациентов) до 7,1% (3 пациентов) (χ2=18,06, p<0,001). Таким образом, мы продолжили наблюдать рост прогностически неблагоприятных вариантов ремоделирования ЛЖ в группе позднего восстановления к 4-му месяцу реабилитации после АКШ (см. рис. 1, 2).
На следующем этапе работы было проведено сравнение уровней галектина-3 и NT-proBNP у пациентов исследуемых групп через 1 и 4 мес после АКШ (табл. 2.)

При первичном сравнении уровни галектина-3 и NT-proBNP в группе позднего восстановления достоверно превышали уровни в группе раннего восстановления (p=0,0001 и p=0,002 соответственно). Более высокие показатели галектина-3 и NT-proBNP у данной категории лиц уже на начальном этапе, на наш взгляд, свидетельствуют в пользу вероятного сочетания снижения эластичности и податливости стенок сердца в результате тканевой перестройки миокарда под действием профиброгенных факторов с объемной перегрузкой ЛЖ, что может приводить к развитию как диастолической, так и систолической дисфункции у данных больных.
К 4-му месяцу наблюдения в 1-й группе показатели галектина-3 и NT-proBNP имели стабильный характер без динамики к росту (p=0,538 и p=0,923 соответственно), тогда как у пациентов в группе 2 отмечался статистически значимый рост значений галектина-3 с 17,95 до 19,19 нг/мл и показателей NT-proBNP с 372 до 460 пг/мл (p=0,013 и р=0,011 соответственно), что может указывать на прогрессирование миокардиальной дисфункции, несмотря на проводимое лечение.
Далее мы попытались установить наличие взаимосвязей между уровнями биомаркеров и типами геометрии ЛЖ.
Расчет коэффициента корреляции Спирмена между уровнем галектина-3 и типами ремоделирования ЛЖ продемонстрировал в группе 1 слабую положительную корреляционную связь в 1 и 4 мес: 0,312 (p<0,05) и 0,296 (p<0,05) соответственно, в группе 2 – положительную умеренную связь в 1 мес и высокую в 4 мес: 0,496 (p<0,01) и 0,819 (p<0,01) соответственно. По всей вероятности, в связи с успешным восстановлением реперфузии, в группе 1 не наблюдалось значимого влияния галектина-3, тогда как в группе 2 роль его возрастала с течением времени, что могло косвенно указывать на активность хронического воспаления и продолжающиеся фибропластические процессы в миокарде на фоне ишемии, выступающие причиной затяжного восстановительного периода после АКШ.
При расчете коэффициента корреляции в группе быстрого восстановления была продемонстрирована заметная положительная связь между уровнем
NT-proBNP и типом ремоделирования ЛЖ в 1-й и 4-й месяц наблюдения: Rs=0,524 (p<0,01) и 0,586 (p<0,01) соответственно. У пациентов группы 2 выявленные корреляции между вышеприведенными параметрами демонстрировали умеренную и высокую положительную связь: Rs=0,681 (p<0,01) и 0,712 (p<0,01) через 1 и 4 мес соответственно.
Таким образом, полученные данные, на наш взгляд, указывают на воздействие объемной перегрузки на ЛЖ, а также возможного ряда других факторов, таких как неполное восстановление коронарной перфузии после АКШ, длительность ИБС, нейрогуморальный фон, некоторые аспекты проведения самой процедуры шунтирования. При этом влияние более значимо в группе позднего восстановления, что, по-нашему мнению, подтверждается более тесной связью между неблагоприятными типами ремоделирования ЛЖ и величиной
изучаемых маркеров.
Обсуждение
Согласно результатам нашего исследования, уже на начальном этапе пациенты группы медленного восстановления после АКШ отличались от группы быстрого восстановления преобладанием гипертрофических типов ремоделирования ЛЖ, повышенными значениями уровней NT-proBNP и галектина-3. Вместе с тем в обеих группах на всех этапах наблюдения определялись ассоциации между типами ремоделирования ЛЖ и уровнями изучаемых маркеров, особенно в группе позднего восстановления, где было отмечено нарастание тесноты связи галектина-3 и NT-proBNP с типами структурной перестройки ЛЖ к 4-му месяцу реабилитации.Известно, что галектин‑3 – представитель семейства β-галактозидсвязывающих белков – прямой участник процессов воспаления и фиброза за счет стимуляции пролиферации фибробластов и выработки коллагена в экстрацеллюлярном матриксе миокарда, что является ключевым процессом в дезадаптивном ремоделировании сердца [15, 16]. Многочисленные исследования подтверждают связь галектина-3 и ремоделирования на животных моделях [17]. De Boer и соавт. были одними из первых, кто оценил потенциальную ценность галектина-3 в качестве диагностического маркера сердечной недостаточности в контексте кардиального ремоделирования в человеческой популяции [15]. В нашем исследовании у пациентов 2-й группы рост гипертрофических вариантов ремоделирования тесно соотносился с увеличением показателей галектина-3 к 4-му месяцу наблюдения, что, на наш взгляд, указывает на ценность последнего в качестве дополнительного маркера диагностики и прогноза ремоделирования сердечной мышцы.
Другой изучаемый нами маркер – NT-proBNP секретируется кардиомиоцитами в ответ на растяжение миокарда в результате возрастающей объемной перегрузки, миокардиальной гипоксии, а также нейроэндокринной стимуляции (воздействия катехоламинов, ангиотензина-2, эндотелина) [18, 19].
Повышение уровня NT-proBNP в плазме при ИБС является частью компенсаторного механизма адаптации к объемной перегрузке, которая может быть следствием снижения сократительной способности миокарда. В результате действия NT-proBNP снижается системная и почечная вазоконстрикция, уменьшается объем внеклеточной жидкости и натрия за счет угнетения ренин-ангиотензин-альдостероновой системы (РААС), что приводит к уменьшению пред- и постнагрузки на сердце и предотвращает процессы кардиоваскулярного ремоделирования [20]. Однако длительно существующая перегрузка объемом, наряду с, вероятно, сохраняющейся ишемией и гибернацией миокарда, действием РААС, приводит к структурной перестройке миокарда в виде удлинения и «урежения» сократительных кардиомиоцитов, формированию эксцентрической гипертрофии и декомпенсации механизма гетерометрической регуляции, тем самым замыкая «порочный круг». Вероятно, описанные патогенетические механизмы имеют место быть и у наших пациентов с затяжным периодом восстановления после АКШ.
Таким образом, выраженность участия тех или иных патогенетических механизмов ремоделирования камер сердца у пациентов с хронической ИБС обусловливает гетерогенность изучаемой группы. У ряда пациентов, несмотря на проведенное АКШ, можно ожидать дальнейший рост гипертрофии миокарда ЛЖ с повышением его жесткости, в совокупности приводящих к декомпенсации и прогрессированию хронической сердечной недостаточности. Нами предполагается, что для этой категории пациентов требуется особый подход к процедуре кардиореабилитации с расширением сроков и объема лечебного пособия. Подобные выводы согласуются с мнением других авторов [20], которые отмечают, что в ряде случаев функциональное восстановление после АКШ у пациентов остается не полным или замедленным и может варьировать от нескольких месяцев до года.
Заключение
В ходе исследования была показана взаимосвязь галектина-3 и NT-proBNP с типами ремоделирования ЛЖ у пациентов с ИБС после перенесенного АКШ. Установленные ассоциации могут иметь клиническое значение для раннего выявления структурно-функциональной перестройки миокарда, определения нарушения сократительного потенциала и, как следствие, миокардиальной дисфункции у пациентов с ИБС после перенесенного АКШ, а уровни галектина-3 и NT-proBNP могут быть использованы в качестве дополнительных маркеров, определяющих длительность восстановительного периода и оценки эффективности реабилитационных мероприятий, проводимых на амбулаторном этапе.Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflicts of interests. The authors declare no conflicts of interests.
Источник финансирования. Авторы заявляют об отсутствии внешнего финансирования при проведении исследования.
Funding source. This study was not supported by any external sources of funding.
Этическая экспертиза. Исследование одобрено локальным этическим комитетом.
Ethics approval. The study complies is approved by the local ethics committee.
Информированное согласие получено у всех участников исследования.
Informed consent was obtained from all study participants.
Информация об авторах
Information about the authors
Стяжкина Юлия Александровна – ассистент каф. поликлинической терапии, ультразвуковой и функциональной диагностики, ФГБОУ ВО «Уральский государственный медицинский университет». E-mail: nadeyulya@yandex.ru; ORCID: 0009-0008-6259-4592
Yulia A. Styazhkina – Assistant, Ural State Medical University. E-mail: nadeyulya@yandex.ru; ORCID: 0009-0008-6259-4592
Гришина Ирина Федоровна – д-р мед. наук, проф., зав. каф. поликлинической терапии, ультразвуковой и функциональной диагностики, ФГБОУ ВО «Уральский государственный медицинский университет». E-mail: grishif@mail.ru; ORCID: 0009-0005-8643-1825
Irina F. Grishina – Dr. Sci. (Med.), Prof., Ural State Medical University. E-mail: grishif@mail.ru; ORCID: 0009-0005-8643-1825
Перетолчина Татьяна Федоровна – д-р мед. наук, проф., зав. каф. профилактической и семейной медицины, ФГБОУ ВО «Уральский государственный медицинский университет». E-mail: estvmed2011@mail.ru; ORCID: 0009-0001-5289-9711
Tatyana F. Peretolchina – Dr. Sci. (Med.), Prof., Ural State Medical University. E-mail: estvmed2011@mail.ru; ORCID:0009-0001-5289-9711
Полетаева Нина Борисовна – канд. мед. наук, доц. каф. поликлинической терапии, ультразвуковой и функциональной диагностики, ФГБОУ ВО «Уральский государственный медицинский университет». E-mail: ninanova@mail.ru; ORCID: 0000-0001-7674-2893
Nina B. Poletaeva – Cand. Sci. (Med.), Ural State Medical University. E-mail: ninanova@mail.ru; ORCID: 0000-0001-7674-2893
Николаенко Ольга Владимировна – канд. мед. наук, доц. каф. поликлинической терапии, ультразвуковой и функциональной диагностики, ФГБОУ ВО «Уральский государственный медицинский университет». E-mail: nickol4@yandex.ru; ORCID: 0000-0003-2364-6085
Olga V. Nikolaenko – Cand. Sci. (Med.), Ural State Medical University. E-mail: nickol4@yandex.ru; ORCID:0000-0003-2364-6085
Поступила в редакцию: 16.11.2023
Поступила после рецензирования: 17.11.2023
Принята к публикации: 23.11.2023
Received: 16.11.2023
Revised: 17.11.2023
Accepted: 23.11.2023
Список исп. литературыСкрыть список1. Беленков ЮА. Ишемическая болезнь сердца как основная причина сердечной недостаточности. Сердечная недостаточность. 2004; 5 (2): 77–8.
Belenkov Yu. Coronary heart disease as the main cause of heart failure. Heart Failure. 2004; 5 (2): 77–8 (in Russian).
2. Pfeffer MA, Braunwald E. Ventricular remodeling after myocardial infarction. Experimental observations and clinical implication. Circulation. 1990; 81 (4): 1161–72.
3. Мареев В.Ю., Беленков Ю.Н., Агеев Ф.Т. и др. Первые результаты российского эпидемиологического исследования по хронической сердечной недостаточности. Сердечная недостаточность. 2003; 4 (1): 17–8.
Mareev VYu, Belenkov YN, Ageev FT et al. First results of a Russian epidemiological study on CHF. Heart failure. 2003; 4 (1): 17–8.
4. Агеев Ф.Т., Даниелян М.О., Мареев В.Ю. и др. Больные с хронической сердечной недостаточностью в российской амбулаторной практике: особенности контингента, диагностики и лечения (по материалам исследования ЭПОХА–О–ХСН). Сердечная Недостаточность. 2004; 5 (1): 4–7.
Ageev FT, Danielyan MO, Mareev VYu et al. Patients with chronic heart failure in Russian outpatient practice: features of the population, diagnosis and treatment (based on materials from the EPOCHA-O-CHF study). Heart Failure. 2004; 5 (1): 4–7.
5. Jiang H, Holm J, Friberg Ö et al. Utility of NT-proBNP as an objective marker of postoperative heart failure after coronary artery bypass surgery: a prospective observational study. Perioper Med (Lond). 2021; 10 (1): 21. DOI: 10.1186/s13741-021-00194-4
6. Чаулин А.М., Дупляков Д.В. Повышение натрийуретических пептидов, не ассоциированное с сердечной недостаточностью. Российский кардиологический журнал. 2020; 25: 4140. DOI: 10.15829/1560-4071-2020-4140
Chaulin AM, Duplyakov DV. Increased natriuretic peptides not associated with heart failure. Russ J Cardiol. 2020; 25: 4140. DOI: 10.15829/1560-4071-2020-4140
7. Mega JL, Morrow DA, De Lemos JA et al. B-type natriuretic peptide at presentation and prognosis in patients with ST-segment elevation myocardial infarction: an ENTIRE-TIMI-23 substudy. J Am Coll Cardiol. 2004; 44 (2): 335–9. DOI: 10.1016/j.jacc.2004.04.033
8. Björklund E, Jernberg T, Johanson P et al. Admission N-terminal pro-brain natriuretic peptide and its interaction with admission troponin T and ST segment resolution for early risk stratification in ST elevation myocardial infarction. Heart. 2006; 92 (6): 735–40. DOI: 10.1136/ hrt.2005.072975
9. Драпкина О.М., Дуболазова Ю.В. Применение биологических маркеров в диагностике диастолической сердечной недостаточности. Журнал сердечная недостаточность. 2011; 12 (6): 364–72.
Drapkina OM, Dubolazova YuV. The use of biological markers in the diagnosis of diastolic heart failure. J Heart Failure. 2011; 12 (6): 364–72.
10. Дуболазова Ю.В. Оценка клинического течения хронической сердечной недостаточности с сохраненной фракцией выброса. Автореферат дис. ... канд. мед. наук. Дуболазова Юлия Викторовна. ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). М., 2012.
Dubolazova SE. Assessment of the clinical course of chronic heart failure with preserved ejection fraction. Abstract diss. ... Ph. D. honey. Sciences. Dubolazova Yulia Vikorovna. Sechenov First Moscow State Medical University (Sechenov University). Moscow, 2012.
11. Dumic J, Dabelic S, Flögel M. Galectin-3: An open-ended story. Biochimica et Biophysica Acta – General Subjects, 2006; 1760 (4): 616–35. DOI: 10.1016/j.bbagen.2005.12.020
12. Lopez-Andrez, Patrick Rossignol, Wafae Iraqi et al. Association of galectin-3 and fibrosis markers with long-term cardiovascular outcomes in patients with heart failure, left ventricular dysfunction and dyssynchrony: insights from CARE-HF (Cardiac Resynchronization in Heart Failure) trial. Eur J Heart Fail. 2012; 14 (1).
13. Ganau A, Devereux RB, Roman MJ et al. Patterns of left ventricular hypertrophy and geometric remodeling in essential hypertension. J Am Coll Cardiol. 1992; 19 (7): 1550–8. DOI: 10.1016/0735-1097(92)
90617-v
14. Du Bois D, Du Bois EF. A formula to estimate the approximate surface area if height and weight be known. Nutrition. 1989; 5 (5): 303–13. PMID: 2520314.
15. De Boer RA, Yu L, van Veldhuisen DJ. Galectin-3 in cardiac remodeling and heart failure. Curr Heart Fail Rep. 2010; 7 (1): 1–8. DOI: 10.1007/s11897-010-0004-x
16. Sharma UC, Pokharel S, Van Brakel TJ et al. Galectin-3 marks activated macrophages in failure-prone hypertrophied hearts and contributes to cardiac dysfunction. Circulation, 2004; 110 (19): 3121–8. DOI: 10.1161/01.CIR.0000147181.65298.4D
17. Henderson NC, Mackinnon AC, Farnworth SL et al. Galectin-3 regulates myofibroblast activation and hepatic fibrosis. Proceedings of the National Academy of Sciences of the United States of America, 2006; 103 (13): 5060–5.
18. Nakagawa Y, Nishikimi T, Kuwahara K. Atrial and brain natriuretic peptides: Hormones secreted from the heart. Peptides. 2019; 111: 18–25. DOI: 10.1016/ j.peptides.2018.05.012
19. Cao Z, Jia Y, Zhu B. BNP and NT-proBNP as Diagnostic Biomarkers for Cardiac Dysfunction in Both Clinical and Forensic Medicine. Int J Mol Sci. 2019; 20 (8): 1820. DOI: 10.3390/ijms20081820
20. Wang TJ, Larson MG, Levy D et al. Plasma natriuretic peptide levels and the risk of cardiovascular events and death. N Engl J Med. 2004; 350 (7): 655–3.


