Клинический разбор в общей медицине №8 2023
Aleksei I. Nechaev1, Yulia Yu. Vasilyeva1, Karine A. Lytkina1, Georgii G. Melkonyan1,
Svetlana A. Ratchina2, Leonid I. Dvoretski2
1 War Veterans Hospital No3, Moscow, Russia;
2 Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russia
sshekshina@yahoo.com
Abstract
Aim. To study the pathogenetic role of interleukin-6 (IL-6) in old patients with trophic ulcers of the lower extremities.
Methods. The study enrolled 66 patients suffered from trophic ulcers of the lower extremities. The mean age of study patients reached 77.1±9.1 years (62–97 years). The majority of patients (65.1%) were women. The concentration of IL-6 in the blood (n<7.0 pg/ml) was determined by enzyme immunoassay.
Results. Increased level of IL-6 was found in 77.3% of patients. The mean concentration of IL-6 was 14.9±14.6 pg/ml (1.5–288.6 pg/ml), median – 10.7pg/ml. The mean values of interleukin-6 in patients with venous ulcers reached 12.7 pg/ml, arterial – 13.4 pg/ml, mixed – 26.7 pg/ml (p=0.01). Direct correlation was registered between IL-6 level and the number of ulcers (r=0.3; p=0.02). There was a direct correlation between IL-6 concentration and the ulcers duration (r=0.28; p=0.03). There was a trend towards a direct correlation between interleukin-6 and ulcers size (r=0.23; p=0.08). In patients with infected ulcers, the mean IL-6 level was 17.5 pg/ml, in patients without microbiological growth – 11.6 pg/ml, but these differences did not reach the statistical significance (p=0.3). Significant direct correlations were established between IL-6 concentration and the level of C-reactive protein (r=0.61; p<0.000001), leukocyte count (r=0.36; p=0.006), neutrophil count (r=0.39; p=0.002), platelet count (r=0.39; p=0.002), ESR (r=0.40; p=0.003), inverse correlation – with hemoglobin (r=-0.41; p=0.001). There was a direct correlation between IL-6 level and severity of frailty (r=-0.38; p=0.03) and inverse correlation – with instrumental activity in daily life scale (r=-0.35; p=0.03). Patients with elevated IL-6 concentration had higher CRP (18.3 and 6.7 mg/l; p=0.001) and ESR (42.5 and 28.1 mg/l; p=0.04mm/h), but lower hemoglobin levels (114.3 and 125.9 g/l; p=0.01). There was a tendency to a direct correlation between IL-6 level and the age of study patients (r=0.23; p=0.06).
Conclusion. Study results indicate a frequent increase in the interleukin-6 level in old patients with trophic ulcers of lower extremities. An increase in IL-6 concentration is associated with number and duration of ulcers as well as with various hematological parameters.
Key words: trophic ulcers, inflammation, interleukin-6, old age.
For citation: Topolyanskaya S.V., Bubman L.I., Karpov V.V. et al. Interleukin-6 in old patients with trophic ulcers of the lower extremities. Clinical review for general practice. 2023; 4 (8): 112–120 (In Russ.). DOI: 10.47407/kr2023.4.8.00339
Известно, что заживление ран представляет собой сложный биологический феномен, характеризующийся несколькими фазами, включая воспаление, пролиферацию и ремоделирование [2–4]. В случае трофических язв нарушается нормальная последовательность фаз заживления ран и, как следствие, отсутствует их регенерация. Хронические язвы остаются в фазе воспаления, а фазы пролиферации и ремоделирования значительно задерживаются или вообще не наступают [2, 5]. Для трофических язв характерна персистирующая (поздняя) воспалительная фаза, ассоциирующаяся с гиперактивацией нейтрофилов и макрофагов и повышенным высвобождением провоспалительных цитокинов [2, 6]. Продемонстрировано, что у больных с трофическими язвами возникает дисбаланс различных цитокинов и факторов роста, среди которых интерлейкин-6 (ИЛ-6) [2].
ИЛ-6 представляет собой плейотропный цитокин с разнообразными функциями. ИЛ-6 играет центральную роль в остром воспалении и необходим для своевременного заживления ран [2, 7]. Этот цитокин модулирует также пролиферацию, созревание гемопоэтических клеток-предшественников и других клеточных линий, а также регулирует рост опухолевых клеток и определенные метаболические процессы [7]. ИЛ-6 является индикатором ранней реакции на воспаление и травму. Моноциты, макрофаги, фибробласты, эндотелиальные клетки, кератиноциты, тучные клетки и Т-лимфоциты обладают способностью продуцировать ИЛ-6 [8]. Уровни ИЛ-6 в сыворотке повышаются при самых разных воспалительных процессах, таких как инфекции, аутоиммунные и лимфопролиферативные заболевания, острая реакция «трансплантат против хозяина».
Высвобождаемый на ранней стадии в ответ на повреждение ИЛ-6 индуцирует высвобождение провоспалительных цитокинов из различных клеток и хемотаксис лейкоцитов в рану [2, 9]. В фазу воспаления ИЛ-6 участвует в дифференцировке лимфоцитов, способствует инфильтрации раны моноцитами, индуцирует синтез ИЛ-4 и ИЛ-13, способствует переходу к фазе пролиферации [2]. При нормальном заживлении ран экспрессия ИЛ-6 значительно снижается во время фазы ремоделирования [2]. В фазе пролиферации ИЛ-6 способствует синтезу фактора роста кератиноцитов, стимулирует продукцию коллагена и содействует неоваскуляризации [2]. Вместе с тем ИЛ-6 является одним из провоспалительных цитокинов, который можно обнаружить в крови на ранних стадиях раневой инфекции. Он также играет решающую роль в индукции синтеза С-реактивного белка (СРБ) и фибриногена в печени при инфекции [10].
Учитывая единичные данные медицинской литературы, мы предприняли попытку своего исследования ИЛ-6 у больных с трофическими язвами нижних конечностей пожилого и старческого возраста. Основная цель настоящего исследования – изучить патогенетическую роль ИЛ-6 при трофических язвах нижних конечностей у больных пожилого и старческого возраста.
Концентрацию ИЛ-6 в крови (норма ниже 7,0 пг/мл) определяли методом иммуноферментного анализа. Наряду с этим рассчитывали различные гематологические индексы. Определяли отношение числа нейтрофилов к лимфоцитам, нейтрофилов к моноцитам, тромбоцитов к лимфоцитам, лимфоцитов к моноцитам, а также произведение нейтрофильно-лимфоцитарного отношения и числа тромбоцитов (системный иммуновоспалительный индекс). Оценивали также стандартные лабораторные показатели анализов крови (общий и биохимический) и мочи, рассчитывали индекс массы тела.
Полученные данные анализировали с использованием программного обеспечения Statistica (версия 13.0). Для предоставления полученных данных использовали методы описательной статистики (среднее значение и стандартное отклонение – для количественных переменных; число и долю – для качественных переменных). При сравнении групп использовали непараметрические методы (критерий Манна–Уитни, критерий χ2); проводили корреляционный анализ с помощью критерия Спирмена.
 В исследование были включены 66 больных – 43 женщины и 23 мужчины с трофическими язвами нижних конечностей. Средний возраст пациентов достигал 77,1±9,1 года (от 60 до 97 лет); 58,9% больных были старше 75 лет. Клинико-демографическая характеристика больных основной группы представлена в табл. 1. Группу сравнения составили 48 пациентов с АГ.
В исследование были включены 66 больных – 43 женщины и 23 мужчины с трофическими язвами нижних конечностей. Средний возраст пациентов достигал 77,1±9,1 года (от 60 до 97 лет); 58,9% больных были старше 75 лет. Клинико-демографическая характеристика больных основной группы представлена в табл. 1. Группу сравнения составили 48 пациентов с АГ.
Среднее значение шкалы инструментальной активности в повседневной жизни (IADL) достигало 5,6±1,6 балла, с колебаниями от 2 до 8 баллов. Показатели шкалы базовой активности в повседневной жизни (индекса Бартела) в среднем составили 79,2±12,4 балла, варьируя от 45 до 100 баллов. Основные характеристики трофических язв нижних конечностей отражены в табл. 2.
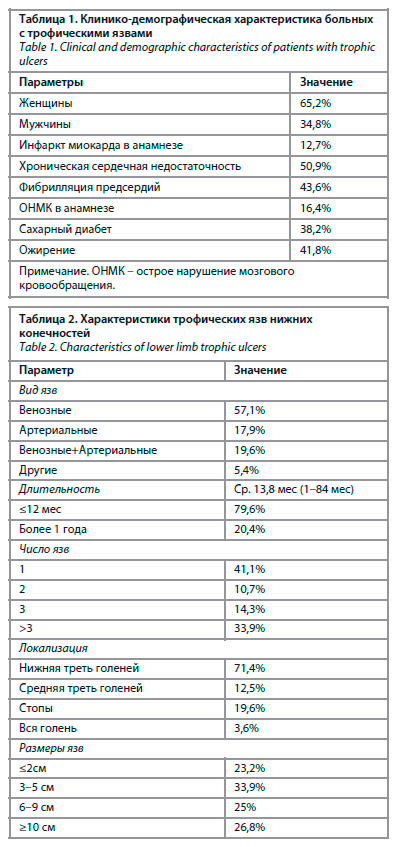
Повышенный уровень ИЛ-6 обнаружен у 77,3% больных. Средняя концентрация ИЛ-6 составила 14,9±14,6 пг/мл (1,5–288,6 пг/мл), медиана данного показателя – 10,7 пг/мл. В группе женщин ИЛ-6 был повышен в 88,2% случаев, у мужчин – в 68,1% (р=0,06). При проведении корреляционного анализа обнаружена тенденция к прямой взаимосвязи между уровнем ИЛ-6 и возрастом больных (r=0,23; р=0,06). Данная взаимосвязь достигала степени статистической достоверности в группе женщин (r=0,33; р=0,03). Средние значения ИЛ-6 у больных с венозными язвами составили 12,7 пг/мл, с артериальными – 13,4 пг/мл, со смешанными – 26,7 пг/мл (р=0,01), рис. 1.
 В группе пациентов с венозными язвами ИЛ-6 был повышен в 74,2% случаев, с артериальными – в 70%, со смешанными – в 90,9%. Зарегистрирована прямая корреляция между уровнем ИЛ-6 и числом язв (r=0,3; р=0,02). В группе пациентов с наличием трех и менее язв ИЛ-6 был повышен в 70% случаев, более 3 язв – в 100% случаев (р=0,007). Выявлена прямая корреляция между концентрацией ИЛ-6 и длительностью существования язв (r=0,28; р=0,03). У больных с длительностью существования язв менее 12 мес ИЛ-6 был повышен в 63,6% случаев, около года – в 80,9%, более года – в 100% случаев (р=0,02). Обнаружена тенденция к прямой зависимости между ИЛ-6 и размером язв (r=0,23; р=0,08). У пациентов с диаметром язв 5 см и менее ИЛ-6 был повышен в 70,9% случаев, а с диаметром язв 10 см и более – в 89,5%. У больных с инфицированными язвами средний уровень ИЛ-6 составил 17,5 пг/мл, у больных без роста микроорганизмов при микробиологическом исследовании – 11,6 пг/мл, однако эти различия не достигали статистической значимости (р=0,3). При наличии инфицированной язвы концентрация ИЛ-6 была повышена в 81,1% случаев, без инфекции – в 66,7% (р=0,2).
В группе пациентов с венозными язвами ИЛ-6 был повышен в 74,2% случаев, с артериальными – в 70%, со смешанными – в 90,9%. Зарегистрирована прямая корреляция между уровнем ИЛ-6 и числом язв (r=0,3; р=0,02). В группе пациентов с наличием трех и менее язв ИЛ-6 был повышен в 70% случаев, более 3 язв – в 100% случаев (р=0,007). Выявлена прямая корреляция между концентрацией ИЛ-6 и длительностью существования язв (r=0,28; р=0,03). У больных с длительностью существования язв менее 12 мес ИЛ-6 был повышен в 63,6% случаев, около года – в 80,9%, более года – в 100% случаев (р=0,02). Обнаружена тенденция к прямой зависимости между ИЛ-6 и размером язв (r=0,23; р=0,08). У пациентов с диаметром язв 5 см и менее ИЛ-6 был повышен в 70,9% случаев, а с диаметром язв 10 см и более – в 89,5%. У больных с инфицированными язвами средний уровень ИЛ-6 составил 17,5 пг/мл, у больных без роста микроорганизмов при микробиологическом исследовании – 11,6 пг/мл, однако эти различия не достигали статистической значимости (р=0,3). При наличии инфицированной язвы концентрация ИЛ-6 была повышена в 81,1% случаев, без инфекции – в 66,7% (р=0,2).
В группе больных с язвами, инфицированными высоко вирулентными патогенами (Acinetobacter baumannii, Pseudomonas aeruginosa, Proteus mirabilis, Klebsiella pneumoniae), средний уровень ИЛ-6 достигал 19,1 пг/мл, а у пациентов, инфицированных грамположительными кокками (Staphylococcus aureus, Enterococcus faecalis и Streptococcus epidermidis), – 10,8 пг/мл. У больных с ко-инфекциями средний уровень ИЛ-6 составил 26,3 пг/мл, с моно-инфекциями – 14,7 пг/мл (р=0,09). При наличии ко-инфекции уровень ИЛ-6 был повышен в 90% случаев, моно-инфекции – в 80% случаев, без роста микроорганизмов – в 66,7%. У 88,9% больных с повышением уровня ИЛ-6 более 30 пг/мл обнаружен рост микроорганизмов в язве, тогда как при уровне ИЛ-6 менее 30 пг/мл – в 67,4% случаев.
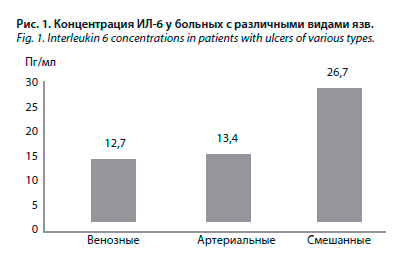
В группе пациентов с повышенной концентрацией ИЛ-6 зарегистрированы более высокие показатели СРБ (18,3 и 6,7 мг/л соответственно; р=0,001) и СОЭ (42,5 и 28,1 мм/ч соответственно; р=0,04), но более низкий уровень гемоглобина (114,3 и 125,9 г/л соответственно; р=0,02), по сравнению с больными, имевшими нормальную концентрацию этого провоспалительного цитокина. У 78,2% больных с повышенной концентрацией ИЛ-6 наблюдалось повышение уровня СРБ, тогда как при нормальном уровне ИЛ-6 повышение СРБ отмечено в 33,3% случаев (р=0,001). У больных с повышенным уровнем ИЛ-6 также наблюдалось достоверно большее число язв, по сравнению с пациентами с нормальным уровнем ИЛ-6 – 3,0±1,9 и 1,7±0,8 соответственно (р=0,03). В табл. 3 и на рис. 2 представлены корреляционные взаимосвязи между концентрацией ИЛ-6 и другими лабораторными показателями.
Зарегистрирована прямая корреляция между концентрацией ИЛ-6 и выраженностью старческой астении, оцененной с помощью шкалы «Возраст не помеха»: r=0,38; р=0,03. Наряду с этим установлена обратная корреляция между уровнем ИЛ-6 и показателями инструментальной активности в повседневной жизни IADL: r=-0,35; р=0,03.
При регрессионном анализе наиболее значимыми факторами, ассоциированными с концентрацией ИЛ-6, был уровень СРБ (β=0,82; р<0,000001) и смешанный вид язв (β=0,43; р=0,0008). Наличие такой сопутствующей патологии, как перенесенные в прошлом инфаркт миокарда и инсульт, хроническая сердечная недостаточность, фибрилляция предсердий, сахарный диабет и ожирение, не оказало значимого влияния на уровень ИЛ-6. В ходе регрессионного анализа не подтвержден также независимый эффект выраженности старческой астении в отношении концентрации ИЛ-6 в крови.
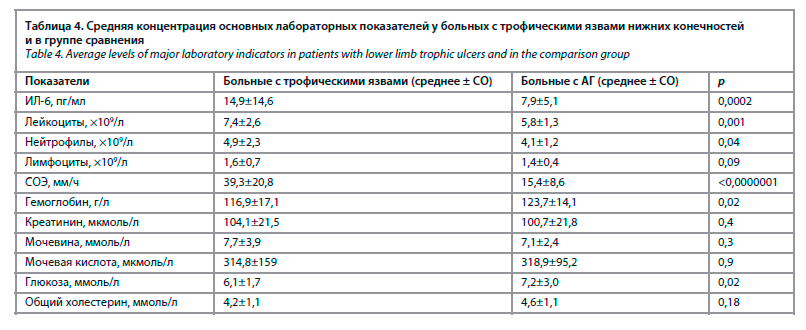
Средняя концентрация ИЛ-6 и других лабораторных показателей у больных с трофическими язвами нижних конечностей и в группе сравнения представлена в табл. 4.
 У 10 больных с трофическими язвами нижних конечностей ИЛ-6 определялся дважды: в момент поступления больного в стационар и по завершении лечения.
У 10 больных с трофическими язвами нижних конечностей ИЛ-6 определялся дважды: в момент поступления больного в стационар и по завершении лечения.
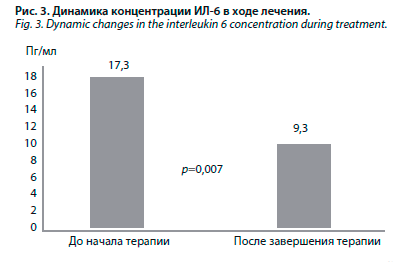
В ходе наблюдения достигнуто достоверное уменьшение концентрации ИЛ-6 – с 17,3 до 9,3 пг/мл (р=0,007), рис. 3. У 4 из 10 больных на фоне проводимой терапии уровень ИЛ-6 полностью нормализовался, еще у трех – практически нормализовался, снизившись до 7,25–7,57 пг/мл, при верхней границе нормы – 7 пг/мл (табл. 5). В табл. 5 представлена динамика концентрации ИЛ-6 и состояния язв в ходе наблюдения.
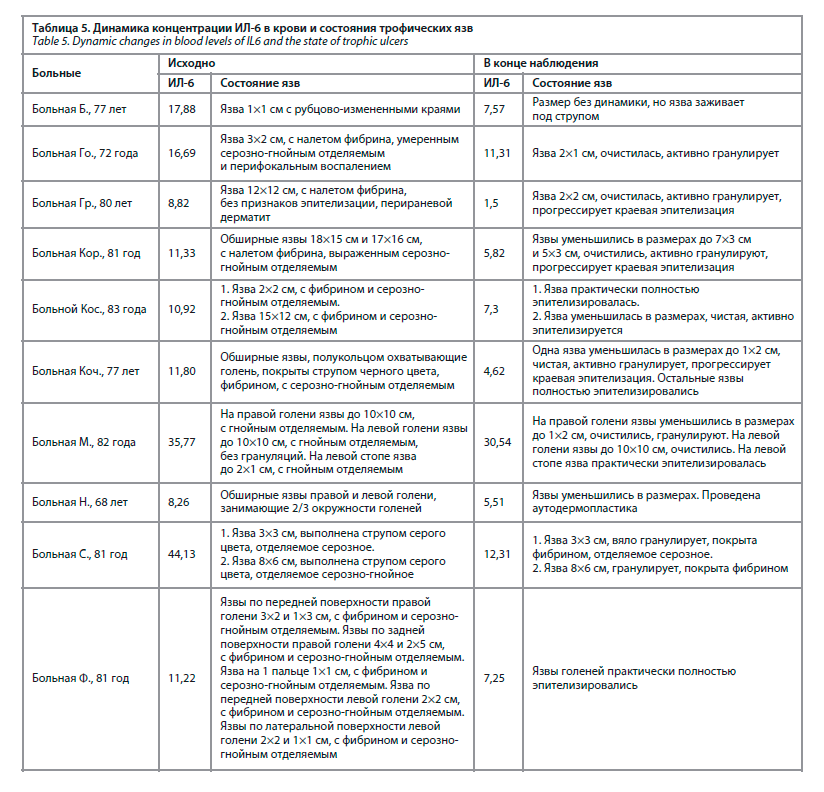
Как видно из представленной выше табл. 5, в 8 из 10 случаев снижение уровня ИЛ-6 в крови сопровождалось уменьшением размеров язв, их очищением и эпителизацией. У больной С. в ходе наблюдения размеры язв остались прежними, но появились грануляции в дне язв и прекратилось гнойное отделяемое.
У больной Б. размеры относительно небольшой язвы также остались прежними, но она стала заживать.
По нашим данным, повышение уровня ИЛ-6 наиболее часто отмечалось у больных со смешанными язвами (в 91% случаев); в этой группе пациентов концентрация данного цитокина была примерно в 2 раза выше, чем у больных с венозными и артериальными язвами. При этом различий по уровню и частоте повышения ИЛ-6 у пациентов с венозными и артериальными язвами не обнаружено. Результаты некоторых исследований свидетельствуют о более высокой концентрации ИЛ-6 в отделяемом артериальных язв, по сравнению с язвами чисто венозной этиологии [13]. Напротив, другие авторы не обнаружили влияния ишемии на уровень цитокинов при смешанных венозно-артериальных язвах [14].
У наших больных зарегистрирована прямая корреляция между уровнем ИЛ-6 и числом, а также размером язв, что может быть обусловлено большим «плацдармом» очага воспалительной активности с большим числом нейтрофилов и макрофагов, синтезирующих различные провоспалительные медиаторы, в том числе ИЛ-6. Аналогично нашим данным, в исследовании C. Wiegand и соавт. более высокие концентрации других провоспалительных цитокинов (ИЛ-1β и ИЛ-8) ассоциировались с большим размером язв [15]. В другой научной работе по изучению эффективности ультразвуковой терапии у больных с рефрактерными венозными язвами нижних конечностей было продемонстрировано ускорение заживления язв и уменьшение их размеров по мере снижения экспрессии таких провоспалительных цитокинов, как ИЛ-6, ИЛ-1, ФНО-α [16]. Результаты исследования J. Escandon и соавт. подтверждают, что заживление ран улучшается по мере стихания воспалительного процесса, который может препятствовать регенерации, а уровень провоспалительных цитокинов может служить дополнительным прогностическим фактором заживления ран [16]. В относительно небольшой подгруппе наших больных с трофическими язвами нижних конечностей также было продемонстрировано существенное снижение уровня ИЛ-6 по завершении курса лечения, что можно трактовать как очередное подтверждение патогенетической роли данного цитокина в длительном персистировании язв.
В наших наблюдениях обнаружена прямая взаимосвязь между повышением уровня ИЛ-6 и длительностью существования язв, при этом у больных с продолжительностью язв более года концентрация данного цитокина в крови была повышена в 100% случаев. Аналогично нашим данным, в исследовании C. Wiegand и соавт. была установлена прямая корреляция между уровнем другого ключевого провоспалительного цитокина ФНО-α и длительностью существования язв [15]. Известно, что хронические раны характеризуются персистирующим воспалением с гиперактивацией нейтрофилов и макрофагов и повышенным высвобождением провоспалительных цитокинов, тогда как при нормальном заживлении ран экспрессия ИЛ-6 достаточно быстро начинает снижаться при наступлении фазы ремоделирования и пролиферации [2, 6]. В исследовании F.A. Altay и соавт. у пациентов с диабетическими язвами в стадии заживления зарегистрировано значительное снижение уровня ИЛ-6 в крови через две недели лечения, тогда как у больных с отсутствием положительной динамики в состоянии язв концентрация ИЛ-6 не изменилась [17]. Напротив, в исследовании C-S. Pan и соавт. обнаружены значительно более высокие уровни ИЛ-6 в острых ранах по сравнению с хроническими [9]. Вместе с тем в вышеупомянутой работе в 14 из 18 образцов отделяемого хронических язв выявлены очень высокие уровни ИЛ-6 (более 30 пг/мл) [9]. Различия в результатах наших исследований могут быть обусловлены разным материалом для определения ИЛ-6: в нашей работе это была сыворотка крови, тогда как в вышеупомянутом – отделяемое ран, а известно, что состав отделяемого ран может отличаться от сыворотки крови.
По нашим данным, наблюдалась тенденция к более высокой концентрации ИЛ-6 у больных с инфицированными язвами, у пациентов с язвами, инфицированными такими высоко вирулентными патогенами, как Acinetobacter baumannii и Pseudomonas aeruginosa, а также в случае ко-инфекций. У 90% наших больных с повышением уровня ИЛ-6 более 30 пг/мл обнаружен рост микроорганизмов в язве, тогда как при концентрации ИЛ-6 менее 30 пг/мл – в 67% случаев. В исследовании S-C. Pan и соавт. пороговое значение ИЛ-6, равное 30 пг/мл, продемонстрировало хорошую чувствительность и специфичность в отношении ранней диагностики раневой инфекции, когда клинических проявлений еще не было [9]. В других научных работах у больных с трофическими язвами нижних конечностей, прежде всего венозной этиологии, более высокие уровни ИЛ-6, ИЛ-8 и ФНО-α также были обнаружены в случае язв с высокой бактериальной нагрузкой [12, 15, 17, 18]. Так, в исследовании
R. Serra и соавт. более высокие уровни ИЛ-6, ИЛ-1, ИЛ-8 и ФНО-α зарегистрированы у пациентов с инфицированными язвами, по сравнению с больными без локальной инфекции [17]. Показано, что ИЛ-6 обнаруживается в сыворотке крови уже на ранних стадиях инфекции, поэтому, по мнению ряда авторов, данный цитокин может быть более приемлемым и ранним суррогатным биомаркером для оценки раневой инфекции по сравнению с СРБ [9, 10, 19].
Аналогично нашим данным, в исследовании A. Ambrosch и соавт. было установлено, что при смешанных бактериальных инфекциях у больных с хроническими язвами нижних конечностей отмечались более высокие концентрации ИЛ-6 и ФНО-α по сравнению с мономикробными инфекциями [13]. В этом исследовании уровень ИЛ-6 был значительно повышен при высокой бактериальной нагрузке и при инфицировании Pseudomonas aeruginosa так же, как и у наших больных [13].
Полученные нами результаты свидетельствуют о различных взаимосвязях между ИЛ-6 и другими клиническими и лабораторными параметрами у больных пожилого и старческого возраста с трофическими язвами нижних конечностей. Так, в нашем исследовании зарегистрирована прямая корреляция между концентрацией ИЛ-6 и выраженностью старческой астении, оцененной с помощью шкалы «Возраст не помеха», и установлена обратная корреляция между уровнем данного цитокина и показателями инструментальной активности в повседневной жизни. Одним из важных эффектов ИЛ-6 в отношении различной возраст-ассоциированной патологии считают его влияние на развитие старческой астении и саркопении [11]. При старческой астении содержание ИЛ-6 выше, чем у лиц того же возраста без признаков астении, и повышенный уровень ИЛ-6 в крови позитивно коррелирует с такими маркерами старческой астении, как низкая скорость ходьбы и сниженная сила мышц [20].
В наших наблюдениях выявлена значимая прямая взаимосвязь между уровнем ИЛ-6 и общим содержанием лейкоцитов, а также числом нейтрофилов. Известно, что в ответ на воспаление ИЛ-6 способствует стимуляции и рекрутированию лейкоцитов в рану [9, 21]. В свою очередь, ИЛ-6 продуцируется главным образом полиморфноядерными лейкоцитами и макрофагами [12]. В нашей работе показана также взаимосвязь между ИЛ-6 и различными лейкоцитарными индексами. В другом нашем исследовании по изучению различных гематологических индексов в качестве маркеров субклинического воспаления у больных ишемической болезнью сердца в старческом возрасте также наблюдались достоверные взаимосвязи между ИЛ-6 и различными гематологическими индексами, числом лейкоцитов, нейтрофилов и СОЭ [22]. В нашей группе пациентов с язвами и повышенной концентрацией ИЛ-6 зарегистрированы более высокие показатели СРБ и СОЭ. В исследовании F.A. Altay и соавт. у больных с диабетическими язвами также наблюдалась положительная корреляция между ИЛ-6 и СОЭ, а также между ИЛ-6 и СРБ [19]. Хорошо известно, что ИЛ-6 играет ведущую роль в острофазовых реакциях и стимулирует синтез СРБ [7, 9].
При корреляционном анализе в нашей группе больных выявлена достоверная обратная взаимосвязь между уровнем ИЛ-6 и содержанием гемоглобина (р=0,001). По мнению ряда авторов, ИЛ-6 может играть ключевую роль в развитии анемии хронического воспаления. Предполагают, что ИЛ-6 подавляет эритропоэз, ингибирует синтез эритропоэтина, активирует гепсидин и нарушает утилизацию железа; все эти факторы приводят в итоге к развитию анемии [23].
Несмотря на ряд значимых данных, полученных в настоящем исследовании, в этой работе имеются некоторые ограничения. Это исследование выполнено при участии больных пожилого и старческого возраста с множественной коморбидной патологией, которая могла повлиять на результаты данного исследования. Наряду с этим, мы определяли концентрацию ИЛ-6
не в отделяемом язв, а в сыворотке крови, что, вероятно, менее чувствительно и специфично.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Тополянская Светлана Викторовна – д-р мед. наук, доц. каф. госпитальной терапии №2, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет), врач-терапевт, ГБУЗ ГВВ №3. E-mail: sshekshina@yahoo.com; ORCID: 0000-0002-4131-8432
Svetlana V. Topolyanskaya – Dr. Sci. (Med.), War Veterans Hospital No3; Sechenov First Moscow State Medical University (Sechenov University). E-mail: sshekshina@yahoo.com; ORCID: 0000-0002-4131-8432
Бубман Леонид Игоревич – зав. 7-м хирургическим отделением, ГБУЗ ГВВ №3. E-mail: bubmanleo@gmail.com; ORCID: 0000-0002-4195-3188
Leonid I. Bubman – Head of the Surgical Department No7, War Veterans Hospital No3. E-mail: bubmanleo@gmail.com; ORCID: 0000-0002-4195-3188
Карпов Виктор Викторович – врач-хирург 7-го хирургического отделения, ГБУЗ ГВВ №3
Viktor V. Karpov – Surgeon, War Veterans Hospital No3
Нечаев Алексей Игоревич – врач-хирург 7-го хирургического отделения, ГВВ №3
Aleksei I. Nechaev – Surgeon, War Veterans Hospital No3
Хан Станислав Олегович – врач-хирург 7-го хирургического отделения, ГВВ №3
Stanislav O. Khan – Surgeon, War Veterans Hospital No3
Васильева Юлия Юрьевна – врач клинико-диагностической лаборатории, ГВВ №3
Yulia Yu. Vasilyeva – doctor of the clinical diagnostic laboratory, War Veterans Hospital No3
Лыткина Каринэ Арнольдовна – канд. мед. наук, зам. глав. врача по терапии, ГБУЗ ГВВ №3. E-mail: lytkina.k@mail.ru; ORCID: 0000-0001-9647-7492
Karine A. Lytkina – Cand. Sci. (Med.), War Veterans Hospital No3. E-mail: lytkina.k@mail.ru; ORCID: 0000-0001-9647-7492
Мелконян Георгий Геннадьевич – д-р мед. наук, проф., глав. врач, ГБУЗ ГВВ №3. E-mail: gvv3@zdrav.mos.ru; ORCID: 0000-0002-4021-5044
Georgii G. Melkonyan – Dr. Sci. (Med.), Prof., Chief doctor War Veterans Hospital No3. E-mail: gvv3@zdrav.mos.ru; ORCID: 0000-0002-4021-5044
Рачина Светлана Александровна – д-р мед. наук, проф., зав. каф. госпитальной терапии №2, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: svetlana.ratchina@antibiotic.ru; ORCID: 0000-0002-3329-7846
Svetlana A. Ratchina – Dr. Sci. (Med.), Prof., Sechenov First Moscow State Medical University (Sechenov University). E-mail: svetlana.ratchina@antibiotic.ru; ORCID: 0000-0002-3329-7846
Дворецкий Леонид Иванович – д-р мед. наук, проф., проф. каф. госпитальной терапии №2, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: dvoretski@mail.ru; ORCID: 0000-0003-3186-0102
Leonid I. Dvoretsky – Dr. Sci. (Med.), Full Prof., Sechenov First Moscow State Medical University (Sechenov University). E-mail: dvoretski@mail.ru; ORCID: 0000-0003-3186-0102
Поступила в редакцию: 16.10.2023
Поступила после рецензирования: 23.10.2023
Принята к публикации: 26.10.2023
Received: 16.10.2023
Revised: 23.10.2023
Accepted: 26.10.2023
Клинический разбор в общей медицине №8 2023
Интерлейкин-6 у больных пожилого и старческого возраста с трофическими язвами нижних конечностей
Номера страниц в выпуске:112-120
Аннотация
Цель. Изучить патогенетическую роль интерлейкина-6 (ИЛ-6) при трофических язвах нижних конечностей у больных пожилого и старческого возраста.
Материалы и методы. Данная работа представляла собой одномоментное («поперечное») исследование, в которое были включены 66 больных с трофическими язвами нижних конечностей. Средний возраст включенных в исследование пациентов составил 77,1±9,1 года, варьируя от 62 до 97 лет. Большинство больных (65,1%) составили женщины. Концентрацию ИЛ-6 в крови (норма <7,0 пг/мл) определяли иммуноферментным анализом.
Результаты. Повышенный уровень ИЛ-6 обнаружен у 77,3% больных. Средняя концентрация ИЛ-6 составила 14,9±14,6 пг/мл (1,5–288,6 пг/мл), медиана – 10,7 пг/мл. Средние значения ИЛ-6 у больных с венозными язвами достигали 12,7 пг/мл, артериальными – 13,4 пг/мл, смешанными – 26,7 пг/мл (р=0,01). Зарегистрирована прямая корреляция между уровнем ИЛ-6 и числом язв (r=0,3; р=0,02). Установлена прямая корреляция между концентрацией ИЛ-6 и длительностью существования язв (r=0,28; р=0,03). Отмечена тенденция к прямой взаимосвязи между содержанием ИЛ-6 и размером язв (r=0,23; р=0,08). У больных с инфицированными язвами средний уровень ИЛ-6 составил 17,5 пг/мл, у больных без роста микроорганизмов – 11,6 пг/мл, однако эти различия не достигли степени статистической достоверности (р=0,3). Установлены достоверные прямые корреляции между концентрацией ИЛ-6 и уровнем С-реактивного белка (r=0,61; р<0,000001), числом лейкоцитов (r=0,36; р=0,006), нейтрофилов (r=0,39; р=0,002), тромбоцитов (r=0,39; р=0,002), СОЭ (r=0,40; р=0,003), а также обратная корреляция – с уровнем гемоглобина (r=-0,41; p=0,001). Выявлена прямая взаимосвязь между уровнем ИЛ-6 и выраженностью старческой астении (r=-0,38; р=0,03) и обратная – с показателями шкалы инструментальной активности в повседневной жизни (r=-0,35; р=0,03). У больных с повышенной концентрацией ИЛ-6 был выше уровень С-реактивного белка (18,3 и 6,7 мг/л; р=0,001) и СОЭ (42,5 и 28,1 мм/ч; р=0,04), но ниже – уровень гемоглобина (114,3 и 125,9 г/л; р=0,01). Наблюдалась тенденция к прямой взаимосвязи между содержанием ИЛ-6 в крови и возрастом больных (r=0,23; р=0,06).
Выводы. Результаты исследования свидетельствуют о частом повышении концентрации ИЛ-6 в крови больных пожилого и старческого возраста с трофическими язвами нижних конечностей. Повышение уровня ИЛ-6 ассоциируется с числом и длительностью существования язв, а также с различными гематологическими показателями.
Ключевые слова: трофические язвы, воспаление, интерлейкин-6, пожилой и старческий возраст.
Для цитирования: Тополянская С.В., Бубман Л.И., Карпов В.В. и др. Интерлейкин-6 у больных пожилого и старческого возраста с трофическими язвами нижних конечностей. Клинический разбор в общей медицине. 2023; 4 (8): 112–120. DOI: 10.47407/kr2023.4.8.00339
Цель. Изучить патогенетическую роль интерлейкина-6 (ИЛ-6) при трофических язвах нижних конечностей у больных пожилого и старческого возраста.
Материалы и методы. Данная работа представляла собой одномоментное («поперечное») исследование, в которое были включены 66 больных с трофическими язвами нижних конечностей. Средний возраст включенных в исследование пациентов составил 77,1±9,1 года, варьируя от 62 до 97 лет. Большинство больных (65,1%) составили женщины. Концентрацию ИЛ-6 в крови (норма <7,0 пг/мл) определяли иммуноферментным анализом.
Результаты. Повышенный уровень ИЛ-6 обнаружен у 77,3% больных. Средняя концентрация ИЛ-6 составила 14,9±14,6 пг/мл (1,5–288,6 пг/мл), медиана – 10,7 пг/мл. Средние значения ИЛ-6 у больных с венозными язвами достигали 12,7 пг/мл, артериальными – 13,4 пг/мл, смешанными – 26,7 пг/мл (р=0,01). Зарегистрирована прямая корреляция между уровнем ИЛ-6 и числом язв (r=0,3; р=0,02). Установлена прямая корреляция между концентрацией ИЛ-6 и длительностью существования язв (r=0,28; р=0,03). Отмечена тенденция к прямой взаимосвязи между содержанием ИЛ-6 и размером язв (r=0,23; р=0,08). У больных с инфицированными язвами средний уровень ИЛ-6 составил 17,5 пг/мл, у больных без роста микроорганизмов – 11,6 пг/мл, однако эти различия не достигли степени статистической достоверности (р=0,3). Установлены достоверные прямые корреляции между концентрацией ИЛ-6 и уровнем С-реактивного белка (r=0,61; р<0,000001), числом лейкоцитов (r=0,36; р=0,006), нейтрофилов (r=0,39; р=0,002), тромбоцитов (r=0,39; р=0,002), СОЭ (r=0,40; р=0,003), а также обратная корреляция – с уровнем гемоглобина (r=-0,41; p=0,001). Выявлена прямая взаимосвязь между уровнем ИЛ-6 и выраженностью старческой астении (r=-0,38; р=0,03) и обратная – с показателями шкалы инструментальной активности в повседневной жизни (r=-0,35; р=0,03). У больных с повышенной концентрацией ИЛ-6 был выше уровень С-реактивного белка (18,3 и 6,7 мг/л; р=0,001) и СОЭ (42,5 и 28,1 мм/ч; р=0,04), но ниже – уровень гемоглобина (114,3 и 125,9 г/л; р=0,01). Наблюдалась тенденция к прямой взаимосвязи между содержанием ИЛ-6 в крови и возрастом больных (r=0,23; р=0,06).
Выводы. Результаты исследования свидетельствуют о частом повышении концентрации ИЛ-6 в крови больных пожилого и старческого возраста с трофическими язвами нижних конечностей. Повышение уровня ИЛ-6 ассоциируется с числом и длительностью существования язв, а также с различными гематологическими показателями.
Ключевые слова: трофические язвы, воспаление, интерлейкин-6, пожилой и старческий возраст.
Для цитирования: Тополянская С.В., Бубман Л.И., Карпов В.В. и др. Интерлейкин-6 у больных пожилого и старческого возраста с трофическими язвами нижних конечностей. Клинический разбор в общей медицине. 2023; 4 (8): 112–120. DOI: 10.47407/kr2023.4.8.00339
Interleukin-6 in old patients with trophic ulcers of the lower extremities
Svetlana V. Topolyanskaya1,2, Leonid I. Bubman1, Viktor V. Karpov1, Stanislav O. Khan1,Aleksei I. Nechaev1, Yulia Yu. Vasilyeva1, Karine A. Lytkina1, Georgii G. Melkonyan1,
Svetlana A. Ratchina2, Leonid I. Dvoretski2
1 War Veterans Hospital No3, Moscow, Russia;
2 Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russia
sshekshina@yahoo.com
Abstract
Aim. To study the pathogenetic role of interleukin-6 (IL-6) in old patients with trophic ulcers of the lower extremities.
Methods. The study enrolled 66 patients suffered from trophic ulcers of the lower extremities. The mean age of study patients reached 77.1±9.1 years (62–97 years). The majority of patients (65.1%) were women. The concentration of IL-6 in the blood (n<7.0 pg/ml) was determined by enzyme immunoassay.
Results. Increased level of IL-6 was found in 77.3% of patients. The mean concentration of IL-6 was 14.9±14.6 pg/ml (1.5–288.6 pg/ml), median – 10.7pg/ml. The mean values of interleukin-6 in patients with venous ulcers reached 12.7 pg/ml, arterial – 13.4 pg/ml, mixed – 26.7 pg/ml (p=0.01). Direct correlation was registered between IL-6 level and the number of ulcers (r=0.3; p=0.02). There was a direct correlation between IL-6 concentration and the ulcers duration (r=0.28; p=0.03). There was a trend towards a direct correlation between interleukin-6 and ulcers size (r=0.23; p=0.08). In patients with infected ulcers, the mean IL-6 level was 17.5 pg/ml, in patients without microbiological growth – 11.6 pg/ml, but these differences did not reach the statistical significance (p=0.3). Significant direct correlations were established between IL-6 concentration and the level of C-reactive protein (r=0.61; p<0.000001), leukocyte count (r=0.36; p=0.006), neutrophil count (r=0.39; p=0.002), platelet count (r=0.39; p=0.002), ESR (r=0.40; p=0.003), inverse correlation – with hemoglobin (r=-0.41; p=0.001). There was a direct correlation between IL-6 level and severity of frailty (r=-0.38; p=0.03) and inverse correlation – with instrumental activity in daily life scale (r=-0.35; p=0.03). Patients with elevated IL-6 concentration had higher CRP (18.3 and 6.7 mg/l; p=0.001) and ESR (42.5 and 28.1 mg/l; p=0.04mm/h), but lower hemoglobin levels (114.3 and 125.9 g/l; p=0.01). There was a tendency to a direct correlation between IL-6 level and the age of study patients (r=0.23; p=0.06).
Conclusion. Study results indicate a frequent increase in the interleukin-6 level in old patients with trophic ulcers of lower extremities. An increase in IL-6 concentration is associated with number and duration of ulcers as well as with various hematological parameters.
Key words: trophic ulcers, inflammation, interleukin-6, old age.
For citation: Topolyanskaya S.V., Bubman L.I., Karpov V.V. et al. Interleukin-6 in old patients with trophic ulcers of the lower extremities. Clinical review for general practice. 2023; 4 (8): 112–120 (In Russ.). DOI: 10.47407/kr2023.4.8.00339
Введение
Трофические язвы нижних конечностей представляют собой существенную проблему для гериатрической хирургии в связи с их высокой распространенностью и большими экономическими затратами [1]. Помимо другой возраст-ассоциированной патологии, хронические язвы рассматривают как один из важных факторов инвалидности и значительного ухудшения качества жизни больных преклонного возраста [2]. Учитывая вышесказанное, представляется актуальным изучение различных факторов, способствующих длительному персистированию язв нижних конечностей, что может, в свою очередь, улучшить результаты лечения больных с данной патологией.Известно, что заживление ран представляет собой сложный биологический феномен, характеризующийся несколькими фазами, включая воспаление, пролиферацию и ремоделирование [2–4]. В случае трофических язв нарушается нормальная последовательность фаз заживления ран и, как следствие, отсутствует их регенерация. Хронические язвы остаются в фазе воспаления, а фазы пролиферации и ремоделирования значительно задерживаются или вообще не наступают [2, 5]. Для трофических язв характерна персистирующая (поздняя) воспалительная фаза, ассоциирующаяся с гиперактивацией нейтрофилов и макрофагов и повышенным высвобождением провоспалительных цитокинов [2, 6]. Продемонстрировано, что у больных с трофическими язвами возникает дисбаланс различных цитокинов и факторов роста, среди которых интерлейкин-6 (ИЛ-6) [2].
ИЛ-6 представляет собой плейотропный цитокин с разнообразными функциями. ИЛ-6 играет центральную роль в остром воспалении и необходим для своевременного заживления ран [2, 7]. Этот цитокин модулирует также пролиферацию, созревание гемопоэтических клеток-предшественников и других клеточных линий, а также регулирует рост опухолевых клеток и определенные метаболические процессы [7]. ИЛ-6 является индикатором ранней реакции на воспаление и травму. Моноциты, макрофаги, фибробласты, эндотелиальные клетки, кератиноциты, тучные клетки и Т-лимфоциты обладают способностью продуцировать ИЛ-6 [8]. Уровни ИЛ-6 в сыворотке повышаются при самых разных воспалительных процессах, таких как инфекции, аутоиммунные и лимфопролиферативные заболевания, острая реакция «трансплантат против хозяина».
Высвобождаемый на ранней стадии в ответ на повреждение ИЛ-6 индуцирует высвобождение провоспалительных цитокинов из различных клеток и хемотаксис лейкоцитов в рану [2, 9]. В фазу воспаления ИЛ-6 участвует в дифференцировке лимфоцитов, способствует инфильтрации раны моноцитами, индуцирует синтез ИЛ-4 и ИЛ-13, способствует переходу к фазе пролиферации [2]. При нормальном заживлении ран экспрессия ИЛ-6 значительно снижается во время фазы ремоделирования [2]. В фазе пролиферации ИЛ-6 способствует синтезу фактора роста кератиноцитов, стимулирует продукцию коллагена и содействует неоваскуляризации [2]. Вместе с тем ИЛ-6 является одним из провоспалительных цитокинов, который можно обнаружить в крови на ранних стадиях раневой инфекции. Он также играет решающую роль в индукции синтеза С-реактивного белка (СРБ) и фибриногена в печени при инфекции [10].
Учитывая единичные данные медицинской литературы, мы предприняли попытку своего исследования ИЛ-6 у больных с трофическими язвами нижних конечностей пожилого и старческого возраста. Основная цель настоящего исследования – изучить патогенетическую роль ИЛ-6 при трофических язвах нижних конечностей у больных пожилого и старческого возраста.
Материал и методы
Данная работа представляла собой одномоментное (поперечное, cross-sectional) исследование, выполненное на клинической базе Госпиталя для ветеранов войн №3 (г. Москва). В основную группу исследования включали мужчин и женщин в возрасте 60 лет и старше, находившихся на стационарном лечении с трофическими язвами нижних конечностей, в группу сравнения – сопоставимых по возрасту и полу пациентов с артериальной гипертензией (АГ), но без трофических язв. Для оценки состояния больных использовали стандартные методы обследования пациентов с трофическими язвами нижних конечностей, ультразвуковое исследование артерий и вен нижних конечностей, при необходимости – КТ-ангиографию. Кроме того, проводили комплексную гериатрическую оценку, включающую опросник «Возраст не помеха», шкалу базовой активности в повседневной жизни (индекс Бартел) и шкалу оценки инструментальной деятельности в повседневной жизни (IADL).Концентрацию ИЛ-6 в крови (норма ниже 7,0 пг/мл) определяли методом иммуноферментного анализа. Наряду с этим рассчитывали различные гематологические индексы. Определяли отношение числа нейтрофилов к лимфоцитам, нейтрофилов к моноцитам, тромбоцитов к лимфоцитам, лимфоцитов к моноцитам, а также произведение нейтрофильно-лимфоцитарного отношения и числа тромбоцитов (системный иммуновоспалительный индекс). Оценивали также стандартные лабораторные показатели анализов крови (общий и биохимический) и мочи, рассчитывали индекс массы тела.
Полученные данные анализировали с использованием программного обеспечения Statistica (версия 13.0). Для предоставления полученных данных использовали методы описательной статистики (среднее значение и стандартное отклонение – для количественных переменных; число и долю – для качественных переменных). При сравнении групп использовали непараметрические методы (критерий Манна–Уитни, критерий χ2); проводили корреляционный анализ с помощью критерия Спирмена.
Результаты
 В исследование были включены 66 больных – 43 женщины и 23 мужчины с трофическими язвами нижних конечностей. Средний возраст пациентов достигал 77,1±9,1 года (от 60 до 97 лет); 58,9% больных были старше 75 лет. Клинико-демографическая характеристика больных основной группы представлена в табл. 1. Группу сравнения составили 48 пациентов с АГ.
В исследование были включены 66 больных – 43 женщины и 23 мужчины с трофическими язвами нижних конечностей. Средний возраст пациентов достигал 77,1±9,1 года (от 60 до 97 лет); 58,9% больных были старше 75 лет. Клинико-демографическая характеристика больных основной группы представлена в табл. 1. Группу сравнения составили 48 пациентов с АГ.Среднее значение шкалы инструментальной активности в повседневной жизни (IADL) достигало 5,6±1,6 балла, с колебаниями от 2 до 8 баллов. Показатели шкалы базовой активности в повседневной жизни (индекса Бартела) в среднем составили 79,2±12,4 балла, варьируя от 45 до 100 баллов. Основные характеристики трофических язв нижних конечностей отражены в табл. 2.
Повышенный уровень ИЛ-6 обнаружен у 77,3% больных. Средняя концентрация ИЛ-6 составила 14,9±14,6 пг/мл (1,5–288,6 пг/мл), медиана данного показателя – 10,7 пг/мл. В группе женщин ИЛ-6 был повышен в 88,2% случаев, у мужчин – в 68,1% (р=0,06). При проведении корреляционного анализа обнаружена тенденция к прямой взаимосвязи между уровнем ИЛ-6 и возрастом больных (r=0,23; р=0,06). Данная взаимосвязь достигала степени статистической достоверности в группе женщин (r=0,33; р=0,03). Средние значения ИЛ-6 у больных с венозными язвами составили 12,7 пг/мл, с артериальными – 13,4 пг/мл, со смешанными – 26,7 пг/мл (р=0,01), рис. 1.
 В группе пациентов с венозными язвами ИЛ-6 был повышен в 74,2% случаев, с артериальными – в 70%, со смешанными – в 90,9%. Зарегистрирована прямая корреляция между уровнем ИЛ-6 и числом язв (r=0,3; р=0,02). В группе пациентов с наличием трех и менее язв ИЛ-6 был повышен в 70% случаев, более 3 язв – в 100% случаев (р=0,007). Выявлена прямая корреляция между концентрацией ИЛ-6 и длительностью существования язв (r=0,28; р=0,03). У больных с длительностью существования язв менее 12 мес ИЛ-6 был повышен в 63,6% случаев, около года – в 80,9%, более года – в 100% случаев (р=0,02). Обнаружена тенденция к прямой зависимости между ИЛ-6 и размером язв (r=0,23; р=0,08). У пациентов с диаметром язв 5 см и менее ИЛ-6 был повышен в 70,9% случаев, а с диаметром язв 10 см и более – в 89,5%. У больных с инфицированными язвами средний уровень ИЛ-6 составил 17,5 пг/мл, у больных без роста микроорганизмов при микробиологическом исследовании – 11,6 пг/мл, однако эти различия не достигали статистической значимости (р=0,3). При наличии инфицированной язвы концентрация ИЛ-6 была повышена в 81,1% случаев, без инфекции – в 66,7% (р=0,2).
В группе пациентов с венозными язвами ИЛ-6 был повышен в 74,2% случаев, с артериальными – в 70%, со смешанными – в 90,9%. Зарегистрирована прямая корреляция между уровнем ИЛ-6 и числом язв (r=0,3; р=0,02). В группе пациентов с наличием трех и менее язв ИЛ-6 был повышен в 70% случаев, более 3 язв – в 100% случаев (р=0,007). Выявлена прямая корреляция между концентрацией ИЛ-6 и длительностью существования язв (r=0,28; р=0,03). У больных с длительностью существования язв менее 12 мес ИЛ-6 был повышен в 63,6% случаев, около года – в 80,9%, более года – в 100% случаев (р=0,02). Обнаружена тенденция к прямой зависимости между ИЛ-6 и размером язв (r=0,23; р=0,08). У пациентов с диаметром язв 5 см и менее ИЛ-6 был повышен в 70,9% случаев, а с диаметром язв 10 см и более – в 89,5%. У больных с инфицированными язвами средний уровень ИЛ-6 составил 17,5 пг/мл, у больных без роста микроорганизмов при микробиологическом исследовании – 11,6 пг/мл, однако эти различия не достигали статистической значимости (р=0,3). При наличии инфицированной язвы концентрация ИЛ-6 была повышена в 81,1% случаев, без инфекции – в 66,7% (р=0,2). В группе больных с язвами, инфицированными высоко вирулентными патогенами (Acinetobacter baumannii, Pseudomonas aeruginosa, Proteus mirabilis, Klebsiella pneumoniae), средний уровень ИЛ-6 достигал 19,1 пг/мл, а у пациентов, инфицированных грамположительными кокками (Staphylococcus aureus, Enterococcus faecalis и Streptococcus epidermidis), – 10,8 пг/мл. У больных с ко-инфекциями средний уровень ИЛ-6 составил 26,3 пг/мл, с моно-инфекциями – 14,7 пг/мл (р=0,09). При наличии ко-инфекции уровень ИЛ-6 был повышен в 90% случаев, моно-инфекции – в 80% случаев, без роста микроорганизмов – в 66,7%. У 88,9% больных с повышением уровня ИЛ-6 более 30 пг/мл обнаружен рост микроорганизмов в язве, тогда как при уровне ИЛ-6 менее 30 пг/мл – в 67,4% случаев.
В группе пациентов с повышенной концентрацией ИЛ-6 зарегистрированы более высокие показатели СРБ (18,3 и 6,7 мг/л соответственно; р=0,001) и СОЭ (42,5 и 28,1 мм/ч соответственно; р=0,04), но более низкий уровень гемоглобина (114,3 и 125,9 г/л соответственно; р=0,02), по сравнению с больными, имевшими нормальную концентрацию этого провоспалительного цитокина. У 78,2% больных с повышенной концентрацией ИЛ-6 наблюдалось повышение уровня СРБ, тогда как при нормальном уровне ИЛ-6 повышение СРБ отмечено в 33,3% случаев (р=0,001). У больных с повышенным уровнем ИЛ-6 также наблюдалось достоверно большее число язв, по сравнению с пациентами с нормальным уровнем ИЛ-6 – 3,0±1,9 и 1,7±0,8 соответственно (р=0,03). В табл. 3 и на рис. 2 представлены корреляционные взаимосвязи между концентрацией ИЛ-6 и другими лабораторными показателями.


Зарегистрирована прямая корреляция между концентрацией ИЛ-6 и выраженностью старческой астении, оцененной с помощью шкалы «Возраст не помеха»: r=0,38; р=0,03. Наряду с этим установлена обратная корреляция между уровнем ИЛ-6 и показателями инструментальной активности в повседневной жизни IADL: r=-0,35; р=0,03.
При регрессионном анализе наиболее значимыми факторами, ассоциированными с концентрацией ИЛ-6, был уровень СРБ (β=0,82; р<0,000001) и смешанный вид язв (β=0,43; р=0,0008). Наличие такой сопутствующей патологии, как перенесенные в прошлом инфаркт миокарда и инсульт, хроническая сердечная недостаточность, фибрилляция предсердий, сахарный диабет и ожирение, не оказало значимого влияния на уровень ИЛ-6. В ходе регрессионного анализа не подтвержден также независимый эффект выраженности старческой астении в отношении концентрации ИЛ-6 в крови.
Средняя концентрация ИЛ-6 и других лабораторных показателей у больных с трофическими язвами нижних конечностей и в группе сравнения представлена в табл. 4.

 У 10 больных с трофическими язвами нижних конечностей ИЛ-6 определялся дважды: в момент поступления больного в стационар и по завершении лечения.
У 10 больных с трофическими язвами нижних конечностей ИЛ-6 определялся дважды: в момент поступления больного в стационар и по завершении лечения. В ходе наблюдения достигнуто достоверное уменьшение концентрации ИЛ-6 – с 17,3 до 9,3 пг/мл (р=0,007), рис. 3. У 4 из 10 больных на фоне проводимой терапии уровень ИЛ-6 полностью нормализовался, еще у трех – практически нормализовался, снизившись до 7,25–7,57 пг/мл, при верхней границе нормы – 7 пг/мл (табл. 5). В табл. 5 представлена динамика концентрации ИЛ-6 и состояния язв в ходе наблюдения.

Как видно из представленной выше табл. 5, в 8 из 10 случаев снижение уровня ИЛ-6 в крови сопровождалось уменьшением размеров язв, их очищением и эпителизацией. У больной С. в ходе наблюдения размеры язв остались прежними, но появились грануляции в дне язв и прекратилось гнойное отделяемое.
У больной Б. размеры относительно небольшой язвы также остались прежними, но она стала заживать.
Обсуждение
Согласно доступным данным медицинской литературы, наше исследование представляет собой одно из немногочисленных исследований ИЛ-6 у больных с трофическими язвами нижних конечностей в пожилом и старческом возрасте. Повышенный уровень ИЛ-6 в крови обнаружен нами более чем у 3/4 пациентов с трофическими язвами. Хорошо известно, что ИЛ-6 играет ключевую роль в различных иммунных реакциях и в процессах воспаления, способствует активации Т-лимфоцитов и дифференцировке В-лимфоцитов, модулирует синтез острофазовых белков, индуцирует и другие проявления воспаления [11]. Предполагают, что ИЛ-6, наряду с другими провоспалительными цитокинами (ИЛ-1, ИЛ-8 и фактором некроза опухоли-α – ФНО-α) имеет важное значение в патогенезе хронических язв нижних конечностей [12].По нашим данным, повышение уровня ИЛ-6 наиболее часто отмечалось у больных со смешанными язвами (в 91% случаев); в этой группе пациентов концентрация данного цитокина была примерно в 2 раза выше, чем у больных с венозными и артериальными язвами. При этом различий по уровню и частоте повышения ИЛ-6 у пациентов с венозными и артериальными язвами не обнаружено. Результаты некоторых исследований свидетельствуют о более высокой концентрации ИЛ-6 в отделяемом артериальных язв, по сравнению с язвами чисто венозной этиологии [13]. Напротив, другие авторы не обнаружили влияния ишемии на уровень цитокинов при смешанных венозно-артериальных язвах [14].
У наших больных зарегистрирована прямая корреляция между уровнем ИЛ-6 и числом, а также размером язв, что может быть обусловлено большим «плацдармом» очага воспалительной активности с большим числом нейтрофилов и макрофагов, синтезирующих различные провоспалительные медиаторы, в том числе ИЛ-6. Аналогично нашим данным, в исследовании C. Wiegand и соавт. более высокие концентрации других провоспалительных цитокинов (ИЛ-1β и ИЛ-8) ассоциировались с большим размером язв [15]. В другой научной работе по изучению эффективности ультразвуковой терапии у больных с рефрактерными венозными язвами нижних конечностей было продемонстрировано ускорение заживления язв и уменьшение их размеров по мере снижения экспрессии таких провоспалительных цитокинов, как ИЛ-6, ИЛ-1, ФНО-α [16]. Результаты исследования J. Escandon и соавт. подтверждают, что заживление ран улучшается по мере стихания воспалительного процесса, который может препятствовать регенерации, а уровень провоспалительных цитокинов может служить дополнительным прогностическим фактором заживления ран [16]. В относительно небольшой подгруппе наших больных с трофическими язвами нижних конечностей также было продемонстрировано существенное снижение уровня ИЛ-6 по завершении курса лечения, что можно трактовать как очередное подтверждение патогенетической роли данного цитокина в длительном персистировании язв.
В наших наблюдениях обнаружена прямая взаимосвязь между повышением уровня ИЛ-6 и длительностью существования язв, при этом у больных с продолжительностью язв более года концентрация данного цитокина в крови была повышена в 100% случаев. Аналогично нашим данным, в исследовании C. Wiegand и соавт. была установлена прямая корреляция между уровнем другого ключевого провоспалительного цитокина ФНО-α и длительностью существования язв [15]. Известно, что хронические раны характеризуются персистирующим воспалением с гиперактивацией нейтрофилов и макрофагов и повышенным высвобождением провоспалительных цитокинов, тогда как при нормальном заживлении ран экспрессия ИЛ-6 достаточно быстро начинает снижаться при наступлении фазы ремоделирования и пролиферации [2, 6]. В исследовании F.A. Altay и соавт. у пациентов с диабетическими язвами в стадии заживления зарегистрировано значительное снижение уровня ИЛ-6 в крови через две недели лечения, тогда как у больных с отсутствием положительной динамики в состоянии язв концентрация ИЛ-6 не изменилась [17]. Напротив, в исследовании C-S. Pan и соавт. обнаружены значительно более высокие уровни ИЛ-6 в острых ранах по сравнению с хроническими [9]. Вместе с тем в вышеупомянутой работе в 14 из 18 образцов отделяемого хронических язв выявлены очень высокие уровни ИЛ-6 (более 30 пг/мл) [9]. Различия в результатах наших исследований могут быть обусловлены разным материалом для определения ИЛ-6: в нашей работе это была сыворотка крови, тогда как в вышеупомянутом – отделяемое ран, а известно, что состав отделяемого ран может отличаться от сыворотки крови.
По нашим данным, наблюдалась тенденция к более высокой концентрации ИЛ-6 у больных с инфицированными язвами, у пациентов с язвами, инфицированными такими высоко вирулентными патогенами, как Acinetobacter baumannii и Pseudomonas aeruginosa, а также в случае ко-инфекций. У 90% наших больных с повышением уровня ИЛ-6 более 30 пг/мл обнаружен рост микроорганизмов в язве, тогда как при концентрации ИЛ-6 менее 30 пг/мл – в 67% случаев. В исследовании S-C. Pan и соавт. пороговое значение ИЛ-6, равное 30 пг/мл, продемонстрировало хорошую чувствительность и специфичность в отношении ранней диагностики раневой инфекции, когда клинических проявлений еще не было [9]. В других научных работах у больных с трофическими язвами нижних конечностей, прежде всего венозной этиологии, более высокие уровни ИЛ-6, ИЛ-8 и ФНО-α также были обнаружены в случае язв с высокой бактериальной нагрузкой [12, 15, 17, 18]. Так, в исследовании
R. Serra и соавт. более высокие уровни ИЛ-6, ИЛ-1, ИЛ-8 и ФНО-α зарегистрированы у пациентов с инфицированными язвами, по сравнению с больными без локальной инфекции [17]. Показано, что ИЛ-6 обнаруживается в сыворотке крови уже на ранних стадиях инфекции, поэтому, по мнению ряда авторов, данный цитокин может быть более приемлемым и ранним суррогатным биомаркером для оценки раневой инфекции по сравнению с СРБ [9, 10, 19].
Аналогично нашим данным, в исследовании A. Ambrosch и соавт. было установлено, что при смешанных бактериальных инфекциях у больных с хроническими язвами нижних конечностей отмечались более высокие концентрации ИЛ-6 и ФНО-α по сравнению с мономикробными инфекциями [13]. В этом исследовании уровень ИЛ-6 был значительно повышен при высокой бактериальной нагрузке и при инфицировании Pseudomonas aeruginosa так же, как и у наших больных [13].
Полученные нами результаты свидетельствуют о различных взаимосвязях между ИЛ-6 и другими клиническими и лабораторными параметрами у больных пожилого и старческого возраста с трофическими язвами нижних конечностей. Так, в нашем исследовании зарегистрирована прямая корреляция между концентрацией ИЛ-6 и выраженностью старческой астении, оцененной с помощью шкалы «Возраст не помеха», и установлена обратная корреляция между уровнем данного цитокина и показателями инструментальной активности в повседневной жизни. Одним из важных эффектов ИЛ-6 в отношении различной возраст-ассоциированной патологии считают его влияние на развитие старческой астении и саркопении [11]. При старческой астении содержание ИЛ-6 выше, чем у лиц того же возраста без признаков астении, и повышенный уровень ИЛ-6 в крови позитивно коррелирует с такими маркерами старческой астении, как низкая скорость ходьбы и сниженная сила мышц [20].
В наших наблюдениях выявлена значимая прямая взаимосвязь между уровнем ИЛ-6 и общим содержанием лейкоцитов, а также числом нейтрофилов. Известно, что в ответ на воспаление ИЛ-6 способствует стимуляции и рекрутированию лейкоцитов в рану [9, 21]. В свою очередь, ИЛ-6 продуцируется главным образом полиморфноядерными лейкоцитами и макрофагами [12]. В нашей работе показана также взаимосвязь между ИЛ-6 и различными лейкоцитарными индексами. В другом нашем исследовании по изучению различных гематологических индексов в качестве маркеров субклинического воспаления у больных ишемической болезнью сердца в старческом возрасте также наблюдались достоверные взаимосвязи между ИЛ-6 и различными гематологическими индексами, числом лейкоцитов, нейтрофилов и СОЭ [22]. В нашей группе пациентов с язвами и повышенной концентрацией ИЛ-6 зарегистрированы более высокие показатели СРБ и СОЭ. В исследовании F.A. Altay и соавт. у больных с диабетическими язвами также наблюдалась положительная корреляция между ИЛ-6 и СОЭ, а также между ИЛ-6 и СРБ [19]. Хорошо известно, что ИЛ-6 играет ведущую роль в острофазовых реакциях и стимулирует синтез СРБ [7, 9].
При корреляционном анализе в нашей группе больных выявлена достоверная обратная взаимосвязь между уровнем ИЛ-6 и содержанием гемоглобина (р=0,001). По мнению ряда авторов, ИЛ-6 может играть ключевую роль в развитии анемии хронического воспаления. Предполагают, что ИЛ-6 подавляет эритропоэз, ингибирует синтез эритропоэтина, активирует гепсидин и нарушает утилизацию железа; все эти факторы приводят в итоге к развитию анемии [23].
Несмотря на ряд значимых данных, полученных в настоящем исследовании, в этой работе имеются некоторые ограничения. Это исследование выполнено при участии больных пожилого и старческого возраста с множественной коморбидной патологией, которая могла повлиять на результаты данного исследования. Наряду с этим, мы определяли концентрацию ИЛ-6
не в отделяемом язв, а в сыворотке крови, что, вероятно, менее чувствительно и специфично.
Заключение
Результаты настоящего исследования позволяют говорить об определенной патогенетической роли ИЛ-6 в развитии и хронизации трофических язв нижних конечностей у больных пожилого и старческого возраста. Повышение концентрации ИЛ-6 связано, прежде всего, с числом и длительностью существования язв, а также с различными гематологическими показателями. Полученные данные способствуют улучшению понимания патогенетических основ хронизации трофических язв нижних конечностей, что в будущем может привести к созданию топических лекарственных препаратов, направленных на подавление воспалительной активности в язвах и ускорение их заживления. С нашей точки зрения, рутинное определение и мониторинг концентрации ИЛ-6 в крови у больных пожилого и старческого возраста с трофическими язвами нижних конечностей нецелесообразны. С целью определения воспалительной активности в этой группе больных достаточно использование таких классических маркеров воспаления, как уровень СРБ, СОЭ, лейкоциты и их соотношения.Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Тополянская Светлана Викторовна – д-р мед. наук, доц. каф. госпитальной терапии №2, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет), врач-терапевт, ГБУЗ ГВВ №3. E-mail: sshekshina@yahoo.com; ORCID: 0000-0002-4131-8432
Svetlana V. Topolyanskaya – Dr. Sci. (Med.), War Veterans Hospital No3; Sechenov First Moscow State Medical University (Sechenov University). E-mail: sshekshina@yahoo.com; ORCID: 0000-0002-4131-8432
Бубман Леонид Игоревич – зав. 7-м хирургическим отделением, ГБУЗ ГВВ №3. E-mail: bubmanleo@gmail.com; ORCID: 0000-0002-4195-3188
Leonid I. Bubman – Head of the Surgical Department No7, War Veterans Hospital No3. E-mail: bubmanleo@gmail.com; ORCID: 0000-0002-4195-3188
Карпов Виктор Викторович – врач-хирург 7-го хирургического отделения, ГБУЗ ГВВ №3
Viktor V. Karpov – Surgeon, War Veterans Hospital No3
Нечаев Алексей Игоревич – врач-хирург 7-го хирургического отделения, ГВВ №3
Aleksei I. Nechaev – Surgeon, War Veterans Hospital No3
Хан Станислав Олегович – врач-хирург 7-го хирургического отделения, ГВВ №3
Stanislav O. Khan – Surgeon, War Veterans Hospital No3
Васильева Юлия Юрьевна – врач клинико-диагностической лаборатории, ГВВ №3
Yulia Yu. Vasilyeva – doctor of the clinical diagnostic laboratory, War Veterans Hospital No3
Лыткина Каринэ Арнольдовна – канд. мед. наук, зам. глав. врача по терапии, ГБУЗ ГВВ №3. E-mail: lytkina.k@mail.ru; ORCID: 0000-0001-9647-7492
Karine A. Lytkina – Cand. Sci. (Med.), War Veterans Hospital No3. E-mail: lytkina.k@mail.ru; ORCID: 0000-0001-9647-7492
Мелконян Георгий Геннадьевич – д-р мед. наук, проф., глав. врач, ГБУЗ ГВВ №3. E-mail: gvv3@zdrav.mos.ru; ORCID: 0000-0002-4021-5044
Georgii G. Melkonyan – Dr. Sci. (Med.), Prof., Chief doctor War Veterans Hospital No3. E-mail: gvv3@zdrav.mos.ru; ORCID: 0000-0002-4021-5044
Рачина Светлана Александровна – д-р мед. наук, проф., зав. каф. госпитальной терапии №2, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: svetlana.ratchina@antibiotic.ru; ORCID: 0000-0002-3329-7846
Svetlana A. Ratchina – Dr. Sci. (Med.), Prof., Sechenov First Moscow State Medical University (Sechenov University). E-mail: svetlana.ratchina@antibiotic.ru; ORCID: 0000-0002-3329-7846
Дворецкий Леонид Иванович – д-р мед. наук, проф., проф. каф. госпитальной терапии №2, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: dvoretski@mail.ru; ORCID: 0000-0003-3186-0102
Leonid I. Dvoretsky – Dr. Sci. (Med.), Full Prof., Sechenov First Moscow State Medical University (Sechenov University). E-mail: dvoretski@mail.ru; ORCID: 0000-0003-3186-0102
Поступила в редакцию: 16.10.2023
Поступила после рецензирования: 23.10.2023
Принята к публикации: 26.10.2023
Received: 16.10.2023
Revised: 23.10.2023
Accepted: 26.10.2023
Список исп. литературыСкрыть список1. Hellström A, Nilsson C, Nilsson A et al. Leg ulcers in older people: a national study addressing variation in diagnosis, pain and sleep disturbance. BMC Geriatr. 2016; 16: 25. DOI: 10.1186/s12877-016-0198-1
2. Makrantonaki E, Wlaschek M, Scharffetter-Kochanek K. Pathogenesis of wound healing disorders in the elderly. J Dtsch Dermatol Ges. 2017; 15 (3): 255–75. DOI: 10.1111/ddg.13199
3. Gurtner GC, Werner S, Barrandon Y, Longaker MT. Wound repair and regeneration. Nature. 2008; 453 (7193): 314–21. DOI: 10.1038/nature07039
4. Johnson BZ, Stevenson AW, Prêle CM et al. The Role of IL-6 in Skin Fibrosis and Cutaneous Wound Healing. Biomedicines. 2020; 8 (5): 101. DOI: 10.3390/biomedicines8050101
5. Willenborg S, Eming SA. Macrophages – sensors and effectors coordinating skin damage and repair. J Dtsch Dermatol Ges. 2014; 12 (3): 214–21. DOI: 10.1111/ddg.12290
6. Charles CA, Romanelli P, Martinez ZB et al. Tumor necrosis factor-alfa in nonhealing venous leg ulcers. J Am Acad Dermatol. 2009; 60 (6): 951–55. DOI: 10.1016/j.jaad.2008.09.012
7. Hajong R, Newme K, Nath CK et al. Role of serum C-reactive protein and interleukin-6 as a predictor of intra-abdominal and surgical site infections after elective abdominal surgery. J Family Med Prim Care. 2021; 10 (1): 403–6. DOI: 10.4103/jfmpc.jfmpc_1191_20
8. Karakas A, Arslan E, Cakmak T et al. Predictive Value of Soluble CD14, Interleukin-6 and Procalcitonin For Lower Extremity Amputation in People with Diabetes with Foot Ulcers: A Pilot Study. Pak J Med Sci. 2014; 30 (3): 578–82. DOI: 10.12669/pjms.303.4575
9. Pan S-C, Wu Y-F, Lin Y-C et al. Paper-Based Interleukin-6 Test Strip for Early Detection of Wound Infection. Biomedicines. 2022; 10 (7): 1585. DOI: 10.3390/biomedicines10071585
10. Korkmaz P, Koçak H, Onbaşı K et al. The Role of Serum Procalcitonin, Interleukin-6, and Fibrinogen Levels in Differential Diagnosis of Diabetic Foot Ulcer Infection. J Diabetes Res. 2018; 2018: 7104352. DOI: 10.1155/2018/7104352
11. Тополянская С.В. Роль интерлейкина-6 при старении и возраст-ассоциированных заболеваниях. Клиницист. 2020; 14 (3–4): 10–7. DOI: 10.17650/1818-8338-2020-14-3-4-K633
Topolyanskaya SV. The role of interleukin 6 in aging and age-associated diseases. Clinician. 2020; 14 (3–4): 10–7. DOI: 10.17650/1818-8338-2020-14-3-4-K633 (in Russian).
12. Burian EA, Sabah L, Karlsmark T et al. Cytokines and Venous Leg Ulcer Healing – A Systematic Review. Int J Mol Sci. 2022; 23: 6526. DOI: 10.3390/ijms23126526
13. Ambrosch A, Lobmann R, Pott A, Preissler J. Interleukin-6 concentrations in wound fluids rather than serological markers are useful in assessing bacterial triggers of ulcer inflammation. Int Wound J. 2008; 5 (1): 99–106. DOI: 10.1111/j.1742-481X.2007.00347.x
14. Trengove NJ, Bielefeldt-Ohmann H, Stacey MC. Mitogenic activity and cytokine levels in non-healing and healing chronic leg ulcers. Wound Repair Regen. 2000; 8 (1): 13–25. DOI: 10.1046/j.1524-475x.2000. 00013.x.
15. Wiegand C, Bittenger K, Galiano RD, Driver VR, Gibbons GW. Does noncontact low-frequency ultrasound therapy contribute to wound healing at the molecular level? Wound Repair Regen. 2017; 25 (5): 871–82. DOI: 10.1111/wrr.12595
16. Escandon J, Vivas AC, Perez R et al. A prospective pilot study of ultrasound therapy effectiveness in refractory venous leg ulcers. Int Wound J. 2012; 9 (5): 570–8. DOI: 10.1111/j.1742-481X.2011.00921.x
17. Serra R, Grande R, Buffone G et al. Extracellular matrix assessment of infected chronic venous leg ulcers: role of metalloproteinases and inflammatory cytokines. Int Wound J. 2016; 13 (1): 53–8. DOI: 10.1111/iwj.12225
18. McInnes RL, Cullen BM, Hill KE et al. Contrasting host immuno-inflammatory responses to bacterial challenge within venous and diabetic ulcers. Wound Repair Regen. 2014; 22: 58–69.
19. Altay FA, Sencan İ, Şentürk GÇ et al. Does treatment affect the levels of serum interleukin-6, interleukin-8 and procalcitonin in diabetic foot infection? A pilot study. J Diabetes Complications. 2012; 26 (3): 214–8. DOI: 10.1016/j.jdiacomp.2012.03.018
20. Cesari M, Penninx BW, Pahor M et al. Inflammatory markers and physical performance in older persons: the InCHIANTI study. J Gerontol A BiolSci Med Sci. 2004; 59 (3): 242–8. DOI: 10.1093/gerona/59.3.m242
21. Krzyszczyk P, Schloss R, Palmer A, Berthiaume F. The Role of Macrophages in Acute and Chronic Wound Healing and Interventions to Promote Pro-wound Healing Phenotypes. Front Physiol. 2018; 9: 419. DOI: 10.3389/fphys.2018.00419
22. Тополянская С.В., Елисеева Т.А., Турна О.И. и др. Гематологические индексы – возможный маркер субклинического воспаления у больных ишемической болезнью сердца старческого возраста и долгожителей. Клинический разбор в общей медицине. 2022; 3 (6): 6–13. DOI: 10.47407/kr2022.3.6.00169
Topolyanskaya SV, Eliseeva TA, Tyurina OI et al. Hematological indices are a possible marker of subclinical inflammation in senile and long–lived patients with coronary heart disease. Clinical review for general practice. 2022; 3 (6): 6–13. DOI: 10.47407/kr2022.3.6.00169 (in Russian).
23. MacCiò A, Madeddu C. Management of Anemia of inflammation in the elderly. Anemia. 2012; 2012: 563251. DOI: 10.1155/2012/563251
12 декабря 2023
Количество просмотров: 2040


