Клинический разбор в общей медицине №9 2024
1 Bukhara State Medical Institute named after Abu Ali ibn Sino, Bukhara, Uzbekistan;
2 Tashkent Pediatric Institute, Tashkent, Uzbekistan;
3 Doctor D Clinic, Tashkent, Uzbekistan;
4 Urgench branch of Tashkent Medical Academy, Khorezm, Uzbekistan
ixtiyarova7272@mail.ru
Abstract
Aim. To study the genetic significance of antiphospholipid syndrome in the development of gestational hypertension and the prevention of thrombolytic complications. Study design: an open independent prospective study.
Material and methods. 126 women were included in the study: of them, group I (main) consisted of 49 pregnant women with gestational hypertension who had autoantibodies to phospholipids, group II (comparative) 47 women with gestational hypertension in whom autoantibodies to phospholipids were not detected, and group III (control) 30 relatively conditionally healthy pregnant women.
Results. Analysis of the data obtained shows that all polymorphisms of the G/A genotype of the F2 gene occur in women with gestational hypertension and in the control group. The study of the genetic structure of this marker indicates that the mutation capacity of the gene is relatively high. in the group of women with gestational hypertension diagnosed with AFS compared to the control group. Allele A and heterozygous type G/A of the genotype of the F2 gene may be one of the important molecular genetic markers of the development of AFS in the population of Uzbekistan (R<0.01). The data obtained showed that the unfavorable allele A of the F2 gene (endocrinopathy) is more common, indicating the presence of autoimmune processes in the body, this position is confirmed by literature data, and in the prevention of AFS, the identification of risk factors in women with gestational hypertension is observed.
Conclusion. Rational consideration of these factors determines the direction of preventive measures in women at risk in order to improve the course of pregnancy, childbirth and reproductive outcomes.
Keywords: molecular genetics, risk factors, anemia, hypertension, antiphosphalipid syndrome.
For citation: Ikhtiyarova G.A., Dustova N.K., Bahramova Sh.U., Ruzieva N.H., Irgashev D.S., Matrizaeva G.J. Molecular genetic markers of hypertension risk in pregnant women with antiphospholipid syndrome. Clinical review for general practice. 2024; 5 (9): 62–69 (In Russ.).
DOI: 10.47407/kr2024.5.9.00480
Генетические и приобретенные тромбофилии играют важную роль в возникновении различных акушерских осложнений. Ряд зарубежных ученых-исследователей стали рассматривать гипертензивные состояния при беременности с точки зрения генетической, возможно скрытой тромбофилии [2, 5, 13]. Учитывая, что беременность сама по себе увеличивает риск гиперкоагуляции, присоединение АФС приводит к дальнейшему увеличению риска тромбообразования у матери [11, 14]. Задачами исследования является использование современных технологий в диагностике сочетания гипертензивных состояний и АФС. Ряд изменений в системе свертывания крови, таких как тромбофилия в организме матери, подтверждает, что это приводит к развитию патогенетических механизмов отягощения беременности. [7–9]. Антенатальная смертность у беременных с данной патологией выше в 3–6 раз, а риск мертворождения увеличивается в 6 раз.
Цель исследования – изучить генетическую значимость АФС в развитии гестационной гипертензии и профилактике тромболитических осложнений.
Диагноз гестационная гипертензия и АФС у беременных устанавливался на основании национальных стандартов перинатальной помощи беременным и детям Республики Узбекистан.
96 беременных с гестационной гипертензией, составившие основную группу, в дальнейшем были разделены на две группы в зависимости от диагноза.
В группу I (основную) вошли 49 (36,0%) беременных с гестационной гипертензией различной степени со сроком 22–40 нед, у которых было 2 и более выкидышей или преждевременных родов, и у которых в крови определялись антифосфолипидные антитела.
Группа II (сравнения) – 47 (34,0%) беременных с гестационной гипертензией различной степени в сроке 22–40 нед без выявления в крови антифосфолипидных антител.
В контрольную группу вошли 30 (30,0%) женщин, обратившихся в родильный комплекс в связи с физиологической беременностью.
Большинство беременных обеих групп (68,3% и 65,0% соответственно по группам), у которых выявлена легкая гипертензия, были в возрасте 20–25 лет.
Большинство беременных групп I и II, у которых наблюдалась тяжелая гипертензия, были в возрасте от 26 до 35 лет. Среди обследованных беременных превалировали домохозяйки (57,1%, 46,5% соответственно по группам). В анамнезе детские инфекции наблюдались у 30 (63,8%) беременных женщин группы I, у группы II – 25 (51,0%). Частые острые респираторные инфекции в настоящей беременности отмечались у 23 (46,9%) беременных группы I, у 15 (31,9%) – группы II. Индекс перенесенных заболеваний в группе I составил 2, в группе II – 1,6, что указывает на связь частоты перенесенных заболеваний и развитием гипертензии. Видимо эта зависимость возникла в результате снижения иммунитета у женщин, имеющих более отягощенный анамнез. Заболевания печени и желчевыводящих путей, щитовидной железы, органов дыхания и мочевыделительной системы встречались не часто, в единичных случаях.
Артериальная гипертензия у обследованных нами беременных отмечалась в пределах 155/112–178/125 в группе I, составив в среднем 164,3±2,1/117,5±1,6 мм рт. ст.
В группе II у беременных наблюдалась артериальная гипертензия, которая была в пределах 165/110–180/120 мм рт. ст., составив в среднем 171,3±3,1–121,6±2,4 мм рт. ст. Суточная протеинурия составила в среднем 0,391±0,14. Средние цифры артериального давления в контрольной группе составляли 110,7±1,9/71,1±1,3 мм рт. ст.
Приведенные выше цифры свидетельствуют о прямой связи степени тяжести АФС с уровнем артериальной гипертензии и уровнем протеинурии (коэффициент корреляции составил r=0,65 – сильная прямая связь у беременных группы I и r=0,59 – сильная прямая связь у беременных группы II). По сравнению со средним артериальным давлением в контрольной группе, у женщин группы II показатели были выше таковых на 54,5% (p<0,001).
С целью изучения гемодинамических нарушений в фетоплацентарном комплексе у беременных с диагнозом АФС изучали систоло-диастолическое отношение (СДО) в маточной артерии и артерии пуповины.
По данным допплерометрии у беременных 1-й группы наблюдались нарушения маточно-плацентарного кровотока (21,9%), плацентарно-плодового (39,1%) и маточно-плацентарно-плодового кровотока (35,6%) (табл. 1).
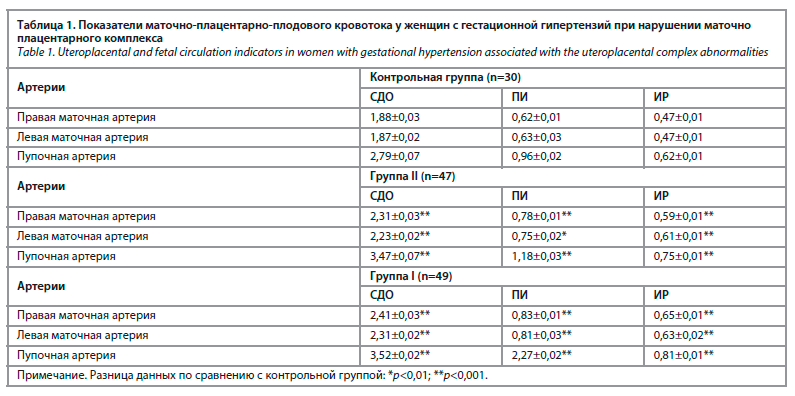
При обследовании сосудов у женщин исследуемых групп определялись нормальные показатели кривизны кровотока. В группе I нарушения гемодинамики 1-й степени выявлены у 10 (38,5%) плодов и у 12 (50,0%) – во 2-й группе. Гемодинамические нарушения 2-й степени наблюдались у 9 (37,5%) женщин группы I и у 9 (34,6%) беременных группы II. Нарушения гемодинамики 3-й степени наблюдались у 7 (26,9%) беременных из группы I и у 3 (12,5%) из группы II.
Патологические допплеровские изменения показывают, что положение плода и дистресс можно оценить, наблюдая за дыхательной и двигательной активностью. Они не являются особым признаком, а оцениваются как состояние, угрожающее жизненным функциям плода, и помогают решить вопрос о тактике вынашивания беременной, способе и сроках ее родоразрешения.
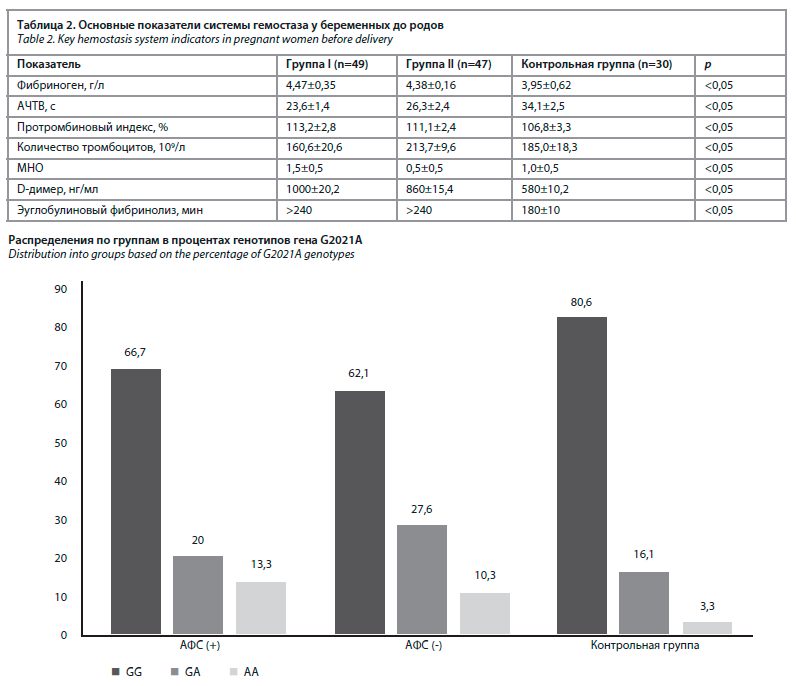
Данные коагулограммы представлены в табл. 2. Она показывает концентрацию фибриногена у обследованных женщин в группе I (4,47±0,35) и группе II (4,38±0,16), что сопоставимо с показателями контрольной группы в пренатальный период (3,95±0,62), который оказался достоверно выше (r<0,05).
У беременных с гестационной гипертензией количество тромбоцитов в крови, являющееся одним из важных показателей системы гемостаза, составило в группе I 160,6±20,6, в группе II – 165,2±21,8, в группе III – 275,0±18,3.
Подобные гематологические сдвиги у беременных с гестационной гипертензией свидетельствуют о нарушении окислительно-восстановительных процессов в женском организме, что создает благоприятные условия для острого и хронического ДВС-синдрома.
При норме АЧТВ 26,1–36,5 с, увеличение АЧТВ свидетельствует о высоком риске кровотечения, а его снижение по сравнению с нормой свидетельствует о склонности к тромбообразованию, в нашем исследовании этот показатель составляет 23,9% в группе I и 31,0% в группе II по сравнению с контрольной группой.
Показатели ортофенантролинового теста у беременных были выше, чем в группе I (26,0±2,0 мг/мл), группе II (25,0±2,0 мг/мл), контрольной группе (8,0±2,0 мг/мл).
В группах I и II показатель продукта распада фибрина (D-димер) составляет 33% и 31% (табл. 2).
По результатам молекулярно-генетического исследования, проведенного у беременных, выявлены следующие показатели путем изучения полиморфизма генов генотипа F2 протромбина (фактора свертывания крови II) и распределения генотипов гена G2021A(rs180133) G<A, которые приведены на рисунке.
При изучении распределения аллелей полиморфизма гена протромбина F2 были определены следующие показатели (табл. 3).
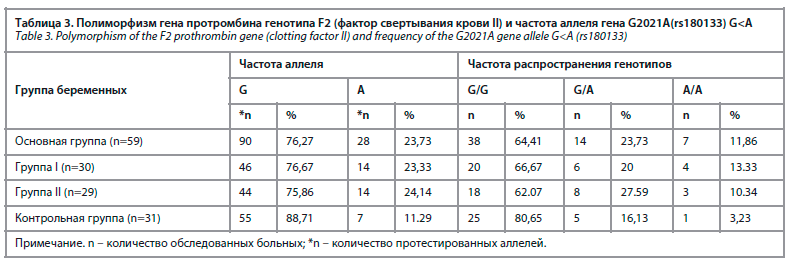
В зависимости от процента встречаемости гена G2021A нормальный G-аллель наблюдался у 76,67% беременных с АФС(+) с гестационной гипертензией.
С другой стороны, этот показатель составил 75,86% у беременных без АФС с гестационной гипертензией и 88,71% в контрольной группе. Мутантный аллель был обнаружен у 11,29% беременных контрольной группы, а в первой и второй группах он составил 23,33% и 24,14% соответственно (табл. 4).
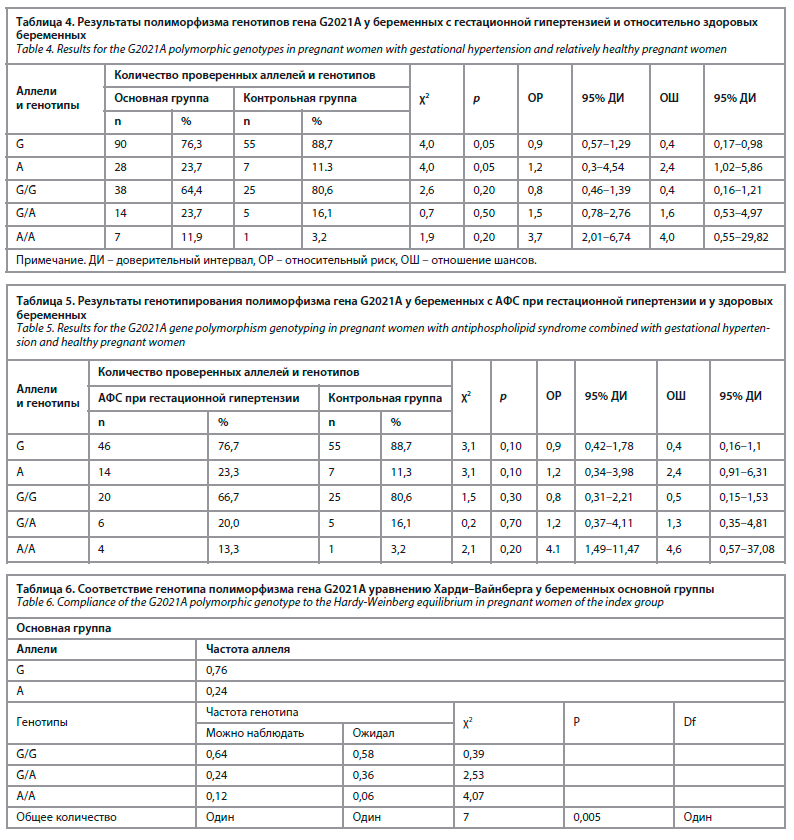
По процентному распределению доброкачественных вариантных генотипов по гену G2021A у всех беременных с гестационной гипертензией и в контрольной группе установлено превосходство второй группы над первой (3,3 и 80,6% соответственно). Гетерозиготный генотип показал практически одинаковый результат в двух группах испытуемых (20% и 27,6% соответственно). Гетерозиготный генотип является фактором, влияющим на развитие гестационной гипертензии, и этот вариант имеет большое значение (χ2=0,7; ОР 1,6; 95% ДИ 0,53–4,97, р=0,5). Однако при изучении мутантной формы А/А было установлено, что она выявлялась в большинстве случаев у пациенток, в отличие от контрольной группы, и подтверждалась как важный фактор риска развития гестационной гипертензии, 11,9% и 3,2% соответственно (χ2=1,9; ОР 4,0; 95% ДИ 0,55–29,82, р<0,2).
В группе I (30 женщин с гестационной гипертензией с АФС) хорошее качество аллель G выявлялось в 83,3% (50/60) и неблагоприятный аллель А в 16,6% (10/60) случаев. У женщин, которые физиологически беременны, G2021A F2 гена – 82,3% (51/62), а аллель А выявлен у 17,7% (11/62) (χ2=0,02; ОР 0,88; ОШ 0,93; 95% ДИ 0,36–2,38).
В ходе исследования, когда мы разделили полиморфное распространение гена G2021A на группы у пациенток с гестационной гипертензией, было установлено, что он является важным и достоверным фактором развития мутантной формы (А/А) у пациенток с АФС. (χ2=1,9; ОШ 4; 95% ДИ 0,55–2,82, р=0,2). В частности, в нашем исследовании преобладала гомозиготная форма генотипа: вариант (G/G) с достоверной разницей в контрольной группе (80,6%), этот вариант составил 66,7% у беременных с GG с АФС(+). Мутантная форма гомозиготного генотипа выявляется у 13,3% беременных с гестационной гипертензией, антифосфолипидные антитела, а гетерозиготного генотипа – у 20%. У относительно здоровых беременных этот показатель составил 3,2 и 16,1% соответственно (табл. 5).
Распределение генотипов по изучаемым полиморфным локусам проверяли на равновесие Харди–Вайнберга. Ожидаемый результат наблюдался на высоком уровне в основной группе генотипов G2021A (табл. 6).
Результаты оценки прогностической способности (AUC) составили 0,57, 0,56 и 0,57 соответственно. Хотя прогностические значения были скромными, моделирование было более надежным у беременных без АФС, чем у беременных с АФС (табл. 7).

Гипертензивные состояния во время беременности могут быть признаком тромбофилии. В то же время исследование показало, что гетерозиготный генотип также оказывает индуцированное влияние на развитие гестационной гипертензии (χ2=0,7; p=0,50). Однако в основной группе, а также в группах АФС(+) и АФС(-) гомозиготный вариант хорошего типа играл протективную роль в отношении возникновения гестационной гипертензии. Что касается уравнения Харди–Вайнберга, мы обнаружили высоко достоверную разницу между ожидаемыми и наблюдаемыми результатами в основной группе (χ2=4,07). Оценка эффективности предсказания полиморфизма, как упоминалось выше, показала только 0,55, что означает недостоверность предсказания эффективности в отношении мутантного аллеля и генотипа.
Отсюда можно сделать вывод, что мутантная форма гена (А/А) G2021A(rs180133) играет важную индуктирующую роль в патогенезе гестационной гипертензии.
Также было важно увидеть частоту выявления сопутствующей патологии в каждой исследуемой группе.
У беременных с диагнозом АФС с гестационной гипертензией встречаемость анемии 1–2-й степени выявлена в 43,1% случаев, эндокринопатии (сахарный диабет, заболевания щитовидной железы) – 32,1%, заболеваний мочевыводящих путей – 14,7%, варикозной болезни – у каждой второй. Аутоантитела к фосфолипидам при гипертензивных расстройствах обнаруживались практически у всех женщин с преморбидным фоном. Выявление гипертензивных расстройств у беременной
обусловливает отнесение ее к группе высокого риска в связи с патологиями, приводящими к ряду осложнений беременности: таких как преждевременные роды (20,4%, 6 случаев из 30), отслойка нормально расположенной плаценты (12%), антенатальная гибель плода (2,6%). А у беременных с гестационной гипертензией без АФС встречаемость анемии выявлена в 34,7% случаев, варикозная болезнь – в 27,5%, заболевания мочевыводящих путей – в 24,7% случаев. Анемия выявлена в 26,3% случаев и у женщин с условно физиологическим течением беременности.
В результате углубленного анализа акушерского анамнеза обследованных беременных неразвивающаяся беременность выявлена у 40% беременных с диагнозом АФС (12 из 30 случаев) и у 10,3% беременных без диагноза АФС (3 из 29 случаев).
Анализ полученных данных показывает, что все полиморфизмы генотипа G/A гена F2 встречаются у женщин с гестационной гипертензией и в контрольной группе. Изучение генетической структуры этого маркера указывает на то, что мутационная способность гена относительно высока в группе женщин с гестационной гипертензией с диагнозом АФС по сравнению с контрольной группой.
Полученные данные показали, что чаще встречается неблагоприятный аллель А гена F2 (эндокринопатии), свидетельствующий о наличии аутоиммунных процессов в организме, это положение подтверждает данные литературы, а в профилактике АФС наблюдается выявление факторов риска у женщин с гестационной гипертензией. Таким образом, аутоантитела к фосфолипидам при гипертензивных расстройствах обнаруживались практически у всех женщин с преморбидным фоном. Выявление гипертензивных расстройств у беременных с АФС обусловливает отнесение ее к группе высокого риска в связи с патологиями, приводящими к ряду осложнений беременности: преждевременные роды (20,4%), отслойка плаценты (12%), антенатальная гибель плода (6,6%) и неразвивающаяся беременность в анамнезе (40%). Неблагоприятная аллель А и гетерозиготный тип генотипа А/A гена F2 являются одним из важных молекулярно-генетических маркеров развития гипертензивных нарушений в популяции Узбекистана (R<0,01). Всем беременным с отягощенным анамнезом, входящих в группу риска перинатальных осложнений, рекомендовано после лабораторных и генетических исследований предгравидарно начать модификацию образа жизни, лечение анемии длительно, применение антикоагулянтов (Фленокс 0,4) и антиагрегантов в прегравидарном периоде и во время беременности.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Ихтиярова Гульчехра Акмаловна – д-р мед. наук, проф., зав. каф. акушерства и гинекологии №1, Бухарский государственный медицинский институт имени Абу Али ибн Сино. E-mail: ixtiyarova7272@mail.ru; ORCID: 0000-0002-2398-3711
Gulchehra A. Ikhtiyarova – Dr. Sci. (Med.), Bukhara State Medical Institute named after Abu Ali ibn Sino. E-mail: ixtiyarova7272@mail.ru; ORCID: 0000-0002-2398-3711
Дустова Нигора Кахрамоновна – д-р мед. наук, доц. каф. акушерства и гинекологии №1, Бухарский государственный медицинский институт имени Абу Али ибн Сино. E-mail: nigoradustova78@gmail.com; ORCID: 0000-0003-0707-5673
Nigora K. Dustova – Dr. Sci. (Med.), Bukhara State Medical Institute named after Abu Ali ibn Sino. E-mail: nigoradustova78@gmail.com;
ORCID: 0000-0003-0707-5673
Бахрамова Шахноза Усмановна – канд. мед. наук, ассистент каф. акушерства и гинекологии №1, Бухарский государственный медицинский институт имени Абу Али ибн Сино. E-mail: bahromovashahnoza585@gmail.com
Shakhnoza U. Bakhramova – Cand. Sci. (Med.), Bukhara State Medical Institute named after Abu Ali ibn Sino. E-mail: bahromovashahnoza585@gmail.com
Рузиева Нодира Хакимовна – Ташкентский педиатрический институт. E-mail: nod_ruz@internet.ru; ORCID:0000-0003-0679
Nodira Kh. Ruzieva – Tashkent Pediatric Institute.
E-mail: nod_ruz@internet.ru; ORCID:0000-0003-0679
Иргашев Дилмурод Соатович – Клиника «Doctor D», Ташкент
Dilmurod S. Irgashev – Doctor D Clinic
Матризаева Гульнора Джуманиязовна – Ургенчский филиал Ташкентской медицинской академии. E-mail: gmatrizayeva@gmail.com; ORCID: 0009-0001-2796-8041
Gulnora D. Matrizayeva – Urgench branch of Tashkent Medical Academy. E-mail: gmatrizayeva@gmail.com; ORCID: 0009-0001-2796-8041
Поступила в редакцию: 16.09.2024
Поступила после рецензирования: 24.09.2024
Принята к публикации: 26.09.2024
Received: 16.09.2024
Revised: 24.09.2024
Accepted: 26.09.2024
Клинический разбор в общей медицине №9 2024
Молекулярно-генетические маркеры риска развития гипертензии у беременных с антифосфолипидным синдромом
Номера страниц в выпуске:62-69
Аннотация
Цель. Изучить генетическую значимость антифосфолипидного синдрома (АФС) в развитии гестационной гипертензии и профилактике тромболитических осложнений.
Дизайн. Открытое независимое проспективное исследование.
Материал и методы. В исследование были включены 126 женщин: из них группу I (основную) составили 49 беременные с гестационной гипертензией, у которых выявлялись аутоантитела к фосфолипидам, группу II (сравнительную) – 47 женщин с гестационной гипертензией, у которых аутоантитела к фосфолипидам не выявлялись, группу III (контрольную) – 30 относительно условно здоровых беременных.
Результаты. Анализ полученных данных показывает, что все полиморфизмы генотипа G/A гена F2 встречаются у женщин с гестационной гипертензией и в контрольной группе. Изучение генетической структуры этого маркера указывает на то, что мутационная способность гена относительно высока в группе женщин с гестационной гипертензией с диагнозом АФС по сравнению с контрольной группой. Аллель А и гетерозиготный тип G/А генотипа гена F2 могут быть одними из важных молекулярно-генетических маркеров развития АФС в популяции Узбекистана (R<0,01). Полученные данные показали, что чаще встречается неблагоприятный аллель А гена F2 (эндокринопатии), свидетельствующий о наличии аутоиммунных процессов в организме, это положение подтверждает данные литературы, а в профилактике АФС наблюдается выявление факторов риска у женщин с гестационной гипертензией.
Заключение. Рациональный учет указанных факторов определяет направленность профилактических мероприятий у женщин группы риска с целью улучшения течения беременности, родов и репродуктивных исходов.
Ключевые слова: молекулярная генетика, факторы риска, анемия, гипертензия, антифосфолипидный синдром.
Для цитирования: Ихтиярова Г.А., Дустова Н.К., Бахрамова Ш.У., Рузиева Н.Х., Иргашев Д.С., Матризаева Г.Ж. Молекулярно-генетические маркеры риска развития гипертензии у беременных с антифосфолипидным синдромом. Клинический разбор в общей медицине. 2024; 5 (9): 62–69. DOI: 10.47407/kr2024.5.9.00480
Цель. Изучить генетическую значимость антифосфолипидного синдрома (АФС) в развитии гестационной гипертензии и профилактике тромболитических осложнений.
Дизайн. Открытое независимое проспективное исследование.
Материал и методы. В исследование были включены 126 женщин: из них группу I (основную) составили 49 беременные с гестационной гипертензией, у которых выявлялись аутоантитела к фосфолипидам, группу II (сравнительную) – 47 женщин с гестационной гипертензией, у которых аутоантитела к фосфолипидам не выявлялись, группу III (контрольную) – 30 относительно условно здоровых беременных.
Результаты. Анализ полученных данных показывает, что все полиморфизмы генотипа G/A гена F2 встречаются у женщин с гестационной гипертензией и в контрольной группе. Изучение генетической структуры этого маркера указывает на то, что мутационная способность гена относительно высока в группе женщин с гестационной гипертензией с диагнозом АФС по сравнению с контрольной группой. Аллель А и гетерозиготный тип G/А генотипа гена F2 могут быть одними из важных молекулярно-генетических маркеров развития АФС в популяции Узбекистана (R<0,01). Полученные данные показали, что чаще встречается неблагоприятный аллель А гена F2 (эндокринопатии), свидетельствующий о наличии аутоиммунных процессов в организме, это положение подтверждает данные литературы, а в профилактике АФС наблюдается выявление факторов риска у женщин с гестационной гипертензией.
Заключение. Рациональный учет указанных факторов определяет направленность профилактических мероприятий у женщин группы риска с целью улучшения течения беременности, родов и репродуктивных исходов.
Ключевые слова: молекулярная генетика, факторы риска, анемия, гипертензия, антифосфолипидный синдром.
Для цитирования: Ихтиярова Г.А., Дустова Н.К., Бахрамова Ш.У., Рузиева Н.Х., Иргашев Д.С., Матризаева Г.Ж. Молекулярно-генетические маркеры риска развития гипертензии у беременных с антифосфолипидным синдромом. Клинический разбор в общей медицине. 2024; 5 (9): 62–69. DOI: 10.47407/kr2024.5.9.00480
Molecular genetic markers of hypertension risk in pregnant women with antiphospholipid syndrome
Gulchehra A. Ikhtiyarova1, Nigora K. Dustova1, Shakhnoza U. Bakhramova1, Nodira Kh. Ruzieva2, Dilmurod S. Irgashev3, Gulnora D. Matrizayeva41 Bukhara State Medical Institute named after Abu Ali ibn Sino, Bukhara, Uzbekistan;
2 Tashkent Pediatric Institute, Tashkent, Uzbekistan;
3 Doctor D Clinic, Tashkent, Uzbekistan;
4 Urgench branch of Tashkent Medical Academy, Khorezm, Uzbekistan
ixtiyarova7272@mail.ru
Abstract
Aim. To study the genetic significance of antiphospholipid syndrome in the development of gestational hypertension and the prevention of thrombolytic complications. Study design: an open independent prospective study.
Material and methods. 126 women were included in the study: of them, group I (main) consisted of 49 pregnant women with gestational hypertension who had autoantibodies to phospholipids, group II (comparative) 47 women with gestational hypertension in whom autoantibodies to phospholipids were not detected, and group III (control) 30 relatively conditionally healthy pregnant women.
Results. Analysis of the data obtained shows that all polymorphisms of the G/A genotype of the F2 gene occur in women with gestational hypertension and in the control group. The study of the genetic structure of this marker indicates that the mutation capacity of the gene is relatively high. in the group of women with gestational hypertension diagnosed with AFS compared to the control group. Allele A and heterozygous type G/A of the genotype of the F2 gene may be one of the important molecular genetic markers of the development of AFS in the population of Uzbekistan (R<0.01). The data obtained showed that the unfavorable allele A of the F2 gene (endocrinopathy) is more common, indicating the presence of autoimmune processes in the body, this position is confirmed by literature data, and in the prevention of AFS, the identification of risk factors in women with gestational hypertension is observed.
Conclusion. Rational consideration of these factors determines the direction of preventive measures in women at risk in order to improve the course of pregnancy, childbirth and reproductive outcomes.
Keywords: molecular genetics, risk factors, anemia, hypertension, antiphosphalipid syndrome.
For citation: Ikhtiyarova G.A., Dustova N.K., Bahramova Sh.U., Ruzieva N.H., Irgashev D.S., Matrizaeva G.J. Molecular genetic markers of hypertension risk in pregnant women with antiphospholipid syndrome. Clinical review for general practice. 2024; 5 (9): 62–69 (In Russ.).
DOI: 10.47407/kr2024.5.9.00480
Введение
Во всем мире гипертензивные нарушение при беременности и тромбофилические осложнения, вызванные нарушениями свертывающей системы крови, занимают 10% от всех соматических патологий. По данным Всемирной организации здравоохранения, преэкламп-сия и гипертензивные нарушения при беременности занимают 2-е место среди причин материнской смертности и встречаются в 14% случаев [1–4]. Охрана здоровья матери и ребенка является одним из основных направлений политики Республики Узбекистан. Антифосфолипидный синдром (AФС) – одна из самых актуальных междисциплинарных проблем современной медицины, которая исследуется как уникальный пример аутоиммунной тромботической васкулопатии [1, 3, 5]. Существует генетическая предрасположенность к повышенному синтезу антифосфолипидных антител, и большинство из них было обнаружено у родственников пациентов с АФС. Проблема лечения и профилактики гипертензивных расстройств чрезвычайно актуальна в связи с влиянием этого патологического процесса на неприятные акушерские и перинатальные осложнения и возможностью тяжелых осложнений, особенно после пандемии COVID-19 [6–9]. Зарубежные исследования [2, 10, 11] подтверждают, что количество потерь беременности увеличивается к возрасту 30–35 лет, а затем резко возрастает до 33,2% у женщин старше 40 лет [5, 8, 12].Генетические и приобретенные тромбофилии играют важную роль в возникновении различных акушерских осложнений. Ряд зарубежных ученых-исследователей стали рассматривать гипертензивные состояния при беременности с точки зрения генетической, возможно скрытой тромбофилии [2, 5, 13]. Учитывая, что беременность сама по себе увеличивает риск гиперкоагуляции, присоединение АФС приводит к дальнейшему увеличению риска тромбообразования у матери [11, 14]. Задачами исследования является использование современных технологий в диагностике сочетания гипертензивных состояний и АФС. Ряд изменений в системе свертывания крови, таких как тромбофилия в организме матери, подтверждает, что это приводит к развитию патогенетических механизмов отягощения беременности. [7–9]. Антенатальная смертность у беременных с данной патологией выше в 3–6 раз, а риск мертворождения увеличивается в 6 раз.
Цель исследования – изучить генетическую значимость АФС в развитии гестационной гипертензии и профилактике тромболитических осложнений.
Материал и методы
В исследование включены 126 беременных женщин, посетивших Бухарский родильный комплекс в 2020–2023 гг. Из них группу I (основную) составили 49 беременных с гестационной гипертензией, у которых выявлялись аутоантитела к фосфолипидам, группу II (сравнительную) – 47 женщин с гестационной гипертензией, у которых аутоантитела к фосфолипидам не выявлялись, и группу III (контрольную) – 30 относительно условно здоровых беременных. В исследовании приняли участие 96 пациенток, мы провели исследование случай-контроль.Диагноз гестационная гипертензия и АФС у беременных устанавливался на основании национальных стандартов перинатальной помощи беременным и детям Республики Узбекистан.
96 беременных с гестационной гипертензией, составившие основную группу, в дальнейшем были разделены на две группы в зависимости от диагноза.
В группу I (основную) вошли 49 (36,0%) беременных с гестационной гипертензией различной степени со сроком 22–40 нед, у которых было 2 и более выкидышей или преждевременных родов, и у которых в крови определялись антифосфолипидные антитела.
Группа II (сравнения) – 47 (34,0%) беременных с гестационной гипертензией различной степени в сроке 22–40 нед без выявления в крови антифосфолипидных антител.
В контрольную группу вошли 30 (30,0%) женщин, обратившихся в родильный комплекс в связи с физиологической беременностью.
Большинство беременных обеих групп (68,3% и 65,0% соответственно по группам), у которых выявлена легкая гипертензия, были в возрасте 20–25 лет.
Большинство беременных групп I и II, у которых наблюдалась тяжелая гипертензия, были в возрасте от 26 до 35 лет. Среди обследованных беременных превалировали домохозяйки (57,1%, 46,5% соответственно по группам). В анамнезе детские инфекции наблюдались у 30 (63,8%) беременных женщин группы I, у группы II – 25 (51,0%). Частые острые респираторные инфекции в настоящей беременности отмечались у 23 (46,9%) беременных группы I, у 15 (31,9%) – группы II. Индекс перенесенных заболеваний в группе I составил 2, в группе II – 1,6, что указывает на связь частоты перенесенных заболеваний и развитием гипертензии. Видимо эта зависимость возникла в результате снижения иммунитета у женщин, имеющих более отягощенный анамнез. Заболевания печени и желчевыводящих путей, щитовидной железы, органов дыхания и мочевыделительной системы встречались не часто, в единичных случаях.
Результаты
При поступлении в родильный комплекс всем беременным были произведены клинико-биохимические исследования: определение уровня общего белка, билирубина, креатинина и мочевины в сыворотке крови, общие анализы крови и мочи, также были исследованы у всех беременных кардиолипин и бета-гликопротеин, тромбоцитарное, прокоагулянтное звено ингибиторов свертывания крови и фибринолитическое звено системы гемостаза. Нами оценены прокоагулянтное и тромбоцитарное звено гемостаза у беременных, в первую очередь некоторые индивидуальные показатели, влияющие на свертываемость крови: концентрацию фибриногена, прокоагулянтно-активированное частичное тромбопластиновое время (АЧТВ), протромбиновый индекс, ортофенантролиновый тест, эуглобулиновый фибринолиз, тромбоцитарную массу. В этой главе из инструментальных исследований охвачена допплерометрия, проведен статистический анализ.Артериальная гипертензия у обследованных нами беременных отмечалась в пределах 155/112–178/125 в группе I, составив в среднем 164,3±2,1/117,5±1,6 мм рт. ст.
В группе II у беременных наблюдалась артериальная гипертензия, которая была в пределах 165/110–180/120 мм рт. ст., составив в среднем 171,3±3,1–121,6±2,4 мм рт. ст. Суточная протеинурия составила в среднем 0,391±0,14. Средние цифры артериального давления в контрольной группе составляли 110,7±1,9/71,1±1,3 мм рт. ст.
Приведенные выше цифры свидетельствуют о прямой связи степени тяжести АФС с уровнем артериальной гипертензии и уровнем протеинурии (коэффициент корреляции составил r=0,65 – сильная прямая связь у беременных группы I и r=0,59 – сильная прямая связь у беременных группы II). По сравнению со средним артериальным давлением в контрольной группе, у женщин группы II показатели были выше таковых на 54,5% (p<0,001).
С целью изучения гемодинамических нарушений в фетоплацентарном комплексе у беременных с диагнозом АФС изучали систоло-диастолическое отношение (СДО) в маточной артерии и артерии пуповины.
По данным допплерометрии у беременных 1-й группы наблюдались нарушения маточно-плацентарного кровотока (21,9%), плацентарно-плодового (39,1%) и маточно-плацентарно-плодового кровотока (35,6%) (табл. 1).

При обследовании сосудов у женщин исследуемых групп определялись нормальные показатели кривизны кровотока. В группе I нарушения гемодинамики 1-й степени выявлены у 10 (38,5%) плодов и у 12 (50,0%) – во 2-й группе. Гемодинамические нарушения 2-й степени наблюдались у 9 (37,5%) женщин группы I и у 9 (34,6%) беременных группы II. Нарушения гемодинамики 3-й степени наблюдались у 7 (26,9%) беременных из группы I и у 3 (12,5%) из группы II.
Патологические допплеровские изменения показывают, что положение плода и дистресс можно оценить, наблюдая за дыхательной и двигательной активностью. Они не являются особым признаком, а оцениваются как состояние, угрожающее жизненным функциям плода, и помогают решить вопрос о тактике вынашивания беременной, способе и сроках ее родоразрешения.
Данные коагулограммы представлены в табл. 2. Она показывает концентрацию фибриногена у обследованных женщин в группе I (4,47±0,35) и группе II (4,38±0,16), что сопоставимо с показателями контрольной группы в пренатальный период (3,95±0,62), который оказался достоверно выше (r<0,05).
У беременных с гестационной гипертензией количество тромбоцитов в крови, являющееся одним из важных показателей системы гемостаза, составило в группе I 160,6±20,6, в группе II – 165,2±21,8, в группе III – 275,0±18,3.

Подобные гематологические сдвиги у беременных с гестационной гипертензией свидетельствуют о нарушении окислительно-восстановительных процессов в женском организме, что создает благоприятные условия для острого и хронического ДВС-синдрома.
При норме АЧТВ 26,1–36,5 с, увеличение АЧТВ свидетельствует о высоком риске кровотечения, а его снижение по сравнению с нормой свидетельствует о склонности к тромбообразованию, в нашем исследовании этот показатель составляет 23,9% в группе I и 31,0% в группе II по сравнению с контрольной группой.
Показатели ортофенантролинового теста у беременных были выше, чем в группе I (26,0±2,0 мг/мл), группе II (25,0±2,0 мг/мл), контрольной группе (8,0±2,0 мг/мл).
В группах I и II показатель продукта распада фибрина (D-димер) составляет 33% и 31% (табл. 2).
По результатам молекулярно-генетического исследования, проведенного у беременных, выявлены следующие показатели путем изучения полиморфизма генов генотипа F2 протромбина (фактора свертывания крови II) и распределения генотипов гена G2021A(rs180133) G<A, которые приведены на рисунке.
При изучении распределения аллелей полиморфизма гена протромбина F2 были определены следующие показатели (табл. 3).

В зависимости от процента встречаемости гена G2021A нормальный G-аллель наблюдался у 76,67% беременных с АФС(+) с гестационной гипертензией.
С другой стороны, этот показатель составил 75,86% у беременных без АФС с гестационной гипертензией и 88,71% в контрольной группе. Мутантный аллель был обнаружен у 11,29% беременных контрольной группы, а в первой и второй группах он составил 23,33% и 24,14% соответственно (табл. 4).

По процентному распределению доброкачественных вариантных генотипов по гену G2021A у всех беременных с гестационной гипертензией и в контрольной группе установлено превосходство второй группы над первой (3,3 и 80,6% соответственно). Гетерозиготный генотип показал практически одинаковый результат в двух группах испытуемых (20% и 27,6% соответственно). Гетерозиготный генотип является фактором, влияющим на развитие гестационной гипертензии, и этот вариант имеет большое значение (χ2=0,7; ОР 1,6; 95% ДИ 0,53–4,97, р=0,5). Однако при изучении мутантной формы А/А было установлено, что она выявлялась в большинстве случаев у пациенток, в отличие от контрольной группы, и подтверждалась как важный фактор риска развития гестационной гипертензии, 11,9% и 3,2% соответственно (χ2=1,9; ОР 4,0; 95% ДИ 0,55–29,82, р<0,2).
В группе I (30 женщин с гестационной гипертензией с АФС) хорошее качество аллель G выявлялось в 83,3% (50/60) и неблагоприятный аллель А в 16,6% (10/60) случаев. У женщин, которые физиологически беременны, G2021A F2 гена – 82,3% (51/62), а аллель А выявлен у 17,7% (11/62) (χ2=0,02; ОР 0,88; ОШ 0,93; 95% ДИ 0,36–2,38).
В ходе исследования, когда мы разделили полиморфное распространение гена G2021A на группы у пациенток с гестационной гипертензией, было установлено, что он является важным и достоверным фактором развития мутантной формы (А/А) у пациенток с АФС. (χ2=1,9; ОШ 4; 95% ДИ 0,55–2,82, р=0,2). В частности, в нашем исследовании преобладала гомозиготная форма генотипа: вариант (G/G) с достоверной разницей в контрольной группе (80,6%), этот вариант составил 66,7% у беременных с GG с АФС(+). Мутантная форма гомозиготного генотипа выявляется у 13,3% беременных с гестационной гипертензией, антифосфолипидные антитела, а гетерозиготного генотипа – у 20%. У относительно здоровых беременных этот показатель составил 3,2 и 16,1% соответственно (табл. 5).
Распределение генотипов по изучаемым полиморфным локусам проверяли на равновесие Харди–Вайнберга. Ожидаемый результат наблюдался на высоком уровне в основной группе генотипов G2021A (табл. 6).
Результаты оценки прогностической способности (AUC) составили 0,57, 0,56 и 0,57 соответственно. Хотя прогностические значения были скромными, моделирование было более надежным у беременных без АФС, чем у беременных с АФС (табл. 7).

Гипертензивные состояния во время беременности могут быть признаком тромбофилии. В то же время исследование показало, что гетерозиготный генотип также оказывает индуцированное влияние на развитие гестационной гипертензии (χ2=0,7; p=0,50). Однако в основной группе, а также в группах АФС(+) и АФС(-) гомозиготный вариант хорошего типа играл протективную роль в отношении возникновения гестационной гипертензии. Что касается уравнения Харди–Вайнберга, мы обнаружили высоко достоверную разницу между ожидаемыми и наблюдаемыми результатами в основной группе (χ2=4,07). Оценка эффективности предсказания полиморфизма, как упоминалось выше, показала только 0,55, что означает недостоверность предсказания эффективности в отношении мутантного аллеля и генотипа.
Отсюда можно сделать вывод, что мутантная форма гена (А/А) G2021A(rs180133) играет важную индуктирующую роль в патогенезе гестационной гипертензии.
Также было важно увидеть частоту выявления сопутствующей патологии в каждой исследуемой группе.
У беременных с диагнозом АФС с гестационной гипертензией встречаемость анемии 1–2-й степени выявлена в 43,1% случаев, эндокринопатии (сахарный диабет, заболевания щитовидной железы) – 32,1%, заболеваний мочевыводящих путей – 14,7%, варикозной болезни – у каждой второй. Аутоантитела к фосфолипидам при гипертензивных расстройствах обнаруживались практически у всех женщин с преморбидным фоном. Выявление гипертензивных расстройств у беременной
обусловливает отнесение ее к группе высокого риска в связи с патологиями, приводящими к ряду осложнений беременности: таких как преждевременные роды (20,4%, 6 случаев из 30), отслойка нормально расположенной плаценты (12%), антенатальная гибель плода (2,6%). А у беременных с гестационной гипертензией без АФС встречаемость анемии выявлена в 34,7% случаев, варикозная болезнь – в 27,5%, заболевания мочевыводящих путей – в 24,7% случаев. Анемия выявлена в 26,3% случаев и у женщин с условно физиологическим течением беременности.
В результате углубленного анализа акушерского анамнеза обследованных беременных неразвивающаяся беременность выявлена у 40% беременных с диагнозом АФС (12 из 30 случаев) и у 10,3% беременных без диагноза АФС (3 из 29 случаев).
Заключение
Таким образом, аллель А и гетерозиготный тип G/А генотипа гена F2 могут быть одними из важных молекулярно-генетических маркеров развития АФС в популяции Узбекистана (R<0,01).Анализ полученных данных показывает, что все полиморфизмы генотипа G/A гена F2 встречаются у женщин с гестационной гипертензией и в контрольной группе. Изучение генетической структуры этого маркера указывает на то, что мутационная способность гена относительно высока в группе женщин с гестационной гипертензией с диагнозом АФС по сравнению с контрольной группой.
Полученные данные показали, что чаще встречается неблагоприятный аллель А гена F2 (эндокринопатии), свидетельствующий о наличии аутоиммунных процессов в организме, это положение подтверждает данные литературы, а в профилактике АФС наблюдается выявление факторов риска у женщин с гестационной гипертензией. Таким образом, аутоантитела к фосфолипидам при гипертензивных расстройствах обнаруживались практически у всех женщин с преморбидным фоном. Выявление гипертензивных расстройств у беременных с АФС обусловливает отнесение ее к группе высокого риска в связи с патологиями, приводящими к ряду осложнений беременности: преждевременные роды (20,4%), отслойка плаценты (12%), антенатальная гибель плода (6,6%) и неразвивающаяся беременность в анамнезе (40%). Неблагоприятная аллель А и гетерозиготный тип генотипа А/A гена F2 являются одним из важных молекулярно-генетических маркеров развития гипертензивных нарушений в популяции Узбекистана (R<0,01). Всем беременным с отягощенным анамнезом, входящих в группу риска перинатальных осложнений, рекомендовано после лабораторных и генетических исследований предгравидарно начать модификацию образа жизни, лечение анемии длительно, применение антикоагулянтов (Фленокс 0,4) и антиагрегантов в прегравидарном периоде и во время беременности.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Ихтиярова Гульчехра Акмаловна – д-р мед. наук, проф., зав. каф. акушерства и гинекологии №1, Бухарский государственный медицинский институт имени Абу Али ибн Сино. E-mail: ixtiyarova7272@mail.ru; ORCID: 0000-0002-2398-3711
Gulchehra A. Ikhtiyarova – Dr. Sci. (Med.), Bukhara State Medical Institute named after Abu Ali ibn Sino. E-mail: ixtiyarova7272@mail.ru; ORCID: 0000-0002-2398-3711
Дустова Нигора Кахрамоновна – д-р мед. наук, доц. каф. акушерства и гинекологии №1, Бухарский государственный медицинский институт имени Абу Али ибн Сино. E-mail: nigoradustova78@gmail.com; ORCID: 0000-0003-0707-5673
Nigora K. Dustova – Dr. Sci. (Med.), Bukhara State Medical Institute named after Abu Ali ibn Sino. E-mail: nigoradustova78@gmail.com;
ORCID: 0000-0003-0707-5673
Бахрамова Шахноза Усмановна – канд. мед. наук, ассистент каф. акушерства и гинекологии №1, Бухарский государственный медицинский институт имени Абу Али ибн Сино. E-mail: bahromovashahnoza585@gmail.com
Shakhnoza U. Bakhramova – Cand. Sci. (Med.), Bukhara State Medical Institute named after Abu Ali ibn Sino. E-mail: bahromovashahnoza585@gmail.com
Рузиева Нодира Хакимовна – Ташкентский педиатрический институт. E-mail: nod_ruz@internet.ru; ORCID:0000-0003-0679
Nodira Kh. Ruzieva – Tashkent Pediatric Institute.
E-mail: nod_ruz@internet.ru; ORCID:0000-0003-0679
Иргашев Дилмурод Соатович – Клиника «Doctor D», Ташкент
Dilmurod S. Irgashev – Doctor D Clinic
Матризаева Гульнора Джуманиязовна – Ургенчский филиал Ташкентской медицинской академии. E-mail: gmatrizayeva@gmail.com; ORCID: 0009-0001-2796-8041
Gulnora D. Matrizayeva – Urgench branch of Tashkent Medical Academy. E-mail: gmatrizayeva@gmail.com; ORCID: 0009-0001-2796-8041
Поступила в редакцию: 16.09.2024
Поступила после рецензирования: 24.09.2024
Принята к публикации: 26.09.2024
Received: 16.09.2024
Revised: 24.09.2024
Accepted: 26.09.2024
Список исп. литературыСкрыть список
1 ноября 2024
Количество просмотров: 212

