Клинический разбор в общей медицине №10 2024
Клинический разбор в общей медицине №10 2024
Лабораторные маркеры воспалительной активности у пациентов с боевыми травмами конечностей
Номера страниц в выпуске:133-144
Аннотация
Цель – изучить лабораторные маркеры воспалительной активности – С-реактивный белок (СРБ), интерлейкин (ИЛ)-6, ферритин, лейкоциты и лейкоцитарные индексы, СОЭ – у пациентов с боевыми травмами конечностей.
Материалы и методы. В проспективное наблюдательное исследование включены 248 пациентов, перенесших боевые травмы нижних и/или верхних конечностей в сроки от 4 до 58 дней (в среднем 15,8±8,6 дня) до поступления в стационар. Все участники исследования мужчины. Возраст включенных в исследование пациентов варьировал от 19 до 59 лет, в среднем составляя 35,6±8,3 года. Наиболее часто раны локализовались на голенях (в 29,3% случаев) и стопах (12,8%). У всех пациентов определяли уровень СРБ, выполняли общий и биохимический анализы крови, вычисляли отношение числа нейтрофилов к лимфоцитам (НЛО), нейтрофилов к моноцитам (НМО), тромбоцитов к лимфоцитам (ТЛО), лимфоцитов к моноцитам (ЛМО), а также произведение нейтрофильно-лимфоцитарного отношения и числа тромбоцитов (системный иммуновоспалительный индекс, СИВИ). Рассчитывали отношение СРБ к альбумину. У 62 пациентов было выполнено определение концентрации ИЛ-6 в крови, у 42 – уровня ферритина в крови.
Результаты. Среднее значение СРБ составило 43,6 мг/л, СОЭ – 44,5 мм/ч, число лейкоцитов – 9,7×109/л, число нейтрофилов – 6,8×109/л, число тромбоцитов – 514,7×109/л, НЛО – 4,47, НМО – 9,29, ЛМО – 2,49, ТЛО – 323,2. Медиана СИВИ составила 1089. Уровень СРБ был повышен у 87,1% пациентов, СОЭ – у 87,3%. Лейкоцитоз выявлялся у 52,2% раненых, тромбоцитоз – у 83,1%. Медиана концентрации ИЛ-6 составила 0,86 пг/мл, ферритина – 249,1 нг/мл, отношения СРБ к альбумину – 0,61. У пациентов с ампутированными конечностями зарегистрированы значительно более высокие показатели СРБ (р=0,0005), числа лейкоцитов (р=0,00007, числа нейтрофилов (р=0,000004), доли нейтрофилов (р=0,000009), НЛО (р=0,000002), СИВИ (р=0,0003) и ИЛ-6 (р=0,02). У раненых с тромбозами наблюдались более высокие уровни ИЛ-6 (р=0,02), число лейкоцитов (р=0,006), число нейтрофилов (р=0,002), доля нейтрофилов (р=0,01), большее НЛО (р=0,001) и СИВИ (р=0,01). Установлены обратные корреляции между временем, прошедшим с момента ранения, и различными лабораторными показателями: СРБ (p<0,000001), СОЭ (р=0,0001), числом лейкоцитов (р<0,000001) и нейтрофилов (р<0,000001), НЛО (р<0,000001), СИВИ (р=0,002), фибриногеном (р=0,000002) и отношением СРБ к альбумину (р=0,000002). Зарегистрированы высокодостоверные корреляции между различными лабораторными показателями воспалительной активности. Установлены прямые корреляционные взаимосвязи между изученными лабораторными показателями воспалительной активности и числом хирургических обработок ран.
Выводы. Результаты настоящего исследования свидетельствуют о выраженном повышении всех изученных лабораторных показателей воспалительной активности у пациентов с боевыми травмами конечностей. Необходимо продолжение исследований по изучению лабораторных маркеров воспаления у пациентов с боевыми ранениями.
Ключевые слова: раны, боевые травмы, воспаление, С-реактивный белок, лейкоцитарные индексы, интерлейкин-6, ферритин, отношение СРБ к альбумину.
Для цитирования: Тополянская С.В., Бубман Л.И., Куржос М.Н., Васильева Ю.Ю., Молочников А.Ю., Хан С.О., Карпов В.В., Нечаев А.И., Эмомадов А.М., Марченко И.П., Лыткина К.А., Буриев И.М., Мелконян Г.Г. Лабораторные маркеры воспалительной активности у пациентов с боевыми травмами конечностей. Клинический разбор в общей медицине. 2024; 5 (10): 133–144. DOI: 10.47407/kr2024.5.10.00508
Цель – изучить лабораторные маркеры воспалительной активности – С-реактивный белок (СРБ), интерлейкин (ИЛ)-6, ферритин, лейкоциты и лейкоцитарные индексы, СОЭ – у пациентов с боевыми травмами конечностей.
Материалы и методы. В проспективное наблюдательное исследование включены 248 пациентов, перенесших боевые травмы нижних и/или верхних конечностей в сроки от 4 до 58 дней (в среднем 15,8±8,6 дня) до поступления в стационар. Все участники исследования мужчины. Возраст включенных в исследование пациентов варьировал от 19 до 59 лет, в среднем составляя 35,6±8,3 года. Наиболее часто раны локализовались на голенях (в 29,3% случаев) и стопах (12,8%). У всех пациентов определяли уровень СРБ, выполняли общий и биохимический анализы крови, вычисляли отношение числа нейтрофилов к лимфоцитам (НЛО), нейтрофилов к моноцитам (НМО), тромбоцитов к лимфоцитам (ТЛО), лимфоцитов к моноцитам (ЛМО), а также произведение нейтрофильно-лимфоцитарного отношения и числа тромбоцитов (системный иммуновоспалительный индекс, СИВИ). Рассчитывали отношение СРБ к альбумину. У 62 пациентов было выполнено определение концентрации ИЛ-6 в крови, у 42 – уровня ферритина в крови.
Результаты. Среднее значение СРБ составило 43,6 мг/л, СОЭ – 44,5 мм/ч, число лейкоцитов – 9,7×109/л, число нейтрофилов – 6,8×109/л, число тромбоцитов – 514,7×109/л, НЛО – 4,47, НМО – 9,29, ЛМО – 2,49, ТЛО – 323,2. Медиана СИВИ составила 1089. Уровень СРБ был повышен у 87,1% пациентов, СОЭ – у 87,3%. Лейкоцитоз выявлялся у 52,2% раненых, тромбоцитоз – у 83,1%. Медиана концентрации ИЛ-6 составила 0,86 пг/мл, ферритина – 249,1 нг/мл, отношения СРБ к альбумину – 0,61. У пациентов с ампутированными конечностями зарегистрированы значительно более высокие показатели СРБ (р=0,0005), числа лейкоцитов (р=0,00007, числа нейтрофилов (р=0,000004), доли нейтрофилов (р=0,000009), НЛО (р=0,000002), СИВИ (р=0,0003) и ИЛ-6 (р=0,02). У раненых с тромбозами наблюдались более высокие уровни ИЛ-6 (р=0,02), число лейкоцитов (р=0,006), число нейтрофилов (р=0,002), доля нейтрофилов (р=0,01), большее НЛО (р=0,001) и СИВИ (р=0,01). Установлены обратные корреляции между временем, прошедшим с момента ранения, и различными лабораторными показателями: СРБ (p<0,000001), СОЭ (р=0,0001), числом лейкоцитов (р<0,000001) и нейтрофилов (р<0,000001), НЛО (р<0,000001), СИВИ (р=0,002), фибриногеном (р=0,000002) и отношением СРБ к альбумину (р=0,000002). Зарегистрированы высокодостоверные корреляции между различными лабораторными показателями воспалительной активности. Установлены прямые корреляционные взаимосвязи между изученными лабораторными показателями воспалительной активности и числом хирургических обработок ран.
Выводы. Результаты настоящего исследования свидетельствуют о выраженном повышении всех изученных лабораторных показателей воспалительной активности у пациентов с боевыми травмами конечностей. Необходимо продолжение исследований по изучению лабораторных маркеров воспаления у пациентов с боевыми ранениями.
Ключевые слова: раны, боевые травмы, воспаление, С-реактивный белок, лейкоцитарные индексы, интерлейкин-6, ферритин, отношение СРБ к альбумину.
Для цитирования: Тополянская С.В., Бубман Л.И., Куржос М.Н., Васильева Ю.Ю., Молочников А.Ю., Хан С.О., Карпов В.В., Нечаев А.И., Эмомадов А.М., Марченко И.П., Лыткина К.А., Буриев И.М., Мелконян Г.Г. Лабораторные маркеры воспалительной активности у пациентов с боевыми травмами конечностей. Клинический разбор в общей медицине. 2024; 5 (10): 133–144. DOI: 10.47407/kr2024.5.10.00508
Original article
S.O. Khan1, V.V. Karpov1, A.I. Nechaev1, A.M. Emomadov1, I.P. Marchenko1, K.A. Lytkina1,
I.M. Buriev1, G.G. Melkonyan1,3
1 War Veterans Hospital No. 3, Moscow, Russia;
2 Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russia;
3 Russian Medical Academy of Continuous Professional Education, Moscow, Russia
sshekshina@yandex.ru
Abstract
The study aim – to investigate laboratory markers of inflammatory activity (C-reactive protein, ESR, leukocytes and leukocyte indices, interleukin-6 and ferritin) in patients with combat limb injuries.
Materials and methods. The prospective observational study enrolled 248 patients who suffered from combat injuries of the lower and/or upper extremities in the period from 4 to 58 days (mean 15.8±8.6 days) before admission to the hospital. All study participants were men. The age of the study patients ranged from 19 to 59 years, with a mean of 35.6±8.3 years. Most often, wounds were localized on the legs (29.3% of cases) and feet (12.8%). In all patients, the level of C-reactive protein (CRP) was determined, general and biochemical blood tests were performed, and the ratio of neutrophils to lymphocytes (NLR), neutrophils to monocytes (NMR), platelets to lymphocytes (PLR), and lymphocytes to monocytes (LMR) was calculated, as well as the systemic immunoinflammatory index (SII). The ratio of CRP to albumin was calculated. In 62 patients the concentration of interleukin-6 (IL-6) and in 42 patients the level of ferritin in the blood were determined.
Results. The mean value of CRP was 43.6 mg/l, ESR – 44.5 mm/h, leukocyte count – 9.7×109/l, neutrophil count – 6.8×109/l, platelets – 514.7×109/l, NLO – 4, 47, NMO – 9.29, LMO – 2.49, TLO – 323.2. The median of the systemic immuno-inflammatory index was 1089. The level of CRP was increased in 87.1% of patients, ESR – in 87.3%. Leukocytosis was detected in 52.2% of the wounded, thrombocytosis – in 83.1%. The median concentration of IL-6 was 0.86 pg/ml, ferritin – 249.1 ng/ml, CRP to albumin ratio – 0.61. In patients with amputated limbs, significantly higher levels of CRP (p=0.0005), leukocyte count (p=0.00007, neutrophil count (p=0.000004), % of neutrophils (p=0.000009), NLO (p=0.000002), SII (p=0.0003) and IL-6 (p=0.02) were registered. In patients with thrombosis, higher levels of IL-6 (p=0.02), leukocyte count (p=0.006), number of neutrophils (p=0.002), % of neutrophils (p=0.01), greater NLO (p=0.001) and SII (p=0.01) were observed. Inverse correlations were established between the time elapsed from the moment of injury and various laboratory parameters: CRP (p<0.000001), ESR (p=0.0001), number of leukocytes (p<0.000001) and neutrophils (p<0.000001), NLO (p<0.000001), SII (p=0.002), fibrinogen (p=0.000002) and the ratio of CRP to albumin (p=0.000002). Highly significant correlations were recorded between various laboratory indicators of inflammatory activity. Direct correlations were established between the investigated laboratory indicators of inflammatory activity and the number of surgical treatments of wounds.
Conclusion: The study results demonstrate a significant increase in all investigated laboratory parameters of inflammation in patients with combat injuries. Continued research is needed to investigate laboratory markers of inflammatory activity in patients with combat wounds.
Keywords: wounds, combat trauma, inflammation, C-reactive protein, leukocytes indices, interleukin-6, ferritin, C-reactive protein/albumin ratio.
For citation: Topolyanskaya S.V., Bubman L.I., Kurzhos M.N., Vasilyeva Yu.Yu., Molochnikov A.Yu., Khan S.O., Karpov V.V., Nechaev A.I., Emomadov A.M., Marchenko I.P., Lytkina K.A., Buriev I.M., Melkonyan G.G. Laboratory markers of inflammatory activity in patients with combat limb injuries. Clinical review for general practice. 2024; 5 (10): 133–144 (In Russ.). DOI: 10.47407/kr2024.5.10.00508
Следует отметить, что неблагоприятные исходы травм определяются не только их тяжестью и/или инфекционными осложнениями, но и интенсивностью иммуновоспалительного ответа, который важен для защиты организма, но в случае его неконтролируемого течения приводит к синдрому полиорганной дисфункции [3]. Нарушения регуляции иммунной системы могут подвергать пациентов риску возникновения поздних осложнений боевой травмы [1, 4] – замедленное заживление ран, поздний сепсис и другие инфекционные осложнения, синдром полиорганной дисфункции, острый респираторный дистресс-синдром и стойкая воспалительная реакция с иммуносупрессией, ведущие к росту заболеваемости и смертности [1, 5]. В связи с нередко возникающими при боевой травме кровотечениями раненым зачастую проводят переливание крови. Переливание большого объема крови, в свою очередь, связано с иммуносупрессией, коагулопатией, ацидозом, органной дисфункцией [1]. Неконтролируемая боль, вызванная обширными ранами, также усугубляет воспалительный процесс и приводит к дисфункции иммунной системы [1, 6]. Вместе с тем при ранениях конечностей со значительным повреждением мягких тканей и переломами костей неоднократные хирургические вмешательства тоже ведут к длительной воспалительной реакции [7].
Хорошо известно, что травма способствует активации почти всех звеньев иммунной системы и что этот процесс сложный и динамичный [1, 8, 9]. Иммуновоспалительная реакция начинается немедленно после ранения, когда множество различных медиаторов, антигенов и токсичных продуктов метаболизма высвобождаются из поврежденных клеток и тканей, активируя иммунную систему и способствуя провоспалительному состоянию [1, 3, 8, 9]. Эти эндогенные факторы взаимодействуют с клетками иммунной системы, инициируя и усугубляя воспалительные реакции (рис. 1) [8, 10].
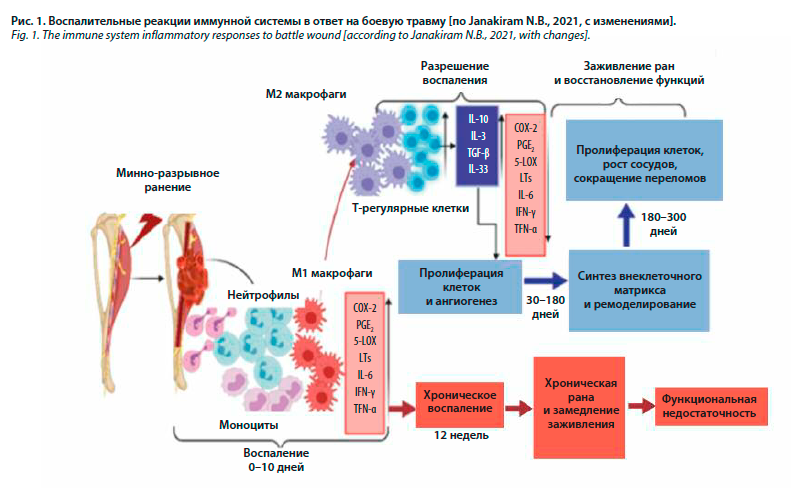
За счет секреции различных медиаторов, включая цитокины, активируются полиморфно-ядерные лейкоциты, клетки эндотелия, макрофаги и лимфоциты [3]. Цитокины и хемокины играют важную роль в инициировании и сохранении провоспалительного состояния, а также в развитии синдрома системного воспалительного ответа после тяжелой травмы [8, 9]. Целью воспалительной реакции является ограничение дальнейшего повреждения, предотвращение или борьба с инфекцией, устранение мертвых или отмирающих тканей и ускорение заживления [1, 8].
Провоспалительное состояние тщательно балансируется компенсаторными противовоспалительными реакциями, что в конечном итоге приводит к затуханию воспаления и возвращению к нормальному гомеостазу [1]. При тяжелой травме может наблюдаться чрезмерно выраженный синдром системного воспалительного ответа, который, независимо от инфекции, приводит к дальнейшему повреждению различных органов и систем и полиорганной недостаточности с неблагоприятным прогнозом [1, 2, 9, 11]. Такие осложнения тяжелой травмы, как синдромы системного воспалительного ответа и полиорганной дисфункции, напрямую связаны с синтезом и высвобождением медиаторов воспаления в кровоток, обусловленными тяжестью самой травмы. В последующем множественные хирургические вмешательства и/или бактериальные инфекции могут усилить провоспалительный иммунный ответ и привести к тяжелым осложнениям и смерти в поздние сроки после травмы [4, 9]. Нарушение баланса провоспалительных медиаторов способствует более высокому риску инфекционных осложнений (как локальных, так и системных) и персистированию локального воспаления в области раневого ложа, что ухудшает исходы ранений и заживление ран [1].
Боевые раны – пример политравмы, приводящей к активации многих стимулов (воспалительных, ноцицепторных, барорецепторных и других) и развитию острофазового ответа [12]. Однако данных по острофазовому воспалительному ответу при боевых травмах крайне мало. Поэтому мы предприняли попытку своего исследования, целью которого было изучение лабораторных маркеров воспалительной активности – С-реактивного белка (СРБ) интерлейкина (ИЛ)-6, ферритина, лейкоцитов и лейкоцитарных индексов, СОЭ у пациентов с боевыми травмами конечностей.
У всех пациентов определяли уровень СРБ, выполняли общий и биохимический анализы крови. Наряду с этим вычисляли отношение числа нейтрофилов к лимфоцитам (НЛО), нейтрофилов к моноцитам (НМО), тромбоцитов к лимфоцитам (ТЛО), лимфоцитов к моноцитам (ЛМО), а также произведение нейтрофильно-лимфоцитарного отношения и числа тромбоцитов (системный иммуновоспалительный индекс, СИВИ), рассчитывали отношение СРБ к альбумину.
 У 62 пациентов было выполнено определение концентрации ИЛ-6 в крови, у 42 – уровня ферритина в крови. Также проводили скрининговую коагулограмму с определением активированного частичного тромбопластинового времени, протромбинового времени, международного нормализованного отношения, фибриногена.
У 62 пациентов было выполнено определение концентрации ИЛ-6 в крови, у 42 – уровня ферритина в крови. Также проводили скрининговую коагулограмму с определением активированного частичного тромбопластинового времени, протромбинового времени, международного нормализованного отношения, фибриногена.
Полученные данные анализировали с использованием программного обеспечения Statistica (версия 13). Количественные переменные исследовали на нормальность распределения с помощью критерия Шапиро–Уилкса. При нормальном распределении описание количественных переменных представляли в виде минимального, максимального, среднего значения и стандартного отклонения, качественных – в виде n (%), при ненормальном распределении – в виде медианы и квартилей. Проводили корреляционный анализ с помощью критерия Спирмена.
(в 29,3% случаев) и стопах (12,8%). Пациенты с ампутированными конечностями составили 27,4%.
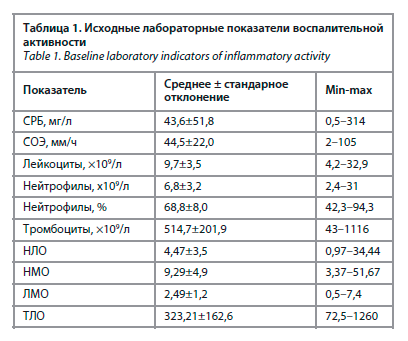
Основные лабораторные показатели воспалительной активности на момент включения пациентов в исследование приведены в табл. 1.
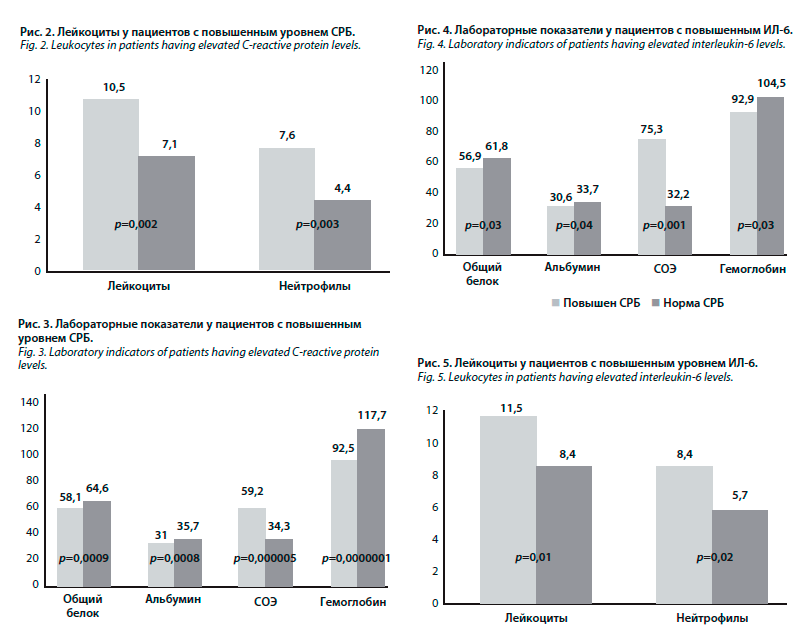
Медиана системного иммуновоспалительного индекса составила 1089 (Q1–Q3: 627,3–1839,5), минимальное значение данного показателя – 105,2, максимальное – 42 840. Уровень СРБ был повышен у 87,1% пациентов, СОЭ – у 87,3%. Лейкоцитоз выявлен у 52,2% раненых, тромбоцитоз – у 83,1%. Лабораторные показатели у пациентов с повышенным и нормальным уровнем СРБ представлены на рис. 2 и 3.
Среднее содержание ИЛ-6 составило 0,823 пг/мл, варьируя от 0,37 до 7,81 пг/мл; медиана данного показателя – 0,86 пг/мл [Q1–Q3: 0,48–0,79]. У пациентов с повышенным уровнем СРБ средняя концентрация
ИЛ-6 в крови достигала 0,98 пг/мл, с нормальным СРБ – 0,56 пг/мл (р=0,008). В группе пациентов с наличием лейкоцитоза средняя концентрация ИЛ-6 составила 0,85 пг/мл, у пациентов с нормальным числом лейкоцитов – 0,62 пг/мл (р=0,03). Лабораторные показатели у пациентов с повышенным и с нормальным уровнем ИЛ-6 представлены на рис. 4 и 5.
Медиана концентрации ферритина в группе из 42 пациентов составила 249,1 нг/мл (Q1–Q3: 83,9–451,3 нг/мл), его минимальное значение – 26,7 нг/мл, максимальное – 2000 нг/мл. Уровень ферритина в сыворотке крови был повышен у 12 пациентов (29,3% случаев).
Сравнение лабораторных показателей воспалительной активности у пациентов с ампутированными и с сохранными конечностями представлено в табл. 2.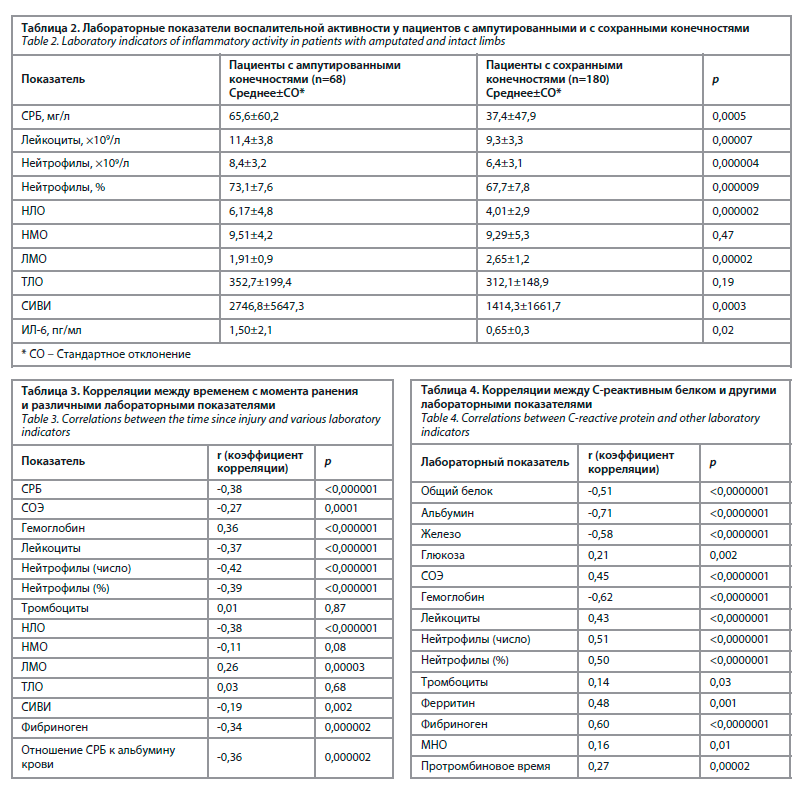
Медиана СРБ у пациентов с ампутациями достигала 37,9 мг/л (Q1–Q3: 14,2–110,4), с сохранными конечностями – 19,9 мг/л (Q1–Q3: 7,2–50,3), медиана СИВИ – 1383,2 (Q1–Q3: 924,8–2752,5) и 1013,3 (Q1–Q3: 573,0–1534,7) соответственно.
Наряду с этим у пациентов с тромботическими осложнениями зарегистрированы более высокие уровни ИЛ-6 в крови (1,29±1,8 и 0,64±0,3; р=0,02), число лейкоцитов (10,8±4,8×109/л и 9,4±3,0×109/л; р=0,006), число нейтрофилов (8,0±4,6×109/л и 6,5±2,5×109/л; р=0,002), процентная доля нейтрофилов (71,0±8,7% и 68,1±7,7%; р=0,01), большее НЛО (5,8±6,1 и 4,1±2,0; р=0,001) и СИВИ (2592,5±5818 и 1445,9±1294; р=0,01).
В табл. 3 приведены корреляционные взаимосвязи между временем, прошедшим с момента ранения, и изученными лабораторными показателями.
Корреляции между уровнем СРБ и другими лабораторными показателями представлены в табл. 4, между ИЛ-6 и иными лабораторными параметрами – в табл. 5.
Зарегистрирована также слабая позитивная корреляция между уровнем СРБ и возрастом пациентов (r=0,16; p=0,01). Средний уровень СРБ у пациентов в возрасте 40 лет и старше составил 51,2 мг/л, моложе 40 лет – 39,8 мг/л (р=0,006).
Установлена прямая корреляция между уровнем интерлейкина-6 и возрастом больных – r=0,26; р=0,04. Наблюдалась тенденция к более высокой концентрации ИЛ-6 у пациентов старше 40 лет, по сравнению с более молодыми ранеными – 1,0 и 0,68 пг/мл, соответственно (р=0,07). Достоверной взаимосвязи между ИЛ-6 и временем, прошедшим с момента ранения, не установлено – r=-0,15; p=0,23. Корреляции между СОЭ и другими лабораторными показателями представлены в табл. 6.
Корреляции между концентрацией ферритина и другими лабораторными показателями отражены в табл. 7. Кроме того, наблюдалась также тенденция к обратной корреляции между ферритином и временем, прошедшим с момента ранения (r=-0,28; p=0,08).
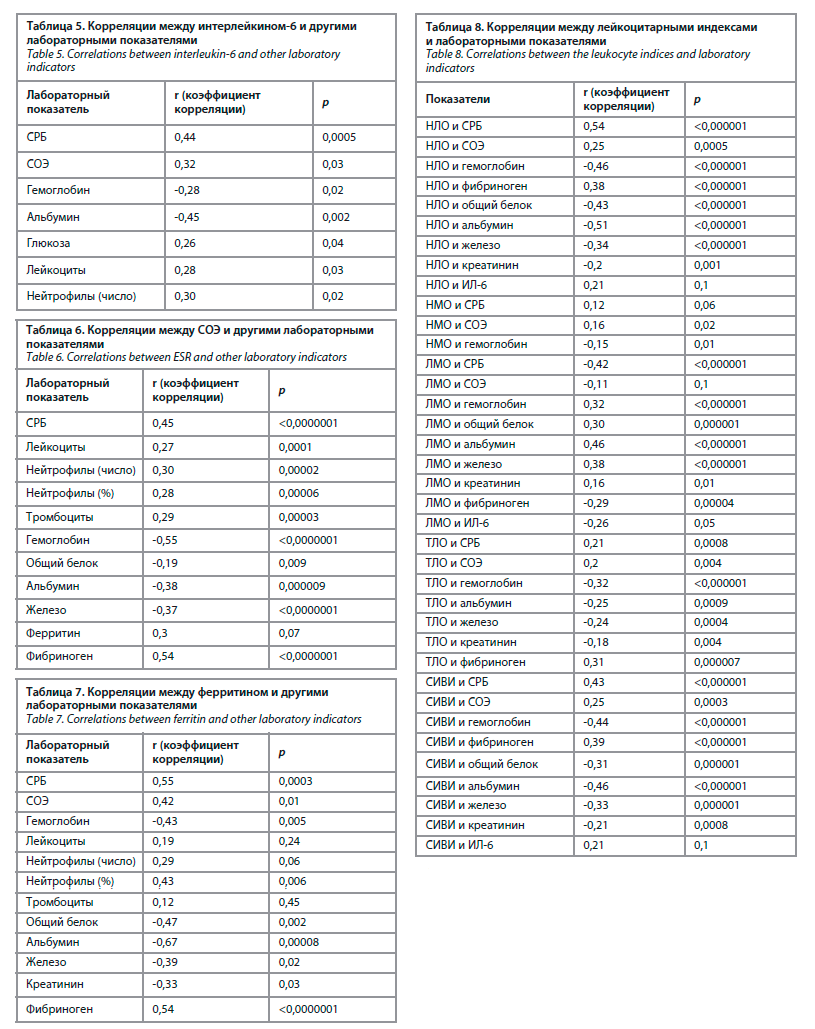
 В табл. 8 представлены корреляционные взаимосвязи между лейкоцитарными индексами и изученными лабораторными показателями.
В табл. 8 представлены корреляционные взаимосвязи между лейкоцитарными индексами и изученными лабораторными показателями.
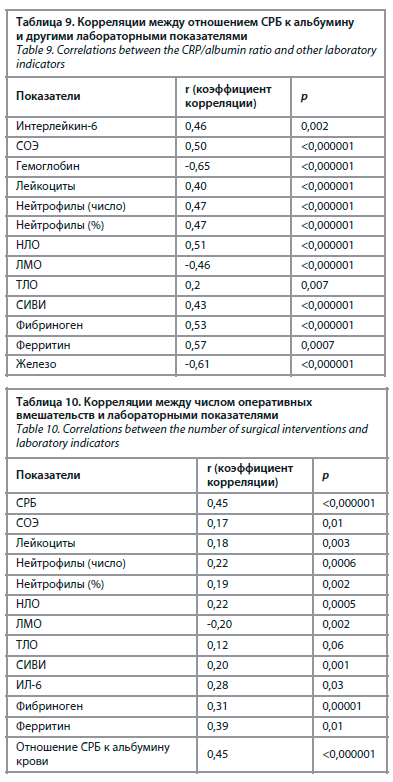
Среднее отношение уровня СРБ к альбумину крови составило 1,5±2,2 (от 0,01 до 15,3), медиана этого показателя – 0,61 (Q1–Q3: 0,2–2,0). Корреляции между отношением СРБ к альбумину и другими лабораторными показателями отражены в табл. 9.
Число вторичных хирургических обработок ран с некрэктомией достоверно коррелировало с большинством показателей лабораторной воспалительной активности (табл. 10).
Полученные нами результаты свидетельствуют об очень частом и выраженном повышении уровня СРБ, СОЭ, числа лейкоцитов и тромбоцитов у раненых с боевыми травмами конечностей. Так, концентрация СРБ была повышена у 87,1% пациентов, а его средний по группе уровень превышал нормальные показатели более чем в 8 раз. В исследовании J. Savic и соавт. с участием 72 раненых в Югославской войне также было отмечено выраженное повышение уровня СРБ, ИЛ-6 и других острофазовых показателей; причем степень их повышения коррелировала с тяжестью ранения [12].
В нашей группе пациентов все основные лабораторные показатели воспалительной активности (СРБ, ИЛ-6, лейкоциты, нейтрофилы, НЛО, СИВИ) также были существенно выше у раненых с наиболее тяжелыми травмами, включая травматическую ампутацию конечностей. В сербском исследовании S.S. Radacovic и соавт. с участием 79 раненых уровень СРБ тоже коррелировал с тяжестью боевой травмы [13]. При этом концентрация СРБ была максимальной на 2-й день после поступления в стационар, а затем она начинала снижаться, составляя на 14-й день 37 мг/л [13]. В нашей же работе средний уровень СРБ достигал 43,6 мг/л, а среднее время от момента ранения – 15,8 дня. В исследовании M. Meisner и соавт. у пациентов с небоевой травмой пиковые концентрации СРБ наблюдались на 2–3-й день после травмы, при этом на 7-й день уровень СРБ находился в пределах нормы только у 6% больных [14].
В работе F.R. Sheppard и соавт. с участием раненых в Ираке и Афганистане пациентов с боевыми травмами конечностей отсроченное заживление ран было связано с увеличением концентрации в сыворотке нескольких медиаторов воспаления, включая ИЛ-6, а повышенные концентрации этого цитокина в раневом отделяемом были маркером критического бактериального загрязнения ран [15]. В нашей работе только у 2 пациентов, у которых определялся уровень ИЛ-6, при микробиологическом исследовании раневого отделяемого не обнаружено роста микроорганизмов, во всех других случаях раны были колонизированы различными бактериальными возбудителями, причем в большинстве своем в ранах наблюдался одновременный рост нескольких микроорганизмов.
В различных исследованиях с участием пациентов с небоевыми травмами повышение уровня ИЛ-6 в крови коррелировало с тяжестью повреждения, было предиктором развития синдрома полиорганной недостаточности и летального исхода [16–22]. В работе F. Gebhard и соавторов у пациентов с травмой отмечалось не только коррелирующее с тяжестью повреждения повышение уровня ИЛ-6, но и у всех пациентов зарегистрировано увеличение концентрации СРБ [17]. Как и в нашей группе пациентов, в этом исследовании уровень СРБ зависел от тяжести травмы [17]. Наряду с этим авторы данной работы обнаружили положительную корреляцию (r=0,55) между ИЛ-6 и СРБ [17]. Нами также установлена аналогичная высокодостоверная взаимосвязь между концентрацией СРБ и ИЛ-6 в крови (r=0,44; p=0,0005). Известно, что ИЛ-6 – один из самых ранних и наиболее важных медиаторов острофазового ответа [17]. Данный провоспалительный цитокин опосредует повреждение органов и тканей при различных инфекционных и других воспалительных заболеваниях и может определять их прогноз [18]. ИЛ-6, в свою очередь, индуцирует синтез СРБ в печени [17]. Повышение уровня СРБ также может чрезвычайно чувствительно отражать повреждение органов и тканей и выраженность воспаления [18]. В исследовании K.A. Edwards и соавт. у военнослужащих с сотрясением головного мозга обнаружено также, что медиана концентрации ИЛ-6 примерно в 2,6 раза выше, чем в контрольной группе [23], а в работе A.A. Antunes и соавт. у пациентов с небоевой черепно-мозговой травмой и внутричерепным кровоизлиянием была найдена взаимосвязь между уровнем ИЛ-6 через 6 часов после травмы и прогрессированием объема внутричерепного кровоизлияния [24].
В различных исследованиях продемонстрировано, что политравма приводит к увеличению уровня СРБ, который, как известно, быстро реагирует в ответ на различные провоспалительные состояния. Уровни СРБ коррелируют со смертностью и полиорганной недостаточностью у пациентов с травмами [25]. В индонезийском исследовании у пациентов с тяжелой политравмой на уровень СРБ оказали влияние возраст, индекс массы тела, гиповолемический шок, переливание крови и коагулопатия. При многофакторном анализе наиболее значимыми факторами, повлиявшими на повышение СРБ, была величина международного нормализованного отношения и гиповолемический шок [25]. В нашем исследовании тоже была зарегистрирована прямая корреляция между уровнем СРБ и МНО (p=0,01), а также протромбиновым временем (p=0,00002). В вышеописанном индонезийском исследовании уровень СРБ был повышен у всех пациентов в возрасте 40 лет и старше, тогда как у пациентов моложе 40 лет он был повышен в 61,9% случаев [25]. В наблюдаемой нами группе пациентов зарегистрирована аналогичная положительная корреляция между уровнем СРБ и возрастом раненых (p=0,01), а у пациентов в возрасте 40 лет и старше концентрация СРБ была существенно выше (p=0,006), чем у раненых моложе 40 лет.
В ответ на политравму происходит не только выраженная активация нейтрофилов, но и посттравматическое снижение общего уровня лимфоцитов. Прогностическое значение НЛО изучали при различных нетравматических заболеваниях, на основании результатов которых предположили, что это отношение может представлять собой простой метод оценки системного воспаления и исходов у пациентов с травмами [26].
В нескольких исследованиях оценивали связь между НЛО и исходами у пациентов с множественными травмами. Так, в сирийском когортном ретроспективном исследовании у 566 пациентов с политравмой (75,8% из которых были с проникающими ранениями) значения НЛО выше 4,0 в первый день после травмы оказались предиктором летального исхода в течение последующих 30 дней [26]. В нашей группе пациентов данное отношение превышало значение четыре в 39,8% случаев, однако летальных исходов в наблюдаемой нами группе раненых не было.
В одном из исследований величина повышения НЛО в течение первых 48 ч после госпитализации была связана с развитием полиорганной недостаточности у 207 пациентов с травмами [27]. В другой работе была продемонстрирована выраженная взаимосвязь между НЛО и ранней смертностью у 285 пациентов с травмами и тяжелым кровотечением [28]. В этом исследовании величина НЛО больше 13,68 на 10-й день после травмы была предиктором внутригоспитальной смертности [28]. Стоит отметить, что в нашей группе пациентов величина НЛО выше 13,68 наблюдалась только в 4 случаях (1,6%). В исследовании E. Dilektasli и соавт. с участием 1356 пациентов с критической травмой превышение НЛО на 2-й и 5-й дни значений 8,19 и 7,92, соответственно, было независимо связано с внутригоспитальной смертностью [29]. У наблюдаемых нами раненых величина НЛО выше 7,92 была зарегистрирована в 23 случаях, однако среднее время от момента ранения было существенно больше (15,8 дня). В другом масштабном исследовании НЛО выше 7,44 оказалось независимым фактором риска смертности пациентов с травмами в отделениях интенсивной терапии, причем это отношение имело лучшую прогностическую ценность при черепно-мозговой травме [30]. Однако в работе H. Fouladseresht и соавт. меньший показатель НЛО (более 5,27) оказался независимым прогностическим фактором внутригоспитальной смертности у пациентов с травмами [31]. В нашей группе раненых значение НЛО более 5,27 было зарегистрировано в 22,9% случаев.
По мнению Y. Qiu и соавт., профиль соотношения нейтрофилов и лимфоцитов через 48 часов после травмы является многообещающим прогностическим инструментом у пациентов с травмами и требует дальнейшего изучения [32]. Согласно данным других авторов, оценка НЛО во время госпитализации – простой и экономически эффективный прогностический биомаркер, который отражает системную воспалительную реакцию и позволяет прогнозировать риск госпитальной смерти пострадавших от травм [33]. Сочетание НЛО с другими биомаркерами может еще больше повысить точность прогнозирования последствий травм, однако до сих пор вопрос оптимального порогового уровня остается предметом споров [33]. По данным же P. Forget и соавт., нормальное нейтрофильно-лимфоцитарное отношение у взрослых (но не пожилых) здоровых людей колеблется от 0,78 до 3,53 [34].
В нашем исследовании среднее значение НЛО составило 4,5, а тромбоцитарно-лимфоцитарного отношения (ТЛО) – 323,2. В работе G.F.P. Kusuma и соавт. медиана НЛО и ТЛО пациентов с черепно-мозговыми травмами составила 7,6 и 145,58 соответственно [35]. Как и в нашей группе пациентов, в этом исследовании была зарегистрирована высокодостоверная прямая корреляция НЛО и ТЛО с уровнем СРБ [35]. Более чем двукратная разница в отношении ТЛО, наиболее вероятно, связана с механизмом травмы и очень частыми кровотечениями с последующим реактивным тромбоцитозом у наших раненых. Наряду с этим число тромбоцитов может повышаться и в рамках синдрома системного воспалительного ответа. Кроме активного участия в процессах коагуляции тромбоциты стимулируют также высвобождение провоспалительных медиаторов и взаимодействуют с различными клетками, включая нейтрофилы, Т-лимфоциты и макрофаги, которые инициируют и усиливают воспалительные процессы; следовательно, высокое ТЛО может указывать на повышенный синтез цитокинов и активацию тромбоцитов, которые способствуют усилению воспаления [36].
В одном из исследований ТЛО выше 190,98 наряду с высоким системным иммуновоспалительным индексом и НЛО было предиктором неблагоприятного прогноза через 6 месяцев после выписки из стационара у пациентов с тяжелыми черепно-мозговыми травмами [37]. В этой работе с плохим прогнозом ассоциировалась величина СИВИ выше 2651 [37]. В наблюдаемой нами группе раненых повышение ТЛО более 190 зарегистрировано в 78,3% случаев, а СИВИ более 2651 – в 13,6% случаев, однако прогноз для жизни у всех наших пациентов был благоприятным.
По результатам систематического обзора M.F. Ilyas и соавт., ТЛО может быть независимым прогностическим маркером у взрослых пациентов с травмами головного мозга [36]. Высокий уровень ТЛО при госпитализации может предсказать увеличение риска смертности через 30 дней и неблагоприятные исходы через 6 месяцев после травмы и, что немаловажно, данный показатель может использоваться повсеместно, поскольку является простым, недорогим и рутинным методом исследования [36].
Вместе с тем в других исследованиях было продемонстрировано негативное прогностическое значение не высокого, а низкого ТЛО. Так, в исследовании J.K. Kim и соавт. величина ТЛО менее 65,35 ассоци-ировалась со значительным увеличением смертности у пациентов с травмами [38]. Стоит отметить, что в нашем исследовании не было ни одного пациента с величиной ТЛО равной или менее 65. В вышеописанной работе Kim J.K. и соавторов, а также в других исследованиях величина ТЛО была существенно ниже, чем в нашей группе пациентов, и составляла 51,3–76,3 для умерших пациентов и 89,9–149,3 – для выживших [38–41]. В исследовании R.-T. Ke и соавт. более высокое число лимфоцитов, более низкое число тромбоцитов и более низкое ТЛО были связаны с более высоким риском смерти у пациентов ОРИТ с травмами [42]. У умерших пациентов величина ТЛО была значительно ниже, чем у выживших (124,3 и 150,6 соответственно), однако существенной разницы в НЛО и МЛО между двумя этими группами не было [42].
В исследовании B. Zhang и соавт. медиана отношения моноцитов к лимфоцитам (МЛО) выше 0,65 независимо ассоциировалась с персистирующим критическим состоянием у пациентов после тяжелой травмы, тогда как отношение нейтрофилов к лимфоцитам значимо не коррелировало с ним [43]. В нашей же группе пациентов среднее значение МЛО было существенно ниже и составило 0,46. В работе D. Zhang и соавт. более высокое НЛО через неделю после ушиба головного мозга и более высокое моноцитарно-лимфоцитарное отношение при поступлении и через 24 ч были достоверно связаны с неблагоприятным прогнозом в течение 6 месяцев после травмы [44]. При этом пороговые значения НЛО и МЛО в качестве предикторов неблагоприятного исхода через 6 месяцев составили 6,39 и 0,76 соответственно [44].
У наблюдаемых нами раненых пациентов повышение уровня ферритина зарегистрировано в 29% случаев и его концентрация напрямую коррелировала с другими лабораторными показателями воспалительной активности. Известно, что ферритин представляет собой не только белок, участвующий в обмене железа, но и играющий важную роль в механизмах воспаления и антиоксидантной защиты [45]. Повышенный уровень ферритина в крови – это индикатор многих воспалительных состояний, включая острые инфекции и травмы. Возможные механизмы увеличения содержания этого белка в крови включают лизис клеток, из-за которого ферритин высвобождается из внутриклеточных хранилищ, воспалительные реакции, при которых он вырабатывается под действием различных провоспалительных цитокинов, включая ИЛ-6, а также окислительный стресс [45]. Уровень сывороточного ферритина может быть предиктором исхода травмы и нередко зависит от ее тяжести [45].
В немногочисленных исследованиях показана положительная корреляция между уровнями ферритина в крови и плохим прогнозом у пациентов с травмами [45–47]. Так, в работе Y.S. Ji и соавт. было обнаружено, что уровень ферритина является предиктором развития острого респираторного дистресс-синдрома (ОРДС) у пациентов с травмами [47]. В этом исследовании средний уровень ферритина достигал 456 мг/дл, а начало ОРДС можно было предсказать, когда его значение превышало 340 мг/дл [47]. В нашей группе пациентов средняя концентрация ферритина достигала 334 нг/мл, его повышение выше 340 нг/мл зарегистрировано в 30,9% случаев, однако ни одного случая ОРДС зарегистрировано не было. Авторы еще одной работы пришли к выводу о том, что у пациентов с длительным пребыванием в ОРИТ динамика сывороточного ферритина отражает прогрессирование полиорганной недостаточности [46].
Отношение СРБ к альбумину – относительно новый показатель воспаления, позволяющий прогнозировать исход различных заболеваний, в том числе политравмы. В исследовании X. Lu и соавт. с участием 264 пациентов с тяжелой травмой индекс шока был значительно выше, когда данное соотношение было ≥4 [48]. Кроме того, в этой работе отношение СРБ к альбумину было независимым прогностическим фактором 28-дневной смертности пациентов с множественными травмами [48]. В нашем исследовании среднее отношение уровня СРБ к альбумину крови составило 1,5, а его величина более 4 зарегистрирована лишь в 8,3% случаев и, как было уже сказано ранее, ни одного смертельного исхода у наблюдаемых нами пациентов не было.
В нашей группе пациентов число оперативных вмешательств прямо коррелировало со всеми лабораторными маркерами воспалительной активности. По мнению P.F. Dobson и соавт., при обширной травме конечностей со значительным повреждением мягких тканей и переломами костей повторные хирургические вмешательства приводят к длительной воспалительной реакции с продолжающимся высвобождением провоспалительных медиаторов [7].
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Тополянская Светлана Викторовна – д-р мед. наук, проф. каф. госпитальной терапии №2, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет), врач-терапевт, Госпиталь для ветеранов войн №3. E-mail: sshekshina@yandex.ru; ORCID: 0000-0002-4131-8432
Svetlana V. Topolyanskaya – Dr. Sci. (Med.), Prof., Sechenov First Moscow State Medical University (Sechenov University); General Practitioner, War Veterans Hospital No. 3. E-mail: sshekshina@yandex.ru; ORCID: 0000-0002-4131-8432
Бубман Леонид Игоревич – врач-хирург, Госпиталь для ветеранов войн №3. E-mail: bubmanli@zdrav.mos.ru; ORCID: 0000-0002-4195-3188
Leonid I. Bubman – Surgeon, War Veterans Hospital No. 3. E-mail: bubmanli@zdrav.mos.ru; ORCID: 0000-0002-4195-3188
Куржос Мария Николаевна – врач-терапевт, Госпиталь для ветеранов войн №3. E-mail: kurzhosmn@zdrav.mos.ru
Maria N. Kurzhos – General Practitioner, War Veterans Hospital No. 3. E-mail: kurzhosmn@zdrav.mos.ru
Васильева Юлия Юрьевна – врач-лаборант клинико-диагностической лаборатории, Госпиталь для ветеранов войн №3. E-mail: vasilievajj@zdrav.mos.ru
Yulia Yu. Vasilyeva – Laboratory assistant, War Veterans Hospital No. 3. E-mail: vasilievajj@zdrav.mos.ru
Молочников Александр Юрьевич – зав. хирургическим отделением №21, Госпиталь для ветеранов войн №3. E-mail: molochnikovayu@zdrav.mos.ru
Alexander Yu. Molochnikov – Head of the Department, War
Veterans Hospital No. 3. E-mail: molochnikovayu@zdrav.mos.ru
Хан Станислав Олегович – врач-хирург, Госпиталь для ветеранов войн №3. E-mail: khanso@zdrav.mos.ru
Stanislav O. Khan – Surgeon, War Veterans Hospital No. 3. E-mail: khanso@zdrav.mos.ru
Карпов Виктор Викторович – врач-хирург, Госпиталь для ветеранов войн №3. E-mail: karpovvv@zdrav.mos.ru
Viktor V. Karpov – Surgeon, War Veterans Hospital No. 3. E-mail: karpovvv@zdrav.mos.ru
Нечаев Алексей Игоревич – врач-хирург Госпиталь для ветеранов войн №3. E-mail: nechaevai@zdrav.mos.ru
Alexey I. Nechaev – Surgeon, War Veterans Hospital No. 3. E-mail: nechaevai@zdrav.mos.ru
Эмомадов Алишер Мухаматджонович – врач-хирург, Госпиталь для ветеранов войн №3; E-mail: emomadovam@zdrav.mos.ru
Alisher M. Emomadov – Surgeon, War Veterans Hospital No. 3.
E-mail: emomadovam@zdrav.mos.ru
Марченко Игорь Петрович – зам. глав. врача по хирургии, Госпиталяь для ветеранов войн №3. E-mail: marchenkoip@zdrav.mos.ru
Igor P. Marchenko – Deputy Chief doctor for surgery, War
Veterans Hospital No. 3. E-mail: marchenkoip@zdrav.mos.ru
Лыткина Каринэ Арнольдовна – зам. глав. врача по терапии, Госпиталь для ветеранов войн №3. E-mail: lytkinaka@zdrav.mos.ru; ORCID: 0000-0001-9647-7492
Karine A. Lytkina – Deputy Chief doctor for therapy, War Veterans Hospital No. 3. E-mail: lytkinaka@zdrav.mos.ru; ORCID: 0000-0001-9647-7492
Буриев Илья Михайлович – советник глав. врача по хирургии, Госпиталь для ветеранов войн №3. E-mail: burievim@zdrav.mos.ru
Ilya M. Buriev – Advisor for surgery, War Veterans Hospital No. 3. E-mail: burievim@zdrav.mos.ru
Мелконян Георгий Геннадьевич – д-р мед. наук, проф., глав. врач ГВВ №3, проф. каф. хирургии РМАНПО. E-mail: gvv3@zdrav.mos.ru; ORCID: 0000-0002-4021-5044
Georgy G. Melkonyan – Dr. Sci. (Med.), Full Prof., Chief doctor, War Veterans Hospital No. 3, Prof., Russian Medical Academy of Continuous Professional Education. E-mail: gvv3@zdrav.mos.ru; ORCID: 0000-0002-4021-5044
Поступила в редакцию: 06.07.2024
Поступила после рецензирования: 25.07.2024
Принята к публикации:15.08.2024
Received: 06.07.2024
Revised: 25.07.2024
Accepted: 15.08.2024
Laboratory markers of inflammatory activity in patients with combat limb injuries
S.V. Topolyanskayа1,2, L.I. Bubman1, M.N. Kurzho1, Yu.Yu. Vasilieva1, A.Yu. Molochnikov1,S.O. Khan1, V.V. Karpov1, A.I. Nechaev1, A.M. Emomadov1, I.P. Marchenko1, K.A. Lytkina1,
I.M. Buriev1, G.G. Melkonyan1,3
1 War Veterans Hospital No. 3, Moscow, Russia;
2 Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russia;
3 Russian Medical Academy of Continuous Professional Education, Moscow, Russia
sshekshina@yandex.ru
Abstract
The study aim – to investigate laboratory markers of inflammatory activity (C-reactive protein, ESR, leukocytes and leukocyte indices, interleukin-6 and ferritin) in patients with combat limb injuries.
Materials and methods. The prospective observational study enrolled 248 patients who suffered from combat injuries of the lower and/or upper extremities in the period from 4 to 58 days (mean 15.8±8.6 days) before admission to the hospital. All study participants were men. The age of the study patients ranged from 19 to 59 years, with a mean of 35.6±8.3 years. Most often, wounds were localized on the legs (29.3% of cases) and feet (12.8%). In all patients, the level of C-reactive protein (CRP) was determined, general and biochemical blood tests were performed, and the ratio of neutrophils to lymphocytes (NLR), neutrophils to monocytes (NMR), platelets to lymphocytes (PLR), and lymphocytes to monocytes (LMR) was calculated, as well as the systemic immunoinflammatory index (SII). The ratio of CRP to albumin was calculated. In 62 patients the concentration of interleukin-6 (IL-6) and in 42 patients the level of ferritin in the blood were determined.
Results. The mean value of CRP was 43.6 mg/l, ESR – 44.5 mm/h, leukocyte count – 9.7×109/l, neutrophil count – 6.8×109/l, platelets – 514.7×109/l, NLO – 4, 47, NMO – 9.29, LMO – 2.49, TLO – 323.2. The median of the systemic immuno-inflammatory index was 1089. The level of CRP was increased in 87.1% of patients, ESR – in 87.3%. Leukocytosis was detected in 52.2% of the wounded, thrombocytosis – in 83.1%. The median concentration of IL-6 was 0.86 pg/ml, ferritin – 249.1 ng/ml, CRP to albumin ratio – 0.61. In patients with amputated limbs, significantly higher levels of CRP (p=0.0005), leukocyte count (p=0.00007, neutrophil count (p=0.000004), % of neutrophils (p=0.000009), NLO (p=0.000002), SII (p=0.0003) and IL-6 (p=0.02) were registered. In patients with thrombosis, higher levels of IL-6 (p=0.02), leukocyte count (p=0.006), number of neutrophils (p=0.002), % of neutrophils (p=0.01), greater NLO (p=0.001) and SII (p=0.01) were observed. Inverse correlations were established between the time elapsed from the moment of injury and various laboratory parameters: CRP (p<0.000001), ESR (p=0.0001), number of leukocytes (p<0.000001) and neutrophils (p<0.000001), NLO (p<0.000001), SII (p=0.002), fibrinogen (p=0.000002) and the ratio of CRP to albumin (p=0.000002). Highly significant correlations were recorded between various laboratory indicators of inflammatory activity. Direct correlations were established between the investigated laboratory indicators of inflammatory activity and the number of surgical treatments of wounds.
Conclusion: The study results demonstrate a significant increase in all investigated laboratory parameters of inflammation in patients with combat injuries. Continued research is needed to investigate laboratory markers of inflammatory activity in patients with combat wounds.
Keywords: wounds, combat trauma, inflammation, C-reactive protein, leukocytes indices, interleukin-6, ferritin, C-reactive protein/albumin ratio.
For citation: Topolyanskaya S.V., Bubman L.I., Kurzhos M.N., Vasilyeva Yu.Yu., Molochnikov A.Yu., Khan S.O., Karpov V.V., Nechaev A.I., Emomadov A.M., Marchenko I.P., Lytkina K.A., Buriev I.M., Melkonyan G.G. Laboratory markers of inflammatory activity in patients with combat limb injuries. Clinical review for general practice. 2024; 5 (10): 133–144 (In Russ.). DOI: 10.47407/kr2024.5.10.00508
Введение
Боевые раны обширные и сложные, нередко загрязнены и связаны с большим повреждением или утратой тканей, которые усугубляются травмой сосудистого русла [1]. Благодаря усовершенствованиям средств защиты, более высокому уровню медицинской помощи на протяжении всего периода эвакуации, быстрому устранению повреждений, улучшению реанимационной помощи и различным новым хирургическим и терапевтическим методикам, выживаемость этих раненых существенно улучшилась [1, 2]. Однако, несмотря на эти успехи, смертность в результате минно-взрывных ранений и других боевых травм остается достаточно высокой [2, 3]. Относительно высокая частота поздних осложнений усугубляет заболеваемость и смертность у раненых, переживших первоначальную травму [1]. К основным факторам, способствующим неблагоприятному прогнозу у пациентов с тяжелыми травмами, относят развитие синдрома полиорганной дисфункции и инфекционные осложнения [2].Следует отметить, что неблагоприятные исходы травм определяются не только их тяжестью и/или инфекционными осложнениями, но и интенсивностью иммуновоспалительного ответа, который важен для защиты организма, но в случае его неконтролируемого течения приводит к синдрому полиорганной дисфункции [3]. Нарушения регуляции иммунной системы могут подвергать пациентов риску возникновения поздних осложнений боевой травмы [1, 4] – замедленное заживление ран, поздний сепсис и другие инфекционные осложнения, синдром полиорганной дисфункции, острый респираторный дистресс-синдром и стойкая воспалительная реакция с иммуносупрессией, ведущие к росту заболеваемости и смертности [1, 5]. В связи с нередко возникающими при боевой травме кровотечениями раненым зачастую проводят переливание крови. Переливание большого объема крови, в свою очередь, связано с иммуносупрессией, коагулопатией, ацидозом, органной дисфункцией [1]. Неконтролируемая боль, вызванная обширными ранами, также усугубляет воспалительный процесс и приводит к дисфункции иммунной системы [1, 6]. Вместе с тем при ранениях конечностей со значительным повреждением мягких тканей и переломами костей неоднократные хирургические вмешательства тоже ведут к длительной воспалительной реакции [7].
Хорошо известно, что травма способствует активации почти всех звеньев иммунной системы и что этот процесс сложный и динамичный [1, 8, 9]. Иммуновоспалительная реакция начинается немедленно после ранения, когда множество различных медиаторов, антигенов и токсичных продуктов метаболизма высвобождаются из поврежденных клеток и тканей, активируя иммунную систему и способствуя провоспалительному состоянию [1, 3, 8, 9]. Эти эндогенные факторы взаимодействуют с клетками иммунной системы, инициируя и усугубляя воспалительные реакции (рис. 1) [8, 10].

За счет секреции различных медиаторов, включая цитокины, активируются полиморфно-ядерные лейкоциты, клетки эндотелия, макрофаги и лимфоциты [3]. Цитокины и хемокины играют важную роль в инициировании и сохранении провоспалительного состояния, а также в развитии синдрома системного воспалительного ответа после тяжелой травмы [8, 9]. Целью воспалительной реакции является ограничение дальнейшего повреждения, предотвращение или борьба с инфекцией, устранение мертвых или отмирающих тканей и ускорение заживления [1, 8].
Провоспалительное состояние тщательно балансируется компенсаторными противовоспалительными реакциями, что в конечном итоге приводит к затуханию воспаления и возвращению к нормальному гомеостазу [1]. При тяжелой травме может наблюдаться чрезмерно выраженный синдром системного воспалительного ответа, который, независимо от инфекции, приводит к дальнейшему повреждению различных органов и систем и полиорганной недостаточности с неблагоприятным прогнозом [1, 2, 9, 11]. Такие осложнения тяжелой травмы, как синдромы системного воспалительного ответа и полиорганной дисфункции, напрямую связаны с синтезом и высвобождением медиаторов воспаления в кровоток, обусловленными тяжестью самой травмы. В последующем множественные хирургические вмешательства и/или бактериальные инфекции могут усилить провоспалительный иммунный ответ и привести к тяжелым осложнениям и смерти в поздние сроки после травмы [4, 9]. Нарушение баланса провоспалительных медиаторов способствует более высокому риску инфекционных осложнений (как локальных, так и системных) и персистированию локального воспаления в области раневого ложа, что ухудшает исходы ранений и заживление ран [1].
Боевые раны – пример политравмы, приводящей к активации многих стимулов (воспалительных, ноцицепторных, барорецепторных и других) и развитию острофазового ответа [12]. Однако данных по острофазовому воспалительному ответу при боевых травмах крайне мало. Поэтому мы предприняли попытку своего исследования, целью которого было изучение лабораторных маркеров воспалительной активности – С-реактивного белка (СРБ) интерлейкина (ИЛ)-6, ферритина, лейкоцитов и лейкоцитарных индексов, СОЭ у пациентов с боевыми травмами конечностей.
Материалы и методы
Данная работа была выполнена на клинической базе Госпиталя для ветеранов войн №3 (г. Москва) и представляла собой проспективное наблюдательное исследование. В исследование включали раненых с боевыми травмами конечностей, находящихся на стационарном лечении в ГВВ №3 с 15.06.2023 по 29.12.2023.У всех пациентов определяли уровень СРБ, выполняли общий и биохимический анализы крови. Наряду с этим вычисляли отношение числа нейтрофилов к лимфоцитам (НЛО), нейтрофилов к моноцитам (НМО), тромбоцитов к лимфоцитам (ТЛО), лимфоцитов к моноцитам (ЛМО), а также произведение нейтрофильно-лимфоцитарного отношения и числа тромбоцитов (системный иммуновоспалительный индекс, СИВИ), рассчитывали отношение СРБ к альбумину.
 У 62 пациентов было выполнено определение концентрации ИЛ-6 в крови, у 42 – уровня ферритина в крови. Также проводили скрининговую коагулограмму с определением активированного частичного тромбопластинового времени, протромбинового времени, международного нормализованного отношения, фибриногена.
У 62 пациентов было выполнено определение концентрации ИЛ-6 в крови, у 42 – уровня ферритина в крови. Также проводили скрининговую коагулограмму с определением активированного частичного тромбопластинового времени, протромбинового времени, международного нормализованного отношения, фибриногена.Полученные данные анализировали с использованием программного обеспечения Statistica (версия 13). Количественные переменные исследовали на нормальность распределения с помощью критерия Шапиро–Уилкса. При нормальном распределении описание количественных переменных представляли в виде минимального, максимального, среднего значения и стандартного отклонения, качественных – в виде n (%), при ненормальном распределении – в виде медианы и квартилей. Проводили корреляционный анализ с помощью критерия Спирмена.
Результаты
В проспективное наблюдательное исследование включены 248 пациентов (все мужчины), перенесших боевые ранения нижних и/или верхних конечностей в сроки от 4 до 58 дней (в среднем 15,8±8,6 дня) до поступления в стационар. Возраст участников исследования – от 19 до 59 лет, в среднем 35,6±8,3 года. Практически все участники исследования имели минно-взрывной характер ранения с большим объемом поражения. Наиболее часто раны локализовались на голенях(в 29,3% случаев) и стопах (12,8%). Пациенты с ампутированными конечностями составили 27,4%.
Основные лабораторные показатели воспалительной активности на момент включения пациентов в исследование приведены в табл. 1.
Медиана системного иммуновоспалительного индекса составила 1089 (Q1–Q3: 627,3–1839,5), минимальное значение данного показателя – 105,2, максимальное – 42 840. Уровень СРБ был повышен у 87,1% пациентов, СОЭ – у 87,3%. Лейкоцитоз выявлен у 52,2% раненых, тромбоцитоз – у 83,1%. Лабораторные показатели у пациентов с повышенным и нормальным уровнем СРБ представлены на рис. 2 и 3.

Среднее содержание ИЛ-6 составило 0,823 пг/мл, варьируя от 0,37 до 7,81 пг/мл; медиана данного показателя – 0,86 пг/мл [Q1–Q3: 0,48–0,79]. У пациентов с повышенным уровнем СРБ средняя концентрация
ИЛ-6 в крови достигала 0,98 пг/мл, с нормальным СРБ – 0,56 пг/мл (р=0,008). В группе пациентов с наличием лейкоцитоза средняя концентрация ИЛ-6 составила 0,85 пг/мл, у пациентов с нормальным числом лейкоцитов – 0,62 пг/мл (р=0,03). Лабораторные показатели у пациентов с повышенным и с нормальным уровнем ИЛ-6 представлены на рис. 4 и 5.
Медиана концентрации ферритина в группе из 42 пациентов составила 249,1 нг/мл (Q1–Q3: 83,9–451,3 нг/мл), его минимальное значение – 26,7 нг/мл, максимальное – 2000 нг/мл. Уровень ферритина в сыворотке крови был повышен у 12 пациентов (29,3% случаев).
Сравнение лабораторных показателей воспалительной активности у пациентов с ампутированными и с сохранными конечностями представлено в табл. 2.

Медиана СРБ у пациентов с ампутациями достигала 37,9 мг/л (Q1–Q3: 14,2–110,4), с сохранными конечностями – 19,9 мг/л (Q1–Q3: 7,2–50,3), медиана СИВИ – 1383,2 (Q1–Q3: 924,8–2752,5) и 1013,3 (Q1–Q3: 573,0–1534,7) соответственно.
Наряду с этим у пациентов с тромботическими осложнениями зарегистрированы более высокие уровни ИЛ-6 в крови (1,29±1,8 и 0,64±0,3; р=0,02), число лейкоцитов (10,8±4,8×109/л и 9,4±3,0×109/л; р=0,006), число нейтрофилов (8,0±4,6×109/л и 6,5±2,5×109/л; р=0,002), процентная доля нейтрофилов (71,0±8,7% и 68,1±7,7%; р=0,01), большее НЛО (5,8±6,1 и 4,1±2,0; р=0,001) и СИВИ (2592,5±5818 и 1445,9±1294; р=0,01).
В табл. 3 приведены корреляционные взаимосвязи между временем, прошедшим с момента ранения, и изученными лабораторными показателями.
Корреляции между уровнем СРБ и другими лабораторными показателями представлены в табл. 4, между ИЛ-6 и иными лабораторными параметрами – в табл. 5.

Зарегистрирована также слабая позитивная корреляция между уровнем СРБ и возрастом пациентов (r=0,16; p=0,01). Средний уровень СРБ у пациентов в возрасте 40 лет и старше составил 51,2 мг/л, моложе 40 лет – 39,8 мг/л (р=0,006).
Установлена прямая корреляция между уровнем интерлейкина-6 и возрастом больных – r=0,26; р=0,04. Наблюдалась тенденция к более высокой концентрации ИЛ-6 у пациентов старше 40 лет, по сравнению с более молодыми ранеными – 1,0 и 0,68 пг/мл, соответственно (р=0,07). Достоверной взаимосвязи между ИЛ-6 и временем, прошедшим с момента ранения, не установлено – r=-0,15; p=0,23. Корреляции между СОЭ и другими лабораторными показателями представлены в табл. 6.
Корреляции между концентрацией ферритина и другими лабораторными показателями отражены в табл. 7. Кроме того, наблюдалась также тенденция к обратной корреляции между ферритином и временем, прошедшим с момента ранения (r=-0,28; p=0,08).
 В табл. 8 представлены корреляционные взаимосвязи между лейкоцитарными индексами и изученными лабораторными показателями.
В табл. 8 представлены корреляционные взаимосвязи между лейкоцитарными индексами и изученными лабораторными показателями.Среднее отношение уровня СРБ к альбумину крови составило 1,5±2,2 (от 0,01 до 15,3), медиана этого показателя – 0,61 (Q1–Q3: 0,2–2,0). Корреляции между отношением СРБ к альбумину и другими лабораторными показателями отражены в табл. 9.
Число вторичных хирургических обработок ран с некрэктомией достоверно коррелировало с большинством показателей лабораторной воспалительной активности (табл. 10).
Обсуждение
Следует отметить, что в доступной литературе не найдено результатов изучения лейкоцитарных индексов и ферритина у пациентов с боевыми травмами. Имеются лишь единичные публикации по провоспалительным цитокинам и СРБ у пациентов с боевыми травмами [3, 12, 13], а в абсолютном большинстве других работ представлены результаты исследований различных маркеров лабораторной воспалительной активности у пациентов с небоевыми травмами или с посттравматическим стрессовым расстройством.Полученные нами результаты свидетельствуют об очень частом и выраженном повышении уровня СРБ, СОЭ, числа лейкоцитов и тромбоцитов у раненых с боевыми травмами конечностей. Так, концентрация СРБ была повышена у 87,1% пациентов, а его средний по группе уровень превышал нормальные показатели более чем в 8 раз. В исследовании J. Savic и соавт. с участием 72 раненых в Югославской войне также было отмечено выраженное повышение уровня СРБ, ИЛ-6 и других острофазовых показателей; причем степень их повышения коррелировала с тяжестью ранения [12].
В нашей группе пациентов все основные лабораторные показатели воспалительной активности (СРБ, ИЛ-6, лейкоциты, нейтрофилы, НЛО, СИВИ) также были существенно выше у раненых с наиболее тяжелыми травмами, включая травматическую ампутацию конечностей. В сербском исследовании S.S. Radacovic и соавт. с участием 79 раненых уровень СРБ тоже коррелировал с тяжестью боевой травмы [13]. При этом концентрация СРБ была максимальной на 2-й день после поступления в стационар, а затем она начинала снижаться, составляя на 14-й день 37 мг/л [13]. В нашей же работе средний уровень СРБ достигал 43,6 мг/л, а среднее время от момента ранения – 15,8 дня. В исследовании M. Meisner и соавт. у пациентов с небоевой травмой пиковые концентрации СРБ наблюдались на 2–3-й день после травмы, при этом на 7-й день уровень СРБ находился в пределах нормы только у 6% больных [14].
В работе F.R. Sheppard и соавт. с участием раненых в Ираке и Афганистане пациентов с боевыми травмами конечностей отсроченное заживление ран было связано с увеличением концентрации в сыворотке нескольких медиаторов воспаления, включая ИЛ-6, а повышенные концентрации этого цитокина в раневом отделяемом были маркером критического бактериального загрязнения ран [15]. В нашей работе только у 2 пациентов, у которых определялся уровень ИЛ-6, при микробиологическом исследовании раневого отделяемого не обнаружено роста микроорганизмов, во всех других случаях раны были колонизированы различными бактериальными возбудителями, причем в большинстве своем в ранах наблюдался одновременный рост нескольких микроорганизмов.
В различных исследованиях с участием пациентов с небоевыми травмами повышение уровня ИЛ-6 в крови коррелировало с тяжестью повреждения, было предиктором развития синдрома полиорганной недостаточности и летального исхода [16–22]. В работе F. Gebhard и соавторов у пациентов с травмой отмечалось не только коррелирующее с тяжестью повреждения повышение уровня ИЛ-6, но и у всех пациентов зарегистрировано увеличение концентрации СРБ [17]. Как и в нашей группе пациентов, в этом исследовании уровень СРБ зависел от тяжести травмы [17]. Наряду с этим авторы данной работы обнаружили положительную корреляцию (r=0,55) между ИЛ-6 и СРБ [17]. Нами также установлена аналогичная высокодостоверная взаимосвязь между концентрацией СРБ и ИЛ-6 в крови (r=0,44; p=0,0005). Известно, что ИЛ-6 – один из самых ранних и наиболее важных медиаторов острофазового ответа [17]. Данный провоспалительный цитокин опосредует повреждение органов и тканей при различных инфекционных и других воспалительных заболеваниях и может определять их прогноз [18]. ИЛ-6, в свою очередь, индуцирует синтез СРБ в печени [17]. Повышение уровня СРБ также может чрезвычайно чувствительно отражать повреждение органов и тканей и выраженность воспаления [18]. В исследовании K.A. Edwards и соавт. у военнослужащих с сотрясением головного мозга обнаружено также, что медиана концентрации ИЛ-6 примерно в 2,6 раза выше, чем в контрольной группе [23], а в работе A.A. Antunes и соавт. у пациентов с небоевой черепно-мозговой травмой и внутричерепным кровоизлиянием была найдена взаимосвязь между уровнем ИЛ-6 через 6 часов после травмы и прогрессированием объема внутричерепного кровоизлияния [24].
В различных исследованиях продемонстрировано, что политравма приводит к увеличению уровня СРБ, который, как известно, быстро реагирует в ответ на различные провоспалительные состояния. Уровни СРБ коррелируют со смертностью и полиорганной недостаточностью у пациентов с травмами [25]. В индонезийском исследовании у пациентов с тяжелой политравмой на уровень СРБ оказали влияние возраст, индекс массы тела, гиповолемический шок, переливание крови и коагулопатия. При многофакторном анализе наиболее значимыми факторами, повлиявшими на повышение СРБ, была величина международного нормализованного отношения и гиповолемический шок [25]. В нашем исследовании тоже была зарегистрирована прямая корреляция между уровнем СРБ и МНО (p=0,01), а также протромбиновым временем (p=0,00002). В вышеописанном индонезийском исследовании уровень СРБ был повышен у всех пациентов в возрасте 40 лет и старше, тогда как у пациентов моложе 40 лет он был повышен в 61,9% случаев [25]. В наблюдаемой нами группе пациентов зарегистрирована аналогичная положительная корреляция между уровнем СРБ и возрастом раненых (p=0,01), а у пациентов в возрасте 40 лет и старше концентрация СРБ была существенно выше (p=0,006), чем у раненых моложе 40 лет.
В ответ на политравму происходит не только выраженная активация нейтрофилов, но и посттравматическое снижение общего уровня лимфоцитов. Прогностическое значение НЛО изучали при различных нетравматических заболеваниях, на основании результатов которых предположили, что это отношение может представлять собой простой метод оценки системного воспаления и исходов у пациентов с травмами [26].
В нескольких исследованиях оценивали связь между НЛО и исходами у пациентов с множественными травмами. Так, в сирийском когортном ретроспективном исследовании у 566 пациентов с политравмой (75,8% из которых были с проникающими ранениями) значения НЛО выше 4,0 в первый день после травмы оказались предиктором летального исхода в течение последующих 30 дней [26]. В нашей группе пациентов данное отношение превышало значение четыре в 39,8% случаев, однако летальных исходов в наблюдаемой нами группе раненых не было.
В одном из исследований величина повышения НЛО в течение первых 48 ч после госпитализации была связана с развитием полиорганной недостаточности у 207 пациентов с травмами [27]. В другой работе была продемонстрирована выраженная взаимосвязь между НЛО и ранней смертностью у 285 пациентов с травмами и тяжелым кровотечением [28]. В этом исследовании величина НЛО больше 13,68 на 10-й день после травмы была предиктором внутригоспитальной смертности [28]. Стоит отметить, что в нашей группе пациентов величина НЛО выше 13,68 наблюдалась только в 4 случаях (1,6%). В исследовании E. Dilektasli и соавт. с участием 1356 пациентов с критической травмой превышение НЛО на 2-й и 5-й дни значений 8,19 и 7,92, соответственно, было независимо связано с внутригоспитальной смертностью [29]. У наблюдаемых нами раненых величина НЛО выше 7,92 была зарегистрирована в 23 случаях, однако среднее время от момента ранения было существенно больше (15,8 дня). В другом масштабном исследовании НЛО выше 7,44 оказалось независимым фактором риска смертности пациентов с травмами в отделениях интенсивной терапии, причем это отношение имело лучшую прогностическую ценность при черепно-мозговой травме [30]. Однако в работе H. Fouladseresht и соавт. меньший показатель НЛО (более 5,27) оказался независимым прогностическим фактором внутригоспитальной смертности у пациентов с травмами [31]. В нашей группе раненых значение НЛО более 5,27 было зарегистрировано в 22,9% случаев.
По мнению Y. Qiu и соавт., профиль соотношения нейтрофилов и лимфоцитов через 48 часов после травмы является многообещающим прогностическим инструментом у пациентов с травмами и требует дальнейшего изучения [32]. Согласно данным других авторов, оценка НЛО во время госпитализации – простой и экономически эффективный прогностический биомаркер, который отражает системную воспалительную реакцию и позволяет прогнозировать риск госпитальной смерти пострадавших от травм [33]. Сочетание НЛО с другими биомаркерами может еще больше повысить точность прогнозирования последствий травм, однако до сих пор вопрос оптимального порогового уровня остается предметом споров [33]. По данным же P. Forget и соавт., нормальное нейтрофильно-лимфоцитарное отношение у взрослых (но не пожилых) здоровых людей колеблется от 0,78 до 3,53 [34].
В нашем исследовании среднее значение НЛО составило 4,5, а тромбоцитарно-лимфоцитарного отношения (ТЛО) – 323,2. В работе G.F.P. Kusuma и соавт. медиана НЛО и ТЛО пациентов с черепно-мозговыми травмами составила 7,6 и 145,58 соответственно [35]. Как и в нашей группе пациентов, в этом исследовании была зарегистрирована высокодостоверная прямая корреляция НЛО и ТЛО с уровнем СРБ [35]. Более чем двукратная разница в отношении ТЛО, наиболее вероятно, связана с механизмом травмы и очень частыми кровотечениями с последующим реактивным тромбоцитозом у наших раненых. Наряду с этим число тромбоцитов может повышаться и в рамках синдрома системного воспалительного ответа. Кроме активного участия в процессах коагуляции тромбоциты стимулируют также высвобождение провоспалительных медиаторов и взаимодействуют с различными клетками, включая нейтрофилы, Т-лимфоциты и макрофаги, которые инициируют и усиливают воспалительные процессы; следовательно, высокое ТЛО может указывать на повышенный синтез цитокинов и активацию тромбоцитов, которые способствуют усилению воспаления [36].
В одном из исследований ТЛО выше 190,98 наряду с высоким системным иммуновоспалительным индексом и НЛО было предиктором неблагоприятного прогноза через 6 месяцев после выписки из стационара у пациентов с тяжелыми черепно-мозговыми травмами [37]. В этой работе с плохим прогнозом ассоциировалась величина СИВИ выше 2651 [37]. В наблюдаемой нами группе раненых повышение ТЛО более 190 зарегистрировано в 78,3% случаев, а СИВИ более 2651 – в 13,6% случаев, однако прогноз для жизни у всех наших пациентов был благоприятным.
По результатам систематического обзора M.F. Ilyas и соавт., ТЛО может быть независимым прогностическим маркером у взрослых пациентов с травмами головного мозга [36]. Высокий уровень ТЛО при госпитализации может предсказать увеличение риска смертности через 30 дней и неблагоприятные исходы через 6 месяцев после травмы и, что немаловажно, данный показатель может использоваться повсеместно, поскольку является простым, недорогим и рутинным методом исследования [36].
Вместе с тем в других исследованиях было продемонстрировано негативное прогностическое значение не высокого, а низкого ТЛО. Так, в исследовании J.K. Kim и соавт. величина ТЛО менее 65,35 ассоци-ировалась со значительным увеличением смертности у пациентов с травмами [38]. Стоит отметить, что в нашем исследовании не было ни одного пациента с величиной ТЛО равной или менее 65. В вышеописанной работе Kim J.K. и соавторов, а также в других исследованиях величина ТЛО была существенно ниже, чем в нашей группе пациентов, и составляла 51,3–76,3 для умерших пациентов и 89,9–149,3 – для выживших [38–41]. В исследовании R.-T. Ke и соавт. более высокое число лимфоцитов, более низкое число тромбоцитов и более низкое ТЛО были связаны с более высоким риском смерти у пациентов ОРИТ с травмами [42]. У умерших пациентов величина ТЛО была значительно ниже, чем у выживших (124,3 и 150,6 соответственно), однако существенной разницы в НЛО и МЛО между двумя этими группами не было [42].
В исследовании B. Zhang и соавт. медиана отношения моноцитов к лимфоцитам (МЛО) выше 0,65 независимо ассоциировалась с персистирующим критическим состоянием у пациентов после тяжелой травмы, тогда как отношение нейтрофилов к лимфоцитам значимо не коррелировало с ним [43]. В нашей же группе пациентов среднее значение МЛО было существенно ниже и составило 0,46. В работе D. Zhang и соавт. более высокое НЛО через неделю после ушиба головного мозга и более высокое моноцитарно-лимфоцитарное отношение при поступлении и через 24 ч были достоверно связаны с неблагоприятным прогнозом в течение 6 месяцев после травмы [44]. При этом пороговые значения НЛО и МЛО в качестве предикторов неблагоприятного исхода через 6 месяцев составили 6,39 и 0,76 соответственно [44].
У наблюдаемых нами раненых пациентов повышение уровня ферритина зарегистрировано в 29% случаев и его концентрация напрямую коррелировала с другими лабораторными показателями воспалительной активности. Известно, что ферритин представляет собой не только белок, участвующий в обмене железа, но и играющий важную роль в механизмах воспаления и антиоксидантной защиты [45]. Повышенный уровень ферритина в крови – это индикатор многих воспалительных состояний, включая острые инфекции и травмы. Возможные механизмы увеличения содержания этого белка в крови включают лизис клеток, из-за которого ферритин высвобождается из внутриклеточных хранилищ, воспалительные реакции, при которых он вырабатывается под действием различных провоспалительных цитокинов, включая ИЛ-6, а также окислительный стресс [45]. Уровень сывороточного ферритина может быть предиктором исхода травмы и нередко зависит от ее тяжести [45].
В немногочисленных исследованиях показана положительная корреляция между уровнями ферритина в крови и плохим прогнозом у пациентов с травмами [45–47]. Так, в работе Y.S. Ji и соавт. было обнаружено, что уровень ферритина является предиктором развития острого респираторного дистресс-синдрома (ОРДС) у пациентов с травмами [47]. В этом исследовании средний уровень ферритина достигал 456 мг/дл, а начало ОРДС можно было предсказать, когда его значение превышало 340 мг/дл [47]. В нашей группе пациентов средняя концентрация ферритина достигала 334 нг/мл, его повышение выше 340 нг/мл зарегистрировано в 30,9% случаев, однако ни одного случая ОРДС зарегистрировано не было. Авторы еще одной работы пришли к выводу о том, что у пациентов с длительным пребыванием в ОРИТ динамика сывороточного ферритина отражает прогрессирование полиорганной недостаточности [46].
Отношение СРБ к альбумину – относительно новый показатель воспаления, позволяющий прогнозировать исход различных заболеваний, в том числе политравмы. В исследовании X. Lu и соавт. с участием 264 пациентов с тяжелой травмой индекс шока был значительно выше, когда данное соотношение было ≥4 [48]. Кроме того, в этой работе отношение СРБ к альбумину было независимым прогностическим фактором 28-дневной смертности пациентов с множественными травмами [48]. В нашем исследовании среднее отношение уровня СРБ к альбумину крови составило 1,5, а его величина более 4 зарегистрирована лишь в 8,3% случаев и, как было уже сказано ранее, ни одного смертельного исхода у наблюдаемых нами пациентов не было.
В нашей группе пациентов число оперативных вмешательств прямо коррелировало со всеми лабораторными маркерами воспалительной активности. По мнению P.F. Dobson и соавт., при обширной травме конечностей со значительным повреждением мягких тканей и переломами костей повторные хирургические вмешательства приводят к длительной воспалительной реакции с продолжающимся высвобождением провоспалительных медиаторов [7].
Заключение
Результаты нашего исследования свидетельствуют о выраженном повышении всех изученных лабораторных показателей воспалительной активности у пациентов с боевыми травмами. Наибольшие значения маркеров воспаления зарегистрированы у пациентов с ампутациями конечностей. Величина всех основных показателей воспалительной активности закономерно уменьшалась по мере увеличения срока от момента ранения. Установлены достоверные корреляционные взаимосвязи между всеми основными лабораторными маркерами воспаления. Различные лейкоцитарные индексы и отношение СРБ к альбумину могут быть использованы в качестве показателей воспалительной активности у пациентов с боевыми травмами. К достоинствам этих маркеров можно отнести их простоту, доступность и низкую стоимость определения. Необходимо продолжить исследования по изучению лабораторных маркеров воспаления у пациентов с боевыми ранениями.Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Тополянская Светлана Викторовна – д-р мед. наук, проф. каф. госпитальной терапии №2, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет), врач-терапевт, Госпиталь для ветеранов войн №3. E-mail: sshekshina@yandex.ru; ORCID: 0000-0002-4131-8432
Svetlana V. Topolyanskaya – Dr. Sci. (Med.), Prof., Sechenov First Moscow State Medical University (Sechenov University); General Practitioner, War Veterans Hospital No. 3. E-mail: sshekshina@yandex.ru; ORCID: 0000-0002-4131-8432
Бубман Леонид Игоревич – врач-хирург, Госпиталь для ветеранов войн №3. E-mail: bubmanli@zdrav.mos.ru; ORCID: 0000-0002-4195-3188
Leonid I. Bubman – Surgeon, War Veterans Hospital No. 3. E-mail: bubmanli@zdrav.mos.ru; ORCID: 0000-0002-4195-3188
Куржос Мария Николаевна – врач-терапевт, Госпиталь для ветеранов войн №3. E-mail: kurzhosmn@zdrav.mos.ru
Maria N. Kurzhos – General Practitioner, War Veterans Hospital No. 3. E-mail: kurzhosmn@zdrav.mos.ru
Васильева Юлия Юрьевна – врач-лаборант клинико-диагностической лаборатории, Госпиталь для ветеранов войн №3. E-mail: vasilievajj@zdrav.mos.ru
Yulia Yu. Vasilyeva – Laboratory assistant, War Veterans Hospital No. 3. E-mail: vasilievajj@zdrav.mos.ru
Молочников Александр Юрьевич – зав. хирургическим отделением №21, Госпиталь для ветеранов войн №3. E-mail: molochnikovayu@zdrav.mos.ru
Alexander Yu. Molochnikov – Head of the Department, War
Veterans Hospital No. 3. E-mail: molochnikovayu@zdrav.mos.ru
Хан Станислав Олегович – врач-хирург, Госпиталь для ветеранов войн №3. E-mail: khanso@zdrav.mos.ru
Stanislav O. Khan – Surgeon, War Veterans Hospital No. 3. E-mail: khanso@zdrav.mos.ru
Карпов Виктор Викторович – врач-хирург, Госпиталь для ветеранов войн №3. E-mail: karpovvv@zdrav.mos.ru
Viktor V. Karpov – Surgeon, War Veterans Hospital No. 3. E-mail: karpovvv@zdrav.mos.ru
Нечаев Алексей Игоревич – врач-хирург Госпиталь для ветеранов войн №3. E-mail: nechaevai@zdrav.mos.ru
Alexey I. Nechaev – Surgeon, War Veterans Hospital No. 3. E-mail: nechaevai@zdrav.mos.ru
Эмомадов Алишер Мухаматджонович – врач-хирург, Госпиталь для ветеранов войн №3; E-mail: emomadovam@zdrav.mos.ru
Alisher M. Emomadov – Surgeon, War Veterans Hospital No. 3.
E-mail: emomadovam@zdrav.mos.ru
Марченко Игорь Петрович – зам. глав. врача по хирургии, Госпиталяь для ветеранов войн №3. E-mail: marchenkoip@zdrav.mos.ru
Igor P. Marchenko – Deputy Chief doctor for surgery, War
Veterans Hospital No. 3. E-mail: marchenkoip@zdrav.mos.ru
Лыткина Каринэ Арнольдовна – зам. глав. врача по терапии, Госпиталь для ветеранов войн №3. E-mail: lytkinaka@zdrav.mos.ru; ORCID: 0000-0001-9647-7492
Karine A. Lytkina – Deputy Chief doctor for therapy, War Veterans Hospital No. 3. E-mail: lytkinaka@zdrav.mos.ru; ORCID: 0000-0001-9647-7492
Буриев Илья Михайлович – советник глав. врача по хирургии, Госпиталь для ветеранов войн №3. E-mail: burievim@zdrav.mos.ru
Ilya M. Buriev – Advisor for surgery, War Veterans Hospital No. 3. E-mail: burievim@zdrav.mos.ru
Мелконян Георгий Геннадьевич – д-р мед. наук, проф., глав. врач ГВВ №3, проф. каф. хирургии РМАНПО. E-mail: gvv3@zdrav.mos.ru; ORCID: 0000-0002-4021-5044
Georgy G. Melkonyan – Dr. Sci. (Med.), Full Prof., Chief doctor, War Veterans Hospital No. 3, Prof., Russian Medical Academy of Continuous Professional Education. E-mail: gvv3@zdrav.mos.ru; ORCID: 0000-0002-4021-5044
Поступила в редакцию: 06.07.2024
Поступила после рецензирования: 25.07.2024
Принята к публикации:15.08.2024
Received: 06.07.2024
Revised: 25.07.2024
Accepted: 15.08.2024
Список исп. литературыСкрыть список1. Thompson KB, Krispinsky LT, Stark RJ. Late immune consequences of combat trauma: a review of trauma-related immune dysfunction and potential therapies. Mil Med Res 2019;6(1):11. DOI: 10.1186/s40779-019-0202-0
2. Li R, Ye JJ, Gan L et al. Traumatic inflammatory response: pathophysiological role and clinical value of cytokines. Eur J Trauma Emerg Surg 2023; Dec 27. DOI: 10.1007/s00068-023-02388-5. Epub ahead of print.
3. Surbatovic M, Filipovic N, Radakovic S, Stankovic N, Slavkovic Z. Immune cytokine response in combat casualties: blast or explosive trauma with or without secondary sepsis. Mil Med 2007;172(2):190-195. DOI: 10.7205/milmed.172.2.190
4. Surbatovic M, Veljovic M, Jevdjic J, et al. Immunoinflammatory response in critically ill patients: severe sepsis and/or trauma. Mediators Inflamm 2013;2013:362793. DOI: 10.1155/2013/362793
5. Brown TS, Hawksworth JS, Sheppard FR, Tadaki DK, Elster E. Inflammatory response is associated with critical colonization in combat wounds. Surg Infect (Larchmt) 2011 Oct;12(5):351-7. DOI: 10.1089/sur.2010.110
6. Malchow RJ, Black IH. The evolution of pain management in the critically ill trauma patient: Emerging concepts from the global war on terrorism. Crit Care Med 2008 Jul;36(7 Suppl):S346-57. DOI: 10.1097/CCM.0b013e31817e2fc9
7. Dobson PF, Muller K, Balogh ZJ. Systemic Response to Injury. In book: Textbook of Emergency General Surgery. Springer Nature Switzerland AG 2023. F.Coccolini, F.Catena (eds.). Available from https://doi.org/ 10.1007/978-3-031-22599-4_8
8. Yang YW, Wu CH, Tsai HT et al. Dynamics of immune responses are inconsistent when trauma patients are grouped by injury severity score and clinical outcomes. Sci Rep 2023;13(1):1391. DOI: 10.1038/s41598-023-27969-7.
9. Lenz A, Franklin GA, Cheadle WG. Systemic inflammation after trauma. Injury 2007;38(12):1336-1345. DOI: 10.1016/j.injury.2007.10.003
10. Janakiram NB, Valerio MS, Goldman SM, Dearth CL. The Role of the Inflammatory Response in Mediating Functional Recovery Following Composite Tissue Injuries. Int J Mol Sci 2021;22(24):13552. DOI: 10.3390/ijms222413552
11. Lord JM, Midwinter MJ, Chen YF et al. The systemic immune response to trauma: an overview of pathophysiology and treatment. Lancet 2014;384(9952):1455-1465. DOI: 10.1016/S0140-6736(14)60687-5
12. Savić J, Černak I, Pejnović N, Topalov D, Lazarov A. Acute phase response to war wound. Shock 1995; 4(6): 61. P-89
13. Radaković S, Surbatović M, Pavlica M, Stanković N. C-reactive protein as an indicator of the severity of war injuries. Acta Chir Iugosl 2003;50(4):91-97. DOI: 10.2298/aci0304091r
14. Meisner M, Adina H, Schmidt J. Correlation of procalcitonin and C-reactive protein to inflammation, complications, and outcome during the intensive care unit course of multiple-trauma patients. Crit Care 2006;10(1):R1. DOI: 10.1186/cc3910
15. Sheppard FR, Keiser P, Craft DW et al. The majority of US combat casualty soft-tissue wounds are not infected or colonized upon arrival or during treatment at a continental US military medical facility. Am J Surg 2010;200(4):489–495. DOI: 10.1016/j.amjsurg.2010.03.001
16. Frink M, van Griensven M, Kobbe P et al. IL-6 predicts organ dysfunction and mortality in patients with multiple injuries. Scand J Trauma Resusc Emerg Med 2009;17:49. DOI: 10.1186/1757-7241-17-49
17. Gebhard F, Pfetsch H, Steinbach G et al. Is Interleukin 6 an Early Marker of Injury Severity Following Major Trauma in Humans? Arch Surg 2000;135(3):291–295. DOI:10.1001/archsurg.135.3.291
18. Li Y, Chen L, Fang W, Chen H. Application value of procalcitonin, C-reactive protein and interleukin-6 in the evaluation of traumatic shock. Exp Ther Med 2019;17:4586-4592. DOI: 10.3892/etm.2019.7492
19. Okeny PK, Ongom P, Kituuka O. Serum interleukin-6 level as an early marker of injury severity in trauma patients in an urban low-income setting: a cross-sectional study. BMC Emerg Med 2015;15:22. DOI: 10.1186/s12873-015-0048-z
20. Sapan HB, Paturusi I, Islam AA et al. Interleukin-6 and interleukin-10 plasma levels and mRNA expression in polytrauma patients. Chin J Traumatol 2017;20(6):318-322. DOI: 10.1016/j.cjtee.2017.05.003
21. Sousa A, Raposo F, Fonseca S et al. Measurement of cytokines and adhesion molecules in the first 72 hours after severe trauma: association with severity and outcome. Dis Markers 2015;2015:747036. DOI: 10.1155/2015/747036
22. Stensballe J, Christiansen M, Tønnesen E et al. The early IL-6 and IL-10 response in trauma is correlated with injury severity and mortality. Acta Anaesthesiol Scand 2009;53(4):515-521. DOI: 10.1111/j.1399-6576.2008.01801.x
23. Edwards KA, Gill JM, Pattinson CL et al. Interleukin-6 is associated with acute concussion in military combat personnel. BMC Neurol 2020;20(1):209. DOI: 10.1186/s12883-020-01760-x
24. Antunes AA, Sotomaior VS, Sakamoto KS et al. Interleukin-6 plasmatic levels in patients with head trauma and intracerebral hemorrhage. Asian J Neurosurg 2010;5(1):68-77
25. Wiargitha IK, Paramita PL. The corellation between aged, body mass index, hypovolemic shock, blood tranfusion and coagulopathy in traumatic patient with elevated C-Reactive Protein in Sanglah General Hospital, Denpasar 2017-2018. Available from https://erepo.unud.ac.id/ id/eprint/20275/1/d8af42ec9ecf39975061c047f1b02d04.pdf. Accessed on 20 June 2024.
26. Soulaiman SE, Dopa D, Raad A-B T et al. Cohort retrospective study: the neutrophil to lymphocyte ratio as an independent predictor of outcomes at the presentation of the multi-trauma patient. Int J Emerg Med 2020;13:5. DOI: 10.1186/s12245-020-0266-3
27. Younan D, Richman J, Zaky A, Pittet JF. An Increasing Neutrophil-to-Lymphocyte Ratio Trajectory Predicts Organ Failure in Critically-Ill Male Trauma Patients. An Exploratory Study. Healthcare (Basel) 2019;7(1):42. DOI: 10.3390/healthcare7010042
28. Duchesne JC, Tatum D, Jones G et al. Multi-institutional analysis of neutrophil-to-lymphocyte ratio (NLR) in patients with severe hemorrhage: A new mortality predictor value. J Trauma Acute Care Surg 2017;83(5):888-893. DOI: 10.1097/TA.0000000000001683
29. Dilektasli E, Inaba K, Haltmeier T et al. The prognostic value of neutrophil-to-lymphocyte ratio on mortality in critically ill trauma patients. J Trauma Acute Care Surg 2016;81(5):882-888. DOI: 10.1097/ TA.0000000000000980
30. Xu J, Li S, Lui KY et al. The neutrophil-to-lymphocyte ratio: A potential predictor of poor prognosis in adult patients with trauma and traumatic brain injury. Front Surg. 2022;9:917172. DOI: 10.3389/fsurg. 2022.917172
31. Fouladseresht H, Bolandparvaz S, Abbasi HR et al. The Neutrophil-to-Lymphocyte Ratio at the Time of Admission: A New Prognostic Indicator for Hospital Mortality of Trauma Patients. Iran J Allergy Asthma Immunol 2021;20(1):33-45. DOI: 10.18502/ijaai.v20i1.5411
32. Qiu Y, Fitzgerald M, Mitra B. Longitudinal analysis of neutrophil-to-lymphocyte ratio over time after major trauma. Trauma 2024;26(1):73-79. DOI: 10.1177/14604086221131106
33. Hosseini M, Fazeli P, Hajivalili M, Paydar S. The prognostic values of neutrophil to lymphocyte ratio in traumatically injured patients upon admission: A mini-Review. Eur J Inflamm. 2023;21. DOI:10.1177/ 1721727X231197494
34. Forget P, Khalifa C, Defour J-P et al. What is the normal value of the neutrophil-to-lymphocyte ratio? BMC Res Notes 2017;10(1):12.
35. Kusuma GFP, Maliawan S, Mahadewa TGB et al. Neutrophil-to-lymphocyte Ratio and Platelet-to-lymphocyte Ratio Correlations with C-reactive Protein and Erythrocyte Sedimentation Rate in Traumatic Brain Injury. Open Access Maced J Med Sci 2020;8(B):1185-92. Available from: https://oamjms.eu/index.php/mjms/article/view/5544. Accessed on 24 June 2024.
36. Ilyas MF, Lado A, Budiono EA et al. Platelet-to-lymphocyte ratio as a prognostic predictive marker on adults with traumatic brain injury: Systematic review. Surg Neurol Int 2024;15:205. DOI: 10.25259/ SNI_878_2023
37. Chen L, Xia S, Zuo Y et al. Systemic immune inflammation index and peripheral blood carbon dioxide concentration at admission predict poor prognosis in patients with severe traumatic brain injury. Front Immunol 2023;13:1034916. DOI: 10.3389/fimmu.2022.1034916
38. Kim JK, Sun KH. Role of platelet-to-lymphocyte ratio at the time of arrival to the emergency room as a predictor of short-term mortality in trauma patients with severe trauma team activation. Acute Crit Care 2024;39(1):146-154. DOI: 10.4266/acc.2023.01319
39. Jo S, Jeong T, Lee JB et al. The prognostic value of platelet-to-lymphocyte ratio on in-hospital mortality in admitted adult traffic accident patients. PLoS One 2020;15(6):e0233838. DOI: 10.1371/journal. pone.0233838
40. El-Menyar A, Mekkodathil A, Al-Ansari A et al. Platelet-lymphocyte and neutrophil-lymphocyte ratio for prediction of hospital outcomes in patients with abdominal trauma. Biomed Res Int 2022;2022:5374419.
41. Ho Lee J, Hun Lee D, Kook Lee B. Association Between Platelet-to-Lymphocyte Ratio and In-hospital Mortality in Elderly Patients with Severe Trauma. West J Emerg Med 2024;25(1):129-135. DOI: 10.5811/westjem.61343
42. Ke RT, Rau CS, Hsieh TM et al. Association of Platelets and White Blood Cells Subtypes with Trauma Patients' Mortality Outcome in the Intensive Care Unit. Healthcare (Basel) 2021;9(8):942. DOI: 10.3390/healthcare9080942
43. Zhang B, Han Y, Chen X et al. Association of Monocyte-to-Lymphocyte and Neutrophil-to-Lymphocyte Ratios With Persistent Critical Illness in Patients With Severe Trauma. J Trauma Nurs 2022;29(5):240-251. DOI: 10.1097/JTN.0000000000000672
44. Zhang D, Zhuang D, Li T et al. An analysis of neutrophil-to-lymphocyte ratios and monocyte-to-lymphocyte ratios with six-month prognosis after cerebral contusions. Front Immunol 2024;15:1336862. DOI: 10.3389/fimmu.2024.1336862
45. Fouladseresht H, Ghamar Talepoor A, Eskandari N et al. Potential Immune Indicators for Predicting the Prognosis of COVID-19 and Trauma: Similarities and Disparities. Front Immunol 2022;12:785946. doi: 10.3389/fimmu.2021.785946
46. Rusu D, Blaj M, Ristescu I et al. Outcome Predictive Value of Serum Ferritin in ICU Patients with Long ICU Stay. Medicina (Kaunas) 2020;57(1):1. DOI: 10.3390/medicina57010001
47. Ji YS, Kim NH, Jung HG et al. Significance of Serum Ferritin in Multiple Trauma Patients with Acute Respiratory Distress Syndrome.
J Trauma Inj 2007;20(2):57-64.
48. Lu X, Liu Wc, Qin Y et al. C-reactive Protein/Albumin Ratio as a Prognostic Indicator in Posttraumatic Shock and Outcome of Multiple Trauma Patients. Curr Med Sci 2023;43:360–366. DOI: 10.1007/s11596-023-2714-9
29 ноября 2024
Количество просмотров: 58


