Клинический разбор в общей медицине №01 2020
1Russian Medical Academy of Continuous Professional Education, Moscow, Russia;
2National Medical Research Center for Cardiology, Moscow, Russia;
3Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russia;
4Pirogov Russian National Research Medical University, Moscow, Russia asus99@mail.ru
Abstract
Homozygous familial hypercholesterolemia is a severe genetic disorder characterized by extremely high levels of total cholesterol and low-density lipoprotein cholesterol (LDL-C), as well as by rapid atherosclerosis progression in various vascular territories. Objective examination of the affected patients often reveals multiple Achilles tendon xanthomas, xanthomas on the extensor surface of arms, knee joints, etc. The prevalence of such severe inherited hyperlipidemia in many populations is about 1 : 1 000 000, however, the family heterozygous type frequency increase leads to the decrease of this value and to the increase in the affected people number. The paper introduces case report for the patient V.I. aged 16 who was diagnosed with homozygous familial hypercholesterolemia at the age of 12. DNA testing revealed pathogenic mutations in the LDL receptor gene which confirmed the diagnosis. The paper reports the results of the discussed patient treatment using triple-drug combination lipid-lowering therapy with rosuvastatin (40 mg/day), ezetimibe (10 mg/day) and evolocumab (420 mg/day) in the last two years. The total cholesterol level decreased from 20.8 mmol/L (baseline) to 7.3–12.00 mmol/L, and the LDL-C level decreased from 19.9 mmol/L to 4.6–9.9 mmol/L due to therapy, the treatment was well tolerated. During the observation period, a rapid regression of xanthomas on the buttocks, knee and elbow joints, and Achilles tendon was achieved. A series of baseline instrumental tests (2013) revealed severe atherosclerosis of carotid arteries (maximum stenosis up to 50%), and first symptoms of aortic valve stenosis. Another examination in the hospital (2019) revealed slowing the progression of atherosclerosis in the carotid arteries and aorta, however, the arterial hypertension onset required additional prescription of a low dose of enalapril. Exercise testing and Holter ECG monitoring has yet identified no myocardial ischemia. Thus, the timely diagnosis together with long-term triple-drug intensive lipid-lowering therapy make it possible to slow down the atherosclerosis progression in the discussed rare and severe category of patients.
Key words: homozygous hypercholesterolemia, familial hypercholesterolemia, low-density lipoprotein cholesterol, rosuvastatin, ezetimibe, evolocumab, combination therapy, slowing the atherosclerosis progression.
For citation: Susekov A.V., Balakhonova T.V., Soloviev V.M. et al. Patient with homozygous familial hypercholesterolemia: difficult to treat. Clinical review for general practice. 2020; 1: 35–41. DOI: 10.47407/kr2020.1.1.00006
Данные исходного клинического обследования пациента В.И. в 2013 г.
Первичная консультация состоялась в январе 2013 г. в ФГБУ «НМИЦ кардиологии» Минздрава России [14]. Пациент был направлен на консультацию в НМИЦ кардиологии из НИИ педиатрии по поводу очень высокого уровня общего ХС (20 ммоль/л) и массивного ксантоматоза. Результаты по первичной консультации и совместного консилиума педиатров, кардиологов и липидологов пациента В.И. с ГомоСГХС опубликованы нами ранее [14]. Данные лабораторных анализов (исходно, без терапии):
в анализе крови от 25.01.2013: креатинин – 44,4 мкмоль/л; ХС – 20,84 ммоль/л; триглицериды – 0,89 ммоль/л;
ХС липопротеидов высокой плотности (ХС-ЛПВП) – 0,94 ммоль/л; ХС-ЛПНП – 19,9 ммоль/л; аланинаминотрансфераза (АЛТ) – 13 Ед/л; аспартатаминотрансфераза (АСТ) – 24 Ед/л; щелочная фосфатаза (ЩФ) – 587 Ед/л; креатинфосфокиназа (КФК) – 102 Ед/л; γ-глутамилтранс-фераза – 16 Ед/л; аполипопротеин А1 – 86 мк/дл; аполипопротеин В >300 мг/дл; липопротеинлипаза <4,0 Ед/л; липопротеид (а) – 4,4 мг/дл.
Весной 2013 г. у пациента был взят анализ крови для ДНК-диагностики в лаборатории молекулярной генетики ФГБУ «ГНИЦ ПМ» Минздрава России (зав. лабораторией канд. мед. наук А.Н. Мешков). У пациента проводилось секвенирование всей кодирующей последовательности генома (экзом). Секвенирование экзома проводилось с помощью метода циклического лигазного секвенирования по технологии SOLiDTM (Applied Biosystems) на секвенаторе SOLID 5500 xl, с предварительным выделением фрагментов ДНК, содержащих экзомы, из генома пациента с помощью TargetSeqTM Exome Enrichment Kit (Applied Biosystems). Мутаций, ответственных за развитие ГХС, в генах ABCG5, ABCG8, CYP7A1, LDLRAP1, PCSK9 и APOB не выявлено. Выявлены две мутации в гене ЛПНП-рецептора (LDLR) – C68F и C270X. Мутация C270X была описана другими исследователями у больных СГХС, в том числе и в России. Наличие этой мутации приводит к прерыванию трансляции ЛПНП-рецептора. Мутация C68F приводит к замене аминокислоты Cys на Phe и ранее не была описана у больных СГХС, однако ранее описана замена аминокислоты Cys в положении 68 на стоп-кодон, что косвенно подтверждает патогенность данной мутации.
По результатам эхокардиографии (ЭхоКГ) от 25.01.2013 (исследование проводила профессор М.А. Саидова): уплотнение стенок аорты, створок аортального клапана с формированием начальных признаков стеноза устья аорты и регургитации аортального клапана I–II степени. Полости сердца не расширены, стенки не утолщены. Сократительная функция левого желудочка удовлетворительная. Клапанный аппарат интактен. Признаков легочной гипертензии нет. Данных, подтверждающих врожденный порок сердца, не получено. Тредмил-тест (май 2013 г.): на фоне выполненной субмаксимальной нагрузки ишемических изменений не зарегистрировано. Проба отрицательная. Толерантность к физической нагрузке средняя (7,7 METS).
Основной диагноз: Е 7.8 – СГХС, II A типа, гомозиготная форма, множественный ксантоматоз; 135.2 – приобретенный порок сердца: надклапанный стеноз аорты с недостаточностью аортальнго клапана. Осложнения основного заболевания: хроническая сердечная недостаточность – функциональный класс II по Ross. Сопутствующие заболевания: 49.8 – дисфункция синусового узла; 170.8 – атеросклероз других артерий; 125.3 – аневризма межпредсердной перегородки; Н52.0 – гиперметропия слабой степени, ангиопатия сетчатки по гипертоническому типу.
По состоянию на сентябрь 2019 г. пациент жалоб не предъявлял. Периодические жалобы на утомляемость, слабость при физической нагрузке, эпизоды повышения артериального давления (АД) до 150/90 мм рт. ст.
Причины регулярных ежегодных госпитализаций в НИКИ педиатрии им. акад. Ю.Е. Вельтищева (2014–2019 гг.) – тяжесть основного заболевания (ГомоСГХС) и необходимость проведения комплекса лабораторных и инструментальных тестов, направленных на диагностику осложнений основного заболевания, а также поиск возможных осложнений (атеросклеротические бляшки, стеноз устья аорты, поражение клапанного аппарата сердца) из-за прогрессирования атеросклероза.
В публикации 2016 г. [16], по данным стационарного обследования, отмечено, что обнаружено уплотнение корня аорты, краевое уплотнение створок аортального клапана с недостаточностью 2–2,5+, надклапанный стеноз аорты с PG 20–25Hg, а также аневризма межпредсердной перегородки. При обследовании в 2016 г., по данным суточного мониторирования АД (СМАД), артериальной гипертонии найдено не было. Весной 2016 г. в результате решения консилиума к комбинированной терапии розувастатином (40 мг/сут) и эзетимибом (10 мг/сут) было решено добавить ингибитор проконвертазы PCSK9 эволокумаб (Репата) 420 мг 1 раз в месяц [16]. Результаты других лабораторных анализов в пределах нормы. В общем анализе крови: гемоглобин – 144 г/л, эритроциты – 4,94×1012/л, лейкоциты – 6,4×109/л, тромбоциты – 264×109/л. Остальные показатели – в пределах нормы.
По данным ЭхоКГ (23.09.2019): умеренная брадикардия с частотой сердечных сокращений (ЧСС) 64–72 уд/мин, PQ – 130 мс, QRS – 90 мс, QT – 360 мс, признаки перегрузки левого предсердия (p-mitrale). Гипертрофия миокарда левого желудочка. Нарушение процессов реполяризации в виде сглаженности зубца Т в I, III, avF, aVL. После физической нагрузки: выраженная синусовая тахикардия с ЧСС 120–130 уд/мин, QRS – 80 мс, PQ – 120 мс, QTc – 480 мс, дальнейшее усугубление процессов реполяризации, в остальном – без особенностей.
ЭхоКГ (23.09.2019): синусовый ритм, ЧСС – 54 уд/мин. Локальное утолщение стенок аорты со стенозированием просвета до 12 мм. Дилатация левого предсердия. М-режим – 26 мм. Левый желудочек – концентрическая гипертрофия. Пролабирование межпредсердной перегородки в полость правого предсердия на 8 мм. Систолическая функция левого желудочка в норме. Признаки умеренного надклапанного стеноза аортального клапана. Трикуспидальная регургитация 1,5+. Перикард – без особенностей.
Холтеровское мониторирование электрокардиограммы (27.09.2019): ЧСС средняя – 78 уд/мин, ЧСС максимальная – 127 уд/мин, ЧСС ночная – 55 уд/мин, ЧСС дневная – 78 уд/мин. В ночное время – умеренная тахикардия. Транзиторная косовосходящая депрессия ST-сегмента на фоне синусовой тахикардии в отведениях II, III, AVF максимально до 1,55 мм в III отведении. Неполная блокада правой ножки пучка Гиса.
Тредмил-тест (27.09.2019): АД исходное – 122/60 мм рт. ст. Нарушение ритма сердца и проводимости не проводилось. Усиление синусовой тахикардии – до ЧСС 169 уд/мин. Депрессия ST-сегмента >1 мм, V3–V6 косовосходящая, диагностически незначимая. Жалоб не предъявлял. Толерантность к физической нагрузке высокая (10.70 METS). Нарушений ритма не отмечалось.
СМАД на фоне гипотензивной терапии (эналаприл 5 мг/сут). Признаков артериальной гипертонии не выявлено. Средние показатели АД – 104/60 мм рт. ст. в дневное время и 102/53 мм рт. ст. – в ночное время. Максимальный подъем АД до 130 мм рт. ст. в 09:51 при ЧСС 58 уд/мин.
Дуплексное сканирование экстракраниальных отделов брахиоцефальных сосудов (26.09.2019): стеноз ОСА (ОСА слева 35–40%, в устье ВСА пролонгированная полуконцентрическая атеросклеротическая бляшка 35–40%, в области бифуркации ОСА справа – бляшка 30%, в области бифуркации с переходом во ВСА – бляшка до 60% в проксимальном отделе).
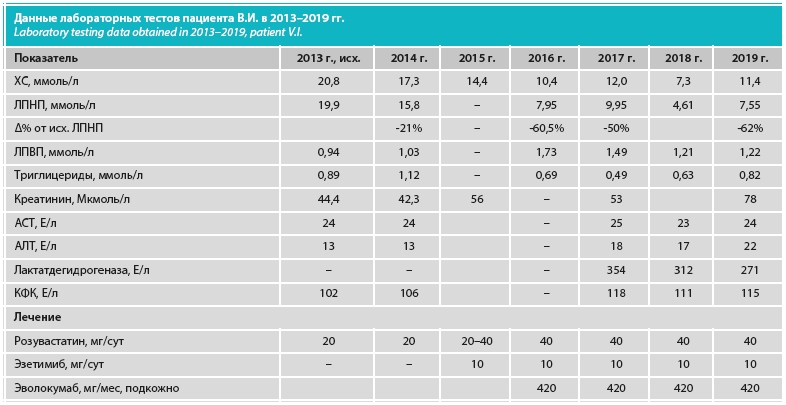
Лечение в течение последних 6 лет. В 2013 г. больному даны рекомендации по соблюдению строгой гиполипидемической диеты, дозированным физическим нагрузкам, назначена агрессивная липидснижающая по жизненным показаниям терапия. При лечении больного В.И. была использована стандартная для таких случаев терапевтическая тактика – гиполипидемическая терапия возрастающими дозами розувастатина (20–40 мг/сут). К маю 2013 г. на дозировке розувастатина 20 мг/сут удалось снизить уровень общего ХС с 20 до 13,7 ммоль/л, ХС-ЛПНП – с 14 до 12,34 ммоль/л. Активность ферментов печени и КФК на фоне монотерапии розувастатином – в пределах нормы. В мае 2013 г. на втором консилиуме пациенту к лечению решено добавить эзетимиб 10 мг/сут. Вместе с тем фактически пациент начал принимать комбинированную терапию (розувастатин 40 мг/сут + эзетимиб) с осени 2015 г. В марте 2016 г. к комбинированной терапии розувастатином (40 мг/сут) и эзетимибом (10 мг/сут) добавлена терапия эволокумабом (420 мг/мес), которая продолжается по настоящее время (см. таблицу). В выписке из истории болезни НИКИ педиатрии (2019 г.) по липидснижающей терапии был назначен эналаприл 2,5 мг 2 раза в день утром и вечером длительно, под контролем АД. На фоне тройной комбинированной терапии достигнуто снижение уровня общего ХС до 11,4 ммоль/л, ХС-ЛПНП – до 7,5 ммоль/л. Снижение уровня ХС-ЛПНП от исходного уровня составило в 2019 г. 62% (см. таблицу). Однако в 2017 г., 2018 г. были перерывы (максимально 3–4 мес) в лечении эволокумабом по немедицинским причинам.
В 2020 г. пациент продолжает комбинированное лечение 3 группами гиполипидемических препаратов, это лечение как по лабораторным показателям (АСТ, АЛТ, КФК, глюкоза, креатинин), так и субъективно переносится хорошо.
 ГомоСГХС является прогностически наиболее злокачественной формой наследственной дислипидемии (очень высокого уровня ХС и высочайшего риска сердечно-сосудистых осложнений) [10–14]. Исторически СГХС описана как аутосомно-доминантное жизнеугрожающее заболевание, в основе которого лежит мутация гена ЛПНП-рецептора, ведущая к гипокатаболизму ЛПНП и развитию преждевременного атеросклероза [9]. Первоначально считалось, что частота этого заболевания 1:1 000 000 в большинстве популяций, однако последние данные говорят о том, что это тяжелое заболевание встречается намного чаще (1:160 000) [15]. В патогенезе развития осложнений при ГомоСГХС играет роль не только сниженный катаболизм ЛПНП, а также и гиперсекреция аполипопротеина В-100, гипокатаболизм ремнатных частиц, а также образование дисфункциональных ЛПВП [10, 11]. Прогноз у этой тяжелой категории больных определяется своевременной диагностикой и, соответственно, интенсивной липидснижающей терапией с раннего детского возраста. Среди специалистов считается общепризнанным, что основной риск ранней смерти у этих пациентов связан не с коронарным атеросклерозом, а с быстрым прогрессированием аортального стеноза и надклапанного поражения аорты [11]. Диагноз «гомозиготная форма ГХС» можно поставить достаточно легко с учетом очень высокого уровня ХС-ЛПНП (больше 10–13 ммоль/л) и ярких патогномоничных клинических признаков (массивный эруптивный ксантоматоз) [12]. Кроме того, как правило, у таких пациентов родители уже имеют клинические и лабораторные признаки гетерозиготной ГХС.
ГомоСГХС является прогностически наиболее злокачественной формой наследственной дислипидемии (очень высокого уровня ХС и высочайшего риска сердечно-сосудистых осложнений) [10–14]. Исторически СГХС описана как аутосомно-доминантное жизнеугрожающее заболевание, в основе которого лежит мутация гена ЛПНП-рецептора, ведущая к гипокатаболизму ЛПНП и развитию преждевременного атеросклероза [9]. Первоначально считалось, что частота этого заболевания 1:1 000 000 в большинстве популяций, однако последние данные говорят о том, что это тяжелое заболевание встречается намного чаще (1:160 000) [15]. В патогенезе развития осложнений при ГомоСГХС играет роль не только сниженный катаболизм ЛПНП, а также и гиперсекреция аполипопротеина В-100, гипокатаболизм ремнатных частиц, а также образование дисфункциональных ЛПВП [10, 11]. Прогноз у этой тяжелой категории больных определяется своевременной диагностикой и, соответственно, интенсивной липидснижающей терапией с раннего детского возраста. Среди специалистов считается общепризнанным, что основной риск ранней смерти у этих пациентов связан не с коронарным атеросклерозом, а с быстрым прогрессированием аортального стеноза и надклапанного поражения аорты [11]. Диагноз «гомозиготная форма ГХС» можно поставить достаточно легко с учетом очень высокого уровня ХС-ЛПНП (больше 10–13 ммоль/л) и ярких патогномоничных клинических признаков (массивный эруптивный ксантоматоз) [12]. Кроме того, как правило, у таких пациентов родители уже имеют клинические и лабораторные признаки гетерозиготной ГХС.
Согласно международным критериям [11–13], диагноз «гомозиготная форма ГХС» пациенту В.И. мог быть поставлен без ДНК-диагностики, в соответствии с наличием массивного кожного ксантоматоза в возрасте до 10 лет и очень высокого уровня ХС-ЛПНП до лечения (19,9 ммоль/л). При обследовании в январе 2013 г., помимо этих данных, обнаружено наличие атеросклероза в аорте, аортальном клапане и в сонных артериях, что подтверждает диагноз тяжелой ГХС у этого больного.
Истинная (классическая) ГомоСГХС бывает при наличии одной и той же мутации в двух аллелях гена ЛПНП-рецептора, однако помимо классической ГомоСГХС в классификации этого заболевания описывают «двойную гетерозиготную» и «комбинированную гетерозиготную» формы соответственно [10–14]. В первом случае у пациента в двух генах (например, ЛПНП-рецептора и аполипопротеина В-100), во втором – разные мутации в каждой аллели гена ЛПНП-рецептора. С учетом того, что у родной сестры пациента и его родного отца уровень ХС нормальный, сложно говорить о конкретной генетической природе ГомоГХС у этого пациента.
Естественное течение атеросклероза у пациента В.И. протекало до начала лечения в январе 2013 г. К этому времени, помимо массивного кожного и сухожильного ксантоматоза, в сонных артериях сформировались стенозы с максимальным стенозированием до 50% и начал формироваться аортальный стеноз. У больного с типичной СГХС начальные проявления атеросклероза начинают формироваться еще в утробе матери [17]. Прогрессированию заболевания часто способствует повышение уровня липопротеида (а), уровень которого, к счастью, был нормальным у нашего пациента.
В научной литературе есть описание смерти мальчика с СГХС от инфаркта миокарда в 4 года по причине полной окклюзии коронарной артерии [18]. Во всех международных рекомендациях и консенсусах по СГХС указано о необходимости срочной интенсивной и пожизненной терапии, нацеленной на максимальное снижение уровня ХС-ЛПНП у таких больных [2, 4, 5, 7, 10, 12, 13]. В комбинированной терапии больных с ГомоСГХС применяют высокие дозы статинов, комбинацию – статины с ингибитором абсорбции ХС в кишечнике (эзетимиб), а ингибиторы PCSK9 (эволокумаб) – в дополнение к терапии статины + эзетимиб. После постановки диагноза назначены начальные дозы розувастатина с рекомендациями к повышению дозы статина до максимальной (40 мг/сут) и переходом на комбинированную липидснижающую терапию (эзетимиб 10 мг/сут и ингибитор PCSK9 эволокумаб 420 мг/мес).
К концу мая 2016 г. максимальная липидснижающая терапия позволила создать и поддерживать уровень ХС-ЛПНП на 58% ниже исходных значений. Присоединение к терапии эволокумаба имело целью максимально усилить катаболизм ХС-ЛПНП, полученный на фоне комбинации розувастатина 40 мг/сут и эзетимиба 10 мг/сут (-61%), однако существенного эффекта в дальнейшем снижении ХС-ЛПНП получено не было.
Врачами и исследователями из ЮАР в рамках исследования TESLA проведен анализ гиполипидемического ответа на эволокумаб в зависимости от типа мутаций.
У 20 больных с ГомоГХС, которые имели рецептор-дефективные мутации в обоих аллелях (т.е. имевшие резидуальную активность ЛПНП-рецепторов), дальнейшее снижение уровня ХС-ЛПНП было достоверным и составило 29,6%. У одного пациента с аутосомно-рецессивной ГомоГХС и второго больного с рецептор-негативной мутацией в обоих аллелях ЛПНП-рецептора ответа на терапию эволокумабом получено не было, более того, уровень ХС-ЛПНП слегка повысился на 3–10% [17]. Таким образом, принимая решение о назначении ингибиторов PCSK9 больным с ГомоГХС, важно учитывать характер мутации ЛПНП-рецептора.
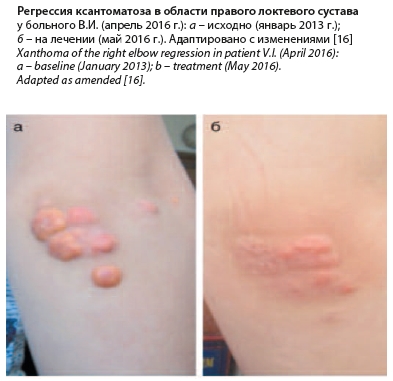
Тактически добавление ингибитора PCSK9 эволокумаба в марте 2016 г. привело к усилению и ускорению регрессии ксантоматоза, хотя и не сопровождалось дальнейшим снижением уровня ХС-ЛПНП. Своевременная диагностика таких редких случаев моногенных дислипидемий, как ГомоГХС, и адекватное лечение этого тяжелого заболевания позволят в значительной мере улучшить качество жизни и прогноз у этих больных. Данные обследования в НИКИ педиатрии в 2019 г. показали, что длительная комбинированная терапия гиполипидемическими препаратами позволяет поддерживать уровень ХС-ЛПНП на уровне -50–60% от исходных значений. Это позволило добиться полной регрессии ксантоматоза и (по совокупности клинических и инструментальных данных, см. таблицу и рисунок) замедлить течение коронарного и экстракоронарного атеросклероза. Со слов пациента, в 2020 г. его физическая активность включает игру в футбол 3–4 раза в неделю в умеренном темпе продолжительностью до 1 ч. На сегодняшний день пациент В.И. получает максимальную гиполипидемическую терапию из возможной в России (за исключением процедур ЛПНП-афереза). Лечебная стратегия у больных с ГомоСГХС основана на пожизненном максимальном снижении уровня ХС-ЛПНП (≥50% от исходного уровня) и включает комбинированную терапию статинами, эзетимибом, ионнообменными смолами и препаратами новых классов (ломитапид, мипомерсен, ингибиторы PCSK9), а также применение ЛПНП-афереза [12–14]. За рубежом есть длительный опыт лечения таких пациентов препаратом ломитапид (регистр LOWER) [10]. В этом году появилась обновленная информация по длительному опыту (2 года) лечения больных с ГомоСГХС препаратом мипомерсен [19] и длительным ЛПНП-аферезом [20].
В исследование TAUSSIG (проводилось в 35 исследовательских центрах в 17 странах) были включены пациенты с ГомоСГХС старше 12 лет на стабильной липидснижающей терапии за последние 4 нед [21]. Все пациенты получали эволокумаб 420 мг ежемесячно с процедурой ЛПНП-афереза или без, которые проводились 1 раз в 2 нед. Первичная конечная точка исследования TAUSSIG – переносимость лечения эволокумабом (побочные эффекты), вторичная точка – снижение липидов в основной и контрольной группах. По результатам этой работы 106 пациентов включены в конечный анализ, средний период наблюдения составил 1,7 года. Через 12 нед от начала исследования средний уровень ХС-ЛПНП снизился на 20,6%, такой же эффект от применения эволокумаба сохранился к 48 нед. Снижение уровня липопротеида (а), важного дополнительного фактора риска для больных с наследственной дислипидемией, к 12 нед составил -7,7%, к 48 нед эффект несколько усилился (-11,9%). В группе лечения эволокумабом отмечено достоверное повышение уровня хорошего ХС – ХС-ЛПВП на 7,6%. Эволокумаб – единственный ингибитор PCSK9, который имеет зарегистрированное показание «Гомозиготная семейная гиперхолестеринемия». Эволокумаб показан взрослым и подросткам старше 12 лет в комбинации с другой гиполипидемической терапией. Основанием для регистрации показания стали результаты исследования TAUSSIG [17]. Способ применения и дозы при ГомоСГХС: если в комбинации с аферезом, то 420 мг (3 шприца) каждые 2 нед; если без афереза, то стартовая доза 420 мг (3 шприца) 1 раз в месяц, затем через 3 мес при недостижении значимого ответа – частота может быть увеличена до 420 мг каждые 2 нед. Результаты этого важного исследования послужат основанием для широкого применения интенсивной терапии не только у тяжелых больных с гомо- и гетерозиготными формами СГХС, но и у больных высокого сердечно-сосудистого риска.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах / Information about the authors
Сусеков Андрей Владимирович – д-р мед. наук., проф. каф. клинической фармакологии и терапии ФГБОУ ДПО РМАПО. E-mail: asus99@mail.ru; ORCID: https://orcid.org/0000-0003-3158-286X
Andrey V. Susekov – D. Sci. (Med.), Prof., Russian Medical Academy of Continuous Professional Education. E-mail: asus99@mail.ru; ORCID: https://orcid.org/0000-0003-3158-286X
Балахонова Татьяна Валентиновна – д-р мед. наук., проф. ФГБУ «НМИЦ кардиологии»; проф. каф. кардиологии, функциональной и ультразвуковой диагностики Института клинической медицины им. Н.В. Склифосовского ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: tvbdoc@gmail.com; ORCID: https://orcid.org/0000-0002-7273-6979
Tatyana V. Balakhonova – D. Sci. (Med.), Prof., National Medical Research Center for Cardiology; Sechenov First Moscow State Medical University (Sechenov University). E-mail: tvbdoc@gmail.com; ORCID: https://orcid.org/0000-0002-7273-6979
Соловьев Владислав Михайлович – детский врач-кардиолог, зав. отд-нием клин. и интервенционной аритмологии ОСП «НИКИ педиатрии им. акад. Ю.Е. Вельтищева» ФГБОУ ВО «РНИМУ им. Н.И. Пирогова». E-mail: vmsolovyev@pedklin.ru; ORCID: https://orcid.org/0000-0003-4608-0168
Vladislav M. Soloviev – pediatric cardiologist, Pirogov Russian National Research Medical University. E-mail: vmsolovyev@pedklin.ru;
ORCID: https://orcid.org/0000-0003-4608-0168
Исаева Юлия Сергеевна – детский врач-кардиолог детского кардиологического отд-ния ОСП «НИКИ педиатрии им. акад.
Ю.Е. Вельтищева» ФГБОУ ВО «РНИМУ им. Н.И. Пирогова». E-mail: isaeva@pedklin.ru
Yuliia S. Isaeva – pediatric cardiologist, Pirogov Russian National Research Medical University. E-mail: isaeva@pedklin.ru
Миклашевич Ирина Михайловна – канд. мед. наук, зав. детским кардиологическим отд-нием ОСП «НИКИ педиатрии им. акад. Ю.Е. Вельтищева» ФГБОУ ВО «РНИМУ им. Н.И. Пирогова». E-mail: imiklashevich@pedklin.ru; ORCID: https://orcid.org/0000-0001-8635-6216
Irina M. Miklashevich – Cand. Sci. (Med.), Pirogov Russian National Research Medical University. E-mail: imiklashevich@pedklin.ru;
ORCID: https://orcid.org/0000-0001-8635-6216
Леонтьева Ирина Викторовна – д-р мед. наук, проф., глав. науч. сотр. отд. детская кардиология и аритмология ОСП «НИКИ педиатрии им. акад. Ю.Е. Вельтищева» ФГБОУ ВО «РНИМУ им. Н.И. Пирогова». ORCID: https://orcid.org/0000-0002-5273-6859
Irina V. Leontieva – D. Sci. (Med.), Prof., Pirogov Russian National Research Medical University. ORCID: https://orcid.org/0000-0002-5273-6859
Статья поступила в редакцию / The article received: 24.06.2020
Статья принята к печати / The article approved for publication: 06.07.2020
Клинический разбор в общей медицине №01 2020
Пациент с гомозиготной семейной гиперхолестеринемией: трудное лечение. Клинический случай
Номера страниц в выпуске:35-41
Аннотация
Гомозиготная семейная гиперхолестеринемия – тяжелое наследственное заболевание, характеризующееся очень высокими уровнями общего холестерина, холестерина липопротеидов низкой плотности (ХС-ЛПНП) и быстрой прогрессией атеросклероза в различных сосудистых бассейнах. При объективном осмотре у таких пациентов нередко можно обнаружить массивный ксантоматоз ахилловых сухожилий, ксантомы разгибательных поверхностей рук, коленных суставов и т.д. Встречаемость этой тяжелой патологии наследственной гиперлипидемии во многих популяциях – примерно 1:1 000 000, но с ростом частоты семейной гетерозиготной формы эта цифра с каждым годом снижается и больных становится больше. В нашей статье мы приводим клинический случай пациента В.И., 16 лет, у которого диагноз «гомозиготная семейная гиперхолестеринемия» поставлен в 12 лет, при ДНК-диагностике были выявлены патогенные мутации в гене ЛПНП-рецептора, подтвердившие первоначальный диагноз. В статье приводятся результаты лечения этого больного тройной комбинированной гиполипидемической терапией розувастатином (40 мг/сут), эзетимибом (10 мг/сут) и эволокумабом (420 мг/мес) в течение последних 3 лет. На фоне такой терапии уровень общего холестерина снизился с 20,8 ммоль/л (исходно) до 7,3–12,00 ммоль/л, уровень ХС-ЛПНП – с 19,9 ммоль/л до 4,6–9,9 ммоль/л, лечение переносится хорошо. За этот период наблюдения удалость добиться быстрой регрессии ксантоматоза в области ягодиц, коленных и локтевых суставов и ахилловых сухожилий. Серия исходных инструментальных тестов (2013 г.) показала наличие выраженного атеросклероза в сонных артериях (максимальное стенозирование до 50%), начальные признаки стеноза устья аорты. При повторном стационарном обследовании (2019 г.) отмечено замедление прогрессирования атеросклероза в сонных артериях и аорте, однако появление артериальной гипертонии требует дополнительного назначения низких доз эналаприла. Нагрузочные тесты и холтеровское мониторирование электрокардиограммы пока не выявили ишемии миокарда. Таким образом, своевременная диагностика и многолетняя трехкомпонентная интенсивная гиполипидемическая терапия позволяют замедлить прогрессирование атеросклероза у этой редкой и тяжелой категории пациентов.
Ключевые слова: гомозиготная гиперхолестеринемия, наследственная гиперхолестеринемия, холестерин липопротеидов низкой плотности, розувастатин, эзетимиб, эволокумаб, комбинированная терапия, замедление прогрессии атеросклероза.
Для цитирования: Сусеков А.В., Балахонова Т.В., Соловьев В.М. и др. Пациент с гомозиготной семейной гиперхолестеринемией: трудное лечение. Клинический разбор в общей медицине. 2020; 1: 35–41. DOI: 10.47407/kr2020.1.1.00006
Гомозиготная семейная гиперхолестеринемия – тяжелое наследственное заболевание, характеризующееся очень высокими уровнями общего холестерина, холестерина липопротеидов низкой плотности (ХС-ЛПНП) и быстрой прогрессией атеросклероза в различных сосудистых бассейнах. При объективном осмотре у таких пациентов нередко можно обнаружить массивный ксантоматоз ахилловых сухожилий, ксантомы разгибательных поверхностей рук, коленных суставов и т.д. Встречаемость этой тяжелой патологии наследственной гиперлипидемии во многих популяциях – примерно 1:1 000 000, но с ростом частоты семейной гетерозиготной формы эта цифра с каждым годом снижается и больных становится больше. В нашей статье мы приводим клинический случай пациента В.И., 16 лет, у которого диагноз «гомозиготная семейная гиперхолестеринемия» поставлен в 12 лет, при ДНК-диагностике были выявлены патогенные мутации в гене ЛПНП-рецептора, подтвердившие первоначальный диагноз. В статье приводятся результаты лечения этого больного тройной комбинированной гиполипидемической терапией розувастатином (40 мг/сут), эзетимибом (10 мг/сут) и эволокумабом (420 мг/мес) в течение последних 3 лет. На фоне такой терапии уровень общего холестерина снизился с 20,8 ммоль/л (исходно) до 7,3–12,00 ммоль/л, уровень ХС-ЛПНП – с 19,9 ммоль/л до 4,6–9,9 ммоль/л, лечение переносится хорошо. За этот период наблюдения удалость добиться быстрой регрессии ксантоматоза в области ягодиц, коленных и локтевых суставов и ахилловых сухожилий. Серия исходных инструментальных тестов (2013 г.) показала наличие выраженного атеросклероза в сонных артериях (максимальное стенозирование до 50%), начальные признаки стеноза устья аорты. При повторном стационарном обследовании (2019 г.) отмечено замедление прогрессирования атеросклероза в сонных артериях и аорте, однако появление артериальной гипертонии требует дополнительного назначения низких доз эналаприла. Нагрузочные тесты и холтеровское мониторирование электрокардиограммы пока не выявили ишемии миокарда. Таким образом, своевременная диагностика и многолетняя трехкомпонентная интенсивная гиполипидемическая терапия позволяют замедлить прогрессирование атеросклероза у этой редкой и тяжелой категории пациентов.
Ключевые слова: гомозиготная гиперхолестеринемия, наследственная гиперхолестеринемия, холестерин липопротеидов низкой плотности, розувастатин, эзетимиб, эволокумаб, комбинированная терапия, замедление прогрессии атеросклероза.
Для цитирования: Сусеков А.В., Балахонова Т.В., Соловьев В.М. и др. Пациент с гомозиготной семейной гиперхолестеринемией: трудное лечение. Клинический разбор в общей медицине. 2020; 1: 35–41. DOI: 10.47407/kr2020.1.1.00006
Patient with homozygous familial hypercholesterolemia: difficult to treat. Case report
Andrey V. Susekov1, Tatyana V. Balakhonova2,3, Vladislav M. Soloviev4, Yuliia S. Isaeva4, Irina M. Miklashevich4, Irina V. Leontieva41Russian Medical Academy of Continuous Professional Education, Moscow, Russia;
2National Medical Research Center for Cardiology, Moscow, Russia;
3Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russia;
4Pirogov Russian National Research Medical University, Moscow, Russia asus99@mail.ru
Abstract
Homozygous familial hypercholesterolemia is a severe genetic disorder characterized by extremely high levels of total cholesterol and low-density lipoprotein cholesterol (LDL-C), as well as by rapid atherosclerosis progression in various vascular territories. Objective examination of the affected patients often reveals multiple Achilles tendon xanthomas, xanthomas on the extensor surface of arms, knee joints, etc. The prevalence of such severe inherited hyperlipidemia in many populations is about 1 : 1 000 000, however, the family heterozygous type frequency increase leads to the decrease of this value and to the increase in the affected people number. The paper introduces case report for the patient V.I. aged 16 who was diagnosed with homozygous familial hypercholesterolemia at the age of 12. DNA testing revealed pathogenic mutations in the LDL receptor gene which confirmed the diagnosis. The paper reports the results of the discussed patient treatment using triple-drug combination lipid-lowering therapy with rosuvastatin (40 mg/day), ezetimibe (10 mg/day) and evolocumab (420 mg/day) in the last two years. The total cholesterol level decreased from 20.8 mmol/L (baseline) to 7.3–12.00 mmol/L, and the LDL-C level decreased from 19.9 mmol/L to 4.6–9.9 mmol/L due to therapy, the treatment was well tolerated. During the observation period, a rapid regression of xanthomas on the buttocks, knee and elbow joints, and Achilles tendon was achieved. A series of baseline instrumental tests (2013) revealed severe atherosclerosis of carotid arteries (maximum stenosis up to 50%), and first symptoms of aortic valve stenosis. Another examination in the hospital (2019) revealed slowing the progression of atherosclerosis in the carotid arteries and aorta, however, the arterial hypertension onset required additional prescription of a low dose of enalapril. Exercise testing and Holter ECG monitoring has yet identified no myocardial ischemia. Thus, the timely diagnosis together with long-term triple-drug intensive lipid-lowering therapy make it possible to slow down the atherosclerosis progression in the discussed rare and severe category of patients.
Key words: homozygous hypercholesterolemia, familial hypercholesterolemia, low-density lipoprotein cholesterol, rosuvastatin, ezetimibe, evolocumab, combination therapy, slowing the atherosclerosis progression.
For citation: Susekov A.V., Balakhonova T.V., Soloviev V.M. et al. Patient with homozygous familial hypercholesterolemia: difficult to treat. Clinical review for general practice. 2020; 1: 35–41. DOI: 10.47407/kr2020.1.1.00006
Введение
Гиперхолестеринемия (ГХС) – основной модифицируемый фактор риска развития атеросклероза и его осложнений [1–4]. Долговременное снижение уровня холестерина липопротеидов низкой плотности (ХС-ЛПНП) – валидированная терапевтическая цель (с огромной доказательной базой исследований «интервенции» со статинами) [3–8]. Наиболее яркой клинической иллюстрацией патогенности выраженной ГХС и возможности замедления прогрессирования/регрессии атеросклероза при интенсивном снижении ХС-ЛПНП являются больные с наследственной ГХС [9, 10], что отражено в международных рекомендациях и консенсусах [11–14]. В основе наследственной ГХС лежат генетические дефекты ЛПНП-рецептора, сериновой пропротеин конвертазы субтилизин/кексинового типа (PCSK9), белка-адаптера протеина к ЛПНП-рецептору и аполипопротеина В-100 [9–13], эти нарушения приводят к раннему и злокачественному течению атеросклероза с момента рождения. Без лечения прогноз больных с гомо- и гетерозиготной семейной ГХС (СГХС) хуже, чем у пациентов со СПИДом, причины смерти – ранние инфаркты, инсульты, надклапанные стенозы аорты. Наиболее тяжелым вариантом СГХС является гомозиготная форма СГХС (ГомоСГХС) [12–14]. Постановка фенотипического диагноза у ребенка с ГомоСГХС, как правило, не вызывает сомнения и основывается на: 1) очень высоком уровне общего холестерина (ХС) плазмы крови (>13 ммоль/л); 2) выраженном сухожильном и кожном ксантоматозе; 3) отягощенном семейном анамнезе по ГХС и преждевременному развитию ишемической болезни сердца у родителей [4]. По данным литературы, встречаемость ГомоСГХС менее чем 1:1 000 000 в общей популяции, а гетерозиготной формы СГХС – 1:200–300 человек [12]. В этой статье мы продолжаем обсуждение результатов обследования и лечения пациента В.И. (16 лет), с подтвержденным диагнозом «гомозиготная семейная гиперхолестеринемия», опыт наблюдения – 6 лет (2013–2019 гг.). Авторы ранее уже сообщали о результатах обследования и лечения этого пациента с 2013 по 2016 г. [15], в этой публикации мы приводим результаты лечения этого больного на тройной комбинированной терапии (розувастатин, эзетимиб и эволокумаб) с 2016 по 2019 г.Данные исходного клинического обследования пациента В.И. в 2013 г.
Первичная консультация состоялась в январе 2013 г. в ФГБУ «НМИЦ кардиологии» Минздрава России [14]. Пациент был направлен на консультацию в НМИЦ кардиологии из НИИ педиатрии по поводу очень высокого уровня общего ХС (20 ммоль/л) и массивного ксантоматоза. Результаты по первичной консультации и совместного консилиума педиатров, кардиологов и липидологов пациента В.И. с ГомоСГХС опубликованы нами ранее [14]. Данные лабораторных анализов (исходно, без терапии):
в анализе крови от 25.01.2013: креатинин – 44,4 мкмоль/л; ХС – 20,84 ммоль/л; триглицериды – 0,89 ммоль/л;
ХС липопротеидов высокой плотности (ХС-ЛПВП) – 0,94 ммоль/л; ХС-ЛПНП – 19,9 ммоль/л; аланинаминотрансфераза (АЛТ) – 13 Ед/л; аспартатаминотрансфераза (АСТ) – 24 Ед/л; щелочная фосфатаза (ЩФ) – 587 Ед/л; креатинфосфокиназа (КФК) – 102 Ед/л; γ-глутамилтранс-фераза – 16 Ед/л; аполипопротеин А1 – 86 мк/дл; аполипопротеин В >300 мг/дл; липопротеинлипаза <4,0 Ед/л; липопротеид (а) – 4,4 мг/дл.
Весной 2013 г. у пациента был взят анализ крови для ДНК-диагностики в лаборатории молекулярной генетики ФГБУ «ГНИЦ ПМ» Минздрава России (зав. лабораторией канд. мед. наук А.Н. Мешков). У пациента проводилось секвенирование всей кодирующей последовательности генома (экзом). Секвенирование экзома проводилось с помощью метода циклического лигазного секвенирования по технологии SOLiDTM (Applied Biosystems) на секвенаторе SOLID 5500 xl, с предварительным выделением фрагментов ДНК, содержащих экзомы, из генома пациента с помощью TargetSeqTM Exome Enrichment Kit (Applied Biosystems). Мутаций, ответственных за развитие ГХС, в генах ABCG5, ABCG8, CYP7A1, LDLRAP1, PCSK9 и APOB не выявлено. Выявлены две мутации в гене ЛПНП-рецептора (LDLR) – C68F и C270X. Мутация C270X была описана другими исследователями у больных СГХС, в том числе и в России. Наличие этой мутации приводит к прерыванию трансляции ЛПНП-рецептора. Мутация C68F приводит к замене аминокислоты Cys на Phe и ранее не была описана у больных СГХС, однако ранее описана замена аминокислоты Cys в положении 68 на стоп-кодон, что косвенно подтверждает патогенность данной мутации.
Данные исходных инструментальных тестов (2013 г.)
Дуплексное сканирование экстракраниального отдела брахиоцефальных артерий от 25.01.2013 (профессор Т.В. Балахонова): множественные стенозы общих наружных и внутренних сонных артерий (ВСА) справа и слева с максимальным стенозированием до 45–50% в бифуркации правой общей сонной артерии (ОСА) и проксимальной трети правой ВСА до 45%. Стеноз 35% в устье правой позвоночной артерии.По результатам эхокардиографии (ЭхоКГ) от 25.01.2013 (исследование проводила профессор М.А. Саидова): уплотнение стенок аорты, створок аортального клапана с формированием начальных признаков стеноза устья аорты и регургитации аортального клапана I–II степени. Полости сердца не расширены, стенки не утолщены. Сократительная функция левого желудочка удовлетворительная. Клапанный аппарат интактен. Признаков легочной гипертензии нет. Данных, подтверждающих врожденный порок сердца, не получено. Тредмил-тест (май 2013 г.): на фоне выполненной субмаксимальной нагрузки ишемических изменений не зарегистрировано. Проба отрицательная. Толерантность к физической нагрузке средняя (7,7 METS).
Основные результаты стационарного обследования в НИКИ педиатрии в 2019 г. и результаты динамического наблюдения за последние 6 лет
К моменту настоящей публикации, подтвержденные клинические диагнозы (выписка из НИКИ педиатрии от 4 октября 2019 г.) у пациента В.И. следующие:Основной диагноз: Е 7.8 – СГХС, II A типа, гомозиготная форма, множественный ксантоматоз; 135.2 – приобретенный порок сердца: надклапанный стеноз аорты с недостаточностью аортальнго клапана. Осложнения основного заболевания: хроническая сердечная недостаточность – функциональный класс II по Ross. Сопутствующие заболевания: 49.8 – дисфункция синусового узла; 170.8 – атеросклероз других артерий; 125.3 – аневризма межпредсердной перегородки; Н52.0 – гиперметропия слабой степени, ангиопатия сетчатки по гипертоническому типу.
По состоянию на сентябрь 2019 г. пациент жалоб не предъявлял. Периодические жалобы на утомляемость, слабость при физической нагрузке, эпизоды повышения артериального давления (АД) до 150/90 мм рт. ст.
Причины регулярных ежегодных госпитализаций в НИКИ педиатрии им. акад. Ю.Е. Вельтищева (2014–2019 гг.) – тяжесть основного заболевания (ГомоСГХС) и необходимость проведения комплекса лабораторных и инструментальных тестов, направленных на диагностику осложнений основного заболевания, а также поиск возможных осложнений (атеросклеротические бляшки, стеноз устья аорты, поражение клапанного аппарата сердца) из-за прогрессирования атеросклероза.
В публикации 2016 г. [16], по данным стационарного обследования, отмечено, что обнаружено уплотнение корня аорты, краевое уплотнение створок аортального клапана с недостаточностью 2–2,5+, надклапанный стеноз аорты с PG 20–25Hg, а также аневризма межпредсердной перегородки. При обследовании в 2016 г., по данным суточного мониторирования АД (СМАД), артериальной гипертонии найдено не было. Весной 2016 г. в результате решения консилиума к комбинированной терапии розувастатином (40 мг/сут) и эзетимибом (10 мг/сут) было решено добавить ингибитор проконвертазы PCSK9 эволокумаб (Репата) 420 мг 1 раз в месяц [16]. Результаты других лабораторных анализов в пределах нормы. В общем анализе крови: гемоглобин – 144 г/л, эритроциты – 4,94×1012/л, лейкоциты – 6,4×109/л, тромбоциты – 264×109/л. Остальные показатели – в пределах нормы.
По данным ЭхоКГ (23.09.2019): умеренная брадикардия с частотой сердечных сокращений (ЧСС) 64–72 уд/мин, PQ – 130 мс, QRS – 90 мс, QT – 360 мс, признаки перегрузки левого предсердия (p-mitrale). Гипертрофия миокарда левого желудочка. Нарушение процессов реполяризации в виде сглаженности зубца Т в I, III, avF, aVL. После физической нагрузки: выраженная синусовая тахикардия с ЧСС 120–130 уд/мин, QRS – 80 мс, PQ – 120 мс, QTc – 480 мс, дальнейшее усугубление процессов реполяризации, в остальном – без особенностей.
ЭхоКГ (23.09.2019): синусовый ритм, ЧСС – 54 уд/мин. Локальное утолщение стенок аорты со стенозированием просвета до 12 мм. Дилатация левого предсердия. М-режим – 26 мм. Левый желудочек – концентрическая гипертрофия. Пролабирование межпредсердной перегородки в полость правого предсердия на 8 мм. Систолическая функция левого желудочка в норме. Признаки умеренного надклапанного стеноза аортального клапана. Трикуспидальная регургитация 1,5+. Перикард – без особенностей.
Холтеровское мониторирование электрокардиограммы (27.09.2019): ЧСС средняя – 78 уд/мин, ЧСС максимальная – 127 уд/мин, ЧСС ночная – 55 уд/мин, ЧСС дневная – 78 уд/мин. В ночное время – умеренная тахикардия. Транзиторная косовосходящая депрессия ST-сегмента на фоне синусовой тахикардии в отведениях II, III, AVF максимально до 1,55 мм в III отведении. Неполная блокада правой ножки пучка Гиса.
Тредмил-тест (27.09.2019): АД исходное – 122/60 мм рт. ст. Нарушение ритма сердца и проводимости не проводилось. Усиление синусовой тахикардии – до ЧСС 169 уд/мин. Депрессия ST-сегмента >1 мм, V3–V6 косовосходящая, диагностически незначимая. Жалоб не предъявлял. Толерантность к физической нагрузке высокая (10.70 METS). Нарушений ритма не отмечалось.
СМАД на фоне гипотензивной терапии (эналаприл 5 мг/сут). Признаков артериальной гипертонии не выявлено. Средние показатели АД – 104/60 мм рт. ст. в дневное время и 102/53 мм рт. ст. – в ночное время. Максимальный подъем АД до 130 мм рт. ст. в 09:51 при ЧСС 58 уд/мин.
Дуплексное сканирование экстракраниальных отделов брахиоцефальных сосудов (26.09.2019): стеноз ОСА (ОСА слева 35–40%, в устье ВСА пролонгированная полуконцентрическая атеросклеротическая бляшка 35–40%, в области бифуркации ОСА справа – бляшка 30%, в области бифуркации с переходом во ВСА – бляшка до 60% в проксимальном отделе).
Лечение в течение последних 6 лет. В 2013 г. больному даны рекомендации по соблюдению строгой гиполипидемической диеты, дозированным физическим нагрузкам, назначена агрессивная липидснижающая по жизненным показаниям терапия. При лечении больного В.И. была использована стандартная для таких случаев терапевтическая тактика – гиполипидемическая терапия возрастающими дозами розувастатина (20–40 мг/сут). К маю 2013 г. на дозировке розувастатина 20 мг/сут удалось снизить уровень общего ХС с 20 до 13,7 ммоль/л, ХС-ЛПНП – с 14 до 12,34 ммоль/л. Активность ферментов печени и КФК на фоне монотерапии розувастатином – в пределах нормы. В мае 2013 г. на втором консилиуме пациенту к лечению решено добавить эзетимиб 10 мг/сут. Вместе с тем фактически пациент начал принимать комбинированную терапию (розувастатин 40 мг/сут + эзетимиб) с осени 2015 г. В марте 2016 г. к комбинированной терапии розувастатином (40 мг/сут) и эзетимибом (10 мг/сут) добавлена терапия эволокумабом (420 мг/мес), которая продолжается по настоящее время (см. таблицу). В выписке из истории болезни НИКИ педиатрии (2019 г.) по липидснижающей терапии был назначен эналаприл 2,5 мг 2 раза в день утром и вечером длительно, под контролем АД. На фоне тройной комбинированной терапии достигнуто снижение уровня общего ХС до 11,4 ммоль/л, ХС-ЛПНП – до 7,5 ммоль/л. Снижение уровня ХС-ЛПНП от исходного уровня составило в 2019 г. 62% (см. таблицу). Однако в 2017 г., 2018 г. были перерывы (максимально 3–4 мес) в лечении эволокумабом по немедицинским причинам.
В 2020 г. пациент продолжает комбинированное лечение 3 группами гиполипидемических препаратов, это лечение как по лабораторным показателям (АСТ, АЛТ, КФК, глюкоза, креатинин), так и субъективно переносится хорошо.

Дискуссия
 ГомоСГХС является прогностически наиболее злокачественной формой наследственной дислипидемии (очень высокого уровня ХС и высочайшего риска сердечно-сосудистых осложнений) [10–14]. Исторически СГХС описана как аутосомно-доминантное жизнеугрожающее заболевание, в основе которого лежит мутация гена ЛПНП-рецептора, ведущая к гипокатаболизму ЛПНП и развитию преждевременного атеросклероза [9]. Первоначально считалось, что частота этого заболевания 1:1 000 000 в большинстве популяций, однако последние данные говорят о том, что это тяжелое заболевание встречается намного чаще (1:160 000) [15]. В патогенезе развития осложнений при ГомоСГХС играет роль не только сниженный катаболизм ЛПНП, а также и гиперсекреция аполипопротеина В-100, гипокатаболизм ремнатных частиц, а также образование дисфункциональных ЛПВП [10, 11]. Прогноз у этой тяжелой категории больных определяется своевременной диагностикой и, соответственно, интенсивной липидснижающей терапией с раннего детского возраста. Среди специалистов считается общепризнанным, что основной риск ранней смерти у этих пациентов связан не с коронарным атеросклерозом, а с быстрым прогрессированием аортального стеноза и надклапанного поражения аорты [11]. Диагноз «гомозиготная форма ГХС» можно поставить достаточно легко с учетом очень высокого уровня ХС-ЛПНП (больше 10–13 ммоль/л) и ярких патогномоничных клинических признаков (массивный эруптивный ксантоматоз) [12]. Кроме того, как правило, у таких пациентов родители уже имеют клинические и лабораторные признаки гетерозиготной ГХС.
ГомоСГХС является прогностически наиболее злокачественной формой наследственной дислипидемии (очень высокого уровня ХС и высочайшего риска сердечно-сосудистых осложнений) [10–14]. Исторически СГХС описана как аутосомно-доминантное жизнеугрожающее заболевание, в основе которого лежит мутация гена ЛПНП-рецептора, ведущая к гипокатаболизму ЛПНП и развитию преждевременного атеросклероза [9]. Первоначально считалось, что частота этого заболевания 1:1 000 000 в большинстве популяций, однако последние данные говорят о том, что это тяжелое заболевание встречается намного чаще (1:160 000) [15]. В патогенезе развития осложнений при ГомоСГХС играет роль не только сниженный катаболизм ЛПНП, а также и гиперсекреция аполипопротеина В-100, гипокатаболизм ремнатных частиц, а также образование дисфункциональных ЛПВП [10, 11]. Прогноз у этой тяжелой категории больных определяется своевременной диагностикой и, соответственно, интенсивной липидснижающей терапией с раннего детского возраста. Среди специалистов считается общепризнанным, что основной риск ранней смерти у этих пациентов связан не с коронарным атеросклерозом, а с быстрым прогрессированием аортального стеноза и надклапанного поражения аорты [11]. Диагноз «гомозиготная форма ГХС» можно поставить достаточно легко с учетом очень высокого уровня ХС-ЛПНП (больше 10–13 ммоль/л) и ярких патогномоничных клинических признаков (массивный эруптивный ксантоматоз) [12]. Кроме того, как правило, у таких пациентов родители уже имеют клинические и лабораторные признаки гетерозиготной ГХС.Согласно международным критериям [11–13], диагноз «гомозиготная форма ГХС» пациенту В.И. мог быть поставлен без ДНК-диагностики, в соответствии с наличием массивного кожного ксантоматоза в возрасте до 10 лет и очень высокого уровня ХС-ЛПНП до лечения (19,9 ммоль/л). При обследовании в январе 2013 г., помимо этих данных, обнаружено наличие атеросклероза в аорте, аортальном клапане и в сонных артериях, что подтверждает диагноз тяжелой ГХС у этого больного.
Истинная (классическая) ГомоСГХС бывает при наличии одной и той же мутации в двух аллелях гена ЛПНП-рецептора, однако помимо классической ГомоСГХС в классификации этого заболевания описывают «двойную гетерозиготную» и «комбинированную гетерозиготную» формы соответственно [10–14]. В первом случае у пациента в двух генах (например, ЛПНП-рецептора и аполипопротеина В-100), во втором – разные мутации в каждой аллели гена ЛПНП-рецептора. С учетом того, что у родной сестры пациента и его родного отца уровень ХС нормальный, сложно говорить о конкретной генетической природе ГомоГХС у этого пациента.
Естественное течение атеросклероза у пациента В.И. протекало до начала лечения в январе 2013 г. К этому времени, помимо массивного кожного и сухожильного ксантоматоза, в сонных артериях сформировались стенозы с максимальным стенозированием до 50% и начал формироваться аортальный стеноз. У больного с типичной СГХС начальные проявления атеросклероза начинают формироваться еще в утробе матери [17]. Прогрессированию заболевания часто способствует повышение уровня липопротеида (а), уровень которого, к счастью, был нормальным у нашего пациента.
В научной литературе есть описание смерти мальчика с СГХС от инфаркта миокарда в 4 года по причине полной окклюзии коронарной артерии [18]. Во всех международных рекомендациях и консенсусах по СГХС указано о необходимости срочной интенсивной и пожизненной терапии, нацеленной на максимальное снижение уровня ХС-ЛПНП у таких больных [2, 4, 5, 7, 10, 12, 13]. В комбинированной терапии больных с ГомоСГХС применяют высокие дозы статинов, комбинацию – статины с ингибитором абсорбции ХС в кишечнике (эзетимиб), а ингибиторы PCSK9 (эволокумаб) – в дополнение к терапии статины + эзетимиб. После постановки диагноза назначены начальные дозы розувастатина с рекомендациями к повышению дозы статина до максимальной (40 мг/сут) и переходом на комбинированную липидснижающую терапию (эзетимиб 10 мг/сут и ингибитор PCSK9 эволокумаб 420 мг/мес).
К концу мая 2016 г. максимальная липидснижающая терапия позволила создать и поддерживать уровень ХС-ЛПНП на 58% ниже исходных значений. Присоединение к терапии эволокумаба имело целью максимально усилить катаболизм ХС-ЛПНП, полученный на фоне комбинации розувастатина 40 мг/сут и эзетимиба 10 мг/сут (-61%), однако существенного эффекта в дальнейшем снижении ХС-ЛПНП получено не было.
Врачами и исследователями из ЮАР в рамках исследования TESLA проведен анализ гиполипидемического ответа на эволокумаб в зависимости от типа мутаций.
У 20 больных с ГомоГХС, которые имели рецептор-дефективные мутации в обоих аллелях (т.е. имевшие резидуальную активность ЛПНП-рецепторов), дальнейшее снижение уровня ХС-ЛПНП было достоверным и составило 29,6%. У одного пациента с аутосомно-рецессивной ГомоГХС и второго больного с рецептор-негативной мутацией в обоих аллелях ЛПНП-рецептора ответа на терапию эволокумабом получено не было, более того, уровень ХС-ЛПНП слегка повысился на 3–10% [17]. Таким образом, принимая решение о назначении ингибиторов PCSK9 больным с ГомоГХС, важно учитывать характер мутации ЛПНП-рецептора.
Тактически добавление ингибитора PCSK9 эволокумаба в марте 2016 г. привело к усилению и ускорению регрессии ксантоматоза, хотя и не сопровождалось дальнейшим снижением уровня ХС-ЛПНП. Своевременная диагностика таких редких случаев моногенных дислипидемий, как ГомоГХС, и адекватное лечение этого тяжелого заболевания позволят в значительной мере улучшить качество жизни и прогноз у этих больных. Данные обследования в НИКИ педиатрии в 2019 г. показали, что длительная комбинированная терапия гиполипидемическими препаратами позволяет поддерживать уровень ХС-ЛПНП на уровне -50–60% от исходных значений. Это позволило добиться полной регрессии ксантоматоза и (по совокупности клинических и инструментальных данных, см. таблицу и рисунок) замедлить течение коронарного и экстракоронарного атеросклероза. Со слов пациента, в 2020 г. его физическая активность включает игру в футбол 3–4 раза в неделю в умеренном темпе продолжительностью до 1 ч. На сегодняшний день пациент В.И. получает максимальную гиполипидемическую терапию из возможной в России (за исключением процедур ЛПНП-афереза). Лечебная стратегия у больных с ГомоСГХС основана на пожизненном максимальном снижении уровня ХС-ЛПНП (≥50% от исходного уровня) и включает комбинированную терапию статинами, эзетимибом, ионнообменными смолами и препаратами новых классов (ломитапид, мипомерсен, ингибиторы PCSK9), а также применение ЛПНП-афереза [12–14]. За рубежом есть длительный опыт лечения таких пациентов препаратом ломитапид (регистр LOWER) [10]. В этом году появилась обновленная информация по длительному опыту (2 года) лечения больных с ГомоСГХС препаратом мипомерсен [19] и длительным ЛПНП-аферезом [20].
В исследование TAUSSIG (проводилось в 35 исследовательских центрах в 17 странах) были включены пациенты с ГомоСГХС старше 12 лет на стабильной липидснижающей терапии за последние 4 нед [21]. Все пациенты получали эволокумаб 420 мг ежемесячно с процедурой ЛПНП-афереза или без, которые проводились 1 раз в 2 нед. Первичная конечная точка исследования TAUSSIG – переносимость лечения эволокумабом (побочные эффекты), вторичная точка – снижение липидов в основной и контрольной группах. По результатам этой работы 106 пациентов включены в конечный анализ, средний период наблюдения составил 1,7 года. Через 12 нед от начала исследования средний уровень ХС-ЛПНП снизился на 20,6%, такой же эффект от применения эволокумаба сохранился к 48 нед. Снижение уровня липопротеида (а), важного дополнительного фактора риска для больных с наследственной дислипидемией, к 12 нед составил -7,7%, к 48 нед эффект несколько усилился (-11,9%). В группе лечения эволокумабом отмечено достоверное повышение уровня хорошего ХС – ХС-ЛПВП на 7,6%. Эволокумаб – единственный ингибитор PCSK9, который имеет зарегистрированное показание «Гомозиготная семейная гиперхолестеринемия». Эволокумаб показан взрослым и подросткам старше 12 лет в комбинации с другой гиполипидемической терапией. Основанием для регистрации показания стали результаты исследования TAUSSIG [17]. Способ применения и дозы при ГомоСГХС: если в комбинации с аферезом, то 420 мг (3 шприца) каждые 2 нед; если без афереза, то стартовая доза 420 мг (3 шприца) 1 раз в месяц, затем через 3 мес при недостижении значимого ответа – частота может быть увеличена до 420 мг каждые 2 нед. Результаты этого важного исследования послужат основанием для широкого применения интенсивной терапии не только у тяжелых больных с гомо- и гетерозиготными формами СГХС, но и у больных высокого сердечно-сосудистого риска.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах / Information about the authors
Сусеков Андрей Владимирович – д-р мед. наук., проф. каф. клинической фармакологии и терапии ФГБОУ ДПО РМАПО. E-mail: asus99@mail.ru; ORCID: https://orcid.org/0000-0003-3158-286X
Andrey V. Susekov – D. Sci. (Med.), Prof., Russian Medical Academy of Continuous Professional Education. E-mail: asus99@mail.ru; ORCID: https://orcid.org/0000-0003-3158-286X
Балахонова Татьяна Валентиновна – д-р мед. наук., проф. ФГБУ «НМИЦ кардиологии»; проф. каф. кардиологии, функциональной и ультразвуковой диагностики Института клинической медицины им. Н.В. Склифосовского ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: tvbdoc@gmail.com; ORCID: https://orcid.org/0000-0002-7273-6979
Tatyana V. Balakhonova – D. Sci. (Med.), Prof., National Medical Research Center for Cardiology; Sechenov First Moscow State Medical University (Sechenov University). E-mail: tvbdoc@gmail.com; ORCID: https://orcid.org/0000-0002-7273-6979
Соловьев Владислав Михайлович – детский врач-кардиолог, зав. отд-нием клин. и интервенционной аритмологии ОСП «НИКИ педиатрии им. акад. Ю.Е. Вельтищева» ФГБОУ ВО «РНИМУ им. Н.И. Пирогова». E-mail: vmsolovyev@pedklin.ru; ORCID: https://orcid.org/0000-0003-4608-0168
Vladislav M. Soloviev – pediatric cardiologist, Pirogov Russian National Research Medical University. E-mail: vmsolovyev@pedklin.ru;
ORCID: https://orcid.org/0000-0003-4608-0168
Исаева Юлия Сергеевна – детский врач-кардиолог детского кардиологического отд-ния ОСП «НИКИ педиатрии им. акад.
Ю.Е. Вельтищева» ФГБОУ ВО «РНИМУ им. Н.И. Пирогова». E-mail: isaeva@pedklin.ru
Yuliia S. Isaeva – pediatric cardiologist, Pirogov Russian National Research Medical University. E-mail: isaeva@pedklin.ru
Миклашевич Ирина Михайловна – канд. мед. наук, зав. детским кардиологическим отд-нием ОСП «НИКИ педиатрии им. акад. Ю.Е. Вельтищева» ФГБОУ ВО «РНИМУ им. Н.И. Пирогова». E-mail: imiklashevich@pedklin.ru; ORCID: https://orcid.org/0000-0001-8635-6216
Irina M. Miklashevich – Cand. Sci. (Med.), Pirogov Russian National Research Medical University. E-mail: imiklashevich@pedklin.ru;
ORCID: https://orcid.org/0000-0001-8635-6216
Леонтьева Ирина Викторовна – д-р мед. наук, проф., глав. науч. сотр. отд. детская кардиология и аритмология ОСП «НИКИ педиатрии им. акад. Ю.Е. Вельтищева» ФГБОУ ВО «РНИМУ им. Н.И. Пирогова». ORCID: https://orcid.org/0000-0002-5273-6859
Irina V. Leontieva – D. Sci. (Med.), Prof., Pirogov Russian National Research Medical University. ORCID: https://orcid.org/0000-0002-5273-6859
Статья поступила в редакцию / The article received: 24.06.2020
Статья принята к печати / The article approved for publication: 06.07.2020
Список исп. литературыСкрыть список1. Ference BA, Ginsberg HN, Graham I et al. Low density lipoprotein cause atherosclerotic cardiovascular disease. Evidence from genetic, epidemiologic and clinical studies. A Consensus Statement from the European Atherosclerosis Society Consensus Panel. Eur Heart J 2017; 1–14.
2. Borén J, Chapman MJ, Krauss RM et al. Low-density lipoproteins cause atherosclerotic cardiovascular disease: pathophysiological, genetic, and therapeutic insights: a consensus statement from the European Atherosclerosis Society Consensus Panel. Eur Heart J 2020. PII: ehz962. DOI: 10.1093/eurheartj/ehz962
3. Mach F, Baigent C, Catapano AL et al. 2019 ESC/EAS guidelines for the management of dyslipidaemias: Lipid modification to reduce cardiovascular risk. Atherosclerosis 2019; 290: 140–205. DOI: 10.1016/j.atherosclerosis.2019.08.014
4. Grundy SM, Stone NJ, Bailey C et al. A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Circulation 2019; 139 (25): e1082-e1143.
5. Heart Protection Study Collaborative Group. MRC/BHF Heart Protection Study of cholesterol lowering with simvastatin in 20,536 high-risk individuals: a randomised placebo-controlled trial. Lancet 2002; 360: 7–22.
6. Cholesterol Treatment Trialists (CTT) Collaborators Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170,000 participants in 26 randomised trials. Lancet 2010; 376: 1670–81.
7. Cholesterol Treatment Trialists (CTT) Collaborators The effects of lowering LDL cholesterol with statin therapy in people at low risk of vascular disease: meta-analysis of individual data from 27 randomised trials. Lancet 2012; 380: 581–90.
8. Cholesterol Treatment Trialists (CTT) Collaborators. Fulcher J.
O’Connel R, Voysey M. Efficacy and safety of LDL-lowering therapy among men and women: meta-analysis of individual data from 174,000 participants in 27 randomized trials. Lancet 2015; 385: 1397–405.
9. Goldstein JL, Brown MS. Familial hypercholesterolemia: identification of a defect in the regulation of 3-hydroxy-3-methylglutaryl coenzyme A reductase activity associated with overproduction of cholesterol. Proc Natl Acad Sci USA 1973; 70: 2804–8.
10. Rader D, Cohen J, Hobbs H. Monogenic hypercholesterolemia: new insights in pathogenesis and treatment. J Clin Investig 2003; 112 (11): 1795–1803.
11. Santos RD, Gidding SS, Hegele RA et al. International Atherosclerosis Society Severe Familial Hypercholesterolemia Panel. Defining Severe Familial Hypercholesterolaemia and the Implications for Clinical Management: A Consensus Statement From the International Atherosclerosis Society Severe Familial Hypercholesterolemia Panel. Lancet Diabetes Endocrinol 2016; 4 (10): 850–61. DOI: 10.1016/S2213-8587(16)30041-9
12. Cuchel M, Bruckert E, Ginsberg HM et al. Homozygous familial hypercholesterolaemia:new insights and guidance for clinicians to improve detection and clinical management. A position paper from the Consensus Panel on Familial Hypercholesterolaemia of the European Atherosclerosis Society. Eur Heart J 2014; 35 (32): 2146–57. DOI: 10.1093/eurheartj/ehu27
13. Wiegman A, Gidding SS, Watts GF et al. Familial hypercholesterolaemia in children and adolescents: gaining decades of life by optimizing detection and treatment. Eur Heart J 2015; 21; 36 (36): 2425–37. DOI: 10.1093/eurheartj/ehv157
14. Зафираки В.К., Космачева Е.Д., Захарова И.Н. и др. Гомозиготная семейная гиперхолестеринемия. Современные аспекты патогенеза, диагностики и терапии. Медицинский совет. 2018; 17: 253–9.
[Zafiraki V.К., Kosmacheva Е.D., Zakharova I.N. et al. Homozygous familial hypercholesterolemia: modern aspects of pathogenesis, diagnostics and treatment. Meditsinskiy sovet = Medical Council. 2018; (17): 253–60 (in Russian).]
15. Сусеков А.В., Лугинова З.Г., Мешков А.Н. и др. Консилиум
у 9-летнего мальчика с уровнем холестерина 20 ммоль/л: от постановки диагноза к эффективному лечению. Медицинский Совет. 2014; 12: 106–10.
[Susekov A.V., Luginova Z.G., Meshkov A.N. et al. Konsilium u 9-letnego mal'chika s urovnem kholesterina 20 mmol'/l: ot postanovki diagnoza k effektivnomu lecheniiu. Meditsinskii Sovet. 2014; 12: 106–10 (in Russian).]
16. Сусеков А.В., Яфарова А.А., Щербакова М.Ю., Мешков А.Н. Регресссия ксантоматоза у 12-летнего пациента с гомозиготной формой семейной гиперхолестеринемии: клинический случай. Consillum Medicum. Педиатрия (прил). 2016; 3: 103–18.
[Susekov A.V., Iafarova A.A., Shcherbakova M.Iu., Meshkov A.N. Regresssiia ksantomatoza u 12-letnego patsienta s gomozigotnoi formoi semeinoi giperkholesterinemii: klinicheskii sluchai. Consillum Medicum. Pediatriia (pril). 2016; 3: 103–18 (in Russian).]
17. Raal FJ, Honarpour N, Blom DJ et al. TESLA Investigators Inhibition of PCSK9 with evolocumab in homozygous familial ypercholesterolaemia (TESLA Part B): a randomised, double-blind, placebo-controlled trial. Lancet 2015; 385 (9965): 341–50. DOI: 10.1016/S0140-6736(14)61374-X
18. Blom DJ, Fayad ZA, Kastelein JJ et al. LOWER investigators. LOWER, a registry of lomitapide-treated patients with homozygous familial hypercholesterolemia: Rationale and design. J Clin Lipidol 2016; 10 (2): 273–82. DOI: 10.1016/j.jacl.2015.11.011
19. Santos RD, Duell PB, East C et al. Long-term efficacy and safety of mipomersen in patients with familial hypercholesterolaemia: 2-year interim results of an open-label extension. Eur Heart J 2015; 36 (9): 566–75. DOI: 10.1093/eurheartj/eht549
20. Stefanutti C, Thomson GR. Lipoprotein Apheresis in the Management of Familial Hypercholesterolaemia: Historical Perspective and Recent Advances. Curr Atheroscler Rep 2015; 17: 465. DOI 10.1007/s11883-014-0465-6
21. Raal FJ, Hoving GK, Blom D et al. Long-term Treatment With Evolocumab Added to Conventional Drug Therapy, With or Without Apheresis, in Patients With Homozygous Familial Hypercholesterolaemia: An Interim Subset Analysis of the Open-Label TAUSSIG Study. Lancet Diabetes Endocrinol 2017; 5 (4): 280–90.
10 октября 2020
Количество просмотров: 19570

