Клинический разбор в общей медицине №2 2022
Клинический разбор в общей медицине №2 2022
Патогенетические комплексы в лечении пациентов с респираторными вирусными инфекциями
Аннотация
По данным Всемирной организации здравоохранения, на долю острых респираторных вирусных инфекций (ОРВИ) приходится около 70–90% всех инфекционных заболеваний. Несмотря на относительно кратковременное течение, они несут значительный экономический ущерб из-за высокой обращаемости среди населения и временной утраты нетрудоспособности. Особенно с конца 2019 г., когда инфекция SARS-Cov-2 заняла приоритетное значение и внимание всего мирового медицинского сообщества. ОРВИ – разнородная группа инфекционных заболеваний органов дыхания, вызываемая огромным числом вирусов (их насчитывается более 200, среди них: вирус гриппа, парагриппа, респираторно-синцитиальный вирус, аденовирус, коронавирус и др.). Симптомы и патогенез заболевания во многом схожи (лихорадка, кашель, боль в грудной клетке, миалгии, астения, головные боли, аносмия и другие), но есть и различия. В статье подробно рассматриваются симптомы ОРВИ (в том числе COVID-19) и лекарственные средства, их компоненты, наиболее широко применяемые в эпидемический период, также приводится патогенетическое обоснование применения. В эпидемический период (в России он длится с октября по март–апрель) традиционно повышается спрос на различные лекарственные средства у населения. Поскольку ОРВИ относятся к группе заболеваний, по отношению к которым велика доля самоназначений лекарственных средств и случаев самолечения, то представляет интерес более подробное рассмотрение различных препаратов и компонентов препаратов с точки зрения патогенеза заболевания.
Ключевые слова: парацетамол, аскорбиновая кислота, фенилэфрин, COVID-19, острые респираторные заболевания.
Для цитирования: Попова Е.Н., Пономарева Л.А., Чинова А.А. Патогенетические комплексы в лечении пациентов с респираторными вирусными инфекциями. Клинический разбор в общей медицине. 2022; 2: 25–32. DOI: 10.47407/kr2022.3.2.00123
По данным Всемирной организации здравоохранения, на долю острых респираторных вирусных инфекций (ОРВИ) приходится около 70–90% всех инфекционных заболеваний. Несмотря на относительно кратковременное течение, они несут значительный экономический ущерб из-за высокой обращаемости среди населения и временной утраты нетрудоспособности. Особенно с конца 2019 г., когда инфекция SARS-Cov-2 заняла приоритетное значение и внимание всего мирового медицинского сообщества. ОРВИ – разнородная группа инфекционных заболеваний органов дыхания, вызываемая огромным числом вирусов (их насчитывается более 200, среди них: вирус гриппа, парагриппа, респираторно-синцитиальный вирус, аденовирус, коронавирус и др.). Симптомы и патогенез заболевания во многом схожи (лихорадка, кашель, боль в грудной клетке, миалгии, астения, головные боли, аносмия и другие), но есть и различия. В статье подробно рассматриваются симптомы ОРВИ (в том числе COVID-19) и лекарственные средства, их компоненты, наиболее широко применяемые в эпидемический период, также приводится патогенетическое обоснование применения. В эпидемический период (в России он длится с октября по март–апрель) традиционно повышается спрос на различные лекарственные средства у населения. Поскольку ОРВИ относятся к группе заболеваний, по отношению к которым велика доля самоназначений лекарственных средств и случаев самолечения, то представляет интерес более подробное рассмотрение различных препаратов и компонентов препаратов с точки зрения патогенеза заболевания.
Ключевые слова: парацетамол, аскорбиновая кислота, фенилэфрин, COVID-19, острые респираторные заболевания.
Для цитирования: Попова Е.Н., Пономарева Л.А., Чинова А.А. Патогенетические комплексы в лечении пациентов с респираторными вирусными инфекциями. Клинический разбор в общей медицине. 2022; 2: 25–32. DOI: 10.47407/kr2022.3.2.00123
Pathogenetic complexes in treatment of patients with viral respiratory infections
Elena N. Popova, Liubov A. Ponomareva, Alina A. Chinova
Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russia
ela12@yandex.ru
Abstract
According to WHO, the share of acute respiratory infections (ARVI) is about 70–90% of all infectious diseases. Despite their relatively short-term course, they suffer significant economic damage due to high turnover among the population and temporary disability. Especially since the end of 2019, when SARS-Cov-2 infection has taken priority and the attention of the entire global medical community. ARVI is a heterogeneous group of infectious diseases of the respiratory system caused by a huge number of viruses (there are more than 200 of them, among them: influenza virus, parainfluenza, respiratory syncytial virus, adenovirus, coronavirus and others). The symptoms and pathogenesis of the disease are similar in many ways (fever, cough, chest pain, myalgia, asthenia, headaches, anosmia and others), but there are also differences. The article discusses
in detail the symptoms of acute respiratory viral infections (including COVID-19) and medicines, their components, which are most widely used in the epidemic period, and also provides a pathogenetic justification for the use. During the epidemic period (in Russia it lasts from October to March-April), the demand for various medicines (drugs) among the population traditionally increases. Since ARVI belong to a group of diseases, in relation to which a large proportion of self-prescribing drugs and cases of self-medication, it is of interest to consider in more detail the various drugs and components of drugs from the point of view of the pathogenesis of the disease.
Key words: paracetamol, ascorbic acid, phenylephrine, COVID-19, acute respiratory infections.
For citation: Popova E.N., Ponomareva L.A., Chinova A.A. Pathogenetic complexes in treatment of patients with viral respiratory infections. Clinical review for general practice. 2022; 2: 25–32. DOI: 10.47407/kr2022.3.2.00123
Пандемия SARS-CoV-2 серьезно повлияла на клинические проявления острых респираторных вирусных инфекций (ОРВИ) в целом, приведя к резкому нарастанию числа пациентов с более выраженной интоксикацией, риносинусопатией, затяжным периодом восстановления. Сохраняющиеся после острого периода вирусной инфекции разнообразные симптомы, проявляющиеся астенией, неврологическими нарушениями, субфебрильной лихорадкой, респираторными и когнитивными расстройствами, в последнее время стали обозначать как постковидный синдром. Как в острую стадию заболевания, так и при наличии остаточных расстройств, связанных с СОVID-19, не исключается одновременное присутствие у больного различных, в том числе и непандемических, штаммов вирусов [1, 3].
Лечение респираторных заболеваний, вызванных как SARS-CoV-2, так и другими вирусными агентами, основано на контроле симптомов, обусловленных молекулярной активностью клеток воспаления, индуцированной вирусным материалом. Реакции вирусного повреждения эпителия дыхательных путей, желудочно-кишечного тракта универсальны и не зависят от этиологического фактора. Элементы «цитокинового шторма», отнесенного, прежде всего, к определенному временному периоду COVID-19 (условно в течение недели от начала болезни), обнаруживаются и при других вирусных инфекциях, что стирает нозологические границы заболеваний и обосновывает необходимость подбора симптоматических средств, ингибирующих выброс медиаторов воспаления и купирующих острые проявления болезни [7, 8].
Провоспалительные цитокины, среди которых в цепи межклеточных взаимодействий лидируют интерлейкин (ИЛ)-1β, ИЛ-6, фактор некроза опухоли (ФНО)-α и ИЛ-1, накапливаясь в легких, повреждают аэрогематический барьер, вызывая нарушение диффузии газов и респираторные проявления, включая кашель, одышку, повышение температуры тела. Недавние исследования показали, что вирус SARS-CoV-2 вызывает накопление железа, способствуя увеличенной экспрессии гепсидина – пептидного гормона, системного регулятора метаболизма железа, действие которого приводит к снижению уровня железа в плазме [3]. Изучение вируса SARS-CoV-2 показало, что он стимулирует экспрессию гепсидина, тем самым увеличивая содержание ферритина. Инфекция COVID-19 приводит к воспалительному процессу, включая цитокиновый шторм, при котором ИЛ-6 стимулирует синтез ферритина и гепсидина. Как увеличение уровня гепсидина, так и подавление ферритина значительно препятствует выведению железа, что приводит к его переизбытку и ферроптозу в клетках [1]. Гиперферритинемия усиливает оксидативный стресс и перекисное окисление липидов, что увеличивает митохондриальную аутофагию и приводит к ферроптозу [1, 4]. Сверхэкспрессия гепсидина и избыток железа играют критическую роль при развитии инфекции COVID-19. В связи с этим гепсидин был предложен в качестве специфического биомаркера для контроля эффективности проводимой терапии [1]. Другими органами-мишенями, кроме легких, при COVID-19 являются сердце и почки. Исследования показали, что большое количество окисленных фосфолипидов накапливается в клетках миокарда и почек у пациентов с COVID-19. Это свидетельствует об участии ферроптоза в повреждении данных органов и развитии реперфузионного повреждения [6, 7].
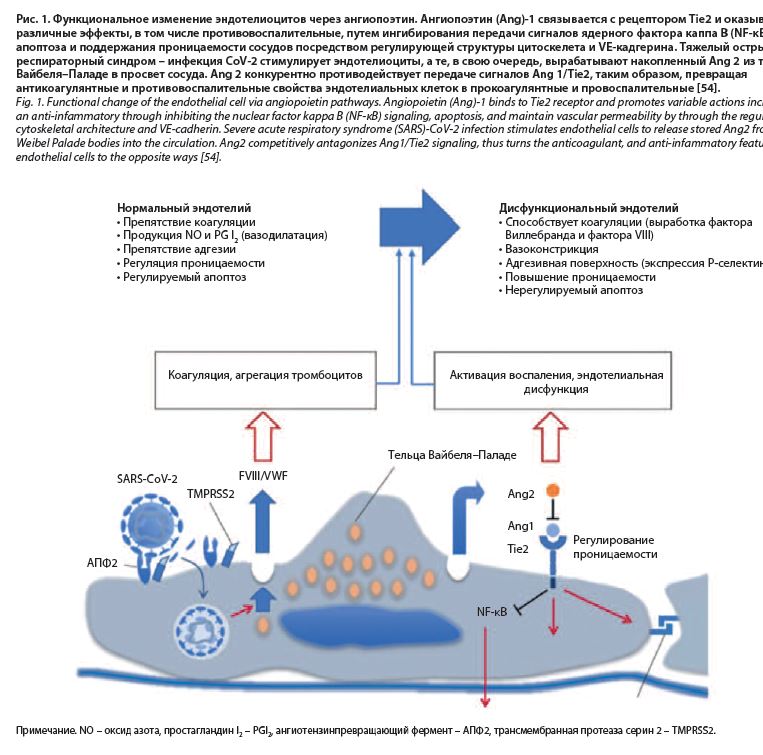 Вызванные вирусной инвазией повреждение эндотелия, повышение свертываемости крови, коагулопатия (тромбоваскулит, тромботическая микроангиопатия) и тромбоэмболические осложнения, повреждение микроциркуляторного русла создают замкнутый круг воспаления в дыхательных путях и, как следствие, определяют длительность симптомов, таких как повышенная температура тела, желудочно-кишечные расстройства, кашель в разгар заболевания и на постковидном этапе. Гипертермия при коронавирусной инфекции обусловлена повышением проницаемости гематоэнцефалического барьера и накоплением в центральной нервной системе пирогенных субстанций, что усиливает и поддерживает симптомы, связанные с интоксикацией (рис. 1).
Вызванные вирусной инвазией повреждение эндотелия, повышение свертываемости крови, коагулопатия (тромбоваскулит, тромботическая микроангиопатия) и тромбоэмболические осложнения, повреждение микроциркуляторного русла создают замкнутый круг воспаления в дыхательных путях и, как следствие, определяют длительность симптомов, таких как повышенная температура тела, желудочно-кишечные расстройства, кашель в разгар заболевания и на постковидном этапе. Гипертермия при коронавирусной инфекции обусловлена повышением проницаемости гематоэнцефалического барьера и накоплением в центральной нервной системе пирогенных субстанций, что усиливает и поддерживает симптомы, связанные с интоксикацией (рис. 1).
Основным источником как сезонных ОРВИ, так и COVID-19 является больной человек, в том числе находящийся в инкубационном периоде заболевания. Передача инфекции осуществляется воздушно-капельным путем [2].
Согласно временным рекомендациям по лекарственной терапии ОРВИ, в амбулаторной практике в период эпидемии COVID-19 основным методом этиологической диагностики ОРВИ и COVID-19 является исследование биологического материала из верхних и нижних дыхательных путей с помощью методов амплификации нуклеиновых кислот, наиболее распространенным из которых является ПЦР-метод [1, 6].
В соответствии с определением, любой случай острой респираторной инфекции (температура тела выше
37,5 °C и как минимум один из следующих признаков: кашель – сухой или со скудной мокротой, одышка, ощущение заложенности в грудной клетке, насыщение крови кислородом, по данным пульсоксиметрии, ≤95%, боль в горле, насморк и другие катаральные симптомы) при отсутствии других известных причин, которые объясняют клиническую картину вне зависимости от эпидемиологического анамнеза, считается подозрительным на COVID-19 [1, 2].
Необходимо дифференцировать COVID-19 с гриппом, острыми инфекциями, вызываемыми вирусами из группы ОРВИ (риновирус, аденовирус, РС-вирус, человеческие метапневмовирусы, MERS-CoV, парагрипп), вирусными гастроэнтеритами, бактериальными возбудителями респираторных инфекций [2].
Инкубационный период большинства ОРВИ, как правило, не превышает 3 дней, тогда как длительность инкубационного периода COVID-19 может колебаться от 1 до 14 дней, однако в среднем составляет 5 дней. При гриппе заболевание начинается остро, при COVID-19 и ОРВИ, как правило, выраженность симптоматики нарастает постепенно. Как при COVID-19, так и при гриппе может отмечаться высокая температура, кашель, слабость. Однако при гриппе и ОРВИ одышка и затрудненное дыхание отмечаются реже и выражены в меньшей степени, чем при COVID-19. Типичным признаком COVID-19 считается десатурация, регистрируемая даже при отсутствии типичных для вирусной инфекции повышения температуры тела, кашля [1, 2, 6].
Основным проявлением респираторных вирусных заболеваний является повышение температуры тела (70–90% случаев), достигающее при коронавирусной инфекции фебрильного уровня, сопровождающееся ознобом, у части больных одышкой (53–80%) и сухим кашлем (60–86%). Другие симптомы – астения (38%), миалгии (15–44%), тошнота/рвота или диарея (15–39%), головная боль, слабость (25%) и ринорея (7%), аносмия (10–15% больных, у 3% описывается как единственный симптом) – встречаются реже, но могут сохраняться длительное время, создавая наряду с когнитивными расстройствами, фибромиалгиями и широким спектром других нереспираторных проявлений своеобразный симптомокомплекс постковидного синдрома, или длинного ковида (рис. 2). Кашель при коронавирусной инфекции может сохраняться длительное время, и тогда заболевание трактуют как постковидный синдром. Были предложены различные механизмы для объяснения кашля, вызванного длительной гиперчувствительностью кашлевого рефлекса после вирусных инфекций, и в частности при SARS-CoV-2 [8, 9]. Клинические исследования, включавшие провокацию капсаицином при кашле (распространенный метод измерения чувствительности
к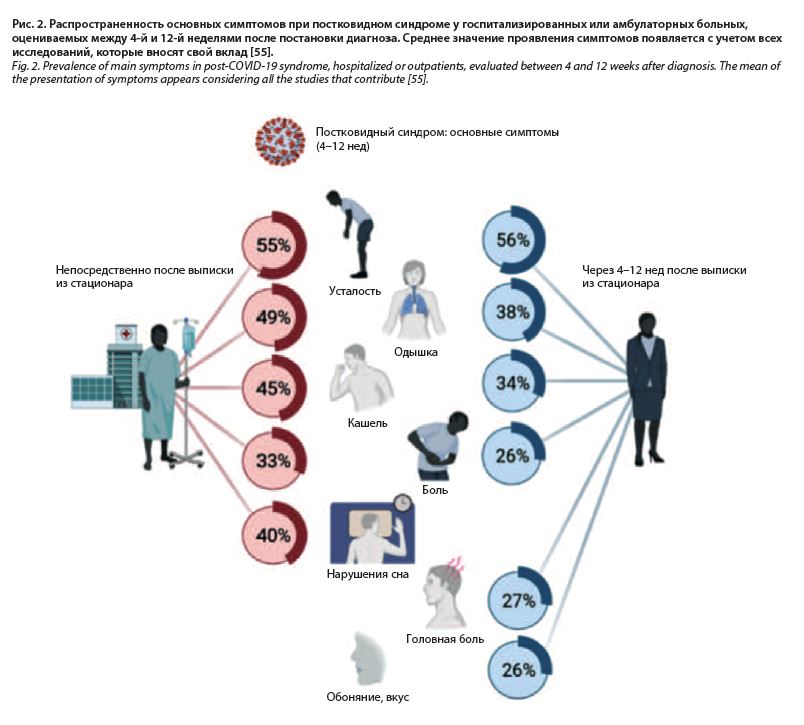 ашлевого рефлекса), продемонстрировали, что чувствительность кашлевого рефлекса повышается в острую стадию ОРВИ и остается таковой в течение 1 мес или более после исчезновения вирусного синдрома [10]. В исходе коронавирусной инфекции, особенно осложнившейся пневмонией, в легких возможно развитие фиброзных изменений [11]. При этом кашель приобретает признаки заболеваний из группы нозологий с прогрессирующим фиброзирующим фенотипом, определяемых также как легочный фиброз. Общие лабораторные отклонения при вирусных инфекциях, и прежде всего при COVID-19, включают лимфопению (83%), повышенные воспалительные маркеры (например, CОЭ, С-реактивный белок, ферритин, ФНО-α, ИЛ-1, ИЛ-6) и аномальные параметры свертывания крови. Например, пролонгированное протромбиновое время, тромбоцитопению, повышенный уровень D-димера (46% пациентов), низкий уровень фибриногена [1, 7].
ашлевого рефлекса), продемонстрировали, что чувствительность кашлевого рефлекса повышается в острую стадию ОРВИ и остается таковой в течение 1 мес или более после исчезновения вирусного синдрома [10]. В исходе коронавирусной инфекции, особенно осложнившейся пневмонией, в легких возможно развитие фиброзных изменений [11]. При этом кашель приобретает признаки заболеваний из группы нозологий с прогрессирующим фиброзирующим фенотипом, определяемых также как легочный фиброз. Общие лабораторные отклонения при вирусных инфекциях, и прежде всего при COVID-19, включают лимфопению (83%), повышенные воспалительные маркеры (например, CОЭ, С-реактивный белок, ферритин, ФНО-α, ИЛ-1, ИЛ-6) и аномальные параметры свертывания крови. Например, пролонгированное протромбиновое время, тромбоцитопению, повышенный уровень D-димера (46% пациентов), низкий уровень фибриногена [1, 7].
Установлено, что снижение общего количества лимфоцитов, особенно CD4+ и CD8+ Т-клеток, коррелирует с тяжестью
заболевания, а также с развитием критических осложнений [9]. Точно так же роль интерферонов (INF) типа I в COVID-19 была подчеркнута, когда наблюдения показали, что 10% пациентов с опасной для жизни пневмонией имеют нейтрализующие аутоантитела против INF типа I, что предполагает потенциальную терапевтическую роль INF [10]. Кроме того, исследования показали, что неблагоприятные исходы можно прогнозировать в случаях снижения уровня CD8+
Т-клеток и В-клеток или увеличения соотношения CD4+/CD8+ [11, 12]. Сообщалось, что усиление ответа
Т-клеток на инфекции SARS-CoV-2 коррелирует с тяжестью заболевания и возрастом больных [16].
У пожилых пациентов, инфицированных SARS-CoV-2, значительно реже, чем у молодых могут проявляться такие типичные симптомы, как лихорадка или кашель [17]. Лихорадка у пожилых пациентов может быть замаскирована, а инфекция COVID-19 может проявляться только в виде когнитивного или функционального снижения, особенно у больных с ранее существовавшими когнитивными расстройствами [18, 19]. Кроме того, у пожилых пациентов с COVID-19 в клинической картине могут преобладать астенические проявления, миалгии и желудочно-кишечные расстройства, включая анорексию, рвоту без лихорадки или кашель [20]. Таким образом, атипичные проявления инфекции SARS-CoV-2 у пожилых пациентов являются частыми и могут отсрочить диагностику заболевания. Кроме того, у них, как правило, чаще наблюдаются госпитальные осложнения. Многоцентровые исследования показали, что в группах у пожилых пациентов с доказанным COVID-19 острый респираторный дистресс-синдром, острое почечное повреждение, сепсис и пневмоторакс, сердечно-сосудистые события наблюдаются значимо чаще (до 40%), чем у более молодых пациентов (14,1%), искусственная вентиляция легких (ИВЛ) также чаще используется у пожилых пациентов, чем у лиц более молодого возраста [16, 20].
Тяжесть прогноза нарастает с возрастом, что обусловлено:
• наличием сопутствующих заболеваний, особенно гипертонии, диабета, ожирения и респираторных заболеваний;
• атипичными проявлениями болезни или отсутствием каких-либо специфических симптомов основного заболевания COVID-19 у пожилых людей, что затрудняет диагностику и раннее лечение этих пациентов;
• с возрастом происходит снижение врожденного иммунного ответа и сдвиг в субпопуляциях Т-клеток, что ограничивает ответ против новых инфекционных агентов.
Возрастные когнитивные расстройства также затрудняют организацию медицинской помощи [20, 21].
КТ-признаки поражения легких при респираторных инфекциях отличаются в зависимости от этиологического фактора. Типичными для COVID-19 изменениями считаются феномен «матового стекла», зоны консолидации, выявляемые в случае прогрессирования болезни, а у части пациентов – в ассоциации с фиброзом и уменьшением объема легких. Симптом «матового стекла» встречается и при других заболеваниях, связанных с воспалением в интерстиции легких. Альвеолит и признаки в виде матового стекла, сопровождающиеся респираторными симптомами, описывают как нежелательные эффекты лекарственных средств (например, кордарона), при системных заболеваниях (ревматоидном артрите), гиперчувствительном пневмоните и при других типах интерстициальных болезней легких. Эти варианты характеризуются нарушением функций легких по рестриктивному типу. В отличие от интерстициальной болезни легких при коронавирусной инфекции ФВД-показатели хотя и остаются в пределах нормы, но при долговременном наблюдении регистрируется снижение диффузионной способности легких и результатов нагрузочных тестов. Авторы объясняют затяжной характер симптомов и устойчивый дефицит функции легких в том числе и тем, что у пациентов, получавших респираторную поддержку, вне зависимости от способа доставки кислорода, отсутствовала возможность полноценного фармакологического контроля цитокиновой активности, включая лечение глюкокортикостероидами и другими патогенетическими средствами [22].
На основании анализа большинства исследований, в том числе систематических обзоров, было установлено, что ни одно из лекарственных средств, за исключением глюкокортикостероидов, не имело достоверно подтвержденного влияния на продление жизни больных с тяжелым течением коронавирусной инфекции, находящихся в стационаре и требующих респираторной поддержки. С другой стороны, не вызывает сомнения, что снижение температуры тела, поддержание неспецифических реакций иммунного ответа, облегчение кашлевого синдрома остается главной краткосрочной целью в лечении как на амбулаторной стадии, так и в стационаре, хотя единого мнения относительно необходимости дополнительного использования витаминов, деконгестантов, жаропонижающих средств так и не сложилось.
В период пандемии в лечении острых респираторных заболеваний все шире применяются комбинированные препараты, направленные на контроль клинических симптомов: лихорадки, проявлений ринита и/или ринофарингита (жаропонижающие препараты, например, парацетамол или ибупрофен, деконгестанты).
Кроме того, большое значение приобретает доставка биологически активных субстанций, витаминов, усиливающих резистентность организма к инфекции и обладающих противовирусными, иммуномодулирующими, противовоспалительными и антиоксидантными эффектами [23, 24].
Известно, что витамин С снижает оксидативный стресс, увеличивает продукцию интерферона, поддерживает противовоспалительное действие глюкокортикоидов. Нормальный уровень витамина С в крови –
50 ммоль/л. Норма потребления с пищей, по рекомендации Института питания РАМН (ныне ФГБНУ «ФИЦ питания и биотехнологий») и по нормам других стран, – 90–100 мг для мужчин и 80 мг для женщин [25]. Рекомендована суточная доза 200 мг в день, особенно для людей старше 65 лет. При респираторных инфекциях хорошо зарекомендовали себя высокие дозы витамина С в сутки (1000–2000 мг), установлено, что при тяжелых пневмониях и сепсисе они снижают продолжительность пребывания пациентов на ИВЛ и смертность [26].
В последних систематических обзорах и метаанализах содержатся данные о том, что употребление витамина С снижает в целом заболеваемость, длительность или тяжесть обычных простудных заболеваний при непрерывном регулярном ежедневном применении или курсом при первых симптомах простуды. Продолжительность простудных заболеваний снижалась на 8% (3–12%) при регулярном приеме витамина С (в качестве профилактики). У детей при применении 1–2 г/сут снижалась тяжесть и продолжительность заболевания на 18%. Авторы отмечают, что регулярное применение не обосновано, но может быть эффективно у людей, которые подвергаются непродолжительным усиленным физическим нагрузкам.
На результатах различных плацебо-контролируемых исследований было показано, что высокая доза витамина С – 3–4 г/сут – во время простудного заболевания уменьшает его продолжительность и облегчает симптомы (заложенность в грудной клетке, лихорадку, озноб) [28, 29].
Внутривенное введение витамина С снижало больничную смертность, уменьшало количество дней пребывания в клинике и к тому же не имело побочных эффектов со стороны почек. Предполагают, что аскорбиновая кислота как водорастворимый витамин, известный антиоксидантными свойствами, снижает интенсивность оксидативного стресса во время заболевания [30].
Применение витамина С снижало риск развития инфекции дыхательных путей и уменьшало продолжительность симптомов. Этот эффект аскорбиновой кислоты был сильнее выражен у мужчин в странах со средним уровнем доходов и у женщин в странах с высоким средним уровнем доходов [31].
С другой стороны, при анализе 8 систематических обзоров, включавших 31 рандомизированное исследование, убедительного доказательства влияния регулярного приема витамина С на заболеваемость и продолжительность ОРВИ найдено не было. Не отмечено разницы в длительности пребывания в клинике между контрольной группой и группой пациентов, получавших витамин С внутривенно в высоких дозах. Хотя у второй группы и была снижена внутрибольничная смертность, разница с контрольной группой была несущественной [28, 29, 32].
В 12 исследованиях с участием 1766 пациентов витамин С уменьшал время пребывания в отделении реанимации и интенсивной терапии (ОРИТ) в среднем на 7,8%. В 6 исследованиях при пероральном приеме аскорбиновой кислоты в дозах 1–3 г/сут (в среднем 2 г) уменьшалась длительность пребывания в ОРИТ на 8,6%.
В 3 исследованиях витамин С сокращал продолжительность ИВЛ у тяжелых пациентов на 18,2% [33, 34].
Жаропонижающие назначают при температуре тела >38,0–38,5 °С. Но при плохой переносимости лихорадочного синдрома, головных болях, повышении артериального давления и выраженной тахикардии (особенно при наличии ишемических изменений или нарушениях ритма) жаропонижающие препараты используют и при более низких цифрах.
Несмотря на появление новых анальгетиков, парацетамол по-прежнему остается одним из наиболее используемых анальгетиков-антипиретиков [35]. У многих клиницистов парацетамол является препаратом 1-й линии для обезболивания и контроля лихорадки у различных пациентов, включая детей, беременных женщин, пожилых людей и пациентов с остеоартритом [36]. Клиницисты все чаще поддерживают идею замены парацетамола ибупрофеном в качестве препарата 1-й линии для лечения лихорадки у младенцев и детей [37].
Парацетамол эффективен при легкой и умеренной головной, зубной боли, при дисменорее и послеоперационной боли [38–40]. Он подходит для симптоматического облегчения боли в горле и лихорадки при инфекции верхних дыхательных путей (ИВДП). В двойном слепом плацебо-контролируемом клиническом исследовании с участием пациентов с болью в горле, связанной с ИВДП, B. Schachtel и соавт. продемонстрировали, что однократная доза парацетамола 650 мг у 13 пациентов уменьшила боль в горле, не вызвав при этом побочных эффектов [41]. В аналогичном двойном слепом плацебо-контролируемом клиническом исследовании после однократного приема 1000 мг парацетамола у 40 пациентов значительно уменьшилась боль в горле, не спровоцировав побочного действия. В последнем исследовании было показано, что доза 1000 мг парацетамола обеспечивает облегчение боли в горле на срок до 6 ч [42].
Однократные дозы в 500 и 1000 мг парацетамола показали лучший эффект, чем плацебо в снижении температуры тела у пациентов с лихорадкой, связанной с ИВДП, и облегчении других симптомов: интоксикации, головной боли, слабости, озноба [43].
Парацетамол особенно эффективен при лечении боли и лихорадки у младенцев и детей, так как он более безопасен, чем аспирин, и не вызывает синдром Рея [36]. Большинство клинических данных об эффективности парацетамола при лечении лихорадки у детей было получено в ходе клинических испытаний, когда сравнивали эффективность ибупрофена и парацетамола [44]. В двойном слепом плацебо-контролируемом исследовании с участием детей в возрасте 2–12 лет было показано, что однократная доза парацетамола
15 мг/кг лучше плацебо в лечении боли в горле и лихорадки при ОРВИ. Авторы обзора, охватившего первые 40 лет применения парацетамола у детей, заявляют, что «Парацетамол остается безрецептурным препаратом 1-й линии терапии как обезболивающее и жаропонижающее средство у детей» [45, 46].
В состав комбинированных средств от простуды и гриппа входит системный деконгестант фенилэфрин – единственный разрешенный для безрецептурного отпуска в Российской Федерации. Фенилэфрин эффективно улучшает носовое дыхание при инфекционном рините за счет устранения отека слизистой оболочки носа. В небольших дозах он не влияет на артериальное давление и не имеет центрального стимулирующего эффекта. Систематическое применение фенилэфрина не приводит к возникновению сухости слизистой оболочки носа и формированию медикаментозного ринита [47]. При простуде противодействует вазодилатации, особенно в зоне назальной слизистой оболочки, не снижая при этом активность реснитчатого эпителия. Кроме того, фенилэфрин снимает спастические явления в трахее, разжижает секрет, уменьшая концентрацию белка в нем [48].
По сравнению с типичными деконгестантами (α2-адреномиметиками) фенилэфрин обладает менее выраженным, более мягким анемизирующим действием и существенно не нарушает кровоток в слизистой оболочке носа. Его эффект развивается в течение 5 мин и длится до 6–7 ч. Кроме того, он значительно менее опасен в плане развития тахифилаксии и медикаментозного ринита [49].
В отличие от взрослых у детей осложнением применения назальных сосудосуживающих препаратов чаще является не развитие медикаментозного ринита, а острое отравление α2-адреномиметиками. По последним данным, в структуре причин госпитализации детей в педиатрические токсикологические отделения не менее 20–30% составляют случаи отравления нафазолином. Поэтому в детской практике широко применяют фенилэфрин [50].
Комбинация фенилэфрина и парацетамола при пероральном применении вызывает большее повышение артериального давления, чем отдельное применение фенилэфрина. В исследовании было показано, что при совместном применении 10 мг фенилэфрина и 1000 мг парацетамола у пациентов с имеющейся артериальной гипертензией среднее артериальное давление повышается на 12,3 мм рт. ст., в то время как при отдельном применении 10 мг фенилэфрина – на 4,2 мм рт. ст. [51].
Фенилэфрин метаболизируется в энтероцитах путем присоединения сульфатной группы (реакция конъюгации), а парацетамол вмешивается в этот процесс и нарушает метаболизм фенилэфрина, что способствует большей концентрации второго в крови. В исследованиях показано, что при пероральном введении 5 мг фенилфэрина и 1000 мг парацетамола кривая «концентрация–время» была аналогична кривой при отдельном применении 10 мг фенилэфрина [51, 52].
Рандомизированное двойное слепое плацебо-контролируемое исследование продемонстрировало эффективность и безопасность совместного применения
400 мг парацетамола, 4 мг фенилэфрина, 4 мг хлорфенамина при симптомах простуды у взрослых [52].
Таким образом, комбинация парацетамола с витамином С и фенилэфрином, с учетом доказанного профиля их безопасности и эффективности, может применяться в качестве универсальной симптоматической и этиотропной терапии острых вирусных инфекций в период пандемии.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах / Information about the authors
Попова Елена Николаевна – д-р мед. наук, проф. каф. внутренних, профессиональных болезней и ревматологии, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: ela12@yandex.ru
Elena N. Popova – D. Sci. (Med.), Prof., Sechenov First Moscow State Medical University (Sechenov University). E-mail: ela12@yandex.ru
Пономарева Любовь Андреевна – студент, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет).
E-mail: liubaponomareva18@yandex.ru
Liubov A. Ponomareva – Student, Sechenov First Moscow State Medical University (Sechenov University).
E-mail: liubaponomareva18@yandex.ru
Чинова Алина Александровна – студент, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет)
Alina A. Chinova – Student, Sechenov First Moscow State Medical University (Sechenov University)
Статья поступила в редакцию / The article received: 17.03.2022
Статья принята к печати / The article approved for publication: 07.04.2022
Elena N. Popova, Liubov A. Ponomareva, Alina A. Chinova
Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russia
ela12@yandex.ru
Abstract
According to WHO, the share of acute respiratory infections (ARVI) is about 70–90% of all infectious diseases. Despite their relatively short-term course, they suffer significant economic damage due to high turnover among the population and temporary disability. Especially since the end of 2019, when SARS-Cov-2 infection has taken priority and the attention of the entire global medical community. ARVI is a heterogeneous group of infectious diseases of the respiratory system caused by a huge number of viruses (there are more than 200 of them, among them: influenza virus, parainfluenza, respiratory syncytial virus, adenovirus, coronavirus and others). The symptoms and pathogenesis of the disease are similar in many ways (fever, cough, chest pain, myalgia, asthenia, headaches, anosmia and others), but there are also differences. The article discusses
in detail the symptoms of acute respiratory viral infections (including COVID-19) and medicines, their components, which are most widely used in the epidemic period, and also provides a pathogenetic justification for the use. During the epidemic period (in Russia it lasts from October to March-April), the demand for various medicines (drugs) among the population traditionally increases. Since ARVI belong to a group of diseases, in relation to which a large proportion of self-prescribing drugs and cases of self-medication, it is of interest to consider in more detail the various drugs and components of drugs from the point of view of the pathogenesis of the disease.
Key words: paracetamol, ascorbic acid, phenylephrine, COVID-19, acute respiratory infections.
For citation: Popova E.N., Ponomareva L.A., Chinova A.A. Pathogenetic complexes in treatment of patients with viral respiratory infections. Clinical review for general practice. 2022; 2: 25–32. DOI: 10.47407/kr2022.3.2.00123
Пандемия SARS-CoV-2 серьезно повлияла на клинические проявления острых респираторных вирусных инфекций (ОРВИ) в целом, приведя к резкому нарастанию числа пациентов с более выраженной интоксикацией, риносинусопатией, затяжным периодом восстановления. Сохраняющиеся после острого периода вирусной инфекции разнообразные симптомы, проявляющиеся астенией, неврологическими нарушениями, субфебрильной лихорадкой, респираторными и когнитивными расстройствами, в последнее время стали обозначать как постковидный синдром. Как в острую стадию заболевания, так и при наличии остаточных расстройств, связанных с СОVID-19, не исключается одновременное присутствие у больного различных, в том числе и непандемических, штаммов вирусов [1, 3].
Лечение респираторных заболеваний, вызванных как SARS-CoV-2, так и другими вирусными агентами, основано на контроле симптомов, обусловленных молекулярной активностью клеток воспаления, индуцированной вирусным материалом. Реакции вирусного повреждения эпителия дыхательных путей, желудочно-кишечного тракта универсальны и не зависят от этиологического фактора. Элементы «цитокинового шторма», отнесенного, прежде всего, к определенному временному периоду COVID-19 (условно в течение недели от начала болезни), обнаруживаются и при других вирусных инфекциях, что стирает нозологические границы заболеваний и обосновывает необходимость подбора симптоматических средств, ингибирующих выброс медиаторов воспаления и купирующих острые проявления болезни [7, 8].
Провоспалительные цитокины, среди которых в цепи межклеточных взаимодействий лидируют интерлейкин (ИЛ)-1β, ИЛ-6, фактор некроза опухоли (ФНО)-α и ИЛ-1, накапливаясь в легких, повреждают аэрогематический барьер, вызывая нарушение диффузии газов и респираторные проявления, включая кашель, одышку, повышение температуры тела. Недавние исследования показали, что вирус SARS-CoV-2 вызывает накопление железа, способствуя увеличенной экспрессии гепсидина – пептидного гормона, системного регулятора метаболизма железа, действие которого приводит к снижению уровня железа в плазме [3]. Изучение вируса SARS-CoV-2 показало, что он стимулирует экспрессию гепсидина, тем самым увеличивая содержание ферритина. Инфекция COVID-19 приводит к воспалительному процессу, включая цитокиновый шторм, при котором ИЛ-6 стимулирует синтез ферритина и гепсидина. Как увеличение уровня гепсидина, так и подавление ферритина значительно препятствует выведению железа, что приводит к его переизбытку и ферроптозу в клетках [1]. Гиперферритинемия усиливает оксидативный стресс и перекисное окисление липидов, что увеличивает митохондриальную аутофагию и приводит к ферроптозу [1, 4]. Сверхэкспрессия гепсидина и избыток железа играют критическую роль при развитии инфекции COVID-19. В связи с этим гепсидин был предложен в качестве специфического биомаркера для контроля эффективности проводимой терапии [1]. Другими органами-мишенями, кроме легких, при COVID-19 являются сердце и почки. Исследования показали, что большое количество окисленных фосфолипидов накапливается в клетках миокарда и почек у пациентов с COVID-19. Это свидетельствует об участии ферроптоза в повреждении данных органов и развитии реперфузионного повреждения [6, 7].
Основным источником как сезонных ОРВИ, так и COVID-19 является больной человек, в том числе находящийся в инкубационном периоде заболевания. Передача инфекции осуществляется воздушно-капельным путем [2].
Согласно временным рекомендациям по лекарственной терапии ОРВИ, в амбулаторной практике в период эпидемии COVID-19 основным методом этиологической диагностики ОРВИ и COVID-19 является исследование биологического материала из верхних и нижних дыхательных путей с помощью методов амплификации нуклеиновых кислот, наиболее распространенным из которых является ПЦР-метод [1, 6].
В соответствии с определением, любой случай острой респираторной инфекции (температура тела выше
37,5 °C и как минимум один из следующих признаков: кашель – сухой или со скудной мокротой, одышка, ощущение заложенности в грудной клетке, насыщение крови кислородом, по данным пульсоксиметрии, ≤95%, боль в горле, насморк и другие катаральные симптомы) при отсутствии других известных причин, которые объясняют клиническую картину вне зависимости от эпидемиологического анамнеза, считается подозрительным на COVID-19 [1, 2].
Необходимо дифференцировать COVID-19 с гриппом, острыми инфекциями, вызываемыми вирусами из группы ОРВИ (риновирус, аденовирус, РС-вирус, человеческие метапневмовирусы, MERS-CoV, парагрипп), вирусными гастроэнтеритами, бактериальными возбудителями респираторных инфекций [2].
Инкубационный период большинства ОРВИ, как правило, не превышает 3 дней, тогда как длительность инкубационного периода COVID-19 может колебаться от 1 до 14 дней, однако в среднем составляет 5 дней. При гриппе заболевание начинается остро, при COVID-19 и ОРВИ, как правило, выраженность симптоматики нарастает постепенно. Как при COVID-19, так и при гриппе может отмечаться высокая температура, кашель, слабость. Однако при гриппе и ОРВИ одышка и затрудненное дыхание отмечаются реже и выражены в меньшей степени, чем при COVID-19. Типичным признаком COVID-19 считается десатурация, регистрируемая даже при отсутствии типичных для вирусной инфекции повышения температуры тела, кашля [1, 2, 6].
Основным проявлением респираторных вирусных заболеваний является повышение температуры тела (70–90% случаев), достигающее при коронавирусной инфекции фебрильного уровня, сопровождающееся ознобом, у части больных одышкой (53–80%) и сухим кашлем (60–86%). Другие симптомы – астения (38%), миалгии (15–44%), тошнота/рвота или диарея (15–39%), головная боль, слабость (25%) и ринорея (7%), аносмия (10–15% больных, у 3% описывается как единственный симптом) – встречаются реже, но могут сохраняться длительное время, создавая наряду с когнитивными расстройствами, фибромиалгиями и широким спектром других нереспираторных проявлений своеобразный симптомокомплекс постковидного синдрома, или длинного ковида (рис. 2). Кашель при коронавирусной инфекции может сохраняться длительное время, и тогда заболевание трактуют как постковидный синдром. Были предложены различные механизмы для объяснения кашля, вызванного длительной гиперчувствительностью кашлевого рефлекса после вирусных инфекций, и в частности при SARS-CoV-2 [8, 9]. Клинические исследования, включавшие провокацию капсаицином при кашле (распространенный метод измерения чувствительности
к
Установлено, что снижение общего количества лимфоцитов, особенно CD4+ и CD8+ Т-клеток, коррелирует с тяжестью
заболевания, а также с развитием критических осложнений [9]. Точно так же роль интерферонов (INF) типа I в COVID-19 была подчеркнута, когда наблюдения показали, что 10% пациентов с опасной для жизни пневмонией имеют нейтрализующие аутоантитела против INF типа I, что предполагает потенциальную терапевтическую роль INF [10]. Кроме того, исследования показали, что неблагоприятные исходы можно прогнозировать в случаях снижения уровня CD8+
Т-клеток и В-клеток или увеличения соотношения CD4+/CD8+ [11, 12]. Сообщалось, что усиление ответа
Т-клеток на инфекции SARS-CoV-2 коррелирует с тяжестью заболевания и возрастом больных [16].
У пожилых пациентов, инфицированных SARS-CoV-2, значительно реже, чем у молодых могут проявляться такие типичные симптомы, как лихорадка или кашель [17]. Лихорадка у пожилых пациентов может быть замаскирована, а инфекция COVID-19 может проявляться только в виде когнитивного или функционального снижения, особенно у больных с ранее существовавшими когнитивными расстройствами [18, 19]. Кроме того, у пожилых пациентов с COVID-19 в клинической картине могут преобладать астенические проявления, миалгии и желудочно-кишечные расстройства, включая анорексию, рвоту без лихорадки или кашель [20]. Таким образом, атипичные проявления инфекции SARS-CoV-2 у пожилых пациентов являются частыми и могут отсрочить диагностику заболевания. Кроме того, у них, как правило, чаще наблюдаются госпитальные осложнения. Многоцентровые исследования показали, что в группах у пожилых пациентов с доказанным COVID-19 острый респираторный дистресс-синдром, острое почечное повреждение, сепсис и пневмоторакс, сердечно-сосудистые события наблюдаются значимо чаще (до 40%), чем у более молодых пациентов (14,1%), искусственная вентиляция легких (ИВЛ) также чаще используется у пожилых пациентов, чем у лиц более молодого возраста [16, 20].
Тяжесть прогноза нарастает с возрастом, что обусловлено:
• наличием сопутствующих заболеваний, особенно гипертонии, диабета, ожирения и респираторных заболеваний;
• атипичными проявлениями болезни или отсутствием каких-либо специфических симптомов основного заболевания COVID-19 у пожилых людей, что затрудняет диагностику и раннее лечение этих пациентов;
• с возрастом происходит снижение врожденного иммунного ответа и сдвиг в субпопуляциях Т-клеток, что ограничивает ответ против новых инфекционных агентов.
Возрастные когнитивные расстройства также затрудняют организацию медицинской помощи [20, 21].
КТ-признаки поражения легких при респираторных инфекциях отличаются в зависимости от этиологического фактора. Типичными для COVID-19 изменениями считаются феномен «матового стекла», зоны консолидации, выявляемые в случае прогрессирования болезни, а у части пациентов – в ассоциации с фиброзом и уменьшением объема легких. Симптом «матового стекла» встречается и при других заболеваниях, связанных с воспалением в интерстиции легких. Альвеолит и признаки в виде матового стекла, сопровождающиеся респираторными симптомами, описывают как нежелательные эффекты лекарственных средств (например, кордарона), при системных заболеваниях (ревматоидном артрите), гиперчувствительном пневмоните и при других типах интерстициальных болезней легких. Эти варианты характеризуются нарушением функций легких по рестриктивному типу. В отличие от интерстициальной болезни легких при коронавирусной инфекции ФВД-показатели хотя и остаются в пределах нормы, но при долговременном наблюдении регистрируется снижение диффузионной способности легких и результатов нагрузочных тестов. Авторы объясняют затяжной характер симптомов и устойчивый дефицит функции легких в том числе и тем, что у пациентов, получавших респираторную поддержку, вне зависимости от способа доставки кислорода, отсутствовала возможность полноценного фармакологического контроля цитокиновой активности, включая лечение глюкокортикостероидами и другими патогенетическими средствами [22].
На основании анализа большинства исследований, в том числе систематических обзоров, было установлено, что ни одно из лекарственных средств, за исключением глюкокортикостероидов, не имело достоверно подтвержденного влияния на продление жизни больных с тяжелым течением коронавирусной инфекции, находящихся в стационаре и требующих респираторной поддержки. С другой стороны, не вызывает сомнения, что снижение температуры тела, поддержание неспецифических реакций иммунного ответа, облегчение кашлевого синдрома остается главной краткосрочной целью в лечении как на амбулаторной стадии, так и в стационаре, хотя единого мнения относительно необходимости дополнительного использования витаминов, деконгестантов, жаропонижающих средств так и не сложилось.
В период пандемии в лечении острых респираторных заболеваний все шире применяются комбинированные препараты, направленные на контроль клинических симптомов: лихорадки, проявлений ринита и/или ринофарингита (жаропонижающие препараты, например, парацетамол или ибупрофен, деконгестанты).
Кроме того, большое значение приобретает доставка биологически активных субстанций, витаминов, усиливающих резистентность организма к инфекции и обладающих противовирусными, иммуномодулирующими, противовоспалительными и антиоксидантными эффектами [23, 24].
Известно, что витамин С снижает оксидативный стресс, увеличивает продукцию интерферона, поддерживает противовоспалительное действие глюкокортикоидов. Нормальный уровень витамина С в крови –
50 ммоль/л. Норма потребления с пищей, по рекомендации Института питания РАМН (ныне ФГБНУ «ФИЦ питания и биотехнологий») и по нормам других стран, – 90–100 мг для мужчин и 80 мг для женщин [25]. Рекомендована суточная доза 200 мг в день, особенно для людей старше 65 лет. При респираторных инфекциях хорошо зарекомендовали себя высокие дозы витамина С в сутки (1000–2000 мг), установлено, что при тяжелых пневмониях и сепсисе они снижают продолжительность пребывания пациентов на ИВЛ и смертность [26].
В последних систематических обзорах и метаанализах содержатся данные о том, что употребление витамина С снижает в целом заболеваемость, длительность или тяжесть обычных простудных заболеваний при непрерывном регулярном ежедневном применении или курсом при первых симптомах простуды. Продолжительность простудных заболеваний снижалась на 8% (3–12%) при регулярном приеме витамина С (в качестве профилактики). У детей при применении 1–2 г/сут снижалась тяжесть и продолжительность заболевания на 18%. Авторы отмечают, что регулярное применение не обосновано, но может быть эффективно у людей, которые подвергаются непродолжительным усиленным физическим нагрузкам.
На результатах различных плацебо-контролируемых исследований было показано, что высокая доза витамина С – 3–4 г/сут – во время простудного заболевания уменьшает его продолжительность и облегчает симптомы (заложенность в грудной клетке, лихорадку, озноб) [28, 29].
Внутривенное введение витамина С снижало больничную смертность, уменьшало количество дней пребывания в клинике и к тому же не имело побочных эффектов со стороны почек. Предполагают, что аскорбиновая кислота как водорастворимый витамин, известный антиоксидантными свойствами, снижает интенсивность оксидативного стресса во время заболевания [30].
Применение витамина С снижало риск развития инфекции дыхательных путей и уменьшало продолжительность симптомов. Этот эффект аскорбиновой кислоты был сильнее выражен у мужчин в странах со средним уровнем доходов и у женщин в странах с высоким средним уровнем доходов [31].
С другой стороны, при анализе 8 систематических обзоров, включавших 31 рандомизированное исследование, убедительного доказательства влияния регулярного приема витамина С на заболеваемость и продолжительность ОРВИ найдено не было. Не отмечено разницы в длительности пребывания в клинике между контрольной группой и группой пациентов, получавших витамин С внутривенно в высоких дозах. Хотя у второй группы и была снижена внутрибольничная смертность, разница с контрольной группой была несущественной [28, 29, 32].
В 12 исследованиях с участием 1766 пациентов витамин С уменьшал время пребывания в отделении реанимации и интенсивной терапии (ОРИТ) в среднем на 7,8%. В 6 исследованиях при пероральном приеме аскорбиновой кислоты в дозах 1–3 г/сут (в среднем 2 г) уменьшалась длительность пребывания в ОРИТ на 8,6%.
В 3 исследованиях витамин С сокращал продолжительность ИВЛ у тяжелых пациентов на 18,2% [33, 34].
Жаропонижающие назначают при температуре тела >38,0–38,5 °С. Но при плохой переносимости лихорадочного синдрома, головных болях, повышении артериального давления и выраженной тахикардии (особенно при наличии ишемических изменений или нарушениях ритма) жаропонижающие препараты используют и при более низких цифрах.
Несмотря на появление новых анальгетиков, парацетамол по-прежнему остается одним из наиболее используемых анальгетиков-антипиретиков [35]. У многих клиницистов парацетамол является препаратом 1-й линии для обезболивания и контроля лихорадки у различных пациентов, включая детей, беременных женщин, пожилых людей и пациентов с остеоартритом [36]. Клиницисты все чаще поддерживают идею замены парацетамола ибупрофеном в качестве препарата 1-й линии для лечения лихорадки у младенцев и детей [37].
Парацетамол эффективен при легкой и умеренной головной, зубной боли, при дисменорее и послеоперационной боли [38–40]. Он подходит для симптоматического облегчения боли в горле и лихорадки при инфекции верхних дыхательных путей (ИВДП). В двойном слепом плацебо-контролируемом клиническом исследовании с участием пациентов с болью в горле, связанной с ИВДП, B. Schachtel и соавт. продемонстрировали, что однократная доза парацетамола 650 мг у 13 пациентов уменьшила боль в горле, не вызвав при этом побочных эффектов [41]. В аналогичном двойном слепом плацебо-контролируемом клиническом исследовании после однократного приема 1000 мг парацетамола у 40 пациентов значительно уменьшилась боль в горле, не спровоцировав побочного действия. В последнем исследовании было показано, что доза 1000 мг парацетамола обеспечивает облегчение боли в горле на срок до 6 ч [42].
Однократные дозы в 500 и 1000 мг парацетамола показали лучший эффект, чем плацебо в снижении температуры тела у пациентов с лихорадкой, связанной с ИВДП, и облегчении других симптомов: интоксикации, головной боли, слабости, озноба [43].
Парацетамол особенно эффективен при лечении боли и лихорадки у младенцев и детей, так как он более безопасен, чем аспирин, и не вызывает синдром Рея [36]. Большинство клинических данных об эффективности парацетамола при лечении лихорадки у детей было получено в ходе клинических испытаний, когда сравнивали эффективность ибупрофена и парацетамола [44]. В двойном слепом плацебо-контролируемом исследовании с участием детей в возрасте 2–12 лет было показано, что однократная доза парацетамола
15 мг/кг лучше плацебо в лечении боли в горле и лихорадки при ОРВИ. Авторы обзора, охватившего первые 40 лет применения парацетамола у детей, заявляют, что «Парацетамол остается безрецептурным препаратом 1-й линии терапии как обезболивающее и жаропонижающее средство у детей» [45, 46].
В состав комбинированных средств от простуды и гриппа входит системный деконгестант фенилэфрин – единственный разрешенный для безрецептурного отпуска в Российской Федерации. Фенилэфрин эффективно улучшает носовое дыхание при инфекционном рините за счет устранения отека слизистой оболочки носа. В небольших дозах он не влияет на артериальное давление и не имеет центрального стимулирующего эффекта. Систематическое применение фенилэфрина не приводит к возникновению сухости слизистой оболочки носа и формированию медикаментозного ринита [47]. При простуде противодействует вазодилатации, особенно в зоне назальной слизистой оболочки, не снижая при этом активность реснитчатого эпителия. Кроме того, фенилэфрин снимает спастические явления в трахее, разжижает секрет, уменьшая концентрацию белка в нем [48].
По сравнению с типичными деконгестантами (α2-адреномиметиками) фенилэфрин обладает менее выраженным, более мягким анемизирующим действием и существенно не нарушает кровоток в слизистой оболочке носа. Его эффект развивается в течение 5 мин и длится до 6–7 ч. Кроме того, он значительно менее опасен в плане развития тахифилаксии и медикаментозного ринита [49].
В отличие от взрослых у детей осложнением применения назальных сосудосуживающих препаратов чаще является не развитие медикаментозного ринита, а острое отравление α2-адреномиметиками. По последним данным, в структуре причин госпитализации детей в педиатрические токсикологические отделения не менее 20–30% составляют случаи отравления нафазолином. Поэтому в детской практике широко применяют фенилэфрин [50].
Комбинация фенилэфрина и парацетамола при пероральном применении вызывает большее повышение артериального давления, чем отдельное применение фенилэфрина. В исследовании было показано, что при совместном применении 10 мг фенилэфрина и 1000 мг парацетамола у пациентов с имеющейся артериальной гипертензией среднее артериальное давление повышается на 12,3 мм рт. ст., в то время как при отдельном применении 10 мг фенилэфрина – на 4,2 мм рт. ст. [51].
Фенилэфрин метаболизируется в энтероцитах путем присоединения сульфатной группы (реакция конъюгации), а парацетамол вмешивается в этот процесс и нарушает метаболизм фенилэфрина, что способствует большей концентрации второго в крови. В исследованиях показано, что при пероральном введении 5 мг фенилфэрина и 1000 мг парацетамола кривая «концентрация–время» была аналогична кривой при отдельном применении 10 мг фенилэфрина [51, 52].
Рандомизированное двойное слепое плацебо-контролируемое исследование продемонстрировало эффективность и безопасность совместного применения
400 мг парацетамола, 4 мг фенилэфрина, 4 мг хлорфенамина при симптомах простуды у взрослых [52].
Таким образом, комбинация парацетамола с витамином С и фенилэфрином, с учетом доказанного профиля их безопасности и эффективности, может применяться в качестве универсальной симптоматической и этиотропной терапии острых вирусных инфекций в период пандемии.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах / Information about the authors
Попова Елена Николаевна – д-р мед. наук, проф. каф. внутренних, профессиональных болезней и ревматологии, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: ela12@yandex.ru
Elena N. Popova – D. Sci. (Med.), Prof., Sechenov First Moscow State Medical University (Sechenov University). E-mail: ela12@yandex.ru
Пономарева Любовь Андреевна – студент, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет).
E-mail: liubaponomareva18@yandex.ru
Liubov A. Ponomareva – Student, Sechenov First Moscow State Medical University (Sechenov University).
E-mail: liubaponomareva18@yandex.ru
Чинова Алина Александровна – студент, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет)
Alina A. Chinova – Student, Sechenov First Moscow State Medical University (Sechenov University)
Статья поступила в редакцию / The article received: 17.03.2022
Статья принята к печати / The article approved for publication: 07.04.2022
3 августа 2022
Количество просмотров: 973
