Клинический разбор в общей медицине №3 2022
Common variable immunodeficiency: difficulties in timely diagnosis (clinical case)
Oksana V. Moskalets
Abstract
Common variable immunodeficiency (CVID) belongs to the group of primary immunodeficiencies with a predominant deficiency in antibody synthesis and the most common diagnosis among clinically significant cases of primary immunodeficiency in adults. The main laboratory criterion for this disease is considered to be hypogammaglobulinemia (a decrease in the level of IgG less than 4.5 g/l with a decrease in the level of IgA, with/without a decrease in the level of IgM). Clinical manifestations of CVID are diverse: infectious syndrome (chronic infections of the lower respiratory tract, sinusitis, otitis, infectious diarrhea, septic arthritis), autoimmune syndrome (cytopenias, systemic rheumatic diseases), non-infectious pathology of the gastrointestinal tract (celiac-like or IBD-like syndromes , nodular hyperplasia of the mucosa), interstitial lung diseases, pathological non-malignant lymphoproliferation (lymphadenopathy, hepatosplenomegaly), oncological diseases, the formation of non-caseating granulomas in the internal organs). Due to the lack of a typical clinical picture, the diagnosis of CVID in adults is often made many years late, especially if the clinical picture is dominated by non-infectious manifestations. The article presents a clinical case when the patient had recurrent lymphadenopathy as the main symptom for several years. After examination by various specialists, she was referred to an immunologist because hypoproteinemia and a sharp decrease in the gamma fraction of globulins have been revealed. An immunological study revealed agammaglobulinemia and a pronounced imbalance of T-lymphocyte subpopulations (a significant decrease in the number of CD4+ cells and an increase in CD8+ cells). The clinical significance of T-lymphocyte disorders in CVID, the need for treatment with adequate doses of intravenous immunoglobulins are discussed.
Key words: primary immunodeficiency, common variable innunodeficiency, granulomatous necrotizing lymphadenitis, T-lymphocyte subsets, intravenous immunoglobulins.
For citation: Moskalets O.V. Common variable immunodeficiency: difficulties in timely diagnosis (clinical case). Clinical review for general practice. 2022; 3: 60–63. DOI: 10.47407/kr2022.3.3.00137
Первичные иммунодефициты (ПИД) с преимущественной недостаточностью синтеза антител являются самым распространенным вариантом из всех ПИД (около 60%) [1–3]. Данная группа достаточно гетерогенна как по механизмам развития, так и по клинико-лабораторным характеристикам. Одной из форм ПИД с преимущественной недостаточностью синтеза антител является общая вариабельная иммунная недостаточность (ОВИН). Это наиболее часто встречающийся диагноз среди клинически значимых случаев ПИД у взрослых. Основным лабораторным критерием ОВИН у взрослых являются снижение уровня иммуноглобулина (Ig) G менее 4,5 г/л и IgA с/без снижения уровня IgM, а также снижение количества переключенных В-клеток памяти (CD19+CD27+IgD-). Общее количество В-лимфоцитов (CD19+ клетки) может быть и нормальным, и сниженным. [4]. Истинная распространенность ОВИН, как и остальных вариантов ПИД, точно неизвестна, так как многое зависит от уровня диагностики и состояния здравоохранения в целом. Приводятся данные от 1:10 000 до 1:340 000 [3–7]. В большинстве случаев установить генетическую основу заболевания не представляется возможным. Примерно у 10–15% больных выявлены мутации в генах, детерминирующих формирование и функциональную активность В-лимфоцитов. Наиболее известны мутация гена TNFRSF13B, кодирующего белок трансмембранный активатор и модулятор кальция (TACI), который при взаимодействии с двумя другими белками – BAFF и APRIL участвует в активации ряда транскрипционных факторов, переключении изотипов Ig, кооперации
В-лимфоцитов с антигенпрезентирующими клетками, дефекты самого BAFF, CD19, CD20, CD21, CD81, приводящие к нарушению разных этапов дифференцировки
В-лимфоцитов, а также дефект ICOS, приводящий к нарушению передачи сигнала с активированных Т-лимфоцитов, который тоже необходим для дифференцировки
В-лимфоцитов, а также влияет на продукцию интерлейкина-10, связанного с образованием В-клеток памяти и плазматических клеток [5–7]. Следует отметить, что от 30 до 50% пациентов имеют те или иные изменения в Т-клеточном звене: снижение функциональной активности при стимуляции митогенами, снижение количества регуляторных Т-лимфоцитов, наивных CD4+ Т-лимфоцитов, увеличение количества Т-клеток памяти и фолликулярных Т-хелперов, повышенную экcпрессию маркера апоптоза CD95 на Т-лимфоцитах и др. [6, 8–11].
При ОВИН отмечают 2 пика заболеваемости: в возрасте 2–5 и 18–25 лет [12, 13]. Характерных клинических симптомов нет, заболевание имеет разные «маски», причем у одного пациента может наблюдаться сразу или поочередно несколько симптомокомплексов. Чаще всего встречается инфекционный синдром: синопульмональные инфекции (70–80% случаев), инфекции желудочно-кишечного тракта, вызванные вирусами или простейшими, инфекционные артриты. Неинфекционные проявления включают аутоиммунный синдром (цитопении, ревматоидый артрит, СКВ-подобный синдром, васкулиты), неинфекционную патологию желудочно-кишечного тракта (синдромы, подобные целиакии или воспалительным заболеваниям кишечника, нодулярная гиперплазия слизистой оболочки), онкологические заболевания (в первую очередь, лимфомы), патологическую лимфопролиферацию (лимфаденопатии, спленомегалия, иногда гепатомегалия), интерстициальную болезнь легких, образование неказеозных гранулем в разных органах (саркоидоподобные изменения в легких и др.) [5, 7, 12, 13]. Следует отметить, что неинфекционные проявления встречаются у 70% больных [11].
Ниже рассматривается случай ОВИН, когда в клинической картине преобладали именно неинфекционные проявления.
Клинический случай
Больная К. 46 лет обратилась к аллергологу-иммунологу с жалобами на увеличение подчелюстных лимфоузлов, быструю утомляемость, похудение.
Анамнез. В 2014 г. перенесла левостороннюю нижнедолевую пневмонию. До этого считала себя практически здоровой, болела острыми респираторными инфекциями 2–3 раза в год, но при детальном расспросе вспомнила, что бывали периоды, когда в течение нескольких недель отмечался учащенный неоформленный стул. Со слов пациентки, после выписки из стационара в общем анализе крови были какие-то изменения, в связи с чем ее направили к гематологу. Проведена стернальная пункция, заболеваний крови не выявлено. До октября 2016 г. чувствовала себя удовлетворительно, затем отметила увеличение подчелюстных лимфоузлов, по поводу чего вновь была направлена к гематологу. Проведена трепанобиопсия, выявлены вторичные изменения гемопоэза, признаков поражения, характерных для лимфомы, не обнаружено. Биопсия лимфоузла: в пределах исследованного материала элементов злокачественного роста/данных за лимфому, в том числе лимфому Ходжкина, не получено. Консультирована фтизиатром – туберкулез исключен. Проведена терапия: амоксициллин/клавулановая кислота, лимфомиазот, постепенно лимфоузлы регрессировали. Повторно указанная группа лимфоузлов увеличилась в июне 2018 г. на фоне острой респираторной вирусной инфекции, причем в значительно большей степени, чем в предыдущий раз. В августе пациентку госпитализировали, провели биопсию лимфоузла, при гистологическом исследовании выявлена лимфома Ходжкина, смешанно-клеточный вариант. Пациентку направили в онкодиспансер, где выполнили повторную биопсию, при иммуногистохимическом исследовании патологических вариантов экспрессии CD20, Pax-5, bcl-2, bcl-6, Cycin D1, CD15, CD30, Cd3, ALK, panCK AE1/3, Ki-67 не выявлено, по данным гистологического исследования обнаружены множественные мелкие очаги абсцедирования с перифокальными скоплениями эпителиоидных клеток, лимфоцитов, гистиоцитов. Заключение: гранулематозный некротизирующий лимфаденит, рекомендована консультация ревматолога. После выписки из стационара лимфоузлы постепенно уменьшились
в размерах, но через несколько месяцев вновь быстро увеличились. При обследовании у ревматолога данных за системное ревматическое заболевание не получено, но обнаружено очень выраженное снижение содержания γ-фракции белков сыворотки крови, в связи с чем пациентку направили к аллергологу-иммунологу для исключения иммунодефицита.
Данные физикального обследования. Состояние удовлетворительное. Рост 164 см, масса тела 47 кг. Кожные покровы и видимые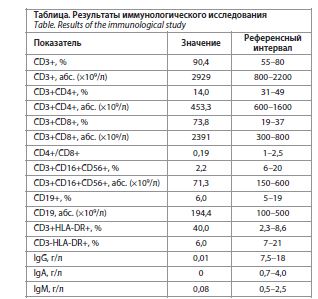 слизистые обычной окраски, умеренно влажные. Пальпируются подчелюстные лимфоузлы плотной консистенции размером с грецкий орех, подвижные, безболезненные, не спаянные с кожей и окружающими тканями. Движения в суставах сохранены в полном объеме. В легких дыхание везикулярное, хрипы не выслушиваются. Тоны сердца приглушены, ритм правильный, частота сердечных сокращений 72 уд/мин, артериальное давление 125/80 мм рт. ст. Язык влажный, с незначительным белым налетом у корня. Живот мягкий, безболезненный. Нижняя граница печени – по краю реберной дуги. Селезенка не пальпируется. Физиологические отправления в норме.
слизистые обычной окраски, умеренно влажные. Пальпируются подчелюстные лимфоузлы плотной консистенции размером с грецкий орех, подвижные, безболезненные, не спаянные с кожей и окружающими тканями. Движения в суставах сохранены в полном объеме. В легких дыхание везикулярное, хрипы не выслушиваются. Тоны сердца приглушены, ритм правильный, частота сердечных сокращений 72 уд/мин, артериальное давление 125/80 мм рт. ст. Язык влажный, с незначительным белым налетом у корня. Живот мягкий, безболезненный. Нижняя граница печени – по краю реберной дуги. Селезенка не пальпируется. Физиологические отправления в норме.
Рентгенограмма органов грудной клетки. Постпневмонический фиброз левого легкого.
Лабораторные исследования. Общий анализ крови и мочи – в пределах нормы. ANA – отрицательные, анти-ДНК – 17 ЕД/мл (норма 0–30 ЕД/мл), анти-Scl-70 – 1,2 ЕД/мл (норма 0–15 ЕД/мл), ANCA – отрицательные, ревматоидный фактор – отрицательный,
С-реактивный белок – 24 мг/л (норма до 6 мг/л). Электрофорез белков сыворотки крови: общий белок –
58 г/л, (норма 64–83 г/л), альбумин – 33,8 г/л – 58,3% (норма 50–65%) , глобулины: α1 – 12,4% (норма 2–6%), α2 – 10,3% (норма 6–12%), β1 – 6,4% (норма 5–14,5%),
β2 – 3,7% (норма 5–14,5%), γ – 1,8% (норма 9,5–22%).
Результаты иммунологического исследования представлены в таблице.
Обсуждение Как видно из таблицы, у пациентки фактически имеется агаммаглобулинемия, хотя количество В-лимфоцитов в пределах нормы. Определить содержание переключенных В-клеток памяти (CD19+CD27+IgD-) не позволяли возможности лаборатории. Не менее интересной находкой было существенное снижение количества CD3+CD4+ лимфоцитов (особенно относительного) и очень большое количество CD3+CD8+ лимфоцитов. За счет этого дисбаланса соотношение CD4+/CD8+ (иммунорегуляторный индекс) был очень низким (практически в 10 раз ниже нормы). Подобные изменения считаются достаточно характерными для ОВИН, их связывают с нарушением передачи сигнала через мембрану CD4+ Т-лимфоцитов-хелперов (дефекты генов CD40L, цитокинов, главного комплекса гистосовместимости), большей подверженности этой субпопуляции апоптозу, а также более медленным восстановлением периферического пула CD4+ лимфоцитов [12, 14, 15].
Тем не менее, учитывая крайне низкое содержание CD3+CD4+ лимфоцитов, наличие лимфоаденопатии, снижение массы тела, было рекомендовано обследование на ВИЧ-инфекцию. Результаты обследования (иммуно-блот, полимеразная цепная реакция) – отрицательные. Хорошо известно, что при ОВИН серологические методы диагностики инфекций неинформативны, так как количество специфических антител может быть ниже предела чувствительности лабораторного метода, поэтому в рекомендациях это было специально оговорено. Основным клиническим симптомом у данной пациентки была рецидивирующая лимфаденопатия, что не очень характерно для ОВИН, так как проявления патологической лимфопролиферации обычно бывают стойкими. Морфологические изменения (гранулематозный лимфаденит) тоже соответствовали критериям ОВИН. В анамнезе были диарейный синдром неясного генеза и некие транзиторные изменения в общем анализе крови. Следует отметить, что пациенты с ОВИН при нетяжелых гастроинтестинальных проявлениях сами об этом говорят редко, приходится задавать наводящие вопросы. Наиболее известный симптомокомплекс ОВИН – рецидивирующие синопульмональные инфекции – за исключением однократной бронхопневмонии отсутствовал. Считается, что нарушения Т-клеток более характерны именно для неинфекционных симптомов ОВИН и ассоциируются с более высоким риском летальности, степень этих нарушений также коррелирует с летальностью и 5-летней выживаемостью [6, 16]. На этом основании высказано предположение, что часть таких больных с серьезными дефектами в Т-клеточном звене следует отнести к группе комбинированных иммунодефицитов с поздним дебютом [16]. В 2019 г. Европейское общество иммунодефицитов (ESID) после уточнения критериев ОВИН переквалифицировало 8% взрослых и 27% детей, включенных в Европейский регистр, в 22 других вида иммунодефицитов (главным образом, на основании молекулярно-генетических исследований). Таким образом, это клиническое наблюдение подтверждает сложности со своевременной диагностикой ОВИН. По данным литературы, задержка с постановкой диагноза в среднем составляет 10,5–14,5 года и лишь у 10,5% больных диагноз устанавливают в течение 1 года после начала заболевания [5, 17].
Основным методом лечения больных с ОВИН является пожизненная заместительная терапия препаратами Ig для внутривенного введения. Разработаны более удобные лекарственные формы для подкожного применения, но в России они только появились и широко не используются. Учитывая очень низкий уровень IgG, была рекомендована терапия в насыщающем режиме (40 г ежемесячно) с контролем претрансфузионного уровня, после достижения уровня 5 г/л коррекция дозы из расчета 400 мг/кг ежемесячно. Сначала данные рекомендации не были выполнены в полном объеме, фактически пациентка получила однократно 30 г препарата, а затем по 5 г ежемесячно. Претрансфузионный уровень IgG – 1,2 г/л. В результате через несколько месяцев у нее развилась двусторонняя пневмония, после этого терапия была скорректирована. Дополнительно рекомендованы ежегодная компьютерная томография органов грудной клетки (для своевременной диагностики интерстициальной болезни легких, гранулематозных изменений), наблюдение гематолога и гастроэнтеролога по месту жительства с проведением всех необходимых инструментальных исследований.
Заключение
Конечно, можно и нужно проводить разнообразные исследования, касающиеся молекулярно-генетических механизмов и особенностей иммунопатогенеза ПИД, но в итоге все это делается для реального выхода в рутинную клиническую практику. К сожалению, в отношении большинства ПИД, в том числе и ОВИН, особенно у взрослых, можно констатировать, что практикующие врачи до сих пор их не рассматривают при проведении дифференциального диагноза. Элементарный лабораторный анализ с определением фракций белков может стать отправной точкой для последующей оценки содержания сывороточных Ig, более детального сбора анамнеза и назначения дополнительных инструментальных исследований. Несоблюдение режима заместительной терапии препаратами Ig для внутривенного введения чревато серьезными осложнениями, вплоть до летального исхода.
Москалец Оксана Владимировна – канд. мед. наук, вед. науч. сотр. лаб. биомедицинских методов исследований ГБУЗ МО МОНИКИ им. М. Ф. Владимирского. E-mail: 6816000@mail.ru; ORCID: 0000-0002-6118-6465
Oksana V. Moskalets – Cand. Sci. (Med.), Moscow Regional Research аnd Clinical Institute. E-mail: 6816000@mail.ru; ORCID: 0000-0002-6118-6465
Статья поступила в редакцию / The article received: 18.07.2022
Конфликт интересов. Автор заявляет об отсутствии конфликта интересов.
Conflict of interests. The author declares that there is not conflict of interests.
Клинический разбор в общей медицине №3 2022
Общая вариабельная иммунная недостаточность: сложности своевременной диагностики (клинический случай)
Аннотация
Общая вариабельная иммунная недостаточность (ОВИН) относится к группе первичных иммунодефицитов с преимущественной недостаточностью синтеза антител и наиболее часто встречающимся диагнозом среди клинически значимых случаев первичных иммунодефицитов у взрослых. Основным лабораторным критерием этого заболевания считается гипогаммаглобулинемия (снижение иммуноглобулина – IgG менее 4,5 г/л при снижении уровня IgA, с/без снижения уровня IgM). Клинические проявления ОВИН разнообразны: инфекционный синдром (хронические инфекции нижних дыхательных путей и ЛОР-органов, инфекционная диарея, септический артрит), аутоиммунный синдром (цитопении, системные ревматические заболевания), неинфекционная патология желудочно-кишечного тракта (синдромы, подобные целиакии или воспалительным заболеваниям кишечника, нодулярная гиперплазия слизистой), интерстициальные заболевания легких, патологическая незлокачественная лимфопролиферация (лимфаденопатия, гепатоспленомегалия), онкологические заболевания, образование неказеозных гранулем во внутренних органах. Из-за отсутствия типичной клинической картины диагноз ОВИН у взрослых часто устанавливают с многолетним опозданием, особенно если в клинической картине доминируют неинфекционные проявления. В статье представлен клинический случай, когда у пациентки на протяжении ескольких лет основным симптомом была рецидивирующая лимфаденопатия. После обследования у разных специалистов ее направили к иммунологу на основании выявленной гипопротеинемии и резкого снижения γ-фракции глобулинов. При иммунологическом исследовании обнаружены агаммаглобулинемия и выраженный дисбаланс субпопуляций Т-лимфоцитов (существенное снижение количества CD4+ клеток и повышение CD8+ клеток). Обсуждается клиническая значимость нарушений Т-лимфоцитов при ОВИН, необходимость лечения препаратами внутривенных Ig в адекватных дозах. Ключевые слова: первичный иммунодефицит, общая вариабельная иммунная недостаточность, гранулематозный некротический лимфаденит, субпопуляции Т-лимфоцитов, внутривенные иммуноглобулины. Для цитирования: Москалец О.В. Общая вариабельная иммунная недостаточность: сложности своевременной диагностики (клинический случай). Клинический разбор в общей медицине. 2022; 3: 60–63. DOI: 10.47407/kr2022.3.3.00137
Common variable immunodeficiency: difficulties in timely diagnosis (clinical case)
Oksana V. Moskalets
Abstract
Common variable immunodeficiency (CVID) belongs to the group of primary immunodeficiencies with a predominant deficiency in antibody synthesis and the most common diagnosis among clinically significant cases of primary immunodeficiency in adults. The main laboratory criterion for this disease is considered to be hypogammaglobulinemia (a decrease in the level of IgG less than 4.5 g/l with a decrease in the level of IgA, with/without a decrease in the level of IgM). Clinical manifestations of CVID are diverse: infectious syndrome (chronic infections of the lower respiratory tract, sinusitis, otitis, infectious diarrhea, septic arthritis), autoimmune syndrome (cytopenias, systemic rheumatic diseases), non-infectious pathology of the gastrointestinal tract (celiac-like or IBD-like syndromes , nodular hyperplasia of the mucosa), interstitial lung diseases, pathological non-malignant lymphoproliferation (lymphadenopathy, hepatosplenomegaly), oncological diseases, the formation of non-caseating granulomas in the internal organs). Due to the lack of a typical clinical picture, the diagnosis of CVID in adults is often made many years late, especially if the clinical picture is dominated by non-infectious manifestations. The article presents a clinical case when the patient had recurrent lymphadenopathy as the main symptom for several years. After examination by various specialists, she was referred to an immunologist because hypoproteinemia and a sharp decrease in the gamma fraction of globulins have been revealed. An immunological study revealed agammaglobulinemia and a pronounced imbalance of T-lymphocyte subpopulations (a significant decrease in the number of CD4+ cells and an increase in CD8+ cells). The clinical significance of T-lymphocyte disorders in CVID, the need for treatment with adequate doses of intravenous immunoglobulins are discussed.
Key words: primary immunodeficiency, common variable innunodeficiency, granulomatous necrotizing lymphadenitis, T-lymphocyte subsets, intravenous immunoglobulins.
For citation: Moskalets O.V. Common variable immunodeficiency: difficulties in timely diagnosis (clinical case). Clinical review for general practice. 2022; 3: 60–63. DOI: 10.47407/kr2022.3.3.00137
Первичные иммунодефициты (ПИД) с преимущественной недостаточностью синтеза антител являются самым распространенным вариантом из всех ПИД (около 60%) [1–3]. Данная группа достаточно гетерогенна как по механизмам развития, так и по клинико-лабораторным характеристикам. Одной из форм ПИД с преимущественной недостаточностью синтеза антител является общая вариабельная иммунная недостаточность (ОВИН). Это наиболее часто встречающийся диагноз среди клинически значимых случаев ПИД у взрослых. Основным лабораторным критерием ОВИН у взрослых являются снижение уровня иммуноглобулина (Ig) G менее 4,5 г/л и IgA с/без снижения уровня IgM, а также снижение количества переключенных В-клеток памяти (CD19+CD27+IgD-). Общее количество В-лимфоцитов (CD19+ клетки) может быть и нормальным, и сниженным. [4]. Истинная распространенность ОВИН, как и остальных вариантов ПИД, точно неизвестна, так как многое зависит от уровня диагностики и состояния здравоохранения в целом. Приводятся данные от 1:10 000 до 1:340 000 [3–7]. В большинстве случаев установить генетическую основу заболевания не представляется возможным. Примерно у 10–15% больных выявлены мутации в генах, детерминирующих формирование и функциональную активность В-лимфоцитов. Наиболее известны мутация гена TNFRSF13B, кодирующего белок трансмембранный активатор и модулятор кальция (TACI), который при взаимодействии с двумя другими белками – BAFF и APRIL участвует в активации ряда транскрипционных факторов, переключении изотипов Ig, кооперации
В-лимфоцитов с антигенпрезентирующими клетками, дефекты самого BAFF, CD19, CD20, CD21, CD81, приводящие к нарушению разных этапов дифференцировки
В-лимфоцитов, а также дефект ICOS, приводящий к нарушению передачи сигнала с активированных Т-лимфоцитов, который тоже необходим для дифференцировки
В-лимфоцитов, а также влияет на продукцию интерлейкина-10, связанного с образованием В-клеток памяти и плазматических клеток [5–7]. Следует отметить, что от 30 до 50% пациентов имеют те или иные изменения в Т-клеточном звене: снижение функциональной активности при стимуляции митогенами, снижение количества регуляторных Т-лимфоцитов, наивных CD4+ Т-лимфоцитов, увеличение количества Т-клеток памяти и фолликулярных Т-хелперов, повышенную экcпрессию маркера апоптоза CD95 на Т-лимфоцитах и др. [6, 8–11].
При ОВИН отмечают 2 пика заболеваемости: в возрасте 2–5 и 18–25 лет [12, 13]. Характерных клинических симптомов нет, заболевание имеет разные «маски», причем у одного пациента может наблюдаться сразу или поочередно несколько симптомокомплексов. Чаще всего встречается инфекционный синдром: синопульмональные инфекции (70–80% случаев), инфекции желудочно-кишечного тракта, вызванные вирусами или простейшими, инфекционные артриты. Неинфекционные проявления включают аутоиммунный синдром (цитопении, ревматоидый артрит, СКВ-подобный синдром, васкулиты), неинфекционную патологию желудочно-кишечного тракта (синдромы, подобные целиакии или воспалительным заболеваниям кишечника, нодулярная гиперплазия слизистой оболочки), онкологические заболевания (в первую очередь, лимфомы), патологическую лимфопролиферацию (лимфаденопатии, спленомегалия, иногда гепатомегалия), интерстициальную болезнь легких, образование неказеозных гранулем в разных органах (саркоидоподобные изменения в легких и др.) [5, 7, 12, 13]. Следует отметить, что неинфекционные проявления встречаются у 70% больных [11].
Ниже рассматривается случай ОВИН, когда в клинической картине преобладали именно неинфекционные проявления.
Клинический случай
Больная К. 46 лет обратилась к аллергологу-иммунологу с жалобами на увеличение подчелюстных лимфоузлов, быструю утомляемость, похудение.
Анамнез. В 2014 г. перенесла левостороннюю нижнедолевую пневмонию. До этого считала себя практически здоровой, болела острыми респираторными инфекциями 2–3 раза в год, но при детальном расспросе вспомнила, что бывали периоды, когда в течение нескольких недель отмечался учащенный неоформленный стул. Со слов пациентки, после выписки из стационара в общем анализе крови были какие-то изменения, в связи с чем ее направили к гематологу. Проведена стернальная пункция, заболеваний крови не выявлено. До октября 2016 г. чувствовала себя удовлетворительно, затем отметила увеличение подчелюстных лимфоузлов, по поводу чего вновь была направлена к гематологу. Проведена трепанобиопсия, выявлены вторичные изменения гемопоэза, признаков поражения, характерных для лимфомы, не обнаружено. Биопсия лимфоузла: в пределах исследованного материала элементов злокачественного роста/данных за лимфому, в том числе лимфому Ходжкина, не получено. Консультирована фтизиатром – туберкулез исключен. Проведена терапия: амоксициллин/клавулановая кислота, лимфомиазот, постепенно лимфоузлы регрессировали. Повторно указанная группа лимфоузлов увеличилась в июне 2018 г. на фоне острой респираторной вирусной инфекции, причем в значительно большей степени, чем в предыдущий раз. В августе пациентку госпитализировали, провели биопсию лимфоузла, при гистологическом исследовании выявлена лимфома Ходжкина, смешанно-клеточный вариант. Пациентку направили в онкодиспансер, где выполнили повторную биопсию, при иммуногистохимическом исследовании патологических вариантов экспрессии CD20, Pax-5, bcl-2, bcl-6, Cycin D1, CD15, CD30, Cd3, ALK, panCK AE1/3, Ki-67 не выявлено, по данным гистологического исследования обнаружены множественные мелкие очаги абсцедирования с перифокальными скоплениями эпителиоидных клеток, лимфоцитов, гистиоцитов. Заключение: гранулематозный некротизирующий лимфаденит, рекомендована консультация ревматолога. После выписки из стационара лимфоузлы постепенно уменьшились
в размерах, но через несколько месяцев вновь быстро увеличились. При обследовании у ревматолога данных за системное ревматическое заболевание не получено, но обнаружено очень выраженное снижение содержания γ-фракции белков сыворотки крови, в связи с чем пациентку направили к аллергологу-иммунологу для исключения иммунодефицита.
Данные физикального обследования. Состояние удовлетворительное. Рост 164 см, масса тела 47 кг. Кожные покровы и видимые
Рентгенограмма органов грудной клетки. Постпневмонический фиброз левого легкого.
Лабораторные исследования. Общий анализ крови и мочи – в пределах нормы. ANA – отрицательные, анти-ДНК – 17 ЕД/мл (норма 0–30 ЕД/мл), анти-Scl-70 – 1,2 ЕД/мл (норма 0–15 ЕД/мл), ANCA – отрицательные, ревматоидный фактор – отрицательный,
С-реактивный белок – 24 мг/л (норма до 6 мг/л). Электрофорез белков сыворотки крови: общий белок –
58 г/л, (норма 64–83 г/л), альбумин – 33,8 г/л – 58,3% (норма 50–65%) , глобулины: α1 – 12,4% (норма 2–6%), α2 – 10,3% (норма 6–12%), β1 – 6,4% (норма 5–14,5%),
β2 – 3,7% (норма 5–14,5%), γ – 1,8% (норма 9,5–22%).
Результаты иммунологического исследования представлены в таблице.
Обсуждение Как видно из таблицы, у пациентки фактически имеется агаммаглобулинемия, хотя количество В-лимфоцитов в пределах нормы. Определить содержание переключенных В-клеток памяти (CD19+CD27+IgD-) не позволяли возможности лаборатории. Не менее интересной находкой было существенное снижение количества CD3+CD4+ лимфоцитов (особенно относительного) и очень большое количество CD3+CD8+ лимфоцитов. За счет этого дисбаланса соотношение CD4+/CD8+ (иммунорегуляторный индекс) был очень низким (практически в 10 раз ниже нормы). Подобные изменения считаются достаточно характерными для ОВИН, их связывают с нарушением передачи сигнала через мембрану CD4+ Т-лимфоцитов-хелперов (дефекты генов CD40L, цитокинов, главного комплекса гистосовместимости), большей подверженности этой субпопуляции апоптозу, а также более медленным восстановлением периферического пула CD4+ лимфоцитов [12, 14, 15].
Тем не менее, учитывая крайне низкое содержание CD3+CD4+ лимфоцитов, наличие лимфоаденопатии, снижение массы тела, было рекомендовано обследование на ВИЧ-инфекцию. Результаты обследования (иммуно-блот, полимеразная цепная реакция) – отрицательные. Хорошо известно, что при ОВИН серологические методы диагностики инфекций неинформативны, так как количество специфических антител может быть ниже предела чувствительности лабораторного метода, поэтому в рекомендациях это было специально оговорено. Основным клиническим симптомом у данной пациентки была рецидивирующая лимфаденопатия, что не очень характерно для ОВИН, так как проявления патологической лимфопролиферации обычно бывают стойкими. Морфологические изменения (гранулематозный лимфаденит) тоже соответствовали критериям ОВИН. В анамнезе были диарейный синдром неясного генеза и некие транзиторные изменения в общем анализе крови. Следует отметить, что пациенты с ОВИН при нетяжелых гастроинтестинальных проявлениях сами об этом говорят редко, приходится задавать наводящие вопросы. Наиболее известный симптомокомплекс ОВИН – рецидивирующие синопульмональные инфекции – за исключением однократной бронхопневмонии отсутствовал. Считается, что нарушения Т-клеток более характерны именно для неинфекционных симптомов ОВИН и ассоциируются с более высоким риском летальности, степень этих нарушений также коррелирует с летальностью и 5-летней выживаемостью [6, 16]. На этом основании высказано предположение, что часть таких больных с серьезными дефектами в Т-клеточном звене следует отнести к группе комбинированных иммунодефицитов с поздним дебютом [16]. В 2019 г. Европейское общество иммунодефицитов (ESID) после уточнения критериев ОВИН переквалифицировало 8% взрослых и 27% детей, включенных в Европейский регистр, в 22 других вида иммунодефицитов (главным образом, на основании молекулярно-генетических исследований). Таким образом, это клиническое наблюдение подтверждает сложности со своевременной диагностикой ОВИН. По данным литературы, задержка с постановкой диагноза в среднем составляет 10,5–14,5 года и лишь у 10,5% больных диагноз устанавливают в течение 1 года после начала заболевания [5, 17].
Основным методом лечения больных с ОВИН является пожизненная заместительная терапия препаратами Ig для внутривенного введения. Разработаны более удобные лекарственные формы для подкожного применения, но в России они только появились и широко не используются. Учитывая очень низкий уровень IgG, была рекомендована терапия в насыщающем режиме (40 г ежемесячно) с контролем претрансфузионного уровня, после достижения уровня 5 г/л коррекция дозы из расчета 400 мг/кг ежемесячно. Сначала данные рекомендации не были выполнены в полном объеме, фактически пациентка получила однократно 30 г препарата, а затем по 5 г ежемесячно. Претрансфузионный уровень IgG – 1,2 г/л. В результате через несколько месяцев у нее развилась двусторонняя пневмония, после этого терапия была скорректирована. Дополнительно рекомендованы ежегодная компьютерная томография органов грудной клетки (для своевременной диагностики интерстициальной болезни легких, гранулематозных изменений), наблюдение гематолога и гастроэнтеролога по месту жительства с проведением всех необходимых инструментальных исследований.
Заключение
Конечно, можно и нужно проводить разнообразные исследования, касающиеся молекулярно-генетических механизмов и особенностей иммунопатогенеза ПИД, но в итоге все это делается для реального выхода в рутинную клиническую практику. К сожалению, в отношении большинства ПИД, в том числе и ОВИН, особенно у взрослых, можно констатировать, что практикующие врачи до сих пор их не рассматривают при проведении дифференциального диагноза. Элементарный лабораторный анализ с определением фракций белков может стать отправной точкой для последующей оценки содержания сывороточных Ig, более детального сбора анамнеза и назначения дополнительных инструментальных исследований. Несоблюдение режима заместительной терапии препаратами Ig для внутривенного введения чревато серьезными осложнениями, вплоть до летального исхода.
Москалец Оксана Владимировна – канд. мед. наук, вед. науч. сотр. лаб. биомедицинских методов исследований ГБУЗ МО МОНИКИ им. М. Ф. Владимирского. E-mail: 6816000@mail.ru; ORCID: 0000-0002-6118-6465
Oksana V. Moskalets – Cand. Sci. (Med.), Moscow Regional Research аnd Clinical Institute. E-mail: 6816000@mail.ru; ORCID: 0000-0002-6118-6465
Статья поступила в редакцию / The article received: 18.07.2022
Конфликт интересов. Автор заявляет об отсутствии конфликта интересов.
Conflict of interests. The author declares that there is not conflict of interests.
22 сентября 2022
Количество просмотров: 600
