Клинический разбор в общей медицине №7 2023
1 Ulyanov Chuvash State University, Cheboksary, Russia;
2 Republic Clinical Hospital, Cheboksary, Russia;
3 Republic Cardiology Dispensary; Cheboksary, Russia
tlarisagast18@mail.ru
Abstract
The article describes a case of acute myocardial infarction with multiple atherosclerotic lesions of the coronary arteries in a working-age patient with ulcerative colitis, against of late initiation of pathogenetic therapy.
Key words: inflammatory bowel diseases, atherosclerosis, acute myocardial infarction, ulcerative colitis.
For citation: Tarasova L.V., Kucherova N.Yu., Tsyganova Ju.V. A case of acute myocardial infarction in a working-age patient with ulcerative colitis against the background of late initiation of pathogenetic therapy. Clinical review for general practice. 2023; 4 (7): 30–34 (In Russ.).
DOI: 10.47407/kr2023.4.7.00283
Параллельно публикуются работы о превалировании сердечно-сосудистых заболеваний (ССЗ) у пациентов с ВЗК по сравнению с популяцией в целом [2].
При этом ССЗ по-прежнему остаются ведущей причиной смертности как во всем мире, так и в России. Ежегодно от болезней сердца и сосудов в нашей стране умирают около миллиона человек, у еще большего количества снижается качество жизни и уровень трудоспособности, что делает их наиболее емкими по социально-экономическим последствиям [3, 4]. В связи с этим высокий интерес к сочетанию заболеваний сердечно-сосудистой системы и ВЗК обоснован и требует многогранного изучения.
По данным S. Weissman и соавт. (2020 г.), пациенты с ВЗК имеют более низкие уровни холестерина липопротеинов низкой плотности (ЛПНП) и общего холестерина, а также более низкие индекс массы тела и частоту гипертонии, чем пациенты без ВЗК [5]. Парадоксально, но при этом риск сердечно-сосудистых событий у пациентов с болезнью Крона и язвенным колитом выше по сравнению с населением в целом, особенно во время
обострения иммуноопосредованного воспалительного процесса [6].
Изучение данных регистров пациентов с ВЗК из 26 стран показало увеличение частоты острых артериальных событий (острого инфаркта миокарда – ОИМ и ишемического инсульта) у пациентов с ВЗК по сравнению с общей популяцией в 1,2 раза [7].
Крупное датское когортное исследование пациентов с ВЗК выявило увеличение риска развития ишемической болезни сердца (ИБС) до 20% по сравнению с контрольной группой сопоставимого возраста, особенно в первый год после установления диагноза ВЗК [8]. Систематический обзор S. Singh также показал увеличенный на 19% риск ИБС, особенно среди женщин и лиц моложе 40–50 лет, страдающих ВЗК [9].
Необходимо отметить, что риск развития осложнений со стороны сердечно-сосудистой системы и обусловленных этим летальных исходов у пациентов с ВЗК, по данным крупных когортных исследований, не зависел от факта приема системных глюкокортикостероидов, но значительно увеличивался в период увеличения активности ВЗК [10].
Не все аспекты, посредством которых ВЗК потенцируют кардиоваскулярный риск, могут быть охвачены традиционными методиками оценки риска ССЗ, что может приводить к заниженной оценке риска и отсутствии своевременной и эффективной профилактики ССЗ у пациентов данной группы.
Анамнез заболевания. В течение 4 лет отмечал жжение в груди при физической нагрузке (рубка леса, работа на приусадебном участке) или в утренние часы после подъема, купировал приемом воды или сахара, нитратами не пользовался, постепенно сформировался стереотип стенокардии (функциональный класс II).
В течение трех последних дней после физических нагрузок (работал с подъемом тяжести) стал фиксировать кратковременные эпизоды жжения в грудной клетке, проходящие после приема воды самостоятельно. За медицинской помощью не обращался.
Ухудшение состояния отмечает с 20 ч 04.08.23, когда после посещения бани стал отмечать потливость, резкую слабость, жжение за грудиной с переходом в давящую боль, сопровождаемую нехваткой воздуха. Привычными средствами болевой синдром не купировался, а интенсивность боли нарастала, в связи с чем была вызвана бригада скорой медицинской помощи. На электрокардиограмме (ЭКГ), снятой врачом скорой медицинской помощи, зарегистрирован синусовый ритм с подъемом сегмента ST в отведениях I, II, III, аVF, V4-V6, патологический зубец Q в отведениях II, III, aVF. Оказана помощь: гепарин 5 тыс. ЕД, клопидогрель 300 мг, аспирин 250 мг, морфин 1% – 1,0 внутривенно струйно, ввиду сохранения боли в грудной клетке с повторным введением. Пациент доставлен в приемный покой РСЦ через 3 ч от момента появления загрудинных болей, в состоянии купированного приступа.
Из анамнеза жизни: никогда не курил, алкоголь употребляет редко в умеренных количествах. Наследственность по артериальной гипертензии, ИБС не отягощена. В течение 6 лет отмечал вздутие в животе, периодически примесь крови в кале, не обследовался, диспансеризацию не проходил, несмотря на активные приглашения по телефону страховых медицинских представителей. Год назад пациент впервые обратился к участковому терапевту в связи с учащением диареи до 5–6 раз в сутки и появлением устойчивой примеси слизи и крови в каловых массах. Был верифицирован диагноз – язвенный колит, хроническое рецидивирующее течение, тотальное поражение, среднетяжелая атака, и пациент был взят на диспансерное наблюдение у врача-терапевта, согласно приказу Минздрава Российской Федерации «Об утверждении порядка проведения диспансерного наблюдения за взрослыми» №168 н от 15 марта 2022 г.
По данным колоноскопии, картина язвенного колита (диффузная гиперемия и отек слизистой кишки, стертость сосудистого рисунка на всем протяжении, субэпителиальные геморрагии с умеренно выраженной контактной ранимостью, множественные эрозии до 3–5 мм, единичные полигональные язвы до 0,7 см, единичные псевдополипы в прямой и сигмовидной кишке). Патологогистологическое исследование биопсийного материала: лимфоплазмоцитарная инфильтрация собственной пластинки слизистой оболочки толстой кишки, уменьшение количества бокаловидных клеток, деформация крипт и формирование крипт-абсцессов. Пациенту была назначена терапия месалазином в таблетках в суточной дозе 4–5 г/сут в комбинации с месалазином в микроклизмах и свечах. В связи с положительным ответом на терапию сульфапрепаратами она была продолжена до 8 нед с последующим переводом на поддерживающие дозы месалазина. Чрез 10 мес пациент начал отмечать учащение стула, появление примеси слизи в кале, и был переведен на системные глюкокортикостероиды (ГКС) в дозе 60 мг/сут в комбинации с азатиоприном 2 мг/кг в сутки, на которой находился до момента появления болевого синдрома за грудиной.
Объективно при поступлении: состояние средней степени тяжести. Пациент нормостенического телосложения. Рост 158 см, масса тела 52 кг, индекс массы тела (ИМТ) 22 кг/м2. Кожные покровы бледные, тургор удовлетворительный. Над всеми легочными полями выслушивалось везикулярное дыхание, частота дыхательных движений 18 в минуту. Границы относительной сердечной тупости – в пределах нормы. Тоны сердца приглушены, ритм правильный. Частота сердечных сокращений (ЧСС) – 90 уд/мин, артериальное давление (АД) – 125/80 мм рт. ст. на обеих руках. Живот мягкий, чувствительный при пальпации в левой подвздошной области. Печень не увеличена в размерах. Периферических отеков нет.
По ЭКГ в стационаре: регистрировались признаки нарушения коронарного кровообращения в миокарде нижней и передне-верхушечно-боковой области левого желудочка (QS во II, зубец Q в III); элевация сегмента ST до 3,0 мм с переходом в положительный зубец Т в отведениях II, III, aVF, V4-V6; депрессия сегмента ST до 0,5 мм в отведении aVL. Уровень Тропонина I при поступлении составил 2871 нг/л.
По данным эхокардиографии: камеры сердца не расширены, выявлена гипокинезия заднего сегмента в апикальном отделе левого желудочка, гипокинезия всех задних сегментов в среднем и базальном отделах левого желудочка, снижение сократительной способности миокарда левого желудочка (фракция выброса – 48%, фракция укорочения – 24,5%), признаки атеросклероза аорты, аортального клапана.
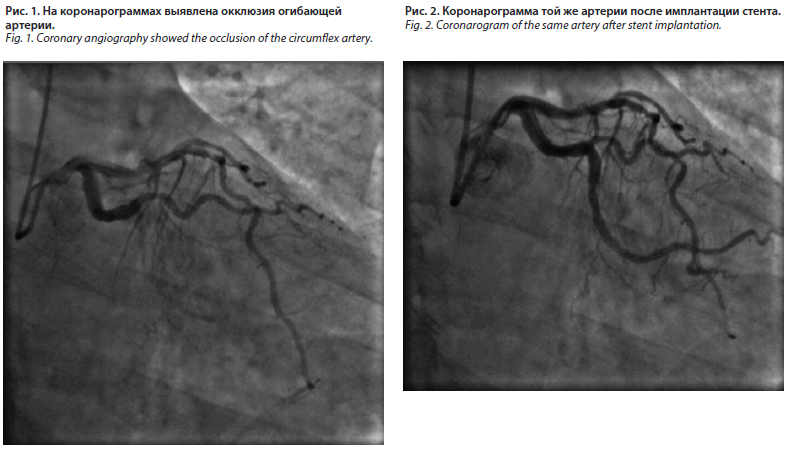
По данным экстренной коронароангиографии выявлены: окклюзия огибающей артерии, стенозы передней нисходящей артерий до 35–55%, первой диагональной ветви до 40–55%, правой коронарной артерии до 40–45% (рис. 1).
Выполнено экстренное чрескожное коронарное вмешательство: баллонная ангиопластика огибающей артерии с имплантацией cтента с лекарственным покрытием (рис. 2).
В общем анализе крови выявлен лейкоцитоз (13,1×109/л), тромбоцитоз (455×109/л), нормохромная анемия легкой степени тяжести (гемоглобин – 107 г/л, средний объем эритроцита – 80 фл, среднее содержание гемоглобина в эритроците – 29,3 пг, средняя концентрация гемоглобина в эритроците – 365 г/л).
В липидограмме на фоне относительно невысокого содержания общего холестерина (3,2 ммоль/л) и ЛПНП (1,8 ммоль/л) наблюдалось низкое содержание липопротеинов высокой плотности (ЛПВП) – 0,7 ммоль/л.
В биохимическом анализе крови наблюдалось значительное повышение аспартатаминотрансферазы – 280 U/L, что объяснимо острой стадией инфаркта миокарда.
Также наблюдалось незначительное снижение сывороточного железа до 8,9 ммоль/л. Показатели глюкозы крови, билирубина, аланинаминотрансферазы, щелочной фосфатазы, креатинина, мочевины, электролитов, коагулограммы были в пределах референсных значений.
При суточном мониторировании ЭКГ зарегистрирован синусовый ритм с ЧСС 55–108 уд/мин, одиночная предсердная экстрасистолия (всего: 32), ишемические изменения в миокарде не выявлены.
При ультразвуковой допплерографии брахиоцефальных сосудов выявлены признаки нестенозирующего атеросклероза: утолщение комплекса «интима–медиа» до 1,2–1,3 мм.
При динамическом контроле ЭКГ наблюдалась текущая динамика ОИМ нижней, нижне-боковой стенки левого желудочка с распространением на базальные отделы, с ЧСС с 94 до 67 в мин, некоторое увеличение степени инверсии зубца Т в отведениях II, III, аVF, V6.
Пациенту был выставлен диагноз: ишемическая болезнь сердца: острый инфаркт миокарда с подъемом сегмента ST, Q-образующий нижне-боковой стенки левого желудочка.
На фоне проводимой терапии (β-адреноблокаторы, ингибиторы ангиотензинпревращающего фермента, ацетилсалициловая кислота, клопидогрель, низкомолекулярные гепарины, статины) приступы стенокардии не рецидивировали, достигнута возможность ходьбы до 1 км/сут в 4–5 приемов с адекватной реакцией АД и ЧСС. На фоне введения антикоагулянтов, двойной
дезагрегантной терапии у пациента появилась постоянная примесь крови и слизи в кале, боли в левой половине живота, участился стул до 5–7 раз в сутки.
По данным колоноскопии выраженная активность язвенного колита по Shroeder 3: слизистая оболочка толстой кишки на всем протяжении отечна, диффузно гиперемирована, сосудистый рисунок смазан, контактно ранимая, с множественными очагами геморрагии, в сигмовидной, нисходящей ободочной кишке множественные эрозии до 3–6 мм, в нисходящей, поперечно ободочной кишках полигональные язвенные дефекты, полиповидные образования.
В связи с наличием клинических показателей тяжелой атаки язвенного колита, согласно индексу Мейо, лабораторных признаков высокой активности язвенного колита (лейкоцитоз до 11,2×109/л, С-реактивный белок – 12 мг/л, фекальный кальпротектин – 965 мкг/г), а также в связи с негативным влиянием базисной ГКС-терапии на сердечно-сосудистую систему для подбора биологической терапии и осуществления мультидисциплинарного ведения (гастроэнтеролог, кардиолог) пациент переведен в гастроэнтерологическое отделение специализированного Республиканского центра по диагностике и лечению ВЗК Бюджетного учреждения «Республиканская клиническая больница» Минздрава Чувашской Республики.
Представленный клинический случай интересен развитием выраженного атеросклеротического поражения коронарных артерий, осложнившегося ОИМ, у пациента с низкой приверженностью к комплексу мероприятий, направленных на раннее выявление заболеваний (профилактический медицинский осмотр, диспансеризация). Позднее обращение к врачу первичного звена по поводу появления клинически значимых и патогномоничных симптомов ВЗК привело к запоздалой диагностике язвенного колита и несвоевременному началу патогенетической терапии и способствовало реализации патогенетического каскада сердечно-сосудистых событий у молодого пациента без привычных факторов сердечно-сосудистого риска.
Хронический воспалительный процесс в стенке кишки, особенно поздно диагностированный, вызывает окислительный стресс, повышенное образование и высвобождение провоспалительных цитокинов: интерлейкинов (ИЛ)-1, ИЛ-6, фактора некроза опухоли (ФНО)-α, под действием которых происходит избыточная экспрессия молекул адгезии и миграция лимфоцитов и моноцитов через эндотелий. Описанные изменения приводят к развитию эндотелиальной дисфункции: снижению продукции оксида азота (NO), повышению продукции матриксных металлопротеиназ, коллагеназы, эластаз, ремоделированию сосудистой стенки с увеличением ее жесткости. Снижение уровня NO способствует уменьшению релаксации гладкомышечных клеток, а передача сигналов ФНО-α индуцирует экспрессию маркеров остеобластов в гладкомышечных клетках, что приводит к усилению кальцификации и утолщению интимы сосудов [11–14].
Изменение нормального функционирования кишечной микробиоты на фоне ВЗК также влияет на ускорение атеросклеротического воспаления сосудистой стенки. Увеличение количества провоспалительных представителей типов Proteobacteria (Escherichia coli и Bacteriodetes) при ВЗК, а также снижение бактериальной выработки бутирата короткоцепочечных жирных кислот, являющихся важнейшими регуляторами липидного метаболизма, способствует поддержанию и прогрессии локального кишечного воспаления, усугубляет дисбиоз и нарушает барьерную функцию кишечного эпителия, за счет чего происходит эндотелиальная транслокация бактериальных метаболитов, запуск и поддержание системного воспалительного иммунного ответа, неизбежно приводящего к ускорению процесса атерогенеза [15].
Нарушение нормальной работы биоценоза кишечника при ВЗК приводит к повышенному бактериальному производству ТМА (триметиламин), который окисляется в печени до проатерогенного метаболита ТМАО (триметиламин – N-оксид). ТМАО также способствует атерогенезу, вмешиваясь в транспортировку холестерина, увеличивает образование пенистых клеток и агрегацию тромбоцитов, причем последнее играет ведущую и потенцирующую роль в развитии острых коронарных событий [16, 17].
Невозможно не подчеркнуть участие в формировании и прогрессирование атеротромботических изменений у пациентов с длительным системным воспалением отдельных фракций липопротеидов и гомоцистеина. Так, ЛПНП при системном воспалении подвергаются различным химическим модификациям – окислению, ацетилированию, карбамилированию, гликированию. Модифицированные ЛПНП дольше задерживаются в интиме и активнее фагоцитируются макрофагами, чем нативные ЛПНП, что определяет их высокую атерогенность [16, 17]. У пациентов с ВЗК также снижены концентрация ЛПВП и их антиоксидантная способность [11].
Доказано, что феномен гипергомоцистеинемии чаще встречается у пациентов с ВЗК, по сравнению с общей популяцией, и способствует увеличению вероятности атеротромбоза за счет образования агрегатов тиолактона гомоцистеина с ЛПНП, активации пенистых клеток, повышенной выработке ими активных кислородных метаболитов, которые способствуют повреждению эндотелия, пролиферации гладкомышечных клеток сосудистой стенки и запуску процесса клеточного окисления ЛПНП в субэндотелиальном слое артериальной стенки [12].
В основе процесса преждевременного атерогенеза при ВЗК лежат процессы хронического местного, позже системного воспаления, окислительный стресс, кишечный дисбиоз, приводящие к развитию эндотелиальной дисфункции и специфической дислипидемии, характеризующейся низким содержание ЛПВП на фоне высокой атерогенности модифицированных ЛПНП при более низком их уровне по сравнению с общей популяцией.
Механизмы, посредством которых ВЗК повышают кардиоваскулярный риск, не могут быть оценены традиционными шкалами риска ССЗ. Актуальными являются исследования, направленные на изучение диагностических и терапевтических подходов снижения бремени сердечно-сосудистого риска, особенно среди когорты молодых пациентов с ВЗК.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Тарасова Лариса Владимировна – д-р мед. наук, доц., зав. каф. факультетской и госпитальной терапии, ФГБОУ ВО «Чувашский государственный университет им. И.Н. Ульянова»; зав. отд-нием гастроэнтерологии, БУ «Республиканская клиническая больница». E-mail: tlarisagast18@mail.ru; ORCID: 0000-0003-1496-0689
Larisa V. Tarasova – Dr. Sci. (Med.), Assoc. Prof., Ulyanov Chuvash State University; Republic Clinical Hospital.
E-mail: tlarisagast18@mail.ru; ORCID: 0000-0003-1496-0689
Кучерова Надежда Юрьевна – аспирант каф. факультетской и госпитальной терапии, ФГБОУ ВО «Чувашский государственный университет им. И.Н. Ульянова»; врач-кардиолог консультативной поликлиники БУ «Республиканский кардиологический диспансер». E-mail: nadezda_kan@mail.ru; ORCID: 0000-0002-9500-3719
Nadezhda Yu. Kucherova – Graduate Student, Ulyanov Chuvash State University; cardiologist, Republic Cardiology Dispensary. E-mail: nadezda_kan@mail.ru;
ORCID: 0000-0002-9500-3719
Цыганова Юлия Вадимовна – канд. мед. наук, ст. преподаватель каф. факультетской и госпитальной терапии ФГБОУ ВО «Чувашский государственный университет им. И.Н. Ульянова».
E-mail: j.v.tsyganova@mail.ru
Julia V. Tsyganova – Cand. Sci. (Med.), Ulyanov Chuvash State University. E-mail: j.v.tsyganova@mail.ru
Поступила в редакцию: 15.10.2023
Поступила после рецензирования: 02.11.2023
Принята к публикации: 02.11.2023
Received: 15.10.2023
Revised: 02.11.2023
Accepted: 02.11.2023
Клинический разбор в общей медицине №7 2023
Случай острого инфаркта миокарда у пациента трудоспособного возраста с язвенным колитом на фоне позднего начала патогенетической терапии
Номера страниц в выпуске:30-34
Аннотация
В статье представлено описание случая острого инфаркта миокарда с множественным атеросклеротическим поражением коронарных артерий у пациента трудоспособного возраста с язвенным колитом на фоне позднего начала патогенетической терапии.
Ключевые слова: воспалительные заболевания кишечника, атеросклероз, острый инфаркт миокарда, язвенный колит.
Для цитирования: Тарасова Л.В., Кучерова Н.Ю., Цыганова Ю.В. Случай острого инфаркта миокарда у пациента трудоспособного возраста с язвенным колитом на фоне позднего начала патогенетической терапии. Клинический разбор в общей медицине. 2023; 4 (7): 30–34. DOI: 10.47407/kr2023.4.7.00283
В статье представлено описание случая острого инфаркта миокарда с множественным атеросклеротическим поражением коронарных артерий у пациента трудоспособного возраста с язвенным колитом на фоне позднего начала патогенетической терапии.
Ключевые слова: воспалительные заболевания кишечника, атеросклероз, острый инфаркт миокарда, язвенный колит.
Для цитирования: Тарасова Л.В., Кучерова Н.Ю., Цыганова Ю.В. Случай острого инфаркта миокарда у пациента трудоспособного возраста с язвенным колитом на фоне позднего начала патогенетической терапии. Клинический разбор в общей медицине. 2023; 4 (7): 30–34. DOI: 10.47407/kr2023.4.7.00283
A case of acute myocardial infarction in a working-age patient with ulcerative colitis against the background of late initiation of pathogenetic therapy
Larisa V. Tarasova1,2, Nadezhda Yu. Kucherova1,3, Julia V. Tsyganova11 Ulyanov Chuvash State University, Cheboksary, Russia;
2 Republic Clinical Hospital, Cheboksary, Russia;
3 Republic Cardiology Dispensary; Cheboksary, Russia
tlarisagast18@mail.ru
Abstract
The article describes a case of acute myocardial infarction with multiple atherosclerotic lesions of the coronary arteries in a working-age patient with ulcerative colitis, against of late initiation of pathogenetic therapy.
Key words: inflammatory bowel diseases, atherosclerosis, acute myocardial infarction, ulcerative colitis.
For citation: Tarasova L.V., Kucherova N.Yu., Tsyganova Ju.V. A case of acute myocardial infarction in a working-age patient with ulcerative colitis against the background of late initiation of pathogenetic therapy. Clinical review for general practice. 2023; 4 (7): 30–34 (In Russ.).
DOI: 10.47407/kr2023.4.7.00283
Введение
В последнее время наблюдается неуклонный рост числа пациентов с воспалительными заболеваниями кишечника (ВЗК) среди всех возрастных групп [1].Параллельно публикуются работы о превалировании сердечно-сосудистых заболеваний (ССЗ) у пациентов с ВЗК по сравнению с популяцией в целом [2].
При этом ССЗ по-прежнему остаются ведущей причиной смертности как во всем мире, так и в России. Ежегодно от болезней сердца и сосудов в нашей стране умирают около миллиона человек, у еще большего количества снижается качество жизни и уровень трудоспособности, что делает их наиболее емкими по социально-экономическим последствиям [3, 4]. В связи с этим высокий интерес к сочетанию заболеваний сердечно-сосудистой системы и ВЗК обоснован и требует многогранного изучения.
По данным S. Weissman и соавт. (2020 г.), пациенты с ВЗК имеют более низкие уровни холестерина липопротеинов низкой плотности (ЛПНП) и общего холестерина, а также более низкие индекс массы тела и частоту гипертонии, чем пациенты без ВЗК [5]. Парадоксально, но при этом риск сердечно-сосудистых событий у пациентов с болезнью Крона и язвенным колитом выше по сравнению с населением в целом, особенно во время
обострения иммуноопосредованного воспалительного процесса [6].
Изучение данных регистров пациентов с ВЗК из 26 стран показало увеличение частоты острых артериальных событий (острого инфаркта миокарда – ОИМ и ишемического инсульта) у пациентов с ВЗК по сравнению с общей популяцией в 1,2 раза [7].
Крупное датское когортное исследование пациентов с ВЗК выявило увеличение риска развития ишемической болезни сердца (ИБС) до 20% по сравнению с контрольной группой сопоставимого возраста, особенно в первый год после установления диагноза ВЗК [8]. Систематический обзор S. Singh также показал увеличенный на 19% риск ИБС, особенно среди женщин и лиц моложе 40–50 лет, страдающих ВЗК [9].
Необходимо отметить, что риск развития осложнений со стороны сердечно-сосудистой системы и обусловленных этим летальных исходов у пациентов с ВЗК, по данным крупных когортных исследований, не зависел от факта приема системных глюкокортикостероидов, но значительно увеличивался в период увеличения активности ВЗК [10].
Не все аспекты, посредством которых ВЗК потенцируют кардиоваскулярный риск, могут быть охвачены традиционными методиками оценки риска ССЗ, что может приводить к заниженной оценке риска и отсутствии своевременной и эффективной профилактики ССЗ у пациентов данной группы.
Описание клинического случая
Пациент Н., 55 лет, поступил в кардиологическое отделение регионального сосудистого центра (РСЦ) 4 августа 2023 г. с жалобами на чувство дискомфорта в груди, выраженную общую слабость, потливость.Анамнез заболевания. В течение 4 лет отмечал жжение в груди при физической нагрузке (рубка леса, работа на приусадебном участке) или в утренние часы после подъема, купировал приемом воды или сахара, нитратами не пользовался, постепенно сформировался стереотип стенокардии (функциональный класс II).
В течение трех последних дней после физических нагрузок (работал с подъемом тяжести) стал фиксировать кратковременные эпизоды жжения в грудной клетке, проходящие после приема воды самостоятельно. За медицинской помощью не обращался.
Ухудшение состояния отмечает с 20 ч 04.08.23, когда после посещения бани стал отмечать потливость, резкую слабость, жжение за грудиной с переходом в давящую боль, сопровождаемую нехваткой воздуха. Привычными средствами болевой синдром не купировался, а интенсивность боли нарастала, в связи с чем была вызвана бригада скорой медицинской помощи. На электрокардиограмме (ЭКГ), снятой врачом скорой медицинской помощи, зарегистрирован синусовый ритм с подъемом сегмента ST в отведениях I, II, III, аVF, V4-V6, патологический зубец Q в отведениях II, III, aVF. Оказана помощь: гепарин 5 тыс. ЕД, клопидогрель 300 мг, аспирин 250 мг, морфин 1% – 1,0 внутривенно струйно, ввиду сохранения боли в грудной клетке с повторным введением. Пациент доставлен в приемный покой РСЦ через 3 ч от момента появления загрудинных болей, в состоянии купированного приступа.
Из анамнеза жизни: никогда не курил, алкоголь употребляет редко в умеренных количествах. Наследственность по артериальной гипертензии, ИБС не отягощена. В течение 6 лет отмечал вздутие в животе, периодически примесь крови в кале, не обследовался, диспансеризацию не проходил, несмотря на активные приглашения по телефону страховых медицинских представителей. Год назад пациент впервые обратился к участковому терапевту в связи с учащением диареи до 5–6 раз в сутки и появлением устойчивой примеси слизи и крови в каловых массах. Был верифицирован диагноз – язвенный колит, хроническое рецидивирующее течение, тотальное поражение, среднетяжелая атака, и пациент был взят на диспансерное наблюдение у врача-терапевта, согласно приказу Минздрава Российской Федерации «Об утверждении порядка проведения диспансерного наблюдения за взрослыми» №168 н от 15 марта 2022 г.
По данным колоноскопии, картина язвенного колита (диффузная гиперемия и отек слизистой кишки, стертость сосудистого рисунка на всем протяжении, субэпителиальные геморрагии с умеренно выраженной контактной ранимостью, множественные эрозии до 3–5 мм, единичные полигональные язвы до 0,7 см, единичные псевдополипы в прямой и сигмовидной кишке). Патологогистологическое исследование биопсийного материала: лимфоплазмоцитарная инфильтрация собственной пластинки слизистой оболочки толстой кишки, уменьшение количества бокаловидных клеток, деформация крипт и формирование крипт-абсцессов. Пациенту была назначена терапия месалазином в таблетках в суточной дозе 4–5 г/сут в комбинации с месалазином в микроклизмах и свечах. В связи с положительным ответом на терапию сульфапрепаратами она была продолжена до 8 нед с последующим переводом на поддерживающие дозы месалазина. Чрез 10 мес пациент начал отмечать учащение стула, появление примеси слизи в кале, и был переведен на системные глюкокортикостероиды (ГКС) в дозе 60 мг/сут в комбинации с азатиоприном 2 мг/кг в сутки, на которой находился до момента появления болевого синдрома за грудиной.
Объективно при поступлении: состояние средней степени тяжести. Пациент нормостенического телосложения. Рост 158 см, масса тела 52 кг, индекс массы тела (ИМТ) 22 кг/м2. Кожные покровы бледные, тургор удовлетворительный. Над всеми легочными полями выслушивалось везикулярное дыхание, частота дыхательных движений 18 в минуту. Границы относительной сердечной тупости – в пределах нормы. Тоны сердца приглушены, ритм правильный. Частота сердечных сокращений (ЧСС) – 90 уд/мин, артериальное давление (АД) – 125/80 мм рт. ст. на обеих руках. Живот мягкий, чувствительный при пальпации в левой подвздошной области. Печень не увеличена в размерах. Периферических отеков нет.
По ЭКГ в стационаре: регистрировались признаки нарушения коронарного кровообращения в миокарде нижней и передне-верхушечно-боковой области левого желудочка (QS во II, зубец Q в III); элевация сегмента ST до 3,0 мм с переходом в положительный зубец Т в отведениях II, III, aVF, V4-V6; депрессия сегмента ST до 0,5 мм в отведении aVL. Уровень Тропонина I при поступлении составил 2871 нг/л.
По данным эхокардиографии: камеры сердца не расширены, выявлена гипокинезия заднего сегмента в апикальном отделе левого желудочка, гипокинезия всех задних сегментов в среднем и базальном отделах левого желудочка, снижение сократительной способности миокарда левого желудочка (фракция выброса – 48%, фракция укорочения – 24,5%), признаки атеросклероза аорты, аортального клапана.
По данным экстренной коронароангиографии выявлены: окклюзия огибающей артерии, стенозы передней нисходящей артерий до 35–55%, первой диагональной ветви до 40–55%, правой коронарной артерии до 40–45% (рис. 1).
Выполнено экстренное чрескожное коронарное вмешательство: баллонная ангиопластика огибающей артерии с имплантацией cтента с лекарственным покрытием (рис. 2).
В общем анализе крови выявлен лейкоцитоз (13,1×109/л), тромбоцитоз (455×109/л), нормохромная анемия легкой степени тяжести (гемоглобин – 107 г/л, средний объем эритроцита – 80 фл, среднее содержание гемоглобина в эритроците – 29,3 пг, средняя концентрация гемоглобина в эритроците – 365 г/л).
В липидограмме на фоне относительно невысокого содержания общего холестерина (3,2 ммоль/л) и ЛПНП (1,8 ммоль/л) наблюдалось низкое содержание липопротеинов высокой плотности (ЛПВП) – 0,7 ммоль/л.

В биохимическом анализе крови наблюдалось значительное повышение аспартатаминотрансферазы – 280 U/L, что объяснимо острой стадией инфаркта миокарда.
Также наблюдалось незначительное снижение сывороточного железа до 8,9 ммоль/л. Показатели глюкозы крови, билирубина, аланинаминотрансферазы, щелочной фосфатазы, креатинина, мочевины, электролитов, коагулограммы были в пределах референсных значений.
При суточном мониторировании ЭКГ зарегистрирован синусовый ритм с ЧСС 55–108 уд/мин, одиночная предсердная экстрасистолия (всего: 32), ишемические изменения в миокарде не выявлены.
При ультразвуковой допплерографии брахиоцефальных сосудов выявлены признаки нестенозирующего атеросклероза: утолщение комплекса «интима–медиа» до 1,2–1,3 мм.
При динамическом контроле ЭКГ наблюдалась текущая динамика ОИМ нижней, нижне-боковой стенки левого желудочка с распространением на базальные отделы, с ЧСС с 94 до 67 в мин, некоторое увеличение степени инверсии зубца Т в отведениях II, III, аVF, V6.
Пациенту был выставлен диагноз: ишемическая болезнь сердца: острый инфаркт миокарда с подъемом сегмента ST, Q-образующий нижне-боковой стенки левого желудочка.
На фоне проводимой терапии (β-адреноблокаторы, ингибиторы ангиотензинпревращающего фермента, ацетилсалициловая кислота, клопидогрель, низкомолекулярные гепарины, статины) приступы стенокардии не рецидивировали, достигнута возможность ходьбы до 1 км/сут в 4–5 приемов с адекватной реакцией АД и ЧСС. На фоне введения антикоагулянтов, двойной
дезагрегантной терапии у пациента появилась постоянная примесь крови и слизи в кале, боли в левой половине живота, участился стул до 5–7 раз в сутки.
По данным колоноскопии выраженная активность язвенного колита по Shroeder 3: слизистая оболочка толстой кишки на всем протяжении отечна, диффузно гиперемирована, сосудистый рисунок смазан, контактно ранимая, с множественными очагами геморрагии, в сигмовидной, нисходящей ободочной кишке множественные эрозии до 3–6 мм, в нисходящей, поперечно ободочной кишках полигональные язвенные дефекты, полиповидные образования.
В связи с наличием клинических показателей тяжелой атаки язвенного колита, согласно индексу Мейо, лабораторных признаков высокой активности язвенного колита (лейкоцитоз до 11,2×109/л, С-реактивный белок – 12 мг/л, фекальный кальпротектин – 965 мкг/г), а также в связи с негативным влиянием базисной ГКС-терапии на сердечно-сосудистую систему для подбора биологической терапии и осуществления мультидисциплинарного ведения (гастроэнтеролог, кардиолог) пациент переведен в гастроэнтерологическое отделение специализированного Республиканского центра по диагностике и лечению ВЗК Бюджетного учреждения «Республиканская клиническая больница» Минздрава Чувашской Республики.
Представленный клинический случай интересен развитием выраженного атеросклеротического поражения коронарных артерий, осложнившегося ОИМ, у пациента с низкой приверженностью к комплексу мероприятий, направленных на раннее выявление заболеваний (профилактический медицинский осмотр, диспансеризация). Позднее обращение к врачу первичного звена по поводу появления клинически значимых и патогномоничных симптомов ВЗК привело к запоздалой диагностике язвенного колита и несвоевременному началу патогенетической терапии и способствовало реализации патогенетического каскада сердечно-сосудистых событий у молодого пациента без привычных факторов сердечно-сосудистого риска.
Интерес клинического случая
В последнее время все больше внимание уделяется изучению проатерогенного влияния ВЗК, причем акцент делается на процессы гиперактивации иммунной системы и персистирующего хронического воспаления, которые обусловливают изменение структуры и функции эндотелия сосудов.Хронический воспалительный процесс в стенке кишки, особенно поздно диагностированный, вызывает окислительный стресс, повышенное образование и высвобождение провоспалительных цитокинов: интерлейкинов (ИЛ)-1, ИЛ-6, фактора некроза опухоли (ФНО)-α, под действием которых происходит избыточная экспрессия молекул адгезии и миграция лимфоцитов и моноцитов через эндотелий. Описанные изменения приводят к развитию эндотелиальной дисфункции: снижению продукции оксида азота (NO), повышению продукции матриксных металлопротеиназ, коллагеназы, эластаз, ремоделированию сосудистой стенки с увеличением ее жесткости. Снижение уровня NO способствует уменьшению релаксации гладкомышечных клеток, а передача сигналов ФНО-α индуцирует экспрессию маркеров остеобластов в гладкомышечных клетках, что приводит к усилению кальцификации и утолщению интимы сосудов [11–14].
Изменение нормального функционирования кишечной микробиоты на фоне ВЗК также влияет на ускорение атеросклеротического воспаления сосудистой стенки. Увеличение количества провоспалительных представителей типов Proteobacteria (Escherichia coli и Bacteriodetes) при ВЗК, а также снижение бактериальной выработки бутирата короткоцепочечных жирных кислот, являющихся важнейшими регуляторами липидного метаболизма, способствует поддержанию и прогрессии локального кишечного воспаления, усугубляет дисбиоз и нарушает барьерную функцию кишечного эпителия, за счет чего происходит эндотелиальная транслокация бактериальных метаболитов, запуск и поддержание системного воспалительного иммунного ответа, неизбежно приводящего к ускорению процесса атерогенеза [15].
Нарушение нормальной работы биоценоза кишечника при ВЗК приводит к повышенному бактериальному производству ТМА (триметиламин), который окисляется в печени до проатерогенного метаболита ТМАО (триметиламин – N-оксид). ТМАО также способствует атерогенезу, вмешиваясь в транспортировку холестерина, увеличивает образование пенистых клеток и агрегацию тромбоцитов, причем последнее играет ведущую и потенцирующую роль в развитии острых коронарных событий [16, 17].
Невозможно не подчеркнуть участие в формировании и прогрессирование атеротромботических изменений у пациентов с длительным системным воспалением отдельных фракций липопротеидов и гомоцистеина. Так, ЛПНП при системном воспалении подвергаются различным химическим модификациям – окислению, ацетилированию, карбамилированию, гликированию. Модифицированные ЛПНП дольше задерживаются в интиме и активнее фагоцитируются макрофагами, чем нативные ЛПНП, что определяет их высокую атерогенность [16, 17]. У пациентов с ВЗК также снижены концентрация ЛПВП и их антиоксидантная способность [11].
Доказано, что феномен гипергомоцистеинемии чаще встречается у пациентов с ВЗК, по сравнению с общей популяцией, и способствует увеличению вероятности атеротромбоза за счет образования агрегатов тиолактона гомоцистеина с ЛПНП, активации пенистых клеток, повышенной выработке ими активных кислородных метаболитов, которые способствуют повреждению эндотелия, пролиферации гладкомышечных клеток сосудистой стенки и запуску процесса клеточного окисления ЛПНП в субэндотелиальном слое артериальной стенки [12].
Заключение
ВЗК связаны с более высоким риском крайне преждевременного атеросклеротического процесса и атеро-тромбоза. Факторами риска атеросклеротической трансформации у пациентов с ВЗК являются длительный анамнез и высокая активность заболевания, зачастую связанные с отсутствием адекватной терапии, несвоевременным назначением базисной терапии и поздним переключением пациентов на биологическую терапию в случае неэффективности базисной.В основе процесса преждевременного атерогенеза при ВЗК лежат процессы хронического местного, позже системного воспаления, окислительный стресс, кишечный дисбиоз, приводящие к развитию эндотелиальной дисфункции и специфической дислипидемии, характеризующейся низким содержание ЛПВП на фоне высокой атерогенности модифицированных ЛПНП при более низком их уровне по сравнению с общей популяцией.
Механизмы, посредством которых ВЗК повышают кардиоваскулярный риск, не могут быть оценены традиционными шкалами риска ССЗ. Актуальными являются исследования, направленные на изучение диагностических и терапевтических подходов снижения бремени сердечно-сосудистого риска, особенно среди когорты молодых пациентов с ВЗК.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Тарасова Лариса Владимировна – д-р мед. наук, доц., зав. каф. факультетской и госпитальной терапии, ФГБОУ ВО «Чувашский государственный университет им. И.Н. Ульянова»; зав. отд-нием гастроэнтерологии, БУ «Республиканская клиническая больница». E-mail: tlarisagast18@mail.ru; ORCID: 0000-0003-1496-0689
Larisa V. Tarasova – Dr. Sci. (Med.), Assoc. Prof., Ulyanov Chuvash State University; Republic Clinical Hospital.
E-mail: tlarisagast18@mail.ru; ORCID: 0000-0003-1496-0689
Кучерова Надежда Юрьевна – аспирант каф. факультетской и госпитальной терапии, ФГБОУ ВО «Чувашский государственный университет им. И.Н. Ульянова»; врач-кардиолог консультативной поликлиники БУ «Республиканский кардиологический диспансер». E-mail: nadezda_kan@mail.ru; ORCID: 0000-0002-9500-3719
Nadezhda Yu. Kucherova – Graduate Student, Ulyanov Chuvash State University; cardiologist, Republic Cardiology Dispensary. E-mail: nadezda_kan@mail.ru;
ORCID: 0000-0002-9500-3719
Цыганова Юлия Вадимовна – канд. мед. наук, ст. преподаватель каф. факультетской и госпитальной терапии ФГБОУ ВО «Чувашский государственный университет им. И.Н. Ульянова».
E-mail: j.v.tsyganova@mail.ru
Julia V. Tsyganova – Cand. Sci. (Med.), Ulyanov Chuvash State University. E-mail: j.v.tsyganova@mail.ru
Поступила в редакцию: 15.10.2023
Поступила после рецензирования: 02.11.2023
Принята к публикации: 02.11.2023
Received: 15.10.2023
Revised: 02.11.2023
Accepted: 02.11.2023
Список исп. литературыСкрыть список1. Zhao M, Gonczi L, Lakatos PL, Burisch J. The durden of inflammatory dowel disease in europe in 2020. J Crohns Colitis. 2021; 15 (9): 1573–87. DOI: 10.1093/ecco-jcc/jjab029
2. Chen B, Collen LV, Mowat C et al. Inflammatory bowel disease and cardiovascular diseases. Am J Med. 2022; 135 (12): 1453–60. DOI: 10.1016/j.amjmed.2022.08.012
3. Федеральная служба государственной статистики. Доступ: https://rosstat.gov.ru/sdg/data/goal3 (дата обращения – 01.08.2023).
Federal State Statistics Service (Russia). URL: https://rosstat.gov.ru/ sdg/data/goal3 (date of access – 01.08.2023) (in Russian).
4. Nguyen NH, Ohno-Machado L, Sandborn WJ, Singh S. Infections and cardiovascular complications are common causes for hospitalization in jlder patients with inflammatory bowel diseases. Inflamm Bowel Dis. 2018; 24 (4): 916–23. DOI: 10.1093/ibd/izx089
5. Weissman S, Sinh P, Mehta TI et al. Atherosclerotic cardiovascular disease in inflammatory bowel disease: The role of chronic inflammation. World J Gastrointest Pathophysiol. 2020; 11 (5): 104–13. DOI: 10.4291/wjgp.v11.i5.104
6. Czubkowski P, Osiecki M, Szymańska E, Kierkuś J. The risk of cardiovascular complications in inflammatory bowel disease. Clin Exp Med. 2020; 20 (4): 481–91. DOI: 10.1007/s10238-020-00639-y
7. Qu C, Cao J, Liu K et al. Crohn's disease complicated with extensive thrombosis of limbs and mesenteric arteries: A case report and literature review. Ann Vasc Surg. 2019; 58: 382.e15-382.e19. DOI: 10.1016/j.avsg.2018.12.079
8. Kristensen SL, Ahlehoff O, Lindhardsen J et al. Disease activity in inflammatory bowel disease is associated with increased risk of myocardial infarction, stroke and cardiovascular death-a Danish nationwide cohort study. PLoS One. 2013; 8 (2): e56944. DOI: 10.1371/journal.pone.0056944
9. Singh S, Singh H, Loftus EV, Pardi DS. Risk of cerebrovascular accidents and ischemic heart disease in patients with inflammatory bowel disease: a systematic review and meta-analysis. Clin Gastroenterol Hepatol. 2014; 12: 382–393. DOI: 10.1016/j.cgh.2013.08.023
10. Aniwan S, Pardi DS, Tremaine WJ et al. Increased risk of acute myocardial infarction and heart failure in patients with inflammatory bowel diseases. Clin Gastroenterol Hepatol. 2018; 16 (10): 1607–15. DOI: 0.1016/j.cgh.2018.04.031
11. Миронова О.Ю., Исайкина М.А., Хасиева С.А. Атеросклероз и сердечно-сосудистый риск у пациентов с воспалительными заболеваниями кишечника. Терапевтический архив. 2021; 93 (12): 1533–8.
Mironova OI, Isaikina MA, Khasieva SA. Аtherosclerosis and cardiovascular risk in patients with inflammatory bowel disease. Therapeutic Archive. 2021; 93 (12): 1533–38. DOI: 10.26442/00403660.2021. 12.201225 (in Russian).
12. Бабаева Г.Г., Бабаев З.М. Частота выявления некоторых маркеров эндотелиальной дисфункции у больных с воспалительными заболеваниями кишечника. Терапевтический архив. 2018; 90 (4): 12–6.
Babayeva GH, Babayeva ZM. Frequency of detection of some markers of endothelial dysfunction in patients with inflammatory bowel diseases. Therapeutic Archive. 2018; 90 (4): 12–16. DOI: 10.26442/terarkh201890412-16 (in Russian).
13. Dowsett L, Higgins E, Alanazi S et al. ADMA: а key player in the relationship between vascular dysfunction and inflammation in atherosclerosis. J Clin Med. 2020; 9 (9): 3026. DOI: 10.3390/jcm9093026
14. Гриневич В.Б., Радченко В.Г. Микробиота кишечника и метаболический синдром. Экспериментальная и клиническая гастроэнтерология. 2020;183(11):11–19.
Grinevich VB, Radchenko VG. Gut microbiota and metabolic syndrome. Experimental and Clinical Gastroenterology. 2020;183(11): 11–19. DOI: 10.31146/1682-8658-ecg-183-11-11-19 (in Russian).
15. Lee MT, Mahtta D, Chen L et al. Premature atherosclerotic cardiovascular disease Risk among patients with inflammatory bowel disease. Am J Med. 2021 Aug; 134 (8): 1047–51. DOI: 10.1016/j.amjmed. 2021.02.029
16. Xiao Y, Powell DW, Liu X, Li Q. Cardiovascular manifestations of inflammatory bowel diseases and the underlying pathogenic mechanisms. Am J Physiol Regul Integr Comp Physiol. 2023; 325 (2): 193–211. DOI: 10.1152/ajpregu.00300.2022
17. Troseid M, Andersen GO, Broch K, Hov JR. The gut microbiome in coronary artery disease and heart failure: Current knowledge and future directions. EBioMedicine. 2020; 52: 102649. DOI: 10.1016/ j.ebiom.2020.102649
