Клинический разбор в общей медицине №10 2024
Daria S. Ivanova
Omsk State Medical University, Omsk, Russia
poltavtseva.98@mail.ru
Abstract
The term "connective tissue dysplasia" (DST) in the territory of the post-Soviet space has become so firmly established in medical practice that many specialists do not seek to verify monogenic syndromes, often hiding behind the usual appearance of the patient "dysplasty". The clinical observation of a patient with signs of DST, who has been observed from a young age by various specialists with pain syndromes, has been operated on three times for abdominal pain syndrome, but no stable positive result has been obtained. Upon examination of a patient with complaints indicating pathology of the digestive system, signs of systemic connective tissue involvement were revealed (7 points in accordance with the Ghent criteria), that is, a marfanoid phenotype was established, in combination with visceral lesions such as transversoptosis, dolichosigma, diverticular disease and diverticulitis, which confirm the presence of hereditary connective tissue disorder (NST). From the OMIM database of hereditary human diseases, it is known that diverticula are characteristic of such NCDs as Marfan syndrome, Ehlers–Danlo syndrome, Coffin–Lowry syndrome, Williams–Behren syndrome, autosomal dominant polycystic kidney disease, between which a differential diagnosis was made. After analyzing all the data, it can be assumed that our patient has Ehlers–Danlo syndrome. It is known that it is a defect in the synthesis of collagen types I or Ⅲ or tenascin X that characterizes progressive intestinal damage in diverticular disease with the possibility of abdominal catastrophes (rupture of the intestine or diverticulitis with peritonitis), therefore, verification of the diagnosis using genetic research is especially important.
Keywords: diverticular disease, hereditary connective tissue disorders, Ehlers-Danlo syndrome, marfanoid phenotype.
For citation: Poltavtseva A.M., Viktorova I.A., Rozhkova M.Yu., Petrenko M.V., Ivanova D.S. Clinical analysis of a patient with marfanoid phenotype and diverticular disease. Clinical review for general practice. 2024; 5 (10): 12–18 (In Russ.). DOI: 10.47407/kr2024.5.10.00489
Наследственные заболевания соединительной ткани рассматриваются большинством специалистов как редкие, однако в последнее время появились данные о большей распространенности этих заболеваний [1]. На практике их выявление затруднительно по ряду причин. Во-первых, клиническое применение Гентских критериев синдрома Марфана для диагностики системного вовлечения соединительной ткани обременено такими методами обследования, как определение «протрузии вертлужной впадины» и «эктазии твердой мозговой оболочки» (высоконагрузочные рентгенологические исследования). Клиническая верификация синдрома Элерса–Данло с использованием критериев, разработанных Международным консорциумом в 2017 г., трудоемка, так как включает многочисленные специфические признаки 13 типов, верификация которых занимает много времени, значительно превышающего время стандартного приема даже врача генетика медико-генетической консультации [2, 3].
Во-вторых, молекулярно-генетические исследования, безусловно, показанные в этой ситуации, в рутинной медицинской практике для большинства пациентов недоступны из-за высокой стоимости (не входят в оплату системы обязательного медицинского страхования).
В-третьих, широкая фенотипическая протяженность признаков дисплазии соединительной ткани (ДСТ) от маловыраженных до тяжелых форм требует знаний и навыков дифференциации диагностики моногенных синдромов, которыми не в полной мере располагают даже генетики. Поэтому из клинической практики практически исчезли пациенты с диагнозами «синдром Марфана», «синдром Элерса–Данло», но появилось большое количество пациентов с недифференцированной ДСТ. Это затрудняет накопление, анализ и осмысление фактов для продуктивного развития этой области научных знаний.
Основные традиционно выделяемые диспластические фенотипы – марфаноподобный (с долихостеномелией, арахнодактилией) и элерсоподобный (с гипермобильностью суставов, гиперэластичной кожей) – нередко перекрещиваются между собой с невозможностью выделения ведущего. Оба синдрома ассоци-ируются с многочисленными отклонениями в опорно-двигательном аппарате, включая сколиоз, деформации грудной клетки и стопы. Эти нарушения включены как в Гентские критерии, так и критерии Международного консорциума 2017 г., и играют значительную роль в диагностике заболеваний. Отличительные характеристики скелета пациентов с синдромом Марфана и с некоторыми подтипами синдрома Элерса–Данло включают астеническое телосложение, высокий рост, превышающий верхние границы возрастных норм, высокое дугообразное нёбо, скученность зубов – признаки классического марфаноидного фенотипа [2, 3]. Однако помимо скелетопатий существует множество висцеральных проявлений данных заболеваний. В России они изучены применительно к недифференцированной ДСТ. Так, желудочно-кишечный тракт (ЖКТ) часто вовлекается в патологический процесс более чем в 70% случаев [4]. Описаны отклонения от нормы всех отделов пищеварительной системы, часто сочетающихся между собой. При ДСТ часто выявляются изменения длины и размеров органов пищеварения: мегаколон и долихосигма, удлиненный желчный пузырь. Изменения положения органов пищеварения также могут быть обусловлены нарушениями структуры и функции соединительной ткани при ДСТ [5]. При ирригоскопии изменения положения толстого кишечника обнаруживаются у 90% пациентов с ДСТ, колоноптоз – у 26% [4]. Диспластикозависимые изменения стенки полых органов ведут к развитию дивертикулов, которые могут возникать практически в любом отделе ЖКТ, чаще толстой кишки, несколько реже – двенадцатиперстной, возможно их сочетание [4, 5]. Высокая частота гастроэнтерологической патологии у пациентов с ДСТ, согласно российским публикациям, свидетельствует о частом вовлечении в диспластический процесс полых органов пищеварения.
В качестве примера, подтверждающего вышеизложенные факты, приводится клиническое наблюдение. Пациентка Б., 58 лет, обратилась с жалобами: на боли в животе после еды, нарушение стула со склонностью к запорам, першение в горле, горечь во рту, налет на языке.
Анамнез жизни: туберкулез, ВИЧ, гепатиты отрицает. Аллергологический анамнез не отягощен. Наследственность: мать страдает гипертонической болезнью, сахарным диабетом 2-го типа. Отец умер от рака ЖКТ.
 Из анамнеза заболевания. Считает себя больной с молодых лет, когда начали беспокоить боли в кишечнике, вздутие живота. Наблюдалась по поводу синдрома раздраженного кишечника, принимала по этому поводу множество препаратов, включая антидепрессанты с переменным эффектом. До настоящего времени по поводу интенсивных болей в животе перенесла три полостные операции (аппендэктомия, холецистэктомия, рассечение спаек) с развитием спаечной болезни органов брюшной полости. В 2020 г. пациентка перенесла COVID-19, после чего боли в животе усилились, изменился вкус привычных продуктов питания, появилось нарушение стула.
Из анамнеза заболевания. Считает себя больной с молодых лет, когда начали беспокоить боли в кишечнике, вздутие живота. Наблюдалась по поводу синдрома раздраженного кишечника, принимала по этому поводу множество препаратов, включая антидепрессанты с переменным эффектом. До настоящего времени по поводу интенсивных болей в животе перенесла три полостные операции (аппендэктомия, холецистэктомия, рассечение спаек) с развитием спаечной болезни органов брюшной полости. В 2020 г. пациентка перенесла COVID-19, после чего боли в животе усилились, изменился вкус привычных продуктов питания, появилось нарушение стула.
В связи с этим пациентка неоднократно обследовалась: фиброгастродуоденоскопия (ФГДС), фиброколоноскопия (ФКС), кал на дисбиоз. Структурных патологических изменений выявлено не было.
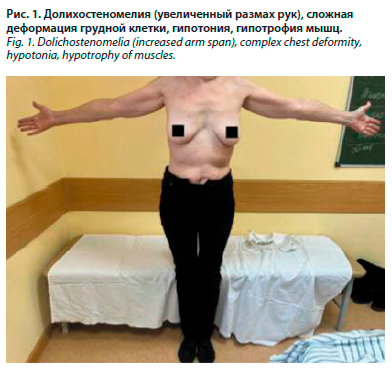
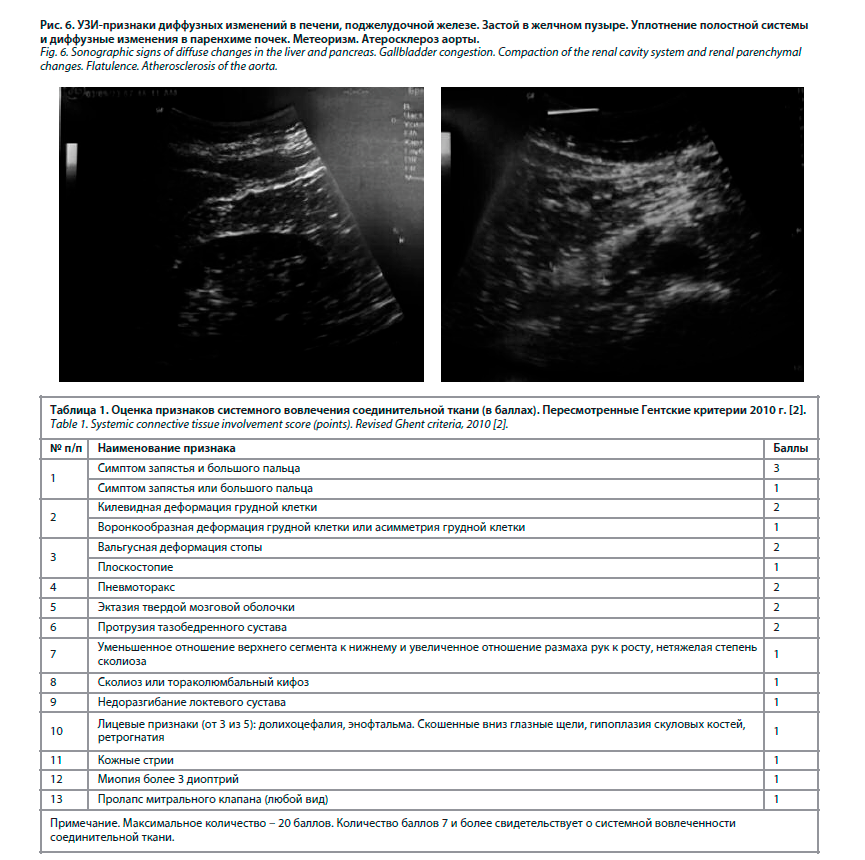
При осмотре общее состояние удовлетворительное. Положение активное. Сознание ясное. Температура тела 36,6˚ С. Телосложение правильное. Тип конституции астенический. Достаточного питания. Обращает на себя внимание гипотония, гипотрофия мышц. Масса тела 67 кг, рост 174 см. ИМТ 22,1 кг/м2. Размах рук 183 см. Долихостеномелия (размах рук превышает рост на 9 см) (рис. 1). Арахнодактилия выявлена с помощью тестов большого пальца и запястья. Рост сидя 85 см, нижний сегмент = 87 см (174 см – рост стоя) (рис. 2). Кожа бледно-розовая, умеренной влажности. Растяжимость кожи на тыле кисти и на предплечье (внутренняя сторона недоминирующей руки) – 4 см. Видимые слизистые розовые. Склеры бледно-голубые. При осмотре полости рта обращает на себя внимание готическое нёбо, прогения, микрогнатия (гипоплазия верхней челюсти), скученность зубов. Язык обложен коричневым налетом. Со стороны зрительной системы: нарушения рефракции +3 диоптрия. Щитовидная железа: видимое увеличение перешейка, пальпаторно увеличен перешеек. Периферические лимфатические узлы не увеличены. Грудная клетка сложной разнонаправленной деформации: в верхней части килевидная форма
корпорокостального типа, а в нижней части (в области прикрепления мечевидного отростка к грудине) – кратерообразное воронкообразное вдавление (рис. 3). Отмечается сколиоз грудного отдела позвоночника 1-й степени (рис. 4).
Грудная клетка эластичная, обе половины одинаково участвуют в акте дыхания. Дыхание везикулярное, дополнительные дыхательные шумы не выслушиваются, ЧДД 16 в минуту. При аускультации сердца ритм правильный, тоны сердца ясные, ритмичные, PS 71 в минуту, АД 110/63 мм рт. ст. на фоне постоянного приема конкора 1,25 мг/день. Живот при осмотре правильной овальной формы, в размерах не увеличен. При пальпации живота отмечается дискомфорт в зоне Шоффара, болезненность в точке Мейо–Робсона 1 и 2. Печень пальпируется у края реберной дуги, край ее ровный, мягкий, безболезненный. Селезенка не пальпируется. Почки не пальпируются. Мочеиспускание свободное. При пальпации паравертебральных точек болезненности нет. Симптомы натяжения отрицательные. Отеков нет. Поперечное и продольное плоскостопие с натоптышами под вторыми пальцами стоп (рис. 5 и 6).
 Мобильность суставов по Beihton&Horan: наклон вперед (1 балл), переразгибание V пальцев (2 балла), сгибание больших пальцев к предплечью (2 балла), переразгибание коленей (0 баллов), переразгибание локтей (2 балла). Сумма составляет 7 баллов, что свидетельствует о гипермобильности суставов.
Мобильность суставов по Beihton&Horan: наклон вперед (1 балл), переразгибание V пальцев (2 балла), сгибание больших пальцев к предплечью (2 балла), переразгибание коленей (0 баллов), переразгибание локтей (2 балла). Сумма составляет 7 баллов, что свидетельствует о гипермобильности суставов.
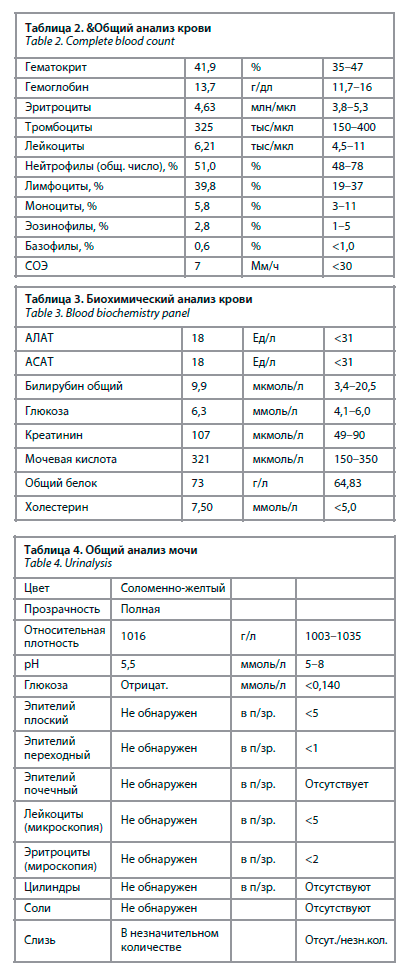
По пересмотренным Гентским критериям 2010 г. [2] для оценки вовлеченности соединительной ткани у пациентки выявлены следующие признаки: положительный симптом запястья и большого пальца (3 балла), килевидная деформация грудной клетки (2 балла), уменьшенное отношение верхнего сегмента к нижнему, увеличенное отношение размаха рук к росту и нетяжелая степень сколиоза (1 балл), плоскостопие (1 балл) (табл. 1). Сумма баллов составила 7 по Гентским критериям, что свидетельствует о системном вовлечении соединительной ткани [2] – наличие марфаноидного фенотипа. Однако других патогномоничных критериев синдрома Марфана (поражение сердечно-сосудистой системы и глаз) у пациентки в 58 лет не выявлено, что исключает его наличие.
При обследовании анализы крови и мочи без особенностей (табл. 2 и 4). На ЭКГ выявлено замедление внутрипредсердной проводимости.
При ФГДС выявлены проксимальный диффузный дуоденит, косвенные признаки дискинезии. Уреазный тест на H. pylori отрицательный.
На УЗИ признаки диффузных изменений в печени, поджелудочной железе, застоя в желчном пузыре. Уплотнение полостной системы и диффузные изменения в паренхиме почек. Метеоризм. Атеросклероз аорты (рис. 7 и 8).
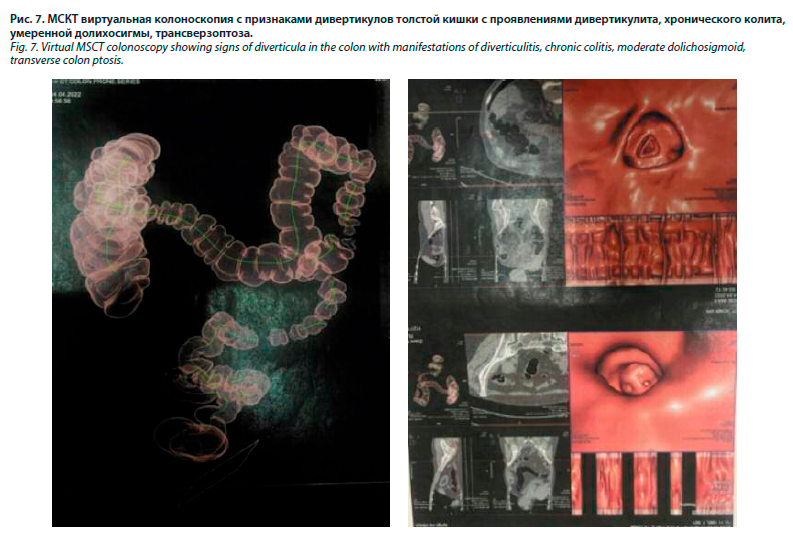
Пациентка неоднократно проходила ФКС, при которой органической патологии обнаружено не было. При проведении МСКТ виртуальной колоноскопии были получены следующие данные: выявлены КТ-признаки дивертикулов толстой кишки с проявлениями дивертикулита, КТ-признаки хронического колита, КТ-признаки долихосигмы, трансверзоптоза (рис. 9 и 10).
Клинический диагноз. Основной: Дивертикулярная болезнь кишечника. Дивертикулы толстой кишки с дивертикулитом. Дисфункция сфинктера Одди по смешанному типу. Гастроэзофагеальная рефлюксная болезнь, неэрозивная форма. Хронический HP – негативный гастрит. Проксимальный дуоденит.
Фоновое заболевание: Марфаноидный фенотип. Трансверзоптоз. Долихосигма.
Сопутствующий: Гипертоническая болезнь II стадии, контролируемая, риск высокий. Атеросклероз аорты. Гиперхолестеринемия. Гипертензивная нефропатия. ХБП 3 А. Целевое АД ≤130/80 мм рт. ст.
Коллаген III типа преимущественно содержится в стенке кровеносных сосудов (аорта, другие артерии), полых органов (кишка, матка) и в коже [15]. Таким образом, нарушение процесса его образования может проявляться развитием не только сосудистых катастроф, но и кишечных, включая разрыв кишки с развитием перитонита или разрыв матки.
Отсутствие у нашей пациентки поражения сердечно-сосудистой системы и глаз, характерных для синдрома Марфана, а также отсутствие патогномоничных лицевых аномалий и ранних когнитивных нарушений, характерных для синдромов Вильямса–Берена и Коффина–Лоури, исключает наличие этих заболеваний. Поликистоз почек по данным ультразвукового исследования также исключен. Наличие марфаноидного фенотипа (7 баллов по признакам системного вовлечения соединительной ткани в соответствие с Гентскими критериями) и в то же время наличие гиперрастяжимой кожи и гипермобильности суставов в сочетании с лицевыми дизморфиями и ДБ делает наиболее вероятным диагноз «синдром Элерса–Данло» с возможностью классически-подобного, гипермобильного или сосудистого типов. Данное заключение основано на указании единого генетического дефекта синдрома Элерса–Данло и ДБ в OMIM: нарушение синтеза коллагена I или III типов или тенасцина Х. Несмотря на все приведенные факты, диагноз «синдром Элерса–Данло» остается предположительным в отсутствие молекулярно-генетического исследования.
Установление точного генетического дефекта помогло бы предугадать возможный патогенетический ход событий и осложнений при системном вовлечении соединительной ткани, ведь такие пациенты имеют риск развития перитонита на фоне дивертикулита или разрыва кишки. Данные об инвалидизирующих и фатальных осложнениях ДБ при синдроме Элерса–Данло были получены по запросу «дивертикулярная болезнь» в каталоге OMIM. Найдено описание двух неродственных пациентов с дефицитом тенасцина X и установленным диагнозом «синдром Элерса–Данло» без его классических проявлений (атрофические рубцы, плохое заживление ран), но с ДБ кишечника, осложнившуюся разрывом дивертикула [14].
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Полтавцева Анастасия Максимовна – асс. каф. поликлинической терапии и внутренних болезней, ФГБОУ ВО ОмГМУ.
ORCID: 0000-0002-5342-9279
Anastasiya M. Poltavtseva – Аssistant, Omsk State Medical University. ORCID: 0000-0002-5342-9279
Викторова Инна Анатольевна – д-р мед. наук, проф., зав. каф. поликлинической терапии и внутренних болезней, ФГБОУ ВО ОмГМУ. ORCID: 0000-0001-8728-2722
Inna A. Viktorova – Dr. Sci. (Med.), Full Prof., Omsk State Medical University. ORCID: 0000-0001-8728-2722
Рожкова Мария Юрьевна – доц. каф. поликлинической терапии и внутренних болезней ФГБОУ ВО ОмГМУ. ORCID: 0000-0002-7695-149X
Maria Yu. Rozhkova – Assoc. Prof., Omsk State Medical University. ORCID: 0000-0002-7695-149X
Петренко Марина – студентка VI курса лечебного факультета, ФГБОУ ВО ОмГМУ. ORCID: 0009-0003-2077-0942
Marina V. Petrenko – Student, Omsk State Medical University. ORCID: 0009-0003-2077-0942
Иванова Дарья Сергеевна – доц. каф. поликлинической терапии и внутренних болезней, ФГБОУ ВО ОмГМУ. ORCID: 0000-0003-3668-1023
Daria S. Ivanova – Cand. Sci. (Med.), Omsk State Medical University. ORCID: 0000-0003-3668-1023
Поступила в редакцию: 18.09.2024
Поступила после рецензирования: 27.09.2024
Принята к публикации: 03.10.2024
Received: 18.09.2024
Revised: 27.09.2024
Accepted: 03.10.2024
Клинический разбор в общей медицине №10 2024
Клинический разбор пациентки с марфаноидным фенотипом и дивертикулярной болезнью
Номера страниц в выпуске:12-18
Аннотация
Термин «дисплазия соединительной ткани» (ДСТ) на территории постсоветского пространства так прочно вошел в медицинскую практику, что многие специалисты не стремятся верифицировать моногенные синдромы, нередко скрывающиеся за привычным обликом пациента-«диспластика». Приводится клиническое наблюдение пациентки с признаками ДСТ, которая с молодых лет наблюдается у разных специалистов с болевыми синдромами, трижды прооперирована по поводу абдоминального болевого синдрома, однако устойчивого положительного результата не получено. При осмотре пациентки с жалобами, указывающими на патологию пищеварительной системы, выявлены признаки системного вовлечения соединительной ткани (7 баллов в соответствие с Гентскими критериями), т.е. установлен марфаноидный фенотип, в сочетании с висцеральными поражениями, такими как трансверзоптоз, долихосигма, дивертикулярная болезнь и дивертикулит, которые подтверждают наличие наследственного нарушения соединительной ткани (ННСТ). Из базы наследственных заболеваний человека OMIM известно, что дивертикулы характерны для таких ННСТ, как синдром Марфана, синдром Элерса–Данло, синдром Коффина–Лоури, синдром Вильямса–Берена, аутосомно-доминантный поликистоз почек, между которыми проводился дифференциальный диагноз. После анализа всех данных можно предположить у нашей пациентки синдром Элерса–Данло. Известно, что именно дефект синтеза коллагена I или Ⅲ типов или тенаскина Х характеризует прогрессирующее поражение кишечника при дивертикулярной болезни с возможностью абдоминальных катастроф (разрыв кишки или дивертикулит с перитонитом), поэтому верификация диагноза с помощью генетического исследования особенно важна.
Ключевые слова: дивертикулярная болезнь, наследственные нарушения соединительной ткани, синдром Элерса–Данло, марфаноидный фенотип.
Для цитирования: Полтавцева А.М., Викторова И.А., Рожкова М.Ю., Петренко М.В., Иванова Д.С. Клинический разбор пациентки с марфаноидным фенотипом и дивертикулярной болезнью. Клинический разбор в общей медицине. 2024; 5 (10): 12–18.
DOI: 10.47407/kr2024.5.10.00489
Термин «дисплазия соединительной ткани» (ДСТ) на территории постсоветского пространства так прочно вошел в медицинскую практику, что многие специалисты не стремятся верифицировать моногенные синдромы, нередко скрывающиеся за привычным обликом пациента-«диспластика». Приводится клиническое наблюдение пациентки с признаками ДСТ, которая с молодых лет наблюдается у разных специалистов с болевыми синдромами, трижды прооперирована по поводу абдоминального болевого синдрома, однако устойчивого положительного результата не получено. При осмотре пациентки с жалобами, указывающими на патологию пищеварительной системы, выявлены признаки системного вовлечения соединительной ткани (7 баллов в соответствие с Гентскими критериями), т.е. установлен марфаноидный фенотип, в сочетании с висцеральными поражениями, такими как трансверзоптоз, долихосигма, дивертикулярная болезнь и дивертикулит, которые подтверждают наличие наследственного нарушения соединительной ткани (ННСТ). Из базы наследственных заболеваний человека OMIM известно, что дивертикулы характерны для таких ННСТ, как синдром Марфана, синдром Элерса–Данло, синдром Коффина–Лоури, синдром Вильямса–Берена, аутосомно-доминантный поликистоз почек, между которыми проводился дифференциальный диагноз. После анализа всех данных можно предположить у нашей пациентки синдром Элерса–Данло. Известно, что именно дефект синтеза коллагена I или Ⅲ типов или тенаскина Х характеризует прогрессирующее поражение кишечника при дивертикулярной болезни с возможностью абдоминальных катастроф (разрыв кишки или дивертикулит с перитонитом), поэтому верификация диагноза с помощью генетического исследования особенно важна.
Ключевые слова: дивертикулярная болезнь, наследственные нарушения соединительной ткани, синдром Элерса–Данло, марфаноидный фенотип.
Для цитирования: Полтавцева А.М., Викторова И.А., Рожкова М.Ю., Петренко М.В., Иванова Д.С. Клинический разбор пациентки с марфаноидным фенотипом и дивертикулярной болезнью. Клинический разбор в общей медицине. 2024; 5 (10): 12–18.
DOI: 10.47407/kr2024.5.10.00489
Clinical analysis of a patient with marfanoid phenotype and diverticular disease
Anastasiya M. Poltavtseva, Inna A. Viktorova, Maria Yu. Rozhkova, Marina V. Petrenko,Daria S. Ivanova
Omsk State Medical University, Omsk, Russia
poltavtseva.98@mail.ru
Abstract
The term "connective tissue dysplasia" (DST) in the territory of the post-Soviet space has become so firmly established in medical practice that many specialists do not seek to verify monogenic syndromes, often hiding behind the usual appearance of the patient "dysplasty". The clinical observation of a patient with signs of DST, who has been observed from a young age by various specialists with pain syndromes, has been operated on three times for abdominal pain syndrome, but no stable positive result has been obtained. Upon examination of a patient with complaints indicating pathology of the digestive system, signs of systemic connective tissue involvement were revealed (7 points in accordance with the Ghent criteria), that is, a marfanoid phenotype was established, in combination with visceral lesions such as transversoptosis, dolichosigma, diverticular disease and diverticulitis, which confirm the presence of hereditary connective tissue disorder (NST). From the OMIM database of hereditary human diseases, it is known that diverticula are characteristic of such NCDs as Marfan syndrome, Ehlers–Danlo syndrome, Coffin–Lowry syndrome, Williams–Behren syndrome, autosomal dominant polycystic kidney disease, between which a differential diagnosis was made. After analyzing all the data, it can be assumed that our patient has Ehlers–Danlo syndrome. It is known that it is a defect in the synthesis of collagen types I or Ⅲ or tenascin X that characterizes progressive intestinal damage in diverticular disease with the possibility of abdominal catastrophes (rupture of the intestine or diverticulitis with peritonitis), therefore, verification of the diagnosis using genetic research is especially important.
Keywords: diverticular disease, hereditary connective tissue disorders, Ehlers-Danlo syndrome, marfanoid phenotype.
For citation: Poltavtseva A.M., Viktorova I.A., Rozhkova M.Yu., Petrenko M.V., Ivanova D.S. Clinical analysis of a patient with marfanoid phenotype and diverticular disease. Clinical review for general practice. 2024; 5 (10): 12–18 (In Russ.). DOI: 10.47407/kr2024.5.10.00489
Наследственные заболевания соединительной ткани рассматриваются большинством специалистов как редкие, однако в последнее время появились данные о большей распространенности этих заболеваний [1]. На практике их выявление затруднительно по ряду причин. Во-первых, клиническое применение Гентских критериев синдрома Марфана для диагностики системного вовлечения соединительной ткани обременено такими методами обследования, как определение «протрузии вертлужной впадины» и «эктазии твердой мозговой оболочки» (высоконагрузочные рентгенологические исследования). Клиническая верификация синдрома Элерса–Данло с использованием критериев, разработанных Международным консорциумом в 2017 г., трудоемка, так как включает многочисленные специфические признаки 13 типов, верификация которых занимает много времени, значительно превышающего время стандартного приема даже врача генетика медико-генетической консультации [2, 3].
Во-вторых, молекулярно-генетические исследования, безусловно, показанные в этой ситуации, в рутинной медицинской практике для большинства пациентов недоступны из-за высокой стоимости (не входят в оплату системы обязательного медицинского страхования).
В-третьих, широкая фенотипическая протяженность признаков дисплазии соединительной ткани (ДСТ) от маловыраженных до тяжелых форм требует знаний и навыков дифференциации диагностики моногенных синдромов, которыми не в полной мере располагают даже генетики. Поэтому из клинической практики практически исчезли пациенты с диагнозами «синдром Марфана», «синдром Элерса–Данло», но появилось большое количество пациентов с недифференцированной ДСТ. Это затрудняет накопление, анализ и осмысление фактов для продуктивного развития этой области научных знаний.
Основные традиционно выделяемые диспластические фенотипы – марфаноподобный (с долихостеномелией, арахнодактилией) и элерсоподобный (с гипермобильностью суставов, гиперэластичной кожей) – нередко перекрещиваются между собой с невозможностью выделения ведущего. Оба синдрома ассоци-ируются с многочисленными отклонениями в опорно-двигательном аппарате, включая сколиоз, деформации грудной клетки и стопы. Эти нарушения включены как в Гентские критерии, так и критерии Международного консорциума 2017 г., и играют значительную роль в диагностике заболеваний. Отличительные характеристики скелета пациентов с синдромом Марфана и с некоторыми подтипами синдрома Элерса–Данло включают астеническое телосложение, высокий рост, превышающий верхние границы возрастных норм, высокое дугообразное нёбо, скученность зубов – признаки классического марфаноидного фенотипа [2, 3]. Однако помимо скелетопатий существует множество висцеральных проявлений данных заболеваний. В России они изучены применительно к недифференцированной ДСТ. Так, желудочно-кишечный тракт (ЖКТ) часто вовлекается в патологический процесс более чем в 70% случаев [4]. Описаны отклонения от нормы всех отделов пищеварительной системы, часто сочетающихся между собой. При ДСТ часто выявляются изменения длины и размеров органов пищеварения: мегаколон и долихосигма, удлиненный желчный пузырь. Изменения положения органов пищеварения также могут быть обусловлены нарушениями структуры и функции соединительной ткани при ДСТ [5]. При ирригоскопии изменения положения толстого кишечника обнаруживаются у 90% пациентов с ДСТ, колоноптоз – у 26% [4]. Диспластикозависимые изменения стенки полых органов ведут к развитию дивертикулов, которые могут возникать практически в любом отделе ЖКТ, чаще толстой кишки, несколько реже – двенадцатиперстной, возможно их сочетание [4, 5]. Высокая частота гастроэнтерологической патологии у пациентов с ДСТ, согласно российским публикациям, свидетельствует о частом вовлечении в диспластический процесс полых органов пищеварения.
В качестве примера, подтверждающего вышеизложенные факты, приводится клиническое наблюдение. Пациентка Б., 58 лет, обратилась с жалобами: на боли в животе после еды, нарушение стула со склонностью к запорам, першение в горле, горечь во рту, налет на языке.
Анамнез жизни: туберкулез, ВИЧ, гепатиты отрицает. Аллергологический анамнез не отягощен. Наследственность: мать страдает гипертонической болезнью, сахарным диабетом 2-го типа. Отец умер от рака ЖКТ.
 Из анамнеза заболевания. Считает себя больной с молодых лет, когда начали беспокоить боли в кишечнике, вздутие живота. Наблюдалась по поводу синдрома раздраженного кишечника, принимала по этому поводу множество препаратов, включая антидепрессанты с переменным эффектом. До настоящего времени по поводу интенсивных болей в животе перенесла три полостные операции (аппендэктомия, холецистэктомия, рассечение спаек) с развитием спаечной болезни органов брюшной полости. В 2020 г. пациентка перенесла COVID-19, после чего боли в животе усилились, изменился вкус привычных продуктов питания, появилось нарушение стула.
Из анамнеза заболевания. Считает себя больной с молодых лет, когда начали беспокоить боли в кишечнике, вздутие живота. Наблюдалась по поводу синдрома раздраженного кишечника, принимала по этому поводу множество препаратов, включая антидепрессанты с переменным эффектом. До настоящего времени по поводу интенсивных болей в животе перенесла три полостные операции (аппендэктомия, холецистэктомия, рассечение спаек) с развитием спаечной болезни органов брюшной полости. В 2020 г. пациентка перенесла COVID-19, после чего боли в животе усилились, изменился вкус привычных продуктов питания, появилось нарушение стула. В связи с этим пациентка неоднократно обследовалась: фиброгастродуоденоскопия (ФГДС), фиброколоноскопия (ФКС), кал на дисбиоз. Структурных патологических изменений выявлено не было.
При осмотре общее состояние удовлетворительное. Положение активное. Сознание ясное. Температура тела 36,6˚ С. Телосложение правильное. Тип конституции астенический. Достаточного питания. Обращает на себя внимание гипотония, гипотрофия мышц. Масса тела 67 кг, рост 174 см. ИМТ 22,1 кг/м2. Размах рук 183 см. Долихостеномелия (размах рук превышает рост на 9 см) (рис. 1). Арахнодактилия выявлена с помощью тестов большого пальца и запястья. Рост сидя 85 см, нижний сегмент = 87 см (174 см – рост стоя) (рис. 2). Кожа бледно-розовая, умеренной влажности. Растяжимость кожи на тыле кисти и на предплечье (внутренняя сторона недоминирующей руки) – 4 см. Видимые слизистые розовые. Склеры бледно-голубые. При осмотре полости рта обращает на себя внимание готическое нёбо, прогения, микрогнатия (гипоплазия верхней челюсти), скученность зубов. Язык обложен коричневым налетом. Со стороны зрительной системы: нарушения рефракции +3 диоптрия. Щитовидная железа: видимое увеличение перешейка, пальпаторно увеличен перешеек. Периферические лимфатические узлы не увеличены. Грудная клетка сложной разнонаправленной деформации: в верхней части килевидная форма
корпорокостального типа, а в нижней части (в области прикрепления мечевидного отростка к грудине) – кратерообразное воронкообразное вдавление (рис. 3). Отмечается сколиоз грудного отдела позвоночника 1-й степени (рис. 4).

Грудная клетка эластичная, обе половины одинаково участвуют в акте дыхания. Дыхание везикулярное, дополнительные дыхательные шумы не выслушиваются, ЧДД 16 в минуту. При аускультации сердца ритм правильный, тоны сердца ясные, ритмичные, PS 71 в минуту, АД 110/63 мм рт. ст. на фоне постоянного приема конкора 1,25 мг/день. Живот при осмотре правильной овальной формы, в размерах не увеличен. При пальпации живота отмечается дискомфорт в зоне Шоффара, болезненность в точке Мейо–Робсона 1 и 2. Печень пальпируется у края реберной дуги, край ее ровный, мягкий, безболезненный. Селезенка не пальпируется. Почки не пальпируются. Мочеиспускание свободное. При пальпации паравертебральных точек болезненности нет. Симптомы натяжения отрицательные. Отеков нет. Поперечное и продольное плоскостопие с натоптышами под вторыми пальцами стоп (рис. 5 и 6).

 Мобильность суставов по Beihton&Horan: наклон вперед (1 балл), переразгибание V пальцев (2 балла), сгибание больших пальцев к предплечью (2 балла), переразгибание коленей (0 баллов), переразгибание локтей (2 балла). Сумма составляет 7 баллов, что свидетельствует о гипермобильности суставов.
Мобильность суставов по Beihton&Horan: наклон вперед (1 балл), переразгибание V пальцев (2 балла), сгибание больших пальцев к предплечью (2 балла), переразгибание коленей (0 баллов), переразгибание локтей (2 балла). Сумма составляет 7 баллов, что свидетельствует о гипермобильности суставов.По пересмотренным Гентским критериям 2010 г. [2] для оценки вовлеченности соединительной ткани у пациентки выявлены следующие признаки: положительный симптом запястья и большого пальца (3 балла), килевидная деформация грудной клетки (2 балла), уменьшенное отношение верхнего сегмента к нижнему, увеличенное отношение размаха рук к росту и нетяжелая степень сколиоза (1 балл), плоскостопие (1 балл) (табл. 1). Сумма баллов составила 7 по Гентским критериям, что свидетельствует о системном вовлечении соединительной ткани [2] – наличие марфаноидного фенотипа. Однако других патогномоничных критериев синдрома Марфана (поражение сердечно-сосудистой системы и глаз) у пациентки в 58 лет не выявлено, что исключает его наличие.
При обследовании анализы крови и мочи без особенностей (табл. 2 и 4). На ЭКГ выявлено замедление внутрипредсердной проводимости.
При ФГДС выявлены проксимальный диффузный дуоденит, косвенные признаки дискинезии. Уреазный тест на H. pylori отрицательный.
На УЗИ признаки диффузных изменений в печени, поджелудочной железе, застоя в желчном пузыре. Уплотнение полостной системы и диффузные изменения в паренхиме почек. Метеоризм. Атеросклероз аорты (рис. 7 и 8).

Пациентка неоднократно проходила ФКС, при которой органической патологии обнаружено не было. При проведении МСКТ виртуальной колоноскопии были получены следующие данные: выявлены КТ-признаки дивертикулов толстой кишки с проявлениями дивертикулита, КТ-признаки хронического колита, КТ-признаки долихосигмы, трансверзоптоза (рис. 9 и 10).
Клинический диагноз. Основной: Дивертикулярная болезнь кишечника. Дивертикулы толстой кишки с дивертикулитом. Дисфункция сфинктера Одди по смешанному типу. Гастроэзофагеальная рефлюксная болезнь, неэрозивная форма. Хронический HP – негативный гастрит. Проксимальный дуоденит.
Фоновое заболевание: Марфаноидный фенотип. Трансверзоптоз. Долихосигма.
Сопутствующий: Гипертоническая болезнь II стадии, контролируемая, риск высокий. Атеросклероз аорты. Гиперхолестеринемия. Гипертензивная нефропатия. ХБП 3 А. Целевое АД ≤130/80 мм рт. ст.
Обсуждение
Дивертикулярная болезнь (ДБ) толстой кишки – достаточно распространенное и сложное заболевание, возникающее в результате взаимодействия множества внешних и внутренних факторов, в том числе и генетических [6]. Данные, подтверждающие роль генетических факторов в развитии ДБ, были получены из каталога наследственных заболеваний человека Online Mendelian Inheritance in Man® (OMIM) как проявление синдромных форм ННСТ, которые включают синдромы Марфана, Элерса–Данло, Коффина-Лоури, Вильямса–Берена, аутосомно-доминантный поликистоз [7–9]. Последние исследования свидетельствуют, что именно генетический дефект в генах, кодирующих коллагены I или III типов, или тенасцин Х предрасполагает к развитию ДБ [10–14]. Диагноз «синдром раздраженной кишки», с которым пациентка наблюдалась длительное время, исключен, так как выявленные изменения (ДБ, трансверзоптоз и долихосигма) следует расценивать как прогрессирующие проявления деградации соединительной ткани при генетическом дефекте синтеза волокнистых компонентов (коллагена или тенасцина Х) у пациентки с установленным марфаноидным фенотипом. Это наблюдение подчеркивает наличие генетической составляющей ДБ, несмотря на возникновение этой болезни в среднем возрасте, и усиливает идею о том, что именно изменения прочности волокнистых белков соединительной ткани с возрастом (коллагена или тенасцина) участвуют в патогенезе этого заболевания.Коллаген III типа преимущественно содержится в стенке кровеносных сосудов (аорта, другие артерии), полых органов (кишка, матка) и в коже [15]. Таким образом, нарушение процесса его образования может проявляться развитием не только сосудистых катастроф, но и кишечных, включая разрыв кишки с развитием перитонита или разрыв матки.
Отсутствие у нашей пациентки поражения сердечно-сосудистой системы и глаз, характерных для синдрома Марфана, а также отсутствие патогномоничных лицевых аномалий и ранних когнитивных нарушений, характерных для синдромов Вильямса–Берена и Коффина–Лоури, исключает наличие этих заболеваний. Поликистоз почек по данным ультразвукового исследования также исключен. Наличие марфаноидного фенотипа (7 баллов по признакам системного вовлечения соединительной ткани в соответствие с Гентскими критериями) и в то же время наличие гиперрастяжимой кожи и гипермобильности суставов в сочетании с лицевыми дизморфиями и ДБ делает наиболее вероятным диагноз «синдром Элерса–Данло» с возможностью классически-подобного, гипермобильного или сосудистого типов. Данное заключение основано на указании единого генетического дефекта синдрома Элерса–Данло и ДБ в OMIM: нарушение синтеза коллагена I или III типов или тенасцина Х. Несмотря на все приведенные факты, диагноз «синдром Элерса–Данло» остается предположительным в отсутствие молекулярно-генетического исследования.
Установление точного генетического дефекта помогло бы предугадать возможный патогенетический ход событий и осложнений при системном вовлечении соединительной ткани, ведь такие пациенты имеют риск развития перитонита на фоне дивертикулита или разрыва кишки. Данные об инвалидизирующих и фатальных осложнениях ДБ при синдроме Элерса–Данло были получены по запросу «дивертикулярная болезнь» в каталоге OMIM. Найдено описание двух неродственных пациентов с дефицитом тенасцина X и установленным диагнозом «синдром Элерса–Данло» без его классических проявлений (атрофические рубцы, плохое заживление ран), но с ДБ кишечника, осложнившуюся разрывом дивертикула [14].
Заключение
Настоящий клинический пример демонстрирует присущую пациентам с марфаноподобным фенотипом полиморбидность, низкий порог болевой чувствительности с множественными болевыми синдромами и неповторяющееся сочетание клинических диспластических признаков, которое называется «фенотипической протяженностью». Необходимость тщательного клинического обследования и наблюдения пациентов-диспластиков с верификацией генетического дефекта в «причинных» генах, ответственных за синтез коллагена 1-го и 3-го типов, а также тенасцина Х в данном случае, вероятнее всего, поможет предсказать и предотвратить инвалидизирующие или фатальные осложнения.Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Полтавцева Анастасия Максимовна – асс. каф. поликлинической терапии и внутренних болезней, ФГБОУ ВО ОмГМУ.
ORCID: 0000-0002-5342-9279
Anastasiya M. Poltavtseva – Аssistant, Omsk State Medical University. ORCID: 0000-0002-5342-9279
Викторова Инна Анатольевна – д-р мед. наук, проф., зав. каф. поликлинической терапии и внутренних болезней, ФГБОУ ВО ОмГМУ. ORCID: 0000-0001-8728-2722
Inna A. Viktorova – Dr. Sci. (Med.), Full Prof., Omsk State Medical University. ORCID: 0000-0001-8728-2722
Рожкова Мария Юрьевна – доц. каф. поликлинической терапии и внутренних болезней ФГБОУ ВО ОмГМУ. ORCID: 0000-0002-7695-149X
Maria Yu. Rozhkova – Assoc. Prof., Omsk State Medical University. ORCID: 0000-0002-7695-149X
Петренко Марина – студентка VI курса лечебного факультета, ФГБОУ ВО ОмГМУ. ORCID: 0009-0003-2077-0942
Marina V. Petrenko – Student, Omsk State Medical University. ORCID: 0009-0003-2077-0942
Иванова Дарья Сергеевна – доц. каф. поликлинической терапии и внутренних болезней, ФГБОУ ВО ОмГМУ. ORCID: 0000-0003-3668-1023
Daria S. Ivanova – Cand. Sci. (Med.), Omsk State Medical University. ORCID: 0000-0003-3668-1023
Поступила в редакцию: 18.09.2024
Поступила после рецензирования: 27.09.2024
Принята к публикации: 03.10.2024
Received: 18.09.2024
Revised: 27.09.2024
Accepted: 03.10.2024
Список исп. литературыСкрыть список1. McGillis L, Mittal N, Santa Mina D et al. Utilization of the 2017 diagnostic criteria for hEDS by the Toronto GoodHope Ehlers-Danlos syndrome clinic: A retrospective review. Am j med genetics. Part A. 2020;182(3):1552-4833.
2. Loeys BL, Dietz HC, Braverman AC et al. The revised ghent nosology for the marfan syndrome. J Med Genetics 2010;47:476-85.
3. Арсентьев В.Г., Кадурина Т.И., Аббакумова Л.Н. Новые принципы диагностики и классификации синдрома Элерса–Данло. Педиатр. 2018;9(1):118–25.
Аrsentev VG, Kadurina TI, Abbakumova LN. New principles of diagnosis and classification of the Ehlers-Danlos syndrome. Pediatrician (St. Petersburg). 2018;9(1):118-25 (in Russian).
4. Яковлев В.М. Иммунопатологические синдромы при наследственной дисплазии соединительной ткани. Ставроп. гос. мед. акад., Ом. гос. мед. акад. Ставрополь: [б. и.], 2005.
Yakovlev V.M. Immunopathological syndromes in hereditary connective tissue dysplasia. Stavropol State Medical University. akad., Om. state. med. acad. Stavropol: [B. I.], 2005 (in Russian).
5. Нечаева Г.И. Дисплазия соединительной ткани: основные гастроэнтерологические проявления. Эксперим. и клин. гастроэнтерол. 2010;(6):66-9.
Nechaeva G.I., Lialiukova E.A., Rozhkova M.Iu. Connective tissue dysplasia: the main gastrointestinal manifestations. Eksp Klin Gastroenterol. 2010;(6):66-9 (in Russian).
6. Barbaro MR, Cremon C, Fuschi D et al. Pathophysiology of Diverticular Disease: From Diverticula Formation to Symptom Generation. Int J Mol Sci 2022;23:6698.
7. Beighton PH, Murdoch JL, Votteler T. Gastrointestinal complications of the Ehlers-Danlos syndrome. Gut 1969;10:1004-8. DOI: 10.1136/gut. 10.12.1004
8. Stagi S, Lapi E, Chiarelli F, de Martino M. Incidence of diverticular disease and complicated diverticular disease in young patients with Williams syndrome. Pediatric Surg Int 2010;26:943-44. DOI: 10.1007/s00383-010-2666-6
9. Tursi A. Current and Evolving Concepts on the Pathogenesis of Diverticular Disease. J Gastrointestin Liver Dis 2019; 28:225-3. DOI: 10.15403/JGLD-184
10. Reichert MC, Kupcinskas J, Krawczyk M et al. Variant of COL3A1 (rs3134646) Is associated with risk of developing diverticulosis in white men. Dis Colon Rectum 2018;61:604-11. DOI: 10.1097/DCR. 0000000000001001
11. Connelly TM, Berg AS, Hegarty JP et al. The TNFSF15 gene single nucleotide polymorphism rs7848647 is associated with surgical diverticulitis. Ann Surg 2014;259:1132–7. DOI: 10.1097/SLA.0000000000000232
12. Sigurdsson S, Alexandersson KF, Sulem P et al. Sequence variants in ARHGAP15, COLQ and FAM155A associate with diverticular disease and diverticulitis. Nat Commun 2017;8:15789. DOI: 10.1038/ncomms15789
13. Coble JL, Sheldon KE, Yue F. et al. Identification of a rare LAMB4 variant associated with familial diverticulitis through exome sequencing. Hum Mol Genet 2017;26:3212-20.
14. Lindor NM, Bristow J. Tenascin-X deficiency in autosomal recessive Ehlers-Danlos syndrome. Am J Med Genet A 2005 May 15;135(1):75-80. DOI: 10.1002/ajmg.a.30671
15. Николаева Е.А., Семячкина А.Н. Гено-фенотипическая характеристика синдрома Элерса–Данло: трудности идентификации типов заболевания и подходы к патогенетическому лечению. Рос. вестн. перинатол. и педиатр. 2021;66:(1):22-30. DOI: 10.21508/1027–4065–2021–66–1–22–30.
Nikolaeva E.А., Semyachkina А.N. Geno-phenotypic characteristics of Ehlers-Danlos syndrome: difficulties of disease type identification and approaches to pathogenetic treatment. Ros Vestn Perinatol i Pediatr 2021;66:(1):22-30
DOI: 10.21508/1027–4065–2021–66–1–22–30 (in Russian).
