Клинический разбор в общей медицине №10 2024
1 Polyakov Samara Regional Clinical Cardiological Dispensary, Samara, Russia;
2 Samara State Medical University, Samara, Russia
kseniabal@list.ru
Abstract
Recently, the correction of iron deficiency in patients with chronic heart failure has been widely studied to improve the prognosis and course of the disease. At the same time, there are not so many works devoted to the study of the use of iron preparations in patients with pulmonary arterial hypertension. Timely diagnosis and treatment of anemia or latent iron deficiency in patients of this category not only correct the symptoms of anemia, but also prevent the progression of the disease. However, at present, in real clinical practice, parenteral iron preparations in patients with latent iron deficiency are rarely used, as a result of which active outreach among practitioners is necessary in order to expand the use of this type of treatment.
Keywords: pulmonary arterial hypertension, iron deficiency, anemia, Ferric carboxymaltose.
For citation: Balkina K.V., Pavlova T.V. A clinical case of iron deficiency anemia in a patient with pulmonary arterial hypertension: a multidisciplinary problem. Clinical review for general practice. 2024; 5 (10): 33–38 (In Russ.). DOI: 10.47407/kr2024.5.10.00493
Дефицит железа (ДЖ) часто встречается у пациентов с сердечной недостаточностью (СН) независимо от наличия или отсутствия клинически проявленной анемии и оказывает более выраженное негативное влияние на прогноз больных, чем анемия без ДЖ [2, 3]. Наличие ДЖ у пациентов с СН связано с повышенным риском госпитализаций и смерти, со снижением качества жизни и более низкой толерантностью к физической нагрузке [2, 4].
Связь между ДЖ и ЛАГ изучена недостаточно. В качестве основных патологических механизмов ДЖ у таких пациентов рассматривают гипоксию, воспаление, функциональные изменения мышечных клеток ЛА. Воздействие гипоксии может вызвать сужение легочных сосудов, что приводит к повышению систолического давления в легочной артерии (СДЛА). Кроме того, вызванные гипоксией вазоконстрикция и ЛГ могут быть усилены хелатированием железа у здоровых взрослых [5]. Легочная гипертоническая реакция, вызванная высотной гипоксией, может быть прекращена инфузией железа, уменьшая СДЛА на 6 мм рт. ст. у жителей на уровне моря. У пациентов с хронической горной болезнью, подвергавшихся снижению уровня железа путем венесекции, наоборот, наблюдалось увеличение СДЛА на 25% [6]. Предполагается, что ДЖ по аналогии с гипоксией увеличивает СДЛА, что может частично объяснить патогенез ЛАГ [7]. В исследовании, опубликованном в журнале Proceedings of the National Academy of Sciences, сообщалось о прямой причинно-следственной связи между ними [8]. Авторы показали, что внутриклеточный ДЖ в гладкомышечных клетках легочной артерии (pulmonary arterial smooth muscle cell-PASMCs) приводит к увеличению концентрации эндогенного вазоконстриктора эндотелина-1, который, как известно, повышен у пациентов с ЛАГ [9]. Кроме того, авторы доказали, что нарушение регуляции этого клеточно-автономного пути может быть этиологическим фактором в случае семейной ЛАГ. Действительно, гладкомышечные клетки ЛА у пациентов с мутациями в рецепторе костного морфогенетического белка 2 (наследственная ЛАГ) снижали экспрессию гепсидина и внутриклеточные уровни железа, увеличивали уровни ферропортина и эндотелина-1 [10]. Согласно клиническим данным, ДЖ достаточно широко распространен и коррелирует со снижением толерантности к физической нагрузке как у пациентов с идиопатической, так и с наследственной формами ЛАГ [11]. Следует особо подчеркнуть, что применение антагонистов эндотелиновых рецепторов в составе ЛАГ-специфической терапии также может приводить к анемии.
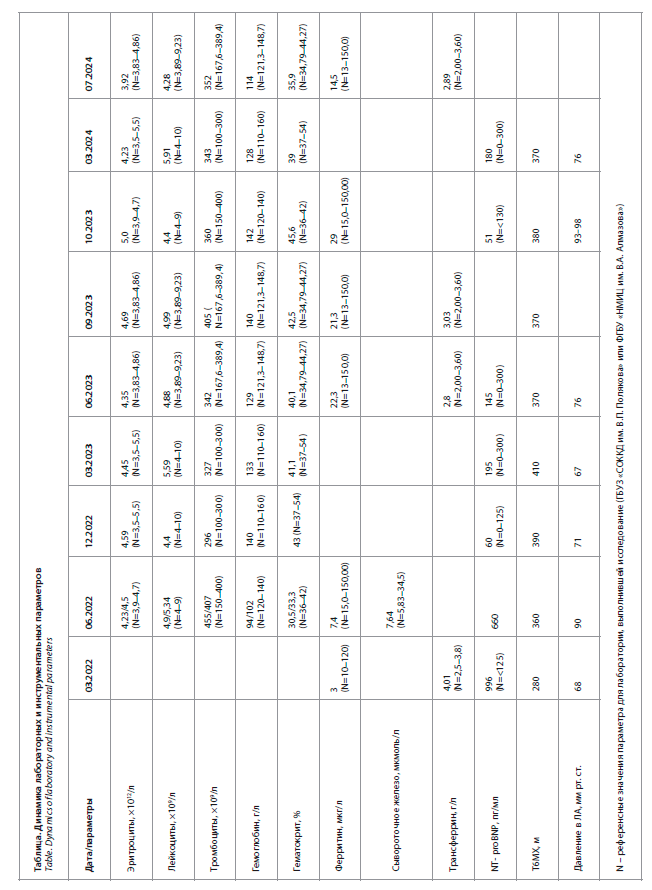
В.П. Полякова» и ФГБУ «НМИЦ им. В.А. Алмазова», для удобства восприятия сведены в единую таблицу с указанием референсных значений для каждой из лабораторий (N).
С января 2022 г. без воздействия какого-либо провоцирующего фактора пациентка стала отмечать появление одышки при физической нагрузке с постепенным ее нарастанием, пресинкопальные состояния при ускорении темпа ходьбы.
В марте 2022 г. пациентка обратилась в поликлинику ГБУЗ «СОККД им. В.П. Полякова», где было проведено обследование:
• Тест 6-минутной ходьбы (Т6МХ) от 03.2022 – 280 м, что соответствует III функциональному классу (ФК).
• Кровь на N-концевой пропептид натрийуретического гормона (NT-proBNP) от 03.2022 – 996 пг/мл.
• Биохимический анализ крови от 03.2022 – ферритин 3 мкг/л, трансферрин – 4,01 г/л.
• Эхокардиография (ЭхоКГ) от 03.2022 – ср. ДЛА 68 мм рт. ст.
Учитывая поливалентную аллергию, в том числе на препараты йода, пациентке была выполнена мультиспиральная компьютерная томография легких без контрастного усиления. Заключение: патологии со стороны легочной паренхимы не выявлено; КТ-признаки ЛГ.
По результатам обследования был поставлен диагноз: «Легочная гипертензия неясного генеза».
В апреле 2022 г. пациентка была госпитализирована в стационар ГБУЗ «СОККД им. В.П. Полякова» в связи с декомпенсацией хронической сердечной недостаточности (ХСН). После стабилизации состояния пациентка была направлена в ФГБУ «НМИЦ им. В.А. Алмазова» для дообследования и решения вопроса о дальнейшей тактике лечения.
В ФГБУ «НМИЦ им. В.А. Алмазова» пациентка была госпитализирована в апреле 2022 г.
Результаты обследований:
Сцинтиграфия легких от 28.04.2022 – сцинтиграфических признаков тромбоэмболии ЛА не выявлено. Глобальная перфузия легочных полей симметричная;
ЭхоКГ от 29.04.2022 – правое предсердие 46×52 мм; правый желудочек: парастернальная позиция 35 мм, 4-камерная 45 мм, передняя стенка 3,7 мм. ЛА – 27 мм. Регургитация на трикуспидальном клапане (ТК) 2-й степени. Дилатация правых камер. Тенденция к парадоксальному движению межжелудочковой перегородки как признак перегрузки правого желудочка; расчетное СДЛА повышено.
С 10.06.2022 по 29.06.2022 пациентка вновь находилась на стационарном лечении в ФГБУ «НМИЦ им.
В.А. Алмазова». Результаты обследования:
• Т6МХ от 16.06.2022 – 360 м, что соответствует II ФК;
• Кровь на NT – proBNP – 660 пг/мл.
• Лабораторные данные: гемоглобин – 94 г/л, сывороточное железо – 7,64 мкмоль/л, ферритин 7,40 нг/мл.
• Чреспищеводное ЭхоКГ от 16.06.2022 – тромбы в ушке левого передсердия не визуализируются. Правые камеры расширены. ЛА 31 мм. Патологических шунтов не выявлено.
• ЭхоКГ от 17.06.2022 – расчетное СДЛА 90 мм рт. ст., недостаточность ТК 2-й степени.
• Спирография от 17.06.2022 – на фоне нормальных значений функции легких проба с бронхолитиком отрицательная.
• Бодиплетизмография от 22.06.2022 – норма.
• Эргоспирометрия от 22.06.2022 – пиковое потребление кислорода – 25% при достигнутом анаэробном пороге, значение которого также ниже нормы. Прирост сердечного выброса преимущественно за счет низкой доставки кислорода легкими из-за паттерна дыхания – частое поверхностное дыхание, дыхательный объем всего 700 мл, частота дыхательных движений 38, что обусловливает неэффективность газообмена, раннее наступление анаэробного порога, высокие вентиляторные эквиваленты. Доставка кислорода на объем выполненной работы снижена.
• Катетеризация правых камер сердца от 20.06.2022 – у пациентки имеется прекапиллярная ЛГ (ср. ДЛА 36 мм рт. ст., ДЗЛА 3 мм рт. ст., ЛСС 7 Ед. Вуда).
• Вазореактивный тест с илопростом отрицательный.
Учитывая наличие анемического синдрома, пациентке были назначены пероральные препараты железа, однако анемия сохранялась. Выполнена фиброгастродуоденоскопия: эндоскопические признаки формирующейся кардиальной грыжи пищеводного отверстия диафрагмы. Эритематозная гастропатия, эритематозная дуоденопатия. Пациентка была проконсультирована гематологом, который для быстрой компенсации железодефицитной анемии рекомендовал терапию препаратами железа внутривенно. Была проведена однократная инфузия препарата карбоксимальтозата железа в дозе 800 мкг. При выписке из стационара уровень гемоглобина пациентки составил 102 г/л.
Пациентка была выписана с диагнозом: Идиопатическая легочная гипертензия, III ФК (ВОЗ). Катетеризация правых отделов сердца от 20.06.2022. HIIА, NYHA II ФК. Дислипидемия. Кардиальная грыжа пищеводного отверстия диафрагмы. Хронический эритематозный гастродуоденит. Хроническая железодефицитная анемия легкой степени.
На амбулаторном этапе лечения пациентке был рекомендован длительный прием пероральных препаратов железа, назначена комбинированная ЛАГ-специфическая терапия: силденафил и селексипаг.
После выписки из стационара пациентка динамически наблюдалась в ГБУЗ «СОККД им. В.П. Полякова», где проводилось регулярное обследование:
• ЭхоКГ от 09.2022 – СДЛА 71 мм рт. ст.
• Кровь на NT-proBNP от 03.2023 – 195 пг/мл.
• ЭхоКГ от 03.2023 – СДЛА 67 мм рт. ст.
По результатам лабораторных исследований за время диспансерного наблюдения уровень гемоглобина составлял от 129 до 140 г/л, также отмечалось повышение уровня ферритина до 22,3 мкмоль/л.
Клинически пациентка отмечала улучшение самочувствия: уменьшилась одышка, повысилась толерантность к физической нагрузке. По результатам Т6МХ зафиксировано увеличение пройденного расстояния до 410 м. За время наблюдения не было ни одной госпитализации с декомпенсацией ХСН.
По рекомендации ФГБУ «НМИЦ им. В.А. Алмазова» для оценки эффективности 2-компонентной ЛАГ-специфической терапии пациентка была вновь направлена на госпитализацию, и повторно находилась на стационарном лечении в ФГБУ «НМИЦ им. В.А. Алмазова» с 03.10.2023 по 18.10.2023. Результаты обследования:
• ЭхоКГ – дилатация правых отделов сердца с признаками объемной перегрузки и парадоксальным движением межжелудочковой перегородки. Регургитация на ТК 3-й степени. ЛА расширена. СДЛА 93–98 мм рт. ст.
• Магнитно-резонансная томография сердца – дилатация правых камер сердца, парадоксальное движение межжелудочковой перегородки, недостаточность ТК.
• Кровь на NT-proBNP – 51 пг/мл.
• Катетеризация правых отделов сердца – среднее давление в легочной артерии – 38 мм рт. ст., сердечный индекс 2,9 м/мин/м2, легочное сосудистое сопротивление 6,1 Ед. Вуда.
• Т6МХ – 380 м.
• Гемоглобин – 142 г/л.
Пациентке была назначена 3-компонентная ЛАГ-специфическая терапия: силденафил 20 мг 3 раза в день, селексипаг 1600 мкг 2 раза в сутки, амбризентан 10 мг 1 таблетке в сутки.
Диагноз при выписки из стационара: «Идиопатическая легочная артериальная гипертензия III ФК (ВОЗ). H IIA, 2 NYHA. Трикуспидальная недостаточность 3-й степени. Недостаточность клапана легочной артерии 2-й степени. Желудочковая экстрасистолия 1-й гр. по RYAN. Катетеризация полостей сердца в условиях ОРИТ от 20.06.2022, 06.10.2023. Дислипидемия. Кардиальная грыжа пищеводного отверстия диафрагмы. Эритематозная гастродуоденопатия. Аппендэктомия от 2013 г. Резекция кисты левого яичника (в 17 лет)».
Находясь под диспансерным наблюдением в ГБУЗ «СОККД им. В.П. Полякова», пациентка регулярно проходит протокольные обследования, в том числе и для своевременной диагностики анемии, так как препарат амбризентан может приводить к снижению уровня гемоглобина. Результаты обследования на амбулаторном этапе лечения:
• Т6МХ 03.2024 – 390 м.
• NT-proBNP 03.2024 – 180 пг/мл.
• ЭХОКГ 03.2024 – СДЛА 76 мм рт. ст.
• Уровень гемоглобина 03.2024 – 128 г/л.
• Уровень гемоглобина 07.2024 – 114 г/л.
Согласно рекомендациям, полученным при выписке из ФГБУ «НМИЦ им. В.А. Алмазова» еще в июне 2022 г., пациентка должна была длительно принимать один из пероральных препаратов железа. Однако при тщательном опросе установлено, что пациентка принимала данные лекарственные средства эпизодически, меняя при этом действующие вещества (железа сульфат, железа глюконат, железа протеин сукцинилат), и в июле 2024 г. вновь было зафиксировано снижение уровня гемоглобина, при этом пациентка отмечала усиление общей слабости и нарастание одышки. На очередном визите в ГБУЗ «СОККД им. В.П. Полякова» была проведена беседа о необходимости постоянного приема препаратов железа. Следующий визит запланирован на октябрь 2024 г. для оценки состояния в динамике и решения вопроса о целесообразности повторного введения парентеральной формы препарата железа.
обосновывает его включение в рекомендации по лечению ХСН от 2020 г. [12]. Согласованное мнение экспертов по поводу лечения ДЖ у стабильных и декомпенсированных больных ХСН, опубликованное в журнале «Кардиология» в 2021 г. [13], гласит, что внутривенное введение железа карбоксимальтозата у пациентов с сочетанием ХСН с ФВ ЛЖ <50% и железодефицита, на фоне декомпенсации ХСН, позволяет предотвращать последующие декомпенсации. В 2024 г. опубликованы результаты исследования, проведенного на базе ФГБУ «НМИЦ им. В.А. Алмазова», посвященного изучению обмена железа и распространенности ДЖ у пациентов с ЛАГ и хронической тромбоэмболической легочной гипертензией на основании различных лабораторных критериев [14]. В целом же работ, подтверждающих эффективность применения препаратов железа у пациентов с ДЖ и легочной гипертензией пока не так много.
В описанном нами клиническом случае показан пример успешной коррекции анемии парентеральным препаратом карбоксимальтозат железа у пациентки с ЛАГ. Однако в дальнейшем, на фоне лечения амбризентаном и нерегулярного приема разных форм перорального железа, анемия у пациентки вновь прогрессировала и привела к нарастанию симптоматики ХСН. В повседневной клинической практике необходимо внедрять регулярную диагностику данного состояния для своевременного выявления ДЖ и оценки показаний к назначению препаратов железа. Согласно последним рекомендациям по диагностике и лечению ЛГ, следует проводить коррекцию ДЖ и лечение анемии для профилактики прогрессирования заболевания (УУР В, УДД 2) [15–17]. Даже при отсутствии клинически выраженной анемии следует рассмотреть возможность коррекции ДЖ у пациентов ЛАГ (УУР В, УДД 3) [15] для улучшения симптомов основного заболевания, повышения толерантности к физической нагрузке и качества жизни.
Проблемой современной медицины является отсутствие специально спланированных клинических исследований, сравнивающих эффективность и безопасность парентеральных и пероральных форм препаратов железа, а также конкретных действующих молекул железа между собой.
Информация об авторах
Information about the authors
Балькина Ксения Васильевна – врач-кардиолог консультативно-реабилитационного отделения ГБУЗ «СОККД им. В.П. Полякова», аспирант каф. пропедевтической терапии с курсом кардиологии ИКМ, ГБОУ ВО СамГМУ. E-mail: kseniabal@list.ru;
ORCID: 0009-0000-3615-2143
Ksenia Vasilyevna Balkina – Cardiologist, Polyakov Samara Regional Clinical Cardiological Dispensary, Graduate Student, Samara State Medical University. E-mail: kseniabal@list.ru; ORCID: 0009-0000-3615-2143
Павлова Татьяна Валентиновна – д-р мед. наук, проф. каф. пропедевтической терапии с курсом кардиологии ИКМ, ГБОУ ВО СамГМУ. E-mail: ptvsam63@mail.ru; ORCID: 0000-0003-3301-1577
Tatyana V. Pavlova – Dr. Sci. (Med.), Prof., Samara State Medical University. E-mail: ptvsam63@mail.ru; ORCID: 0000-0003-3301-1577
Поступила в редакцию: 25.09.2024
Поступила после рецензирования: 03.10.2024
Принята к публикации: 10.10.2024
Received: 25.09.2024
Revised: 03.10.2024
Accepted: 10.10.2024
Клинический разбор в общей медицине №10 2024
Клинический случай железодефицитной анемии у пациентки с легочной артериальной гипертензией: мультидисциплинарная проблема
Номера страниц в выпуске:33-38
Аннотация
В последнее время внимание клиницистов привлекают проблемы лечения дефицита железа у пациентов с хронической сердечной недостаточностью различного генеза, так как коррекция этого состояния улучшает прогноз и течение заболевания. При этом работ, посвященных изучению применения препаратов железа у пациентов с легочной артериальной гипертензией, не так много. Своевременная диагностика и лечение анемии или скрытого железодефицита у пациентов данной категории не только корректируют симптомы анемии, но и профилактируют прогрессирование основного заболевания. Однако в клинической практике парентеральные препараты железа у пациентов со скрытым его дефицитом используют достаточно редко, вследствие чего необходима активная разъяснительная работа среди практикующих врачей с целью расширения использования данного вида лечения.
Ключевые слова: легочная артериальная гипертензия, железодефицит, анемия, карбоксиматозат железа.
Для цитирования: Балькина К.В., Павлова Т.В. Клинический случай железодефицитной анемии у пациентки с легочной артериальной гипертензией: мультидисциплинарная проблема. Клинический разбор в общей медицине. 2024; 5 (10): 33–38. DOI: 10.47407/kr2024.5.10.00493
В последнее время внимание клиницистов привлекают проблемы лечения дефицита железа у пациентов с хронической сердечной недостаточностью различного генеза, так как коррекция этого состояния улучшает прогноз и течение заболевания. При этом работ, посвященных изучению применения препаратов железа у пациентов с легочной артериальной гипертензией, не так много. Своевременная диагностика и лечение анемии или скрытого железодефицита у пациентов данной категории не только корректируют симптомы анемии, но и профилактируют прогрессирование основного заболевания. Однако в клинической практике парентеральные препараты железа у пациентов со скрытым его дефицитом используют достаточно редко, вследствие чего необходима активная разъяснительная работа среди практикующих врачей с целью расширения использования данного вида лечения.
Ключевые слова: легочная артериальная гипертензия, железодефицит, анемия, карбоксиматозат железа.
Для цитирования: Балькина К.В., Павлова Т.В. Клинический случай железодефицитной анемии у пациентки с легочной артериальной гипертензией: мультидисциплинарная проблема. Клинический разбор в общей медицине. 2024; 5 (10): 33–38. DOI: 10.47407/kr2024.5.10.00493
A clinical case of iron deficiency anemia in a patient with pulmonary arterial hypertension: a multidisciplinary problem
Ksenia V. Balkina1,2, Tatyana V. Pavlova11 Polyakov Samara Regional Clinical Cardiological Dispensary, Samara, Russia;
2 Samara State Medical University, Samara, Russia
kseniabal@list.ru
Abstract
Recently, the correction of iron deficiency in patients with chronic heart failure has been widely studied to improve the prognosis and course of the disease. At the same time, there are not so many works devoted to the study of the use of iron preparations in patients with pulmonary arterial hypertension. Timely diagnosis and treatment of anemia or latent iron deficiency in patients of this category not only correct the symptoms of anemia, but also prevent the progression of the disease. However, at present, in real clinical practice, parenteral iron preparations in patients with latent iron deficiency are rarely used, as a result of which active outreach among practitioners is necessary in order to expand the use of this type of treatment.
Keywords: pulmonary arterial hypertension, iron deficiency, anemia, Ferric carboxymaltose.
For citation: Balkina K.V., Pavlova T.V. A clinical case of iron deficiency anemia in a patient with pulmonary arterial hypertension: a multidisciplinary problem. Clinical review for general practice. 2024; 5 (10): 33–38 (In Russ.). DOI: 10.47407/kr2024.5.10.00493
Введение
Легочная артериальная гипертензия (ЛАГ) – это прекапиллярная форма легочной гипертензии (ЛГ) при отсутствии заболеваний легких, хронической тромбоэмболии в систему легочной артерии (ЛА), других редких болезней (группа V) в качестве возможных причин повышения давления в легочной артерии (ДЛА). Прекапиллярная ЛГ – гемодинамический вариант ЛГ при среднем давлении в легочной артерии – ср. ДЛА >20 мм рт. ст., давлении заклинивания легочной артерии (ДЗЛА) ≤15 мм рт. ст., легочном сосудистом сопротивлении (ЛСС) >2 единиц Вуда [3]. ЛАГ классифицируется на идиопатическую, наследственную, вызванную лекарственными средствами и токсинами, ассоциированную с другими заболеваниями (например, врожденными пороками сердца, системными заболеваниями соединительной ткани, портальной гипертензией, шистосомозом, инфекцией, вызванной вирусом иммунодефицита человека), легочную веноокклюзионную болезнь/легочный капилллярный гемангиоматоз, персистирующую ЛАГ новорожденных. Диагноз идиопатической ЛАГ устанавливают при верифицированной ЛАГ после исключения наследственного анамнеза и всех ассоциированных форм патологии [1].Дефицит железа (ДЖ) часто встречается у пациентов с сердечной недостаточностью (СН) независимо от наличия или отсутствия клинически проявленной анемии и оказывает более выраженное негативное влияние на прогноз больных, чем анемия без ДЖ [2, 3]. Наличие ДЖ у пациентов с СН связано с повышенным риском госпитализаций и смерти, со снижением качества жизни и более низкой толерантностью к физической нагрузке [2, 4].
Связь между ДЖ и ЛАГ изучена недостаточно. В качестве основных патологических механизмов ДЖ у таких пациентов рассматривают гипоксию, воспаление, функциональные изменения мышечных клеток ЛА. Воздействие гипоксии может вызвать сужение легочных сосудов, что приводит к повышению систолического давления в легочной артерии (СДЛА). Кроме того, вызванные гипоксией вазоконстрикция и ЛГ могут быть усилены хелатированием железа у здоровых взрослых [5]. Легочная гипертоническая реакция, вызванная высотной гипоксией, может быть прекращена инфузией железа, уменьшая СДЛА на 6 мм рт. ст. у жителей на уровне моря. У пациентов с хронической горной болезнью, подвергавшихся снижению уровня железа путем венесекции, наоборот, наблюдалось увеличение СДЛА на 25% [6]. Предполагается, что ДЖ по аналогии с гипоксией увеличивает СДЛА, что может частично объяснить патогенез ЛАГ [7]. В исследовании, опубликованном в журнале Proceedings of the National Academy of Sciences, сообщалось о прямой причинно-следственной связи между ними [8]. Авторы показали, что внутриклеточный ДЖ в гладкомышечных клетках легочной артерии (pulmonary arterial smooth muscle cell-PASMCs) приводит к увеличению концентрации эндогенного вазоконстриктора эндотелина-1, который, как известно, повышен у пациентов с ЛАГ [9]. Кроме того, авторы доказали, что нарушение регуляции этого клеточно-автономного пути может быть этиологическим фактором в случае семейной ЛАГ. Действительно, гладкомышечные клетки ЛА у пациентов с мутациями в рецепторе костного морфогенетического белка 2 (наследственная ЛАГ) снижали экспрессию гепсидина и внутриклеточные уровни железа, увеличивали уровни ферропортина и эндотелина-1 [10]. Согласно клиническим данным, ДЖ достаточно широко распространен и коррелирует со снижением толерантности к физической нагрузке как у пациентов с идиопатической, так и с наследственной формами ЛАГ [11]. Следует особо подчеркнуть, что применение антагонистов эндотелиновых рецепторов в составе ЛАГ-специфической терапии также может приводить к анемии.
Клинический случай
Далее мы приводим описание клинического случая пациентки 38 лет, у которой была диагностирована ЛАГ с сопутствующим ДЖ. Избранные результаты лабораторных и инструментальных методов исследования в динамике, выполненные в ГБУЗ «СОККД им.В.П. Полякова» и ФГБУ «НМИЦ им. В.А. Алмазова», для удобства восприятия сведены в единую таблицу с указанием референсных значений для каждой из лабораторий (N).
С января 2022 г. без воздействия какого-либо провоцирующего фактора пациентка стала отмечать появление одышки при физической нагрузке с постепенным ее нарастанием, пресинкопальные состояния при ускорении темпа ходьбы.
В марте 2022 г. пациентка обратилась в поликлинику ГБУЗ «СОККД им. В.П. Полякова», где было проведено обследование:
• Тест 6-минутной ходьбы (Т6МХ) от 03.2022 – 280 м, что соответствует III функциональному классу (ФК).
• Кровь на N-концевой пропептид натрийуретического гормона (NT-proBNP) от 03.2022 – 996 пг/мл.
• Биохимический анализ крови от 03.2022 – ферритин 3 мкг/л, трансферрин – 4,01 г/л.
• Эхокардиография (ЭхоКГ) от 03.2022 – ср. ДЛА 68 мм рт. ст.
Учитывая поливалентную аллергию, в том числе на препараты йода, пациентке была выполнена мультиспиральная компьютерная томография легких без контрастного усиления. Заключение: патологии со стороны легочной паренхимы не выявлено; КТ-признаки ЛГ.
По результатам обследования был поставлен диагноз: «Легочная гипертензия неясного генеза».
В апреле 2022 г. пациентка была госпитализирована в стационар ГБУЗ «СОККД им. В.П. Полякова» в связи с декомпенсацией хронической сердечной недостаточности (ХСН). После стабилизации состояния пациентка была направлена в ФГБУ «НМИЦ им. В.А. Алмазова» для дообследования и решения вопроса о дальнейшей тактике лечения.
В ФГБУ «НМИЦ им. В.А. Алмазова» пациентка была госпитализирована в апреле 2022 г.
Результаты обследований:
Сцинтиграфия легких от 28.04.2022 – сцинтиграфических признаков тромбоэмболии ЛА не выявлено. Глобальная перфузия легочных полей симметричная;
ЭхоКГ от 29.04.2022 – правое предсердие 46×52 мм; правый желудочек: парастернальная позиция 35 мм, 4-камерная 45 мм, передняя стенка 3,7 мм. ЛА – 27 мм. Регургитация на трикуспидальном клапане (ТК) 2-й степени. Дилатация правых камер. Тенденция к парадоксальному движению межжелудочковой перегородки как признак перегрузки правого желудочка; расчетное СДЛА повышено.
С 10.06.2022 по 29.06.2022 пациентка вновь находилась на стационарном лечении в ФГБУ «НМИЦ им.
В.А. Алмазова». Результаты обследования:
• Т6МХ от 16.06.2022 – 360 м, что соответствует II ФК;
• Кровь на NT – proBNP – 660 пг/мл.
• Лабораторные данные: гемоглобин – 94 г/л, сывороточное железо – 7,64 мкмоль/л, ферритин 7,40 нг/мл.
• Чреспищеводное ЭхоКГ от 16.06.2022 – тромбы в ушке левого передсердия не визуализируются. Правые камеры расширены. ЛА 31 мм. Патологических шунтов не выявлено.
• ЭхоКГ от 17.06.2022 – расчетное СДЛА 90 мм рт. ст., недостаточность ТК 2-й степени.
• Спирография от 17.06.2022 – на фоне нормальных значений функции легких проба с бронхолитиком отрицательная.
• Бодиплетизмография от 22.06.2022 – норма.
• Эргоспирометрия от 22.06.2022 – пиковое потребление кислорода – 25% при достигнутом анаэробном пороге, значение которого также ниже нормы. Прирост сердечного выброса преимущественно за счет низкой доставки кислорода легкими из-за паттерна дыхания – частое поверхностное дыхание, дыхательный объем всего 700 мл, частота дыхательных движений 38, что обусловливает неэффективность газообмена, раннее наступление анаэробного порога, высокие вентиляторные эквиваленты. Доставка кислорода на объем выполненной работы снижена.
• Катетеризация правых камер сердца от 20.06.2022 – у пациентки имеется прекапиллярная ЛГ (ср. ДЛА 36 мм рт. ст., ДЗЛА 3 мм рт. ст., ЛСС 7 Ед. Вуда).
• Вазореактивный тест с илопростом отрицательный.
Учитывая наличие анемического синдрома, пациентке были назначены пероральные препараты железа, однако анемия сохранялась. Выполнена фиброгастродуоденоскопия: эндоскопические признаки формирующейся кардиальной грыжи пищеводного отверстия диафрагмы. Эритематозная гастропатия, эритематозная дуоденопатия. Пациентка была проконсультирована гематологом, который для быстрой компенсации железодефицитной анемии рекомендовал терапию препаратами железа внутривенно. Была проведена однократная инфузия препарата карбоксимальтозата железа в дозе 800 мкг. При выписке из стационара уровень гемоглобина пациентки составил 102 г/л.
Пациентка была выписана с диагнозом: Идиопатическая легочная гипертензия, III ФК (ВОЗ). Катетеризация правых отделов сердца от 20.06.2022. HIIА, NYHA II ФК. Дислипидемия. Кардиальная грыжа пищеводного отверстия диафрагмы. Хронический эритематозный гастродуоденит. Хроническая железодефицитная анемия легкой степени.
На амбулаторном этапе лечения пациентке был рекомендован длительный прием пероральных препаратов железа, назначена комбинированная ЛАГ-специфическая терапия: силденафил и селексипаг.
После выписки из стационара пациентка динамически наблюдалась в ГБУЗ «СОККД им. В.П. Полякова», где проводилось регулярное обследование:
• ЭхоКГ от 09.2022 – СДЛА 71 мм рт. ст.
• Кровь на NT-proBNP от 03.2023 – 195 пг/мл.
• ЭхоКГ от 03.2023 – СДЛА 67 мм рт. ст.
По результатам лабораторных исследований за время диспансерного наблюдения уровень гемоглобина составлял от 129 до 140 г/л, также отмечалось повышение уровня ферритина до 22,3 мкмоль/л.
Клинически пациентка отмечала улучшение самочувствия: уменьшилась одышка, повысилась толерантность к физической нагрузке. По результатам Т6МХ зафиксировано увеличение пройденного расстояния до 410 м. За время наблюдения не было ни одной госпитализации с декомпенсацией ХСН.
По рекомендации ФГБУ «НМИЦ им. В.А. Алмазова» для оценки эффективности 2-компонентной ЛАГ-специфической терапии пациентка была вновь направлена на госпитализацию, и повторно находилась на стационарном лечении в ФГБУ «НМИЦ им. В.А. Алмазова» с 03.10.2023 по 18.10.2023. Результаты обследования:
• ЭхоКГ – дилатация правых отделов сердца с признаками объемной перегрузки и парадоксальным движением межжелудочковой перегородки. Регургитация на ТК 3-й степени. ЛА расширена. СДЛА 93–98 мм рт. ст.
• Магнитно-резонансная томография сердца – дилатация правых камер сердца, парадоксальное движение межжелудочковой перегородки, недостаточность ТК.
• Кровь на NT-proBNP – 51 пг/мл.
• Катетеризация правых отделов сердца – среднее давление в легочной артерии – 38 мм рт. ст., сердечный индекс 2,9 м/мин/м2, легочное сосудистое сопротивление 6,1 Ед. Вуда.
• Т6МХ – 380 м.
• Гемоглобин – 142 г/л.
Пациентке была назначена 3-компонентная ЛАГ-специфическая терапия: силденафил 20 мг 3 раза в день, селексипаг 1600 мкг 2 раза в сутки, амбризентан 10 мг 1 таблетке в сутки.
Диагноз при выписки из стационара: «Идиопатическая легочная артериальная гипертензия III ФК (ВОЗ). H IIA, 2 NYHA. Трикуспидальная недостаточность 3-й степени. Недостаточность клапана легочной артерии 2-й степени. Желудочковая экстрасистолия 1-й гр. по RYAN. Катетеризация полостей сердца в условиях ОРИТ от 20.06.2022, 06.10.2023. Дислипидемия. Кардиальная грыжа пищеводного отверстия диафрагмы. Эритематозная гастродуоденопатия. Аппендэктомия от 2013 г. Резекция кисты левого яичника (в 17 лет)».
Находясь под диспансерным наблюдением в ГБУЗ «СОККД им. В.П. Полякова», пациентка регулярно проходит протокольные обследования, в том числе и для своевременной диагностики анемии, так как препарат амбризентан может приводить к снижению уровня гемоглобина. Результаты обследования на амбулаторном этапе лечения:
• Т6МХ 03.2024 – 390 м.
• NT-proBNP 03.2024 – 180 пг/мл.
• ЭХОКГ 03.2024 – СДЛА 76 мм рт. ст.
• Уровень гемоглобина 03.2024 – 128 г/л.
• Уровень гемоглобина 07.2024 – 114 г/л.
Согласно рекомендациям, полученным при выписке из ФГБУ «НМИЦ им. В.А. Алмазова» еще в июне 2022 г., пациентка должна была длительно принимать один из пероральных препаратов железа. Однако при тщательном опросе установлено, что пациентка принимала данные лекарственные средства эпизодически, меняя при этом действующие вещества (железа сульфат, железа глюконат, железа протеин сукцинилат), и в июле 2024 г. вновь было зафиксировано снижение уровня гемоглобина, при этом пациентка отмечала усиление общей слабости и нарастание одышки. На очередном визите в ГБУЗ «СОККД им. В.П. Полякова» была проведена беседа о необходимости постоянного приема препаратов железа. Следующий визит запланирован на октябрь 2024 г. для оценки состояния в динамике и решения вопроса о целесообразности повторного введения парентеральной формы препарата железа.

Обсуждение
В научной литературе большое внимание уделяется коррекции ДЖ у пациентов с ХСН. По итогам исследования FAIR-HF, повышение уровня железа значительно улучшало качество жизни и толерантность к физической нагрузке, снижало функциональный класс у пациентов с ДЖ и хронической левожелудочковой недостаточностью. При этом эффективность для коррекции ДЖ у стабильных пациентов с ХСН доказал парентеральный препарат железа карбоксимальтозат, чтообосновывает его включение в рекомендации по лечению ХСН от 2020 г. [12]. Согласованное мнение экспертов по поводу лечения ДЖ у стабильных и декомпенсированных больных ХСН, опубликованное в журнале «Кардиология» в 2021 г. [13], гласит, что внутривенное введение железа карбоксимальтозата у пациентов с сочетанием ХСН с ФВ ЛЖ <50% и железодефицита, на фоне декомпенсации ХСН, позволяет предотвращать последующие декомпенсации. В 2024 г. опубликованы результаты исследования, проведенного на базе ФГБУ «НМИЦ им. В.А. Алмазова», посвященного изучению обмена железа и распространенности ДЖ у пациентов с ЛАГ и хронической тромбоэмболической легочной гипертензией на основании различных лабораторных критериев [14]. В целом же работ, подтверждающих эффективность применения препаратов железа у пациентов с ДЖ и легочной гипертензией пока не так много.
В описанном нами клиническом случае показан пример успешной коррекции анемии парентеральным препаратом карбоксимальтозат железа у пациентки с ЛАГ. Однако в дальнейшем, на фоне лечения амбризентаном и нерегулярного приема разных форм перорального железа, анемия у пациентки вновь прогрессировала и привела к нарастанию симптоматики ХСН. В повседневной клинической практике необходимо внедрять регулярную диагностику данного состояния для своевременного выявления ДЖ и оценки показаний к назначению препаратов железа. Согласно последним рекомендациям по диагностике и лечению ЛГ, следует проводить коррекцию ДЖ и лечение анемии для профилактики прогрессирования заболевания (УУР В, УДД 2) [15–17]. Даже при отсутствии клинически выраженной анемии следует рассмотреть возможность коррекции ДЖ у пациентов ЛАГ (УУР В, УДД 3) [15] для улучшения симптомов основного заболевания, повышения толерантности к физической нагрузке и качества жизни.
Проблемой современной медицины является отсутствие специально спланированных клинических исследований, сравнивающих эффективность и безопасность парентеральных и пероральных форм препаратов железа, а также конкретных действующих молекул железа между собой.
Заключение
В представленном нами клиническом случае наглядно продемонстрирована необходимость диагностики и коррекции ДЖ у пациентов с ЛАГ. Скрининг ДЖ следует проводить уже при первом обращении пациента с повышенным давлением в легочной артерии по результатам ЭхоКГ. Если ДЖ доказан лабораторно, всем пациентам рекомендовано назначение препаратов железа для снижения числа госпитализаций с декомпенсацией ХСН, а также повышения толерантности к физической нагрузке и улучшения качества жизни. Также необходим регулярный контроль лабораторных показателей у пациентов, состоящих на диспансерном учете с ЛАГ, для своевременного выявления ДЖ. Особое внимание стоит уделить пациентам, принимающим ЛАГ-специфическую терапию препаратами группы антагонистов эндотелиновых рецепторов, так как побочным эффектом их приема является железодефицитная анемия. Следует особо подчеркнуть, что коррекция анемии и ДЖ не заменяет ЛАГ-специфическую терапию, но является очень важным дополнением к комплексной терапии, позволяющим влиять на прогноз основного заболевания.Информация об авторах
Information about the authors
Балькина Ксения Васильевна – врач-кардиолог консультативно-реабилитационного отделения ГБУЗ «СОККД им. В.П. Полякова», аспирант каф. пропедевтической терапии с курсом кардиологии ИКМ, ГБОУ ВО СамГМУ. E-mail: kseniabal@list.ru;
ORCID: 0009-0000-3615-2143
Ksenia Vasilyevna Balkina – Cardiologist, Polyakov Samara Regional Clinical Cardiological Dispensary, Graduate Student, Samara State Medical University. E-mail: kseniabal@list.ru; ORCID: 0009-0000-3615-2143
Павлова Татьяна Валентиновна – д-р мед. наук, проф. каф. пропедевтической терапии с курсом кардиологии ИКМ, ГБОУ ВО СамГМУ. E-mail: ptvsam63@mail.ru; ORCID: 0000-0003-3301-1577
Tatyana V. Pavlova – Dr. Sci. (Med.), Prof., Samara State Medical University. E-mail: ptvsam63@mail.ru; ORCID: 0000-0003-3301-1577
Поступила в редакцию: 25.09.2024
Поступила после рецензирования: 03.10.2024
Принята к публикации: 10.10.2024
Received: 25.09.2024
Revised: 03.10.2024
Accepted: 10.10.2024
Список исп. литературыСкрыть список1. Чазова И.Е., Мартынюк Т.В., Шмальц А.А., Грамович В.В., Данилов Н.М и др. Евразийские рекомендации по диагностике и лечению легочной гипертензии (2023). Февраль 2024;(1):6-85.
Chazova I.E., Martynyuk T.V., Shmalts A.A., Gramovich V.V., Danilov N.M. et al. Eurasian recommendations for the diagnosis and treatment of pulmonary hypertension (2023). February 2024;(1):6-85. DOI: 10.38109/2225-1685-2024-1-6-85 (in Russian).
2. Klip IT, Comin-Colet J, Voors AA et al. Iron deficiency in chronic heart failure: an international pooled analysis. Am Heart J 2013;165:575-82.e3. DOI: 10.1016/j.ahj.2013.01.017
3. Jankowska EA, von Haehling S, Anker SD et al. Iron deficiency and heart failure: diagnostic dilemmas and therapeutic perspectives. Eur Heart J 2013;34:816-29. DOI: 10.1093/eurheartj/ehs224
4. Enjuanes C, Klip IT, Bruguera J et al. Iron deficiency and healthrelated quality of life in chronic heart failure: results from a multicenter European study. Int J Cardiol 2014;174:268-75. DOI: 10.1016/j.ijcard.2014. 03.169
5. Willie CK, Patrician A, Hoiland RL. et al. Influence of iron manipulation on hypoxic pulmonary vasoconstriction and pulmonary reactivity during ascent and acclimatization to 5050 m. J Physiol 2021;599(5): 1685-1708. DOI: 10.1113/JP281114
6. Smith TG, Balanos GM, Croft QP et al. The increase in pulmonary arterial pressure caused by hypoxia depends on iron status. J Physiol 2008 Dec 15;586(24):5999-6005. DOI: 10.1113/jphysiol.2008.160960
7. Cotroneo E, Ashek A, Wang L. et al. Iron homeostasis and pulmonary hypertension: iron deficiency leads to pulmonary vascular remodeling in the rat. Circ Res 2015;116:1680-90. 10.1161/CIRCRESAHA.116.305265
8. Lakhal-Littleton S, Crosby A, Frise MC et al. Intracellular iron deficiency in pulmonary arterial smooth muscle cells induces pulmonary arterial hypertension in mice. Proc Natl Acad Sci USA 2019;116:13122-13130. DOI: 10.1073/pnas.1822010116
9. Soon E, Treacy CM, Toshner MR et al. Unexplained iron deficiency in idiopathic and heritable pulmonary arterial hypertension. Thorax 2011;66:326-332. DOI: 10.1136/thx.2010.147272
10. Lakhal-Littleton S, Crosby A, Frise MC et al. Intracellular iron deficiency in pulmonary arterial smooth muscle cells induces pulmonary arterial hypertension in mice. Proc Natl Acad Sci USA 2019;116:13122-30. DOI: 10.1073/pnas.1822010116
11. Rhodes CJ, Wharton J, Howard L et al. Iron deficiency in pulmonary arterial hypertension: a potential therapeutic target. Eur Respir J 2011 Dec;38(6):1453-60. DOI: 10.1183/09031936.00037711
12. Терещенко С.Н. Галявич А.С., Ускач Т.М. и др. Хроническая сердечная недостаточность. Клинические рекомендации 2020. Рос. кардиол. журн. 2020;25(11):311-74. DOI: 10.15829/1560-4071-2020-4083
Tereshchenko S.N. Galyavich A.S., Uskach T.M. et al. Chronic heart failure. Clinical recommendations 2020. Russian cardiol. J 2020;25(11):311-74. DOI: 10.15829/1560-4071-2020-4083 (in Russian).
13. Мареев Ю.В., Гиляревский С.Р., Беграмбекова Ю.Л. и др. Согласованное мнение экспертов по поводу лечения дефицита железа у стабильных и декомпенсированных больных хронической сердечной недостаточностью. Кардиология. 2021;61(4):73–8.
Mareev Yu.V., Gilyarevsky S.R., Begrambekova Yu.L. et al. The agreed opinion of experts on the treatment of iron deficiency in stable and decompensated patients with chronic heart failure. Cardiology 2021;61(4): 73–8. DOI: 10.18087/cardio.2021.4.n1639 (in Russian).
14. Жиленкова Ю.И., Золотова Е.А., Васильева Е.Ю. и др. Исследование обмена железа у пациентов с ле гочной артериальной гипертензией и хронической тромбоэмболической легочной гипертензией Клин. лаб. диагностика. 2024;69(6):30-43. DOI: 10.17816/ cld629834
Zhilenkova Yu.I., Zolotova E.A., Vasilyeva E.Yu. et al. Study of iron metabolism in patients with pulmonary arterial hypertension and chronic thromboembolic pulmonary hypertension Clin. Lab. diagnostics. 2024;69(6):30-43. DOI: 10.17816/cld629834 (in Russian).
15. Humbert M, Kovacs G, Hoeper MM et al. ESC/ERS Scientific Document Group. 2022 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension Developed by the task force for the diagnosis and treatment of pulmonary hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS). Endorsed by the International Society for Heart and Lung Transplantation (ISHLT) and the European Reference Network on rare respiratory diseases (ERN-LUNG). Eur Heart J 2022;43(38):3618-3731. DOI: 10.1093/eurheartj/ehac237
16. Galiè N, Humbert M, Vachiery JL et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS): Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT). Eur Heart J 2016;37(1):67-119. DOI: 10.1093/eurheartj/ehv317.
17. Авдеев С.Н., Барбараш О.Л., Баутин А.Е. и др. Легочная гипертензия, в том числе хроническая тромбоэмболическая легочная гипертензия. Клинические рекомендации 2020. Рос. кардиол. журн. 2021;26(12):46.
Avdeev S.N., Barbarash O.L., Bautin A.E. et al. Pulmonary hypertension, including chronic thromboembolic pulmonary hypertension. Clinical recommendations 2020. Russian cardiol J 2021;26(12):46. DOI: 10.15829/1560-4071-2021-4683 (in Russian).

