Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№07 2003
Ремерон в неврологической практике №07 2003
Депрессия при неврологической патологии может являться клиническим проявлением органического неврологического заболевания. Так, характерно возникновение депрессии при паркинсонизме, рассеянном склерозе, инсульте, многих дегенеративных заболеваниях. Однако число таких пациентов невелико. Важнейшее патогенетическое значение депрессия имеет при широко распространенных хронических болевых синдромах, вегетативных нарушениях, диссомниях, мотивационно-энодокринных расстройствах, что и послужило критерием выбора клинических групп в настоящем исследовании. Для успешного лечения этих чрезвычайно многочисленных форм патологии неврологу необходимо обладать навыками диагностики депрессии, в том числе атипично и скрыто протекающих форм. В лечении широко используются антидепрессанты, адекватный выбор препарата производится с учетом всего спектра его клинического действия и побочных эффектов. Дозировки и длительность лечения могут существенным образом отличаться от применяемых в психиатрии [2].
Многие антидепрессанты, начиная с амитриптилина, проходят традиционный путь от психиатрии к неврологии, а затем в терапию; получают новые показания к их клиническому применению.
Ремерон (митразапин) – новый антидепрессант, который появился в Нидерландах (фирма "Органон") в 1994 г. В настоящее время ремерон используют во многих странах мира, таких как Австрия, Бразилия, Дания, Финляндия, США, Великобритания и др. К январю 1998 г. более 750 000 пациентов прошли терапию ремероном. Препарат преимущественно был использован в психиатрических клиниках для лечения различного вида депрессий тяжелой и средней степени выраженности и показал высокую эффективность и хорошую переносимость [3–5]. В 1998–2000 гг. были проведены открытые исследования терапевтической эффективности препарата в нескольких психиатрических клиниках России.
Механизм действия ремерона принципиально отличается от ранее известных антидепрессантов и обозначается как норадренергическое и специфическое серотонинергическое действие (NАSSА). Препарат повышает норадренергическую трансмиссию, блокируя альфа-2-адренергические рецепторы. Кроме того, ремерон повышает серотонинергическую нейротрансмиссию за счет двух механизмов: увеличения возбудимости сигнала серотонинергического нейрона и блокады альфа-2-гетерорецепторов. Ремерон специфически повышает 5-НТ1-медиаторную трансмиссию за счет блокады 5-НТ2- и 5-НТ3-рецепторов. В отличие от амитриптилина он не обладает побочным кардиотоксическим эффектом, а также воздействиями, связанными с влиянием на внутриглазное давление и мочеиспускание [6]. Кроме того, избирательное действие на серотониновые рецепторы позволяет избежать характерных для селективных ингибиторов обратного захвата серотонина инсомнии, тревоги, ажитации, сексуальной дисфункции и тошноты [7–10].
Целью исследования явилось изучение эффективности антидепрессанта ремерона в неврологической практике.
Были поставлены следующие задачи:
1. Определение клинической эффективности ремерона при лечении пациентов с хроническими болевыми синдромами и инсомнией.
2. Сравнительная оценка скорости наступления клинического и антидепрессантного эффектов.
3. Оценка анксиолитического действия ремерона с учетом высокой коморбидности (до 70%) депрессивных и тревожных нарушений при неврологической патологии.
4. Исследование уровня внимания при лечении ремероном.
5. Определение нежелательных побочных действий препарата.
6. Определение оптимальных суточных доз при использовании ремерона в неврологической практике.
Материал исследования
В исследование включен 71 больной: 21 человек (9 мужчин и 12 женщин), средний возраст 40,9 года, с хроническими скелетно-мышечными болями; 30 человек с головной болью, из них 10 человек (9 женщин и 1 мужчина), средний возраст 39,5 лет, с мигренью, 20 человек (17 женщин и 3 мужчин), средний возраст 36,6 года, с хронической головной болью напряжения (ГБН); 20 человек (17 женщин и 3 мужчин), средний возраст 45,7 года, с инсомнией.
Методы исследования
1. Клинико-неврологическое исследование (включает определение характера, интенсивности болевых синдромов, их частоты, а также характера инсомнических нарушений).
2. Шкала депрессии Бека и шкала депрессии Гамильтона.
3. Тест Спилбергера для оценки реактивной и личностной тревоги.
4. Шкала субъективной оценки качества ночного сна.
5. Анкета для оценки выраженности признаков синдрома вегетативной дистонии (СВД).
6. Анкета качества жизни.
7. Оценка внимания (по методике Мюнстенберга).
Суточная доза ремерона составляла 15– 30 мг, препарат назначали однократно за 30–40 мин перед сном. Длительность терапии составила 50 дней.
Исследование проводили до начала лечения, на 7-й день терапии и по окончании лечения на 43–50-й дни.
Хронические скелетно-мышечные боли
Боль в спине – одна из самых частых жалоб на приеме невролога или терапевта. Около 20% взрослого населения страдают от периодически рецидивирующих болей в спине. У большинства боли проходят под воздействием лечения в течение 1 мес, а у 4% они принимают хроническое течение. Более чем у 60% пациентов с хроническими дорзалгиями имеются признаки эмоциональных нарушений депрессивного характера, которые могут быть обусловлены как имеющимся у них болевым синдромом, так и психогенными причинами. Однако в любом случае депрессия, уменьшая активность антиноцицептивных систем, приводит к усилению болевого синдрома, способствует хронификации боли и обусловливает малую эффективность традиционного в этих случаях лечения.
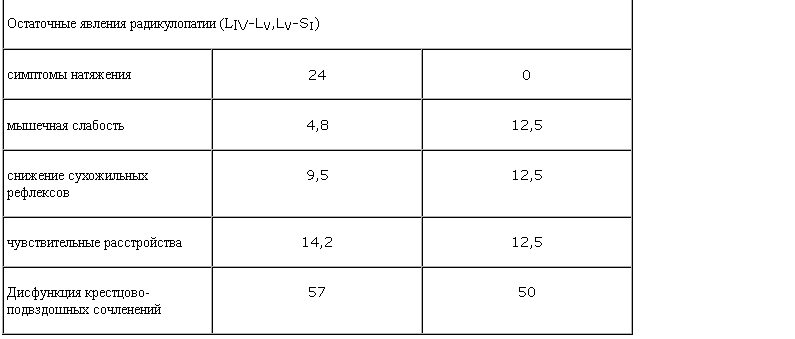
Критерием отбора пациентов для настоящего исследования была хроническая боль в спине вертеброгенного (остеохондроз, остеоартроз, функциональное блокирование межпозвонковых суставов) и миофасциального генеза. Среди них боль поясничной локализации наблюдали у 57% пациентов, шейно-грудной – у 15%, распространенный болевой синдром – у 28% пациентов. Боль была практически ежедневной, длительность болевого синдрома насчитывала от 4 мес до 18 лет. Основную часть исследованной группы составляли больные с рефлекторными мышечно-тоническими и миофасциальными болевыми синдромами на фоне остеохондроза позвоночника, статико-локомоторных нарушений, аномалий развития опорно-двигательного аппарата, обратимых функциональных блоков, у части пациентов имелись остаточные явления радикулопатии. Вертеброгенные изменения выявлены у 42% пациентов, по данным нейровизуализации.
Пациенты получали ремерон по 30 мг однократно в сутки в течение 50 дней. Кроме того, использовали нелекарственные методы лечения: физиотерапию, массаж, ЛФК, а также пациенты занимались индивидуально подобранной гимнастикой, основанной на приемах самопостизометрической релаксации, по установленному врачом графику. Лечение проводили в амбулаторных условиях.
Таким образом, пациенты с хронической скелетно-мышечной болью получали комплексное лечение, нелекарственные методы в различных сочетаниях использовались ими прежде без значимого клинического эффекта, новым было назначение антидепрессанта ремерона.
Полный курс лечения прошли 16 человек – 3 на повторный осмотр не явились, а у 2 пациентов ремерон был отменен по медицинским показаниям.
Проведенная терапия способствовала существенному снижению интенсивности болевого синдрома в среднем по группе с 4,86 до 1,86 балла по визуальной аналоговой шкале (ВАШ). По этому показателю эффект лечения можно оценить как отличный у 43% (редукция болевого синдрома свыше 75%), хороший у 32% (редукция боли на 50–75%), удовлетворительный у 12,5% (редукция боли на 25–50%), малоэффективной терапия была у 12,5% пациентов.
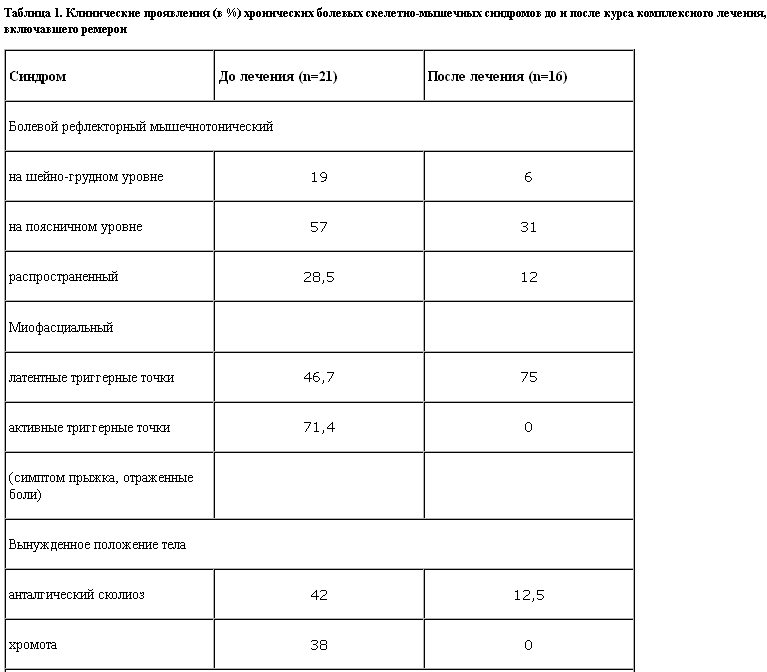
Уменьшение хронической скелетно-мышечной боли в результате проведенного лечения способствовало улучшению качества жизни пациентов: до лечения оно было снижено на 41%, после – только на 17% (р<0,05).
При психометрическом исследовании, проведенном до начала комплексной терапии, у пациентов выявлены эмоциональные нарушения (депрессия и тревога, нарушения ночного сна, снижение уровня внимания по тесту Мюнстенберга), а также средний балл по вегетативной анкете существенно превышал показатели здоровых испытуемых. После проведенного курса лечения статистически достоверные сдвиги наблюдали в улучшении качества ночного сна (до лечения – 17,57 балла; после лечения – 21,9 балла, p<0,05), уменьшении депрессивных проявлений по тесту Бека (до лечения – 16,52 балла, после – 8,94 балла, p<0,05) и повышении уровня внимания (процент ошибок до лечения составил 33,25, после лечения – 25,0, p<0,05).
Таким образом, комплексная терапия хронических скелетно-мышечных болей, включавшая антидепрессант ремерон, уменьшала выраженность рефлекторных мышечно-тонических и миофасциальных синдромов, что приводило к увеличению двигательных возможностей пациентов, улучшению их качества жизни, а также уменьшала выраженность депрессивных проявлений. Учитывая седативное действие препарата, важным было отсутствие нарушений внимания во время проводимого лечения.
Антидепрессанты давно и успешно используются в лечении головной боли. При хронической форме ГБН они являются препаратами первого ряда, что, несомненно, связано с ведущей ролью депрессивных нарушений в патогенезе этого вида головной боли. При мигрени возникновение у пациента депрессивных или тревожно-депрессивных нарушений под действием эмоционального стресса может существенным образом влиять на течение головной боли, вызывая учащение мигренозных приступов, обусловливая приступы панической мигрени (сочетание мигренозной геммикрании с панической атакой), а в ряде случаев приводя к ее трансформации в хроническую ежедневную головную боль [1, 2]. В связи с этим антидепрессанты используют в профилактическом лечении мигрени, задачей которого является снижение частоты возникновения приступов головной боли, уменьшение коморбидных психовегетативных нарушений, улучшение качества жизни. При профилактическом лечении мигрени с частыми приступами высокая эффективность по ИГБ была отмечена у 70%, средняя – у 30%. При лечении хронической ГБН высокая эффективность также наблюдалась в 60%, средняя – в 20%, низкая – в 20%.
Экспериментальное психологическое исследование пациентов проводили до начала курса антидепрессантной терапии (0-й день), через неделю после начала лечения (7-й день) и по его окончании (50-й день). Следует отметить, что исходно у пациентов с мигренью выраженность депрессии как по субъективной оценке (шкала самооценки Бека), так и по объективной оценке (шкала Гамильтона) носила незначительную степень выраженности. Показатели уровня как реактивной, так и личностной тревоги превышали нормативные данные (табл. 2). У больных с хронической ГБН депрессия и тревога были значительно более выражены, что полностью соответствует данным литературы [1].
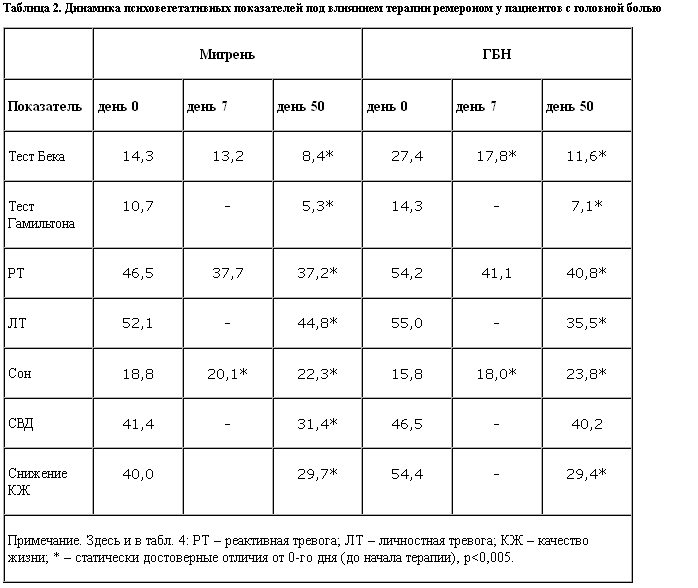
Уменьшение тревожно-депрессивных нарушений отмечали уже через 1 нед после начала терапии. В конце курса лечения в обеих группах произошло достоверное снижение уровней как тревоги, так и депрессии.
У пациентов обеих групп до начала курса антидепрессантной терапии отмечали полиморфные вегетативные нарушения. Суммарный балл по анкете выраженности синдрома вегетативной дистонии до лечения в обеих группах превышал показатели здоровых испытуемых: мигрень – 41,4, ГБН – 46,5, контрольная группа – не более 25 баллов (р<0,05). На фоне лечения у пациентов с мигренью отмечено снижение признаков выраженности синдрома вегетативной дистонии уже через 7 дней, а к концу курса оно достигло статистически достоверных значений (мигрень – 31,4 балла). При ГБН до лечения отмечали несколько более выраженные явления, так и после проведенного курса динамика их была незначительной (ГБН – 40,2, р<0,05).
Большинство исследованных нами пациентов с головной болью предъявляли жалобы на нарушение ночного сна. Данные жалобы объективизировались анкетой оценки качества сна. Лечение ремероном нормализовало ночной сон в обеих группах, положительная динамика отмечена через неделю лечения, достоверное повышение показателей при мигрени и ГБН до уровня здоровых испытуемых отмечено на 50-й день лечения.
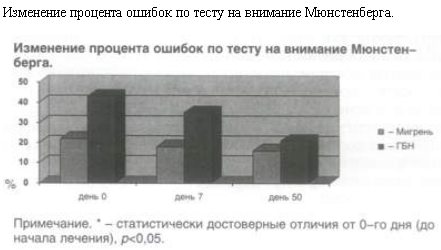
Показатели внимания тестировали с помощью теста Мюнстенберга, где все правильные ответы за 2 мин времени принимали за 100%. Проведенное нами исследование показало, что ремерон не только не вызывает снижения уровня внимания, а даже, наоборот, пациенты становятся более внимательными к концу лечения. На рисунке показана динамика показателей внимания и достоверное их улучшение к 50-му дню.
Влияние головной боли на качество жизни пациентов и изменение его в процессе лечения демонстрирует тест качества жизни. При исследовании до начала терапии наибольшее снижение качества жизни отмечали пациенты с хронической ГБН на 54,6%, с мигренью на 40%. В конце курса терапии качество жизни пациентов обеих групп достоверно улучшилось по сравнению с показателями до лечения, причем более существенно процент снижения качества жизни уменьшился у пациентов с хронической ГБН (мигрень – 29,7% ГБН – 29,4% р<0,05.)
Учитывая тот факт, что больные получали различные дозировки ремерона, при хронической ГБН был проведен анализ клинической эффективности препарата в зависимости от дозы: 15 или 30 мг. Наиболее важным клиническим показателем была интенсивность головной боли по шкале ВАШ; ее динамика оказалась сходной в обеих группах (до лечения: 15 мг – 8, 30 мг – 7,7 балла, после лечения: 15 мг – 3, 30 мг – 2,7 балла).
Динамика психовегетативных показателей представлена в табл. 3.
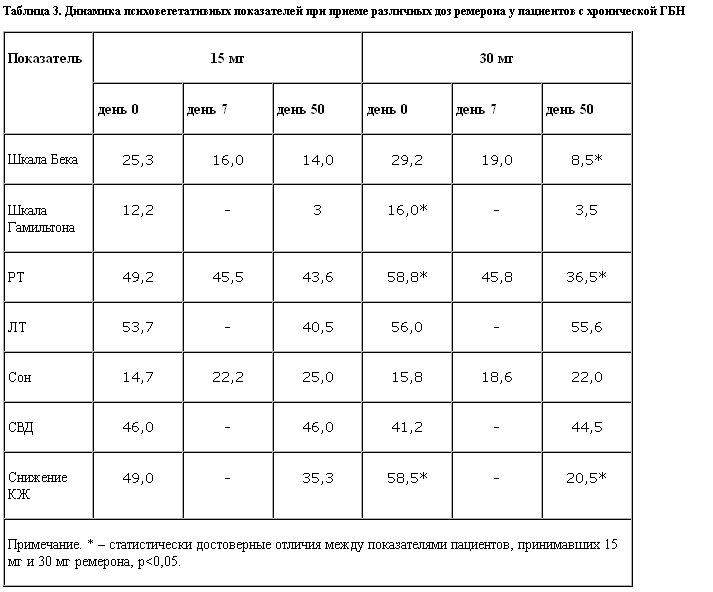
Обращает на себя внимание исходно более высокий уровень депрессии по шкале Бека и более высокий уровень реактивной тревоги в группе, принимавшей 30 мг. После 50-дневного курса терапии ремероном в дозе 30 мг отмечено относительно большее достоверное снижение депрессии по тесту Бека и реактивной тревоги. Качество жизни также подверглось больше положительной динамике при приеме более высокой дозы препарата. Таким образом, можно отметить, что антиболевой эффект различных доз ремерона был одинаков, однако тревожно-депрессивный синдром регрессировал, а качество жизни улучшилось в большей степени при приеме 30 мг.
Инсомния является базовой патологией медицины сна. Высокая распространенность [11] нарушений ночного сна (28–45% популяции) и недостаточная эффективность современных снотворных средств [12] предполагают постоянный поиск наиболее эффективных гипнотиков.
Другой важной проблемой является депрессия, высокая распространенность которой может занять 2-е место после ишемической болезни сердца среди причин нетрудоспособности. Тесная связь нарушений ночного сна и депрессии [7, 13, 14] заставляет использовать антидепрессанты как для лечения депрессивных расстройств, так и для нормализации сопутствующих нарушений ночного сна [9]. Антидепрессанты являются патогенетическим методом терапии инсомнии, обусловленной депрессивными нарушениями.
Как известно, ремерон, являясь представителем нового класса антидепрессантов с норадренергической и специфической серотонинергической активностью, оказывает снотворное действие [4, 15], однако эффективность и безопасность приема ремерона у больных инсомнией в амбулаторной неврологической практике остаются до конца не изученны.
В исследовании приняли участие пациенты с жалобами на нарушение ночного сна вне зависимости от этиологического фактора, не принимавшие каких-либо психотропных средств с гипногенным эффектом менее чем за 2 нед до начала обследования.
Исследовано 20 больных инсомнией (17 женщин и 3 мужчин), средний возраст больных составил 45,7 года. Длительность нарушений ночного сна была в среднем по группе около 5 лет. По шкале Гамильтона для оценки депрессии средний балл составил 16,5. Наличие депрессии было подтверждено также по шкале самооценки Бека (20,8 балла). Данные результаты свидетельствуют о наличии депрессии у исследованной группы пациентов с инсомнией, выраженность которой у большинства больных была легкой или средней степени. Депрессия сопровождалась тревожными нарушениями, наличие которых определялось как клинически, так и с помощью теста Спилбергера: средний уровень реактивной тревоги 40,0 и личностной 42,4. Оценка анкеты качества жизни до лечения позволила выявить относительно низкий уровень (53,9 балла из 100 возможных). Вегетативная анкета свидетельствует о наличии вегетативных нарушений (33,7 балла), только у 1 пациента вегетативные нарушения не доходили до клинически значимых величин (выше 25 баллов) и составили 17 баллов. Проведение теста Мюнстенберга на внимание выявило, что больные обнаруживали только 61% слов (39% ошибок).
Субъективная картина инсомнии, по данным анкеты сна (оценка производилась по 5-балльной системе, чем выше балл, тем лучше сон), характеризовалась нарушением засыпания, недостаточной длительностью сна, большим количеством ночных пробуждений, низким качеством сна и самочувствия после утреннего пробуждения, практически в одинаковой степени выраженности.
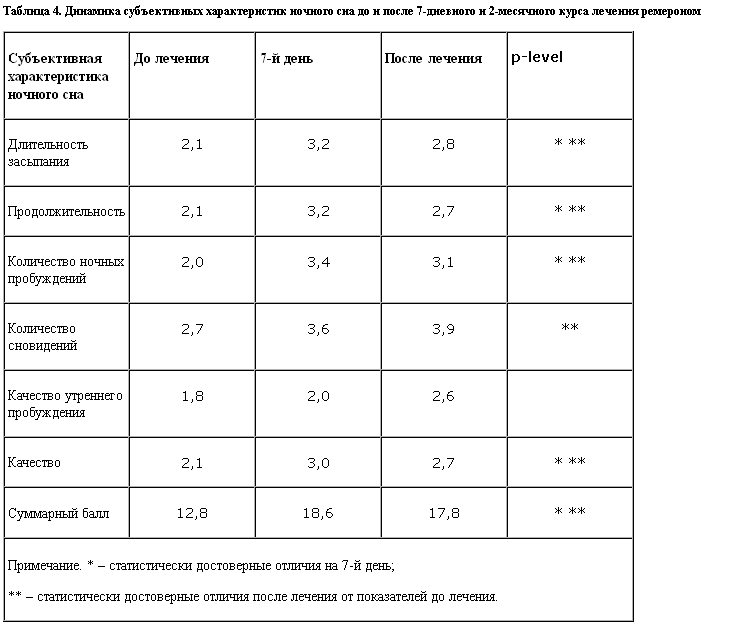
Лечение пациентов показало, что субъективная оценка сна имеет положительную динамику уже в течение первой недели лечения практически по всем субъективным характеристикам за исключением количества сновидений и качества утреннего пробуждения, которые не претерпели существенных изменений. Полученные данные представлены в табл. 4.
Исследование степени выраженности тревожно-депрессивных нарушений, выраженности СВД, уровня внимания через неделю после начала лечения достоверной динамики показателей не выявило.
Анализ субъективных показателей сна показал, что к концу 2-месячного курса лечения большинство показателей субъективной оценки сна имеют достоверно более высокие баллы (лучшее качество).
Анализ динамики психовегетативных показателей после 2-месячного курса лечения показал достоверное снижение депрессии по тесту Бека и реактивной тревоги по тесту Спилбергера. Достоверных изменений уровня внимания и выраженности вегетативных нарушений в целом по группе получено не было, а то же время качество жизни пациентов существенно возросло.
Половина пациентов (10 человек) с инсомнией (1-я группа) принимала 15 мг ремерона и 2-я группа (10 человек) – 30 мг. Проведен анализ эффективности препарата в зависимости от назначенной дозы на субъективные характеристики ночного сна. Суммарный балл субъективной оценки качества ночного сна в обеих группах достоверно превышал показатели до лечения, что свидетельствовало об эффективности как 15 мг, так и 30 мг препарата при лечении инсомнии. Однако при назначении препарата в дозе 30 мг отмечено лучшее качество утреннего пробуждения, снижение количества ночных сновидений и уменьшение количества ночных пробуждений.
Переносимость ремерона при использовании в неврологической практике
Большинство пациентов хорошо переносили лечение ремероном, отмечали выраженный клинический эффект препарата и, несмотря на некоторые нежелательные побочные эффекты, закончили полный курс лечения, что сопровождалось улучшением качества жизни. Только у 3 пациентов из 70 человек (2 пациента с хронической скелетно-мышечной болью и 1 пациент с инсомнией) препарат был отменен из-за быстрого и выраженного увеличения массы тела, возникновения гипоманиакального состояния с нарушениями ночного сна и значительных подъемов артериального давления в первые 3 дня лечения.
Побочные эффекты, наблюдаемые у пациентов с неврологической патологией, прошедших полный (50 дней) курс лечения антидепрессантом ремероном, можно было разделить на три группы: 1) сонливость и заторможенность; 2) сухость во рту, тошнота и чувство дурноты; 3) повышение аппетита и увеличение массы тела.
Следует отметить, что группы побочных эффектов 1 и 2 были непродолжительны и наблюдались 1 или 2 нед в начале приема препарата. Однако именно они не позволили увеличить дозу препарата до 30 мг у пациентов, продолжающих трудиться во время проводимого лечения. Лишь сухость во рту незначительной степени оставалась во время всего курса лечения.
К наиболее устойчивым побочным эффектам относились повышение аппетита и увеличение массы тела, наблюдаемые у 30% пациентов. Следует отметить, что увеличение массы тела отмечено преимущественно у пациентов, получавших 30 мг ремерона в сутки. Пациенты с инсомнией были заранее предупреждены о возможном увеличении массы тела, увеличении аппетита и снижении общей физической активности (при возникновении сонливости), в связи с чем им было рекомендовано внимательней следить за диетой. Это позволило сократить число пациентов с увеличением массы тела с 30% по группе в целом до 5%.
Выводы
1. Ремерон обладает выраженным противоболевым действием у пациентов с хронической скелетно-мышечной болью и может быть использован в комплексной терапии наряду с нелекарственными методами лечения – массажем, мануальной терапией, ЛФК.
2. Показана высокая эффективность ремерона при лечении первичной головной боли – мигрени и хронической ГБН.
3. Ремерон обладает выраженным гипногенным действием и существенно улучшает субъективные характеристики ночного сна – укорачивает время засыпания, уменьшает количество ночных пробуждений и сновидений, увеличивает продолжительность ночного сна и, что особенно важно, улучшает качество утреннего пробуждения.
4. Психотропное и гипногенное действие препарата наступает быстро – уже через 1 нед лечения.
5. Учитывая клинические свойства антидепрессанта ремерона, он может быть препаратом выбора при лечении хронических болевых синдромов, сопровождающихся выраженными нарушениями сна и тревожными расстройствами.
6. В амбулаторной неврологической практике возможно использование половинной дозы 15 мг, что позволяет значительно уменьшить нежелательные побочные эффекты препарата и улучшить его переносимость, существенно не снижая клинической эффективности при данной патологии.
7. Во избежание выраженного увеличения массы тела во время курса лечения ремероном пациент должен быть предупрежден о возможном увеличении аппетита, ему следует рекомендовать внимательней следить за диетой.
8. Препарат не оказывает отрицательного влияния на когнитивные способности пациентов во время лечения. Наоборот, в ряде случаев он улучшал показатели внимания, по-видимому, за счет уменьшения тревожно-депрессивных нарушений.
Список исп. литературыСкрыть список1. Болевые синдромы в неврологической практике. Под ред. чл.-корр. РАМН А.М.Вейна. М.: МЕДпресс. 1999; 365 с.
2. Вознесенская Т.Г. Антидепрессанты в неврологической практике. Журн. лечение нервн. бол. 2000; 1 (1): 8–14.
3. Морозова М.А. и др. Роль ранней терапевтической динамики тревоги в изменении состояния больных с тяжелым депрессивным эпизодом. Журн. соц. и клин. психиатр., 2001; 1: 81–4.
4. Мосолов С.Н., Костюкова Е.Г. и др. Клиническая эффективность и переносимость нового антидепрессанта митразепина (ремерон) при тяжелых депрессиях. Ж. соц. и клин. психиатр., 2000; 1: 55–60.
5. Филатова Е.Г., Яковлев О.Н. Ремерон в лечении головной боли напряжения (первый опыт применения). Журн. лечение нервн. бол., 2001 ; 3 (5): 22–6.
6. Яковлев В.А. и др. Сравнительная эффективность ремерона (митразепина) и амитриптилина при лечении больных с депрессивными состояниями средней тяжести. Военно-мед. журн., 2000; 10: 27–9.
7. Kryger MH, Roth T, Dement WC. Principles and Practice of Sleep Medicine. W. B. Saunders company. 1994; p. 16.
8. Wheatley DP et al. Efficacy and tolerability mitrazepine in comparison with fluoxetine in patientes with moderate to sever major depressive disorder. J Clin Psychiatry 1998; 59: 306–13.
9. Vartiainen H, Leinonen E. Double – blind study of mitrazapine and placebo in hospitalized patients with major depression. Eur Neuropsychopharmacol 1994; 4: 145–50.
10. Montgomery SA. et al. Mitrazapine versus amitrptyline in the long-term treatment of depression; a double-blind, placebo controlled study. Int Clin Psychopharmacol 1998; 13: 63–73.
11. Вейн А.М., Хехт К. Сон человека. Физиология и патология. М., 1989.
12. Freeman H, Puech AJ, Roth T. Zolpidem: an update of its pharmacological properties and therapeutic placer in the management of insomnia. Elsevier, 1996; 215–30.
13. Левин Я.И., Посохов С.И., Ханунов И.Г. Ночной сон при депрессии. совр. психиатр.Журн., 1998 ; 3: 23–4.
14. Мосолов С.Н. Клиническое применение современных антидепрессантов. СПб., 1995; 565 с.
15. Колюцкая Е.В., Ястребов Д.В. Использование митразапина при лечении депрессии. Журн. совр. психиатр, 1998; 3: 23–4.
