Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№04 2014
Результаты обсервационной программы ДЖАЗ: ремиссия, предикторы ее формирования и переносимость Вальдоксана (агомелатина) у пациентов с тревожной депрессией в рамках большого депрессивного расстройства №04 2014
Номера страниц в выпуске:4-9
В настоящей статье продолжают обсуждаться результаты обсервационной программы ДЖАЗ: эффективность и безопасность препарата Вальдоксан (агомелатин) при лечении пациентов с тревожной депрессией в рамках большого депрессивного расстройства, в которой принимали участие 9 российских центров.
Резюме. Приводятся данные обсервационной программы ДЖАЗ, касающиеся частоты формирования ремиссии, ее предикторов, а также переносимости агомелатина. В 9 клинических центрах были набраны 310 пациентов, из них 294 полностью завершили исследование. Включались пациенты с симптомами тревоги в структуре большого депрессивного эпизода, которым назначался агомелатин в дозе 25 мг/сут вечером, продолжительность терапии составила 8 нед. Динамика состояния пациентов оценивалась при помощи психометрических шкал: HDRS-17, CGI-I, ShARS, STAI, BSS, LSEQ. Доля пациентов, достигших ремиссии, составила 69%. Предикторами эффективности терапии являлись: молодой возраст, единичный депрессивный эпизод, назначение агомелатина в качестве первого антидепрессанта и изначально высокий уровень тревоги. Была подтверждена высокая переносимость агомелатина (нежелательные явления встречались в 5,5% случаев).
Ключевые слова: агомелатин, тревога, депрессия, ремиссия, переносимость.
The results of observational studies JAZZ: remission, predictors of its formation
and tolerability of Valdoxane (agomelatine) in patients with anxious depression
within major depressive disorder
A.S.Avedisova, K.V.Zakharova, М.P.Marachev
Therapy of Mental & Behaviour Disorders Department Serbsky National Research Centre for Social & Forensic
Psychiatry
Summary. The observational program JAZZ data on the frequency of remission, its predictors, and tolerability of agomelatine. In 9 clinical centers were enrolled 310 patients, of whom 294 completed the study. Included patients with symptoms of anxiety in the structure of a major depressive episode, which was administered at a dose of agomelatine 25 mg/day in the evening, the duration of treatment was 8 weeks. The effects were assessed using psychometric scales: HDRS-17, CGI-I, ShARS, STAI, BSS, LSEQ. Proportion of patients achieving remission was 69%. Predictors of treatment efficacy were: young age, a single depressive episode, agomelatine appointment as the first antidepressant and initially high levels of anxiety. Was confirmed by the high tolerability of agomelatine (adverse events occurred in 5,5% of cases).
Key words: agomelatine, anxiety, depression, remission, tolerability.
В настоящей статье продолжают обсуждаться результаты обсервационной программы ДЖАЗ: эффективность и безопасность препарата Вальдоксан (агомелатин) при лечении пациентов с тревожной депрессией в рамках большого депрессивного расстройства, в которой принимали участие 9 российских центров. Данные, касающиеся эффективности препарата, его влияния на симптоматологический профиль тревожной депрессии (с акцентом на тревогу, инсомнию и суицидальность), уже опубликованы [1]. Эта статья посвящена анализу частоты формирования ремиссии, предикторов ее формирования и переносимости агомелатина.
Напомним некоторые сведения о дизайне исследования. В него включались пациенты в возрасте от 18 до 65 лет с диагнозами: «депрессивный эпизод умеренный (F32.1) или тяжелый (F32.2) без психотических симптомов», «рекуррентное депрессивное расстройство; умеренный (F33.1) или тяжелый (F33.2) депрессивный эпизод без психотических симптомов»; с суммой баллов по шкале HDRS-17 не менее 17, по шкале самооценки тревоги Шихана – не менее 30. Вальдоксан назначался в стартовой терапевтической дозе 25 мг, которая (в случае недостаточного, по мнению исследователя, эффекта препарата) могла быть повышена до 50 мг однократно вечером. В ходе 8-недельного периода наблюдения было предусмотрено 7 визитов с применением психопатологического, общесоматического (артериальное давление – АД, частота сердечных сокращений – ЧСС, биохимический анализ крови, измерение массы тела) и психометрического (HDRS-17, шкала самооценки тревоги Шихана – ShARS, шкала самооценки уровня тревожности Спилберга–Ханина – STAI, шкала суицидальных мыслей Бека – BSS, шкала оценки показателей сна – LSEQ) обследований.
Критерием ремиссии являлась редукция балла по шкале HDRS-17 до 7 и ниже. Переносимость терапии оценивалась по следующим показателям: перечню и частоте серьезных нежелательных явлений (НЯ); перечню и частоте НЯ с объективной (врачами) и субъективной (пациентами) оценкой переносимости терапии (отличная, хорошая, удовлетворительная и плохая). Безопасность препарата характеризовалась влиянием длительной терапии на основные жизненные показатели (АД, ЧСС), на функции печени (аспартатаминотрансфераза – АСТ, аланинаминотрансфераза – АЛТ), на щелочную фосфатазу (ЩФ) и общий билирубин (ОБ) крови.
Всего в исследование были включены 310 пациентов, из которых 294 (94,8%) человека полностью завершили программу и составили клинический материал для данной программы.
В качестве сопутствующей психотропной терапии (43 человека; 14,62%) назначались диазепам – сибазон, релиум (6,12%), феназепам (3,06%), гидроксизин – атаракс (2,38%), медазепам – мезапам (2,04%), оксазепам – нозепам (0,34%). Несмотря на то что алпразолам и депакин хроно были запрещены протоколом, их получали 2 пациентов (по 0,34%).
Несколько более высокий процент ремиссии отмечен в работе В.В.Читловой (26,8%) [3], в задачи которой входила оценка эффективности монотерапии флувоксамином пациентов с тревожной депрессией. Таким образом, результаты данной программы вносят коррекцию в широко распространенное мнение о низкой эффективности антидепрессантов при сочетании депрессии и тревоги. В соответствии с исследованиями, формирующими это мнение, присоединение тревоги к депрессии требует больше времени для достижения ремиссии [4–6], а эффективность терапии антидепрессантами при этом снижается [2, 6–10].
Частота формирования ремиссии не зависела от повышения дозы назначаемого препарата. В ходе настоящей программы Вальдоксан в дозе 25 мг/сут принимали 61,56% (n=181), тогда как 38,44% (n=113) пациентам доза была повышена до 50 мг. Процент достижения ремиссии оказался в 2 раза выше при стабильной дозировке (25 мг), чем при ее повышении до 50 мг (81,22% vs 49,56%). Таким образом, в соответствии с полученными результатами стремление врачей добиться более существенного эффекта при наращивании дозы агомелатина не всегда достигает своей цели и, возможно, стратегией повышения эффекивности в данном случае является увеличение длительности применения препарата до 12 нед, что рассматривается в ряде работ в качестве тактики ведения пациентов при отсутствии ремиссии [11].
Анализ терапевтических ремиссий с учетом дименсионального подхода, в рамках которого феноменология ремиссий представлена в виде 4 вариационных рядов: бессимптомная ремиссия – моносимптоматическая ремиссия – полисимптоматическая ремиссия – ремиссия со структурой малой депрессии [12], позволил выявить различия между клинически однородной группой пациентов с тревожной депрессией (ДЖАЗ) и клинически гетерогенной группой больных с депрессией, у которых только в 11,6% случаев состояние определялось тревожной депрессией [12]. Несмотря на высокую частоту достижения ремиссии у больных, вошедших в исследование ДЖАЗ (69,05%), бессимптомная (полная ремиссия) формировалась только в 4,93% случаев. В остальных наблюдениях (95,07%) речь шла о симптоматической (неполной) ремиссии.
В исследовании Л.С.Канаевой [12] полная ремиссия формировалась в 4 раза чаще – 22,4%. Для пациентов, принявших участие в исследовании ДЖАЗ, было характерно формирование неполных ремиссий со структурой симптоматики, описываемой как «малая депрессия» (35,96%), ключевой характеристикой которой является наличие гипотимии в сочетании с факультативной симптоматикой. На долю моносиптоматической (наличие стойкого изолированного остаточного симптома, чаще всего тревожного, соматовегетативного, инсомнического или ипохондрического спектров) и полисимптоматической (констелляция факультативных для депрессивного состояния симптомов) ремиссии приходилось 59% случаев. При этом среднее число остаточных симптомов на 1 пациента было существенно выше в группе пациентов ДЖАЗ (5,5 vs 2,2); табл. 1.
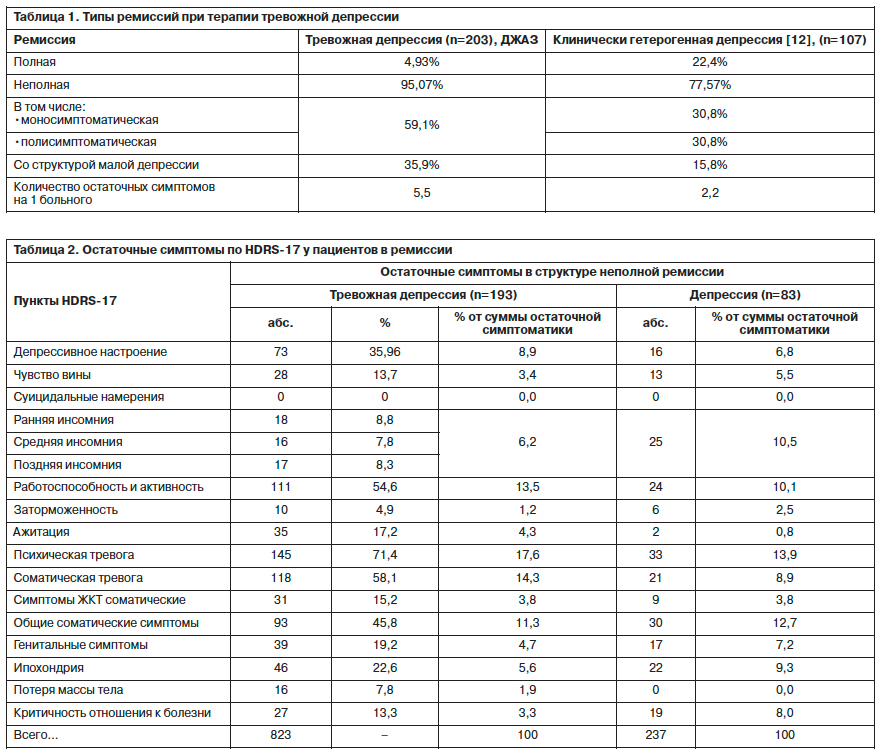
Как видно из табл. 2, спектр остаточной симптоматики в структуре ремиссии у пациентов с тревожной депрессией характеризовался высокой частотой психической (71,4%) и соматической (58,1%) тревоги и снижения активности/работоспособности (54,6%). У многих больных в ремиссии отмечались общие соматические симптомы (45,8%) и депрессивное настроение (35,96%). Частота остальных симптомов была существенно ниже (чувство вины, все виды инсомний, заторможенность, ажитация, соматические симптомы желудочно-кишечного тракта – ЖКТ, изменения массы тела, критика к болезни, генитальные, ипохондрические симптомы). Суицидальные намерения редуцировались полностью и не наблюдались ни у одного пациента, достигшего ремиссии. В сравнении с этой остаточной симптоматикой спектр резидуальных расстройств в структуре терапевтической ремиссии при клинически гетерогенной депрессии характеризовался преобладанием инсомнических проявлений, чувства вины, генитальных симптомов, заторможенности, ипохондрии и общих соматических симптомов.
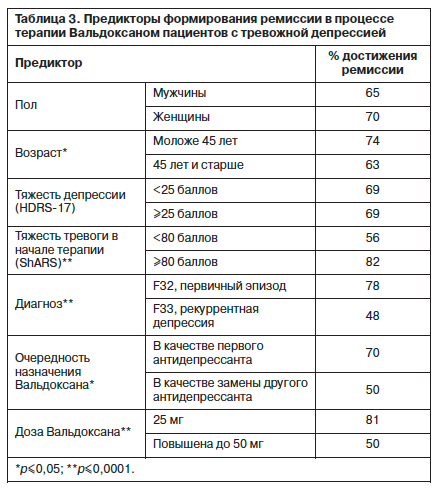
Проведенный корреляционный анализ позволил подтвердить приведенные данные о зависимости ремиссии от таких показателей, как возраст и исходный уровень тревоги (ShARS). В то же время корреляционная связь между полом, фоновыми баллами по шкалам HDRS-17 и BSS, а также показателями реактивной и личностной тревожности выявлена не была.
Сравнивая время наступления ремиссии при тревожной и атипичной депрессии [13] в процессе терапии Вальдоксаном, следует отметить, что у пациентов данного исследования пик формирования ремиссии приходился на период с 4 по 8-ю неделю, в то время как при атипичной депрессии ремиссия начинала формироваться в более ранние сроки уже с 3-й недели, тогда как к 6-й неделе темпы становления ремиссии значительно снижались (табл. 4).
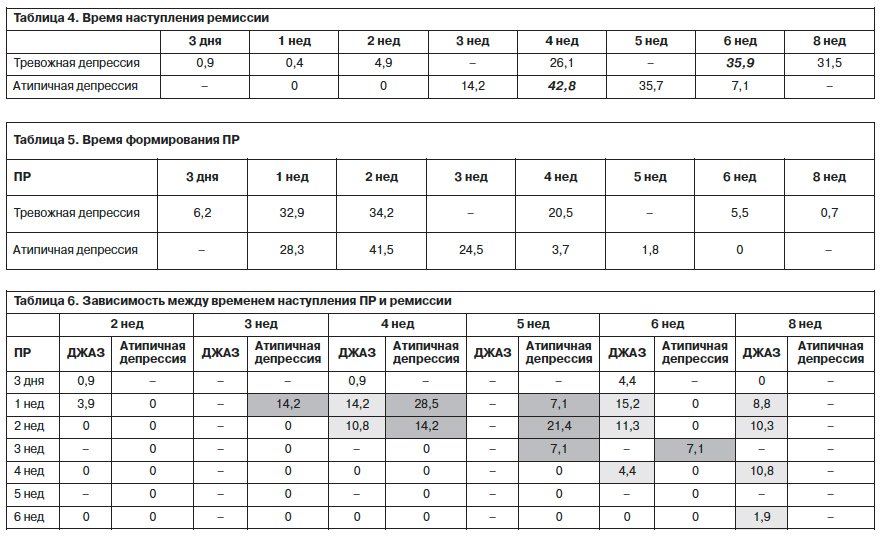
Как следует из наших предшествующих исследований [13, 14], первичный респонс – ПР (т.е. редукция симптоматики в процессе терапии на 25%) является важным предиктором дальнейшего прогноза терапии. Сравнивая ПР при тревожной и атипичной депрессии, можно отметить, что его формирование фиксировалось уже на 1-й неделе лечения (при тревожной депрессии уже на 3-й день), достигая своего максимума на 2-й неделе терапии в обеих группах (34,2% – при тревожной депрессии, 41,5% – при атипичной депрессии). В то же время, если при тревожной депрессии ПР значительно уменьшался к 6-й неделе (5,5%), то для пациентов с атипичной депрессией такая динамика была характерна уже к 4-й неделе (3,7%) исследования (табл. 5).
Выявленная в предшествующих исследованиях [13–15] закономерность, в соответствии с которой более раннее наступление ПР свидетельствует о более ранних сроках формирования ремиссии, была подтверждена и в настоящей наблюдательной программе. Так, пациенты, у которых ПР отмечался в течение первых 2 нед терапии, в 31% случаев достигали ремиссии уже в течение первых 4 нед лечения. Вместе с тем в отличие от применения агомелатина при атипичной депрессии, при которой в случае раннего респонса формирование ремиссии было ограничено 3–5-й неделей, при терапии тревожной депрессии возможность формирования ремиссии сохранялась вплоть до 8-й недели терапии. Например, при наступлении ПР на 4-й неделе ремиссия формировалась на 6 и 8-й неделях применения агомелатина (табл. 6).
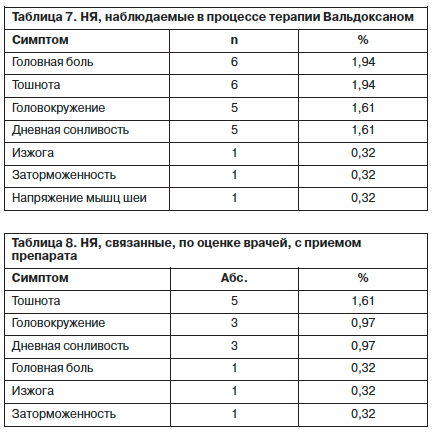
По мнению врачей, НЯ, связанными с приемом препарата, были тошнота (1,61%), головокружение (0,97%), дневная сонливость (0,97%), головная боль, изжога и заторможенность (по 0,32%); табл. 8.
Спектр НЯ у больных, принимавших Вальдоксан в дозе 25 и 50 мг, не изменялся. Однако количество НЯ в случае повышения дозы до 50 мг увеличивалось (кроме заторможенности и напряжения мышц шеи), хотя и не достигало статистически значимого уровня (табл. 9).
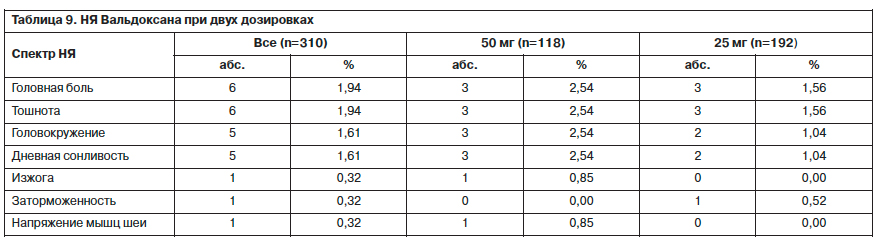
Большинство врачей (82,65%) оценили переносимость Вальдоксана (среди тех пациентов, которые полностью завершили курс терапии) как отличную (НЯ отсутствовали), 15,31% – как хорошую (незначительные НЯ). Только
2 (0,68%) человека отметили удовлетворительную переносимость (умеренные нежелательные реакции). Выраженных нежелательных реакций, по мнению врачей, не было. Для 4 (1,36%) человек не было данных по оценке переносимости. Оценка переносимости терапии пациентами
была несколько ниже. Больные реже отмечали отличную переносимость (65,99%), но чаще – хорошую переносимость (31,63%). Умеренные нежелательные реакции отмечали у себя 2 (0,68%) пациента, а выраженные – 1 (0,34%). У 4 (1,36%) пациентов данные о переносимости препарата отсутствовали (см. рисунок).
В процессе обсервационной программы было отмечено два случая, которые можно отнести к серьезным НЯ: 1 пациент на 10-й день был госпитализирован в отделение неврологии (причина госпитализации не указана); у 1 пациента на 7-й день терапии был выявлен сахарный диабет. В ходе терапии масса тела пациентов, хотя и не очень заметно, но статистически достоверно увеличивается (p<0,00001). Более того, это увеличение массы тела является статистически значимым не только за все 8 нед терапии, но даже за 2 нед терапии (p=0,029), что скорее всего говорит о нормализации аппетита (как об одном из критериев эффективности лечения депрессии) и возвращении массы тела к доболезненному уровню (табл. 10).
Влияние терапии на сердечно-сосудистую систему выражалось в снижении ЧСС. Более того, это снижение является статистически значимым не только в конце терапии, но даже после первых 2 нед применения агомелатина (p=0,000013) и в незначительном снижении АД – систолического (САД) и диастолического (ДАД); табл. 11.
В отношении биохмических показателей был выявлен статистически достоверный рост показателя АСТ (p=0,000041). Величина АЛТ также увеличилась, но не достигла статистической значимости (p=0,063). В процессе лечения не выявлено статистически значимых изменений ЩФ (p=0,13).
Вместе с тем количество ОБ статистически значимо увеличилось (p=0,021). Однако, несмотря на повышение значений биохимических показателей, они на всем этапе терапии продолжали оставаться в пределах клинической нормы (табл. 12).
2. Бессимптомная (полная ремиссия) формировалась только в 4,93% случаев. В остальных (95,07%) наблюдениях речь шла о симптоматической (неполной) ремиссии, в спектре которой преобладали психическая и соматическая тревога, а также снижение активности/работоспособности.
3. Благоприятными предикторами эффективности терапии являлись возраст моложе 45 лет, первичный депрессивный эпизод, назначение Вальдоксана в качестве первого антидепрессанта, изначально высокий уровень тревоги. На частоту формирования ремиссии не оказывали статистически значимого влияния пол пациента и тяжесть депрессии.
4. Выявленная в предшествующих исследованиях закономерность, в соответствии с которой более раннее наступление ПР свидетельствует о более ранних сроках формирования ремиссии, было подтверждено в настоящей наблюдательной программе: 1/3 пациентов, у которых ПР отмечался в течение первых 2 нед терапии, достигали ремиссии уже в течение 4 нед лечения.
5. Вальдоксан подтвердил свою высокую переносимость по результатам объективного обследования, а также по мнению врачей и пациентов. НЯ были отмечены только в 5,5% случаев, среди которых преобладали головная боль, тошнота, головокружение и дневная сонливость. Показатели АД, пульса, биохимические параметры не выходили за пределы клинической нормы на протяжении всего периода программы, что свидетельствовало о безопасности применения Вальдоксана.
им. В.П.Сербского Минздрава России
К.В.Захарова – канд. мед. наук, ст. науч. сотр. отд. терапии психических и поведенческих расстройств ФГБУ ГНЦССП
им. В.П.Сербского Минздрава России
М.П.Марачев – канд. мед. наук, науч. сотр. отд. терапии психических и поведенческих расстройств ФГБУ ГНЦССП
им. В.П.Сербского Минздрава России
Ключевые слова: агомелатин, тревога, депрессия, ремиссия, переносимость.
The results of observational studies JAZZ: remission, predictors of its formation
and tolerability of Valdoxane (agomelatine) in patients with anxious depression
within major depressive disorder
A.S.Avedisova, K.V.Zakharova, М.P.Marachev
Therapy of Mental & Behaviour Disorders Department Serbsky National Research Centre for Social & Forensic
Psychiatry
Summary. The observational program JAZZ data on the frequency of remission, its predictors, and tolerability of agomelatine. In 9 clinical centers were enrolled 310 patients, of whom 294 completed the study. Included patients with symptoms of anxiety in the structure of a major depressive episode, which was administered at a dose of agomelatine 25 mg/day in the evening, the duration of treatment was 8 weeks. The effects were assessed using psychometric scales: HDRS-17, CGI-I, ShARS, STAI, BSS, LSEQ. Proportion of patients achieving remission was 69%. Predictors of treatment efficacy were: young age, a single depressive episode, agomelatine appointment as the first antidepressant and initially high levels of anxiety. Was confirmed by the high tolerability of agomelatine (adverse events occurred in 5,5% of cases).
Key words: agomelatine, anxiety, depression, remission, tolerability.
В настоящей статье продолжают обсуждаться результаты обсервационной программы ДЖАЗ: эффективность и безопасность препарата Вальдоксан (агомелатин) при лечении пациентов с тревожной депрессией в рамках большого депрессивного расстройства, в которой принимали участие 9 российских центров. Данные, касающиеся эффективности препарата, его влияния на симптоматологический профиль тревожной депрессии (с акцентом на тревогу, инсомнию и суицидальность), уже опубликованы [1]. Эта статья посвящена анализу частоты формирования ремиссии, предикторов ее формирования и переносимости агомелатина.
Напомним некоторые сведения о дизайне исследования. В него включались пациенты в возрасте от 18 до 65 лет с диагнозами: «депрессивный эпизод умеренный (F32.1) или тяжелый (F32.2) без психотических симптомов», «рекуррентное депрессивное расстройство; умеренный (F33.1) или тяжелый (F33.2) депрессивный эпизод без психотических симптомов»; с суммой баллов по шкале HDRS-17 не менее 17, по шкале самооценки тревоги Шихана – не менее 30. Вальдоксан назначался в стартовой терапевтической дозе 25 мг, которая (в случае недостаточного, по мнению исследователя, эффекта препарата) могла быть повышена до 50 мг однократно вечером. В ходе 8-недельного периода наблюдения было предусмотрено 7 визитов с применением психопатологического, общесоматического (артериальное давление – АД, частота сердечных сокращений – ЧСС, биохимический анализ крови, измерение массы тела) и психометрического (HDRS-17, шкала самооценки тревоги Шихана – ShARS, шкала самооценки уровня тревожности Спилберга–Ханина – STAI, шкала суицидальных мыслей Бека – BSS, шкала оценки показателей сна – LSEQ) обследований.
Критерием ремиссии являлась редукция балла по шкале HDRS-17 до 7 и ниже. Переносимость терапии оценивалась по следующим показателям: перечню и частоте серьезных нежелательных явлений (НЯ); перечню и частоте НЯ с объективной (врачами) и субъективной (пациентами) оценкой переносимости терапии (отличная, хорошая, удовлетворительная и плохая). Безопасность препарата характеризовалась влиянием длительной терапии на основные жизненные показатели (АД, ЧСС), на функции печени (аспартатаминотрансфераза – АСТ, аланинаминотрансфераза – АЛТ), на щелочную фосфатазу (ЩФ) и общий билирубин (ОБ) крови.
Всего в исследование были включены 310 пациентов, из которых 294 (94,8%) человека полностью завершили программу и составили клинический материал для данной программы.
В качестве сопутствующей психотропной терапии (43 человека; 14,62%) назначались диазепам – сибазон, релиум (6,12%), феназепам (3,06%), гидроксизин – атаракс (2,38%), медазепам – мезапам (2,04%), оксазепам – нозепам (0,34%). Несмотря на то что алпразолам и депакин хроно были запрещены протоколом, их получали 2 пациентов (по 0,34%).
Частота формирования ремиссии при тревожной депрессии
Доля пациентов, достигших ремиссии (по HDRS-17) к концу терапии агомелатином, составила 69,05%. Полученные показатели существенно выше, чем в других работах, посвященных изучению эффективности антидепрессантов у пациентов с тревожной депрессией. Так, в исследовании STAR-D [2], одной из целей которого являлось сравнение эффективности антидепрессивной терапии у пациентов с тревожной депрессией и депрессией без тревоги, процент больных, достигших ремиссии при тревожной депрессии, составил 22,2% (а при депрессии без тревоги – 33,4%), что в 3 раза ниже, чем в настоящей программе.Несколько более высокий процент ремиссии отмечен в работе В.В.Читловой (26,8%) [3], в задачи которой входила оценка эффективности монотерапии флувоксамином пациентов с тревожной депрессией. Таким образом, результаты данной программы вносят коррекцию в широко распространенное мнение о низкой эффективности антидепрессантов при сочетании депрессии и тревоги. В соответствии с исследованиями, формирующими это мнение, присоединение тревоги к депрессии требует больше времени для достижения ремиссии [4–6], а эффективность терапии антидепрессантами при этом снижается [2, 6–10].
Частота формирования ремиссии не зависела от повышения дозы назначаемого препарата. В ходе настоящей программы Вальдоксан в дозе 25 мг/сут принимали 61,56% (n=181), тогда как 38,44% (n=113) пациентам доза была повышена до 50 мг. Процент достижения ремиссии оказался в 2 раза выше при стабильной дозировке (25 мг), чем при ее повышении до 50 мг (81,22% vs 49,56%). Таким образом, в соответствии с полученными результатами стремление врачей добиться более существенного эффекта при наращивании дозы агомелатина не всегда достигает своей цели и, возможно, стратегией повышения эффекивности в данном случае является увеличение длительности применения препарата до 12 нед, что рассматривается в ряде работ в качестве тактики ведения пациентов при отсутствии ремиссии [11].
Анализ терапевтических ремиссий с учетом дименсионального подхода, в рамках которого феноменология ремиссий представлена в виде 4 вариационных рядов: бессимптомная ремиссия – моносимптоматическая ремиссия – полисимптоматическая ремиссия – ремиссия со структурой малой депрессии [12], позволил выявить различия между клинически однородной группой пациентов с тревожной депрессией (ДЖАЗ) и клинически гетерогенной группой больных с депрессией, у которых только в 11,6% случаев состояние определялось тревожной депрессией [12]. Несмотря на высокую частоту достижения ремиссии у больных, вошедших в исследование ДЖАЗ (69,05%), бессимптомная (полная ремиссия) формировалась только в 4,93% случаев. В остальных наблюдениях (95,07%) речь шла о симптоматической (неполной) ремиссии.
В исследовании Л.С.Канаевой [12] полная ремиссия формировалась в 4 раза чаще – 22,4%. Для пациентов, принявших участие в исследовании ДЖАЗ, было характерно формирование неполных ремиссий со структурой симптоматики, описываемой как «малая депрессия» (35,96%), ключевой характеристикой которой является наличие гипотимии в сочетании с факультативной симптоматикой. На долю моносиптоматической (наличие стойкого изолированного остаточного симптома, чаще всего тревожного, соматовегетативного, инсомнического или ипохондрического спектров) и полисимптоматической (констелляция факультативных для депрессивного состояния симптомов) ремиссии приходилось 59% случаев. При этом среднее число остаточных симптомов на 1 пациента было существенно выше в группе пациентов ДЖАЗ (5,5 vs 2,2); табл. 1.

Как видно из табл. 2, спектр остаточной симптоматики в структуре ремиссии у пациентов с тревожной депрессией характеризовался высокой частотой психической (71,4%) и соматической (58,1%) тревоги и снижения активности/работоспособности (54,6%). У многих больных в ремиссии отмечались общие соматические симптомы (45,8%) и депрессивное настроение (35,96%). Частота остальных симптомов была существенно ниже (чувство вины, все виды инсомний, заторможенность, ажитация, соматические симптомы желудочно-кишечного тракта – ЖКТ, изменения массы тела, критика к болезни, генитальные, ипохондрические симптомы). Суицидальные намерения редуцировались полностью и не наблюдались ни у одного пациента, достигшего ремиссии. В сравнении с этой остаточной симптоматикой спектр резидуальных расстройств в структуре терапевтической ремиссии при клинически гетерогенной депрессии характеризовался преобладанием инсомнических проявлений, чувства вины, генитальных симптомов, заторможенности, ипохондрии и общих соматических симптомов.
Предикторы формирования ремиссии при терапии агомелатином пациентов с тревожной депрессией
С целью определения предикторов эффективности терапии было проведено изучение влияния социодемографических и клинических характеристик (пол, возраст, тяжесть депрессии, тяжесть тревоги в начале терапии, диагноз, очередность назначения препарата и его доза) на формирование ремиссии (табл. 3). На частоту формирования ремиссии не оказывали статистически значимого влияния пол пациента (64,81% – у мужчин, 70% – у женщин) и тяжесть депрессии (69,12% при HDRS-17<25 и 68,89% при HDRS-17>25 баллов). Все остальные исследуемые показатели имели статистически достоверное значение для наступления ремиссии. Так, у пациентов моложе 45 лет ремиссия отмечалась в 73,58% случаев, а у пациентов старше 45 лет – в 62,88% (р≤0,05). Ремиссия у больных с первым депрессивным эпизодом достигалась в 77,78% случаев, при рекуррентном течении заболевания эти цифры были значительно ниже – 48,35% (р≤0,0001). Фоновый уровень тревоги также влиял на частоту формирования ремиссии, которая была выше (82,07%) у пациентов с изначально более высокими показателями тревоги, оцениваемой по самоопроснику Шихана. Пациенты с более низкими фоновыми значениями достигали ремиссии только в 55,86% случаев (р≤0,0001). Более высокий процент достижения ремиссии (69,64%) отмечался у пациентов, которым Вальдоксан назначался в качестве первого антидепрессанта, по сравнению с пациентами, у которых он применялся в качестве замены другого антидепрессанта – 50% (р≤0,05).
Проведенный корреляционный анализ позволил подтвердить приведенные данные о зависимости ремиссии от таких показателей, как возраст и исходный уровень тревоги (ShARS). В то же время корреляционная связь между полом, фоновыми баллами по шкалам HDRS-17 и BSS, а также показателями реактивной и личностной тревожности выявлена не была.
Сравнивая время наступления ремиссии при тревожной и атипичной депрессии [13] в процессе терапии Вальдоксаном, следует отметить, что у пациентов данного исследования пик формирования ремиссии приходился на период с 4 по 8-ю неделю, в то время как при атипичной депрессии ремиссия начинала формироваться в более ранние сроки уже с 3-й недели, тогда как к 6-й неделе темпы становления ремиссии значительно снижались (табл. 4).

Как следует из наших предшествующих исследований [13, 14], первичный респонс – ПР (т.е. редукция симптоматики в процессе терапии на 25%) является важным предиктором дальнейшего прогноза терапии. Сравнивая ПР при тревожной и атипичной депрессии, можно отметить, что его формирование фиксировалось уже на 1-й неделе лечения (при тревожной депрессии уже на 3-й день), достигая своего максимума на 2-й неделе терапии в обеих группах (34,2% – при тревожной депрессии, 41,5% – при атипичной депрессии). В то же время, если при тревожной депрессии ПР значительно уменьшался к 6-й неделе (5,5%), то для пациентов с атипичной депрессией такая динамика была характерна уже к 4-й неделе (3,7%) исследования (табл. 5).
Выявленная в предшествующих исследованиях [13–15] закономерность, в соответствии с которой более раннее наступление ПР свидетельствует о более ранних сроках формирования ремиссии, была подтверждена и в настоящей наблюдательной программе. Так, пациенты, у которых ПР отмечался в течение первых 2 нед терапии, в 31% случаев достигали ремиссии уже в течение первых 4 нед лечения. Вместе с тем в отличие от применения агомелатина при атипичной депрессии, при которой в случае раннего респонса формирование ремиссии было ограничено 3–5-й неделей, при терапии тревожной депрессии возможность формирования ремиссии сохранялась вплоть до 8-й недели терапии. Например, при наступлении ПР на 4-й неделе ремиссия формировалась на 6 и 8-й неделях применения агомелатина (табл. 6).
Переносимость и безопасность Вальдоксана
НЯ при терапии Вальдоксаном были отмечены только у 17 (5,48%) пациентов. Наиболее часто возникали головная боль (1,94%), тошнота (1,94%), головокружение (1,61%), дневная сонливость (1,61%), реже изжога, заторможенность, напряжение мышц шеи (по 0,32%); табл. 7.
По мнению врачей, НЯ, связанными с приемом препарата, были тошнота (1,61%), головокружение (0,97%), дневная сонливость (0,97%), головная боль, изжога и заторможенность (по 0,32%); табл. 8.
Спектр НЯ у больных, принимавших Вальдоксан в дозе 25 и 50 мг, не изменялся. Однако количество НЯ в случае повышения дозы до 50 мг увеличивалось (кроме заторможенности и напряжения мышц шеи), хотя и не достигало статистически значимого уровня (табл. 9).

Большинство врачей (82,65%) оценили переносимость Вальдоксана (среди тех пациентов, которые полностью завершили курс терапии) как отличную (НЯ отсутствовали), 15,31% – как хорошую (незначительные НЯ). Только

2 (0,68%) человека отметили удовлетворительную переносимость (умеренные нежелательные реакции). Выраженных нежелательных реакций, по мнению врачей, не было. Для 4 (1,36%) человек не было данных по оценке переносимости. Оценка переносимости терапии пациентами
была несколько ниже. Больные реже отмечали отличную переносимость (65,99%), но чаще – хорошую переносимость (31,63%). Умеренные нежелательные реакции отмечали у себя 2 (0,68%) пациента, а выраженные – 1 (0,34%). У 4 (1,36%) пациентов данные о переносимости препарата отсутствовали (см. рисунок).
В процессе обсервационной программы было отмечено два случая, которые можно отнести к серьезным НЯ: 1 пациент на 10-й день был госпитализирован в отделение неврологии (причина госпитализации не указана); у 1 пациента на 7-й день терапии был выявлен сахарный диабет. В ходе терапии масса тела пациентов, хотя и не очень заметно, но статистически достоверно увеличивается (p<0,00001). Более того, это увеличение массы тела является статистически значимым не только за все 8 нед терапии, но даже за 2 нед терапии (p=0,029), что скорее всего говорит о нормализации аппетита (как об одном из критериев эффективности лечения депрессии) и возвращении массы тела к доболезненному уровню (табл. 10).
Влияние терапии на сердечно-сосудистую систему выражалось в снижении ЧСС. Более того, это снижение является статистически значимым не только в конце терапии, но даже после первых 2 нед применения агомелатина (p=0,000013) и в незначительном снижении АД – систолического (САД) и диастолического (ДАД); табл. 11.

В отношении биохмических показателей был выявлен статистически достоверный рост показателя АСТ (p=0,000041). Величина АЛТ также увеличилась, но не достигла статистической значимости (p=0,063). В процессе лечения не выявлено статистически значимых изменений ЩФ (p=0,13).

Вместе с тем количество ОБ статистически значимо увеличилось (p=0,021). Однако, несмотря на повышение значений биохимических показателей, они на всем этапе терапии продолжали оставаться в пределах клинической нормы (табл. 12).
Выводы
1. Доля пациентов, достигших ремиссии к концу терапии Вальдоксаном, составила 69%, что значительно превышает соответствующий показатель, полученный в других исследованиях. Частота формирования ремиссии не зависела от повышения дозы препарата, что предполагает возможность повышения эффективности терапии путем увеличения длительности его применения без наращивания дозировки.2. Бессимптомная (полная ремиссия) формировалась только в 4,93% случаев. В остальных (95,07%) наблюдениях речь шла о симптоматической (неполной) ремиссии, в спектре которой преобладали психическая и соматическая тревога, а также снижение активности/работоспособности.
3. Благоприятными предикторами эффективности терапии являлись возраст моложе 45 лет, первичный депрессивный эпизод, назначение Вальдоксана в качестве первого антидепрессанта, изначально высокий уровень тревоги. На частоту формирования ремиссии не оказывали статистически значимого влияния пол пациента и тяжесть депрессии.
4. Выявленная в предшествующих исследованиях закономерность, в соответствии с которой более раннее наступление ПР свидетельствует о более ранних сроках формирования ремиссии, было подтверждено в настоящей наблюдательной программе: 1/3 пациентов, у которых ПР отмечался в течение первых 2 нед терапии, достигали ремиссии уже в течение 4 нед лечения.
5. Вальдоксан подтвердил свою высокую переносимость по результатам объективного обследования, а также по мнению врачей и пациентов. НЯ были отмечены только в 5,5% случаев, среди которых преобладали головная боль, тошнота, головокружение и дневная сонливость. Показатели АД, пульса, биохимические параметры не выходили за пределы клинической нормы на протяжении всего периода программы, что свидетельствовало о безопасности применения Вальдоксана.
Сведения об авторах
А.С.Аведисова – д-р мед. наук, проф., рук. отд. терапии психических и поведенческих расстройств ФГБУ ГНЦССПим. В.П.Сербского Минздрава России
К.В.Захарова – канд. мед. наук, ст. науч. сотр. отд. терапии психических и поведенческих расстройств ФГБУ ГНЦССП
им. В.П.Сербского Минздрава России
М.П.Марачев – канд. мед. наук, науч. сотр. отд. терапии психических и поведенческих расстройств ФГБУ ГНЦССП
им. В.П.Сербского Минздрава России
Список исп. литературыСкрыть список1. Аведисова А.С., Захарова К.В., Марачев М.П. Результаты обсервационной программы ДЖАЗ: «Эффективность препарата агомелатин (Вальдоксан) при лечении пациентов с тревожной депрессией в рамках большого депрессивного расстройства». Психиатр. и психофармакотер. 2013; 6.
2. Fava M, Rush AJ, Alpert JE et al. Difference in treatment outcome in outpatients with anxious vs. nonanxious depression: a STAR*D report. Am J Psychiat 2008; 165: 342–51.
3. Читлова В.В. Тревожная депрессия и расстройства личности (коморбидность, типологическая дифференциация, терапия). Автореф. дис. … канд. мед. наук. М., 2013.
4. Clayton PJ, Grove WM, Coryell W et al. Follow-up and family study of anxious depression. Am J Psychiat 1991; 148: 1512–7.
5. Hecht H, von Zerssen D, Wittchen HU. Anxiety and depression in a community sample: the influence of comorbidity on social functioning. J Affect Dis 1990; 18 (2): 137–44.
6. Nutt D. Management of patients with depression associated with anxiety symptoms. J Clin Psychiat 1997; 58 (Suppl. 8): 11–6.
7. Coryell W, Endicott J, Winokur G. Anxiety syndromes as epiphenomena of primary major depression: outcome and familial psychopathology. Am J Psychiat 1992; 149 (1): 100–7.
8. Fava M, Rush AJ, Alpert JE et al. What clinical and symptom features and comorbid disorders characterize outpatients with anxious major depressive disorder: a replication and extension. Can J Psychiat 2006; 51: 823–35.
9. Schosser A, Serretti A, Souery D et al. European Group for the study of Resistant Depression (GSRD). Where have we gone so far: Review of clinical and genetic findings. Eur Neuropsychopharmacol 2012; 22 (7): 453–68.
10. Stein DJ, Hollander E. Anxiety disorders comorbid with depression: social anxiety disorder, post-traumatic stress disorder, generalized anxiety disorder and obsessive-compulsive disorder. Martin Dunitz, London 2002.
11. Мосолов С.Н. Клиническое применение современных антидепрессантов. СПб., 1995.
12. Канаева Л.С. Клиническая структура ремиссий при фармакотерапии и психотерапии больных с непсихотическими депрессиями. Психич. здоровье. 2013; 9: 42–50.
13. Марачев М.П. Эффективность агомелатина при терапии атипичной депрессии. Журн. психиатр. и психофармакотер. 2012; 3: 25–30.
14. Аведисова А.С. Новая стратегия повышения эффективности терапии депрессивных расстройств, определяемая первичным ответом. Психиатр. и психофармакотер. 2011; 11.
15. Вазагаева Т.И. Качество и стойкость ремиссии при применении антидепрессантов и трансперсональной психотерапии у больных с депрессивными расстройствами. Рос. психиатр. журн. 2009; с. 658–65.
25 сентября 2014
Количество просмотров: 2154
