Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№03 2013
Клинико-патогенетическая связь тревоги и воспаления: возможные терапевтические следствия №03 2013
Номера страниц в выпуске:49-52
В отличие от нормальной тревожной реакции, сопровождающейся активацией адаптационных механизмов организма с выбросом стрессовых гормонов, противовоспалительной иммунной активацией, регулируемой системой гипоталамус–гипофиз–кора надпочечников, при действии хронических стрессовых факторов наблюдается нарушение процессов адаптации и иммунной защиты. В частности, установлено существенное повышение концентрации провоспалительных и снижение противовоспалительных цитокинов в плазме крови.
Резюме. В статье проводится анализ исследований патогенетической связи тревоги и воспаления в области психиатрии и нейронаук. Результаты указывают на наличие тесной взаимосвязи патогенетических механизмов расстройств тревожно-депрессивного спектра и иммуновоспалительных ревматических заболеваний, в частности системной красной волчанки (СКВ), основанной на действии хронических стрессовых факторов. На основании проведенного исследования эффективности препарата Афобазол у больных с тревожным расстройством адаптации при СКВ, а также имеющихся доказательств его положительного действия на воспалительные реакции, обосновывается внедрение данного препарата в комплексную терапию больных тревожными расстройствами в ревматологической практике.
Ключевые слова: тревожные расстройства, расстройства адаптации, воспаление, стресс, иммуновоспалительные ревматические заболевания, психофармакотерапия, Афобазол.
Clinical and pathogenic relationship of anxiety and inflammation:
possible therapeutic consequences
D.Yu.Veltishchev1, T.A.Lisitsyna2
1Moscow Research Institute of Psychiatry Ministry of Health
2V.A.Nasonov Research Institute of Rheumatology RAMS, Moscow
Summary. The article contains the review of the results of investigations on the pathogenesis relations of anxiety and inflammation in psychiatry and neurosciences. The results of the studies show close relation of pathogenesis mechanisms of immuno-inflammatory rheumatic diseases and anxiety-depressive spectrum disorders based on the influence of chronic stress factors. The results of the clinical study of therapeutic effects of Afobazol in adjustment disorders in systemic lupus erithematosus and the review of its immunological properties made it possible to recommend its inclusion to the therapy of anxiety disorders in rheumatology practice.
Key words: anxiety disorders, disorders of adaptation, inflammation, stress, immuno-inflammatory rheumatic diseases, psychopharmacotherapy, Afobazol.
В отличие от нормальной тревожной реакции, сопровождающейся активацией адаптационных механизмов организма с выбросом стрессовых гормонов, противовоспалительной иммунной активацией, регулируемой системой гипоталамус–гипофиз–кора надпочечников, при действии хронических стрессовых факторов наблюдается нарушение процессов адаптации и иммунной защиты. В частности, установлено существенное повышение концентрации провоспалительных и снижение противовоспалительных цитокинов в плазме крови [1–3]. Особое значение придают регулирующему влиянию глюкокортикоидов [4]. Так, при нормальной стрессовой реакции глюкокортикоиды тормозят воспалительную активность. При патологической – нарушается контроль процессов воспаления [5] в связи со снижением чувствительности системы гипоталамус–гипофиз–кора надпочечников, которая в норме тормозит воспалительную реакцию. На генетическом уровне происходит стимуляция транскрипции провоспалительных генов в ответ на действие стрессовых факторов [6]. Проблема взаимосвязи психической и соматической патологии в последние годы приобрела особое звучание в связи с успехами в исследованиях тревожных и депрессивных расстройств в области нейронаук, прежде всего нейроиммунологии. Эти исследования показали наличие патогенетической связи расстройств тревожно-депрессивного спектра (РТДС) с соматической патологией, сопровождающейся воспалением, в частности иммуновоспалительными ревматическими заболеваниями (РЗ). Во многом эта связь обусловлена влиянием хронических стрессовых факторов и предрасположенности.
В частности, в последние годы установлено:
Провоспалительные цитокины, проникая через гематоэнцефалический барьер, запускают каскад реакций, приводящий к снижению секреции нейромедиаторов и повышению чувствительности глютаматных рецепторов, что на клиническом уровне проявляется развитием тревоги и депрессии [16]. В некоторых исследованиях показано повышение концентрации провоспалительных цитокинов не только при депрессивных расстройствах, но и при посттравматическом [17, 18], генерализованном тревожном [12] и паническом расстройстве [19]. Кроме того, при некоторых тревожных расстройствах установлено повышение концентрации другого маркера воспаления – С-реактивного белка [15, 19].
Еще одним патогенетическим механизмом, обеспечивающим взаимосвязь тревоги с соматическими заболеваниями, является окислительный стресс, в условиях которого нарушается баланс между про- и антиоксидантными воздействиями в пользу прооксидантных, что приводит к окислительному повреждению основных структурных компонентов клетки (белков, липидов, ДНК), а также ее рецепторного аппарата. Окислительный стресс является ведущим патогенетическим звеном многих соматических, в частности иммуновоспалительных, РЗ. Избыточное образование активных форм кислорода и их способность вызывать антигенную модификацию ДНК с последующим образованием аутоантител к ДНК играют существенную роль в патогенезе системной красной волчанки (СКВ). В последние годы уделяют большое внимание исследованиям окислительного стресса в патогенезе тревожных расстройств. Эти работы подтвердили причинную связь окислительного стресса в развитии тревожных состояний при дефиците антиоксидантов (в частности, витамина Е) [20].
Наиболее ярко взаимосвязь РТДС и воспалительных процессов прослеживается при изучении психических расстройств у больных иммуновоспалительными РЗ. Психические травмы и негативные жизненные события традиционно рассматриваются в качестве ведущего провоцирующего фактора как РЗ, так и РТДС. По данным совместного исследования сотрудников ФГБУ Научно-исследовательский институт ревматологии Российской академии медицинских наук им. В.А.Насоновой и ФГБУ Московский научно-исследовательский институт психиатрии Минздрава РФ, наличие значимого стрессового фактора отмечено перед началом РЗ у подавляющего большинства больных ревматоидным артритом (РА) – 77,6% и СКВ – 67,2%. Последующие обострения также чаще всего связаны с наличием хронических стрессовых факторов (61–74%) [7, 8].
Следует отметить, что психопатологическая структура депрессивных расстройств включала тревожные нарушения в виде тревожно-тоскливого или тревожно-апатического синдрома у большинства больных РЗ и психическими расстройствами: при РА – 71%, СКВ – 76%. Не менее часто наблюдался также стрессовый синдром в виде фиксации содержания переживаний на травмирующей ситуации, симптомов избегания и повышенной возбудимости.
Астенический синдром, прежде всего субъективное ощущение усталости, характерен как для РЗ, так и для РТДС. В совместном исследовании усталость выявлена у большинства больных РА (80%) и СКВ (58,7%). Как «причину» усталости при РЗ также нередко рассматривают гиперпродукцию провоспалительных цитокинов, свойственную РЗ и РТДС. Ощущение усталости при СКВ с высокой точностью ассоциировалось как с наличием выраженной тревоги, депрессии, когнитивных нарушений, так и с наличием остеопороза и применением максимальной дозы глюкокортикоидов [14].
Таким образом, установленная взаимосвязь иммуновоспалительных РЗ и РТДС предполагает дальнейшую разработку терапевтических подходов, учитывающих влияние психофармакологических препаратов не только на тревогу или депрессию, но и на астенический синдром. Кроме того, влияние некоторых психофармакологических препаратов на маркеры воспаления предполагает их синергизм с разными противовоспалительными препаратами, что может способствовать повышению качества комплексного лечения больных, страдающих иммуновоспалительными РЗ.
К таким препаратам относится Афобазол ((5-этокси-2-[2-(морфолино)-этилтио]) бензимидазола дигидрохлорид), созданный и внедренный в практику в ГУ Научно-исследовательский институт фармакологии им. В.В.Закусова РАМН. Этот препарат разработан на основе оригинальной фармакогенетической концепции анксиолитического эффекта и нейрохимической мишени фармакологической коррекции эмоционально-стрессовых реакций, ориентированной на регуляцию нарушенного мембранно-рецепторного взаимодействия. Исследования последних лет выявили разнообразные эффекты Афобазола на нейрорецепторные связи.
В частности, установлена связь анксиолитического действия Афобазола с его влиянием на s1-рецепторы, мелатониновые (МТ-1, МТ-3) рецепторы, моноаминоксидазы типа А рецепторы и способностью предотвращать стрессиндуцированное падение связывания в бензодиазепиновом участке рецептора g-аминомасляной кислоты (ГАМК) и восстанавливать конфигурацию ГАМК-рецепторов и их чувствительность к основному медиатору торможения – ГАМК [21]. Результаты некоторых экспериментальных исследований указывают на значимые эффекты Афобазола на иммунную систему. Так, показано, что Афобазол подавляет активность Т-лимфоцитов, повышает фагоцитарную активность моноцитов, ингибирует стимулированную в эксперименте секрецию цитокинов – интерлейкинов (ИЛ): ИЛ-1b, ИЛ-2, ИЛ-4 и интерферона-g, усиливает созревание дендритных клеток [22, 23]. Кроме того, продемонстрировано, что включение Афобазола в комплексную терапию больных СКВ приводит к снижению уровней ДНК-повреждений в клетках крови и к повышению устойчивости клеток к окислительному генотоксическому воздействию [24].
Афобазол в отличие от большинства анксиолитических средств лишен снотворного, миорелаксирующего эффекта и не приводит к снижению памяти, развитию зависимости и синдрому отмены. В клинических плацебо-контролируемых исследованиях с высокой степенью достоверности доказана эффективность применения Афобазола при генерализованном тревожном расстройстве, неврастении, расстройствах адаптации, а также при тревожных расстройствах при многих соматических заболеваниях. При проведении экспериментальных и клинических исследований было установлено, что Афобазол не влияет на действие препаратов, применяемых для лечения соматической патологии, и в связи с этим особенно востребован при тревожных расстройствах в общей и специализированной медицинской практике [25–28].
Исследование эффективности Афобазола при тревожном варианте расстройств адаптации у больных СКВ показало наличие анксиолитического и противоастенического эффекта. Терапевтическая динамика оценивалась с применением шкалы тревоги Гамильтона – ШТГ (M.Hamilton, 1959) с анализом динамики выраженности психического и соматического компонента, шкалы выраженности усталости – ШВУ (L.Kruco, 1989), шкалы общего клинического впечатления – ШОКВ (H.Guy, 1975), также проводилась оценка побочных эффектов лечения. Длительность терапии Афобазолом составила 42 дня (6 нед). В исследование были включены 40 больных с диагнозом СКВ с расстройством адаптации с тревожной симптоматикой: 35 женщин и 5 мужчин в возрасте от 18 до 61 года (средний возраст 37,6±10,8 года). Длительность расстройств адаптации составила от 1 до 6 мес, в среднем 2,5±1,3 мес. Полный курс лечения прошли 37 больных, 3 пациента выбыли из исследования по причинам, не связанным с терапией Афобазолом.
Анализ динамики показателей ШТГ выявил положительный эффект в отношении расстройств адаптации начиная с 1-й недели лечения. На 3-й неделе отмечен отчетливый положительный эффект, достигающий в среднем 50% от первоначального уровня выраженности. В целом при окончании лечения положительный эффект составил 83% от первоначального уровня показателей. В течение всего срока лечения наблюдалось гармоничное уменьшение выраженности психического и соматического компонента тревоги в соответствии с ШТГ (рис. 1).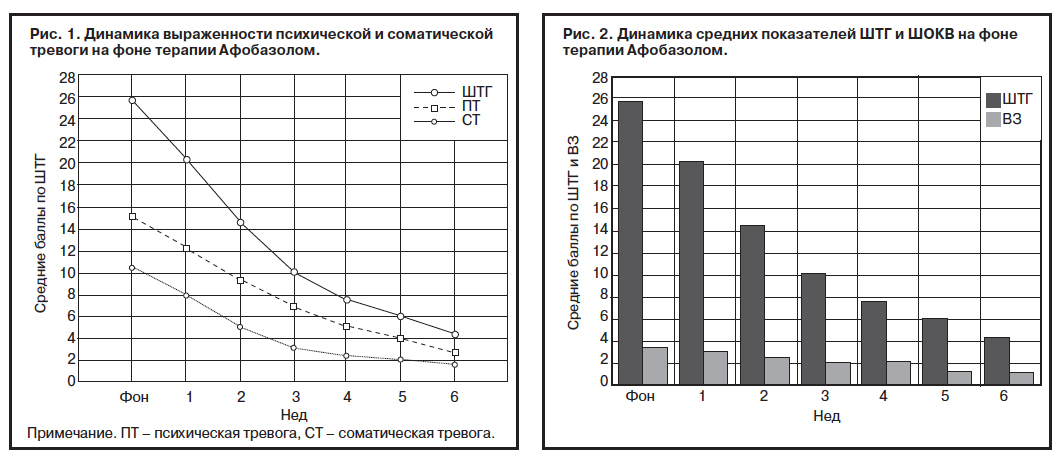
Показатели динамики средней выраженности тревоги, оцениваемой по ШТГ, находились в тесной корреляционной связи с выраженностью расстройства, оцениваемого по ШОКВ (рис. 2). До начала терапии средняя выраженность заболевания (ВЗ) по ШОКВ составляла 3,4±0,6 балла, что соответствовало легкой и средней тяжести заболевания; а после завершения терапии средняя оценка по ШОКВ приблизилась к нормальному состоянию (1,1±0,4). У большинства пациентов отмечалось постепенное улучшение состояния на протяжении всего периода терапии.
ШВУ использовалась не только для уточнения особенностей действия Афобазола на астеническую симптоматику, но и для установления связи ощущения усталости с тревогой при расстройстве адаптации у больных СКВ. Средняя выраженность усталости до начала терапии составляла 45,7±12,5 балла. На 3-й неделе лечения отмечено уменьшение средней выраженности усталости более чем на 40%. При окончании терапии средняя выраженность уменьшилась на 76%. Снижение выраженности усталости происходило постепенно на протяжении всего курса терапии (рис. 3).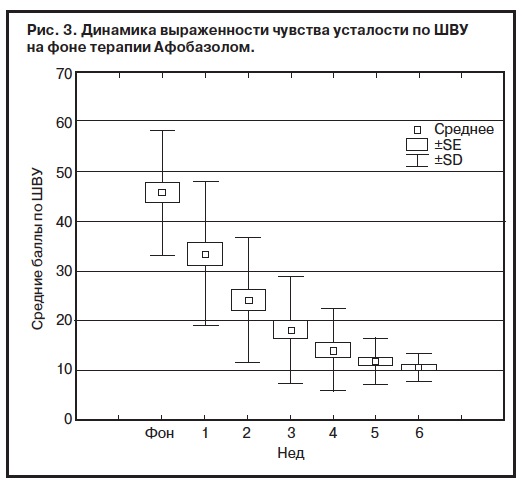
Корреляционный анализ выявил статистически значимые связи показателей ШТГ, ШОКВ и ШВУ (p<0,05). Следует особо отметить наличие значимой связи усталости не только с соматическим, но и психическим компонентом тревожного синдрома.
Нежелательные эффекты лечения встречались в единичных случаях (10%) и были преимущественно связаны с активирующим эффектом, сопровождающим противотревожное действие Афобазола. Этот эффект в нескольких случаях опережал анксиолитическое действие в течение первых 2 нед терапии. В частности, у 1 пациента выявлено умеренное и кратковременное усиление тревоги, у 1 – нарушение засыпания, у 2 – кратковременная легкая тошнота после приема препарата. Эти явления проходили самостоятельно и не требовали прекращения приема препарата. Необходимо отметить, что терапия Афобазолом не оказывала негативного влияния на выраженность симптомов основного заболевания.
Таким образом, полученные результаты показали высокую эффективность препарата Афобазол при лечении расстройства адаптации с тревожной симптоматикой у больных СКВ. Выявлено гармоничное положительное влияние Афобазола как на психический, так и соматический компонент тревожного синдрома. Не менее значимым результатом являлось подтверждение воздействия препарата на астеническую симптоматику, в частности, субъективное ощущение усталости. Результаты свидетельствуют о возможности внедрения препарата в лечение расстройств адаптации с тревожной и астенической симптоматикой в общей медицинской практике. Кроме того, клиническое исследование подтверждает перспективность дальнейшего изучения влияния Афобазола на общие звенья патогенеза тревожных расстройств и иммуновоспалительных РЗ.
Сведения об авторах
Вельтищев Дмитрий Юрьевич – д-р мед. наук, заведующий отделом стрессовых расстройств ФГБУ Московский научно-исследовательский институт психиатрии Минздрава РФ. E-mail: dveltishchev@gmail.com
Лисицына Татьяна Андреевна – канд. мед. наук, ст. науч. сотр. лаборатории системных ревматических заболеваний отдела сосудистой патологии ФГБУ Научно-исследовательский институт ревматологии Российской академии медицинских наук
им. В.А.Насоновой, Москва. E-mail: talisitsyna@rambler.ru
Ключевые слова: тревожные расстройства, расстройства адаптации, воспаление, стресс, иммуновоспалительные ревматические заболевания, психофармакотерапия, Афобазол.
Clinical and pathogenic relationship of anxiety and inflammation:
possible therapeutic consequences
D.Yu.Veltishchev1, T.A.Lisitsyna2
1Moscow Research Institute of Psychiatry Ministry of Health
2V.A.Nasonov Research Institute of Rheumatology RAMS, Moscow
Summary. The article contains the review of the results of investigations on the pathogenesis relations of anxiety and inflammation in psychiatry and neurosciences. The results of the studies show close relation of pathogenesis mechanisms of immuno-inflammatory rheumatic diseases and anxiety-depressive spectrum disorders based on the influence of chronic stress factors. The results of the clinical study of therapeutic effects of Afobazol in adjustment disorders in systemic lupus erithematosus and the review of its immunological properties made it possible to recommend its inclusion to the therapy of anxiety disorders in rheumatology practice.
Key words: anxiety disorders, disorders of adaptation, inflammation, stress, immuno-inflammatory rheumatic diseases, psychopharmacotherapy, Afobazol.
В отличие от нормальной тревожной реакции, сопровождающейся активацией адаптационных механизмов организма с выбросом стрессовых гормонов, противовоспалительной иммунной активацией, регулируемой системой гипоталамус–гипофиз–кора надпочечников, при действии хронических стрессовых факторов наблюдается нарушение процессов адаптации и иммунной защиты. В частности, установлено существенное повышение концентрации провоспалительных и снижение противовоспалительных цитокинов в плазме крови [1–3]. Особое значение придают регулирующему влиянию глюкокортикоидов [4]. Так, при нормальной стрессовой реакции глюкокортикоиды тормозят воспалительную активность. При патологической – нарушается контроль процессов воспаления [5] в связи со снижением чувствительности системы гипоталамус–гипофиз–кора надпочечников, которая в норме тормозит воспалительную реакцию. На генетическом уровне происходит стимуляция транскрипции провоспалительных генов в ответ на действие стрессовых факторов [6]. Проблема взаимосвязи психической и соматической патологии в последние годы приобрела особое звучание в связи с успехами в исследованиях тревожных и депрессивных расстройств в области нейронаук, прежде всего нейроиммунологии. Эти исследования показали наличие патогенетической связи расстройств тревожно-депрессивного спектра (РТДС) с соматической патологией, сопровождающейся воспалением, в частности иммуновоспалительными ревматическими заболеваниями (РЗ). Во многом эта связь обусловлена влиянием хронических стрессовых факторов и предрасположенности.
В частности, в последние годы установлено:
- тревожные и депрессивные расстройства выявляют у большинства больных иммуновоспалительными заболеваниями [7, 8];
- высокая концентрация биомаркеров воспаления (прежде всего провоспалительных цитокинов) обнаружена при паническом расстройстве, посттравматическом стрессовом расстройстве и депрессивных расстройствах [9–12];
- применение провоспалительных цитокинов в терапии ряда заболеваний повышает риск депрессии [9, 10];
- выраженные острые и хронические стрессовые факторы активируют провоспалительные механизмы воспаления и провоцируют развитие или усиление тревожных и депрессивных расстройств [7, 13];
- детские психические травмы (в частности, родительская депривация) предрасполагают к развитию РТДС и иммуновоспалительных заболеваний в связи с нейротоксическим эффектом гиперпродукции стрессовых гормонов [7, 13];
- иммуновоспалительные заболевания и РТДС имеют некоторые общие клинические проявления, в частности – усталость и боль [14, 15];
- психофармакологические препараты могут снижать воспалительный ответ организма [9, 10];
- нестероидные противовоспалительные препараты (ингибиторы фактора некроза опухоли-a) способствуют улучшению настроения, а также повышению эффективности комплексного лечения тревожных и депрессивных расстройств [9, 10].
Провоспалительные цитокины, проникая через гематоэнцефалический барьер, запускают каскад реакций, приводящий к снижению секреции нейромедиаторов и повышению чувствительности глютаматных рецепторов, что на клиническом уровне проявляется развитием тревоги и депрессии [16]. В некоторых исследованиях показано повышение концентрации провоспалительных цитокинов не только при депрессивных расстройствах, но и при посттравматическом [17, 18], генерализованном тревожном [12] и паническом расстройстве [19]. Кроме того, при некоторых тревожных расстройствах установлено повышение концентрации другого маркера воспаления – С-реактивного белка [15, 19].
Еще одним патогенетическим механизмом, обеспечивающим взаимосвязь тревоги с соматическими заболеваниями, является окислительный стресс, в условиях которого нарушается баланс между про- и антиоксидантными воздействиями в пользу прооксидантных, что приводит к окислительному повреждению основных структурных компонентов клетки (белков, липидов, ДНК), а также ее рецепторного аппарата. Окислительный стресс является ведущим патогенетическим звеном многих соматических, в частности иммуновоспалительных, РЗ. Избыточное образование активных форм кислорода и их способность вызывать антигенную модификацию ДНК с последующим образованием аутоантител к ДНК играют существенную роль в патогенезе системной красной волчанки (СКВ). В последние годы уделяют большое внимание исследованиям окислительного стресса в патогенезе тревожных расстройств. Эти работы подтвердили причинную связь окислительного стресса в развитии тревожных состояний при дефиците антиоксидантов (в частности, витамина Е) [20].
Наиболее ярко взаимосвязь РТДС и воспалительных процессов прослеживается при изучении психических расстройств у больных иммуновоспалительными РЗ. Психические травмы и негативные жизненные события традиционно рассматриваются в качестве ведущего провоцирующего фактора как РЗ, так и РТДС. По данным совместного исследования сотрудников ФГБУ Научно-исследовательский институт ревматологии Российской академии медицинских наук им. В.А.Насоновой и ФГБУ Московский научно-исследовательский институт психиатрии Минздрава РФ, наличие значимого стрессового фактора отмечено перед началом РЗ у подавляющего большинства больных ревматоидным артритом (РА) – 77,6% и СКВ – 67,2%. Последующие обострения также чаще всего связаны с наличием хронических стрессовых факторов (61–74%) [7, 8].
Следует отметить, что психопатологическая структура депрессивных расстройств включала тревожные нарушения в виде тревожно-тоскливого или тревожно-апатического синдрома у большинства больных РЗ и психическими расстройствами: при РА – 71%, СКВ – 76%. Не менее часто наблюдался также стрессовый синдром в виде фиксации содержания переживаний на травмирующей ситуации, симптомов избегания и повышенной возбудимости.
Астенический синдром, прежде всего субъективное ощущение усталости, характерен как для РЗ, так и для РТДС. В совместном исследовании усталость выявлена у большинства больных РА (80%) и СКВ (58,7%). Как «причину» усталости при РЗ также нередко рассматривают гиперпродукцию провоспалительных цитокинов, свойственную РЗ и РТДС. Ощущение усталости при СКВ с высокой точностью ассоциировалось как с наличием выраженной тревоги, депрессии, когнитивных нарушений, так и с наличием остеопороза и применением максимальной дозы глюкокортикоидов [14].
Таким образом, установленная взаимосвязь иммуновоспалительных РЗ и РТДС предполагает дальнейшую разработку терапевтических подходов, учитывающих влияние психофармакологических препаратов не только на тревогу или депрессию, но и на астенический синдром. Кроме того, влияние некоторых психофармакологических препаратов на маркеры воспаления предполагает их синергизм с разными противовоспалительными препаратами, что может способствовать повышению качества комплексного лечения больных, страдающих иммуновоспалительными РЗ.
К таким препаратам относится Афобазол ((5-этокси-2-[2-(морфолино)-этилтио]) бензимидазола дигидрохлорид), созданный и внедренный в практику в ГУ Научно-исследовательский институт фармакологии им. В.В.Закусова РАМН. Этот препарат разработан на основе оригинальной фармакогенетической концепции анксиолитического эффекта и нейрохимической мишени фармакологической коррекции эмоционально-стрессовых реакций, ориентированной на регуляцию нарушенного мембранно-рецепторного взаимодействия. Исследования последних лет выявили разнообразные эффекты Афобазола на нейрорецепторные связи.
В частности, установлена связь анксиолитического действия Афобазола с его влиянием на s1-рецепторы, мелатониновые (МТ-1, МТ-3) рецепторы, моноаминоксидазы типа А рецепторы и способностью предотвращать стрессиндуцированное падение связывания в бензодиазепиновом участке рецептора g-аминомасляной кислоты (ГАМК) и восстанавливать конфигурацию ГАМК-рецепторов и их чувствительность к основному медиатору торможения – ГАМК [21]. Результаты некоторых экспериментальных исследований указывают на значимые эффекты Афобазола на иммунную систему. Так, показано, что Афобазол подавляет активность Т-лимфоцитов, повышает фагоцитарную активность моноцитов, ингибирует стимулированную в эксперименте секрецию цитокинов – интерлейкинов (ИЛ): ИЛ-1b, ИЛ-2, ИЛ-4 и интерферона-g, усиливает созревание дендритных клеток [22, 23]. Кроме того, продемонстрировано, что включение Афобазола в комплексную терапию больных СКВ приводит к снижению уровней ДНК-повреждений в клетках крови и к повышению устойчивости клеток к окислительному генотоксическому воздействию [24].
Афобазол в отличие от большинства анксиолитических средств лишен снотворного, миорелаксирующего эффекта и не приводит к снижению памяти, развитию зависимости и синдрому отмены. В клинических плацебо-контролируемых исследованиях с высокой степенью достоверности доказана эффективность применения Афобазола при генерализованном тревожном расстройстве, неврастении, расстройствах адаптации, а также при тревожных расстройствах при многих соматических заболеваниях. При проведении экспериментальных и клинических исследований было установлено, что Афобазол не влияет на действие препаратов, применяемых для лечения соматической патологии, и в связи с этим особенно востребован при тревожных расстройствах в общей и специализированной медицинской практике [25–28].
Исследование эффективности Афобазола при тревожном варианте расстройств адаптации у больных СКВ показало наличие анксиолитического и противоастенического эффекта. Терапевтическая динамика оценивалась с применением шкалы тревоги Гамильтона – ШТГ (M.Hamilton, 1959) с анализом динамики выраженности психического и соматического компонента, шкалы выраженности усталости – ШВУ (L.Kruco, 1989), шкалы общего клинического впечатления – ШОКВ (H.Guy, 1975), также проводилась оценка побочных эффектов лечения. Длительность терапии Афобазолом составила 42 дня (6 нед). В исследование были включены 40 больных с диагнозом СКВ с расстройством адаптации с тревожной симптоматикой: 35 женщин и 5 мужчин в возрасте от 18 до 61 года (средний возраст 37,6±10,8 года). Длительность расстройств адаптации составила от 1 до 6 мес, в среднем 2,5±1,3 мес. Полный курс лечения прошли 37 больных, 3 пациента выбыли из исследования по причинам, не связанным с терапией Афобазолом.
Анализ динамики показателей ШТГ выявил положительный эффект в отношении расстройств адаптации начиная с 1-й недели лечения. На 3-й неделе отмечен отчетливый положительный эффект, достигающий в среднем 50% от первоначального уровня выраженности. В целом при окончании лечения положительный эффект составил 83% от первоначального уровня показателей. В течение всего срока лечения наблюдалось гармоничное уменьшение выраженности психического и соматического компонента тревоги в соответствии с ШТГ (рис. 1).

Показатели динамики средней выраженности тревоги, оцениваемой по ШТГ, находились в тесной корреляционной связи с выраженностью расстройства, оцениваемого по ШОКВ (рис. 2). До начала терапии средняя выраженность заболевания (ВЗ) по ШОКВ составляла 3,4±0,6 балла, что соответствовало легкой и средней тяжести заболевания; а после завершения терапии средняя оценка по ШОКВ приблизилась к нормальному состоянию (1,1±0,4). У большинства пациентов отмечалось постепенное улучшение состояния на протяжении всего периода терапии.
ШВУ использовалась не только для уточнения особенностей действия Афобазола на астеническую симптоматику, но и для установления связи ощущения усталости с тревогой при расстройстве адаптации у больных СКВ. Средняя выраженность усталости до начала терапии составляла 45,7±12,5 балла. На 3-й неделе лечения отмечено уменьшение средней выраженности усталости более чем на 40%. При окончании терапии средняя выраженность уменьшилась на 76%. Снижение выраженности усталости происходило постепенно на протяжении всего курса терапии (рис. 3).

Корреляционный анализ выявил статистически значимые связи показателей ШТГ, ШОКВ и ШВУ (p<0,05). Следует особо отметить наличие значимой связи усталости не только с соматическим, но и психическим компонентом тревожного синдрома.
Нежелательные эффекты лечения встречались в единичных случаях (10%) и были преимущественно связаны с активирующим эффектом, сопровождающим противотревожное действие Афобазола. Этот эффект в нескольких случаях опережал анксиолитическое действие в течение первых 2 нед терапии. В частности, у 1 пациента выявлено умеренное и кратковременное усиление тревоги, у 1 – нарушение засыпания, у 2 – кратковременная легкая тошнота после приема препарата. Эти явления проходили самостоятельно и не требовали прекращения приема препарата. Необходимо отметить, что терапия Афобазолом не оказывала негативного влияния на выраженность симптомов основного заболевания.
Таким образом, полученные результаты показали высокую эффективность препарата Афобазол при лечении расстройства адаптации с тревожной симптоматикой у больных СКВ. Выявлено гармоничное положительное влияние Афобазола как на психический, так и соматический компонент тревожного синдрома. Не менее значимым результатом являлось подтверждение воздействия препарата на астеническую симптоматику, в частности, субъективное ощущение усталости. Результаты свидетельствуют о возможности внедрения препарата в лечение расстройств адаптации с тревожной и астенической симптоматикой в общей медицинской практике. Кроме того, клиническое исследование подтверждает перспективность дальнейшего изучения влияния Афобазола на общие звенья патогенеза тревожных расстройств и иммуновоспалительных РЗ.
Сведения об авторах
Вельтищев Дмитрий Юрьевич – д-р мед. наук, заведующий отделом стрессовых расстройств ФГБУ Московский научно-исследовательский институт психиатрии Минздрава РФ. E-mail: dveltishchev@gmail.com
Лисицына Татьяна Андреевна – канд. мед. наук, ст. науч. сотр. лаборатории системных ревматических заболеваний отдела сосудистой патологии ФГБУ Научно-исследовательский институт ревматологии Российской академии медицинских наук
им. В.А.Насоновой, Москва. E-mail: talisitsyna@rambler.ru
Список исп. литературыСкрыть список1. Raison CL, Capuron L, Miller AH. Cytokines sing the blues: inflammation and the pathogenesis of depression. Trends Immunol 2006; 27 (1): 24–31.
2. Raison CL, Miller AH. Is depression an inflammatory disorder? Curr Psychiatry Rep 2011; 13 (6): 467–775.
3. Maes M, Song C, Lin A et al. The effects of psychological stress on humans: increased production of pro-inflammatory cytokines and Th1-like response in stress-induced anxiety. Cytokine 1998; 10 (4): 313–8.
4. Miller GE, Rohleder N, Stetler C et al. Clinical depression and regulation of the inflammatory response during acute stress. Psychosom Med 2005; 67 (5): 679–87.
5. Raison CL, Miller AH. When not enough is too much: the role of insufficient glucocorticoid signaling in the pathophysiology of stress-related disorders. Am J Psychiatry 2003; 160 (9): 1554–65.
6. Tak PP, Firestein GS. NF-κB: a key role in inflammatory diseases. J Clin Invest 2001; 107 (1): 7–12.
7. Лисицына Т.А., Вельтищев Д.Ю., Насонов Е.Л. Стрессовые факторы и депрессивные расстройства при ревматических заболеваниях. Научно-практическая ревматология. 2013; 2: 98–103.
8. Вельтищев Д.Ю., Лисицына Т.А., Серавина О.Ф. и др. Расстройства тревожно-депрессивного спектра при системной красной волчанке: особенности диагностики и терапии. Фарматека. 2006; спец. вып.: 20–6, 48, 91, 700–6.
9. Cavanagh J, Mathias C. Inflammation and its relevance to psychiatry. Advances in Psychiatr Treatment 2008; 14: 248–55.
10. Almond M. Depression and inflammation: examining the link. Curr Psychiatr 2013; 12 (6): 25–32.
11. Vogelzangs N, Beekman A, de Jonge P, Penninx BW. Anxiety disorders and inflammation in a large adult cohort. Transl Psychiatr 2013; 3: e249.
12. Hoge EA, Brandstetter K, Moshier S et al. Broad spectrum of cytokine abnormalities in panic disorder and posttraumatic stress disorder. Depress Anxiety 2009; 26: 447–55.
13. Hassett AL, Clauw DJ. The role of stress in rheumatic diseases. Arthritis Research & Therapy 2010; 12: 123.
14. Лисицына Т.А., Вельтищев Д.Ю., Герасимов А.Н. и др. Выраженность усталости и ее связь с депрессией, болью и воспалительной активностью при ревматоидном артрите. Терапевт. арх. 2013; 85 (5): 8–15.
15. Лисицына Т.А., Вельтищев Д.Ю., Герасимов А.Н. и др. Факторы, влияющие на восприятие боли при ревматоидном артрите. Клин. медицина. 2013; 91 (3): 54–61.
16. Müller N, Schwarz MJ. The immune-mediated alteration of serotonin and glutamate: towards an integrated view of depression. Mol Psychiatry 2007; 12 (11): 988–100.
17. Gill JM, Saligan L, Woods S, Page G. PTSD is associated with an excess of inflammatory immune activities. Perspect Psychiatr Care 2009; 45: 262–77.
18. Spitzer C, Barnow S, Volzke H et al. Association of posttraumatic stress disorder with low-grade elevation of C-reactive protein: evidence from the general population. J Psychiatr Res 2010; 44: 15–21.
19. Bankier B, Barajas J, Martinez-Rumayor A, Januzzi JL. Association between C-reactive protein and generalized anxiety disorder in stable coronary heart disease patients. Eur Heart J 2008; 29: 2212–7.
20. Bouayed J, Rammal H, Soulimani R. Oxidative stress and anxiety. Relationship and cellular pathways. Oxid Med Cell Longev 2009; 2 (2): 63–7.
21. Серединин С.Б., Воронин М.В. Нейрорецепторные механизмы действия Афобазола. Психиатрия и психофармакотерапия. 2013; 1: 4–14.
22. Разумная Ф.Г., Сибиряк С.В. Влияние Афобазола на функциональную активность моноцитов в системе in vitro. Цитокины и воспаление. 2011; 1.
23. Разумная Ф.Г., Салимгареева М.Х., Ямиданов Р.С. и др. Афобазол подавляет функциональную активность Т-лимфоцитов в системе in vitro. Цитокины и воспаление. 2012; 4, 5.
24. Жанатаев А.К., Лисицына Т.А., Дурнев А.Д. и др. Влияние Афобазола на ДНК-повреждения у больных системной красной волчанкой. Бюлл. эксперим. биол. и мед. 2009; 148 (10): 404–7.
25. Незнамов Г.Г., Сюняков С.А., Чумаков Д.В., Маметова Л.Э. Новый селективный анксиолитик Афобазол. Журн. неврологии и психиатрии им. Корсакова. 2005; 105 (4): 35–40.
26. Краснов В.Н., Вельтищев Д.Ю., Немцов А.В., Ивушкин А.А. Новые подходы к лечению стрессовых и тревожных расстройств: результаты многоцентрового исследования эффективности Афобазола в психиатрической практике. Фарматека. 2006; спец. вып.: 83–90.
27. Смулевич А.Б., Андрющенко А.В., Романов Д.В., Сиранчиева О.А. Терапия пограничных психических расстройств (исследование эффективности и переносимости Афобазола). Психические расстройства в общей практике. 2006; 1: 10–6.
28. Аведисова А.С., Чахава В.О., Борукаев Р.Р. Эффективность Афобазола в условиях длительной терапии. Психиатрия и психофармакотерапия. 2008; 5: 13–8.

