Психиатрия Психические расстройства в общей медицине
Психиатрия Психические расстройства в общей медицине
№01 2009
Инфаркт миокарда и депрессия: клинико-функциональные взаимосвязи и возможности коррекции ремоделирования левого желудочка антидепрессантом тианептином №01 2009
Номера страниц в выпуске:61-65
В последние годы большой интерес специалистов вызывает проблема коморбидности аффективных нарушений и ишемической болезни сердца (ИБС), в частности инфаркта миокарда (ИМ). Во многом это связано с прогнозом ВОЗ, согласно которому к 2020 г. депрессия выйдет на второе место после ИБС по числу лет сокращения полноценной жизни в связи с инвалидностью. В ряде исследований изучено влияние сопутствующих тревожно-депрессивных расстройств на клиническое течение ИМ, функциональное состояние пациентов и качество их жизни, прогноз заболевания.
В последние годы большой интерес специалистов вызывает проблема коморбидности аффективных нарушений и ишемической болезни сердца (ИБС), в частности инфаркта миокарда (ИМ) [1–3]. Во многом это связано с прогнозом ВОЗ, согласно которому к 2020 г. депрессия выйдет на второе место после ИБС по числу лет сокращения полноценной жизни в связи с инвалидностью [4].
В ряде исследований изучено влияние сопутствующих тревожно-депрессивных расстройств на клиническое течение ИМ, функциональное состояние пациентов и качество их жизни, прогноз заболевания, однако опубликованные результаты весьма противоречивы [5–7]. Между тем получены данные о том, что избыточная активация симпатоадреналовой системы, нередко выявляемая у пациентов с аффективной патологией, может приводить к тяжелой обратимой сократительной дисфункции левого желудочка (ЛЖ) даже у пациентов без ИБС [8]. В сочетании с нарушениями процессов нормального восстановления, наблюдающимися при депрессии [9], это может обусловливать неблагоприятное течение постинфарктного ремоделирования ЛЖ, однако исследования по данному вопросу в литературе не описаны. Вместе с тем есть основание полагать, что современные антидепрессанты, влияя на активность симпатоадреналовой и серотониновой систем, могут замедлять процессы ремоделирования ЛЖ и благоприятно влиять на течение основного заболевания [10], однако эти данные требуют уточнения.
В связи с изложенным целью настоящей работы было изучение динамики клинико-функционального состояния и параметров ремоделирования ЛЖ у пациентов с острым ИМ в зависимости от наличия и выраженности сопутствующих аффективных расстройств, а также проводимой в дополнение к стандартному лечению ИМ терапии тианептином (антидепрессант из группы селективных стимуляторов обратного захвата серотонина).
Материалы и методы
Изученная выборка сформирована на основе следующих критериев включения:
Диагноз настоящего ИМ верифицировали на основании критериев Всероссийского научного общества кардиологов (2007 г.). На 2-е–3-и сутки острого ИМ всем больным проводили общеклиническое и электрокардиографическое (ЭКГ) обследование. Повторное клинико-функциональное обследование проводилось перед выпиской из стационара (19–21-е сутки острого ИМ), через 2 и 6 мес с момента развития ИМ и включало измерение частоты сердечных сокращений (ЧСС) и артериального давления (АД) в положении сидя после 5-минутного отдыха, ЭКГ, оценку функционального класса (ФК) стенокардии (согласно классификации Канадской ассоциации кардиологов, 1976), учет числа приступов стенокардии в неделю, степени выраженности и стадии хронической сердечной недостаточности (ХСН) (согласно классификации ОССН1, 2006).
Всем больным на 3-и–5-е сутки острого ИМ и через 6 мес проводили двухмерную эхокардиографию (ЭхоКГ) на ультразвуковой диагностической системе Sonos-5500 фирмы «Hewlett-Packard» (США). Определяли конечно-диастолический (КДР) и конечно-систолический (КСР) размеры ЛЖ, толщину межжелудочковой перегородки (ТМЖП) и задней стенки (ТЗС) в конце диастолы. Методом «дисков» по Simpson определяли конечно-диастолический (КДО), конечно-систолический (КСО), ударный (УО) объемы и фракцию выброса (ФВ) ЛЖ. Полученные объемы индексировали по отношению к площади поверхности тела пациента. Вычисляли сердечный индекс (СИ), систолический и диастолический миокардиальный стресс (МС), индекс относительной толщины стенок (ИОТС) ЛЖ, индекс сферичности (ИС) в систолу и диастолу. Диастолическую функцию ЛЖ оценивали с помощью допплер-ЭхоКГ трансмитрального кровотока и кровотока в легочных венах. Диастолическую функцию ЛЖ не оценивали при наличии у пациента митральной регургитации более I степени.
Толерантность к физической нагрузке и ФК ХСН пациентов перед выпиской из стационара и через 6 мес после ИМ определяли по данным теста 6-минутной ходьбы. Тест проводили с учетом рекомендаций Американского торакального общества (ATS, 2002).
Для выявления и оценки выраженности расстройств аффективного спектра на 4–5-й день острого ИМ всем пациентам проводили психопатологическое обследование психиатром с использованием критериев МКБ-10, шкал тревоги и депрессии Hamilton. По результатам обследования выделены две группы пациентов с сопутствующими расстройствами аффективного спектра: с клинически выраженной депрессией и расстройствами адаптации (РА), проявлявшимися депрессивным или тревожным настроением легкой степени выраженности. Повторное психопатологическое обследование проводили через 2 и 6 мес c момента развития острого ИМ.
Всем больным при включении в исследование и отсутствии противопоказаний назначали базисную терапию b-блокаторами, ингибиторами ангиотензинпревращающего фермента, аспирином и статинами. При необходимости присоединяли антиангинальную терапию нитропрепаратами, объем которой учитывали отдельно.
Для коррекции аффективной симптоматики пациентам с установленной депрессией, дополнительно к общепринятой терапии острого ИМ, на 5–7-е сутки назначали антидепрессант тианептин (Коаксил, «Сервье», Франция), однако часть больных отказались от антидепрессанта из-за боязни психиатрической стигматизации или привыкания к препарату.
Начальная доза тианептина составляла 18,75 мг/сут и в течение 3–4 дней при отсутствии побочных явлений доводилась до терапевтической – 37,5 мг/сут. Средняя продолжительность курса лечения препаратом составила 3,9±1,1 мес. С учетом проведенной терапии все включенные в исследование пациенты были разделены на группы: 1 группу составили 64 пациента с острым ИМ без аффективных расстройств (АР), 2A группу – 19 пациентов с острым ИМ и сопутствующей депрессией, согласившихся на терапию Коаксилом, 2Б – 10 пациентов с острым ИМ и сопутствующей депрессией, отказавшихся от применения антидепрессанта, и группу 3 – 15 пациентов с острым ИМ и РА.
Статистическую обработку данных проводили с помощью пакета программ «Statistica 6.0», Statsoft (США). Для описания данных при нормальном распределении использовали среднее значение (m) и стандартное отклонение средней (SD), а в случае отклонения распределения от нормального – медиану (M) и 25–75% интерквартильный интервал. Достоверность различий значений параметров в группах оценивали по t-критерию Стьюдента для зависимых и независимых выборок с учетом поправки Бонферрони при множественных сравнениях. Если вид распределения отличался от нормального, использовали непараметрические критерии Mann–Whitney и Wilcoxon. Различия в показателях между группами считали статистически значимыми при p≤0,05. Парную взаимосвязь двух признаков и более определяли многомерным методом корреляционного анализа Pearson и методом ранговых корреляций по Spearman и считали статистически достоверной при p≤0,05.
Результаты и обсуждение
В остром периоде ИМ клиническое обследование, проведенное психиатром, выявило наличие аффективных расстройств у 44 (40,7%) из 108 пациентов. Использование критериев МКБ-10 позволило выделить следующие диагностические категории: депрессивные эпизоды умеренной и легкой степени выраженности (первичные и в рамках рекуррентного депрессивного расстройства) – у 29 (26,9%) пациентов, РА – у 15 (13,9%) пациентов. Спонтанная немедикаментозная редукция депрессивной симптоматики за 6 мес наблюдения отмечена у 40% пациентов.
На момент включения в исследование между сформированными группами не отмечено статистически значимых различий по возрасту, полу, тяжести и локализации ИМ, длительности и тяжести проявлений предшествующей ИБС и частоте сопутствующих заболеваний.
На стационарном этапе в группе пациентов с сопутствующей депрессией в сравнении с пациентами без аффективных расстройств (АР) достоверно чаще отмечено развитие ранней постинфарктной стенокардии (53,6 и 22,2%, p=0,017). По выраженности проявлений ХСН, наличию других осложнений острого ИМ (нарушения ритма, эпистенокардитический перикардит, острая аневризма ЛЖ) группы статистически не различались.
В целом в процессе наблюдения выявлена тенденция к уменьшению частоты встречаемости стенокардии напряжения высокого ФК у пациентов без АР (6,3; 4,2 и 1,9% при выписке из стационара, через 2 и 6 мес с момента развития ИМ соответственно). У пациентов с сопутствующей депрессией, не получавших антидепрессант, напротив, отмечено ее увеличение (17,9; 27,6 и 40,0% на этапах наблюдения).
При анализе объема терапии через 6 мес с момента развития ИМ отмечено, что пациенты с сопутствующей депрессией достоверно чаще получали нитраты, чем пациенты без АР, что прямо коррелировало с тяжестью течения стенокардии у больных (r=0,63; p<0,001). Влияние коморбидного депрессивного расстройства на интенсивность приступов стенокардии, по-видимому, связано с наблюдаемым при депрессии уменьшением числа нейронов, продуцирующих вазодилататор оксид азота, что сопровождается нарушениями в b-эндорфинергической антиноцицептивной системе и снижением порога болевой чувствительности при приступах ишемии миокарда.
В процессе исследования выявлена тенденция к более тяжелому течению ХСН у пациентов группы 2Б. Через 6 мес после ИМ средний ФК ХСН по NYHA у них составил 1,8±0,8 против 1,4±0,5 в группе 1, 1,5±0,62 в группе 2А и 1,2±0,4 в группе 3, хотя различия и не достигли статистической значимости.
Влияние сопутствующих расстройств аффективного спектра на структурно-геометрические параметры ЛЖ и внутрисердечную гемодинамику при ИМ в литературе отражено крайне скудно и противоречиво. В одних исследованиях [11, 12] не найдено взаимосвязи наличия депрессивных расстройств и величины ФВ ЛЖ при ИМ, в то время как в других [13, 14] депрессия при ИМ ассоциируется со снижением насосной и сократительной функции ЛЖ и чаще выявлялась у пациентов с более низкой ФВ ЛЖ.
Данные ЭхоКГ-исследования пациентов сравниваемых групп нашей выборки представлены в табл. 1. При включении в исследование в группе с сопутствующей депрессией отмечена статистически значимо более низкая ФВ ЛЖ (p=0,004) и величина СИ (p=0,04), чем в группе без АР. Величина ФВ и СИ не отличалась у пациентов без АР и с РА.
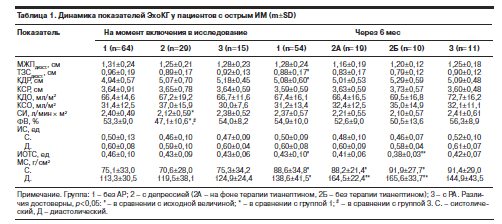
Через 6 мес от момента развития ИМ у пациентов группы 2Б выявлено максимальное увеличение КДР ЛЖ, свидетельствующее о прогрессировании процессов ремоделирования ЛЖ, тогда как в группе 2A он имел тенденцию к снижению. Кроме того, лишь в группе 2Б выявлена тенденция к увеличению КСР ЛЖ в динамике в отличие от недостоверного снижения этого показателя в других группах.
ФВ ЛЖ статистически незначимо увеличилась по сравнению с исходной величиной во всех группах, максимально – в группе 2A, в этой же группе недостоверно выросла величина СИ. Статистически значимых межгрупповых различий по линейным и объемным показателям ЛЖ, а также параметрам внутрисердечной гемодинамики через 6 мес после ИМ выявить не удалось.
Максимальное истончение стенок и степень увеличения КДР ЛЖ в группе 2Б нашли отражение в достоверно меньшем ИОТС у этих больных через 6 мес после ИМ в сравнении с пациентами группы 1 (p=0,004). В группах 2A и 3 существенная динамика ИОТС за период наблюдения отсутствовала.
Систолический и диастолический МС, отражающие, соответственно, пост- и преднагрузку на миокард, достоверно увеличились через 6 мес после ИМ во всех группах пациентов, кроме пациентов с РА, у которых тенденция к их увеличению не достигла статистической значимости.
Диастолический МС в сравнении с исходной величиной максимально увеличился в группе 2Б и через 6 мес с момента развития ИМ стал достоверно превышать таковой в группе 1 (p=0,042).
Таким образом, по результатам нашей работы у пациентов с ИМ наличие сопутствующих расстройств депрессивного спектра было связано с достоверно более низкой ФВ ЛЖ и величиной СИ в остром периоде заболевания. У больных депрессией выявлена также тенденция к наибольшей выраженности процессов постинфарктного ремоделирования ЛЖ через 6 мес наблюдения, что проявлялось в достоверно меньшем ИОТС и большем показателе диастолического МС, а также тенденцией к максимальному увеличению показателей КДР и КСР ЛЖ в сравнении с пациентами без АР.
В доступной литературе не было найдено данных о влиянии сопутствующих расстройств депрессивного спектра на диастолическую функцию ЛЖ у пациентов с ИМ. Нами проведен соответствующий статистический анализ, по результатам которого, однако, достоверного влияния сопутствующих депрессивных расстройств на диастолическую функцию ЛЖ при ИМ не выявлено.
Анализ литературы свидетельствует, что наличие сопутствующей депрессии значительно снижает функциональные возможности пациентов с ИБС, ограничивает их толерантность к физической нагрузке [13, 15]. В работе J.Ickovics и соавт. [6] наличие сопутствующих депрессивных расстройств уступало только наличию ИМ в анамнезе в ряду факторов, ограничивающих повседневную активность пациентов через 1 год после ИМ.
Проведенное нами исследование позволяет присоединиться к этой точке зрения. Максимальную толерантность к физической нагрузке по результатам теста 6-минутной ходьбы на всех этапах наблюдения продемонстрировали пациенты группы 3 (табл. 2). В сравнении с результатами теста при выписке из стационара отмечено достоверное увеличение пройденной дистанции во всех анализируемых группах, кроме больных группы 2Б. Пациенты этой группы через 6 мес после ИМ имели наихудшие показатели теста, причем в сравнении с больными групп 1 и 3 различия достигали статистической значимости.

Большой интерес вызывают вопросы терапии сопутствующей депрессии у пациентов с ИМ в связи с возможным положительным ее влиянием на течение постинфарктного периода и прогноз [16,17]. В ряде работ показана безопасность и хорошая переносимость применения современных антидепрессантов (из группы селективных ингибиторов обратного захвата серотонина, а также тианептина) у пациентов с ИБС [18, 19]. Медикаментозная терапия депрессии, сопутствующей ИБС, в ряде исследований сопровождалась не только улучшением психического состояния пациентов, но и улучшением их соматических показателей. Так, по данным Г.В.Погосовой и соавт. [20], терапия депрессии при ИБС тианептином (Коаксил) приводит к уменьшению выраженности кардиалгического синдрома и повышению толерантности к физической нагрузке.
Как уже показано, в нашем исследовании проведение антидепрессивной терапии тианептином уменьшало тяжесть и частоту приступов стенокардии напряжения в постинфарктном периоде, увеличивало толерантность к физической нагрузке. Была выявлена тенденция к замедлению постинфарктного ремоделирования ЛЖ на фоне терапии антидепрессантом, что через 6 мес после ИМ проявлялось в меньшем нарастании показателей систолического и диастолического МС, линейных размеров ЛЖ и относительно большем ИОТС ЛЖ в сравнении с пациентами с депрессией, не получавшими тианептин. Это подтверждает ранее полученные данные о позитивном влиянии терапии антидепрессантами на процессы ремоделирования ЛЖ сердца, полученные в работе Е.А.Нестеровой и соавт. при исследовании пациентов с артериальной гипертензией [10]. Кроме того, в нашем исследовании, как и в работе М.Е.Стаценко и соавт. [21], у пациентов, прошедших курс терапии тианептином, был выявлен более выраженный прирост ФВ ЛЖ через 6 мес после ИМ, чем у пациентов, отказавшихся от антидепрессивной терапии, хотя различия не достигли статистической значимости.
Одной из особенностей исследования являлась оценка влияния на течение ИМ не только очерченных тревожно-депрессивных расстройств, но и так называемых РА. В доступной литературе было найдено только две работы, оценивавшие сходных пациентов2. В исследовании D.Bush и соавт. установлено, что наличие даже минимальных симптомов депрессии увеличивает риск смерти пациентов старше 65 лет после острого ИМ [22]. В работе M.Horsten и соавт. [23] наличие всего только 2 симптомов депрессии у пациенток после острого коронарного синдрома повышало риск возникновения повторного ИМ и увеличивало вероятность сердечно-сосудистой смертности в течение последующих 5 лет в 1,9 раза (95% доверительный интервал – ДИ 1,02–3,6; p=0,02). Данных о влиянии сопутствующих расстройств адаптации на клинико-функциональные особенности течения ИМ у таких пациентов не обнаружено.
По результатам проведенного исследования, распространенность РА у пациентов с ИМ составила 13,9%. В процессе 6-месячного наблюдения не отмечено достоверных различий в течении острого периода ИМ и постинфарктного периода у пациентов с сопутствующими расстройствами адаптации и без аффективных расстройств ни по клиническим данным, ни по данным проведенного инструментального обследования, за исключением тенденции к более высокой толерантности к физической нагрузке у этих больных.
Выводы
В ряде исследований изучено влияние сопутствующих тревожно-депрессивных расстройств на клиническое течение ИМ, функциональное состояние пациентов и качество их жизни, прогноз заболевания, однако опубликованные результаты весьма противоречивы [5–7]. Между тем получены данные о том, что избыточная активация симпатоадреналовой системы, нередко выявляемая у пациентов с аффективной патологией, может приводить к тяжелой обратимой сократительной дисфункции левого желудочка (ЛЖ) даже у пациентов без ИБС [8]. В сочетании с нарушениями процессов нормального восстановления, наблюдающимися при депрессии [9], это может обусловливать неблагоприятное течение постинфарктного ремоделирования ЛЖ, однако исследования по данному вопросу в литературе не описаны. Вместе с тем есть основание полагать, что современные антидепрессанты, влияя на активность симпатоадреналовой и серотониновой систем, могут замедлять процессы ремоделирования ЛЖ и благоприятно влиять на течение основного заболевания [10], однако эти данные требуют уточнения.
В связи с изложенным целью настоящей работы было изучение динамики клинико-функционального состояния и параметров ремоделирования ЛЖ у пациентов с острым ИМ в зависимости от наличия и выраженности сопутствующих аффективных расстройств, а также проводимой в дополнение к стандартному лечению ИМ терапии тианептином (антидепрессант из группы селективных стимуляторов обратного захвата серотонина).
Материалы и методы
Изученная выборка сформирована на основе следующих критериев включения:
• наличие «острого» (в пределах 3 сут с момента развития) Q-позитивного ИМ;Критерии исключения:
• информированное согласие пациента на участие в исследовании.
• возраст старше 75 лет;В исследование включены 108 пациентов, в том числе 71 (65,7%) мужчина и 37 (34,3%) женщин. Средний возраст пациентов составил 58,9±9,3 года. ИМ был первичным у 93 (86,1%) больных, повторным – у 15 (13,9%). По локализации поражения у 55 (50,9%) пациентов имелся передний, а 53 (49,1%) – нижний ИМ.
• тяжелая сопутствующая соматическая патология, значимо влияющая на качество жизни пациентов;
• постоянная или часто рецидивирующая фибрилляция предсердий;
• когнитивные нарушения, ограничивающие адекватный контакт с пациентом;
• предшествующая (в пределах 4 нед) терапия психотропными препаратами;
• наличие хронической алкогольной интоксикации.
Диагноз настоящего ИМ верифицировали на основании критериев Всероссийского научного общества кардиологов (2007 г.). На 2-е–3-и сутки острого ИМ всем больным проводили общеклиническое и электрокардиографическое (ЭКГ) обследование. Повторное клинико-функциональное обследование проводилось перед выпиской из стационара (19–21-е сутки острого ИМ), через 2 и 6 мес с момента развития ИМ и включало измерение частоты сердечных сокращений (ЧСС) и артериального давления (АД) в положении сидя после 5-минутного отдыха, ЭКГ, оценку функционального класса (ФК) стенокардии (согласно классификации Канадской ассоциации кардиологов, 1976), учет числа приступов стенокардии в неделю, степени выраженности и стадии хронической сердечной недостаточности (ХСН) (согласно классификации ОССН1, 2006).
Всем больным на 3-и–5-е сутки острого ИМ и через 6 мес проводили двухмерную эхокардиографию (ЭхоКГ) на ультразвуковой диагностической системе Sonos-5500 фирмы «Hewlett-Packard» (США). Определяли конечно-диастолический (КДР) и конечно-систолический (КСР) размеры ЛЖ, толщину межжелудочковой перегородки (ТМЖП) и задней стенки (ТЗС) в конце диастолы. Методом «дисков» по Simpson определяли конечно-диастолический (КДО), конечно-систолический (КСО), ударный (УО) объемы и фракцию выброса (ФВ) ЛЖ. Полученные объемы индексировали по отношению к площади поверхности тела пациента. Вычисляли сердечный индекс (СИ), систолический и диастолический миокардиальный стресс (МС), индекс относительной толщины стенок (ИОТС) ЛЖ, индекс сферичности (ИС) в систолу и диастолу. Диастолическую функцию ЛЖ оценивали с помощью допплер-ЭхоКГ трансмитрального кровотока и кровотока в легочных венах. Диастолическую функцию ЛЖ не оценивали при наличии у пациента митральной регургитации более I степени.
Толерантность к физической нагрузке и ФК ХСН пациентов перед выпиской из стационара и через 6 мес после ИМ определяли по данным теста 6-минутной ходьбы. Тест проводили с учетом рекомендаций Американского торакального общества (ATS, 2002).
Для выявления и оценки выраженности расстройств аффективного спектра на 4–5-й день острого ИМ всем пациентам проводили психопатологическое обследование психиатром с использованием критериев МКБ-10, шкал тревоги и депрессии Hamilton. По результатам обследования выделены две группы пациентов с сопутствующими расстройствами аффективного спектра: с клинически выраженной депрессией и расстройствами адаптации (РА), проявлявшимися депрессивным или тревожным настроением легкой степени выраженности. Повторное психопатологическое обследование проводили через 2 и 6 мес c момента развития острого ИМ.
Всем больным при включении в исследование и отсутствии противопоказаний назначали базисную терапию b-блокаторами, ингибиторами ангиотензинпревращающего фермента, аспирином и статинами. При необходимости присоединяли антиангинальную терапию нитропрепаратами, объем которой учитывали отдельно.
Для коррекции аффективной симптоматики пациентам с установленной депрессией, дополнительно к общепринятой терапии острого ИМ, на 5–7-е сутки назначали антидепрессант тианептин (Коаксил, «Сервье», Франция), однако часть больных отказались от антидепрессанта из-за боязни психиатрической стигматизации или привыкания к препарату.
Начальная доза тианептина составляла 18,75 мг/сут и в течение 3–4 дней при отсутствии побочных явлений доводилась до терапевтической – 37,5 мг/сут. Средняя продолжительность курса лечения препаратом составила 3,9±1,1 мес. С учетом проведенной терапии все включенные в исследование пациенты были разделены на группы: 1 группу составили 64 пациента с острым ИМ без аффективных расстройств (АР), 2A группу – 19 пациентов с острым ИМ и сопутствующей депрессией, согласившихся на терапию Коаксилом, 2Б – 10 пациентов с острым ИМ и сопутствующей депрессией, отказавшихся от применения антидепрессанта, и группу 3 – 15 пациентов с острым ИМ и РА.
Статистическую обработку данных проводили с помощью пакета программ «Statistica 6.0», Statsoft (США). Для описания данных при нормальном распределении использовали среднее значение (m) и стандартное отклонение средней (SD), а в случае отклонения распределения от нормального – медиану (M) и 25–75% интерквартильный интервал. Достоверность различий значений параметров в группах оценивали по t-критерию Стьюдента для зависимых и независимых выборок с учетом поправки Бонферрони при множественных сравнениях. Если вид распределения отличался от нормального, использовали непараметрические критерии Mann–Whitney и Wilcoxon. Различия в показателях между группами считали статистически значимыми при p≤0,05. Парную взаимосвязь двух признаков и более определяли многомерным методом корреляционного анализа Pearson и методом ранговых корреляций по Spearman и считали статистически достоверной при p≤0,05.
Результаты и обсуждение
В остром периоде ИМ клиническое обследование, проведенное психиатром, выявило наличие аффективных расстройств у 44 (40,7%) из 108 пациентов. Использование критериев МКБ-10 позволило выделить следующие диагностические категории: депрессивные эпизоды умеренной и легкой степени выраженности (первичные и в рамках рекуррентного депрессивного расстройства) – у 29 (26,9%) пациентов, РА – у 15 (13,9%) пациентов. Спонтанная немедикаментозная редукция депрессивной симптоматики за 6 мес наблюдения отмечена у 40% пациентов.
На момент включения в исследование между сформированными группами не отмечено статистически значимых различий по возрасту, полу, тяжести и локализации ИМ, длительности и тяжести проявлений предшествующей ИБС и частоте сопутствующих заболеваний.
На стационарном этапе в группе пациентов с сопутствующей депрессией в сравнении с пациентами без аффективных расстройств (АР) достоверно чаще отмечено развитие ранней постинфарктной стенокардии (53,6 и 22,2%, p=0,017). По выраженности проявлений ХСН, наличию других осложнений острого ИМ (нарушения ритма, эпистенокардитический перикардит, острая аневризма ЛЖ) группы статистически не различались.
В целом в процессе наблюдения выявлена тенденция к уменьшению частоты встречаемости стенокардии напряжения высокого ФК у пациентов без АР (6,3; 4,2 и 1,9% при выписке из стационара, через 2 и 6 мес с момента развития ИМ соответственно). У пациентов с сопутствующей депрессией, не получавших антидепрессант, напротив, отмечено ее увеличение (17,9; 27,6 и 40,0% на этапах наблюдения).
При анализе объема терапии через 6 мес с момента развития ИМ отмечено, что пациенты с сопутствующей депрессией достоверно чаще получали нитраты, чем пациенты без АР, что прямо коррелировало с тяжестью течения стенокардии у больных (r=0,63; p<0,001). Влияние коморбидного депрессивного расстройства на интенсивность приступов стенокардии, по-видимому, связано с наблюдаемым при депрессии уменьшением числа нейронов, продуцирующих вазодилататор оксид азота, что сопровождается нарушениями в b-эндорфинергической антиноцицептивной системе и снижением порога болевой чувствительности при приступах ишемии миокарда.
В процессе исследования выявлена тенденция к более тяжелому течению ХСН у пациентов группы 2Б. Через 6 мес после ИМ средний ФК ХСН по NYHA у них составил 1,8±0,8 против 1,4±0,5 в группе 1, 1,5±0,62 в группе 2А и 1,2±0,4 в группе 3, хотя различия и не достигли статистической значимости.
Влияние сопутствующих расстройств аффективного спектра на структурно-геометрические параметры ЛЖ и внутрисердечную гемодинамику при ИМ в литературе отражено крайне скудно и противоречиво. В одних исследованиях [11, 12] не найдено взаимосвязи наличия депрессивных расстройств и величины ФВ ЛЖ при ИМ, в то время как в других [13, 14] депрессия при ИМ ассоциируется со снижением насосной и сократительной функции ЛЖ и чаще выявлялась у пациентов с более низкой ФВ ЛЖ.
Данные ЭхоКГ-исследования пациентов сравниваемых групп нашей выборки представлены в табл. 1. При включении в исследование в группе с сопутствующей депрессией отмечена статистически значимо более низкая ФВ ЛЖ (p=0,004) и величина СИ (p=0,04), чем в группе без АР. Величина ФВ и СИ не отличалась у пациентов без АР и с РА.

Через 6 мес от момента развития ИМ у пациентов группы 2Б выявлено максимальное увеличение КДР ЛЖ, свидетельствующее о прогрессировании процессов ремоделирования ЛЖ, тогда как в группе 2A он имел тенденцию к снижению. Кроме того, лишь в группе 2Б выявлена тенденция к увеличению КСР ЛЖ в динамике в отличие от недостоверного снижения этого показателя в других группах.
ФВ ЛЖ статистически незначимо увеличилась по сравнению с исходной величиной во всех группах, максимально – в группе 2A, в этой же группе недостоверно выросла величина СИ. Статистически значимых межгрупповых различий по линейным и объемным показателям ЛЖ, а также параметрам внутрисердечной гемодинамики через 6 мес после ИМ выявить не удалось.
Максимальное истончение стенок и степень увеличения КДР ЛЖ в группе 2Б нашли отражение в достоверно меньшем ИОТС у этих больных через 6 мес после ИМ в сравнении с пациентами группы 1 (p=0,004). В группах 2A и 3 существенная динамика ИОТС за период наблюдения отсутствовала.
Систолический и диастолический МС, отражающие, соответственно, пост- и преднагрузку на миокард, достоверно увеличились через 6 мес после ИМ во всех группах пациентов, кроме пациентов с РА, у которых тенденция к их увеличению не достигла статистической значимости.
Диастолический МС в сравнении с исходной величиной максимально увеличился в группе 2Б и через 6 мес с момента развития ИМ стал достоверно превышать таковой в группе 1 (p=0,042).
Таким образом, по результатам нашей работы у пациентов с ИМ наличие сопутствующих расстройств депрессивного спектра было связано с достоверно более низкой ФВ ЛЖ и величиной СИ в остром периоде заболевания. У больных депрессией выявлена также тенденция к наибольшей выраженности процессов постинфарктного ремоделирования ЛЖ через 6 мес наблюдения, что проявлялось в достоверно меньшем ИОТС и большем показателе диастолического МС, а также тенденцией к максимальному увеличению показателей КДР и КСР ЛЖ в сравнении с пациентами без АР.
В доступной литературе не было найдено данных о влиянии сопутствующих расстройств депрессивного спектра на диастолическую функцию ЛЖ у пациентов с ИМ. Нами проведен соответствующий статистический анализ, по результатам которого, однако, достоверного влияния сопутствующих депрессивных расстройств на диастолическую функцию ЛЖ при ИМ не выявлено.
Анализ литературы свидетельствует, что наличие сопутствующей депрессии значительно снижает функциональные возможности пациентов с ИБС, ограничивает их толерантность к физической нагрузке [13, 15]. В работе J.Ickovics и соавт. [6] наличие сопутствующих депрессивных расстройств уступало только наличию ИМ в анамнезе в ряду факторов, ограничивающих повседневную активность пациентов через 1 год после ИМ.
Проведенное нами исследование позволяет присоединиться к этой точке зрения. Максимальную толерантность к физической нагрузке по результатам теста 6-минутной ходьбы на всех этапах наблюдения продемонстрировали пациенты группы 3 (табл. 2). В сравнении с результатами теста при выписке из стационара отмечено достоверное увеличение пройденной дистанции во всех анализируемых группах, кроме больных группы 2Б. Пациенты этой группы через 6 мес после ИМ имели наихудшие показатели теста, причем в сравнении с больными групп 1 и 3 различия достигали статистической значимости.

Большой интерес вызывают вопросы терапии сопутствующей депрессии у пациентов с ИМ в связи с возможным положительным ее влиянием на течение постинфарктного периода и прогноз [16,17]. В ряде работ показана безопасность и хорошая переносимость применения современных антидепрессантов (из группы селективных ингибиторов обратного захвата серотонина, а также тианептина) у пациентов с ИБС [18, 19]. Медикаментозная терапия депрессии, сопутствующей ИБС, в ряде исследований сопровождалась не только улучшением психического состояния пациентов, но и улучшением их соматических показателей. Так, по данным Г.В.Погосовой и соавт. [20], терапия депрессии при ИБС тианептином (Коаксил) приводит к уменьшению выраженности кардиалгического синдрома и повышению толерантности к физической нагрузке.
Как уже показано, в нашем исследовании проведение антидепрессивной терапии тианептином уменьшало тяжесть и частоту приступов стенокардии напряжения в постинфарктном периоде, увеличивало толерантность к физической нагрузке. Была выявлена тенденция к замедлению постинфарктного ремоделирования ЛЖ на фоне терапии антидепрессантом, что через 6 мес после ИМ проявлялось в меньшем нарастании показателей систолического и диастолического МС, линейных размеров ЛЖ и относительно большем ИОТС ЛЖ в сравнении с пациентами с депрессией, не получавшими тианептин. Это подтверждает ранее полученные данные о позитивном влиянии терапии антидепрессантами на процессы ремоделирования ЛЖ сердца, полученные в работе Е.А.Нестеровой и соавт. при исследовании пациентов с артериальной гипертензией [10]. Кроме того, в нашем исследовании, как и в работе М.Е.Стаценко и соавт. [21], у пациентов, прошедших курс терапии тианептином, был выявлен более выраженный прирост ФВ ЛЖ через 6 мес после ИМ, чем у пациентов, отказавшихся от антидепрессивной терапии, хотя различия не достигли статистической значимости.
Одной из особенностей исследования являлась оценка влияния на течение ИМ не только очерченных тревожно-депрессивных расстройств, но и так называемых РА. В доступной литературе было найдено только две работы, оценивавшие сходных пациентов2. В исследовании D.Bush и соавт. установлено, что наличие даже минимальных симптомов депрессии увеличивает риск смерти пациентов старше 65 лет после острого ИМ [22]. В работе M.Horsten и соавт. [23] наличие всего только 2 симптомов депрессии у пациенток после острого коронарного синдрома повышало риск возникновения повторного ИМ и увеличивало вероятность сердечно-сосудистой смертности в течение последующих 5 лет в 1,9 раза (95% доверительный интервал – ДИ 1,02–3,6; p=0,02). Данных о влиянии сопутствующих расстройств адаптации на клинико-функциональные особенности течения ИМ у таких пациентов не обнаружено.
По результатам проведенного исследования, распространенность РА у пациентов с ИМ составила 13,9%. В процессе 6-месячного наблюдения не отмечено достоверных различий в течении острого периода ИМ и постинфарктного периода у пациентов с сопутствующими расстройствами адаптации и без аффективных расстройств ни по клиническим данным, ни по данным проведенного инструментального обследования, за исключением тенденции к более высокой толерантности к физической нагрузке у этих больных.
Выводы
1. Расстройства аффективного спектра при ИМ выявлены в 40,7% случаев, депрессивные расстройства различной степени тяжести – в 26,9% случаев.
2. Наличие депрессивных расстройств при ИМ коррелирует с большей тяжестью и частотой приступов стенокардии в постинфарктном периоде, тенденцией к увеличению выраженности проявлений ХСН и объема проводимой пациентам медикаментозной терапии.
3. У пациентов с ИМ наличие расстройств депрессивного спектра ассоциируется со снижением ФВ ЛЖ и величины СИ в остром периоде заболевания, а также достоверно меньшим ИОТС ЛЖ, большим диастолическим МС и тенденцией к максимальному увеличению показателей КДР и КСР ЛЖ через 6 мес наблюдения.
4. Через 6 мес после развития ИМ пациенты с депрессивными расстройствами имеют достоверно худшую толерантность к физической нагрузке, по данным теста 6-минутной ходьбы, в сравнении с пациентами без АР.
5. У пациентов с ИМ терапия антидепрессантом тианептином (Коаксил) улучшает клиническое течение постинфарктного периода и повышает толерантность к физической нагрузке. На фоне терапии тианептином выявлена тенденция к замедлению постинфарктного ремоделирования ЛЖ.


