Психиатрия Всемирная психиатрия
Психиатрия Всемирная психиатрия
№02 2019
Изучение независимых и сопряженных эффектов молекулярной генетической предрасположенности и средовых воздействий при шизофрении: результаты исследования EUGEI №02 2019
Номера страниц в выпуске:178-188
Шизофрения в настоящее время представляется комплексным наследуемым фенотипом. С одной стороны, он ассоциирован с генетической предиспозицией, при этом вклад каждой из многочисленных и распространенных вариаций по отдельности невелик. С другой стороны, существует множество значимых средовых воздействий. Близнецовые и семейные исследования, которые ранее использовались в качестве замены прямых методов выявления генетического риска, позволяют предположить взаимодействие генетических и средовых факторов в этиологии шизофрении, но молекулярно-генетические данные достаточно скудны. Данный материал также раскрывает тему взаимодействия генетических и средовых факторов в генезе шизофрении: в нем проанализированы основные и сочетанные ассоциации уровня полигенного риска шизофрении (PRS-SCZ) и средовых воздействий у 1699 пациентов с диагнозом расстройств шизофренического спектра и 1542 представителей контрольной группы без соответствующих расстройств в анамнезе. Выявлена суммация эффекта состояния молекулярно-генетического риска шизофрении (бинарная модель PRS-SCZ более 75% от контрольного распределения) и такими внешними факторами, как регулярное употребление каннабиса на протяжении жизни и подверженность негативному воздействию в раннем возрасте (сексуальное и эмоциональное насилие, эмоциональная депривация, травля), но не выявлено взаимодействия с такими факторами, как нарушение слуха, время года, на которое приходится дата рождения, а также подверженность физическому насилию и депривации физических потребностей в детстве. Анализ чувствительности, в котором изначально выбранный уровень PRS-SCZ в 75% был заменен на более низкие уровни (25 и 50%) подтвердил выявленные взаимоотношения факторов. Наши результаты позволяют предположить, что в этиопатогенезе шизофрении играет роль генетическая предрасположенность, которая повышает чувствительность индивида к средовым воздействиям.
Ключевые слова: шизофрения, психоз, генетика, среда, взаимодействие генов и среды, полигенный риск, детская травма, каннабис, травля.
Ключевые слова: шизофрения, психоз, генетика, среда, взаимодействие генов и среды, полигенный риск, детская травма, каннабис, травля.
Перевод: Шишковская Т.И. (Москва)
Редактура: к.м.н. Федотов И.А. (Рязань)
Guloksuz S et al. Examining the independent and joint effects of molecular genetic liability and environmental exposures in schizophrenia: results from the EUGEI study. World Psychiatry 2019;18(2):173-182.
Шизофрения в настоящее время представляется комплексным наследуемым фенотипом. С одной стороны, он ассоциирован с генетической предиспозицией, при этом вклад каждой из многочисленных и распространенных вариаций по отдельности невелик. С другой стороны, существует множество значимых средовых воздействий. Близнецовые и семейные исследования, которые ранее использовались в качестве замены прямых методов выявления генетического риска, позволяют предположить взаимодействие генетических и средовых факторов в этиологии шизофрении, но молекулярно-генетические данные достаточно скудны. Данный материал также раскрывает тему взаимодействия генетических и средовых факторов в генезе шизофрении: в нем проанализированы основные и сочетанные ассоциации уровня полигенного риска шизофрении (PRS-SCZ) и средовых воздействий у 1699 пациентов с диагнозом расстройств шизофренического спектра и 1542 представителей контрольной группы без соответствующих расстройств в анамнезе. Выявлена суммация эффекта состояния молекулярно-генетического риска шизофрении (бинарная модель PRS-SCZ более 75% от контрольного распределения) и такими внешними факторами, как регулярное употребление каннабиса на протяжении жизни и подверженность негативному воздействию в раннем возрасте (сексуальное и эмоциональное насилие, эмоциональная депривация, травля), но не выявлено взаимодействия с такими факторами, как нарушение слуха, время года, на которое приходится дата рождения, а также подверженность физическому насилию и депривации физических потребностей в детстве. Анализ чувствительности, в котором изначально выбранный уровень PRS-SCZ в 75% был заменен на более низкие уровни (25 и 50%) подтвердил выявленные взаимоотношения факторов. Наши результаты позволяют предположить, что в этиопатогенезе шизофрении играет роль генетическая предрасположенность, которая повышает чувствительность индивида к средовым воздействиям.
Ключевые слова: шизофрения, психоз, генетика, среда, взаимодействие генов и среды, полигенный риск, детская травма, каннабис, травля.
Шизофрения – комплексный фенотип, который характеризуется искаженным восприятием реальности, когнитивной дисфункцией и негативной симптоматикой. Хотя распространенность расстройств шизофренического спектра невысока – 0,47% для шизофрении (состояний с наименее благоприятным исходом) и 3% для других диагнозов, относящихся к группе психотических расстройств1, – они ассоциированы со значительным ущербом в личностном, социальном и экономическом аспектах. На шизофрению приходится 218 лет жизни, скорректированных по нетрудоспособности (DALY) из 100 0002, таким образом, шизофрения занимает по этому показателю пятое место в возрастной группе от 15 до 44. Таким образом, медицина остро нуждается в инновационных подходах к профилактике, диагностике и лечению расстройств шизофренического спектра, и добиться этого позволило бы понимание их этиологии и патогенеза.
За десятилетия работы над этой проблемой неоднократно было показано, что наследуемость этих расстройств достаточно высока, соответственно, в их развитии играет роль генетическая предрасположенность3,4. Последние данные датского национального регистра согласуются с самыми первыми семейными исследованиями шизофрении, оценивают наследуемость для расстройств шизофренического спектра в 73%, а для самой шизофрении – в 79%5.
На этих фактах из области количественной генетической эпидемиологии основан нынешний интерес к молекулярной генетике – среди изучающих расстройства шизофренического спектра эта область наиболее популярна. Доступность технологий, с одной стороны, недорогих и простых в применении, с другой – высокопроизводительных, подняла на новый уровень разрешающую способность генетических исследований. С целью объединить усилия по выявлению генов с малым размером эффекта в проектах по полногеномному поиску ассоциаций (GWA) был создан Консорциум по психиатрической геномике6. Рабочая группа по шизофрении в рамках этого консорциума идентифицировала 108 значимых локусов7, и количество возможных генетических вариаций возрастает пропорционально размеру выборки8. Как и предполагала полувековой давности полигенная теория шизофрении9, GWA обнаружил, что значительная доля генетического риска обусловлена вариациями многочисленных генов, широко распространенных в популяции, но обладающих очень небольшим размером эффекта.
Тем не менее, обнаруженная в ходе GWA генетическая предрасположенность вследствие однонуклеотидных полиморфизмов (SNP) объясняет лишь небольшую часть данных по наследуемости шизофрении, полученных в близнецовых исследованиях. Иными словами, существует своего рода «разрыв в наследуемости» между данными близнецовых и молекулярно-генетических исследований10. Наиболее вероятным объяснением этого разрыва является тот факт, что для изучаемых пар близнецов сходны не только генетические, но и многие средовые факторы, поскольку чаще всего они растут в одной семье10. В то же время этиология психотических расстройств, вероятно, состоит в генетической предрасположенности, которая повышает чувствительность индивида к средовым воздействиям или увеличивает его склонность подвергаться таким воздействиям11.
Наряду с расширением наших познаний в области генетики при исследовании средовых воздействий в генезе шизофрении также получены интересные результаты. Наблюдение выявило различные внешние факторы, ассоциированные с расстройствами психотического регистра, – все они демонстрируют разные уровни доказательности и размер эффекта. К таким внешним факторам относятся употребление каннабиса, детские травмы (например, сексуальное насилие, эмоциональная депривация), травля (буллинг), городская среда, условия, располагающие к отгороженности от общества (например, принадлежность к этническим меньшинствам, мигрантам или нарушение слуха), время года, на которое приходится дата рождения, осложнения беременности и родов12,13.
Таким образом, эмпирические исследования, опирающиеся на суррогатные показатели генетического риска (такие как семейный анамнез шизофрении), представляются в настоящий момент спорными из-за возможного вклада среды в получаемые результаты11, но интересной задачей видится перевод этих исследований в плоскость молекулярно-генетического анализа14.
Использование такого показателя, как уровень полигенного риска (PRS), для определения риска по данным молекулярной генетики значительно расширило возможности исследователей в определении ассоциированных фенотипов и выявлении взаимодействия генетических и средовых факторов. В настоящее время уровень полигенного риска шизофрении (PRS-SCZ) для определенного индивида определяется так: логарифмы отношения шансов для каждого SNP умножаются на количество аллелей, ассоциированных с риском, в интересующем локусе, и полученные результаты складываются15. PRS-SCZ на данный момент объясняет 7% на шкале предрасположенности к шизофрении, по крайней мере у пациентов с хроническими формами и в случае использования последней версии Консорциума по психиатрической геномике7.
В недавнем материале мы обсуждали трудности, с которыми сталкивается исследователь при оценке вклада средовых факторов в психиатрии, и пришли к выводу о необходимости системного подхода, который охватывал бы популяцию, подвергающуюся какому-либо фактору, в целом, – это позволит разграничить эффекты, возникающие за счет реактивности индивида и за счет изначально мощного влияния внешнего фактора16. Отталкиваясь от этих результатов, в данной статье мы попытались проанализировать основные и сопряженные ассоциации между средовыми воздействиями и PRS-SCZ в кросс-секционной выборке, созданной специально для исследования по взаимодействию средовых и генетических факторов в происхождении шизофрении.
Исследуемая популяция
В данном исследовании взаимодействия средовых и генетических факторов по типу случай-контроль использовалась информация Рабочей группы 6 (WP6) Европейского отделения Международной сети по изучению взаимодействия генетических и средовых факторов при шизофрении (EUGEI), а также исследования Генетический риск и исход при психозах (GROUP) в рамках EUGEI18. Данные были собраны в промежутке между 2010 и 2015 годом в Нидерландах, Турции, Испании и Сербии.
Диагноз расстройства шизофренического спектра выставлялся по критериям DSM-IV-TR (средняя длительность заболевания после первого контакта с психиатрической службой = 9,9 года). В дальнейшем диагноз верифицировался с использованием Списка операциональных критериев для психотических и аффективных заболеваний19 в случае EUGEI WP6 и Перечня для клинической оценки в нейропсихиатрии20 или комплексной оценки симптомов и анамнеза21 в случае GROUP. Члены контрольной группы, не имеющие психотических расстройств в анамнезе, набирались из той же популяции, что и исследуемая группа, но родственники пациентов исследуемой группы были исключены. Критериями исключения для любой группы были диагноз психотического расстройства в связи с иными медицинскими проблемами, травма головы с потерей сознания в анамнезе, IQ < 70.
Всего в исследование были включены 1866 пациентов и 1583 здоровых участника, для которых имелись данные по исследованию генотипа. Поскольку в отношении индивидов, не относящихся к белой европеоидной расе, предсказательная сила PRS-SCZ не оценивалась22, в данном исследовании участвовали только ее представители. Окончательный размер выборки составил 1699 пациентов и 1542 члена группы контроля.
Все проекты были одобрены медицинскими этическими комитетами стран-участников и проводились в соответствии с Хельсинкской Декларацией. Все респонденты предоставили информированное согласие в письменном виде. В случае участников младше 18 лет информированное согласие подписывали родителями, от самих участников также было получено разрешение.
Для достижения высокого качества и однородности оценки внешних факторов, клинической и экспериментальной использовались стандартизированные инструменты, а применявшие их психиатры, психологи и научные ассистенты, которые прошли обязательное обучение как очно, так и в виде тренировочных модулей в режиме онлайн, включая интерактивные видеоинтервью и опросники для самооценки17,18. Чтобы добиться высокой межрейтерсковой надежности на всем протяжении исследования, и очные, и заочные тренировочные сессии проводились ежегодно.
Подверженность неблагоприятному влиянию в детском возрасте оценивалась с помощью Краткой формы опросника по детской травме (CTQ)23. Он состоит из 28 вопросов, оцениваемых по 5-балльной шкале Ликерта, оцениваются 5 доменов жестокого обращения с ребенком: эмоциональная и физическая депривация, эмоциональное, физическое и сексуальное насилие. В полной мере были изучены психометрические характеристики переводных версий CTQ (на испанском, турецком, голландском и сербском языках)24,26. Для формализации каждого из доменов жестокого обращения (0=отсутствовало или 1=присутствовало), как и в прежних работах EUGEI, мы пользовались следующими пороговыми значениями: ≥9 для эмоционального насилия, ≥8 для физического насилия, ≥6 для сексуального насилия, ≥10 для эмоциональной депривации и ≥8 для физической депривации.
Употребление каннабиса оценивали с помощью модифицированной версии Опросника об опыте употребления каннабиса28 в исследовании EUGEI WP6 (0=нет, 1=один или два раза, 2=несколько раз в год, 3=несколько раз в месяц, 4=один или более раз в неделю, 5=каждый день) и с помощью секции L Комплексного международного диагностического интервью (CIDI)29 в исследовании GROUP (0=нет, 1=реже, чем раз в неделю, 2=еженедельно, 3=ежедневно). Как и в прежних работах30-32, для создания бинарной модели в отношении регулярного употребления каннабиса в качестве порогового значения использовалась частота один или более раз в неделю в период наиболее частого употребления на протяжении жизни.
При исследовании связи между временем года, на которое приходится дата рождения, и шизофренией за период высокого риска традиционно были приняты месяцы зимнего солнцестояния (декабрь-март), на чем базировалась и бинарная модель.
Нарушение слуха определяли на основании самоотчета об ухудшении слуха за последние 12 месяцев (0=отсутствовало или 1=присутствовало).
История травли со стороны ровесников (с проявлениями эмоционального, психологического и физического насилия) до 17 лет оценивалась с помощью краткой версии Ретроспективного опросника для оценки травли (буллинга) (RBQ)34,35, который оценивает тяжесть пережитого опыта травли: 0=нет, 1=малая (не было физических повреждений), 2=умеренная (легкие повреждения и преходящие эмоциональные реакции), 3=выраженная (частый и тяжелый физиологический и психологический вред). Подверженность травле в детском возрасте была приведена к бинарной модели с использованием ≥1 в качестве порогового значения: 0 – отсутствовала, ≥1 – присутствовала.
Анализ качества проводился в программе PLINK v1.0736 или с использованием специально разработанных Perl- скриптов. Варианты с call rate (доля интересующих генотипов среди всех возможных) <98% исключались из объема данных. Показатель р в отношении Харди–Вайнберга подсчитывался отдельно для турецкой, южноевропейской и североевропейской популяций. Варианты, для которых p составил <1e-6, в каждом из трех регионов были исключены из исследования. После контроля качества в исследовании осталось 559 505 вариантов.
Образцы с call rate <98% исключались из общего объема данных. Набор вариантов, в котором излишняя детализация ликвидировалась методом прунинга по признаку неравновесного сцепления генов (linkage disequilibrium, LD), был обработан с помощью команды – indep-pairwise в PLINK (максимальный показатель r2=0,25, размер окна 500 SNP, размер шага окна – 50 SNP) и использовался для дальнейшего анализа. Показатель гомозиготности F был подсчитан с помощью команды – het в PLINK, и образцы, для которых значения оказались за рамками выделенного интервала (F<–0,11 или F>0,15), были исключены. Генетический пол в образцах определялся по данным Х-хромосомы с помощью команды – check-sex в PLINK, образцы, у которых генетический пол отличался от внесенного в базу данных, были исключены из исследования.
Также в PLINK для образов рассчитывались индексы идентичности по происхождению. Образцы, для которых в выборке обнаруживался один или более генотипически родственный, но при этом генотипически не являющийся сиблингом (определялось по PI-HAT >0,35 и <0,65), исключались из исследования. После этого образцы, для которых в базе данных обнаруживалось 2 или более сиблингов, не подтвержденных генотипическим родством, также исключались.
Визуально оценив результаты кластеринга ошибок, допущенных при использовании чипа для генотипирования, мы приняли решение исключить чипы с высоким процентом ошибок. Были исключены все оставшиеся образцы с чипов, где из-за высокой гетерозиготности или call rate ранее исключались более 5 образцов (из 12 возможных). Также исключались все образцы с чипов, где 4 или более образца были исключены из-за вопросов с определением генетического пола и родства, за исключением случаев, когда при перепроверке на другом чипе их результат был подтвержден.
Первичные компоненты анализа проводились в PLINK с использованием вариантов, прореженных по признаку неравновесных связей, при взаимодействии с базой Thousand Genomes. Так как выборка и соответствующие ей варианты анализа являлись, в сущности, межпопуляционными, на этом этапе исключения образцов не проводилось. Популяционные эффекты были впоследствии скорректированы в процессе индивидуального анализа.
После контроля качества результаты были загружены в программу для статистического предсказания – Michigan Imputation Server с применением панели Консорциума по гаплотипам (весрия 1.1), а также программ Eagle для фазирования по гаплотипу и Minimac3 для предсказания37,38. После этого для дальнейшего участия в исследовании отобрали варианты с достоверностью предсказания r2>0,6, минимальной частотой аллелей (MAF) >0,1% и call rate >99% (8 277 535 вариантов). Генотипы «наилучшего совпадения» создавались в PLINK методом вероятностной генерации генотипов.
PRS-SCZ создавался на основе обобщенной статистики по данным полногеномного поиска ассоциаций в рамках Консорциума по психиатрической геномике, при этом образцы, представленные в базе исследования GROUP, исключались7. Группировка проводилась в PLINK среди генотипов «наилучшего совпадения» отдельно для каждого набора данных (максимальный r2=0,2, размер окна=500 kb, минимальный MAF=10%, уровень минимальной информации по загрузке=0,7). Вариации внутри протяженного региона неравновесного сцепления генов (включая главный комплекс гистосовместимости) были исключены39. PRS-SCZ рассчитывался на основе генотипов «наилучшего совпадения» в программе PLINK при десяти разных пороговых значениях p (1, 0,5, 0,3, 0,2, 0,1, 0,05, 0,01, 1×10–4, 1×10–6, 5×10–8). Как и в предшествующих исследованиях по данной тематике40-43, для первичного анализа мы использовали показатель p=0,05, поскольку он объясняет большинство фенотипических вариаций при анализе данных Консорциума по психиатрической гено-мике7.
Чтобы впоследствии сравнить оценки, полученные в нашей выборке, с объемом вариаций, которые объясняет PRS-SCZ, по данным прежних исследований, применялась модель логистической регрессии, которая позволяет выявить ассоциацию PRS-SCZ с отдельными исследованиями по типу случай-контроль (скорректированные для ситуаций, когда в исследовании участвовали родственники, с использованием первых десяти основных компонентов), при этом рассчитывали R2 Нагелькерке. PRS-SCZ значимо отличался в исследуемой группе и группе контроля (отношение шансов, ОШ=1,30; 95% ДИ: 1,25-1,34; p<0,001; R2 Нагелькерке=0,15), в том числе при сопоставлении по возрасту, полу и стране (ОШ=1,30; 95% ДИ: 1,26-1,35; p<0,001; R2 Нагелькерке=0,20). Дихотомизация PRS-SCZ проводилась с использованием пограничных значений квартилей, которые в свою очередь определялись на основании контрольного распределения PRS-SCZ в разных странах (чтобы учесть этнические вариации, которые могут приводить к различиям PRS-SCZ между ними). Наивысший квартиль (PRS-SCZ>75% контрольной группы) был принят за пороговое значение для состояния высокого риска шизофрении (в дальнейшем PRS-SCZ75).
Для выявления сопряженных эффектов внешних воздействий и генетического риска мы ввели в многоуровневую модель логистической регрессии в качестве независимых переменных четыре состояния, обусловленных сочетанием определенного вида воздействия и PRS-SCZ (три их них – фиктивные переменные, в которых генетический риск отсутствовал, для сравнения), а в качестве зависимых – характеристики клинической картины.
Отклонение от аддитивности проверяли с использованием коэффициента контрастности взаимодействия; другое название этого показателя – относительный избыточный риск вследствие взаимодействия (RERI). RERI – стандартный показатель взаимодействия на аддитивной шкале для исследований по типу случай-контроль48. Он рассчитывается по формуле (OШexposure&PRS-SCZ75 − OШexposure − OШPRS-SCZ75 +1)49. RERI выше нуля расценивается как положительное отклонение от аддитивности и считается значимым, если 95% ДИ отличается от нуля. Для каждой модели RERI рассчитывался дельта-методом на основе полученных в них ОШ.
Для определения чувствительности использовался альтернативный пошаговый перцентильный метод50 (N=1000 шагов) – с его помощью определяли 95% ДИ для RERI. Все модели приводили к равновесному распределению по предсуществующим ковариатам (пол и возраст), в то время как модели, включающие PRS-SCZ75, дополнительно корректировались по показателям родства с использованием первых десяти основных компонентов, в соответствии с общими рекомендациями. Согласно приложению к Руководству по усовершенствованию отчетов по наблюдательным исследованиям в эпидемиологии (STROBE)48, отчет об анализе взаимодействий строился на единственной категории отношения, включающей независимые и сопряженные эффекты PRS-SCZ75, а также все обозначенные эффекты совместно с PRS-SCZ75.
Все процедуры анализа проводились также для данных, полученных методом статистического предсказания, учитывая, что при оценке внешних воздействий непосредственное наблюдение не проводилось. Исходя из предположения о случайном распределении отсутствующих данных, мы применяли цепную равновесную модель множественных предсказаний51 с 20 предсказанными вариантами в пределах ранее определенных значений (относительная эффективность варьировалась между 97 и 99%). Предсказанные данные не отличались от выявленных в изначальной выборке. Дальнейшие процедуры анализа выполнялись на основе предсказанных данных, полученные оценки объединялись по правилам Рубина52.
С целью оценить устойчивость обнаруженных закономерностей к ошибкам (robustness) проводился анализ чувствительности пороговых значений бинарного генетического риска с использованием порога в 25 и 50% контрольной группы. Номинальная значимость порога составила р=0,05.
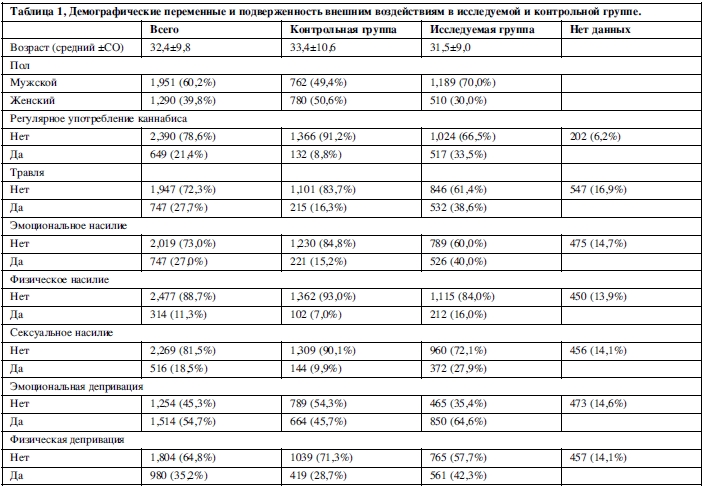
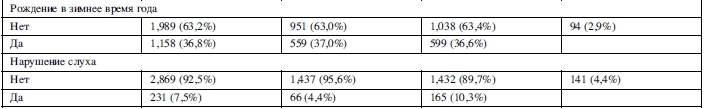
Данные по полу, возрасту и подверженности неблагоприятным воздействиям представлены в таблице 1.
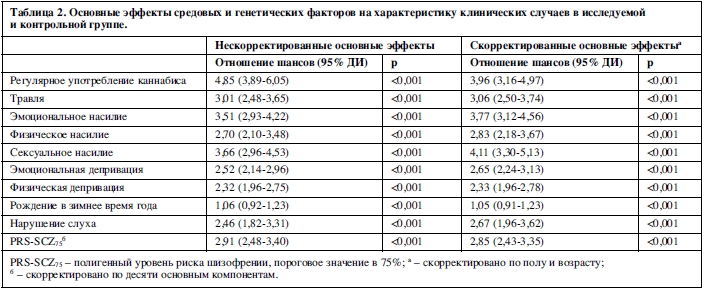
Для всех видов воздействия, кроме рождения зимой, были обнаружены ассоциации с характеристиками клинической картины, в том числе после коррекции по полу и возрасту. В таблице 2 представлены скорректированные и нескорректированные ОШ для PRS-SCZ75 и каждой разновидности внешних воздействий, ассоциированной с характеристиками клинической картины.
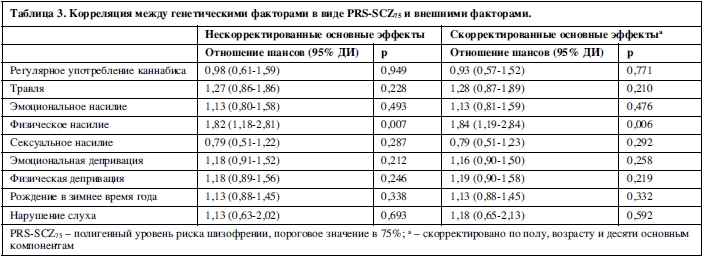
Данных за корреляцию между средовыми и генетическими воздействиями не было обнаружено ни в одном сочетании, кроме физического насилия, поскольку PRS-SCZ75 не был выраженно и значимо ассоциирован с подверженностью остальным видам воздействия в контрольной группе (таблица 3). Напротив, физическое насилие было ассоциировано с PRS-SCZ75 (скорректированное ОШ=1,84; 95% ДИ: 1,19-2,84; p=0,006).
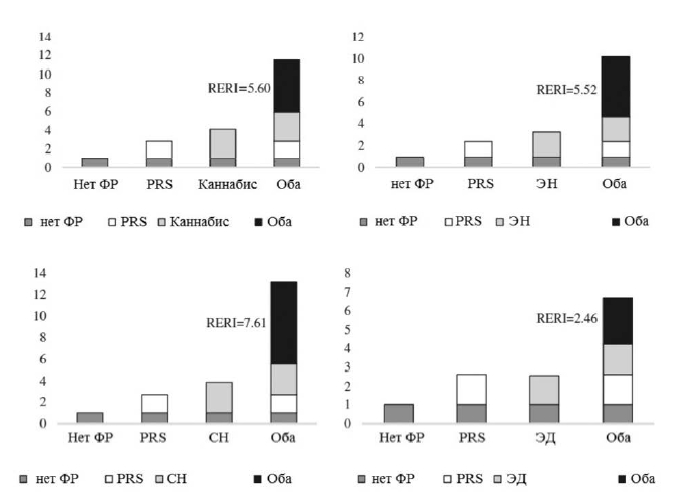
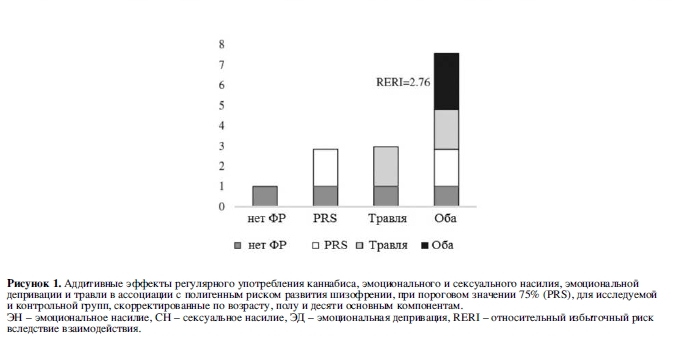
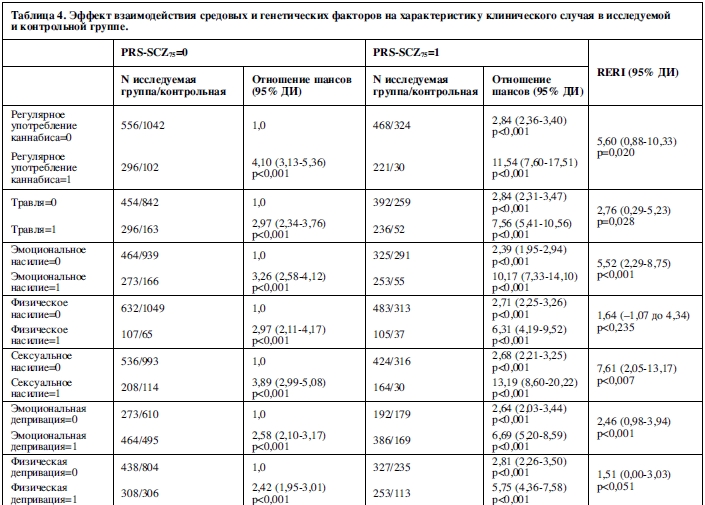
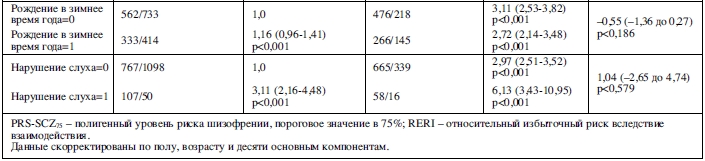
В таблице 4 отражен совместный эффект PRS-SCZ75 и внешнего фактора на характеристику клинического случая. Получены данные за взаимодополняющее действие в формировании заболевания между PRS-SCZ75 и регулярным употреблением каннабиса (RERI=5,60; 95% ДИ: 0,88-10,33; p=0,020), травлей в детском возрасте (RERI=2,76; 95% ДИ: 0,29-5,23; p=0,028), эмоциональным насилием (RERI=5,52; 95% ДИ: 2,29-8,75; p<0,001), сексуальным насилием (RERI=7,61; 95% ДИ: 2,05-13,17; p=0,007) и эмоциональной депривацией (RERI=2,46; 95% ДИ: 0,98-3,94; p=0,001) соответственно. На рисунке 1 показаны значимые эффекты взаимодействия на шкале аддитивности. Значимых взаимодополняющих эффектов между PRS-SCZ75 и физическим насилием, депривацией физических потребностей и рождением в зимнее время года не было обнаружено.
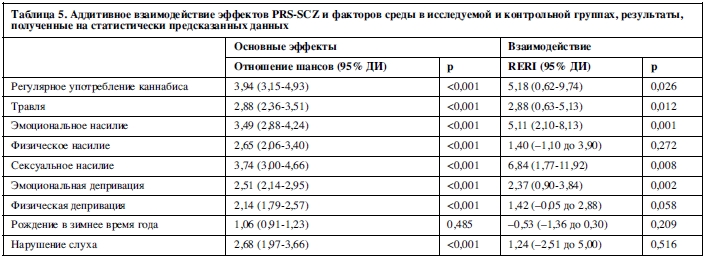
Анализ с использованием альтернативного пошагового перцентильного метода дал схожие результаты (данные не приводятся в статье). Анализ чувствительности, где изначально установленное пороговое значение PRS-SCZ75 в качестве показателя генетического риска заменялось на другие значения PRS-SCZ (25 и 50%) подтвердил, что дополняющее взаимодействие существовало между любого уровня PRS-SCZ и регулярным употреблением каннабиса, травлей в детском возрасте, эмоциональным и сексуальным насилием, эмоциональной депривацией (данные не приводятся в статье). Схожие результаты получены в анализе с использованием статистически предсказанных данных (таблица 5).
В данном исследовании, посвященном независимым и сопряженным эффектам средовых воздействий и генетической предрасположенности к заболеваниям шизофренического спектра, были получены данные в пользу позитивных дополняющих взаимодействий генетической предрасположенности с такими факторами, как регулярное употребление каннабиса и подверженность неблагоприятным воздействиям в дестком возрасте (сексуальное и эмоциональное насилие, эмоциональная депривация и травля в коллективе).
При современном уровне науки в данной работе нам впервые удалось показать, что чувствительность к неблагоприятным воздействиям в детском возрасте и такому фактору, как употребление каннабиса, модулируется уровнем генетического риска шизофрении (PRS-SCZ75). Иными словами, положительный и взаимодополняющий характер взаимодействия между генетическими и средовыми факторами позволяет говорить об их синергии, то есть эффект, производимый сочетанием генетической предрасположенности и средовых воздействий, больше, чем простая сумма их эффектов по отдельности.
Как было показано и в предшествующих работах, по PRS-SCZ75 исследуемая группа значимо отличается от контрольной, и все средовые факторы демонстрировали ассоциацию с характеристикой клинического случая. Однако взаимное усиление эффектов не было показано при взаимодействии PRS-SCZ75 с такими факторами, как физическое насилие и депривация физических потребностей, нарушение слуха и рождение в зимнее время года.
Доля вариаций, которые объясняет PRS-SCZ75 в нашей выборке, была сравнима с результатами прошлых исследований53 и последними данными Консорциума по психиатрической геномике7. В данном исследовании мы строго придерживались ранее введенных определений внешнего воздействия, чтобы повысить воспроизводимость и создать возможности для сравнения результатов. В соответствии с ранее полученными результатами в нашей работе одномерный анализ показал, что степень ассоциации внешних воздействий с характеристикой клинического случая варьировалась, но в целом не отличалась от результатов метаанализа12,13.
Пользуясь преимуществами непосредственного молекулярного подхода к определению генетического риска, мы предоставили очередные доводы в пользу гипотезы о взаимодействии средовых и генетических факторов в формировании расстройств шизофренического спектра – ранее это предположение основывалось лишь на непрямых оценках генетической предрасположенности по данным семейных исследований (близнецов, родственников и т.п.)54. Выявленные закономерности подтвердились в исследовании с помощью регрессионных моделей (с использованием разных пороговых значений генетического риска, где PRS-SCZ составлял 25 и 50%), а также при анализе данных, полученных методами статистического предсказания.
ДИ 95% и RERI более двух в случае эмоционального и сексуального насилия предполагают «механистическое» взаимодействие29, т.е. касались случаев, когда расстройство развивалось только при сочетании генетической предрасположенности и внешнего воздействия, но при наличии только одного из этих факторов шизофрения не развивалась.
Работы, связанные с расчетом PRS, в последнее время поддерживаются в области исследований по взаимодействию генетических и средовых факторов. Ранее уже исследовался вопрос о возможной взаимосвязи между генетическими полиморфизмами, играющими роль в биологических механизмах психоза, с употреблением каннабиса и подверженностью неблагоприятным воздействиям в детском возрасте. Хотя были определены SNP (в разных генах), обладающие потенциалом для дальнейшего изучения (например, AKT1, COMT, BDNF), в разных выборках55 эти находки оказались несостоятельными и отошли на второй план с появлением подходов, охватывающих геном в целом.
На сегодняшний день лишь небольшое количество исследований затрагивают вопрос взаимодействия средовых и генетических факторов в формировании расстройств психотического спектра и используют показатель PRS-SCZ. Пилотное исследование, которое включало 80 пациентов с первым психотическим эпизодом и 110 участников контрольной группы и ставило задачу изучить, опосредует ли PRS-SCZ связь между психозом и подверженностью неблагоприятным воздействиям в детском возрасте, обладало недостаточной мощностью для выявления названных взаимодействий56. В недавнем исследовании на выборке близнецов из общей популяции мы обнаружили данные за положительное взаимодействие между PRS-SCZ и подверженностью неблагоприятным воздействиям, что сказывалось на особенностях эмоциональной регуляции и склонности к психотическим расстройствам58. Кроме того, выполнено мультимодальное исследование, которое объединило результаты генетических анализов и методов нейровизуализации – оно продемонстрировало, что на ассоциацию между PRS-SCZ и созреванием коры у молодых представителей мужского пола влиял опыт употребления каннабиса в раннем возрасте59. Подводя итог, можно сказать, что с использованием данных GWA в области исследования взаимодействия генетических и средовых факторов постепенно повышается воспроизводимость результатов, однако пока она не демонстрирует фактов, которые позволили бы сделать практически значимые выводы.
В эпоху GWA наши результаты могут быть полезны в дальнейшем изучении взаимодействия средовых и генетических факторов в нескольких аспектах. Во-первых, они могут задать направление для дальнейших исследований с предварительной регистрацией данных, которые ставили бы задачу подтвердить уже имеющиеся результаты. Во-вторых, они могли бы стимулировать перспективную линию исследований взаимодействия генетических и средовых факторов в контексте биологической теории, с использованием, например, данных о путях реализации генетической информации вместо аккумуляции данных о генах, составляющих уровень риска фенотипического проявления болезни. Эти исследования раскрыли бы гипотезу о частных биологических механизмах, в которые могут вмешиваться внешние факторы (например, механизм гипоксии-ишемии × осложненные роды и подверженность влиянию неблагоприятных факторов в детском возрасте × гипоталамо-гипофизарно-надпочечниковая ось)60,61, а также общих патофизиологических путях, как, например, воспалительный, активность которого может регулировать одновременно множество внешних воздействий62.
Однако у последнего подхода есть и недостатки: уровни риска на основе биологических механизмов могут оказаться не таким мощным инструментом, как совокупный полигенный уровень риска определенного фенотипа, а возможности построения «гипотетических» путей практически ничем не ограничиваются. Поэтому набор генов, на котором будет основан поиск механизмов, должен быть определен предварительно и зафиксирован в центральном репозитории с целью избежать неконтролируемого дополнения данных. В идеале следовало бы также создать фиксированный список протоколов для анализа внешних воздействий и их биологических механизмов (как, например, регулярное употребление каннабиса и эндоканнабиноидный путь), а если это невозможно, следует продолжить независимый анализ данных.
В нашем исследовании сбор данных проводился специально обученными психиатрами, психологами и научными ассистентами и был направлен именно на выявление роли средовых и генетических факторов в генезе шизофрении. В дальнейшем, поскольку выборка отличалась высоким культурным и географическим разнообразием, у нас была возможность проследить различные вариации внешних факторов и с большей точностью выявить эффекты взаимодействия63.
Однако следует упомянуть о некоторых ограничениях данного исследования. Во-первых, кросс-секционный дизайн позволяет выявить лишь временные ассоциации, но не причинно-следственные связи. Тем не менее, кросс-секционные исследования остаются необходимым первым звеном в работе по выявлению факторов риска и создают условия для последующих лонгитудинальных исследований, которые отразили бы взаимодействие генетических и средовых факторов в развитии. Во-вторых, учитывая размер выборки и поисковый характер работы, мы сконцентрировались на основных и сопряженных эффектах ранее выдвинутых средовых факторов и PRS-SCZ. Однако самые современные статистические модели не могут в полной мере охватить сложные отношения, которые существуют в реальности, включая динамические взаимодействия, ассоциации, связанные и не связанные с причинной обусловленностью в рамках экспозома (тесно взаимосвязанных внешних факторов, эффект которых может варьироваться в зависимости от момента воздействия, его продолжительности, массивности и количества повторений)16,64, генома (его избыточности, феноменов эпистаза и плейотропии)65 и фенома (разнообразие синдромов, вовлекающее одновременно множество дименсий)66. В-третьих, в данном исследовании мы прибегли к квази-систематическому подходу в противоположность распространенной практике избирательно изучать один вид воздействия в одном исследовании. Таким образом мы хотели отразить целостную картину взаимодействий между генетическими и средовыми факторами в имеющейся выборке. Однако многие факторы в нашем исследовании не рассматривались (например, осложнения беременности и родов).
В заключение можно сказать, что, используя молекулярно-генетические подходы к оценке риска, мы получили еще одно подтверждение роли взаимодействия генетических и средовых факторов в генезе шизофрении. Приведенные результаты требуют дальнейшего подтверждения в исследованиях с предварительным сбором данных.
Дополнение
Исследователи GROUP в проекте EUGEI: Behrooz Z. Alizadeh, Therese van Amelsvoort, Nico J. van Beveren, Richard Bruggeman, Wiepke Cahn, Lieuwe de Haan, Philippe Delespaul, Jurjen J. Luykx, Inez Myin-Germeys, Ruud van Winkel and Jim van Os.
Благодарности
Проект EUGEI поддержан грантом HEALTH-F2-2010-241909 в рамках Седьмой Европейской Программы по Поддержке Общественного Здоровья. Авторы благодарят всех пациентов и их родственников за участие в проекте. Также авторы выражают благодарность всем специалистам, участвовавшим в исследовании, в частности, J. van Baaren, E. Veermans, G. Driessen, T. Driesen, E. van’t Hag and J. de Nijs. Все образцы ДНК из Турции были предоставлены Ankara University Brain Research Center Biobank, что обеспечил проект Ankara University Scientific Research Projects Coordination Unit (номер проекта 10A6055003, 2010). Деятельность B.P.F. Rutten финансировалась премией VIDI no. 91718336 от the Netherlands Scientific Organization. S. Guloksuz, L.-K. Pries, B.P.F. Rutten и J. van Os внесли равный вклад в данную работу.
DOI: 10.1002/wps.20629
Редактура: к.м.н. Федотов И.А. (Рязань)
Guloksuz S et al. Examining the independent and joint effects of molecular genetic liability and environmental exposures in schizophrenia: results from the EUGEI study. World Psychiatry 2019;18(2):173-182.
Шизофрения в настоящее время представляется комплексным наследуемым фенотипом. С одной стороны, он ассоциирован с генетической предиспозицией, при этом вклад каждой из многочисленных и распространенных вариаций по отдельности невелик. С другой стороны, существует множество значимых средовых воздействий. Близнецовые и семейные исследования, которые ранее использовались в качестве замены прямых методов выявления генетического риска, позволяют предположить взаимодействие генетических и средовых факторов в этиологии шизофрении, но молекулярно-генетические данные достаточно скудны. Данный материал также раскрывает тему взаимодействия генетических и средовых факторов в генезе шизофрении: в нем проанализированы основные и сочетанные ассоциации уровня полигенного риска шизофрении (PRS-SCZ) и средовых воздействий у 1699 пациентов с диагнозом расстройств шизофренического спектра и 1542 представителей контрольной группы без соответствующих расстройств в анамнезе. Выявлена суммация эффекта состояния молекулярно-генетического риска шизофрении (бинарная модель PRS-SCZ более 75% от контрольного распределения) и такими внешними факторами, как регулярное употребление каннабиса на протяжении жизни и подверженность негативному воздействию в раннем возрасте (сексуальное и эмоциональное насилие, эмоциональная депривация, травля), но не выявлено взаимодействия с такими факторами, как нарушение слуха, время года, на которое приходится дата рождения, а также подверженность физическому насилию и депривации физических потребностей в детстве. Анализ чувствительности, в котором изначально выбранный уровень PRS-SCZ в 75% был заменен на более низкие уровни (25 и 50%) подтвердил выявленные взаимоотношения факторов. Наши результаты позволяют предположить, что в этиопатогенезе шизофрении играет роль генетическая предрасположенность, которая повышает чувствительность индивида к средовым воздействиям.
Ключевые слова: шизофрения, психоз, генетика, среда, взаимодействие генов и среды, полигенный риск, детская травма, каннабис, травля.
Шизофрения – комплексный фенотип, который характеризуется искаженным восприятием реальности, когнитивной дисфункцией и негативной симптоматикой. Хотя распространенность расстройств шизофренического спектра невысока – 0,47% для шизофрении (состояний с наименее благоприятным исходом) и 3% для других диагнозов, относящихся к группе психотических расстройств1, – они ассоциированы со значительным ущербом в личностном, социальном и экономическом аспектах. На шизофрению приходится 218 лет жизни, скорректированных по нетрудоспособности (DALY) из 100 0002, таким образом, шизофрения занимает по этому показателю пятое место в возрастной группе от 15 до 44. Таким образом, медицина остро нуждается в инновационных подходах к профилактике, диагностике и лечению расстройств шизофренического спектра, и добиться этого позволило бы понимание их этиологии и патогенеза.
За десятилетия работы над этой проблемой неоднократно было показано, что наследуемость этих расстройств достаточно высока, соответственно, в их развитии играет роль генетическая предрасположенность3,4. Последние данные датского национального регистра согласуются с самыми первыми семейными исследованиями шизофрении, оценивают наследуемость для расстройств шизофренического спектра в 73%, а для самой шизофрении – в 79%5.
На этих фактах из области количественной генетической эпидемиологии основан нынешний интерес к молекулярной генетике – среди изучающих расстройства шизофренического спектра эта область наиболее популярна. Доступность технологий, с одной стороны, недорогих и простых в применении, с другой – высокопроизводительных, подняла на новый уровень разрешающую способность генетических исследований. С целью объединить усилия по выявлению генов с малым размером эффекта в проектах по полногеномному поиску ассоциаций (GWA) был создан Консорциум по психиатрической геномике6. Рабочая группа по шизофрении в рамках этого консорциума идентифицировала 108 значимых локусов7, и количество возможных генетических вариаций возрастает пропорционально размеру выборки8. Как и предполагала полувековой давности полигенная теория шизофрении9, GWA обнаружил, что значительная доля генетического риска обусловлена вариациями многочисленных генов, широко распространенных в популяции, но обладающих очень небольшим размером эффекта.
Тем не менее, обнаруженная в ходе GWA генетическая предрасположенность вследствие однонуклеотидных полиморфизмов (SNP) объясняет лишь небольшую часть данных по наследуемости шизофрении, полученных в близнецовых исследованиях. Иными словами, существует своего рода «разрыв в наследуемости» между данными близнецовых и молекулярно-генетических исследований10. Наиболее вероятным объяснением этого разрыва является тот факт, что для изучаемых пар близнецов сходны не только генетические, но и многие средовые факторы, поскольку чаще всего они растут в одной семье10. В то же время этиология психотических расстройств, вероятно, состоит в генетической предрасположенности, которая повышает чувствительность индивида к средовым воздействиям или увеличивает его склонность подвергаться таким воздействиям11.
Наряду с расширением наших познаний в области генетики при исследовании средовых воздействий в генезе шизофрении также получены интересные результаты. Наблюдение выявило различные внешние факторы, ассоциированные с расстройствами психотического регистра, – все они демонстрируют разные уровни доказательности и размер эффекта. К таким внешним факторам относятся употребление каннабиса, детские травмы (например, сексуальное насилие, эмоциональная депривация), травля (буллинг), городская среда, условия, располагающие к отгороженности от общества (например, принадлежность к этническим меньшинствам, мигрантам или нарушение слуха), время года, на которое приходится дата рождения, осложнения беременности и родов12,13.
Таким образом, эмпирические исследования, опирающиеся на суррогатные показатели генетического риска (такие как семейный анамнез шизофрении), представляются в настоящий момент спорными из-за возможного вклада среды в получаемые результаты11, но интересной задачей видится перевод этих исследований в плоскость молекулярно-генетического анализа14.
Использование такого показателя, как уровень полигенного риска (PRS), для определения риска по данным молекулярной генетики значительно расширило возможности исследователей в определении ассоциированных фенотипов и выявлении взаимодействия генетических и средовых факторов. В настоящее время уровень полигенного риска шизофрении (PRS-SCZ) для определенного индивида определяется так: логарифмы отношения шансов для каждого SNP умножаются на количество аллелей, ассоциированных с риском, в интересующем локусе, и полученные результаты складываются15. PRS-SCZ на данный момент объясняет 7% на шкале предрасположенности к шизофрении, по крайней мере у пациентов с хроническими формами и в случае использования последней версии Консорциума по психиатрической геномике7.
В недавнем материале мы обсуждали трудности, с которыми сталкивается исследователь при оценке вклада средовых факторов в психиатрии, и пришли к выводу о необходимости системного подхода, который охватывал бы популяцию, подвергающуюся какому-либо фактору, в целом, – это позволит разграничить эффекты, возникающие за счет реактивности индивида и за счет изначально мощного влияния внешнего фактора16. Отталкиваясь от этих результатов, в данной статье мы попытались проанализировать основные и сопряженные ассоциации между средовыми воздействиями и PRS-SCZ в кросс-секционной выборке, созданной специально для исследования по взаимодействию средовых и генетических факторов в происхождении шизофрении.
МЕТОДЫ
Исследуемая популяция
В данном исследовании взаимодействия средовых и генетических факторов по типу случай-контроль использовалась информация Рабочей группы 6 (WP6) Европейского отделения Международной сети по изучению взаимодействия генетических и средовых факторов при шизофрении (EUGEI), а также исследования Генетический риск и исход при психозах (GROUP) в рамках EUGEI18. Данные были собраны в промежутке между 2010 и 2015 годом в Нидерландах, Турции, Испании и Сербии.
Диагноз расстройства шизофренического спектра выставлялся по критериям DSM-IV-TR (средняя длительность заболевания после первого контакта с психиатрической службой = 9,9 года). В дальнейшем диагноз верифицировался с использованием Списка операциональных критериев для психотических и аффективных заболеваний19 в случае EUGEI WP6 и Перечня для клинической оценки в нейропсихиатрии20 или комплексной оценки симптомов и анамнеза21 в случае GROUP. Члены контрольной группы, не имеющие психотических расстройств в анамнезе, набирались из той же популяции, что и исследуемая группа, но родственники пациентов исследуемой группы были исключены. Критериями исключения для любой группы были диагноз психотического расстройства в связи с иными медицинскими проблемами, травма головы с потерей сознания в анамнезе, IQ < 70.
Всего в исследование были включены 1866 пациентов и 1583 здоровых участника, для которых имелись данные по исследованию генотипа. Поскольку в отношении индивидов, не относящихся к белой европеоидной расе, предсказательная сила PRS-SCZ не оценивалась22, в данном исследовании участвовали только ее представители. Окончательный размер выборки составил 1699 пациентов и 1542 члена группы контроля.
Все проекты были одобрены медицинскими этическими комитетами стран-участников и проводились в соответствии с Хельсинкской Декларацией. Все респонденты предоставили информированное согласие в письменном виде. В случае участников младше 18 лет информированное согласие подписывали родителями, от самих участников также было получено разрешение.
Для достижения высокого качества и однородности оценки внешних факторов, клинической и экспериментальной использовались стандартизированные инструменты, а применявшие их психиатры, психологи и научные ассистенты, которые прошли обязательное обучение как очно, так и в виде тренировочных модулей в режиме онлайн, включая интерактивные видеоинтервью и опросники для самооценки17,18. Чтобы добиться высокой межрейтерсковой надежности на всем протяжении исследования, и очные, и заочные тренировочные сессии проводились ежегодно.
Средовые воздействия
В рамках имеющихся данных мы попытались выявить внешние воздействия, которые в более ранних исследованиях демонстрировали ассоциацию с расстройствами шизофренического спектра.Подверженность неблагоприятному влиянию в детском возрасте оценивалась с помощью Краткой формы опросника по детской травме (CTQ)23. Он состоит из 28 вопросов, оцениваемых по 5-балльной шкале Ликерта, оцениваются 5 доменов жестокого обращения с ребенком: эмоциональная и физическая депривация, эмоциональное, физическое и сексуальное насилие. В полной мере были изучены психометрические характеристики переводных версий CTQ (на испанском, турецком, голландском и сербском языках)24,26. Для формализации каждого из доменов жестокого обращения (0=отсутствовало или 1=присутствовало), как и в прежних работах EUGEI, мы пользовались следующими пороговыми значениями: ≥9 для эмоционального насилия, ≥8 для физического насилия, ≥6 для сексуального насилия, ≥10 для эмоциональной депривации и ≥8 для физической депривации.
Употребление каннабиса оценивали с помощью модифицированной версии Опросника об опыте употребления каннабиса28 в исследовании EUGEI WP6 (0=нет, 1=один или два раза, 2=несколько раз в год, 3=несколько раз в месяц, 4=один или более раз в неделю, 5=каждый день) и с помощью секции L Комплексного международного диагностического интервью (CIDI)29 в исследовании GROUP (0=нет, 1=реже, чем раз в неделю, 2=еженедельно, 3=ежедневно). Как и в прежних работах30-32, для создания бинарной модели в отношении регулярного употребления каннабиса в качестве порогового значения использовалась частота один или более раз в неделю в период наиболее частого употребления на протяжении жизни.
При исследовании связи между временем года, на которое приходится дата рождения, и шизофренией за период высокого риска традиционно были приняты месяцы зимнего солнцестояния (декабрь-март), на чем базировалась и бинарная модель.
Нарушение слуха определяли на основании самоотчета об ухудшении слуха за последние 12 месяцев (0=отсутствовало или 1=присутствовало).
История травли со стороны ровесников (с проявлениями эмоционального, психологического и физического насилия) до 17 лет оценивалась с помощью краткой версии Ретроспективного опросника для оценки травли (буллинга) (RBQ)34,35, который оценивает тяжесть пережитого опыта травли: 0=нет, 1=малая (не было физических повреждений), 2=умеренная (легкие повреждения и преходящие эмоциональные реакции), 3=выраженная (частый и тяжелый физиологический и психологический вред). Подверженность травле в детском возрасте была приведена к бинарной модели с использованием ≥1 в качестве порогового значения: 0 – отсутствовала, ≥1 – присутствовала.
Обработка генетических данных
Генотипирование всех полученных образцов проводилось в Cardiff University Institute of Psychological Medicine and Clinical Neurology (Кардифском институте психологической медицины и клинической неврологии) с использованием зондов для генотипирования Illumina HumanCoreExome-24 BeadChip с возможностью распознавания 570 038 генетических вариантов (Illumina, San Diego, CA). Дальнейшая обработка данных проводилась с помощью пакета Genome Studio, они были переведены в формат PLINK для дальнейшего анализа.Анализ качества проводился в программе PLINK v1.0736 или с использованием специально разработанных Perl- скриптов. Варианты с call rate (доля интересующих генотипов среди всех возможных) <98% исключались из объема данных. Показатель р в отношении Харди–Вайнберга подсчитывался отдельно для турецкой, южноевропейской и североевропейской популяций. Варианты, для которых p составил <1e-6, в каждом из трех регионов были исключены из исследования. После контроля качества в исследовании осталось 559 505 вариантов.
Образцы с call rate <98% исключались из общего объема данных. Набор вариантов, в котором излишняя детализация ликвидировалась методом прунинга по признаку неравновесного сцепления генов (linkage disequilibrium, LD), был обработан с помощью команды – indep-pairwise в PLINK (максимальный показатель r2=0,25, размер окна 500 SNP, размер шага окна – 50 SNP) и использовался для дальнейшего анализа. Показатель гомозиготности F был подсчитан с помощью команды – het в PLINK, и образцы, для которых значения оказались за рамками выделенного интервала (F<–0,11 или F>0,15), были исключены. Генетический пол в образцах определялся по данным Х-хромосомы с помощью команды – check-sex в PLINK, образцы, у которых генетический пол отличался от внесенного в базу данных, были исключены из исследования.
Также в PLINK для образов рассчитывались индексы идентичности по происхождению. Образцы, для которых в выборке обнаруживался один или более генотипически родственный, но при этом генотипически не являющийся сиблингом (определялось по PI-HAT >0,35 и <0,65), исключались из исследования. После этого образцы, для которых в базе данных обнаруживалось 2 или более сиблингов, не подтвержденных генотипическим родством, также исключались.
Визуально оценив результаты кластеринга ошибок, допущенных при использовании чипа для генотипирования, мы приняли решение исключить чипы с высоким процентом ошибок. Были исключены все оставшиеся образцы с чипов, где из-за высокой гетерозиготности или call rate ранее исключались более 5 образцов (из 12 возможных). Также исключались все образцы с чипов, где 4 или более образца были исключены из-за вопросов с определением генетического пола и родства, за исключением случаев, когда при перепроверке на другом чипе их результат был подтвержден.
Первичные компоненты анализа проводились в PLINK с использованием вариантов, прореженных по признаку неравновесных связей, при взаимодействии с базой Thousand Genomes. Так как выборка и соответствующие ей варианты анализа являлись, в сущности, межпопуляционными, на этом этапе исключения образцов не проводилось. Популяционные эффекты были впоследствии скорректированы в процессе индивидуального анализа.
После контроля качества результаты были загружены в программу для статистического предсказания – Michigan Imputation Server с применением панели Консорциума по гаплотипам (весрия 1.1), а также программ Eagle для фазирования по гаплотипу и Minimac3 для предсказания37,38. После этого для дальнейшего участия в исследовании отобрали варианты с достоверностью предсказания r2>0,6, минимальной частотой аллелей (MAF) >0,1% и call rate >99% (8 277 535 вариантов). Генотипы «наилучшего совпадения» создавались в PLINK методом вероятностной генерации генотипов.
PRS-SCZ создавался на основе обобщенной статистики по данным полногеномного поиска ассоциаций в рамках Консорциума по психиатрической геномике, при этом образцы, представленные в базе исследования GROUP, исключались7. Группировка проводилась в PLINK среди генотипов «наилучшего совпадения» отдельно для каждого набора данных (максимальный r2=0,2, размер окна=500 kb, минимальный MAF=10%, уровень минимальной информации по загрузке=0,7). Вариации внутри протяженного региона неравновесного сцепления генов (включая главный комплекс гистосовместимости) были исключены39. PRS-SCZ рассчитывался на основе генотипов «наилучшего совпадения» в программе PLINK при десяти разных пороговых значениях p (1, 0,5, 0,3, 0,2, 0,1, 0,05, 0,01, 1×10–4, 1×10–6, 5×10–8). Как и в предшествующих исследованиях по данной тематике40-43, для первичного анализа мы использовали показатель p=0,05, поскольку он объясняет большинство фенотипических вариаций при анализе данных Консорциума по психиатрической гено-мике7.
Чтобы впоследствии сравнить оценки, полученные в нашей выборке, с объемом вариаций, которые объясняет PRS-SCZ, по данным прежних исследований, применялась модель логистической регрессии, которая позволяет выявить ассоциацию PRS-SCZ с отдельными исследованиями по типу случай-контроль (скорректированные для ситуаций, когда в исследовании участвовали родственники, с использованием первых десяти основных компонентов), при этом рассчитывали R2 Нагелькерке. PRS-SCZ значимо отличался в исследуемой группе и группе контроля (отношение шансов, ОШ=1,30; 95% ДИ: 1,25-1,34; p<0,001; R2 Нагелькерке=0,15), в том числе при сопоставлении по возрасту, полу и стране (ОШ=1,30; 95% ДИ: 1,26-1,35; p<0,001; R2 Нагелькерке=0,20). Дихотомизация PRS-SCZ проводилась с использованием пограничных значений квартилей, которые в свою очередь определялись на основании контрольного распределения PRS-SCZ в разных странах (чтобы учесть этнические вариации, которые могут приводить к различиям PRS-SCZ между ними). Наивысший квартиль (PRS-SCZ>75% контрольной группы) был принят за пороговое значение для состояния высокого риска шизофрении (в дальнейшем PRS-SCZ75).
Статистический анализ
Все процедуры анализа проводились в программе STATA версии 15.044. Для проверки одомерной ассоциации средовых воздействий или PRS-SCZ75 с клинической картиной использовалась многоуровневая модель логистической регрессии в сочетании с методом случайных срезов, которая учитывала кластеризацию участников внутри каждой страны. В контрольной группе многоуровневая модель логистической регрессии также использовалась для проверки взаимодействия средовых и генетических факторов для всех разновидностей внешнего воздействия. Для выявления этих взаимодействий в период еще до начала сбора данных (Съезд Консорциума EUGEI, 14 декабря 2013 года) были выбраны аддитивные, а не мультипликативные модели, поскольку они более полно отражают внутренние связи на биологическом уровне45 и направляют процесс принятия решений в здравоохранении в рамках концепции достаточной причины46,47.Для выявления сопряженных эффектов внешних воздействий и генетического риска мы ввели в многоуровневую модель логистической регрессии в качестве независимых переменных четыре состояния, обусловленных сочетанием определенного вида воздействия и PRS-SCZ (три их них – фиктивные переменные, в которых генетический риск отсутствовал, для сравнения), а в качестве зависимых – характеристики клинической картины.
Отклонение от аддитивности проверяли с использованием коэффициента контрастности взаимодействия; другое название этого показателя – относительный избыточный риск вследствие взаимодействия (RERI). RERI – стандартный показатель взаимодействия на аддитивной шкале для исследований по типу случай-контроль48. Он рассчитывается по формуле (OШexposure&PRS-SCZ75 − OШexposure − OШPRS-SCZ75 +1)49. RERI выше нуля расценивается как положительное отклонение от аддитивности и считается значимым, если 95% ДИ отличается от нуля. Для каждой модели RERI рассчитывался дельта-методом на основе полученных в них ОШ.
Для определения чувствительности использовался альтернативный пошаговый перцентильный метод50 (N=1000 шагов) – с его помощью определяли 95% ДИ для RERI. Все модели приводили к равновесному распределению по предсуществующим ковариатам (пол и возраст), в то время как модели, включающие PRS-SCZ75, дополнительно корректировались по показателям родства с использованием первых десяти основных компонентов, в соответствии с общими рекомендациями. Согласно приложению к Руководству по усовершенствованию отчетов по наблюдательным исследованиям в эпидемиологии (STROBE)48, отчет об анализе взаимодействий строился на единственной категории отношения, включающей независимые и сопряженные эффекты PRS-SCZ75, а также все обозначенные эффекты совместно с PRS-SCZ75.
Все процедуры анализа проводились также для данных, полученных методом статистического предсказания, учитывая, что при оценке внешних воздействий непосредственное наблюдение не проводилось. Исходя из предположения о случайном распределении отсутствующих данных, мы применяли цепную равновесную модель множественных предсказаний51 с 20 предсказанными вариантами в пределах ранее определенных значений (относительная эффективность варьировалась между 97 и 99%). Предсказанные данные не отличались от выявленных в изначальной выборке. Дальнейшие процедуры анализа выполнялись на основе предсказанных данных, полученные оценки объединялись по правилам Рубина52.
С целью оценить устойчивость обнаруженных закономерностей к ошибкам (robustness) проводился анализ чувствительности пороговых значений бинарного генетического риска с использованием порога в 25 и 50% контрольной группы. Номинальная значимость порога составила р=0,05.
РЕЗУЛЬТАТЫ
Данные по полу, возрасту и подверженности неблагоприятным воздействиям представлены в таблице 1.
Для всех видов воздействия, кроме рождения зимой, были обнаружены ассоциации с характеристиками клинической картины, в том числе после коррекции по полу и возрасту. В таблице 2 представлены скорректированные и нескорректированные ОШ для PRS-SCZ75 и каждой разновидности внешних воздействий, ассоциированной с характеристиками клинической картины.
Данных за корреляцию между средовыми и генетическими воздействиями не было обнаружено ни в одном сочетании, кроме физического насилия, поскольку PRS-SCZ75 не был выраженно и значимо ассоциирован с подверженностью остальным видам воздействия в контрольной группе (таблица 3). Напротив, физическое насилие было ассоциировано с PRS-SCZ75 (скорректированное ОШ=1,84; 95% ДИ: 1,19-2,84; p=0,006).
В таблице 4 отражен совместный эффект PRS-SCZ75 и внешнего фактора на характеристику клинического случая. Получены данные за взаимодополняющее действие в формировании заболевания между PRS-SCZ75 и регулярным употреблением каннабиса (RERI=5,60; 95% ДИ: 0,88-10,33; p=0,020), травлей в детском возрасте (RERI=2,76; 95% ДИ: 0,29-5,23; p=0,028), эмоциональным насилием (RERI=5,52; 95% ДИ: 2,29-8,75; p<0,001), сексуальным насилием (RERI=7,61; 95% ДИ: 2,05-13,17; p=0,007) и эмоциональной депривацией (RERI=2,46; 95% ДИ: 0,98-3,94; p=0,001) соответственно. На рисунке 1 показаны значимые эффекты взаимодействия на шкале аддитивности. Значимых взаимодополняющих эффектов между PRS-SCZ75 и физическим насилием, депривацией физических потребностей и рождением в зимнее время года не было обнаружено.


Анализ с использованием альтернативного пошагового перцентильного метода дал схожие результаты (данные не приводятся в статье). Анализ чувствительности, где изначально установленное пороговое значение PRS-SCZ75 в качестве показателя генетического риска заменялось на другие значения PRS-SCZ (25 и 50%) подтвердил, что дополняющее взаимодействие существовало между любого уровня PRS-SCZ и регулярным употреблением каннабиса, травлей в детском возрасте, эмоциональным и сексуальным насилием, эмоциональной депривацией (данные не приводятся в статье). Схожие результаты получены в анализе с использованием статистически предсказанных данных (таблица 5).







ОБСУЖДЕНИЕ
В данном исследовании, посвященном независимым и сопряженным эффектам средовых воздействий и генетической предрасположенности к заболеваниям шизофренического спектра, были получены данные в пользу позитивных дополняющих взаимодействий генетической предрасположенности с такими факторами, как регулярное употребление каннабиса и подверженность неблагоприятным воздействиям в дестком возрасте (сексуальное и эмоциональное насилие, эмоциональная депривация и травля в коллективе).
При современном уровне науки в данной работе нам впервые удалось показать, что чувствительность к неблагоприятным воздействиям в детском возрасте и такому фактору, как употребление каннабиса, модулируется уровнем генетического риска шизофрении (PRS-SCZ75). Иными словами, положительный и взаимодополняющий характер взаимодействия между генетическими и средовыми факторами позволяет говорить об их синергии, то есть эффект, производимый сочетанием генетической предрасположенности и средовых воздействий, больше, чем простая сумма их эффектов по отдельности.
Как было показано и в предшествующих работах, по PRS-SCZ75 исследуемая группа значимо отличается от контрольной, и все средовые факторы демонстрировали ассоциацию с характеристикой клинического случая. Однако взаимное усиление эффектов не было показано при взаимодействии PRS-SCZ75 с такими факторами, как физическое насилие и депривация физических потребностей, нарушение слуха и рождение в зимнее время года.
Доля вариаций, которые объясняет PRS-SCZ75 в нашей выборке, была сравнима с результатами прошлых исследований53 и последними данными Консорциума по психиатрической геномике7. В данном исследовании мы строго придерживались ранее введенных определений внешнего воздействия, чтобы повысить воспроизводимость и создать возможности для сравнения результатов. В соответствии с ранее полученными результатами в нашей работе одномерный анализ показал, что степень ассоциации внешних воздействий с характеристикой клинического случая варьировалась, но в целом не отличалась от результатов метаанализа12,13.
Пользуясь преимуществами непосредственного молекулярного подхода к определению генетического риска, мы предоставили очередные доводы в пользу гипотезы о взаимодействии средовых и генетических факторов в формировании расстройств шизофренического спектра – ранее это предположение основывалось лишь на непрямых оценках генетической предрасположенности по данным семейных исследований (близнецов, родственников и т.п.)54. Выявленные закономерности подтвердились в исследовании с помощью регрессионных моделей (с использованием разных пороговых значений генетического риска, где PRS-SCZ составлял 25 и 50%), а также при анализе данных, полученных методами статистического предсказания.
ДИ 95% и RERI более двух в случае эмоционального и сексуального насилия предполагают «механистическое» взаимодействие29, т.е. касались случаев, когда расстройство развивалось только при сочетании генетической предрасположенности и внешнего воздействия, но при наличии только одного из этих факторов шизофрения не развивалась.
Работы, связанные с расчетом PRS, в последнее время поддерживаются в области исследований по взаимодействию генетических и средовых факторов. Ранее уже исследовался вопрос о возможной взаимосвязи между генетическими полиморфизмами, играющими роль в биологических механизмах психоза, с употреблением каннабиса и подверженностью неблагоприятным воздействиям в детском возрасте. Хотя были определены SNP (в разных генах), обладающие потенциалом для дальнейшего изучения (например, AKT1, COMT, BDNF), в разных выборках55 эти находки оказались несостоятельными и отошли на второй план с появлением подходов, охватывающих геном в целом.
На сегодняшний день лишь небольшое количество исследований затрагивают вопрос взаимодействия средовых и генетических факторов в формировании расстройств психотического спектра и используют показатель PRS-SCZ. Пилотное исследование, которое включало 80 пациентов с первым психотическим эпизодом и 110 участников контрольной группы и ставило задачу изучить, опосредует ли PRS-SCZ связь между психозом и подверженностью неблагоприятным воздействиям в детском возрасте, обладало недостаточной мощностью для выявления названных взаимодействий56. В недавнем исследовании на выборке близнецов из общей популяции мы обнаружили данные за положительное взаимодействие между PRS-SCZ и подверженностью неблагоприятным воздействиям, что сказывалось на особенностях эмоциональной регуляции и склонности к психотическим расстройствам58. Кроме того, выполнено мультимодальное исследование, которое объединило результаты генетических анализов и методов нейровизуализации – оно продемонстрировало, что на ассоциацию между PRS-SCZ и созреванием коры у молодых представителей мужского пола влиял опыт употребления каннабиса в раннем возрасте59. Подводя итог, можно сказать, что с использованием данных GWA в области исследования взаимодействия генетических и средовых факторов постепенно повышается воспроизводимость результатов, однако пока она не демонстрирует фактов, которые позволили бы сделать практически значимые выводы.
В эпоху GWA наши результаты могут быть полезны в дальнейшем изучении взаимодействия средовых и генетических факторов в нескольких аспектах. Во-первых, они могут задать направление для дальнейших исследований с предварительной регистрацией данных, которые ставили бы задачу подтвердить уже имеющиеся результаты. Во-вторых, они могли бы стимулировать перспективную линию исследований взаимодействия генетических и средовых факторов в контексте биологической теории, с использованием, например, данных о путях реализации генетической информации вместо аккумуляции данных о генах, составляющих уровень риска фенотипического проявления болезни. Эти исследования раскрыли бы гипотезу о частных биологических механизмах, в которые могут вмешиваться внешние факторы (например, механизм гипоксии-ишемии × осложненные роды и подверженность влиянию неблагоприятных факторов в детском возрасте × гипоталамо-гипофизарно-надпочечниковая ось)60,61, а также общих патофизиологических путях, как, например, воспалительный, активность которого может регулировать одновременно множество внешних воздействий62.
Однако у последнего подхода есть и недостатки: уровни риска на основе биологических механизмов могут оказаться не таким мощным инструментом, как совокупный полигенный уровень риска определенного фенотипа, а возможности построения «гипотетических» путей практически ничем не ограничиваются. Поэтому набор генов, на котором будет основан поиск механизмов, должен быть определен предварительно и зафиксирован в центральном репозитории с целью избежать неконтролируемого дополнения данных. В идеале следовало бы также создать фиксированный список протоколов для анализа внешних воздействий и их биологических механизмов (как, например, регулярное употребление каннабиса и эндоканнабиноидный путь), а если это невозможно, следует продолжить независимый анализ данных.
В нашем исследовании сбор данных проводился специально обученными психиатрами, психологами и научными ассистентами и был направлен именно на выявление роли средовых и генетических факторов в генезе шизофрении. В дальнейшем, поскольку выборка отличалась высоким культурным и географическим разнообразием, у нас была возможность проследить различные вариации внешних факторов и с большей точностью выявить эффекты взаимодействия63.
Однако следует упомянуть о некоторых ограничениях данного исследования. Во-первых, кросс-секционный дизайн позволяет выявить лишь временные ассоциации, но не причинно-следственные связи. Тем не менее, кросс-секционные исследования остаются необходимым первым звеном в работе по выявлению факторов риска и создают условия для последующих лонгитудинальных исследований, которые отразили бы взаимодействие генетических и средовых факторов в развитии. Во-вторых, учитывая размер выборки и поисковый характер работы, мы сконцентрировались на основных и сопряженных эффектах ранее выдвинутых средовых факторов и PRS-SCZ. Однако самые современные статистические модели не могут в полной мере охватить сложные отношения, которые существуют в реальности, включая динамические взаимодействия, ассоциации, связанные и не связанные с причинной обусловленностью в рамках экспозома (тесно взаимосвязанных внешних факторов, эффект которых может варьироваться в зависимости от момента воздействия, его продолжительности, массивности и количества повторений)16,64, генома (его избыточности, феноменов эпистаза и плейотропии)65 и фенома (разнообразие синдромов, вовлекающее одновременно множество дименсий)66. В-третьих, в данном исследовании мы прибегли к квази-систематическому подходу в противоположность распространенной практике избирательно изучать один вид воздействия в одном исследовании. Таким образом мы хотели отразить целостную картину взаимодействий между генетическими и средовыми факторами в имеющейся выборке. Однако многие факторы в нашем исследовании не рассматривались (например, осложнения беременности и родов).
В заключение можно сказать, что, используя молекулярно-генетические подходы к оценке риска, мы получили еще одно подтверждение роли взаимодействия генетических и средовых факторов в генезе шизофрении. Приведенные результаты требуют дальнейшего подтверждения в исследованиях с предварительным сбором данных.
Дополнение
Исследователи GROUP в проекте EUGEI: Behrooz Z. Alizadeh, Therese van Amelsvoort, Nico J. van Beveren, Richard Bruggeman, Wiepke Cahn, Lieuwe de Haan, Philippe Delespaul, Jurjen J. Luykx, Inez Myin-Germeys, Ruud van Winkel and Jim van Os.
Благодарности
Проект EUGEI поддержан грантом HEALTH-F2-2010-241909 в рамках Седьмой Европейской Программы по Поддержке Общественного Здоровья. Авторы благодарят всех пациентов и их родственников за участие в проекте. Также авторы выражают благодарность всем специалистам, участвовавшим в исследовании, в частности, J. van Baaren, E. Veermans, G. Driessen, T. Driesen, E. van’t Hag and J. de Nijs. Все образцы ДНК из Турции были предоставлены Ankara University Brain Research Center Biobank, что обеспечил проект Ankara University Scientific Research Projects Coordination Unit (номер проекта 10A6055003, 2010). Деятельность B.P.F. Rutten финансировалась премией VIDI no. 91718336 от the Netherlands Scientific Organization. S. Guloksuz, L.-K. Pries, B.P.F. Rutten и J. van Os внесли равный вклад в данную работу.
DOI: 10.1002/wps.20629
Список исп. литературыСкрыть список1. Perala J, Suvisaari J, Saarni SI et al. Lifetime prevalence of psychotic and bipolar I disorders in a general population. Arch Gen Psychiatry 2007;64:19-28.
2. Murray CJ, Vos T, Lozano R et al. Disability-adjusted life years (DALYs) for 291 diseases and injuries in 21 regions, 1990-2010: a systematic analysis for the Global Burden of Disease Study 2010. Lancet 2012;380:2197-223.
3. McGuffin P, Farmer AE, Gottesman II et al. Twin concordance for operationally defined schizophrenia: confirmation of familiality and heritability. Arch Gen Psychiatry 1984;41:541-5.
4. Cardno AG, Marshall EJ, Coid B et al. Heritability estimates for psychotic disorders: the Maudsley twin psychosis series. Arch Gen Psychiatry 1999;56:162-8.
5. Hilker R, Helenius D, Fagerlund B et al. Heritability of schizophrenia and schizophrenia spectrum based on the nationwide Danish twin register. Biol Psychiatry 2018;83:492-8.
6. Sullivan PF, Agrawal A, Bulik CM et al. Psychiatric genomics: an update and an agenda. Am J Psychiatry 2017;175:15-27.
7. Schizophrenia Working Group of the Psychiatric Genomics Consortium. Biological insights from 108 schizophrenia-associated genetic loci. Nature 2014;511:421-7.
8. Pardinas AF, Holmans P, Pocklington AJ et al. Common schizophrenia alleles are enriched in mutation-intolerant genes and in regions under strong background selection. Nat Genet 2018;50:381-9.
9. Gottesman II, Shields J. A polygenic theory of schizophrenia. Int J Ment Health 1972;1:107-15.
10. Uher R, Zwicker A. Etiology in psychiatry: embracing the reality of poly-gene- environmental causation of mental illness. World Psychiatry 2017;16:121-9.
11. van Os J, Kenis G, Rutten BP. The environment and schizophrenia. Nature 2010;468:203.
12. Radua J, Ramella-Cravaro V, Ioannidis JP et al. What causes psychosis? An umbrella review of risk and protective factors. World Psychiatry 2018;17:49- 66.
13. Belbasis L, Kohler C, Stefanis N et al. Risk factors and peripheral biomarkers for schizophrenia spectrum disorders: an umbrella review of meta-analyses. Acta Psychiatr Scand 2018;137:88-97.
14. Duncan LE, Keller MC. A critical review of the first 10 years of candidate gene-by-environment interaction research in psychiatry. Am J Psychiatry 2011;168:1041-9.
15. Wray NR, Lee SH, Mehta D et al. Research review: polygenic methods and their application to psychiatric traits. J Child Psychol Psychiatry 2014;55:1068-87.
16. Guloksuz S, Rutten BP, Pries L-K et al. The complexities of evaluating the exposome in psychiatry: a data-driven illustration of challenges and some propositions for amendments. Schizophr Bull 2018;44:1175-9.
17. EUGEI, van Os J, Rutten BP et al. Identifying gene-environment interactions in schizophrenia: contemporary challenges for integrated, large scale investigations. Schizophr Bull 2014;40:729-36.
18. Korver N, Quee PJ, Boos HB et al. Genetic Risk and Outcome of Psychosis (GROUP), a multi site longitudinal cohort study focused on gene environment interaction: objectives, sample characteristics, recruitment and assessment methods. Int J Methods Psychiatr Res 2012;21:205-21.
19. McGuffin P, Farmer A, Harvey I. A polydiagnostic application of operational criteria in studies of psychotic illness: development and reliability of the OPCRIT system. Arch Gen Psychiatry 1991;48:764-70.
20. Wing JK, Babor T, Brugha T et al. SCAN: Schedules for Clinical Assessment in Neuropsychiatry. Arch Gen Psychiatry 1990;47:589-93.
21. Andreasen NC, Flaum M, Arndt S. The Comprehensive Assessment of Symptoms and History (CASH): an instrument for assessing diagnosis and psychopathology. Arch Gen Psychiatry 1992;49:615-23.
22. Vassos E, Di Forti M, Coleman J et al. An examination of polygenic score risk prediction in individuals with first-episode psychosis. Biol Psychiatry 2017;81:470-7.
23. Bernstein DP, Stein JA, Newcomb MD et al. Development and validation of a brief screening version of the Childhood Trauma Questionnaire. Child Abuse Negl 2003;27:169-90.
24. Sar V, Akyuz G, Kundakcı T et al. Childhood trauma, dissociation, and psychiatric comorbidity in patients with conversion disorder. Am J Psychiatry 2004;161:2271-6.
25. Hernandez A, Gallardo-Pujol D, Pereda N et al. Initial validation of the Spanish Childhood Trauma Questionnaire-Short Form: factor structure, reliability and association with parenting. J Interpers Viol 2013;28:1498-518.
26. Thombs BD, Bernstein DP, Lobbestael J et al. A validation study of theDutch Childhood Trauma Questionnaire-Short Form: factor structure, reliability, and known-groups validity. Child Abuse Negl 2009;33:
518-23.
27. Kraan TC, Velthorst E, Themmen M et al. Child maltreatment and clinical outcome in individuals at ultra-high risk for psychosis in the EUGEI high risk study. Schizophr Bull 2017;44:584-92.
28. Barkus EJ, Stirling J, Hopkins RS et al. Cannabis-induced psychosis-like experiences are associated with high schizotypy. Psychopathology 2006;39:175-8.
29. Robins LN, Wing J, Wittchen HU et al. The Composite International DiagnosticInterview: an epidemiologic instrument suitable for use in conjunction with different diagnostic systems and in different cultures. Arch Gen Psychiatry 1988;45:1069-77.
30. Van Winkel R, Van Beveren NJ, Simons C et al. AKT1 moderation of cannabis-induced cognitive alterations in psychotic disorder. Neuropsychopharmacology 2011;36:2529-37.
31. Pries L-K, Guloksuz S, ten Have M et al. Evidence that environmental and familial risks for psychosis additively impact a multidimensional subthreshold psychosis syndrome. Schizophr Bull 2018;44:710-9.
32. Radhakrishnan R, Guloksuz S, ten Have M et al. Interaction between environmental and familial affective risk impacts psychosis admixture in states of affective dysregulation. Psychol Med (in press).
33. Davies G, Welham J, Chant D et al. A systematic review and meta-analysis of Northern Hemisphere season of birth studies in schizophrenia. Schizophr Bull 2003;29:587-93.
34. Schafer M, Korn S, Smith PK et al. Lonely in the crowd: recollections of bullying. Br J Dev Psychol 2004;22:379-94.
35. Hunter SC, Mora-Merchan J, Ortega R. The long-term effects of coping strategy use in victims of bullying. Spanish J Psychol 2004;7:3-12.
36. Purcell S, Neale B, Todd-Brown K et al. PLINK: a tool set for whole-genome association and population-based linkage analyses. Am J Hum Genet 2007;81:559-75.
37. Das S, Forer L, Schonherr S et al. Next-generation genotype imputation service and methods. Nat Genet 2016;48:1284-7.
38. Loh PR, Danecek P, Palamara PF et al. Reference-based phasing using the Haplotype Reference Consortium panel. Nat Genet 2016;48:1443-8.
39. Price AL, Weale ME, Patterson N et al. Long-range LD can confound genome scans in admixed populations. Am J Hum Genet 2008;83:1325.
40. Allardyce J, Leonenko G, Hamshere M et al. Association between schizophrenia-related polygenic liability and the occurrence and level of mood-incongruent psychotic symptoms in bipolar disorder. JAMA Psychiatry 2018;75:28-35.
41. Escott-Price V, Smith DJ, Kendall K et al. Polygenic risk for schizophrenia and season of birth within the UK Biobank cohort. Psychol Med (in press).
42. Sorensen HJ, Debost J-C, Agerbo E et al. Polygenic risk scores, school achievement, and risk for schizophrenia: a Danish population-based study. Biol Psychiatry 2018;84:684-91.
43. van Os J, van der Steen Y, Islam MA et al. Evidence that polygenic risk for psychotic disorder is expressed in the domain of neurodevelopment, emotion regulation and attribution of salience. Psychol Med 2017;47: 2421-37.
44. StataCorp. STATA Statistical Software: Release 15. Texas: College Station, 2017.
45. Rothman KJ. The estimation of synergy or antagonism. Am J Epidemiol 1976;103:506-11.
46. Kendler KS, Gardner CO. Interpretation of interactions: guide for the perplexed. Br J Psychiatry 2010;197:170-1.
47. Rothman KJ, Greenland S, Walker AM. Concepts of interaction. Am J Epidemiol 1980;112:467-70.
48. Knol MJ, VanderWeele TJ. Recommendations for presenting analyses of effect modification and interaction. Int J Epidemiol 2012;41:514-20.
49. VanderWeele TJ, Knol MJ. A tutorial on interaction. Epidemiol Methods 2014;3:33-72.
50. Richardson DB, Kaufman JS. Estimation of the relative excess risk due to interaction and associated confidence bounds. Am J Epidemiol 2009;169:756-60.
51. Royston P, White IR. Multiple imputation by chained equations (MICE): implementation in Stata. J Stat Softw 2011;45:1-20.
52. Rubin DB. Multiple imputation for nonresponse in surveys, Vol. 81. Chichester: Wiley, 2004.
53. Mistry S, Harrison JR, Smith DJ et al. The use of polygenic risk scores to identify phenotypes associated with genetic risk of schizophrenia: systematic review. Schizophr Res 2018;197:2-8.
54. Van Os J, Rutten BP, Poulton R. Gene-environment interactions in schizophrenia: review of epidemiological findings and future directions. Schizophr Bull 2008;34:1066-82.
55. Modinos G, Iyegbe C, Prata D et al. Molecular genetic gene-environment studies using candidate genes in schizophrenia: a systematic review. Schizophr Res 2013;150:356-65.
56. Trotta A, Iyegbe C, Di Forti M et al. Interplay between schizophrenia polygenic risk score and childhood adversity in first-presentation psychotic disorder: a pilot study. PLoS One 2016;11:e0163319.
57. Ursini G, Punzi G, Chen Q et al. Convergence of placenta biology and genetic risk for schizophrenia. Nat Med 2018;24:792-801.
58. Pries LK, Klingenberg B, Menne-Lothmann C et al. Interaction between polygenic liability for schizophrenia and childhood adversity influences daily-life emotional dysregulation and subtle psychosis expression. Submitted for publication.
59. French L, Gray C, Leonard G et al. Early cannabis use, polygenic risk score for schizophrenia and brain maturation in adolescence. JAMA Psychiatry 2015;72:1002-11.
60. Schmidt-Kastner R, Van Os J, Esquivel G et al. An environmental analysis of genes associated with schizophrenia: hypoxia and vascular factors as interacting elements in the neurodevelopmental model. Mol Psychiatry 2012;17:1194-205.
61. Binder EB. Understanding gene x early adversity interactions: possibilities for insight in the biology of psychiatric disorders. Eur Arch Psychiatry Clin Neurosci 2017;267:183-5.
62. Radhakrishnan R, Kaser M, Guloksuz S. The link between the immune system, environment, and psychosis. Schizophr Bull 2017;43:693-7.
63. Ritz BR, Chatterjee N, Garcia-Closas M et al. Lessons learned from past gene-environment interaction successes. Am J Epidemiol 2017;186:778-86.
64. Guloksuz S, van Os J, Rutten BP. The exposome paradigm and the complexities of environmental research in psychiatry. JAMA Psychiatry 2018;75:985-6.
65. Pingault J-B, O’Reilly PF, Schoeler T et al. Using genetic data to strengthen causal inference in observational research. Nat Rev Genet 2018;19:566-80.
66. Guloksuz S, Van Os J. The slow death of the concept of schizophrenia and the painful birth of the psychosis spectrum. Psychol Med 2018;48:229-44.
15 мая 2019
Количество просмотров: 694
