Дерматология
Разнообразие топических кортикостероидов в дерматологии
В настоящее время в человеческой популяции насчитывается более 2 тыс. различных заболеваний кожи, большинство из них являются хроническими воспалительными неинфекционными. При этом, учитывая, что кожа – самый большой орган, а дерматологические заболевания в подавляющем большинстве имеют видимые проявления, стигматизирующие больного, помимо непосредственного негативного влияния на общее состояние здоровья болезни кожи резко снижают качество жизни больных, нередко приводя к развитию выраженных личностных, социальных, психологических проблем. Поэтому именно заболевания кожи, клинические проявления которых сразу замечает не только сам больной, но и его окружение, вызывают особенное беспокойство, и при обращении к врачу у больного возникает запрос на как можно быстрейшее устранение симптомов заболевания.
Нужно отметить, что дерматология всегда была сочетанием искусства и науки. Однако наука была рудиментарной и смешанной с эмпиризмом и опытом. Многие современные дерматологические методы лечения эволюционировали по счастливой случайности. На сегодняшний день существует большое количество подходов к лечению заболеваний кожи, которые непрестанно совершенствуются. При этом препаратами выбора терапии дерматологических болезней всегда оставались лекарственные средства для наружного применения, среди которых наиболее часто используются топические кортикостероиды. Можно даже сказать, что современная эра дерматотерапии началась именно с введения в клиническую практику местных кортикостероидов.
История кортикостероидов началась в середине прошлого века, когда Е. Kendall и соавт. в 1948 г. выделили различные соединения из надпочечников крупного рогатого скота и обозначили их буквами от А до F. Было обнаружено, что среди этих соединений эффективны у людей Е (кортизон) и F (гидрокортизон) [1]. В 1952 г. M. Sulzberger и соавт. сообщили об эффективности местного применения соединения F (гидрокортизона) при отдельных дерматозах, что стало знаковым событием в дерматотерапии [2].
Гидрокортизон, как известно, является глюкокортикоидом, получаемым из коры надпочечников. При местном применении он проявлял гораздо более высокую противовоспалительную активность, чем исходное соединение, кортизон, что послужило основанием для разработки различных лекарственных средств для наружной терапии на основе именно гидрокортизона.
Гидрокортизон состоит из 21 атома углерода, составляющих ядро цикло-пентано-пергидро-фенантрена, и боковой цепи 17,21-дигидрокси (ОН)-20-кето (О); см. рисунок. Четыре кольца в структуре обозначены от A до D. Боковая цепь имеет решающее значение для реализации глюкокортикоидного эффекта. Гидроксильная (ОН) группа на С11, двойная связь на С4, 5 и кетоновая часть на С3 также необходимы для глюкокортикоидной активности. Это основная формула, из которой получены все другие молекулы топических кортикостероидов (ТКС).
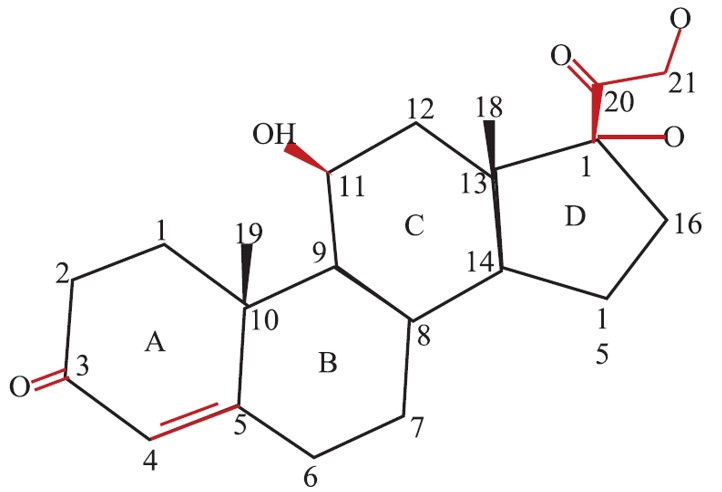
Структура гидрокортизона.
При последующих исследованиях гидрокортизона было обнаружено, что нативная молекула недостаточно активна в коже и для повышения эффективности топических кортикостероидов стали проводить этерификацию и галогенирование. Так, например, фторирование на атомах С6 и С9 молекулы гидрокортизона повышает ее активность, в то время как добавление ацетонидной группы улучшает проницаемость и чреcкожное всасывание [3]. Галогенирование придает соединениям более высокие минералокортикоидные свойства, включая антипролиферативный эффект, что помимо прочего может быть использовано в качестве таргетной терапии при таких заболеваниях, как псориаз и хроническая лихенизированная экзема. Этерификация, в свою очередь, повышает липофильность и улучшает проницаемость препаратов через кожу [4].
Внутриэпидермальная деэтерификация является одним из основных механизмов метаболизма ТКС. Ранее считалось, что это объяснение тахифилаксии, наблюдаемой при применении данных лекарственных средств, но впоследствии было опровергнуто. Тем не менее биотрансформацию ТКС в коже можно выгодно модулировать для повышения их эффективности. Галогенирование этих средств придает устойчивость к деэтерификации, продлевая активное состояние соединения.
Основа, как и рецептура, играет очень важную роль в определении эффективности, а также показаниях к назначению ТКС. На сегодняшний день на фармацевтическом рынке присутствуют различные формы данных лекарственных средств: мази, кремы, гели, лосьоны, растворы и более новые составы, такие как шампуни и пены. При этом на выбор рецептуры ТКС для конкретного больного влияет множество факторов. Так, мази достаточно жирные, обладают более высокой проникающей способностью и наиболее эффективны на утолщенных участках кожи, ладонях и подошвах, а также на лихенизированной и сухой коже. Кремы менее жирные, действуют более поверхностно и подходят для влажных и мокнущих участков кожи (например, в складках). Лосьоны и спреи легко распределяются на больших площадях кожного покрова, их удобно применять на участках, покрытых волосами, и в складках. Лосьоны наряду с гелями целесообразно использовать на влажных участках кожи благодаря их подсушивающему действию. Также в последние годы появились шампуни с кортикостероидами для волосистой части головы, весьма удобные в применении.
Биологическое действие ТКС осуществляется в результате их контакта со специфическими рецепторами, которые находятся в цитоплазме клетки в несвязанном состоянии и транслоцируются в ядро только после связывания с глюкокортикоидом, в результате чего запускаются искомые эффекты данных лекарственных средств. Другим механизмом действия является цитоплазматическое взаимодействие глюкокортикоидного рецептора с белками клеточной транскрипции.
В результате активации нуклеарных факторов транскрипции реализуются основные эффекты кортикостероидов: противовоспалительный, иммуносупрессивный, сосудосуживающий и мембраностабилизирующий. Кроме этого, данные лекарственные средства обладают способностью воздействовать на процессы связывания гистамина и серотонина в коже, снижают чувствительность нервных окончаний к нейропептидам и гистамину, купируя зуд, ингибируют выработку и/или высвобождение основных медиаторов воспаления (простагландинов, лейкотриенов, компонентов комплемента, гистамина, фактора некроза опухоли α), снижают активность фосфолипазы А, экспрессию молекул клеточной адгезии, тормозят миграцию и пролиферацию в очаг воспаления лимфоцитов и эозинофилов, снижают проницаемость сосудистой стенки.
Выбор топического стероида для лечения того или иного заболевания кожи зависит от класса лекарственного средства согласно силы его действия, а также чувствительности самого заболевания к воздействию стероидов. В таблице приведена примерная классификация чувствительности различных дерматозов к местной кортикостероидной терапии [5]. Следует отметить, что приведенные данные не являются абсолютными, поскольку на скорость и полноту наступления терапевтического эффекта будут также влиять стадия заболевания (острая, подострая), особенности кожного покрова, где возникли симптомы заболевания (ороговевшая, сухая кожа, участки с чувствительной кожей, складки, волосистая часть, аногенитальная область и пр.), возраст, наличие осложнений основного заболевания кожи (присоединение вторичной инфекции), наличие сопутствующей патологии. Поэтому в большинстве случаев выбор конкретного ТКС в конкретном клиническом случае происходит эмпирически и во многом зависит от компетентности врача.

Еще одним ориентиром при выборе ТКС может являться довольно известная классификация биологической активности данных лекарственных средств Miller–Munro, где к I классу, слабых, относятся ТКС с низкой активностью, ко II классу – умеренно-сильные, к III – сильные и к IV – сверхсильные.
Дозировка лекарственных средств для наружного применения в ряде случаев вызывает затруднение и у больных, и у врачей. Современные топические кортикостероиды в большинстве случаев обладают эффектом «депо», т.е. накапливаются в коже, сохраняя свою терапевтическую эффективность, по некоторым данным, до 5 дней [6], что позволяет применять их 1–2 раза в сутки.
Кроме этого, в дерматологии широко применяется «правило руки» или «единица измерения кончика пальца» (ЕИКП), разработанные C. Long и соавт. в 90-х годах прошлого века для измерения количества топических лекарственных средств, необходимого для адекватного покрытия определенных анатомических областей [7, 8]. ЕИКП – это количество препарата, выдаваемое из тюбика (диаметр отверстия 5 мм) от дистальной складки до кончика ладонной поверхности указательного пальца. Для терапии высыпаний, локализованных на лице и шее, необходимо 2,5 ЕИКП, на туловище (спина, грудь и живот) – 14, на руке до запястья – 3, на кисти с обеих сторон – 1, на ноге до щиколотки – 6, на стопе – 2. «Правило руки» гласит, что на площадь одной стороны кисти требуется примерно 0,5 ЕИКП или 0,25 г топического лекарственного средства. Одна ЕИКП приблизительно эквивалентна 0,49 и 0,43 г крема или мази для мужчин и женщин соответственно [8]. Ориентиром для дозирования ТКС может быть формула: «4 области кисти = 2 единицы кончиков пальцев = 1 г мази», которая показывает взаимосвязь между «правилом руки» и «единицей измерения кончика пальца».
Еще одной проблемой, связанной с применением ТКС, является развитие тахифилаксии и нежелательных побочных эффектов, что нередко вызывает довольно распространенное явление кортикофобии как среди пациентов, так иногда и среди врачей.
Тахифилаксия определяется как быстро уменьшающаяся реакция на последовательные дозы препарата, делающая его менее эффективным. На сегодняшний день результаты клинических исследований, изучающих феномен тахифилаксии, отсутствуют. Однако полагают, что резистентность к ТКС и рецидив заболеваний развиваются в результате несоблюдения пациентами рекомендаций врача в долгосрочной перспективе. Считается, что плохая приверженность больных топической терапии с течением времени может восприниматься как тахифилаксия, а не фактическое снижение эффективности препарата [9]. Также существует мнение, что в течение первых нескольких недель терапии наблюдается первоначальный максимальный клинический ответ, за которым следует плато. В течение периода плато кортикостероиды обладают ограниченной эффективностью. Однако естественное ухудшение в течении заболевания в этот период может создать неверное впечатление о тахифилаксии. Был даже предложен термин «брадифилаксия», когда такая невосприимчивость наблюдается у пациентов, получающих длительную местную терапию кортикостероидами. Она была определена как «медленное, прогрессирующее снижение реакции на лечение в течение длительных периодов использования».
Данные о развитии возможных нежелательных побочных эффектов, возникающие на фоне применения ТКС, широко опубликованы в научной литературе. Их можно классифицировать на местные и системные побочные эффекты. Так, при применении ТКС могут локально возникать покалывание и раздражение кожи. Негативными воздействиями на эпидермис являются атрофия, гипо/гиперпигментация, фоточувствительность, нарушение кожного барьера и преждевременное старение. Кроме этого, при применении ТКС затрудняются заживление ран и образование коллагена, что приводит к развитию телеангиэктазий, изъязвлений, стрий, пурпуры Бейтмана, легкому образованию синяков. Также известными побочными явления, вызванные стероидами, – акне, розацеа, гипертрихоз и алопеция.
Кроме этого, стероиды повышают восприимчивость к инфекциям, в том числе кожным. Очень редко они даже могут вызывать аллергический контактный дерматит, периоральный дерматит, контактную крапивницу и ягодичную гранулему у младенцев.
Системные побочные эффекты ТКС развиваются также крайне редко и включают подавление гипоталамо-гипофизарно-надпочечниковой системы, впервые возникший сахарный диабет/гипергликемию, ятрогенный синдром Кушинга, минералокортикоидные эффекты (отек, гипокальциемия, гипокалиемия, гипертония) и угнетение функции надпочечников. У детей ТКС могут вызывать задержку линейного роста костей. У взрослых – остеопороз и аваскулярный некроз костей. Побочные эффекты со стороны органа зрения при периокулярном нанесении ТКС включают заднюю субкапсулярную катаракту и глаукому.
Тем не менее возможные нежелательные побочные эффекты в настоящее время не являются значимым препятствием для назначения ТКС или их преждевременной отмены. Тщательный отбор пациентов, правильное назначение, надлежащее использование препарата и адекватное консультирование остаются основой предотвращения указанных нежелательных побочных эффектов. Некоторыми способами снижения частоты побочных эффектов являются использование стероидов с более низкой активностью в восприимчивых возрастных группах, уменьшение доз и частоты применения после достижения первоначального терапевтического эффекта, уменьшение кратности нанесения и переход на поддерживающую терапию.
Отличным примером многообразия форм и характеристик ТКС является линейка препаратов компании «Бауш Хелс», в которую входят Бетадерм, Латикорт Лоринден А, Лоринден С, Кловейт, Флуцинар.
Латикорт представляет собой ТКС в виде мази, действующим веществом является гидрокортизона бутират, относящийся к III, наиболее многочисленному классу сильных ТКС, согласно классификации Miller–Munro. Препарат разрешен к применению с 6-месячного возраста и может использоваться для терапии широкого спектра заболеваний кожи в подострых стадиях либо сопровождающихся лихенизацей.
Флуцинар – флуоцинолона ацетонид в виде геля и мази разрешен к применению с 2-летнего возраста. Этот ТКС также относится к классу сильных и благодаря наличию двух форм может применяться как на мокнущие участки (гель), так и на грубую, лихенизированную кожу. Флуоцинолона ацетонид легко проникает в роговой слой эпидермиса, не подвергается биотрансформации, кумулирует, что обеспечивает достижение быстрого терапевтического эффекта. Но на тонкой коже в области складок или на лице, а также на участках с поврежденным эпидермисом или на коже, пораженной острым воспалительным процессом, всасывание данного ТКС усиливается. Поэтому в этих случаях использование препарата следует ограничить, как и его применение под окклюзионную повязку, а также частое нанесение или применение на большой площади кожи.
Кловейт – клобетазола пропионат, выпускается в виде крема и мази. Две формы выпуска также позволяют применять данное средство при различных проявлениях дерматозов у больных старше 1 года. Клобетазол относится к классу сверхсильных ТКС, поэтому его целесообразно использовать для лечения устойчивых к стероидам дерматозов, при тяжелом их течении, но ограничить длительное применение Кловейта, а также на лице и так называемых участках чувствительной кожи – шея, внутренняя поверхность рук, аногенитальная область.
Бетадерм относится к комбинированным ТКС. В его состав входит бетаметазона дипропионат, относящийся к классу сильных кортикостероидов, а также гентамицин – антибиотик широкого спектра действия из группы аминогликозидов. Такой состав позволяет эффективно использовать Бетадерм в терапии дерматозов, осложненных бактериальной инфекцией. Данный ТКС выпускается в виде мази.
Лоринден А в виде мази также является комбинированным ТКС, содержит флуметазон и салициловую кислоту. Такая комбинация позволяет применять препарат при выраженном шелушении и киперкератозе, поскольку наличие салициловой кислоты способствует лучшей пенетрации кортикостероидного компонента и придает препарату дополнительное антипаракератозное, умеренное кератолитическое и местное гипотермическое свойство. Кроме этого, за счет наличия салициловой кислоты это лекарственное средство обладает антибактериальным и фунгицидным действием, а также восстанавливает барьерную функцию кожи, устраняя гиперкератоз. Однако применение на коже лица и чувствительных областей должно быть ограничено в связи с возможным раздражающим действием салицилата. Лоринден А разрешен к применению у взрослых и детей старше 2 лет.
Лоринден С представляет собой комбинацию флуметазона пивалата и клиохинола (йодхлороксихинолина), который является производным 8-оксихинолинов в виде мази. Клиохинол активен в отношении дерматофитов и дрожжевых грибов (Microsporum spp., Trichophyton spp., Candida albicans), а также грамположительных бактерий (Staphylococcus spp., Enterococcus spp.). Это позволяет применять Лоринден С при дерматозах, осложненных сочетанной инфекцией, в тех случаях, когда сложно точно идентифицировать возбудителя, но требуется скорейшее начало лечения. Кроме этого, присутствие в составе лекарственного средства клиохинола усиливает антиэкссудативное действие флуметазона. Средство выпускается в виде мази и разрешено к применению с 2-летнего возраста.
Таким образом, на примере серии ТКС компании «Бауш Хелс» мы продемонстрировали разнообразие форм и возможностей применения этих лекарственных средств. Но на сегодняшний день имеется еще большее разнообразие ТКС, позволяющих решить любые задачи, связанные с терапией острых и хронических, простых и осложненных заболеваний кожи. Поэтому даже спустя несколько десятилетий после их введения в клиническую практику ТКС являются препаратами для терапии 1-й линии при различных дерматологических заболеваниях. Несмотря на то, что стали доступны иные местные лекарственные средства для лечения ряда дерматозов, например ингибиторы кальциневрина, ценность ТКС не уменьшилась. Внедрение комбинированных ТКС позволяет решать широкий спектр терапевтических задач, особенно в случае осложненных дерматозов, либо сопровождающихся сильным шелушением, либо ороговением кожи. При этом такие лекарственные средства особенно удобны для применения больным, позволяя использовать только одно лекарственное средство, курирующее сразу несколько симптомов, что неизменно повышает уровень приверженности лечению.
Следует заметить, что, несмотря на наличие достаточно широкого выбора ТКС, в разных формах выпуска, различной терапевтической силы, поддерживать тонкий баланс между разумным использованием и частым злоупотреблением этими средствами сложно. До тех пор, пока не появятся новые и более безопасные местные кортикостероиды, бдительность врача и просвещение пациентов остаются основой решения этой растущей проблемы.
Информация об авторе
Дворянкова Евгения Викторовна – д-р мед. наук, ведущий научный сотрудник ФГБУН «Центр теоретических проблем физико-химической фармакологии» РАН

