Онкология
Терапия рака предстательной железы: комбинация андрогенной депривационной терапии с апалутамидом. Результаты клинических исследований и данные реальной практики
В 2021 г. состоялось важное для специалистов разного профиля мероприятие – XI Съезд онкологов России, на котором собралось более 1500 специалистов в области онкологии, радиологии, лучевой и инструментальной диагностики, паллиативной помощи и других смежных специальностей. Участники подняли самые актуальные вопросы, связанные с решением проблем ранней диагностики всех видов рака, ознакомились с современными методами лечения злокачественных новообразований, обменялись опытом ведения пациентов.
Так, Волкова Мария Игоревна – ведущий научный сотрудник отделения онкоурологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, врач-онколог, д.м.н., представила обновленные данные клинического исследования 3-й фазы TITAN в контексте ведения метастатического гормоночувствительного рака предстательной железы (РПЖ) [1]. Рекомендации по ведению таких пациентов в Российской Федерации изменились: пациентам показана комбинированная терапия с антиандрогенами второго поколения, абиратероном (не одобрено на территории РФ) или доцетакселом во всех случаях, за исключением противопоказаний к ней при непереносимости. Эти пациенты должны получать монотерапию. Пациенты с малым объемом метастатической нагрузки могут рассматриваться в качестве кандидатов для проведения дистанционной лучевой терапии в комбинации с АДТ, поскольку в британском многогрупповом многоступенчатом исследовании STAMPEDE (крупнейшее по изучению влияния различных режимов системной терапии при местно-распространенном и метастатическом РПЖ) было показано, что больные первичным метастатическим гормоночувствительным РПЖ, получавшие дистанционную лучевую терапию при малом объеме опухолевого поражения по определению CHAARTED (без висцеральных очагов, не более 4 костных очагов и с не одним очагом, расположенным за пределами костей таза или осевого скелета), достигают лучших показателей общей выживаемости.
Первым препаратом, показавшим свою эффективность при метастатическом гормоночувствительном РПЖ, стал доцетаксел: данные трех клинических исследований показали, что введение препарата в комплексную терапию достоверно увеличивает время до начала прогрессирования заболевания и общую выживаемость больных. Энзалутамид в двух рандомизированных исследованиях показал свою эффективность при метастатическом гормоночувствительном РПЖ по сравнению с антиандрогенами 1-го поколения (исследование ENZAMET) или с плацебо (исследование ARCHES) в плане выживаемости, времени до повышения уровня ПСА (простат-специфического антигена) и клинического прогрессирования, причем наилучшие результаты наблюдались у пациентов при малом объеме опухолевой нагрузки и у больных, ранее не получавших доцетаксел на этапе гормональной чувствительности. Также в исследовании ARCHES показано преимущество в плане радиологической беспрогрессивной выживаемости в группе пациентов, получавших комбинацию энзалутамида и андрогенную депривационную терапию по сравнению с АДТ в большинстве подгрупп пациентов [2].
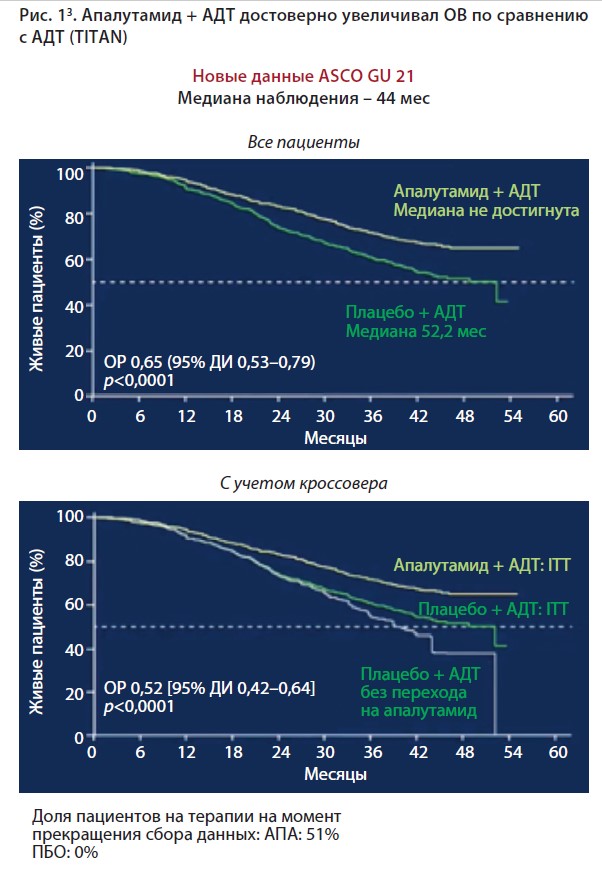
Апалутамид – нестероидный антиандроген, обладающий крайне высоким аффинитетом к андрогенным рецепторам. Препарат изучался при метастатическом гормоно-чувствительном раке предстательной железы в рандомизированном исследовании 3-й фазы TITAN1. Исследование включало 1052 больных, к участию допускались лица со сниженным соматическим статусом, тяжестью состояния 1 по шкале ECOG, было допустимо проведение АДТ в течение 6 мес при метастатической форме болезни или в течение не более 3 лет при неметастатической форме гормоночувствительного рака, а также получавших доцетаксел ранее. Пациенты были разделены на две группы: первая получала апалутамид и АДТ, вторая – плацебо и АДТ. В 2021 г. были доложены обновленные результаты исследования TITAN, показавшие, что даже с учетом кроссовера (перехода 40% пациентов из группы плацебо на апалутамид) разница между группами оказалась весьма существенной, а после коррекции общей выживаемости (ОВ) с учетом этого перехода снижение риска смерти на фоне лечения апалутамидом+АДТ составило 48%. Апалутамид достоверно обеспечивал преимущество по ОВ (рис. 1) по сравнению с плацебо, при этом объем метастатического поражения не оказывал влияния на эффективность терапии. Кроме того, апалутамид достоверно увеличивал радиологическую беспрогрессивную выживаемость, снижая риск прогрессирования и смерти на 52% по сравнению с группой контроля независимо от распространенности опухолевого процесса, локализации метастазов и объема метастатической нагрузки.
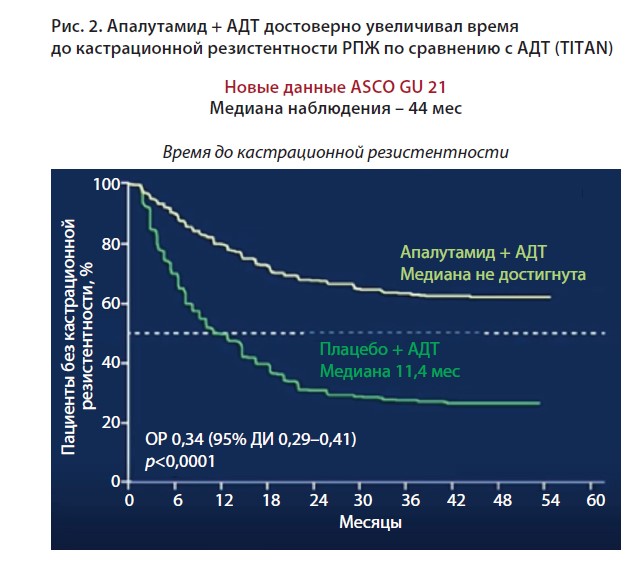
Было показано, что апалутамид значимо увеличивал время до кастрационной резистентности РПЖ (рис. 2). Поскольку сроки наблюдения были довольно большими, некоторые пациенты успели получить первую последующую системную терапию как новыми гормональными препаратами, так и таксанами. Через 44 мес апалутамид уверено продемонстрировал увеличение выживаемости без повторного прогрессирования. Это свидетельствует о том, что ранняя интенсификация лечения больных метастатическим гормоночувствительным РПЖ не ухудшает результатов последующей терапии. Кроме того, назначение апалутамида и АДТ достоверно увеличивало время до химиотерапии по сравнению с моно АДТ.
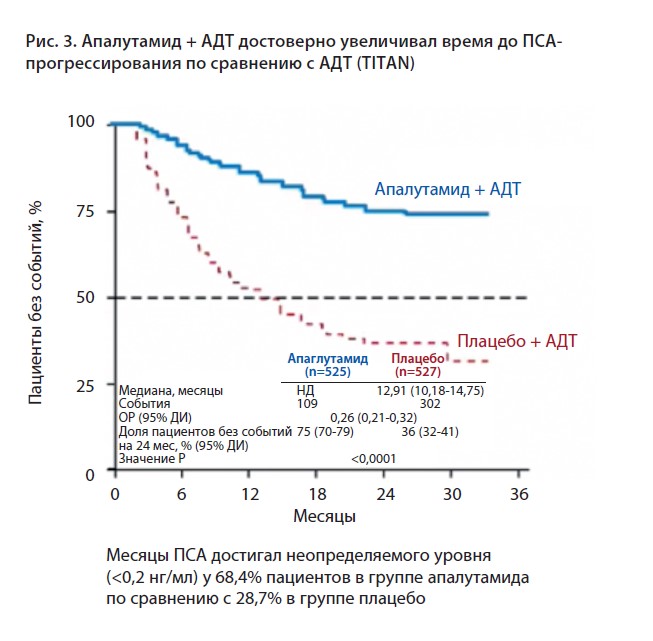
Также апалутамид достоверно увеличивал время до ПСА-прогрессирования, причем ПСА достигал неопределяемого уровня (<0,2 нг/мл) у 68,4% пациентов в группе апалутамида по сравнению с 28,7% в группе плацебо (рис. 3).
Что касается профиля безопасности, то в группе апалутамида частота нежелательных явлений была сопоставима с плацебо, что является свидетельством хорошей переносимости препарата.
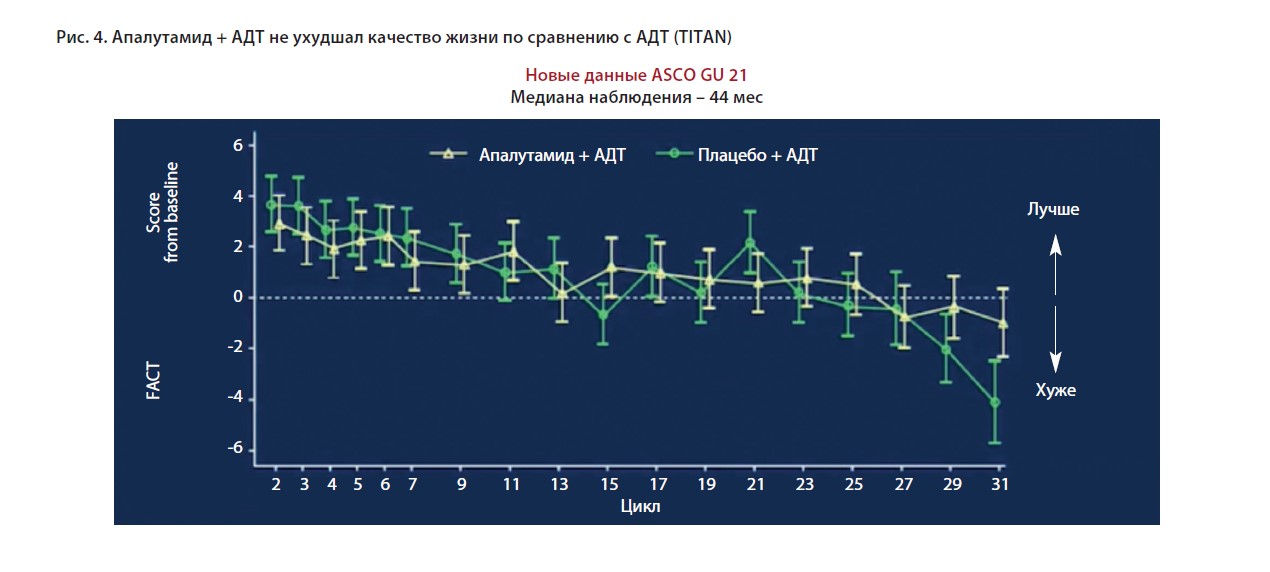
Важным показателем, отражающим эффективность и переносимость лечения, становится качество жизни пациента. Показано, что апалутамид не ухудшал качество жизни по сравнению с плацебо.
АДТ в сочетании с апалутамидом сопоставимо увеличивают радиологическую беспрогрессивную выживаемость по сравнению с АДТ (непрямое сравнение). Согласно российским рекомендациям, апалутамид рекомендован для терапии метастатического гормоночувствительного РПЖ в комбинации с АДТ и может назначаться при любом объеме опухоли, при этом антиандрогены 2-го поколения демонстрируют наиболее достойный профиль безопасности.
Интересные клинические случаи пациентов с метастатическим гормоночувствительным РПЖ представил Климов Алексей Вячеславович – онколог, старший научный сотрудник хирургического отделения №4 (онкоурологии) ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, к.м.н.
Первое клиническое наблюдение. Пациент 67 лет, пенсионер, инвалид 2-й группы по сопутствующим заболеваниям [ишемическая болезнь сердца (ИБС), острый инфаркт миокарда 2 года назад, артериальная гипертензия (АГ) кризового течения]. Поступил с жалобами на дизурию, никтурию, ПСА 153 нг/мл. После проведения магнитно-резонансной томографии (МРТ) пациенту установлен диагноз: рак простаты сT3b, определены тазовые лимфатические узлы до 2 см. Биопсия предстательной железы (ПЖ) показала аденокарциному 3+4=7 баллов по Глисону, по данным сцинтиграфии – поражение костей скелета M1b (менее 10 очагов в позвонках и ребрах). С учетом современных рекомендаций пациенту назначается комбинированная терапия агонистом лютеинизирующего гормона рилизинг-гормона (ЛГРГ) и антиандроген 2-го поколения апалутамид. Через 3 мес отмечено снижение ПСА до 7,6 нг/мл (практически в 4 раза). У пациента отмечается астения, которая хорошо переносится и не ухудшает качество жизни. К 7-му месяцу терапии у пациента купируются дизурические расстройства, ПСА снижается до 2,8 нг/мл, происходит стабилизация опухолевого процесса. Через 12 мес пациент выходит на плато – ПСА составляет 1,1 нг/мл. Терапия продолжается в течение 23 мес.
Второе клиническое наблюдение. Пациент 63 лет, строитель. Сопутствующие заболевания: АГ 2-й степени, сахарный диабет (СД) 2-го типа инсулинонепотребный в стадии компенсации. При диспансерном плановом осмотре предъявляет жалобы на малоинтенсивную боль в костях, которую связывает с профессиональной деятельностью. ПСА 16 нг/мл. По данным трансректального ультразвукового исследования (УЗИ) заподозрен рак простаты cT3b. Биопсия ПЖ подтверждает аденокарциному 4+5=9 баллов по Глисону, определяется более 10 метастазов в костях. По данным компьютерной томографии (КТ): N1 метастазы в тазовых (ТЛУ; 2,2 см) и забрюшинных лимфатических узлах (ЗЛУ; 2,0 см). Пациент начинает терапию с агониста ЛГРГ и антиандрогена 2-го поколения апалутамида. Через 3 мес отмечено снижение ПСА до 3,8 нг/мл, при этом сохранялась малоинтенсивная боль в костях, объем метастазов в лимфоузлах оставался прежним. К концу 9-го месяца ПСА снизился до 1,4 нг/мл, купирована боль в костях, метастазы уменьшились в размерах (ТЛУ до 1,3 см, ЗЛУ до 1,1 см). Присоединяется астения 1-й степени, не влияющая на качество жизни и не требующая коррекции терапии. Учитывая эффективность лечения, пациент продолжает терапию до 12 мес (ПСА 1,1 нг/мл), а затем и до 19 мес (ПСА 0,8 нг/мл), на протяжении которых сохраняется стабилизация опухолевого процесса и отсутствие жалоб.
Третье клиническое наблюдение. Пациент 59 лет, строитель. Тяжелых сопутствующих заболеваний и жалоб нет, на приеме у уролога выявлен ПСА 12 нг/мл. После выполнения трансректального УЗИ заподозрен рак простаты cT2b. При комплексном обследовании не выявлено отдаленных проявлений болезни, по биопсии выявлена аденокарцинома 3+3=6 баллов по Глисону. Пациенту проведена радикальная простатэктомия, во время которой обнаружен выход опухоли за капсулу ПЖ, определен метастаз в лимфатическом узле и положительный хирургический край резекции. Скорректирован диагноз: pT3aN1M0R+ сумма Глисона 4+3=7 баллов. Пациент является кандидатом для проведения адъювантной лучевой терапии. Через месяц ПСА не достиг ожидаемого снижения (0,8 нг/мл). После восстановления мочеиспускания (через 3 мес) на уровне ПСА 1,3 нг/мл назначены адъювантная дистанционная лучевая терапия на фоне АДТ сроком на 24 мес. К сожалению, к концу лучевой терапии у пациента развились ректит и цистит 1-й степени, пациенту продолжена АДТ. Через 6 мес ПСА составила 0,2 нг/мл, к концу двухлетнего периода – 0,04 нг/мл, после 40 мес – 0,2 нг/мл, после 48 мес – 1,0 нг/мл. Некоторое время больной не консультировался у врача, а по прошествии 66 мес обратился с жалобами на малоинтенсивную боль в костях. ПСА составляет 65 нг/мл, найдено более 10 метастазов в костях по данным сцинтиграфии, висцеральные метастазы не обнаружены. Таким образом, развился рецидив заболевания с поражением костей скелета. Пациенту с метастатическим гормоночувствительным раком простаты назначены АДТ в сочетании с апалутамидом, через 70 мес (4 мес на фоне последней терапии) ПСА составляет 19 нг/мл, болевой синдром отсутствует. Сцинтиграфия не выявляет новых метастазов. Через 81 мес (через 15 мес комбинированного лечения) ПСА снижается до 1,3 нг/мл. Нежелательных явлений на фоне терапии не отмечается.
Таким образом, согласно Клиническим рекомендациям Минздрава РФ, новые антиандрогены – одна из рекомендованных опций в лечении пациентов с метастатическим гормоночувствительным РПЖ. Основываясь на данных клинических исследований этой группы препаратов, антиандрогены нового поколения улучшают показатели текущей терапии – продлевают жизнь пациентов, отдалив переход на стадию мКРРПЖ минимально на 3,5 года. Применение антиандрогенов нового поколения не влияет на качество жизни больного.
Инструкция по медицинскому применению препарата Эрлеада (апалутамид) ЛП-005797*: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=043c101d-9cb8-4f7b-99ed-c06653c74e55&t=
*Перед применением необходимо ознакомиться с полным текстом инструкции по медицинскому применению.
ООО «Джонсон & Джонсон», Россия, 121614, Москва, ул. Крылатская, д. 17, корп. 2. Контактные тел.: (495) 755-83-57, факс: (495) 755-83-58.
Материал предназначен для медицинских и фармацевтических работников.
CP-258235

