Тольяттинский медицинский консилиум 2015
D.A. Svirskii, D.N. Uvarov, E.E. Antipin
Резюме
В ходе проспективного рандомизированного исследования качества послеоперационной мультимодальной анальгезии методом блокады нервов нейрофасциального пространства живота, в сочетании с ненаркотическими анальгетиками при оперативном родоразрешении, удалось выявить ряд преимуществ её использования, в сравнении с традиционной методикой обезболивания.
Ключевые слова: оперативное родоразрешение, мультимодальная послеоперационная анальгезия, блокада нервов нейрофасциального пространства живота (БННПЖ)
Abstract
In a randomized controlled blinded clinical trial we evaluated the analgesic efficacy of transversus abdominis plane (TAP) block in patients undergoing operative delivery.
METHODS: Sixty-two adult patients undergoing operative delivery were randomized to undergo standard care (n=31) or to undergo a bilateral US-guided TAP-block with bupivacaine (n=31). All participants received a spinal anaesthetic with bupivacaine. In addition, all patients received non-steroidal anti-inflammatory drug, as required, in the postoperative period. Each patient was assessed 24 h after delivery for opioid usage, vital capacity of the lungs, glucose and cortisol levels, vas pain score at rest and on movement, nausea, vomiting, pruritus, drowsiness, and satisfaction with pain relief.
RESULTS: Ultrasound-guided TAP block significantly reduced postoperative opioid consumption in the first 24 h. Postoperative visual analogue scale pain scores were also reduced in the TAP block group at 12h at rest [Me10 (0;20) vs 20 (10;25), P<0.005]; at 12h on movement [Me 20 (10;25) vs 35(20;50), P<0.005] and at 24 h at rest [Ме 5(0;15) vs 10 (5;20), P=0.001]; at 24h on movement [Ме 10 (5;20) vs 25 (15;30). P=0.0001]. There were no complications attributable to the TAP block.
CONCLUSIONS: The US-guided TAP block reduces opioid requirements after Caesarean delivery when used as a component of a multimodal analgesic regimen
Keywords: Cesarean section, multimodal postoperative analgesia, transversus abdominis plane block (TAP-block)
Одним из важнейших этапов периоперационного ведения пациента является надёжная послеоперационная анальгезия, способствующая ранней активизации и повышающая послеоперационный комфорт [1, 2, 3]. В настоящее время за рубежом существует немало статей об эффективности и преимуществах использования блокады нервов нейрофасциального пространства живота (БННПЖ) при кесаревом сечении в сравнении с другими возможными способами послеоперационной анальгезии, однако в российской периодической печати этих работ по прежнему недостаточно [4].
Материалы и методы. В основу проспективного рандомизированного исследования положены результаты анализа качества и уровня обезболивания в раннем послеоперационном периоде у 62 пациенток, перенесших операцию планового кесарева сечения с разрезом по Пфанненштилю в условиях спинальной анестезии 0,5% раствором гипербарического бупивакаина на уровне L3–L4. В группе исследования (31 чел.) послеоперационная анальгезия проводилась методом билатеральной блокады нервов нейрофасциального пространства живота под контролем ультразвука в сочетании с НПВП и парацетамолом, в группе сравнения (31 чел.) послеоперационное обезболивание проводилось методом опиоидной анальгезии в сочетании с НПВП и парацетамолом.
Пункция нейрофасциального пространства живота производилась в операционной после завершения операции при положении пациентки на спине в асептических условиях. После ультразвуковой визуализации всех слоёв брюшной стенки на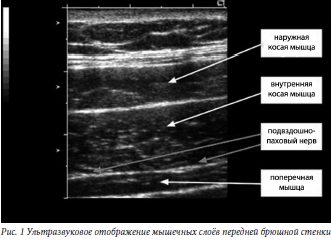 боковой поверхности живота (см. рис. 1) игла направлялась соостно датчику через наружную и внутреннюю косые мышцы живота к нейрофасциальному пространству, расположенному между внутренней косой и поперечной мышцами.
боковой поверхности живота (см. рис. 1) игла направлялась соостно датчику через наружную и внутреннюю косые мышцы живота к нейрофасциальному пространству, расположенному между внутренней косой и поперечной мышцами.
ивакаина гидрохлорида (Маркаин, AstraZeneca) в объеме 20 мл с обеих сторон. Точность введения МА также контролировалось с помощью ультразвука, что исключало ошибочное введение препарата.
В течение первых суток после операции в основной группе послеоперационная анальгезия в комбинации с БННПЖ проводилась назначением НПВП (кетопрофен 100 мг внутримышечно дважды в сутки) и парацетамола (внутривенно по 1г каждые 8 часов).
В группе сравнения за тридцать минут до предполагаемой регрессии спинального блока проводилась инфузия 1г парацетамола. В дальнейшем парацетамол вводили с интервалом 1 г каждые 6 часов. НПВП (кетопрофен) назначался из расчёта 100 мг каждые 8-12 часов. Инъекции наркотических анальгетиков (трамадол 100 мг) производились по назначению врача, а также по требованию пациентки – при недостаточно эффективном купировании болевого синдрома.
Оценка качества и адекватности анальгезии проводилась с помощью 100-миллиметровой визуально-аналоговой шкалы (ВАШ) в покое и при кашле на этапах: после регрессии спинального блока, через 12 и 24 часа после операции. Болевое торможение функции внешнего дыхания оценивали путем измерения на этапах исследования жизненной ёмкости лёгких при помощи спирометрии. Биохимические исследования были направлены на оценку содержания в венозной крови глюкозы фотометрическим глюкометром и кортизола в свежезамороженной плазме методом твердофазного иммуноферментного анализа с использованием моноклональных антител. На основе клинической оценки сравнивали частоту возникновения и выраженность побочных эффектов, обусловленных анальгезией, обращали внимание на развитие избыточной седации, кожного зуда, задержку мочи и появление тошноты и рвоты.
На протяжении всего периода наблюдения уровень обезболивания соответствовал основному критерию адекватности анальгезии и не превышал 30 мм отметки по ВАШ в состоянии покоя и 40 мм – при кашле. При исходной оценке боли по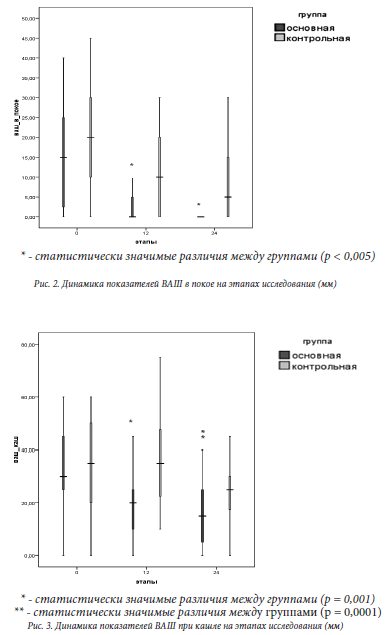 ВАШ достоверных межгрупповых отличий выявлено не было (см. рис. 2, 3). При последующем наблюдении в обеих группах отмечалась положительная динамика снижения выраженности болевого синдрома в покое и при кашле. На этапе 12 часового исследования показатели ВАШ в покое составляли в среднем 10 (0; 20) мм - в основной группе и 20 (10; 25) мм - в контрольной.
ВАШ достоверных межгрупповых отличий выявлено не было (см. рис. 2, 3). При последующем наблюдении в обеих группах отмечалась положительная динамика снижения выраженности болевого синдрома в покое и при кашле. На этапе 12 часового исследования показатели ВАШ в покое составляли в среднем 10 (0; 20) мм - в основной группе и 20 (10; 25) мм - в контрольной.
На этом же этапе показатели оценки ВАШ при кашле составили 20 (10; 25) мм и 35 (20; 50) мм, соответственно.
В обоих случаях показателя имели статистически значимую межгрупповую разницу. Высокий уровень анальгезии сохранялся до конца исследования, к концу первых суток показатели ВАШ в покое составили в основной группе Ме 5(0; 15) мм и 10 (5; 20) мм - в контрольной, при кашле – 10 (5; 20) и 25 (15; 30) мм, соответственно (р=0,0001). Таким образом, мы получили статистически значимую разницу значений ВАШ в покое и при кашле между исследуемыми группами на этапе 12 и 24 часа после операции.
В целом, оценка динамики болевого синдрома у родильниц в состоянии покоя и при кашле по ВАШ свидетельствует, что использование БННПЖ в качестве компонента мультимодальной анальгезии достоверно улучшает эффективность послеоперационного обезболивания по сравнению с традиционным режимом системной опиоидной анальгезии.
Анализируя полученные значения концентрации кортизола в плазме крови, можно прийти к выводу об отсутствии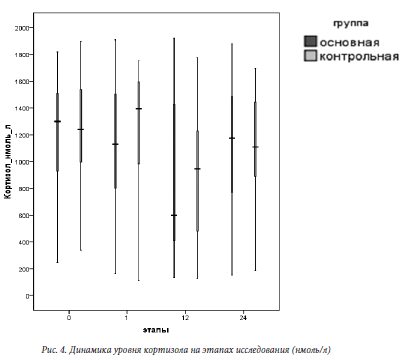 статистически значимых межгрупповых различий на всех этапах исследования (см рис. 4). Изменения концентрации кортизола в ходе исследования соответствовали физиологической суточной динамике данного показателя и не превышали физиологической нормы, что позволяет говорить об адекватной стресс модуляции организма родильниц в ответ на операционную травму в первые 24 часа послеоперационного периода.
статистически значимых межгрупповых различий на всех этапах исследования (см рис. 4). Изменения концентрации кортизола в ходе исследования соответствовали физиологической суточной динамике данного показателя и не превышали физиологической нормы, что позволяет говорить об адекватной стресс модуляции организма родильниц в ответ на операционную травму в первые 24 часа послеоперационного периода.
Глюкоза является маркером эндокринного стресс-ответа на операционную травму и боль. При исследовании уровня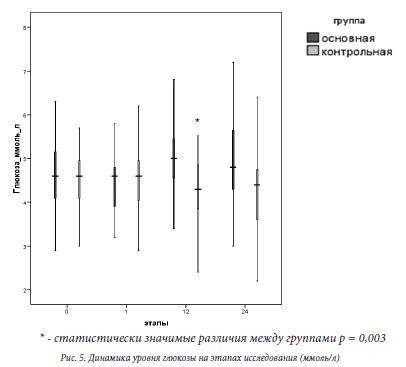 гликемии у пациенток статистически значимые различия были выявлены лишь на этапе 12 часов после операции (см.рис.5).
гликемии у пациенток статистически значимые различия были выявлены лишь на этапе 12 часов после операции (см.рис.5).
Уровень сахара крови был значимо выше в основной группе и составлял по Ме 4,8 (4,5; 5,5) ммоль/л против 4,3 (3,8; 4,9) ммоль/л – в контрольной группе. Полученную разницу можно объяснить более ранней активизацией и началом питания родильниц в основной группе. Пациентки контрольной группы вследствие применения опиоидных анальгетиков были седатированы и ввиду этого не имели стимулов к ранней активизации. Напротив, родильницы из основной группы практически сразу после регрессии спинального блока вели себя активно - начинали садиться, ходить по палате и в туалет, раньше начинали принимать пищу и проводили больше времени в уходе за новорожденными. К концу первых суток различия по уровню глюкозы в крови исчезали.
Оценивая показатели ЖЕЛ на этапах исследования мы обнаружили через 12 часов заметную - Ме 2500 (2200; 2900) в основной и 2200 (1800; 2800) мл в контрольной и статистически значимую разницу – Ме 2800 (2200; 3000) и 2200 (1800; 2800) мл (р=0,014), в группах соответственно, к концу первых суток после операции (см. рис. 6).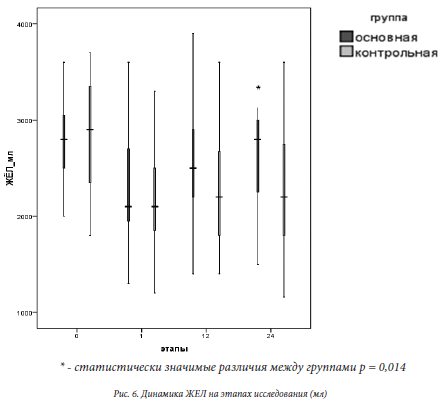
и позволяет сделать вывод о хорошем купировании болевого тормоза глубокого дыхания из операционной раны и эффективной профилактике дыхательных осложнений в раннем послеоперационном периоде при использовании БННПЖ. Это в очередной раз подчёркивает преимущество БННПЖ перед системной анальгезией для послеоперационного обезболивания.
Говоря о побочных эффектах исследуемых методов послеоперационной анальгезии, можно сказать, что в основной группе их удалось полностью избежать, в то время как в контрольной группе у 45,2% пациенток отмечалась избыточная седация, а у 19,4% - тошнота или рвота, в одном случае отмечено развитие кожного зуда.
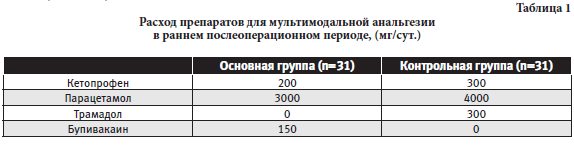
В основной группе удалось полностью избежать использования наркотических анальгетиков. Дополнительно необходимо отметить, что, в целом, в контрольной группе расход анальгетиков был значительно больше (см. табл. 1).
Резюмируя вышеизложенное, а также литературные данные [5, 6, 7], очевидно, что использование БННПЖ как компонента мультимодальной послеоперационной анальгезии при операции планового кесарева сечения позволяет отказаться от использования наркотических анальгетиков при улучшении качества обезболивания, полностью избежать при этом паранаркотических побочных эффектов, увеличить скорость восстановления родильницы после операционного стресса и повысить её послеоперационный комфорт.
Применение блокады нервов нейрофасциального пространства живота под ультразвуковой навигацией в сочетании с НПВП и парацетамолом для послеоперационной анальгезии при кесаревом сечении улучшает качество обезболивания по сравнению с системной опиоидной анальгезией трамадолом.
Использование БННПЖ в сравнении с системной опиоидной анальгезией при кесаревом сечении обеспечивает значимое улучшение показателя ЖЕЛ через 24 часа после операции и стабильное содержание кортизола и глюкозы в венозной крови в пределах физиологической нормы.
Использование БННПЖ в сочетании с НПВП и парацетамолом позволяет полностью отказаться от наркотических анальгетиков и избежать в раннем послеоперационном периоде побочных эффектов в виде избыточной седации, диспептических явлений и кожного зуда.
ГБУЗ АО «Архангельский клинический родильный дом им. К.Н. Самойловой».
163060, Архангельск, ул. Тимме, 1. Тел. 89025047505.
e-mail: dsvirskiy@mail.ru.
Уваров Денис Николаевич – к.м.н., врач-анестезиолог-реаниматолог
ГБУ ВПО «СГМУ Минздрава России». 163045, г. Архангельск,
Троицкий проспект, д.51. Тел. 89116860583.
e-mail: loybikanah@mail.ru.
Антипин Эдуард Эдуардович – к.м.н., врач-анестезиолог-реаниматолог
ГБУЗ АО «Архангельский клинический родильный дом им. К.Н. Самойловой».
163060, г. Архангельск, ул. Тимме, 1. Тел. 89600114083.
e-mail: vard67@mail.ru.
Тольяттинский медицинский консилиум 2015
№05-06 2015
Эффективность послеоперационной мультимодальной анальгезии с использованием блокады нервов нейрофасциального пространства живота №05-06 2015
Номера страниц в выпуске:27-32
В ходе проспективного рандомизированного исследования качества послеоперационной мультимодальной анальгезии методом блокады нервов нейрофасциального пространства живота, в сочетании с ненаркотическими анальгетиками при оперативном родоразрешении, удалось выявить ряд преимуществ её использования, в сравнении с традиционной методикой обезболивания.
Ключевые слова: оперативное родоразрешение, мультимодальная послеоперационная анальгезия, блокада нервов нейрофасциального пространства живота (БННПЖ)
Ключевые слова: оперативное родоразрешение, мультимодальная послеоперационная анальгезия, блокада нервов нейрофасциального пространства живота (БННПЖ)
The analgesic efficacy of transversus abdominis plane block as a part of multimodal analgesia
D.A. Svirskii, D.N. Uvarov, E.E. Antipin
Резюме
В ходе проспективного рандомизированного исследования качества послеоперационной мультимодальной анальгезии методом блокады нервов нейрофасциального пространства живота, в сочетании с ненаркотическими анальгетиками при оперативном родоразрешении, удалось выявить ряд преимуществ её использования, в сравнении с традиционной методикой обезболивания.
Ключевые слова: оперативное родоразрешение, мультимодальная послеоперационная анальгезия, блокада нервов нейрофасциального пространства живота (БННПЖ)
Abstract
In a randomized controlled blinded clinical trial we evaluated the analgesic efficacy of transversus abdominis plane (TAP) block in patients undergoing operative delivery.
METHODS: Sixty-two adult patients undergoing operative delivery were randomized to undergo standard care (n=31) or to undergo a bilateral US-guided TAP-block with bupivacaine (n=31). All participants received a spinal anaesthetic with bupivacaine. In addition, all patients received non-steroidal anti-inflammatory drug, as required, in the postoperative period. Each patient was assessed 24 h after delivery for opioid usage, vital capacity of the lungs, glucose and cortisol levels, vas pain score at rest and on movement, nausea, vomiting, pruritus, drowsiness, and satisfaction with pain relief.
RESULTS: Ultrasound-guided TAP block significantly reduced postoperative opioid consumption in the first 24 h. Postoperative visual analogue scale pain scores were also reduced in the TAP block group at 12h at rest [Me10 (0;20) vs 20 (10;25), P<0.005]; at 12h on movement [Me 20 (10;25) vs 35(20;50), P<0.005] and at 24 h at rest [Ме 5(0;15) vs 10 (5;20), P=0.001]; at 24h on movement [Ме 10 (5;20) vs 25 (15;30). P=0.0001]. There were no complications attributable to the TAP block.
CONCLUSIONS: The US-guided TAP block reduces opioid requirements after Caesarean delivery when used as a component of a multimodal analgesic regimen
Keywords: Cesarean section, multimodal postoperative analgesia, transversus abdominis plane block (TAP-block)
Введение
Одним из важнейших этапов периоперационного ведения пациента является надёжная послеоперационная анальгезия, способствующая ранней активизации и повышающая послеоперационный комфорт [1, 2, 3]. В настоящее время за рубежом существует немало статей об эффективности и преимуществах использования блокады нервов нейрофасциального пространства живота (БННПЖ) при кесаревом сечении в сравнении с другими возможными способами послеоперационной анальгезии, однако в российской периодической печати этих работ по прежнему недостаточно [4].
Материалы и методы. В основу проспективного рандомизированного исследования положены результаты анализа качества и уровня обезболивания в раннем послеоперационном периоде у 62 пациенток, перенесших операцию планового кесарева сечения с разрезом по Пфанненштилю в условиях спинальной анестезии 0,5% раствором гипербарического бупивакаина на уровне L3–L4. В группе исследования (31 чел.) послеоперационная анальгезия проводилась методом билатеральной блокады нервов нейрофасциального пространства живота под контролем ультразвука в сочетании с НПВП и парацетамолом, в группе сравнения (31 чел.) послеоперационное обезболивание проводилось методом опиоидной анальгезии в сочетании с НПВП и парацетамолом.
Пункция нейрофасциального пространства живота производилась в операционной после завершения операции при положении пациентки на спине в асептических условиях. После ультразвуковой визуализации всех слоёв брюшной стенки на
 боковой поверхности живота (см. рис. 1) игла направлялась соостно датчику через наружную и внутреннюю косые мышцы живота к нейрофасциальному пространству, расположенному между внутренней косой и поперечной мышцами.
боковой поверхности живота (см. рис. 1) игла направлялась соостно датчику через наружную и внутреннюю косые мышцы живота к нейрофасциальному пространству, расположенному между внутренней косой и поперечной мышцами. ивакаина гидрохлорида (Маркаин, AstraZeneca) в объеме 20 мл с обеих сторон. Точность введения МА также контролировалось с помощью ультразвука, что исключало ошибочное введение препарата.
В течение первых суток после операции в основной группе послеоперационная анальгезия в комбинации с БННПЖ проводилась назначением НПВП (кетопрофен 100 мг внутримышечно дважды в сутки) и парацетамола (внутривенно по 1г каждые 8 часов).
В группе сравнения за тридцать минут до предполагаемой регрессии спинального блока проводилась инфузия 1г парацетамола. В дальнейшем парацетамол вводили с интервалом 1 г каждые 6 часов. НПВП (кетопрофен) назначался из расчёта 100 мг каждые 8-12 часов. Инъекции наркотических анальгетиков (трамадол 100 мг) производились по назначению врача, а также по требованию пациентки – при недостаточно эффективном купировании болевого синдрома.
Оценка качества и адекватности анальгезии проводилась с помощью 100-миллиметровой визуально-аналоговой шкалы (ВАШ) в покое и при кашле на этапах: после регрессии спинального блока, через 12 и 24 часа после операции. Болевое торможение функции внешнего дыхания оценивали путем измерения на этапах исследования жизненной ёмкости лёгких при помощи спирометрии. Биохимические исследования были направлены на оценку содержания в венозной крови глюкозы фотометрическим глюкометром и кортизола в свежезамороженной плазме методом твердофазного иммуноферментного анализа с использованием моноклональных антител. На основе клинической оценки сравнивали частоту возникновения и выраженность побочных эффектов, обусловленных анальгезией, обращали внимание на развитие избыточной седации, кожного зуда, задержку мочи и появление тошноты и рвоты.
Результаты исследования и их обсуждение
На протяжении всего периода наблюдения уровень обезболивания соответствовал основному критерию адекватности анальгезии и не превышал 30 мм отметки по ВАШ в состоянии покоя и 40 мм – при кашле. При исходной оценке боли по
 ВАШ достоверных межгрупповых отличий выявлено не было (см. рис. 2, 3). При последующем наблюдении в обеих группах отмечалась положительная динамика снижения выраженности болевого синдрома в покое и при кашле. На этапе 12 часового исследования показатели ВАШ в покое составляли в среднем 10 (0; 20) мм - в основной группе и 20 (10; 25) мм - в контрольной.
ВАШ достоверных межгрупповых отличий выявлено не было (см. рис. 2, 3). При последующем наблюдении в обеих группах отмечалась положительная динамика снижения выраженности болевого синдрома в покое и при кашле. На этапе 12 часового исследования показатели ВАШ в покое составляли в среднем 10 (0; 20) мм - в основной группе и 20 (10; 25) мм - в контрольной. На этом же этапе показатели оценки ВАШ при кашле составили 20 (10; 25) мм и 35 (20; 50) мм, соответственно.
В обоих случаях показателя имели статистически значимую межгрупповую разницу. Высокий уровень анальгезии сохранялся до конца исследования, к концу первых суток показатели ВАШ в покое составили в основной группе Ме 5(0; 15) мм и 10 (5; 20) мм - в контрольной, при кашле – 10 (5; 20) и 25 (15; 30) мм, соответственно (р=0,0001). Таким образом, мы получили статистически значимую разницу значений ВАШ в покое и при кашле между исследуемыми группами на этапе 12 и 24 часа после операции.
В целом, оценка динамики болевого синдрома у родильниц в состоянии покоя и при кашле по ВАШ свидетельствует, что использование БННПЖ в качестве компонента мультимодальной анальгезии достоверно улучшает эффективность послеоперационного обезболивания по сравнению с традиционным режимом системной опиоидной анальгезии.
Анализируя полученные значения концентрации кортизола в плазме крови, можно прийти к выводу об отсутствии
 статистически значимых межгрупповых различий на всех этапах исследования (см рис. 4). Изменения концентрации кортизола в ходе исследования соответствовали физиологической суточной динамике данного показателя и не превышали физиологической нормы, что позволяет говорить об адекватной стресс модуляции организма родильниц в ответ на операционную травму в первые 24 часа послеоперационного периода.
статистически значимых межгрупповых различий на всех этапах исследования (см рис. 4). Изменения концентрации кортизола в ходе исследования соответствовали физиологической суточной динамике данного показателя и не превышали физиологической нормы, что позволяет говорить об адекватной стресс модуляции организма родильниц в ответ на операционную травму в первые 24 часа послеоперационного периода.Глюкоза является маркером эндокринного стресс-ответа на операционную травму и боль. При исследовании уровня
 гликемии у пациенток статистически значимые различия были выявлены лишь на этапе 12 часов после операции (см.рис.5).
гликемии у пациенток статистически значимые различия были выявлены лишь на этапе 12 часов после операции (см.рис.5). Уровень сахара крови был значимо выше в основной группе и составлял по Ме 4,8 (4,5; 5,5) ммоль/л против 4,3 (3,8; 4,9) ммоль/л – в контрольной группе. Полученную разницу можно объяснить более ранней активизацией и началом питания родильниц в основной группе. Пациентки контрольной группы вследствие применения опиоидных анальгетиков были седатированы и ввиду этого не имели стимулов к ранней активизации. Напротив, родильницы из основной группы практически сразу после регрессии спинального блока вели себя активно - начинали садиться, ходить по палате и в туалет, раньше начинали принимать пищу и проводили больше времени в уходе за новорожденными. К концу первых суток различия по уровню глюкозы в крови исчезали.
Оценивая показатели ЖЕЛ на этапах исследования мы обнаружили через 12 часов заметную - Ме 2500 (2200; 2900) в основной и 2200 (1800; 2800) мл в контрольной и статистически значимую разницу – Ме 2800 (2200; 3000) и 2200 (1800; 2800) мл (р=0,014), в группах соответственно, к концу первых суток после операции (см. рис. 6).

и позволяет сделать вывод о хорошем купировании болевого тормоза глубокого дыхания из операционной раны и эффективной профилактике дыхательных осложнений в раннем послеоперационном периоде при использовании БННПЖ. Это в очередной раз подчёркивает преимущество БННПЖ перед системной анальгезией для послеоперационного обезболивания.
Говоря о побочных эффектах исследуемых методов послеоперационной анальгезии, можно сказать, что в основной группе их удалось полностью избежать, в то время как в контрольной группе у 45,2% пациенток отмечалась избыточная седация, а у 19,4% - тошнота или рвота, в одном случае отмечено развитие кожного зуда.
В основной группе удалось полностью избежать использования наркотических анальгетиков. Дополнительно необходимо отметить, что, в целом, в контрольной группе расход анальгетиков был значительно больше (см. табл. 1).

Резюмируя вышеизложенное, а также литературные данные [5, 6, 7], очевидно, что использование БННПЖ как компонента мультимодальной послеоперационной анальгезии при операции планового кесарева сечения позволяет отказаться от использования наркотических анальгетиков при улучшении качества обезболивания, полностью избежать при этом паранаркотических побочных эффектов, увеличить скорость восстановления родильницы после операционного стресса и повысить её послеоперационный комфорт.
Выводы
Применение блокады нервов нейрофасциального пространства живота под ультразвуковой навигацией в сочетании с НПВП и парацетамолом для послеоперационной анальгезии при кесаревом сечении улучшает качество обезболивания по сравнению с системной опиоидной анальгезией трамадолом.
Использование БННПЖ в сравнении с системной опиоидной анальгезией при кесаревом сечении обеспечивает значимое улучшение показателя ЖЕЛ через 24 часа после операции и стабильное содержание кортизола и глюкозы в венозной крови в пределах физиологической нормы.
Использование БННПЖ в сочетании с НПВП и парацетамолом позволяет полностью отказаться от наркотических анальгетиков и избежать в раннем послеоперационном периоде побочных эффектов в виде избыточной седации, диспептических явлений и кожного зуда.
Для корреспонденции
Свирский Дмитрий Алексеевич – к.м.н., врач-анестезиолог-реаниматологГБУЗ АО «Архангельский клинический родильный дом им. К.Н. Самойловой».
163060, Архангельск, ул. Тимме, 1. Тел. 89025047505.
e-mail: dsvirskiy@mail.ru.
Уваров Денис Николаевич – к.м.н., врач-анестезиолог-реаниматолог
ГБУ ВПО «СГМУ Минздрава России». 163045, г. Архангельск,
Троицкий проспект, д.51. Тел. 89116860583.
e-mail: loybikanah@mail.ru.
Антипин Эдуард Эдуардович – к.м.н., врач-анестезиолог-реаниматолог
ГБУЗ АО «Архангельский клинический родильный дом им. К.Н. Самойловой».
163060, г. Архангельск, ул. Тимме, 1. Тел. 89600114083.
e-mail: vard67@mail.ru.
Список исп. литературыСкрыть списокОвечкин А. М., Гнездилов А. В., Кукушкин М. Л. Профилактика послеоперационной боли, патогенетические основы и клиническое применение // Анестезиология и реаниматология. 2000. № 5. С. 71–76.
Овечкин А. М., Карпов И. А., Люосев С. В. Послеоперационное обезболивание в абдоминальной хирургии, новый взгляд на старую проблему // Анестезиология и реаниматология. 2003. № 5. С. 45–50.
Овечкин А. М., Романова Т. Л. Послеоперационное обезболивание : оптимизация подходов с точки зрения доказательной медицины // Рус. мед. журн. 2008. Т. 14, № 12. С. 865–872.
Effects of maternal analgesia and anesthesia on the fetus and the newborn / L. Arnaout [et al.] // J. Gynecol. Obstet. Biol. Reprod. (Paris). 2008. Vol. 37, suppl. 1. P. 46–55.
Rafi A. N. Abdominal field block : a new approach via the lumbar triangle // Anaesthesia. 2001. Vol. 56, N 10. P. 1024–1026.
O’Donnell B. D., McDonnell J. G., McShane A. J. The transverses abdominis plane (TAP) block in open retropubic prostatectomy // Reg. Anesth. Pain. Med. 2006. Vol. 31, N 1. P. 91.
Hebbard P. Subcostal transversus abdominis plane block under ultrasound guidance // Anesth. Analg. 2008. Vol.
10 октября 2015
Количество просмотров: 2981

