Диагностическая и интервенционная радиология 2015
Диагностическая и интервенционная радиология 2015
№01 2015
Диагностические компьютерно-томографические критерии гепатоцеллюлярного рака разной степени дифференцировки в непораженной циррозом печени №01 2015
Номера страниц в выпуске:27-33
Цель: изучение особенностей КТ семиотики гепатоцеллюлярного рака (ГЦР) различной сте-пени дифференцировки в непораженной циррозом печени.
Материалы и методы: работа основана на клинико-морфологических сопоставлениях 29 больных (19 мужчин и 10 женщин в возрасте 19–68 лет), страдающих ГЦР без сопутствующего цирроза печени. На дооперационном этапе всем больным проводилась спиральная КТ с болюсным контрастным усилением (по четырем фазам исследования). На КТ-сканах определяли локализацию, размеры, границы и структуру узлов, включая особенности накопления контрастного вещества для определения степени гистологической дифференцировки.
Результаты: у большинства изученных пациентов ГЦР имел вид солитарного крупного узла, средние значения наибольшего диаметра и площади сечения составили 9,3 см и 68,4 см2 соответственно. В нативную фазу КТ достаточно четкий контур опухолевого узла определялся в 40% наблюдений высокодифференцированного и трети наблюдений умереннодифференцированного ГЦР, при низкодифференцированном варианте контур не выражен. Характерной КТ особенностью узлов ГЦР является гетерогенный характер их внутренней структуры, которая лучше всего визуализировалась в артериальную фазу. Чаще всего (в 67,6%) выявлялись участки некроза, реже наблюдались очаги склероза (23,5%) и обызвествления (11,8%).
Заключение: компьютерно-томографические характеристики ГЦР в отсутствии цирроза печени зависят как от фазы исследования, так и степени гистологической дифференцировки новообразования, что следует учитывать при дифференциальной диагностике и определении прогноза заболевания.
Материалы и методы: работа основана на клинико-морфологических сопоставлениях 29 больных (19 мужчин и 10 женщин в возрасте 19–68 лет), страдающих ГЦР без сопутствующего цирроза печени. На дооперационном этапе всем больным проводилась спиральная КТ с болюсным контрастным усилением (по четырем фазам исследования). На КТ-сканах определяли локализацию, размеры, границы и структуру узлов, включая особенности накопления контрастного вещества для определения степени гистологической дифференцировки.
Результаты: у большинства изученных пациентов ГЦР имел вид солитарного крупного узла, средние значения наибольшего диаметра и площади сечения составили 9,3 см и 68,4 см2 соответственно. В нативную фазу КТ достаточно четкий контур опухолевого узла определялся в 40% наблюдений высокодифференцированного и трети наблюдений умереннодифференцированного ГЦР, при низкодифференцированном варианте контур не выражен. Характерной КТ особенностью узлов ГЦР является гетерогенный характер их внутренней структуры, которая лучше всего визуализировалась в артериальную фазу. Чаще всего (в 67,6%) выявлялись участки некроза, реже наблюдались очаги склероза (23,5%) и обызвествления (11,8%).
Заключение: компьютерно-томографические характеристики ГЦР в отсутствии цирроза печени зависят как от фазы исследования, так и степени гистологической дифференцировки новообразования, что следует учитывать при дифференциальной диагностике и определении прогноза заболевания.
Резюме:
Цель: изучение особенностей КТ семиотики гепатоцеллюлярного рака (ГЦР) различной сте-пени дифференцировки в непораженной циррозом печени.
Материалы и методы: работа основана на клинико-морфологических сопоставлениях 29 больных (19 мужчин и 10 женщин в возрасте 19–68 лет), страдающих ГЦР без сопутствующего цирроза печени. На дооперационном этапе всем больным проводилась спиральная КТ с болюсным контрастным усилением (по четырем фазам исследования). На КТ-сканах определяли локализацию, размеры, границы и структуру узлов, включая особенности накопления контрастного вещества для определения степени гистологической дифференцировки.
Результаты: у большинства изученных пациентов ГЦР имел вид солитарного крупного узла, средние значения наибольшего диаметра и площади сечения составили 9,3 см и 68,4 см2 соответственно. В нативную фазу КТ достаточно четкий контур опухолевого узла определялся в 40% наблюдений высокодифференцированного и трети наблюдений умереннодифференцированного ГЦР, при низкодифференцированном варианте контур не выражен. Характерной КТ особенностью узлов ГЦР является гетерогенный характер их внутренней структуры, которая лучше всего визуализировалась в артериальную фазу. Чаще всего (в 67,6%) выявлялись участки некроза, реже наблюдались очаги склероза (23,5%) и обызвествления (11,8%).
варианте контур не выражен. Характерной КТ особенностью узлов ГЦР является гетерогенный характер их внутренней структуры, которая лучше всего визуализировалась в артериальную фазу. Чаще всего (в 67,6%) выявлялись участки некроза, реже наблюдались очаги склероза (23,5%) и обызвествления (11,8%).
Заключение: компьютерно-томографические характеристики ГЦР в отсутствии цирроза печени зависят как от фазы исследования, так и степени гистологической дифференцировки новообразования, что следует учитывать при дифференциальной диагностике и определении прогноза заболевания.
Yachina N.I. – MD, PhD, professor1
Karmazanovsky G.G. – MD, PhD, professor1,2
Shchegolev A.I. – MD, PhD, professor3
1. The Vishnevsky Institute of surgery of Russian Ministry of Healthcare
Bolshaya Serpuhovskaya ulitsa 27, Moscow, Russian Federation, 117997
2. I.M. Sechenov First Moscow State Medical University under Ministry of Health of the Russian Federation
8 structure 2, Malaya Trubetskaya str., Moscow Russian Federation, 119991
3. Research Center of Obstetrics, Gynecology, and Perinatology named after academician V.I. Kulakov,
of Russian Ministry of Healthcare
4. Oparin street, Moscow, Russian Federation, 117997
ABSTRACT:
Aim: was to study CT semiotic features of hepatocellular carcinoma (HCC) with varying degrees of differentiation in liver, unaffected by cirrhosis.
Materials and methods: the study is based on clinical and morphological comparisons of 29 patients (19 men and 10 women aged 19–68 years) suffering from HCC without associated cirrhosis. In the preoperative period all patients underwent multislice CT with bolus contrast enhancement (on four phases of the study). On CT scans were determined: localization, size, borders and structure of nodes, including features of the accumulation of contrast agent for determining the degree of histological differentiation.
Results: HCC had the appearance of a large solitary node, the average value of the largest diameter and the cross-sectional area amounted to 9.3 cm and 68.4 cm2 respectively in most of examined patients. In the native phase of CT quite distinct contour of the tumor node was determined in 40% of cases at highly differentiated and one-third of moderately differentiated HCC observations, at poorly differentiated variant contour is not expressed.The characteristic feature of CT HCC nodes is the heterogeneous nature of their internal structure, which is best visualized in the arterial phase. Most frequently in observations (in 67.6%) were detected areas of necrosis, rarely observed lesions sclerosis (23.5%) and calcifications (11.8%).
characteristic feature of CT HCC nodes is the heterogeneous nature of their internal structure, which is best visualized in the arterial phase. Most frequently in observations (in 67.6%) were detected areas of necrosis, rarely observed lesions sclerosis (23.5%) and calcifications (11.8%).
Conclusion: Computed tomographic characteristics of HCC in the absence of cirrhosis depend on the phase of the study, and the degree of histological differentiation of tumors that should be considered in the differential diagnosis and prognosis of the disease.
Введение
Гепатоцеллюлярный рак (ГЦР) остается одним из наиболее частых заболеваний среди злокачественных новообразований и соответственно является причиной более чем миллиона смертельных случаев ежегодно во всем мире [1]. Выбор тактики лечения и прогноз жизни пациентов с ГЦР определяются в первую очередь объемом и функциональным состоянием непораженной ткани печени, а также размером, количеством и анатомическим расположением опухолевых узлов. В этой связи следует добавить, что развитие большинства узлов ГЦР наблюдается на фоне цирроза печени. При этом ГЦР чаще возникает на фоне крупноузлового (узелки >3 мм) цирроза по сравнению с мелкоузловым (<3 мм). Тем не менее, доля ГЦР, развившегося без признаков цирроза печени, варьирует в различных географических областях от 7% до 54% [2]. Отрадно, что пациенты, страдающие ГЦР без сопутствующего цирроза печени, имеют больший выбор методов лечения и более благоприятный прогноз.
Основными методами неинвазивной диагностики и соответственно определения последующего лечения и прогноза ГЦР считаются лучевые методы исследо-вания [3,4]. В настоящее время при КТ и МРТ диаг-ностике ГЦР используются критерии LI-RADS (Liver Imaging Reporting and Data System) [5]. Однако данные критерии рекомендуется использовать лишь для дифференциальной ди-агностики очаговых образований печени на фоне ее цирроза. В этой связи КТ-семиотика опухолевых узлов ГЦР в отсутствии цирроза печени нуждается в уточнениях и систематических описаниях.
Цель исследования: изучение особенностей КТ-семиотики ГЦР различной степени дифференцировки в непораженной циррозом печени.
Материалы и методы исследования
Работа основана на клинико-морфологических сопоставлениях 29 больных (19 мужчин в возрасте 15–75 лет и 10 женщин в возрасте 19–68 лет, средний воз-раст пациентов 52 года), проживающих на территории России, оперированных в Институте хирургии имени А.В. Вишневского.
На дооперационном этапе всем больным проводилась спиральная компью-терная томография (СКТ) с болюсным контрастным усилением на аппарате Philips Brilliance 64 CT. Инъекцию контрастного препарата проводили с помощью двухголовчатого автоматического инъектора OptiVantage DH (Mallinckrodt; Inc) со скоростью 4 мл/сек. Для запуска сканирования использовался программный пакет «bolus tracking» («погоня за болюсом»). Анализировались четыре фа-зы: нативная, артериальная, венозная, отсроченная. На полученных КТ-сканах определяли локализацию, размеры, границы и их выраженность, структуру уз-лов, включая такие параметры как гомогенность ткани узлов при накоплении контрастного препарата и равномерность распределения контрастирования центра узлов относительно их периферии, а также наличие включений в структуре узлов: участков соединительной, жировой ткани, некроза, кровоизлияний, каль-цинатов. У всех пациентов отсутствовали КТ признаки цирроза печени.
Полученный после резекции операционный материал подвергали комплексному макро- и микроскопическому исследованию. Гистологическое исследо-вание проводили на парафиновых срезах, окрашенных гематоксилином и эозином. Определение степени гистологической дифференцировки опухолевых узлов проводили согласно рекомендациям ВОЗ по Международной гистологической классификации опухолей печени [6]. В 14 образованиях диагностирован высокодифференцированный (ВД), в 16 умереннодифференцированный (УД) и в 4 – низкодифференцированный (НД) вариант ГЦР.
Результаты и их обсуждение
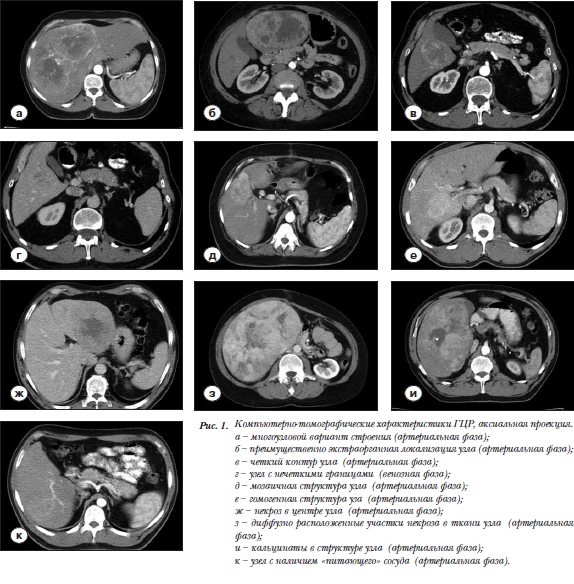 В результате проведения МСКТ у 25 пациентов было диагностировано солитарное, в том числе в виде сливающихся узлов (рис. 1а), поражение печени. У трех больных имелось два отдельных узла и у одного ГЦР был представлен тремя образованиями. Почти в половине (47%) изученных наблюдений диагностирован УД вариант ГЦР, ВД верифицирован в 41% и НД – в 12%.
В результате проведения МСКТ у 25 пациентов было диагностировано солитарное, в том числе в виде сливающихся узлов (рис. 1а), поражение печени. У трех больных имелось два отдельных узла и у одного ГЦР был представлен тремя образованиями. Почти в половине (47%) изученных наблюдений диагностирован УД вариант ГЦР, ВД верифицирован в 41% и НД – в 12%.
Большинство (67,6%) узлов определялось в правой доле печени. Соотношение их расположения в правой и левой доле печени в группах с разной степенью гистологической дифференцировки составило 5:2 при ВД, 5:3 при УД и 3:1 при НД ГЦР. При этом 32 образования локализовались интрапаренхиматозно, и лишь в двух наблюдениях большая часть узла находилась за пределами печени (рис. 1б). Соответственно во всех случаях установлено отсутствие ножки новообразо-вания.
Размеры опухолевых узлов на КТ сканах определялись путем измерения максимальной площади их сечения и по наибольшему диаметру. На основании проведенных исследований установлено, что площадь новообразований варьировала от 1,4 см2 до 239 см2, а максимальный диаметр в пределах 1,5–19 см. При этом наиболее высокие средние значения площади новообразования зарегистрированы нами в группе НД ГЦР, наименьшие значения – в группе ВД ГЦР. Соответственно средние значения большего диаметра образования имеют наибольшие значения также в наблюдениях НД ГЦР, превышающие соответствующие показатели ВД и УД рака в 2,7 и 1,9 раза.
КТ характеристики границ и внутренней структуры образования зависели от фазы исследования ( табл.1, рис. 1в,г). Так, в нативную фазу КТ исследования относительно четкий контур образования определялся примерно в трети наблюдений ВД и УД ГЦР. При НД форме во всех изученных наблюдениях контур был не выражен. В артериальную фазу выраженный контур определялся, напротив, в двух третях случаев ВД и УД рака и во всех наблюдениях НД ГЦР. В венозную и отсроченную фазы КТ исследования контур образования определялся примерно одинаково. При ВД ГЦР достаточно четкая граница наблюдалась лишь в 2(14,3%) и 3(21,4%) узлах соответственно. При УД форме выраженный контур зарегистрирован соответственно в 31,3% и 37,5%. Узлы НД рака имели четкие контуры в 3(75%) наблюдениях в венозную фазу и в 2(50%) – в отсроченную фазу КТ исследования. При анализе внутренней структуры образования в нативную фазу КТ исследования установлено, что 12(в 85,7%) узлов ВД и 15(93,8%) НД ГЦР имели гомогенный характер. При НД форме преобладали (в 75%) признаки гетерогенности. Артериальная фаза характеризовалась лучшим проявлением внутренней структуры образования в плане выявления его гетерогенности (мозаичности) (рис. 1д) или гомогенности (рис. 1е). Действительно, признаки гетерогенного строения узлов установлены в 12(85,7%) наблюдениях ВД ГЦР, в 11(68,8%) УД и в 3(75%) случаях НД рака. Вместе с тем в венозную фазу наиболее четко гете-рогенность проявилась в узлах НД ГЦР. При ВД и УД формах рака гетерогенность строения наблюдалась соответственно в 7(50%) и 9(56,3%) случаях. В отсроченную фазу большинство узлов ВД (78,6%) и НД (75%) ГЦР имело вид гомогенного образования.
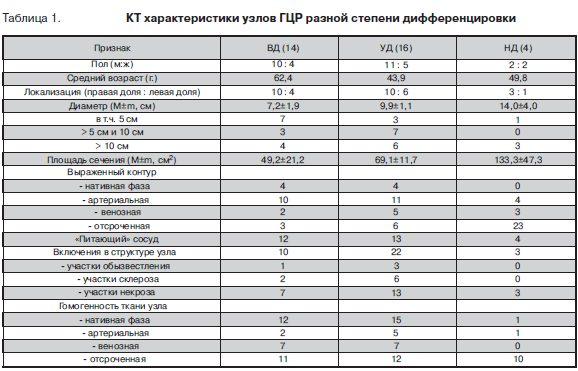
Включения в узлах на КТ-сканах были представлены в основном наличием участков некроза. Последние определялись в 23(67,6%) новообразованиях. Наи-более часто они наблюдались в ткани УД (81,3%) и НД (75%) ГЦР, при ВД раке они зарегистрированы в половине наблюдений. При этом некротические изме-нения чаще выявлялись в крупных узлах. В 13 наблюдениях участки некроза определялись в центре узлов (рис. 1ж), а в 10 были рассеяны по всей паренхиме в виде очагов разного размера (рис. 1з). У одного пациента с ВД ГЦР некротические изменения были следствием ранее проведенной процедуры термоабляции.
В 8 наблюдениях в структуре опухолей определялись участки склероза: 2(14,3%) в ткани ВД и 6(37,5%) в УД ГЦР. При этом все узлы были диаметром более 5 см. Множественные очаги обызвествления были выявлены нами лишь в 4(11,8%) изученных наблюдениях (1 в ткани ВД (рис. 1и) и 3 в УД ГЦР). Все они визуализировались в области некротических изменений.
В артериальную фазу сканирования в 29(85,3%) наблюдениях визуализировались «питающие» артериальные сосуды. В 21-м из них к узлу подходила одна артерия (рис. 1к), в 7 наблюдениях от 2 до 4 сосудов. Диаметр питающих артерий варьировал от 2 до 5 мм.
Результаты денситометрических показателей ткани новообразования и окружающей паренхимы печени представлены в таблице 2. В нативную фазу исследования все опухолевые узлы имели характеристики изоденсного или гиподенсного образования. В группе ВД ГЦР 9(64,3%) узлов были изоденсными и 5(35,7%) гиподенсными по отношению к печени. Ткань УД рака, наоборот, была преимущественно гиподенсной (в 62,5% по сравнению с 37,5% изоденсных образований). При НД ГЦР 75% были изоденсными и 25% гиподенсными.
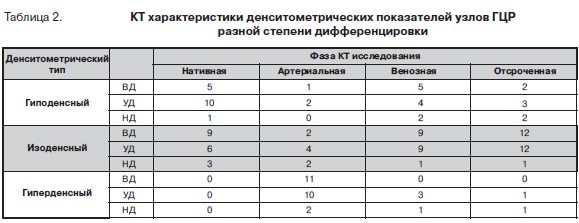
В артериальную фазу контрастного исследования большая часть (67,6%) опухолевых узлов выглядела как гиперденсные образования. Среди ВД форм ГЦР они составили 78,6%, УД – 62,5% и НД – 50%. При этом характеристики гиподенсных узлов отмечались лишь в 1(7,1%) наблюдении ВД и 2(12,5%) УД рака.
В венозную фазу исследования в группе ВД ГЦР соотношение изоденсных и гиподенсных образований (9:5) было аналогичным нативной фазы. Среди УД форм рака 3 узла остались гиперденсными, а 9(56,3%) и 4(25%) соответственно стали изоденсными и гиподенсными. В наблюдениях НД ГЦР один узел остался гиперденсным и два стали гиподенсными.
В отсроченную фазу большинство узлов ВД (85,7%) и УД (75%) ГЦР были гиподенсны окружающей паренхиме печени. При этом лишь по одному узлу УД и НД рака имели характеристики гиперденсных образований.
Таким образом, у большинства изученных нами пациентов ГЦР имел вид солитарного крупного узла.
Именно такое поражение печени характерно при отсутствии ее цирроза. При циррозе печени, наоборот, наблюдаются, как правило, один или несколько мелких опухолевых узелков. Так, по данным M. Di Martino с соавт. [7] средние размеры ГЦР составили 6,7 см (с колебаниями от 1,3 до 18 см) и 1,5 см (с колебаниями от 1,5 до 12 см) соответственно в группе без и с наличием цирроза печени. В исследовании
S. Gaddikeri с соавт. [8] размеры нецирротического ГЦР варьировали от 2 до 23 см со средним значением 12,4 см. Согласно проведенным нами исследованиям средние значения наибольшего диаметра и площади сечения составили 9,3 и 68,4 см2 соответственно. То есть, согласно классификации TNM [9], основная масса пациентов была прооперирована на стадиях II и III заболевания.
В изученных нами наблюдениях преобладали УД и ВД формы ГЦР, при этом большие размеры опухолевого узла сочетались с уменьшением степени гистологической дифференцировки. Подобные изменения, видимо, свидетельствуют о том, что в процессе развития ГЦР происходит как увеличение узла в размерах, так и снижение степени гистологической дифференцировки (увеличение степени злокачественности).
Согласно данным литературы [8], при КТ исследованиях ВД формы ГЦР были инкапсулированы (имели псевдокапсулу) с четкими контурами, а НД формы и опухоли с агрессивным течением имели тенденцию к отсутствию капсулы (псевдокапсулы) и нечетким границам. На основании проведенных нами исследований можно заключить, что выраженность контура зависела от степени дифференцировки опухоли и фазы КТ исследования. В нативную фазу достаточно четкий контур опухолевого узла определялся в 40% наблюдений ВД и трети наблюдений УД ГЦР. При НД форме контур был не выражен. Наиболее четко границы образований визуализировались нами в артериальную фазу: в 73,5% изученных наблюдений, в том числе во всех узлах НД ГЦР.
Характерной КТ особенностью узлов ГЦР является гетерогенный характер их внутренней структуры. Такое гетерогенное (или мозаичное) строение отмечается в 63% при лучевых исследованиях массивных и крупных новообразований [10]. При КТ обычно выявляются участки центрально или периферически расположенного кальциноза, некроза, а также кровоизлияния и признаки стеатоза опухолевых клеток [8]. Действительно, по данным морфологического исследования в ткани ГЦР без сопутствующего цирроза печени в 46,9% наблюдались участки кровоизлияний, в 6,3% – обызвествления, в 18,8% – липидные включения в цитоплазме опухолевых клеток [7]. В целом признаки кальциноза встречаются у 2–12% больных ГЦР.
В изученных нами наблюдениях чаще всего (в 67,6%) выявлялись участки некроза. Значительно реже наблюдались участки склероза (23,5%) и обызвеств-ления (11,8%). Лучше всего гетерогенность строения узлов визуализировалась в артериальную (ВД и УД) и венозную (НД) фазы. При этом частота выявления включений зависела от степени злокачественности опухоли.
Основными дифференциально-диагностическими признаками очаговых образований печени считаются изменения их КТ-плотности в разные фазы КТ исследования [11, 12]. В нативную фазу 52,9% изученных нами узлов ГЦР были изоденсны и 47,1% – гиподенсны относительно окружающей паренхимы печени. Для сравнения, при циррозе печени только треть (27-34%) ГЦР размером менее 2 см выглядит гиподенсным по отношению к паренхиме печени [13–15].
В артериальную фазу большая часть (67,6%) изученных нами образований стала гиперденсной, а 23,5% и 8,8% узлов остались соответственно изоденсными и гиподенсными относительно паренхимы печени. В венозную и отсроченную фазы КТ исследования преобладали изоденсные (55,9% и 73,5% соответственно) и гиподенсные (32,4% и 20,6% соответственно) образования. Подобная динамика изменений КТ денсности ГЦР после введения контрастного вещества у больных без сопутствующего цирроза печени согласуется с данными литературы [7,8]. Так, в исследовании Di Martino с соавт. [7] в 87,5% наблюдений ГЦР отме-чались признаки гиперваскулярности с последующим контрастным провалом.
Однако показатели КТ-плотности в определенной мере зависят от степени гистологической дифференцировки опухоли, что диктует необходимость допол-нительных дифференциально-диагностических критериев ГЦР. На наш взгляд, в качестве таких критериев следует использовать КТ показатели васкуляризации новообразования. Действительно, в узлах ВД формы рака КТ показатель васкуляризации имеет наибольшие значения (74,0), при УД и НД ГЦР его значения ниже на 3,5% и 45,3% соответственно [16]. Дополнительным дифференциально-диагностическим признаком может служить определение прироста плотности ткани образования в артериальную фазу КТ исследования. Если в ткани очагового образования печени прирост КТ плотности составляет свыше 90 ед.Н, то в первую очередь следует думать об очаговой узловой гиперплазии. Значения артериального прироста меньше 30 ед.Н в большей степени свидетельствуют о ГЦР [17].
Характеризуя особенности ГЦР при отсутствии цирроза печени, необходимо также добавить, что по данным литературы [18,19] такие пациенты, как правило, моложе и в большинстве наблюдений им показана резекция печени. Для них также характерен лучший прогноз: средние показатели продолжительности жизни составляют 2,7 г., а порядка 25% больных живут не менее 5 лет [20].
Следовательно, КТ семиотика ГЦР в отсутствии цирроза печени зависит от фазы исследования. Основные признаки, в том числе показатели КТ-плотности, в целом соответствуют таковым при сопутствующем циррозе печени, однако имеют ряд вышеуказанных особенностей. Вместе с тем, КТ характеристики ГЦР в определенной мере зависят и от степени гистологической дифференцировки новообразования, что следует учитывать при дифференциальной диагностике и определении прогноза заболевания.
Цель: изучение особенностей КТ семиотики гепатоцеллюлярного рака (ГЦР) различной сте-пени дифференцировки в непораженной циррозом печени.
Материалы и методы: работа основана на клинико-морфологических сопоставлениях 29 больных (19 мужчин и 10 женщин в возрасте 19–68 лет), страдающих ГЦР без сопутствующего цирроза печени. На дооперационном этапе всем больным проводилась спиральная КТ с болюсным контрастным усилением (по четырем фазам исследования). На КТ-сканах определяли локализацию, размеры, границы и структуру узлов, включая особенности накопления контрастного вещества для определения степени гистологической дифференцировки.
Результаты: у большинства изученных пациентов ГЦР имел вид солитарного крупного узла, средние значения наибольшего диаметра и площади сечения составили 9,3 см и 68,4 см2 соответственно. В нативную фазу КТ достаточно четкий контур опухолевого узла определялся в 40% наблюдений высокодифференцированного и трети наблюдений умереннодифференцированного ГЦР, при низкодифференцированном
 варианте контур не выражен. Характерной КТ особенностью узлов ГЦР является гетерогенный характер их внутренней структуры, которая лучше всего визуализировалась в артериальную фазу. Чаще всего (в 67,6%) выявлялись участки некроза, реже наблюдались очаги склероза (23,5%) и обызвествления (11,8%).
варианте контур не выражен. Характерной КТ особенностью узлов ГЦР является гетерогенный характер их внутренней структуры, которая лучше всего визуализировалась в артериальную фазу. Чаще всего (в 67,6%) выявлялись участки некроза, реже наблюдались очаги склероза (23,5%) и обызвествления (11,8%).Заключение: компьютерно-томографические характеристики ГЦР в отсутствии цирроза печени зависят как от фазы исследования, так и степени гистологической дифференцировки новообразования, что следует учитывать при дифференциальной диагностике и определении прогноза заболевания.
Computed tomography diagnostic criteria ofhepatocellular carcinoma with varying degree of differentiation in the liver unaffected by cirrhosis
*Tumanova U.N. – MD, junior researcher1Yachina N.I. – MD, PhD, professor1
Karmazanovsky G.G. – MD, PhD, professor1,2
Shchegolev A.I. – MD, PhD, professor3
1. The Vishnevsky Institute of surgery of Russian Ministry of Healthcare
Bolshaya Serpuhovskaya ulitsa 27, Moscow, Russian Federation, 117997
2. I.M. Sechenov First Moscow State Medical University under Ministry of Health of the Russian Federation
8 structure 2, Malaya Trubetskaya str., Moscow Russian Federation, 119991
3. Research Center of Obstetrics, Gynecology, and Perinatology named after academician V.I. Kulakov,
of Russian Ministry of Healthcare
4. Oparin street, Moscow, Russian Federation, 117997
ABSTRACT:
Aim: was to study CT semiotic features of hepatocellular carcinoma (HCC) with varying degrees of differentiation in liver, unaffected by cirrhosis.
Materials and methods: the study is based on clinical and morphological comparisons of 29 patients (19 men and 10 women aged 19–68 years) suffering from HCC without associated cirrhosis. In the preoperative period all patients underwent multislice CT with bolus contrast enhancement (on four phases of the study). On CT scans were determined: localization, size, borders and structure of nodes, including features of the accumulation of contrast agent for determining the degree of histological differentiation.
Results: HCC had the appearance of a large solitary node, the average value of the largest diameter and the cross-sectional area amounted to 9.3 cm and 68.4 cm2 respectively in most of examined patients. In the native phase of CT quite distinct contour of the tumor node was determined in 40% of cases at highly differentiated and one-third of moderately differentiated HCC observations, at poorly differentiated variant contour is not expressed.The
 characteristic feature of CT HCC nodes is the heterogeneous nature of their internal structure, which is best visualized in the arterial phase. Most frequently in observations (in 67.6%) were detected areas of necrosis, rarely observed lesions sclerosis (23.5%) and calcifications (11.8%).
characteristic feature of CT HCC nodes is the heterogeneous nature of their internal structure, which is best visualized in the arterial phase. Most frequently in observations (in 67.6%) were detected areas of necrosis, rarely observed lesions sclerosis (23.5%) and calcifications (11.8%).Conclusion: Computed tomographic characteristics of HCC in the absence of cirrhosis depend on the phase of the study, and the degree of histological differentiation of tumors that should be considered in the differential diagnosis and prognosis of the disease.
Введение
Гепатоцеллюлярный рак (ГЦР) остается одним из наиболее частых заболеваний среди злокачественных новообразований и соответственно является причиной более чем миллиона смертельных случаев ежегодно во всем мире [1]. Выбор тактики лечения и прогноз жизни пациентов с ГЦР определяются в первую очередь объемом и функциональным состоянием непораженной ткани печени, а также размером, количеством и анатомическим расположением опухолевых узлов. В этой связи следует добавить, что развитие большинства узлов ГЦР наблюдается на фоне цирроза печени. При этом ГЦР чаще возникает на фоне крупноузлового (узелки >3 мм) цирроза по сравнению с мелкоузловым (<3 мм). Тем не менее, доля ГЦР, развившегося без признаков цирроза печени, варьирует в различных географических областях от 7% до 54% [2]. Отрадно, что пациенты, страдающие ГЦР без сопутствующего цирроза печени, имеют больший выбор методов лечения и более благоприятный прогноз.Основными методами неинвазивной диагностики и соответственно определения последующего лечения и прогноза ГЦР считаются лучевые методы исследо-вания [3,4]. В настоящее время при КТ и МРТ диаг-ностике ГЦР используются критерии LI-RADS (Liver Imaging Reporting and Data System) [5]. Однако данные критерии рекомендуется использовать лишь для дифференциальной ди-агностики очаговых образований печени на фоне ее цирроза. В этой связи КТ-семиотика опухолевых узлов ГЦР в отсутствии цирроза печени нуждается в уточнениях и систематических описаниях.
Цель исследования: изучение особенностей КТ-семиотики ГЦР различной степени дифференцировки в непораженной циррозом печени.
Материалы и методы исследования
Работа основана на клинико-морфологических сопоставлениях 29 больных (19 мужчин в возрасте 15–75 лет и 10 женщин в возрасте 19–68 лет, средний воз-раст пациентов 52 года), проживающих на территории России, оперированных в Институте хирургии имени А.В. Вишневского. На дооперационном этапе всем больным проводилась спиральная компью-терная томография (СКТ) с болюсным контрастным усилением на аппарате Philips Brilliance 64 CT. Инъекцию контрастного препарата проводили с помощью двухголовчатого автоматического инъектора OptiVantage DH (Mallinckrodt; Inc) со скоростью 4 мл/сек. Для запуска сканирования использовался программный пакет «bolus tracking» («погоня за болюсом»). Анализировались четыре фа-зы: нативная, артериальная, венозная, отсроченная. На полученных КТ-сканах определяли локализацию, размеры, границы и их выраженность, структуру уз-лов, включая такие параметры как гомогенность ткани узлов при накоплении контрастного препарата и равномерность распределения контрастирования центра узлов относительно их периферии, а также наличие включений в структуре узлов: участков соединительной, жировой ткани, некроза, кровоизлияний, каль-цинатов. У всех пациентов отсутствовали КТ признаки цирроза печени.
Полученный после резекции операционный материал подвергали комплексному макро- и микроскопическому исследованию. Гистологическое исследо-вание проводили на парафиновых срезах, окрашенных гематоксилином и эозином. Определение степени гистологической дифференцировки опухолевых узлов проводили согласно рекомендациям ВОЗ по Международной гистологической классификации опухолей печени [6]. В 14 образованиях диагностирован высокодифференцированный (ВД), в 16 умереннодифференцированный (УД) и в 4 – низкодифференцированный (НД) вариант ГЦР.
Результаты и их обсуждение
 В результате проведения МСКТ у 25 пациентов было диагностировано солитарное, в том числе в виде сливающихся узлов (рис. 1а), поражение печени. У трех больных имелось два отдельных узла и у одного ГЦР был представлен тремя образованиями. Почти в половине (47%) изученных наблюдений диагностирован УД вариант ГЦР, ВД верифицирован в 41% и НД – в 12%.
В результате проведения МСКТ у 25 пациентов было диагностировано солитарное, в том числе в виде сливающихся узлов (рис. 1а), поражение печени. У трех больных имелось два отдельных узла и у одного ГЦР был представлен тремя образованиями. Почти в половине (47%) изученных наблюдений диагностирован УД вариант ГЦР, ВД верифицирован в 41% и НД – в 12%. Большинство (67,6%) узлов определялось в правой доле печени. Соотношение их расположения в правой и левой доле печени в группах с разной степенью гистологической дифференцировки составило 5:2 при ВД, 5:3 при УД и 3:1 при НД ГЦР. При этом 32 образования локализовались интрапаренхиматозно, и лишь в двух наблюдениях большая часть узла находилась за пределами печени (рис. 1б). Соответственно во всех случаях установлено отсутствие ножки новообразо-вания.
Размеры опухолевых узлов на КТ сканах определялись путем измерения максимальной площади их сечения и по наибольшему диаметру. На основании проведенных исследований установлено, что площадь новообразований варьировала от 1,4 см2 до 239 см2, а максимальный диаметр в пределах 1,5–19 см. При этом наиболее высокие средние значения площади новообразования зарегистрированы нами в группе НД ГЦР, наименьшие значения – в группе ВД ГЦР. Соответственно средние значения большего диаметра образования имеют наибольшие значения также в наблюдениях НД ГЦР, превышающие соответствующие показатели ВД и УД рака в 2,7 и 1,9 раза.
КТ характеристики границ и внутренней структуры образования зависели от фазы исследования ( табл.1, рис. 1в,г). Так, в нативную фазу КТ исследования относительно четкий контур образования определялся примерно в трети наблюдений ВД и УД ГЦР. При НД форме во всех изученных наблюдениях контур был не выражен. В артериальную фазу выраженный контур определялся, напротив, в двух третях случаев ВД и УД рака и во всех наблюдениях НД ГЦР. В венозную и отсроченную фазы КТ исследования контур образования определялся примерно одинаково. При ВД ГЦР достаточно четкая граница наблюдалась лишь в 2(14,3%) и 3(21,4%) узлах соответственно. При УД форме выраженный контур зарегистрирован соответственно в 31,3% и 37,5%. Узлы НД рака имели четкие контуры в 3(75%) наблюдениях в венозную фазу и в 2(50%) – в отсроченную фазу КТ исследования. При анализе внутренней структуры образования в нативную фазу КТ исследования установлено, что 12(в 85,7%) узлов ВД и 15(93,8%) НД ГЦР имели гомогенный характер. При НД форме преобладали (в 75%) признаки гетерогенности. Артериальная фаза характеризовалась лучшим проявлением внутренней структуры образования в плане выявления его гетерогенности (мозаичности) (рис. 1д) или гомогенности (рис. 1е). Действительно, признаки гетерогенного строения узлов установлены в 12(85,7%) наблюдениях ВД ГЦР, в 11(68,8%) УД и в 3(75%) случаях НД рака. Вместе с тем в венозную фазу наиболее четко гете-рогенность проявилась в узлах НД ГЦР. При ВД и УД формах рака гетерогенность строения наблюдалась соответственно в 7(50%) и 9(56,3%) случаях. В отсроченную фазу большинство узлов ВД (78,6%) и НД (75%) ГЦР имело вид гомогенного образования.

Включения в узлах на КТ-сканах были представлены в основном наличием участков некроза. Последние определялись в 23(67,6%) новообразованиях. Наи-более часто они наблюдались в ткани УД (81,3%) и НД (75%) ГЦР, при ВД раке они зарегистрированы в половине наблюдений. При этом некротические изме-нения чаще выявлялись в крупных узлах. В 13 наблюдениях участки некроза определялись в центре узлов (рис. 1ж), а в 10 были рассеяны по всей паренхиме в виде очагов разного размера (рис. 1з). У одного пациента с ВД ГЦР некротические изменения были следствием ранее проведенной процедуры термоабляции.
В 8 наблюдениях в структуре опухолей определялись участки склероза: 2(14,3%) в ткани ВД и 6(37,5%) в УД ГЦР. При этом все узлы были диаметром более 5 см. Множественные очаги обызвествления были выявлены нами лишь в 4(11,8%) изученных наблюдениях (1 в ткани ВД (рис. 1и) и 3 в УД ГЦР). Все они визуализировались в области некротических изменений.
В артериальную фазу сканирования в 29(85,3%) наблюдениях визуализировались «питающие» артериальные сосуды. В 21-м из них к узлу подходила одна артерия (рис. 1к), в 7 наблюдениях от 2 до 4 сосудов. Диаметр питающих артерий варьировал от 2 до 5 мм.
Результаты денситометрических показателей ткани новообразования и окружающей паренхимы печени представлены в таблице 2. В нативную фазу исследования все опухолевые узлы имели характеристики изоденсного или гиподенсного образования. В группе ВД ГЦР 9(64,3%) узлов были изоденсными и 5(35,7%) гиподенсными по отношению к печени. Ткань УД рака, наоборот, была преимущественно гиподенсной (в 62,5% по сравнению с 37,5% изоденсных образований). При НД ГЦР 75% были изоденсными и 25% гиподенсными.

В артериальную фазу контрастного исследования большая часть (67,6%) опухолевых узлов выглядела как гиперденсные образования. Среди ВД форм ГЦР они составили 78,6%, УД – 62,5% и НД – 50%. При этом характеристики гиподенсных узлов отмечались лишь в 1(7,1%) наблюдении ВД и 2(12,5%) УД рака.
В венозную фазу исследования в группе ВД ГЦР соотношение изоденсных и гиподенсных образований (9:5) было аналогичным нативной фазы. Среди УД форм рака 3 узла остались гиперденсными, а 9(56,3%) и 4(25%) соответственно стали изоденсными и гиподенсными. В наблюдениях НД ГЦР один узел остался гиперденсным и два стали гиподенсными.
В отсроченную фазу большинство узлов ВД (85,7%) и УД (75%) ГЦР были гиподенсны окружающей паренхиме печени. При этом лишь по одному узлу УД и НД рака имели характеристики гиперденсных образований.
Таким образом, у большинства изученных нами пациентов ГЦР имел вид солитарного крупного узла.
Именно такое поражение печени характерно при отсутствии ее цирроза. При циррозе печени, наоборот, наблюдаются, как правило, один или несколько мелких опухолевых узелков. Так, по данным M. Di Martino с соавт. [7] средние размеры ГЦР составили 6,7 см (с колебаниями от 1,3 до 18 см) и 1,5 см (с колебаниями от 1,5 до 12 см) соответственно в группе без и с наличием цирроза печени. В исследовании
S. Gaddikeri с соавт. [8] размеры нецирротического ГЦР варьировали от 2 до 23 см со средним значением 12,4 см. Согласно проведенным нами исследованиям средние значения наибольшего диаметра и площади сечения составили 9,3 и 68,4 см2 соответственно. То есть, согласно классификации TNM [9], основная масса пациентов была прооперирована на стадиях II и III заболевания.
В изученных нами наблюдениях преобладали УД и ВД формы ГЦР, при этом большие размеры опухолевого узла сочетались с уменьшением степени гистологической дифференцировки. Подобные изменения, видимо, свидетельствуют о том, что в процессе развития ГЦР происходит как увеличение узла в размерах, так и снижение степени гистологической дифференцировки (увеличение степени злокачественности).
Согласно данным литературы [8], при КТ исследованиях ВД формы ГЦР были инкапсулированы (имели псевдокапсулу) с четкими контурами, а НД формы и опухоли с агрессивным течением имели тенденцию к отсутствию капсулы (псевдокапсулы) и нечетким границам. На основании проведенных нами исследований можно заключить, что выраженность контура зависела от степени дифференцировки опухоли и фазы КТ исследования. В нативную фазу достаточно четкий контур опухолевого узла определялся в 40% наблюдений ВД и трети наблюдений УД ГЦР. При НД форме контур был не выражен. Наиболее четко границы образований визуализировались нами в артериальную фазу: в 73,5% изученных наблюдений, в том числе во всех узлах НД ГЦР.
Характерной КТ особенностью узлов ГЦР является гетерогенный характер их внутренней структуры. Такое гетерогенное (или мозаичное) строение отмечается в 63% при лучевых исследованиях массивных и крупных новообразований [10]. При КТ обычно выявляются участки центрально или периферически расположенного кальциноза, некроза, а также кровоизлияния и признаки стеатоза опухолевых клеток [8]. Действительно, по данным морфологического исследования в ткани ГЦР без сопутствующего цирроза печени в 46,9% наблюдались участки кровоизлияний, в 6,3% – обызвествления, в 18,8% – липидные включения в цитоплазме опухолевых клеток [7]. В целом признаки кальциноза встречаются у 2–12% больных ГЦР.
В изученных нами наблюдениях чаще всего (в 67,6%) выявлялись участки некроза. Значительно реже наблюдались участки склероза (23,5%) и обызвеств-ления (11,8%). Лучше всего гетерогенность строения узлов визуализировалась в артериальную (ВД и УД) и венозную (НД) фазы. При этом частота выявления включений зависела от степени злокачественности опухоли.
Основными дифференциально-диагностическими признаками очаговых образований печени считаются изменения их КТ-плотности в разные фазы КТ исследования [11, 12]. В нативную фазу 52,9% изученных нами узлов ГЦР были изоденсны и 47,1% – гиподенсны относительно окружающей паренхимы печени. Для сравнения, при циррозе печени только треть (27-34%) ГЦР размером менее 2 см выглядит гиподенсным по отношению к паренхиме печени [13–15].
В артериальную фазу большая часть (67,6%) изученных нами образований стала гиперденсной, а 23,5% и 8,8% узлов остались соответственно изоденсными и гиподенсными относительно паренхимы печени. В венозную и отсроченную фазы КТ исследования преобладали изоденсные (55,9% и 73,5% соответственно) и гиподенсные (32,4% и 20,6% соответственно) образования. Подобная динамика изменений КТ денсности ГЦР после введения контрастного вещества у больных без сопутствующего цирроза печени согласуется с данными литературы [7,8]. Так, в исследовании Di Martino с соавт. [7] в 87,5% наблюдений ГЦР отме-чались признаки гиперваскулярности с последующим контрастным провалом.
Однако показатели КТ-плотности в определенной мере зависят от степени гистологической дифференцировки опухоли, что диктует необходимость допол-нительных дифференциально-диагностических критериев ГЦР. На наш взгляд, в качестве таких критериев следует использовать КТ показатели васкуляризации новообразования. Действительно, в узлах ВД формы рака КТ показатель васкуляризации имеет наибольшие значения (74,0), при УД и НД ГЦР его значения ниже на 3,5% и 45,3% соответственно [16]. Дополнительным дифференциально-диагностическим признаком может служить определение прироста плотности ткани образования в артериальную фазу КТ исследования. Если в ткани очагового образования печени прирост КТ плотности составляет свыше 90 ед.Н, то в первую очередь следует думать об очаговой узловой гиперплазии. Значения артериального прироста меньше 30 ед.Н в большей степени свидетельствуют о ГЦР [17].
Характеризуя особенности ГЦР при отсутствии цирроза печени, необходимо также добавить, что по данным литературы [18,19] такие пациенты, как правило, моложе и в большинстве наблюдений им показана резекция печени. Для них также характерен лучший прогноз: средние показатели продолжительности жизни составляют 2,7 г., а порядка 25% больных живут не менее 5 лет [20].
Следовательно, КТ семиотика ГЦР в отсутствии цирроза печени зависит от фазы исследования. Основные признаки, в том числе показатели КТ-плотности, в целом соответствуют таковым при сопутствующем циррозе печени, однако имеют ряд вышеуказанных особенностей. Вместе с тем, КТ характеристики ГЦР в определенной мере зависят и от степени гистологической дифференцировки новообразования, что следует учитывать при дифференциальной диагностике и определении прогноза заболевания.
Список исп. литературыСкрыть список1. Siegel R., Ma J., Zou Z., Jemal A. Cancer Statistics, 2014. CA Cancer J Clin 2014; 64: 9–29.
2. Trevisani F., Frigerio M., Santi V., Grignaschi A., Bernardi M.: Hepatocellular carcinoma in non-cirrhotic liver: a reappraisal. Dig. Liver Dis. 2010; 42: 341–347.
3. Silva A.C., Evans J.M., McCullough A.E. et al. MR Imaging of hypervascular liver masses: A review of current techniques. RadioGraphics. 2009; 29: 385–402.
4. Furlan A., Marin D., Vanzulli A. et al. Hepatocellular carcinoma in cirrhotic patients at multidetector CT: hepatic venous phase versus delayed phase for the detection of tumour washout. Brit. J. Radiology. 2011; 84: 403–412.
5. American College of Radiology website. Liver Imaging Reporting and Data System. www.acr.org/Quality-Safety/Resources/LIRADS. Accessed March 21, 2014
6. Theise N.D., Curado M.P., Franceschi S. et al. (Eds.) WHO classification of tumours of the digestive system. Lyon: IARC, 2010; 205–216.
7. Di Martino M., Saba L., Bosco S. et al. Hepatocellular carcinoma (HCC) in non-cirrhotic liver: clinical, radiological and pathological findings. Eur. Radiol. 2014; 24: 1446–1454.
8. Gaddikeri S., McNeeley M.F., Wang C.L. et al. Hepatocellular Carcinoma in the Noncirrhotic Liver. AJR. 2014; 203: W34-W47
9. ТNМ: Классификация злокачественных опухолей Под ред. Л.Х. Собина и др.; пер. с англ. и научн. ред. А.И. Щеголев. – М.: Логосфера, 2011.
TNM: classification of malignant tumours, 7th ed. Ed by L.H. Sobin et al. Transl. and ed. A.I. Shchegolev. Moscow: Logosfera, 2011. [In Russ].
10. Honda H., Onitsuka H., Murakami J. et al. Characteristic findings of hepatocellular carcinoma: an evaluation with comparative study of US, CT, and MRI. Gastrointest Radiol. 1992; 17: 245–249.
11. Hofer М. CT teaching manual. A systemic approach to CT reading. 3rd ed. Stuttgart et al: Thieme, 2007.
12. Туманова У.Н., Кармазановский Г.Г., Щеголев А.И. Денситометрические характеристики гепатоцеллюлярного рака при спиральной компьютерной томографии. Медицинская визуализация. 2012; 6: 42–50.
Tumanova U.N., Karmazanovsky G.G., Shchegolev A.I. Densitometric characteristics of hepatocellular carcinoma at spiral computed tomography. Medicinskaja vizualizacija. 2012; 6: 42–50. [In Russ].
13. Kudo M. Imaging diagnosis of hepatocellular carcinoma and premalignant/borderline lesions. Semin. Liver Dis. 1999; 19: 297–309.
14. Hayashi M., Matsui O., Ueda K. et al. Progression to hypervascular hepatocellular carcinoma: correlation with intranodular blood supply evaluated with CT during intraarterial injection of contrast material. Radiology. 2002; 225: 143–149.
15. Bolondi L., Gaiani S., Celli N. et al. Characterization of small nodules in cirrhosis by assessment of vascularity: the problem of hypovascular hepatocellular carcinoma. Hepatology. 2005; 42: 27–34.
16. Туманова У.Н., Дубова Е.А., Кармазановский Г.Г., Щеголев А.И. Компьютерно-томографическая оценка кровоснабжения гепатоцеллюлярного рака печени. Анналы хирургической гепатологии. 2013; 4: 53–60.
Tumanova U.N., Dubova E.A., Karmazanovsky G.G., Shchegolev A.I. Computed tomographic evaluation of the blood supply hepatocellular carcinoma at the liver. Annaly hirurgicheskoj gepatologii. 2013; 4: 53–60. [In Russ].
17. Туманова У.Н., Кармазановский Г.Г., Дубова Е.А., Щеголев А.И. Сравнительный анализ степени васкуляризации гепатоцеллюлярного рака и очаговой узловой гиперплазии печени по данным компьютерно-томографического и морфологического исследований. Вестник Российской Академии медицинских наук. 2013; 12: 9–15.
Tumanova U.N., Dubova E.A., Karmazanovsky G.G., Shchegolev A.I. Comparative analysis of the degree of vascularization hepatocellular carcinoma and focal nodular hyperplasia of the liver according to the computed-tomography and morphological studies. Vestnik Rossijskoj Akademii medicinskih nauk. 2013; 12: 9–15. [In Russ].
18. Nzeako U.C., Goodman Z.D., Ishak K.G. Hepatocellular carcinoma in cirrhotic and noncirrhotic livers. A clinic-histopathologic study of 804 North American patients. Am. J. Clin. Pathol. 1996; 105: 65–75.
19. Shimada M., Hashimoto E., Taniai M. et al. Hepatocellular carcinoma in patients with non-alcoholic steatohepatitis. J. Hepatol. 2002; 37: 154–160.
20. Smalley S., Moertel C., Hilton J. et al. Hepatoma in the noncirrhotic liver. Cancer. 1988; 62: 1414–1424.
1 января 2015
Количество просмотров: 3080
