Диагностическая и интервенционная радиология 2015
№01 2015
ПЭТ/КТ с 18F-ФДГ и 18F-холином в диагностике смешанного гепатохолангиоцеллюлярного рака (Клиническое наблюдение) №01 2015
Материалы и методы: ПЭТ/КТ с 18F-Холином и 18F-фтордезоксиглюкозой была выполнена пациентке 70 лет с диагнозом гепатохолангиоцеллюлярный рак. Также были проведены КТ и МРТ с внутривенным контрастированием, гистологическое и иммуногистохимическое исследование послеоперационного материала (правосторонняя гемигепатэктомия).
Результаты: выявлены различия в накоплении 18F-Холина и 18F-фтордезоксиглюкозы в отдельных участках гепатохолангиоцеллюлярного рака: в области холангиоцеллюлярного рака и в области низкодифференцированного гепатоцеллюлярного рака.
Выводы: 18F-холин обладает низкой диагностической ценностью в выявлении ХЦР и низкодифференцированного ГЦР, в отличие от 18F-ФДГ, в то время как при высокодифферецированном ГЦР исследование с 18F-холином будет более предпочтительным. Диагностическая ценность 18F-ФДГ при высокодифференцированном ГЦР крайне низка.
Цель: оценить диагностическую ценность ПЭТ с 18F-Холином и 18F-фтордезоксиглюкозой при гепатохолангиоцеллюлярном раке.
Материалы и методы: ПЭТ/КТ с 18F-Холином и 18F-фтордезоксиглюкозой была выполнена пациентке 70 лет с диагнозом гепатохолангиоцеллюлярный рак. Также были проведены КТ и МРТ с внутривенным контрастированием, гистологическое и иммуногистохимическое исследование послеоперационного материала (правосторонняя гемигепатэктомия).
Результаты: выявлены различия в накоплении 18F-Холина и 18F-фтордезоксиглюкозы в отдельных участках гепатохолангиоцеллюлярного рака: в области холангиоцеллюлярного рака и в области низкодифференцированного гепатоцеллюлярного рака.
 Выводы: 18F-холин обладает низкой диагностической ценностью в выявлении ХЦР и низкодифференцированного ГЦР, в отличие от 18F-ФДГ, в то время как при высокодифферецированном ГЦР исследование с 18F-холином будет более предпочтительным. Диагностическая ценность 18F-ФДГ при высокодифференцированном ГЦР крайне низка.
Выводы: 18F-холин обладает низкой диагностической ценностью в выявлении ХЦР и низкодифференцированного ГЦР, в отличие от 18F-ФДГ, в то время как при высокодифферецированном ГЦР исследование с 18F-холином будет более предпочтительным. Диагностическая ценность 18F-ФДГ при высокодифференцированном ГЦР крайне низка.
PET/CT with 18F-FDG and 18F-choline in the diagnosis of hepatocellular cancer mixed with cholangiocellular cancer (case report)
*Tulin P.E. – MD
Dolgushin M.B. – MD, PhD, professor
Patiutko U.I. – MD, PhD, professor
Shiryaev S.V. – MD, PhD, professor
Odzharova A.A. – MD, PhD
Vihrova N.B. – MD, postgraduate
Moroz E.A. – MD, PhD
Medvedeva B.M. – MD, PhD
Romanova K.A. – MD, postgraduate
Federal State Budget Institution «N.N. Blokhin Russian Cancer Research Center»
under the Russian Academy of Medical Sciences
24, Kashirskoye Shosse, Moscow, Russian Federation, 115478
ABSTRACT:
Aim: was to estimate the diagnostic value of PET with 18F-Choline and 18F-FDG in case of mixed hepatocellular (HCC) and cholangiocellular cancer (CCC).
Materials and methods: PET/CT with 18F-Choline and 18F-FDG was performed on 70 years old patient, with diagnosed hepatobilliary cancer. CT scan and MRI with intravenous contrast-enhanced, histological and immunohistochemical study of postoperative material (right-sided hemihepatectomy) were also performed.
Results: difference in the accumulation of 18F-Choline and 18F-FDG in some areas of mixed hepatocellular and  cholangiocellular cancer was detected: in the field of cholangiocellular cancer and in the field of poorly differentiated hepatocellular cancer.
cholangiocellular cancer was detected: in the field of cholangiocellular cancer and in the field of poorly differentiated hepatocellular cancer.
Conclusions: 18F-choline has a low diagnostic value in the detection of cholangiocellular cancer and poorly differentiated HCC, in contrast to 18F-FDG, whereas at high differentiated HCC study, 18F-choline is more preferable. Diagnostic value of 18F-FDG at high differentiated HCC is extremely low.
Введение
На сегодняшний день для диагностики поражений печени применяются такие методы, как ультра-звуковое исследование (УЗИ), компьютерная томография (КТ), магнитно-резонансная томография (МРТ), ангиография, позитронная эмиссионная томография (ПЭТ). Стремительное совершенствование технологий лучевых методов диагностики и внедрение гибридных систем с высокой точностью позволяют диагностировать солидные опухоли печени. При наличии хронических заболеваний печени, вызывающих дистрофические изменения гепатоцитов и эпителиальных клеток желчных протоков, независимо от их природы (вирусные гепатиты, алкогольное поражение печени, недостаточность альфа1-антитрипсина, гемохроматоз, тирозинемия типа I), распознать опухоль на ранних стадиях удается не всегда, так как она может развиваться на фоне имеющегося цирроза печени. Иногда даже при использовании высокотехнологических методов визуализации признаки опухоли печени могут трактоваться как прогрессирование цирроза.
Гепатоцеллюлярный рак (ГЦР) – злокачественная опухоль печени, развивающаяся из гепатоцитов. На долю гепатоцеллюлярного рака приходится 80-90% первичных злокачественных опухолей печени [1]. По данным ВОЗ по частоте возникновения гепатоцеллюлярный рак занимает 5-е место у мужчин и 8-е место у женщин среди всех злокачественных новообразований. Мужчины болеют в 2 раза чаще, средний возраст больных 50 лет [2]. Летальность через год с момента выявления заболевания у мужчин составляет 75%, у женщин – 71,4% [3]. В 60–90% случаев ГЦР возникает на фоне цирроза печени, частой причиной которого являются гепатит В или С [4–7], при этом 50-55% приходятся на долю HBV-инфекции и около 20-30% на долю HCV-инфекции [8,9].
Холангиоцеллюлярный рак (ХЦР) – опухоль, развивающаяся из клеток эпителия желчных протоков. На холангиокарциному с внутрипеченочной локализацией приходится приблизительно 5–30% всех первичных злокачественных новообразований печени, и она занимает 2-е место по встречаемости после ГЦР. Чаще всего опухоль развивается в возрасте 60–70 лет. За последние 30 лет частота выявления ХЦР увеличилась, что связано как с развитием методов диагностики, так и с увеличением истинного количества больных [10]. Факторы риска включают первичный склерозирующий холангит, холедохо- и гепатолитиаз, билиодигестивные анастомозы, неспецифический язвенный колит, аденомы гепатикохоледоха, множественный папилломатоз, врожденный фиброз и паразитарные инвазии [11].
Смешанный гепатохолангиоцеллюлярный рак является редким типом опухоли печени. Этиологические факторы и демографические особенности данного заболевания изучены недостаточно, однако фоновые заболевания, такие как гепатиты и цирроз выявляются у большинства больных. Смешанный рак обладает агрессивным течением: 3-х и 5-летняя выживаемость составляют 30% и 18%, после резекций – 38% и 24% соответственно [12]. Каждый из методов лучевой диагностики позволяет выявлять ряд признаков, характерных для ГЦР и ХЦР. Несмотря на это, зачастую возникают дифференциально-диагностические трудности даже при отсутствии фонового хронического процесса в печени. Так, при УЗИ первичные злокачественные опухоли малых размеров (<2 см) могут быть гипо-, изо- или гиперэхогенными относительно паренхимы печени, то есть иметь схожие характеристики с фокальной нодулярной гиперплазией (ФНГ) и кавернозной гемангиомой [13]. Патогномоничным для ГЦР является исчезновение нормальной печеночной триады (артерия, вена, желчный проток), появление патологического нестандартного ангиогенеза [14], или артерио-венозного шунта − признак, который определяется при УЗ-исследовании в допплер-режиме. УЗИ с внутривенным контрастированием обладает высокой чувствительностью (92%) и специфичностью (87–96%) в диагностике ГЦР и ХЦР [15, 16]. Как правило, в низко и умереннодифференцированных опухолях «вымывание» контрастного препарата происходит быстрее, чем при высокодифференцированных. Артериальная и венозная фазы являются наиболее информативными при КТ с внутривенным контрастированием в диагностике ГЦР и ХЦР. Отсроченная фаза предполагает выявление опухоли с высоким кровотоком, что опосредованно может свидетельствовать о низкой степени ее дифференцировки. Крупные узлы ГЦР и ХЦР часто гетерогенны вследствие наличия зон некроза или кровоизлияний. В портальную фазу контрастирования происходит быстрое «вымывание» контрастного вещества из узла, он становится изоденсным. Иногда обнаруживается капсула опухоли, а также более мелкие очаги – внутрипеченочные метастазы [17]. При нативном исследовании чаще всего узлы ГЦР и ХЦР представлены изо- или гиподенсными участками [18]. При МРТ применение парамагнетиков значительно повышает возможности дифференциальной диагностики различных узловых новообразований в печени, в том числе регенераторных и диспластических узлов. В артериальную фазу большинство узлов ГЦР и ХЦР при МРТ характеризуются диффузным контрастированием всего объема опухоли. На диффузионно-взвешенных изображениях узлы ГЦР и ХЦР, как правило, гиперинтенсивны [19–22]. В ряде случаев, структура опухоли может представлять неоднородный характер за счет сопутствующих кровоизлияний, жировых включений и некротических изменений [23]. На сегодняшний день позитронная эмиссионная томография (ПЭТ) в диагностике ГЦР не получила широкого клинического применения. По данным литературы, чувствительность ПЭТ-КТ с 18F-ФДГ (18Фтор-флюоро-2-дезокси-D-глюкоза) к ГЦР не превышает 40–70% [24, 25]. Низкая степень включения 18F-ФДГ в высокодифференцированных опухолях связана с высокой концентрацией фермента глюкозо-6-фосфатазы, что не позволяет визуализировать опухолевые очаги на фоне физиологического накопления РФП в неизмененной паренхиме печени. При ХЦР и низкодифференцированном ГЦР, характеризующихся повышенными энергетическими требованиями клеток, диагностические возможности 18F-ФДГ существенно выше. Значительную роль ПЭТ/КТ с 18F-ФДГ играет и в диагностике внутри- и внепеченочной распространенности ГЦР и ХЦР [26–28]. В последнее время активно разрабатываются новые РФП для ПЭТ. Что касается диагностики ГЦР, наиболее интересным представляется 18F-холин – радиофармпрепарат, отображающий липидный обмен. Существует несколько путей метаболизма холина в печени. Один из них заключается в синтезе фосфатидилхолинов, которые являются самыми распространенными компонентами клеточных мембран. Причины повышенного метаболизма холина в клетках высокодифференцированного гепатоцеллюлярного рака изучены не достаточно хорошо. Однако, благодаря ряду исследований, выяснилось, что в клетках высокодифференцированного гепатоцеллюлярного рака возрастает концентрация таких ферментов, как холин-киназа и цитидин-дифосфат холин (CDP-Cho), первых веществ в цепочке преобразования холина в молекулу фосфатидилхолина. С другой стороны, концентрация указанных ферментов в клетках низкодифференцированного гепатоцеллюлярного рака снижена [29]. Известно, что для формирования мембран активно делящихся опухолевых клеток необходим холин, что и приводит к повышенному накоплению 18F-холина. Проведены единичные исследования по изучению возможностей холина в сравнении с ФДГ в диагностике различных опухолей, в том числе ГЦР и ХЦР. Например, по данным ряда авторов, чувствительность ПЭТ/КТ с 18F-ФДГ в диагностике низкодифференцированных ГЦР и внутрипеченочных холангиокарцином достигает 91,3%, в то время как чувствительность ПЭТ/КТ с 18F-холином при этих опухолях составляет всего 40%. В связи с этими особенностями, представляется интересным изучение возможностей каждого из РФП в дифференциальной диагностике высокодифференцированных ГЦР и смешанного гепатохолангиоцеллюлярного рака [30–33].
Клинический пример
 Пациентка Н., 70 лет, обратилась в поликлинику по месту жительства с жалобами на боль и тяжесть в правом подреберье, слабость, периодическую горечь во рту. Отметила значительное снижение веса за последние 6 месяцев. По данным УЗИ было выявлено объёмное образование в правой доле печени, при повторном динамическом УЗИ через 2 месяца отмечено увеличение образования в размерах. По данным МРТ – объёмное образование в печени, выполняющее весь объем правой доли печени. В связи с чем, по месту жительства пациентке была выполнена трепан-биопсия печени. Гистологическое исследование полученного биоптата оказалось малоинформативным, поскольку материал был
Пациентка Н., 70 лет, обратилась в поликлинику по месту жительства с жалобами на боль и тяжесть в правом подреберье, слабость, периодическую горечь во рту. Отметила значительное снижение веса за последние 6 месяцев. По данным УЗИ было выявлено объёмное образование в правой доле печени, при повторном динамическом УЗИ через 2 месяца отмечено увеличение образования в размерах. По данным МРТ – объёмное образование в печени, выполняющее весь объем правой доли печени. В связи с чем, по месту жительства пациентке была выполнена трепан-биопсия печени. Гистологическое исследование полученного биоптата оказалось малоинформативным, поскольку материал был 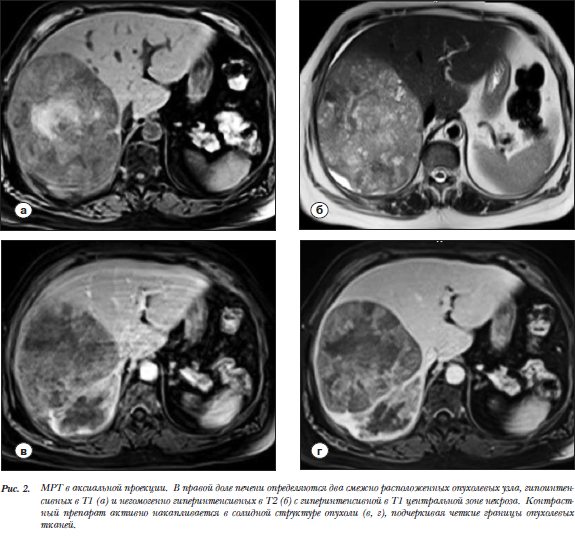 представлен, в основном, некротическим детритом. Данных о гепатите В, С и циррозе печени не получено. С предположительным диагнозом: первичный рак правой доли печени, узловая форма, в ФГБУ «РОНЦ им. Н.Н. Блохина» пациентке проведено обследование, включающее УЗИ, КТ, МРТ с контрастным усилением и ПЭТ с 18F-ФДГ и 18F-холином. Компьютерная томография выполнялась на мультиспиральном томографе (Siemens Somatom Sensation 64) с внутривенным болюсным введением контрастного препарата «Омнипак - 350» в объеме 100 мл со скоростью 2,5 мл/сек. Исследование состояло из четырех фаз: нативная (до введения контрастного препарата), артериальная (задержка 15 с.), венозная (70 с.),
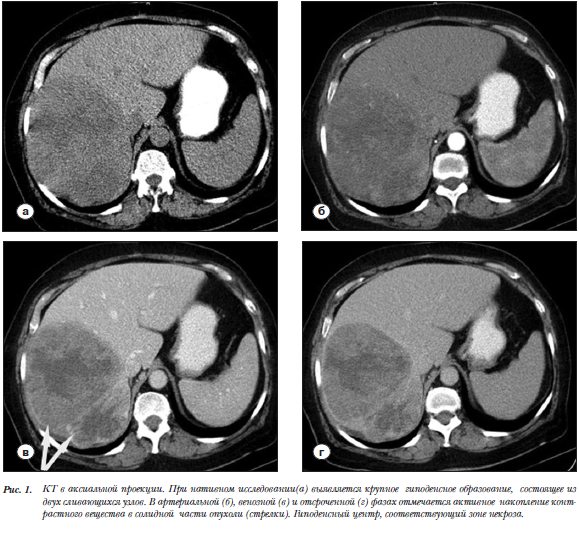
представлен, в основном, некротическим детритом. Данных о гепатите В, С и циррозе печени не получено. С предположительным диагнозом: первичный рак правой доли печени, узловая форма, в ФГБУ «РОНЦ им. Н.Н. Блохина» пациентке проведено обследование, включающее УЗИ, КТ, МРТ с контрастным усилением и ПЭТ с 18F-ФДГ и 18F-холином. Компьютерная томография выполнялась на мультиспиральном томографе (Siemens Somatom Sensation 64) с внутривенным болюсным введением контрастного препарата «Омнипак - 350» в объеме 100 мл со скоростью 2,5 мл/сек. Исследование состояло из четырех фаз: нативная (до введения контрастного препарата), артериальная (задержка 15 с.), венозная (70 с.), 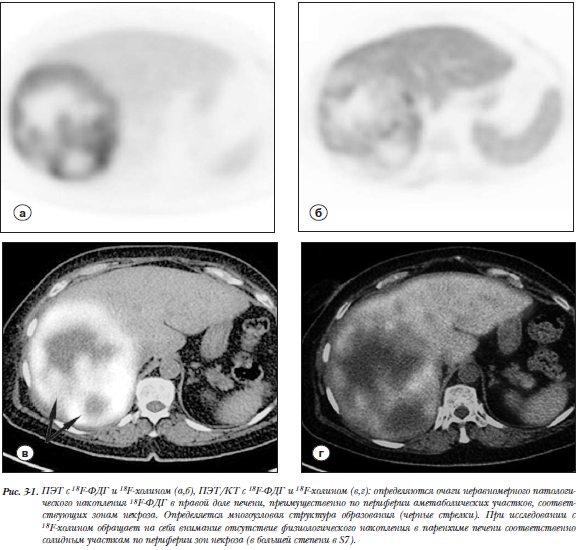 паренхиматозная (3 мин.). Структура паренхимы правой доли печени при КТ представлялась неоднородной за счет наличия крупного опухолевого гиподенсного конгломерата, состоящего из двух узлов (рис. 1а). При внутривенном контрастировании отмечено интенсивное накопление рентгеноконтрастного препарата в солидной части опухоли (рис.1 б,в,г, белые стрелки). Центральная зона некроза характеризовалась отсутствием выраженной фиксации контрастного вещества. Магнитно-резонансная томография проводилась на аппарате (Siemens MAGNETOM Espree, напряженностью поля - 1,5 Т). Исследование проводилось с синхронизацией с дыхательным циклом. Были
паренхиматозная (3 мин.). Структура паренхимы правой доли печени при КТ представлялась неоднородной за счет наличия крупного опухолевого гиподенсного конгломерата, состоящего из двух узлов (рис. 1а). При внутривенном контрастировании отмечено интенсивное накопление рентгеноконтрастного препарата в солидной части опухоли (рис.1 б,в,г, белые стрелки). Центральная зона некроза характеризовалась отсутствием выраженной фиксации контрастного вещества. Магнитно-резонансная томография проводилась на аппарате (Siemens MAGNETOM Espree, напряженностью поля - 1,5 Т). Исследование проводилось с синхронизацией с дыхательным циклом. Были  получены аксиальные срезы в режимах Т2 TSE, T2 HASTE, DWI, ADC, а также Т1ВИ GRE/VIBE с полной задержкой дыхания. Внутривенное констрастирование выполнялось с гепатотропным препаратом «Примовист» в объеме 10 мл в артериальную (20–25 сек.), портальную (60–70 сек.), равновесную (180 сек.) и гепатоспецифическую (10 мин.) фазы исследования. На МР-томограммах в правой доле печени определяется многоузловое образование гетерогенной структуры, с четкими границами относительно непораженной паренхимы печени. В режиме Т1 в централь-ной части опухоли отмечается зона повышенного сигнала, обусловленная геморрагическим
получены аксиальные срезы в режимах Т2 TSE, T2 HASTE, DWI, ADC, а также Т1ВИ GRE/VIBE с полной задержкой дыхания. Внутривенное констрастирование выполнялось с гепатотропным препаратом «Примовист» в объеме 10 мл в артериальную (20–25 сек.), портальную (60–70 сек.), равновесную (180 сек.) и гепатоспецифическую (10 мин.) фазы исследования. На МР-томограммах в правой доле печени определяется многоузловое образование гетерогенной структуры, с четкими границами относительно непораженной паренхимы печени. В режиме Т1 в централь-ной части опухоли отмечается зона повышенного сигнала, обусловленная геморрагическим 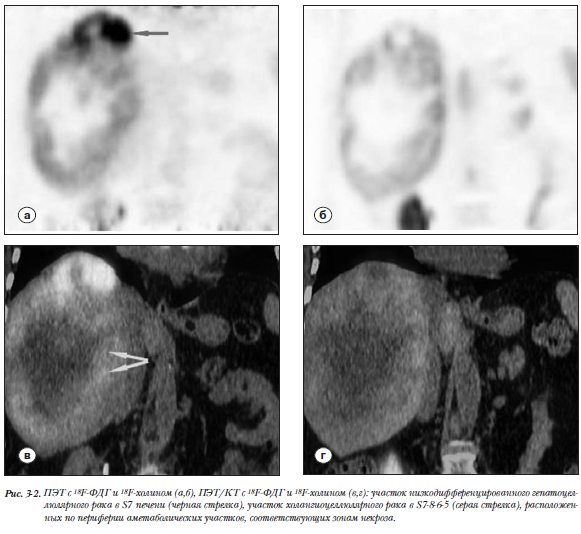 компонентом (рис. 2 а). В режиме Т2 образование характеризуется преимущественно гиперинтенсивным сигналом с множественными гипоинтенсивными включениями различного размера. Накопление контрастного препарата в структуре опухоли выраженное и неравномерное, что является характерным для ГЦР (рис.2). С учетом полученных данных КТ и МРТ, была выполнена повторная биопсия под контролем УЗИ с прицелом на краевые солидные фрагменты новообразования. Результат гистологического исследования – низкодифференцированный гепатоцеллюлярный рак. ПЭТ/КТ с 18F-ФДГ (Siemens
компонентом (рис. 2 а). В режиме Т2 образование характеризуется преимущественно гиперинтенсивным сигналом с множественными гипоинтенсивными включениями различного размера. Накопление контрастного препарата в структуре опухоли выраженное и неравномерное, что является характерным для ГЦР (рис.2). С учетом полученных данных КТ и МРТ, была выполнена повторная биопсия под контролем УЗИ с прицелом на краевые солидные фрагменты новообразования. Результат гистологического исследования – низкодифференцированный гепатоцеллюлярный рак. ПЭТ/КТ с 18F-ФДГ (Siemens 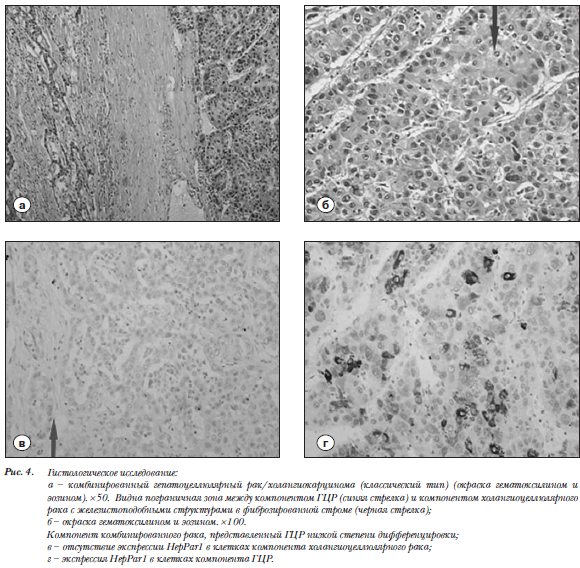 Biograph mСТ). Исследование выполнено натощак (не менее 6 часов голодания) с водной нагрузкой (0,5 литра воды). Внутривенно было введено 302 МБк 18F-ФДГ. Исследование проводилось через 50 минут. Продолжительность ПЭТ-исследования составила 7 минут на одну «кровать». На серии полученных томографических срезов были выявлены очаги патологического накопления РФП в солидных участках опухоли. Измерены уровни накопления РФП (maxSUV - standardized uptake value) в солидных участках двух опухолевых узлов, расположенных в S7 (maxSUV-25,74) и S7-8-6-5 (maxSUV-11,86). Кроме того, определяли уровни накопления в зонах некроза (maxSUV-2,51) и в неизмененной паренхиме печени (maxSUV-3,41).ПЭТ/КТ с 18F-холином. Подготовка и режимы исследования аналогичны ПЭТ/КТ с 18F-ФДГ. Внутривенно было введено 364 МБк 18F-холина, через 40 минут выполняли исследование с измерением уровней накопления РФП (maxSUV в узле в S7 – 14,20, в узле в S7-8-6-5 – 16,90, в зоне некроза – 2,45, в неизмененной паренхиме печени – 13,10) (рис. 3.1, 3.2). Пациентке была проведена правосторонняя гемиге-патэктомия с последующим гистологическим иссле-дованием. По результатам гистологического и иммуногистохимического исследования различных участков новообразования опухоль представляла собой комбинированный гепатоцеллюлярный рак/холангиокарциному (классический тип) [34]. Участок, соответствующий верхушке 7-го сегмента, − низкодифференцированный гепатоцеллюлярный рак (рис. 4 а,б). Большая же часть опухоли в 7-8-6-5 сегментах представлена холангиоцеллюлярным раком с зонами некроза (рис. 4 в,г), (рис. 3.2). Данное исследование показало, что существует корреляция между степенью злокачественности ГЦР и уровнем накопления РФП: низкодифференцированный гепатоцеллюлярный рак обладает высокой метаболической активностью, что подтверждается высокой степенью накопления 18F-ФДГ, и, по всей видимости, низкой активностью формирования мембранных комплексов – об этом свидетельствуют количественные значения накопления 18F-холина. Значительной разницы в уровне накопления обоих РФП в участке холангиоцеллюлярного рака относительно нормальной паренхимы печени при настоящем исследовании выявлено не было (табл.1).
Biograph mСТ). Исследование выполнено натощак (не менее 6 часов голодания) с водной нагрузкой (0,5 литра воды). Внутривенно было введено 302 МБк 18F-ФДГ. Исследование проводилось через 50 минут. Продолжительность ПЭТ-исследования составила 7 минут на одну «кровать». На серии полученных томографических срезов были выявлены очаги патологического накопления РФП в солидных участках опухоли. Измерены уровни накопления РФП (maxSUV - standardized uptake value) в солидных участках двух опухолевых узлов, расположенных в S7 (maxSUV-25,74) и S7-8-6-5 (maxSUV-11,86). Кроме того, определяли уровни накопления в зонах некроза (maxSUV-2,51) и в неизмененной паренхиме печени (maxSUV-3,41).ПЭТ/КТ с 18F-холином. Подготовка и режимы исследования аналогичны ПЭТ/КТ с 18F-ФДГ. Внутривенно было введено 364 МБк 18F-холина, через 40 минут выполняли исследование с измерением уровней накопления РФП (maxSUV в узле в S7 – 14,20, в узле в S7-8-6-5 – 16,90, в зоне некроза – 2,45, в неизмененной паренхиме печени – 13,10) (рис. 3.1, 3.2). Пациентке была проведена правосторонняя гемиге-патэктомия с последующим гистологическим иссле-дованием. По результатам гистологического и иммуногистохимического исследования различных участков новообразования опухоль представляла собой комбинированный гепатоцеллюлярный рак/холангиокарциному (классический тип) [34]. Участок, соответствующий верхушке 7-го сегмента, − низкодифференцированный гепатоцеллюлярный рак (рис. 4 а,б). Большая же часть опухоли в 7-8-6-5 сегментах представлена холангиоцеллюлярным раком с зонами некроза (рис. 4 в,г), (рис. 3.2). Данное исследование показало, что существует корреляция между степенью злокачественности ГЦР и уровнем накопления РФП: низкодифференцированный гепатоцеллюлярный рак обладает высокой метаболической активностью, что подтверждается высокой степенью накопления 18F-ФДГ, и, по всей видимости, низкой активностью формирования мембранных комплексов – об этом свидетельствуют количественные значения накопления 18F-холина. Значительной разницы в уровне накопления обоих РФП в участке холангиоцеллюлярного рака относительно нормальной паренхимы печени при настоящем исследовании выявлено не было (табл.1).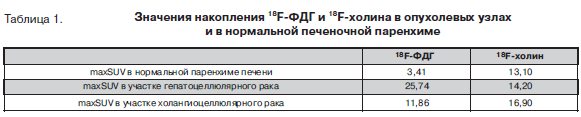
Заключение
Низкодифференцированный рак и холангиоцеллюлярный рак характеризовались высокими метаболическими показателями относительно неизмененной паренхимы печени. В солидной структуре низкодифференцированного рака печени наблюдался самый высокий уровень накопления 18F-ФДГ (maxSUV – 25,74) и наименьший уровень включения 18F-холина (maxSUV – 14,20), в ткани холангиоцеллюлярного рака степень накопления 18F-ФДГ и 18F-холина составила (maxSUV – 11,86 и 16,90 соответственно). Полученные данные показали, что 18F-холин обладает низкой диагностической ценностью в выявлении ХЦР и низкодифференцированного ГЦР, в отличие от 18F-ФДГ. При подозрении на высокодифферецированный ГЦР исследование с 18F-холином будет более предпочтительным. Диагностическая ценность 18F-ФДГ при высокодифференцированном ГЦР крайне низка. КТ и МРТ с контрастным усилением в комплексе с ПЭТ (18F-ФДГ и 18F-холином) значительно повышает качество первичной дифференциальной диагностики у больных с опухолевыми заболеваниями печени, а в некоторых случаях позволяет предположить их гистологическую природу.Список исп. литературыСкрыть список1. Патютко Ю.И., Сагайдак И.В., Чучуев Е.С. Гепатоцеллюлярный рак печени. Бюллетень медицинских интернет-конференций. 2011;1:35–61.
Patjutko Ju.I., Sagajdak I.V., Chuchuev E.S. Gepatocelljuljarnyj rak pecheni [Hepatocellular cancer]. Bjulleten' medicinskih internet-konferencij. 2011;1: 35–61 [In Russ].
2. Чиссов В.И. Онкология. М.: Гэотар-Медиа. 2007; С. 391–399
Chissov V.I. Onkologija [Oncology]. M.: Gjeotar-Media. 2007; 391–399 [In Russ].
3. Суконко О.Г. Гепатоцеллюлярный рак. Алгоритм диагностики и лечения злокачественных новообразований. М.: Медиа Сфера. 2012; 127–135.
Sukonko O.G. Gepatocelljuljarnyj rak. Algoritm diagnostiki i lechenija zlokachestvennyh novoobrazovanij[Hepatocellular cancer. Algorithm of diagnostics and treatment of malignant neoplasms] M.: Media Sfera. 2012; 127–135 [In Russ].
4. Bosh F.X., Ribes J., Borras J. Epidemiology of primary liver cancer. Semin. Liver dis., vol.19. 1999; 271–285.
5. Beasley R.P., Hwang L.Y. Overview on the epidemiology of hepatocellular carcinoma. Viral hepatitis and liver disease. 1991; 532–535.
6. Huo T.I., Lee S.D., Wu J.C. For hepatocellular carcinoma: look for a perfect classification system. J. Hepatol. 20–4; .40(6): 1041–1042.
7. Barazani Y., Hiatt J.R., Tong M.J. et al. Сhronic viral hepatitis and hepatocellular carcinoma. World J. Surg. 2007; 31: 1245–250.
8. Jeong S., Aviata H., Katamura Y. Low-dose intermittent interferon — alpha-therapy for HCV — related liver cirrosis after curative treatment of hepatocellular carcinoma. World J. Gastroenterology. 2007;113; 5188–5195.
9. Зогот С.Р., Акберов Р.Ф. Гепатоцеллюлярный рак (эпидемиология, лучевая диагностика, современные аспекты лечения). Лекции для врачей общей практики, онкология, практическая медицина, хирургия. 2013; 112–115.
Zogot S.R., Akberov R.F. Gepatocelljuljarnyj rak (jepidemiologija, luchevaja diagnostika, sovremennye aspekty lechenija). Lekcii dlja vrachej obshhej praktiki, onkologija, prakticheskaja medicina, hirurgija [Hepatocellular cancer (epidemiology, radiodiagnostics, modern aspects of treatment). Lectures for general practice doctors, oncology, practical medicine, surgery]. 2013; 112–115 [In Russ].
10. Майстренко Н.А., Шейко С.Б., Алентьев А.В. Холангиоцеллюлярный рак (особенности диагностики и лечения). Практическая онкология. 2009; 9(4): 229–236.
Majstrenko N.A., Shejko S.B., Alent'ev A.V. Holangiocelljuljarnyj rak (osobennosti diagnostiki i lechenija) [Cholangiocellular cancer (features of diagnostics and treatment)]. Prakticheskaja onkologija. 2009; 9(4): 229–236 [In Russ].
11. Ward J., Robinson P. How to detect hepatocellular carcinoma in cirrhosis. Eur. Radiology. 2002; 2258–2273.
12. Zhang F., Chen X.-P., Zhang W. et al. Combined hepatocellular cholangiocarcinoma originating from hepatic progenitor cells: immunohistochemical and double-fluorescence immunostaining evidence. Histopathology. 2008; 52: 224–232.
13. Caturelli E., Pompili M. Hemangioma-like lesions in chronic liver disease: diagnostic evaluation in patients. Radiology. 2001; 337–342.
14. Matsui O., Kadoya M., Kameyama T. Benign and malignant nodules in cirrhotic livers: distinction based on blood supply. Radiology. 1991; 493–497.
15. Xu H.X., Liu G.J., Lu M.D. Characterization of focal liver lesions using contrast-enhanced sonography with a low mechanical index mode and a sulfur hexafluoride-filled microbubble contrast agent. J. Clin Ultrasound. 2006; 261–272.
16. Lencioni R., Piscaglia F. Contrast-enhanced ultrasound in the diagnosis of hepatocellular carcinoma. Journal Of Hepatology. 2008; 48: 848–857.
17. Prokop M. Spiral and multislice computed tomography of the body. Georg Thieme Verlag. 2003; Р 234–240.
18.Tiferes D., D’ippolito G. Liver neoplasms: imaging characterization. Radiol. Bras. 2008; 41(2): 119–127.
19. Медведева Б.М., Лукьянченко А.Б. Возможности МРТ в диагностике гепатоцеллюлярного рака у пациентов с циррозом печени. Rejr. 2013; 3(2): 63.
Medvedeva B.M., Luk'janchenko A.B. Vozmozhnosti MRT v diagnostike gepatocelljuljarnogo raka u pacientov s cirrozom pecheni [Possibilities of MRI in diagnostics of hepatocellular cancer in patients with liver cirrhosis ]. Rejr. 2013; 3(2): 63 [In Russ].
20. Jeong Y., Yim N., Kang H. Hepatocellular carcinoma in the cirrhotic liver with helical CT and MRI: imaging spectrum and pitfalls of cirrhosis-related nodules. Ajr. 2005; 1024–1032.
21. Lee M.H., Kim S.H., Park M.J., Park C.K. Gadoxetic acid–enhanced hepatobiliary phase MRI and high-b-value diffusion-weighted imaging to distinguish well-differentiated hepatocellular carcinomas from benign nodules in patients with chronic liver disease. Ajr. 2011; 197: 868–875.
22. Nasu K., Kuroki Y., Tsukamoto T. Diffusion-weighted imaging of surgically resected hepatocellular carcinoma: imaging characteristics and relationship among signal intensity, apparent diffusion coefficient, and histopathologic grade. Ajr. 2009; 193: 438–444.
23. Ferucci J. MRI of the liver. Amer. J. Roentgenol. 1985; 147: 1103–1116.
24. Yamamoto Y., Nishiyama Y. Detection of hepatocellular carcinoma using 11C-choline PET: comparison with 18F-FDG PET. The journal of nuclear medicine. 2008; 49(8): 1245–1248.
25. Hwang K.H., Choi D.-J. Evaluation of patients with hepatocellular carcinomas using [11C]-acetate and [18F]-FDG PET/CT: a preliminary study. Radiation and isotopes. 2009; 67: 1195–1198.
26. Talbot J., Gutman F. PET/CT in patients with hepatocellular carcinoma using [18F]- fluorocholine: preliminary comparison with [18F]-FDG PET/CT. Eur. J. Nucl. Med. 2006; 33: 1285–1289.
27. Сhang M., Seungmin B. Usefulness of 18F-fluorodeoxyglucose positron emission tomography in differential diagnosis and staging of cholangiocarcinomas. Journal of gastroenterology and hepatology. 2008; 23: 759–765.
28. Kluge R., Schmidt F., Caca K. Positron emission tomography with [18F]fluoro-2-deoxy-d-glucose for diagnosis and staging of bile duct cancer. Hepatology. 2001; 33: 1029–1035.
29. Kuang Y., Salem N. Transport and metabolism of radiolabeled choline in hepatocellular carcinoma. Molecular рharmaceutics. 2010; 6: 2077–2092.
30. Trojan J., Schroeder O., Raedle J. Fluorine-18FDG positron emission tomography for imaging of hepatocellular carcinoma. Am. J. Gastroenterol. 1999; 94: 3314–3319.
31. Esschert J.W., Bieze M. Differentiation of hepatocellular adenoma and focal nodular hyperplasia using 18F-fluorocholine PET/CT. Eur. J. Nucl. Med. 2011; 38: 436–440.
32. Lee J., Paeng J. Prediction of tumor recurrence by 18F-FDG PET in liver transplantation for hepatocellular carcinoma. J. Nucl. Med. 2009; 50: 682–687.
33. Kuang Y., Salem N. Imaging lipid synthesis in hepatocellular carcinoma with [methyl-11C]-choline: correlation with in vivo metabolic studies. J. Nucl. Med. 2011; 52: 98–106.
34. Bosman F., Carneiro F., Ruban R. Classification of tumors of the digestive system. 2010; 201–207.
