Диагностическая и интервенционная радиология 2015
№02 2015
Возможности магнитно-резонансной томографии в диагностике новообразований сердца №02 2015
Материалы и методы: ретроспективно изучены клинические случаи новообразований сердца, диагностированные и оперированные в ФГБУ «ФЦССХ» Минздрава России (г. Пенза) с 2008 по 2014 г. Всем пациентам при поступлении выполнялась эхокардиография (ЭхоКГ), после которой в ряде случаев для уточнения топографии новообразования и особенностей индивидуальной анатомии выполнялась МРТ. В послеоперационном периоде проводились контрольные исследования. Во всех случаях диагноз был гистологически верифицирован. Все прооперированные больные были выписаны в удовлетворительном со-стоянии. Был выполнен поиск и анализ научной литературы по лучевой диагностике объемных образований сердца.
Результаты: за 6 лет в ФГБУ «ФЦССХ» Минздрава России (г. Пенза) прошли обследование и оперативное лечение более 30 тысяч пациентов, из них объемные новообразованиями сердца выявлены в 25(0,08%) случаях. Миксома выявлена у 19(76%) пациентов, из них в 2(8%) случаях эхокардиографическая картина была неоднозначна, что потребовало подтверждения магнитно резонансной томографией. МРТ также использовалось у 2(8%) пациентов с доброкачественной и озлокачествленной мезенхиомами, и в единичных случаях (по 4%) рабдомиомы, липоматозной гипертрофии межпредсердной перегородки, эпителиоидноклеточной лейомиомы прорастающей из матки в предсердие и метастаза меланомы. Также в ряде случаев применение МРТ позволило исключить новообразование и распознать пристеночный тромб.
МРТ позволила в процессе одного исследования детально изучить морфологию и лока-лизацию новообразования, оценить его пространственные взаимоотношения с соседними структурами, изучить объемные и функциональные параметры сердца. Динамический ре-жим (Cine-SSFP), плоскостная и объемная реконструкция (MPR) наглядно продемонстри-ровали топографию новообразования. Это помогло широкому дооперационному понима-нию патологии и упростило принятие хирургических решений. МРТ позволила проанали-зировать результаты хирургической коррекции и осуществить динамическое наблюдение в ранний и отдаленный послеоперационные периоды.
Выводы: МРТ в диагностике объемных новообразований сердца существенно дополняет ЭхоКГ, обеспечивая неинвазивную мультимодальную визуализацию, необходимую для всесторонней оценки топографии новообразований, выявления индивидуальных анатомических особенностей внутрисердечных и экстракардиальных структур. МРТ должна входить в алгоритм диагностики объемных новообразований сердца в том числе и для оценки наступивших гемодинамических изменений.
Ключевые слова:
• новообразования сердца
• опухоли сердца
• МРТ сердца
Цель исследования: показать возможности метода магнитно-резонансной томографии (МРТ) в выявлении и характеристике объемных новообразований сердца.
Материалы и методы: ретроспективно изучены клинические случаи новообразований сердца, диагностированные и оперированные в ФГБУ «ФЦССХ» Минздрава России (г. Пенза) с 2008 по 2014 г. Всем пациентам при поступлении выполнялась эхокардиография (ЭхоКГ), после которой в ряде случаев для уточнения топографии новообразования и особенностей индивидуальной анатомии выполнялась МРТ. В послеоперационном периоде проводились контрольные исследования. Во всех случаях диагноз был гистологически верифицирован. Все прооперированные больные были выписаны в удовлетворительном со-стоянии. Был выполнен поиск и анализ научной литературы по лучевой диагностике объемных образований сердца.
Результаты: за 6 лет в ФГБУ «ФЦССХ» Минздрава России (г. Пенза) прошли обследование и оперативное лечение более 30 тысяч пациентов, из них объемные новообразованиями сердца выявлены в 25(0,08%) случаях. Миксома выявлена у 19(76%) пациентов, из них в 2(8%) случаях эхокардиографическая картина была неоднозначна, что потребовало подтверждения магнитно резонансной томографией. МРТ также использовалось у 2(8%) пациентов с доброкачественной и озлокачествленной мезенхиомами, и в единичных случаях (по 4%) рабдомиомы, липоматозной гипертрофии межпредсердной перегородки, эпителиоидноклеточной лейомиомы прорастающей из матки в предсердие и метастаза меланомы. Также в ряде случаев применение МРТ позволило исключить новообразование и распознать пристеночный тромб.
МРТ позволила в процессе одного исследования детально изучить морфологию и лока-лизацию новообразования, оценить его пространственные взаимоотношения с соседними структурами, изучить объемные и функциональные параметры сердца. Динамический ре-жим (Cine-SSFP), плоскостная и объемная реконструкция (MPR) наглядно продемонстри-ровали топографию новообразования. Это помогло широкому дооперационному понима-нию патологии и упростило принятие хирургических решений. МРТ позволила проанали-зировать результаты хирургической коррекции и осуществить динамическое наблюдение в ранний и отдаленный послеоперационные периоды.
Выводы: МРТ в диагностике объемных новообразований сердца существенно дополняет ЭхоКГ, обеспечивая неинвазивную мультимодальную визуализацию, необходимую для всесторонней оценки топографии новообразований, выявления индивидуальных анатомических особенностей внутрисердечных и экстракардиальных структур. МРТ должна входить в алгоритм диагностики объемных новообразований сердца в том числе и для оценки наступивших гемодинамических изменений.
Ключевые слова:
• новообразования сердца
• опухоли сердца
• МРТ сердца
Possibilities of mri in diagnosis of heart neoplasms
*Paramonova T.I. – MD, PhD
Vdovkin A.V.– MD
Karpukhin V.G. – MD
Palkova V.A. – MD
Federation National Center of Cardiovascular Surgery
6, Stasova str, Penza, Russian Federation, 440071
ABSTRACT:
Aim: was to show possibilities of magnetic resonance imaging (MRI) in the detection and characterization of neoplasms of the heart.
Materials and methods: we retrospectively studied clinical cases of heart neoplasms, diagnosed and operated in Federal National Center of Cardiovascular Surgery (FNCCS) (Penza) since 2008 to 2014. All patients on admission underwent echocardiography, after which, in some cases to clarify the topography of neoplasms and features of individual anatomy - MRI was performed. In postoperative follow-up period, control studies were conducted. In all cases, the diagnosis was histologically verified. All operated patients were discharged in satisfactory condition. We made a search and analysis of scientific literature on beam diagnostics of space-occupying lesions of heart.
Results: for the period of 6 years, in FNCCS were examined and surgical treatment of more than 30 thousand patients, of which neoplasms of the heart were detected in 25(0.08%) cases. Cardiac myxoma was diagnosed in 19(76%) patients, of whom in 2(8%) cases, the echocardiographic picture was mixed, that had required magnetic resonance imaging. MRI has also been used in
2(8%) patients with benign and malignant transformation of mesenchyoma, and in few cases (4%) rhabdomyomas, lipomatous hypertrophy, atrial septum, epithelioid leiomyoma of the uterus in the germinating atrium and metastatic melanoma. Also, in some cases, the use of MRI allowed to rule out malignancy and to identify mural thrombus.
In 1 case, MRI gave, a detailed study of the morphology and localization of tumors to evaluate its spatial relationship with neighboring structures, study of three-dimensional and functional parameters of the heart. Dynamic mode (Cine-SSFP), planar and volumetric reconstruction (MPR) demonstrated the topography of tumors. That helped a broad understanding of the pre-operative pathology and surgical simplified decision-making. MRI allowed to analyze results of surgical correction and implement dynamic monitoring during the early and late postoperative period.
Conclusions: MRI in the diagnosis of tumors of the heart significantly complements echocardiography, providing a non-invasive multi-modal visualization, necessary for a comprehensive assessment of the topography of lesions, detection of individual anatomical features of intracardiac and extracardiac structures.
MRI should be included in the diagnostic algorithm of tumors of the heart, including to assess occured hemodynamic changes.
Key-words:
• neoplasms of the heart
• cardiac tumors
• СMR
Введение
Среди новообразований различных локализаций, частота поражения сердца составляет 0,05% [1,2]. По данным клиники Mэйo (США) за год регистрируется в среднем не более одного случая [3]. Опухоли сердца при несвоевременной диагностике и лечении становятся причиной ранней смерти больного [4,5].
Основной проблемой является их низкая клиническая выявляемость, составляющая всего 5–10% случаев [2,6]. Поэтому для ранней диагностики достаточно актуальны лучевые методы. В настоящее время на начальном этапе ведущая роль принадлежит трансторакальной эхокардиографии (ЭхоКГ) [5,7], которая позволяет судить о локализации новообразования, его форме, размере и подвижности, тем самым предоставляя достаточно информации для диагностики. Однако метод имеет ряд ограничений: зависимость от оператора, низкое качество визуализации у пациентов с высоким индексом массы тела, затруднение оценки правых камер сердца. Чреспищеводная ЭхоКГ, применяемая для улучшения визуализации камер сердца, является инвазивной и имеет ограниченные углы обзора [8, 9].
На современном этапе развития медицины возросла роль МРТ. Благодаря постоянному технологическому прогрессу увеличиваются разрешающие возможности визуализации органов и тканей, снижается время обработки полученной информации, что повышает актуальность МРТ в оценке морфофункциональных параметров сердца [7,10,11]. В частности, метод МРТ нашел широкое применение в диагностике объёмных образований сердца [7–9, 12,13].
Цель исследования показать возможности метода магнитно – резонансной томографии (МРТ) в выявлении и характеристике объемных новообразований сердца.
Материалы и методы
Ретроспективно изучены клинические случаи новообразований сердца, диагностированные и оперированные в ФГБУ «ФЦССХ» Минздрава России (г. Пенза) с 2008 по 2014 год. За 6 лет прошли обследование и оперативное лечение более 30 тысяч пациентов. Всем пациентам при поступлении выполнялась ЭхоКГ, после которой в ряде случаев для уточнения топографии новообразования и особенностей индивидуальной анатомии выполнялась МРТ. В послеоперационном периоде проводились контрольные исследования. Во всех случаях диагноз был гистологически верифицирован. Все прооперированные больные были выписаны в удовлетворительном состоянии. Был выполнен поиск и анализ научной литературы по лучевой диагностике объемных образований сердца.
Протокол проведения МРТ сердца
Исследование выполнялось на аппарате Siemens Magnetom Avanto напряженностью магнитного поля
1,5 Тесла. Сканирование проводилось согласно стандартному протоколу с задержкой дыхания. Использованы Т1 и Т2 - взвешенные изображения (Т1-WS, Т2-WS), импульсная последовательность «градиентное эхо» (GE) и динамический режим (Cine-SSFP) в стандартных проекциях [8,12].
Для дифференциальной диагностики использовали сканирование с контрастным усилением в тех же режимах. В качестве контрастного вещества (КВ) использовались омнискан (0,2 мл/кг) или гадовист (0,1 мл/кг) с болюсным введением автоматическим инъектором. Наличие и характер накопления КВ оценивался в раннюю и отсроченную фазы контрастирования.
На основании полученных изображений на рабочих станциях в программе Argus (Siemens) или QMass и QFlow (Medis) производилась плоскостная и объемная реконструкция (MPR) с целью наглядной демонстрации топографии новообразования.
Результаты
За 6 лет в ФГБУ «ФЦССХ» Минздрава России (г. Пенза) прошли обследование и оперативное лечение более 30 тысяч пациентов, из них объемные новообразования сердца выявлены в 25(0,08%) случаях. Миксома обнаружена у 19(76%) пациентов, из них в 2(8%) случаях эхокардиографическая картина была неоднозначна, что потребовало подтверждения магнитно – ре-зонансной томографией. Также МРТ использовалось в единичных случаях (по 4%) доброкачественной и озлокачествленной мезенхиом, рабдомиомы, липоматозной гипертрофии межпредсердной перегородки, эпителиоидноклеточной лейомиомы прорастающей из матки в предсердие и метастаза меланомы. Также в ряде случаев МРТ позволило исключить новообразование и распознать пристеночный тромб.
Стандартное МРТ исследование обеспечило непосредственную визуализацию объемных образований, последующая обработка срезов в MPR режиме позволила проводить многомерные реконструкции и демонстрировать пространственные взаимоотношения новообразования. В послеоперационном периоде МРТ позволила оценить динамику сократительной способности миокарда и изменившуюся внутрисердечную гемодинамику.
Клинический пример 1
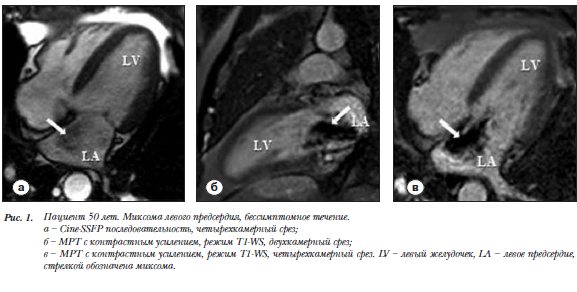 Пациент 49 лет. Миксома левого предсердия (ЛП), бессимптомное течение. В ЛП объемное образование 5,8´3,9´3,5 см с неровными контурами, широким основанием прилежащее к межпредсердной перегородке (МПП), не создающее обструкцию митрального клапана. Внутренняя структура образования неоднородна, сигнал на Т1-WS изоинтенсивен миокарду, на Т2-WS гиперинтенсивный, на сканах в GE последовательности сигнал гипоинтенсивный (рис. 1а). При контрастном усилении – накопление КВ в образовании (рис. 1б,в).
Пациент 49 лет. Миксома левого предсердия (ЛП), бессимптомное течение. В ЛП объемное образование 5,8´3,9´3,5 см с неровными контурами, широким основанием прилежащее к межпредсердной перегородке (МПП), не создающее обструкцию митрального клапана. Внутренняя структура образования неоднородна, сигнал на Т1-WS изоинтенсивен миокарду, на Т2-WS гиперинтенсивный, на сканах в GE последовательности сигнал гипоинтенсивный (рис. 1а). При контрастном усилении – накопление КВ в образовании (рис. 1б,в).
Клинический пример 2
Пациент 60 лет. Миксома ЛП с клинической 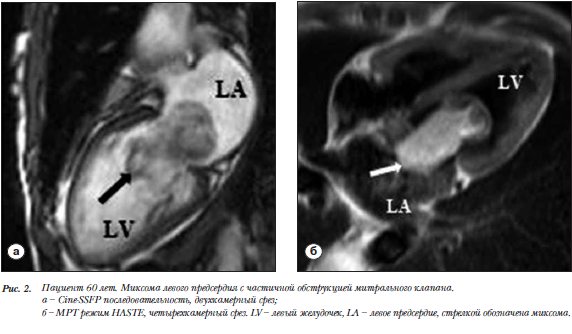 картиной частичной обструкции митрального клапана (МК).
картиной частичной обструкции митрального клапана (МК).
В дилатированном ЛП объемное образование 7,4´4,1´2,6 см с четкими контурами, прикрепляющееся к средней трети МПП. Сигнал на Т1-WS изоинтенсивен миокарду, на Т2-WS более интенсивный, GE сигнал гипоинтенсивный. В диастолу опухоль частично пролабирует в полость левого желудочка (ЛЖ) через дилатированное до 4,1 см отверстие МК, с неполным его обтурированием (рис. 2а). При контрастном усилении накопление КВ в образовании (рис. 2б).
Клинический пример 3
Пациентка 65 лет. Тромб левого предсердия (ЛП), выявленный при дифференциальной диагностике между миксомой и неопухолевым образованием 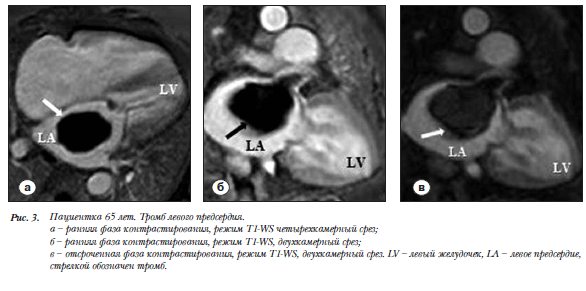 предсердия. В дилатированном ЛП образование 7,0´8,0´4,5 см с неровным контуром исходит из ушка ЛП и создает выраженную обструкцию МК. В Т1-WS и Т2-WS регистрируют изоинтенсивный сигнал. В режиме Cine-SSFP образование изоинтенсивно миокарду. После контрастирования в раннюю фазу сигнал от образования гипоинтенсивный, четко дифференцируется по отношению к миокарду и к полостям сердца (рис. 3a,б). В отсроченную фазу контрастирования образования не наблюдается (рис. 3в).
предсердия. В дилатированном ЛП образование 7,0´8,0´4,5 см с неровным контуром исходит из ушка ЛП и создает выраженную обструкцию МК. В Т1-WS и Т2-WS регистрируют изоинтенсивный сигнал. В режиме Cine-SSFP образование изоинтенсивно миокарду. После контрастирования в раннюю фазу сигнал от образования гипоинтенсивный, четко дифференцируется по отношению к миокарду и к полостям сердца (рис. 3a,б). В отсроченную фазу контрастирования образования не наблюдается (рис. 3в).
Клинический пример 4
Пациентка 1 год и 2 мес. Сочетание 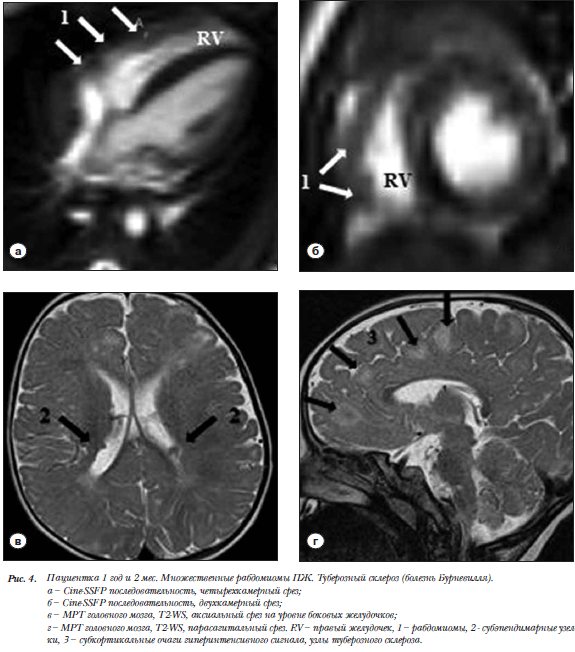 множественных рабдомиом ПЖ и туберозного склероза головного мозга (болезнь Бурневилля). В стенках ПЖ определяются множественные объемные новообразования до 0,4 см, не создающие обструкцию выходного тракта. На Т1-WS образования изоинтенсивны миокарду, на Т2-WS гиперинтенсивны (рис. 4а,б). Наблюдается незначи-тельное накопление КВ. При МРТ головного мозга в боковых желудочках субэпендимарные узелки, морфологически характерные для туберозного склероза (рис. 4в). В Т2-режиме гиперинтенсивные участки в белом веществе боковых желудочков (рис. 4г).
множественных рабдомиом ПЖ и туберозного склероза головного мозга (болезнь Бурневилля). В стенках ПЖ определяются множественные объемные новообразования до 0,4 см, не создающие обструкцию выходного тракта. На Т1-WS образования изоинтенсивны миокарду, на Т2-WS гиперинтенсивны (рис. 4а,б). Наблюдается незначи-тельное накопление КВ. При МРТ головного мозга в боковых желудочках субэпендимарные узелки, морфологически характерные для туберозного склероза (рис. 4в). В Т2-режиме гиперинтенсивные участки в белом веществе боковых желудочков (рис. 4г).
Клинический пример 5
Пациентка 62 года. Липоматозная гипертрофия МПП. Случайная находка при обследовании по поводу аневризмы ЛЖ. Межпредсердная перегородка утолщена на протяжении более 2 см, за исключением области овальной ямки (по типу «песочных часов»). В Т1-WS сигнал от МПП усилен и изоинтенсивен сигналу от подкожной жировой клетчатки (рис. 5а,б). В режиме жироподавления структура образования гипоинтенсивна (рис. 5в).
Клинический пример 6
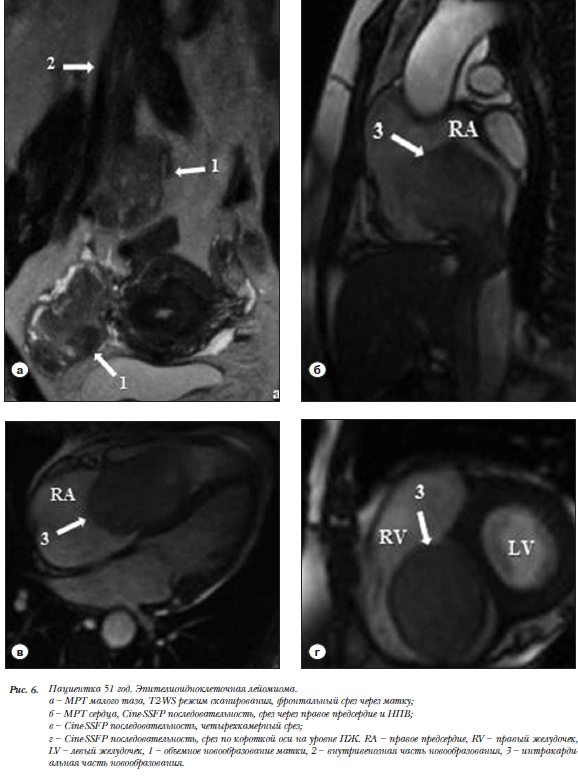
Пациентка 51 год. Эпителиоидноклеточная лейомиома. Направлена на МРТ после ЭхоКГ, для уточнения топографии образования распространяющегося из НПВ в ПП, и вероятно исходящего из матки. Выполнено МРТ органов малого таза, брюшной полости и сердца. 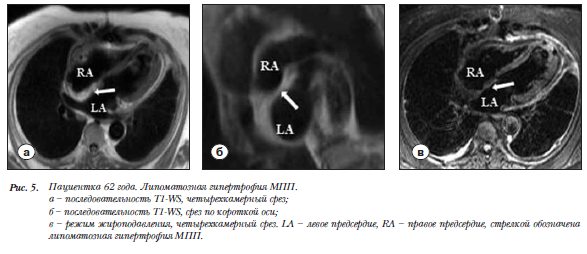 Образование 4,4´3,3 см в миометрии, прорастающее в полость малого таза и правую общую под-вздошную и нижнюю полую вены (НПВ) на всем их протяжении (рис. 6а). Внутрисосудистая часть образования имеет лентовидную форму и обтурирует до половины их просвета. Печеночные вены расширены. Внутрисердечная часть образования 8,8´5,0´6,0 см, из НПВ проникает в ПП, и далее в диастолу пролабирует через расширенное кольцо ТК в ПЖ (рис. 6 б,в,г).
Образование 4,4´3,3 см в миометрии, прорастающее в полость малого таза и правую общую под-вздошную и нижнюю полую вены (НПВ) на всем их протяжении (рис. 6а). Внутрисосудистая часть образования имеет лентовидную форму и обтурирует до половины их просвета. Печеночные вены расширены. Внутрисердечная часть образования 8,8´5,0´6,0 см, из НПВ проникает в ПП, и далее в диастолу пролабирует через расширенное кольцо ТК в ПЖ (рис. 6 б,в,г).
Клинический пример 7
 Пациентка 57 лет. Мезенхимома ЛП. В ЛП опреде-ляется объемное образование 4,8´3,7´4,1 см с ровными контурами неоднородной структуры, исходящее из МПП широким основанием, неоднородной структуры преимущественно гипоинтенсивное в Т1-WS и гиперинтенсивное в Т2-WS (рис. 7 а,б). Прорастания в соседние структуры не отмечается. Предсердия дилатированы, недостаточность митрального клапана 3 степени. В раннюю и позднюю фазы контрастирования неоднородность накопления в разных участках образования (рис. 7 в).
Пациентка 57 лет. Мезенхимома ЛП. В ЛП опреде-ляется объемное образование 4,8´3,7´4,1 см с ровными контурами неоднородной структуры, исходящее из МПП широким основанием, неоднородной структуры преимущественно гипоинтенсивное в Т1-WS и гиперинтенсивное в Т2-WS (рис. 7 а,б). Прорастания в соседние структуры не отмечается. Предсердия дилатированы, недостаточность митрального клапана 3 степени. В раннюю и позднюю фазы контрастирования неоднородность накопления в разных участках образования (рис. 7 в).
Клинический пример 8
Пациентка 25 лет. Многокомпонентная мезенхимома (рабдомиофиброангиолипома) с инвазивным ростом. Образование 5,8´7,0´11,5 см в полости ПП с гетерогенным сигналом в Т1 и Т2 последовательностях, прорастающее через стенку в перикард и ВПВ (рис. 8а). Граница между ним и стенкой предсердия убедительно не дифференцируется (рис. 8 б,в). Неоднородность контрастирования на разных участках образования. Жидкость в перикарде без признаков тампонады.
Клинический пример 9
Пациентка 64 года. Метастазы меланомы. В анамнезе операцию удаления меланомы левой подлопаточной области. На МРТ направлена после ЭхоКГ для уточнения локализации и дифференциальной диагностики объемного образования за правыми камерами сердца. В перикарде за правым предсердием визуализируется объемное образование 6,0´5,2´2,8 см (рис. 9а), гиперинтенсивное в Т1 последовательности и в режиме жироподавления (рис. 9в). МРТ с контрастным усилением демонстрирует накопление КВ. Правое пред-сердие и кольцо ТК дилатированы, 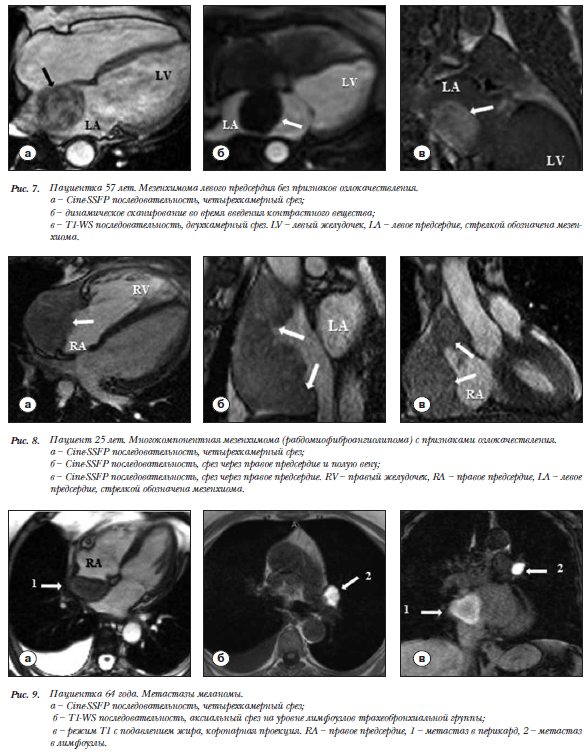 трикуспидальная регургитация 2 степени. В лимфоузлах левой трахеобронхиальной группы определяется образование 3´2,5´3 см с идентичными характеристиками МР-
трикуспидальная регургитация 2 степени. В лимфоузлах левой трахеобронхиальной группы определяется образование 3´2,5´3 см с идентичными характеристиками МР-
сигнала (рис. 9 б,в). Правосторонний гидроторакс, расширение НПВ.
Обсуждение
Опухоли сердца чаще возникают в миокарде и эндокарде, реже в клапанах и перикарде. Доброкачественные опухоли составляют три четверти всех первичных новообразований сердца. Самой частой является миксома (до 50%), реже встречаются липомы (8%), фиброэластомы (8%), рабдомиомы (7%), крайне редки фибромы, гемангиомы, тератомы, мезотелиомы (по 2Ц3%). Злокачественные первичные опухоли сердца чаще представлены саркомами: ангиосаркомами (7%) и рабдомиосаркомами (5%), реже мезотелимами (4%), фибросаркомами (3%), лимфомами (1%). Метастатические опухоли встречаются в 2–4 раза чаще, чем первичные злокачественные опухоли. Метастазы в сердце обнаруживают в 0,6–1,5% случаев рака молочной железы, легких, желудка. Для них характерным является поражение перикарда [14,15].
Клинические симптомы опухолей сердца неспецифичны и подразделяются на экстракардиальные, интрамиокардиальные и внутриполостные. Внутриполостные симптомы обусловлены обструкцией клапанов. Интрамиокардиальные симптомы характеризуются аритмиями. Экстракардиальные симптомы проявляются признаками обструкции или эмболизации системного кровотока. При злокачественных новообразованиях эти симптомы проявляются более остро и прогрессируют быстрее [7,13,16].
У разных новообразований сердца, опухолевых и неопухолевых интенсивность сигнала в Т1 и T2 режимах, на срезах в режиме GE и изображениях после контрастирования имеют различия, а иногда индивидуальность (табл. 1).
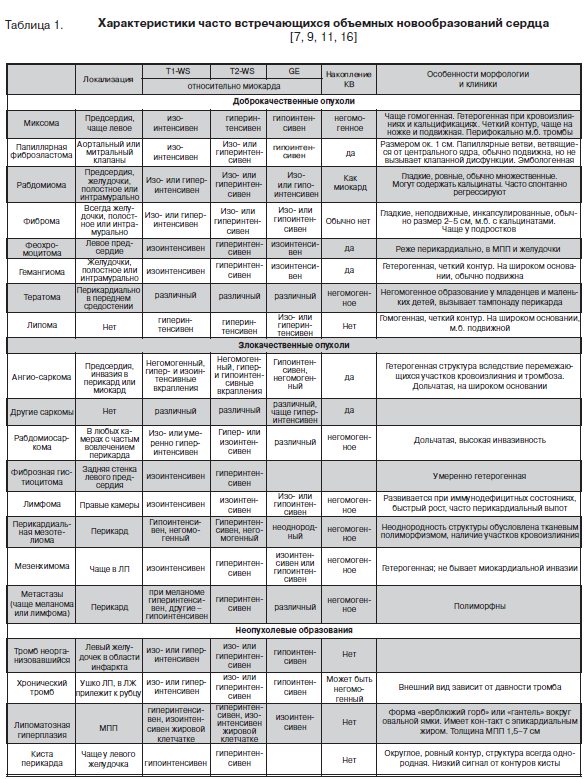
Дифференциальная диагностика между доброкачественными и злокачественными опухолями в сердце проводится на основе оценки их локализации относительно полостей сердца, характера контактирования с миокардом и особенностей внутренней структуры [7,16,17]. Доброкачественные новообразования поражают одну камеру, контактируют с миокардом на ножке или четко от него отграничены, имеют гомогенную структуру. Злокачественные опухоли поражают нес-колько камер сердца и распространяются за пределы сердца или инфильтрируют сосуды, контактируют с миокардом на широком основании и инвазируют его, имеют негомогенную структуру за счет некроза и кровоизлияний. Кроме этого злокачественное поражение часто сопровождается выпотом в перикард, иногда геморрагическим [7,16,17].
Безсимптомная миксома, на широком основании и неподвижная, выявленная в клиническом примере 1 относится к редко встречающимся вариантам этого поражения (встречается в 25%) (рис. 1). Чаще выявляется миксома с гемодинамически значимой обструкцией митрального клапана, как в клиническом примере 2 [18–20]. В обоих случаях выявленная локализация и характер сигнала в стандартных последовательностях были типичными для данного образования (табл. 1). Миксома, вызывающая клапанную обструкцию, имела ножку (наблюдается в 75%) и в Cine-SSFP - режиме отчетливо пролабировала через МК (рис. 2).
Тромб ЛП в ряде случаев с трудом дифференцируется от миксомы при нативном исследовании [20–22]. В клиническом примере 3 тромб имел схожую с миксомой форму и характер сигнала до введения КВ. Диагностическими критериями послужили место прикрепления, типичное для тромба (ушко ЛП) и гипоинтенсивный сигнал в раннюю и отсроченную фазы контрастирования (рис. 3).
Рабдомиома в клиническом примере 4 была заподозрена на основании возраста (встречается у детей в
75%), интрамуральной локализации, характерных изменений сигнала (рис. 4) [13, 23]. Сочетания с туберозным склерозом (бывает в 50%) является патогномоничным для данного поражения [13, 24]. Пациент не был подвергнут хирургической коррекции, так как с возрастом рабдомиомы часто спонтанно регрессируют.
Липоматозная гипертрофия МПП в клиническом примере 5 была случайной диагностической находкой. Перегородка имела характерную форму «песочных часов» с перемычкой в области овальной ямки, сигнал как был идентичен сигналу подкожной жировой клетчатки в режимах Т1 и жироподавления [13, 25].Типичная картина, наблюдаемая при МРТ, не потребовала проведения биопсии для подтверждения диагноза (рис. 5).
Внутривенный лейомиоматоз, выявленный в клиническом примере 6 представляет собой редкий случай прорастания опухоли матки через венозные коллекторы в правые камеры сердца [26, 27]. МРТ позволила оценить объем поражения в полости малого таза, распространенность в венозном русле и наступившие гемодинамические нарушения в сердце (рис.6).
Мезенхимома вызывает трудности диагностики из-за тканевого полиморфизма, в зависимости от преобладающего типа ткани [28, 29]. В клиническом примере 7 наблюдалась неоднородная структура образования, преимущественно гипоинтенсивная в Т1-WS и гиперинтенсивное в Т2-WS, а также неоднородное контрастирование. Образование имело ровные контуры, четко отграничиваясь от стенки предсердия (рис. 7). Тип образования был верифицирован гистологически.
Мезенхимома с инвазивным ростом в перикард и ВПВ в клиническом примере 8 визуально имела ту же неоднородную структуру сигнала при нативном и контрастном исследованиях (рис. 8). Гистологически определена многокомпонентная мезенхимома – рабдомиофиброангилипома.
Метастазы меланомы в клиническом примере 9 имели типичную локализацию в перикарде и лимфоузлах и в отличии от других метастазов имели характерный яркий сигнал в Т1-WS, сохраняющийся в режиме жироподавления, что обусловлено парамагнитным эффектом меланина (рис. 9) [20, 30]. Выявлены гидроторакс и гидроперикард, которые часто встречаются при
метастазировании.
МРТ позволила в процессе одного исследования детально изучить морфологию и локализацию новообразования, оценить его пространственные взаи-моотношения с соседними структурами, изучить объемные и функциональные параметры сердца. Динамический режим (Cine-SSFP), плоскостная и объемная реконструкция (MPR) наглядно продемонстрировали топографию новообразования. Это помогло широкому дооперационному пониманию патологии и упростило принятие хирургических решений. В послеоперацион-ном периоде МРТ позволила проанализировать результаты хирургической коррекции и осуществить динамическое наблюдение в раннем и отдаленном периодах.
Выводы
ЭхоКГ и МРТ в диагностике объемных новообразований сердца существенно дополняют друг друга, обеспечивая неинвазивную мультимодальную визуализацию, необходимую для всесторонней оценки топографии новообразований, выявления индивидуальных анатомических особенностей внутрисердечных и экстракардиальных структур.
МРТ должна входить в алгоритм диагностики объемных новообразований сердца, в том числе и для оценки наступивших гемодинамических изменений.
Список исп. литературыСкрыть список1. Centofanti P., Rosa E.Di., Deorsola L. et al. Primary cardiac tumors: carly and late results of surgical treatment in 91 patients. Ann. Thorac. Surg. 1999; 68(4):1236–1241.
2. Schaff H.V., Mullany C.J. Surgery for cardiac myxomas. Semin Thorac. Cardiovasc. Surg. 2000; 12:77–88.
3. Moynihan T. J. Is there such a thing as heart cancer? http: www.mayoclinic.org/heart-cancer/expert-answers/ faq-20058130.
4. Roberts W.C. Neoplasms involving the heart, their simulators, and adverse consequences of their therapy. Bayl Univ. Med. Cent. 2001; 14:358–376.
5. Sutsch G., Jenni R., L. von Segesser, Schneider J. Heart tumors: incidence, distribution, diagnosis exemplified by 20,305 echocardiographies. Schweiz. Med. Wochenschr. 1991; 121:621–629.
6. Goswami K.C., Shrivastava S., Bahl V.K., et al. Cardiac myxomas: clinical and echocardiographic profile intern J. Cardiol. 1998; 63 (3):251–259.
7. Bogaert J., Dymarkowski S., Taylor A.M. Clinical Cardiac MRI. Springer 2005; 549.
8. Buckley O., Madan R., Kwong R., et al. Cardiac Masses, Part 1: Imaging Strategies and Technical Consideration. AJR. 2011; 197:837-841.
9. O’Donnell D.H., Abbara S., Chaithiraphan V., et al. Cardiac Tumors: Optimal Cardiac MR Sequences and Spectrum of Imaging Appearances. AJR. 2009; 193: 377-387.
10. Finn J.P., Nael K., Deshpande V., et al. Cardiac MR imaging: state of the technology. Radiology. 2006; 241:338–354.
11. Fussen S., De Boeck B.W., Zellweger M.J., et al Cardiovascular magnetic resonance imaging for diagnosis and clinical management of suspected cardiac masses and tumours. Eur. Heart J. 2011; 32(12):1551–1560.
12. Беленков Ю.Н., Синицин В.Е., Терновой С.К. Магнитно-резонансная томография сердца и сосудов. Видар. 1997; 144С.
Belenkov Ju.N., Sinicin V.E., Ternovoj S.K. Magnitno-rezonansnaja tomografija serdca i sosudov[MRI of heart and vessels]. Vidar. 1997; 144 р [In Russ].
13. Бокерия Л.А., Малашенков А.И., Кавсадзе В. Э., Серов Р.А. Кардиоонкология. НЦССХ им. А.Н. Бакулева РАМН. 2003; 254С.
Bokerija L.A., Malashenkov A.I., Kavsadze V. Je., Serov R.A. Kardioonkologija [Cardiology]. NCSSH im. A.N. Bakuleva RAMN. 2003; 254 р [In Russ].
14. Burke A., Virmani R. Atlas of Tumor Pathology. Tumors of the Heart and Great Vessels. Armed Forces Institute of Pathology. 1996.
15. Butany J., Leong S.W., Carmichael K., Komeda M. A 30-year analysis of cardiac neoplasms at autopsy. Can. J. Cardiol. 2005; 21:675–680.
16. Телен М., Эрбел Р., Крейтнер К-Ф., Баркхаузен Й. Лучевые методы диагностики болезней сердца МЕДпресс-информ. 2011; 408 c.
Telen M., Jerbel R., Krejtner K-F., Barkhauzen J. Luchevye metody diagnostiki boleznej serdca [Beam methods of diagnostics of heart diseases]. MEDpress-inform. 2011; 408 р
[in Russ].
17. Hanson E.C. Cardiac tumors: a current perspective. NY State J. Med. 1992; 92:41–42.
18. Amano J., Kono T., Wada Y., et al. Cardiac myxoma: its origin and tumor characteristics. Ann. Thorac.
Cardiovasc. Surg. 2003; 9:215–21.
19. Araoz P.A., Mulvagh S.L., Tazelaar H.D., et al. CT and MR imaging of benign primary cardiac neoplasms with echocardiographic correlation. Radiographics. 2000; 20:1303–19.
20. Buckley O., Madan R., Kwong R., et al. Cardiac Masses, Part 2: Key Imaging Features for Diagnosis and Surgical Planning. AJR. 2011; 197:842–851.
21. Jungehulsing M., Sechtem U., Theissen P., et al. Left ventricular thrombi: evaluation with spin-echo and gradient-echo MR imaging. Radiology 1992; 182:225–229.
22. Paydarfar D., Krieger D., Dib N., et al. In vivo magnetic resonance imaging and surgical histopathology of intra-cardiac masses: distinct features of subacute thrombi. Cardiology. 2001; 95:40–47.
23. Kiaffis M.G., Powell A.J., Geva T. Magnetic resonance imaging evaluation of cardiac tumor characteristics in infants and children. Am. J. Cardiol. 2002; 89:1229–1233.
24. Aggoun Y., Hunkeler N., Destephen M. et al. Cardiac rhabdomyomatosis and Bourneville’s tuberous sclerosis in the fetus. Arch. Mal. Coeur. Vaiss. 1992; 85:609–613.
25. Gaerte S.C., Meyer C.A., Winer-Muram H.T., et al. Fat-containing lesions of the chest. Jr. Radiographics. 2002; 22:61–78.
26. Bennett E.S., Arora N.S., Kay M., et al. Intracardiac leiomyomatosis: iliac vein to right-ventricular
outflow tract. Nat. Clin. Pract. Cardiovasc. Med. 2005; 2:369–72.
27. Cooper N.M., Guillem J., Dalton J. et al. Recurrent intravenous leiomyomatosis with cardiac extension. Ann. Thorac. Surg. 1992; 53:139–41.
28. Kun Y., Yinglong L., Hongyue W., et al. Epidemiological and pathological characteristics of cardiac tumors: a clinical study of 242 cases.. Interactive CardioVascular and Thoracic Surgery. 2007; 6:636–639.
29. Kutsal A., Tansal S., Okutan H., Tuncer I. Primary malignant mesenchymoma of the heart. European Journal of Cardio-thoracic Surgery. 2002; 21:124–126.
30. Chiles C., Woodard P.K., Gutierrez F.R., Link K.M. Metastatic involvement of heart and pericardium: CT and MR imaging. Radiographics. 2001; 21:439–449.
