Диагностическая и интервенционная радиология 2015
№02 2015
Клиническое наблюдение геморрагического и тромботического осложнения после чрескожного коронарного вмешательства при инфаркте миокарда №02 2015
Материалы и методы: ретроспективно проанализирован клинический случай интервенционного лечения инфаркта миокарда с поздним постпункционным геморрагическим осложнением (спустя 41 день), последствия которого привели к тромбозу наружной подвздошной вены с тромбоэмболией легочных артерий, а также повторной острой окклюзией стентированной ранее коронарной артерии. Результаты. Развившиеся осложнения были разрешены хирургическими вмешательствами (повторное коронарное стентирование, ушивание дефекта бедренной артерии, имплантация кава-фильтра с его последующим удалением), а также проведением тромболитической терапии. Пациентка была выписана на амбулаторное долечивание без значимой сердечно-легочной недостаточности и компенсированным артериальным и венозным кровообращением оперированной нижней конечности. Через 11 месяцев состояние без отрицательной динамики с удовлетворительным качеством жизни.
Выводы: данный клинический пример демонстрирует сложность диагностики пункционных кровотечений. В случаях бедренного доступа рутинное применение устройств для закрытия пункционных дефектов потенциально может снизить риск геморрагических осложнений.
Ключевые слова:
• чрескожное коронарное вмешательство
• острый инфаркт миокарда
• реперфузионная терапия
• пульсирующая гематома
• тромбоэмболия легочных артерий
Цель: улучшить результаты лечения пациентов с инфарктами миокарда, подвергнутых экстренным коронарным стентированиям, за счёт профилактики геморрагических осложнений из мест пункций.
Материалы и методы: ретроспективно проанализирован клинический случай интервенционного лечения инфаркта миокарда с поздним постпункционным геморрагическим осложнением (спустя 41 день), последствия которого привели к тромбозу наружной подвздошной вены с тромбоэмболией легочных артерий, а также повторной острой окклюзией стентированной ранее коронарной артерии. Результаты. Развившиеся осложнения были разрешены хирургическими вмешательствами (повторное коронарное стентирование, ушивание дефекта бедренной артерии, имплантация кава-фильтра с его последующим удалением), а также проведением тромболитической терапии. Пациентка была выписана на амбулаторное долечивание без значимой сердечно-легочной недостаточности и компенсированным артериальным и венозным кровообращением оперированной нижней конечности. Через 11 месяцев состояние без отрицательной динамики с удовлетворительным качеством жизни.
Выводы: данный клинический пример демонстрирует сложность диагностики пункционных кровотечений. В случаях бедренного доступа рутинное применение устройств для закрытия пункционных дефектов потенциально может снизить риск геморрагических осложнений.
Ключевые слова:
• чрескожное коронарное вмешательство
• острый инфаркт миокарда
• реперфузионная терапия
• пульсирующая гематома
• тромбоэмболия легочных артерий
Hemorrhagic and thrombotic complications after percutaneous coronary intervention in acute myocardial infarction (case report)
Kireev K.A. – MD, PhD1
*Abaydulin R.Zh. – MD1,2
Fokin A.A. – MD, PhD, professor1
Kireeva T.S. – MD1
1 «South Ural State Medical University»
64 , Vorovskogo Str., Chelyabinsk, Chelyabinsk region, Russian Federation 454092
2 «Chelyabinsk Regional Clinical Hospital»
70, Vorovskogo Str., Chelyabinsk, Chelyabinsk region, Russian Federation, 454076
ABSTRACT:
Aim: was to improve results of treatment of patients with myocardial infarction who underwent emergency coronary stenting, by prevention of bleeding complications from puncture place.
Materials and methods: we present retrospective analysis of clinical case of interventional treatment of myocardial infarction, with late post-puncture bleeding complication (41 day after PCI). Its consequences caused the thrombosis of the external iliac vein with further pulmonary embolism, and acute reocclusion of previously stented coronary artery.
Results: developed complications were surgically treated (recurrent coronary stenting, elimination of defect of the femoral artery, implantation of cava filter with its subsequent removal), and thrombolytic therapy. Patient was discharged to outpatient care without any indications of cardiopulmonary insufficiency and compensated arterial and venous circulation of operated lower limb. After 11 months, the patient's condition was without negative dynamics with a satisfactory quality of life.
Conclusion: this clinical example demonstrates how difficult is to detect bleeding from a puncture wound. In cases of femoral access, the routine use of vascular closure devices can reduce the risk of bleeding complications.
Key-words:
• percutaneous coronary intervention
• acute myocardial infarction
• reperfusion treatment
• pulsating hematoma
• pulmonary embolism
Введение
Современные условия оказания специализированной кардиологической медицинской помощи при острой коронарной патологии характеризуются интенсивным потоком пациентов с разнообразными механизмами развития заболевания и нарушениями в свёртывающей системе крови. В стремлении снизить летальность назначаются препараты, воздействующие на разные звенья гемостаза. При этом рутинно применяются эндоваскулярные технологии. В сложившейся ситуации неизбежны геморрагические осложнения разного плана от пункционных и желудочно-кишечных кровотечений до внутримозговых гематом. Рациональный баланс сочетания чрескожных коронарных вмешательств и медикаментозного сопровождения острой ишемии миокарда достигается накоплением клинического опыта, его обменом, а также критическим анализом. Для предупреждения подобных ситуаций необходимо принятие единых алгоритмов тактических действий как на уровне медицинской организации, так и ассоциаций и научных сообществ.
Клинический пример
Пациентка В., 52 года, поступила в «Челябинскую областную клиническую больницу» в 01:00 15 декабря 2013 года в экстренном порядке с диагнозом «Острый коронарный синдром с подъемом сегмента ST в области нижней стенки. ОСН 1 класс по Killip» через 2 часа от начала заболевания с купированным болевым синдромом. При первичном медицинском контакте на фоне типичного ангинозного приступа в течение 30–40 минут установлены ишемические повреждения миокарда по нижней стенке левого желудочка (элевация сегмента ST до 3,0 мм в отведениях II, III, AVF с реципрокной депрессией сегмента SТ в отведениях I, AVL, V2-V6). Гемодинамика устойчивая на этапе скорой медицинской помощи и приемного покоя (нормотензия с нормокардией).
На догоспитальном этапе оказана помощь: нитроспрей 1 доза; ацетилсалициловая кислота 250 мг, клопидогрел 300 мг и анаприлин 20 мг перорально; морфин 1,0 мл и гепарин 5000 единиц внутривенно. С учётом транспортной доступности ЧКВ-центра (чрескожное коронарное вмешательство) в течение ближайших 60 минут от верификации острой ишемии миокарда тромболитическая терапия не проводилась.
Из анамнеза известно, что приступы стенокардии наблюдались редко только при эмоциональных переживаниях. Страдает артериальной гипертензией около 5 лет с максимальными цифрами артериального давления до 150–160/80–90 мм рт.ст. Специального лечения не получала. Наследственность по сердечно-сосудистой патологии не отягощена. Не курит, употребление алкоголя отрицает. Менопауза с 43 лет. Индекс массы тела 27,5 кг/м2.
Лабораторные анализы без критических величин, тропонин при поступлении отрицательный. Из приемного покоя пациентка доставлена в рентгеноперационную для проведения экстренной коронароангиографии (КАГ) и возможного чрескожного коронарного вмешательства (ЧКВ). Перед эндоваскулярной процедурой дополнительно получила клопидогрел 300 мг перорально.
В 01:20 15 декабря 2013 г. выполнена КАГ правым бедренным доступом.
Коронарография: правый тип коронарного кровоснабжения. Ангиографические признаки «острой» окклюзии правой коронарной артерии (ПКА) в начальном отделе со слабым восстановлением дистальных ветвей из бассейна левой коронарной артерии (ЛКА). Ствол ЛКА – без особенностей, определяются стенозы до 50% в начальном отделе передней нисходящей артерии, в огибающей артерии на фоне кровотока TIMI 3 определяется стеноз в начальном отделе – 85–90%. Инфарктсвязанной артерией определена правая коронарная артерия. Введено 5000 ЕД гепарина интраартериально с достижением АВС более 300 секунд. Выполнена аспирация тромботических масс (получен кровоток TIMI 2–3) с последующим 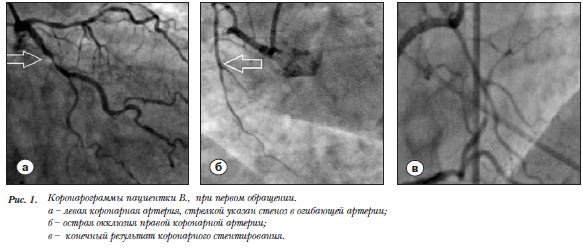 стентированием среднего и начального отдела ПКА тремя кобальт-хромовыми стентами (рис.1).
стентированием среднего и начального отдела ПКА тремя кобальт-хромовыми стентами (рис.1).
На контрольных коронарограммах просвет артерии в области окклюзии восстановлен, стенты проходимы, признаков диссекции, резидуального стеноза, а также дистальной эмболии не выявлено. Кровоток TIMI 3.
С 15 по 17 декабря 2013 г. пациентка находилась в отделении реанимации, где получала антиагрегантную (аспирин и плавикс) и антикоагулянтную терапию (клексан по схеме). Интродьюсер из правой бедренной артерии удален 16 декабря 2013 года (через 32 часа) с хорошим гемостатическим эффектом, в последующем умеренная подкожная гематома.
На контрольных ЭКГ от 15–17 декабря 2013 г. закономерная динамика инфаркта миокарда (глубокие патологические зубцы Q во II, III, AVF; сегмент ST на изолинии с формированием отрицательных зубцов Т во II, III, AFV, нивелирование реципрокной депрессии). Тропонин от 15 декабря 2012 г. (через 6 часов после стентирования) – 20,41 нг/мл. Гиперхолестеринемия 8,4 ммоль/л.
Через 2 суток после ЧКВ на правой коронарной артерии 17 декабря 2013 г. в 8:00 отмечен (через 2 суток от ЧКВ на правой коронарной артерии) затяжной ангинозный приступ, некупируемый нитратами и внутривенным введением трамадола 2,0 мл. На контрольной ЭКГ уменьшилась глубина зубца Т в отведениях II, III и AVF. С подозрением на тромбоз стентов ПКА выполнена повторная экстренная коронарография левым бедренным доступом. Коронарография: имплантированные стенты ПКА проходимы с кровотоком TIMI 3, сохраняется стеноз до 90% в начальной трети огибающей артерии. Без каких-либо технических сложностей выполнено прямое стентирование стенозированного сегмента огибающей артерии хром-кобальтовым стентом с полноценным восстановлением просвета и кровотоком TIMI 3. Интродьюсер из левой бедренной артерии удален в операционной, наложена давящая повязка. Через 1,5 часа после ЧКВ на огибающей артерии появилась массивная постпункционная гематома левой бедренной артерии, осложнившаяся острой анемией тяжелой степени, потребовавшей гемотрансфузий в объеме 1500 мл эритроцитарной массы и 500 мл свежезамороженной плазмы. Выполнено ультразвуковое исследование мягких тканей в зоне пункции.
По данным УЗИ: кожа, подкожно-жировая клетчатка и частично мышечная ткань утолщены, повышенной эхогенности за счет имбибиции кровью. На медиальных поверхностях верхних третей бедер с двух сторон, на глубине до 10 мм визуализируются отграниченные жидкостные скопления небольших размеров (11´7 мм справа и 23´17 мм слева), однородной структуры, с четкими контурами, при ЦДК кровоток в них не зарегистрирован. Учитывая отсутствие продолжающегося кровотечения, хирургического вмешательства не потребовалось. Проводили динамическое наблюдение за постпункционной гематомой: компрессия, строгий постельный режим, холод. По клиническим и ультразвуковым данным в последующие дни наблюдений отмечалась положительная динамика: уменьшение площади, плотности гематомы, снижение болевых ощущений.
Несмотря на развившиеся геморрагические осложнения, пациентка получала двойную антиагрегантную терапию (аспирин и клопидогрел), клексан отменен. Указанные выше антитромбоцитарные препараты назначены после выписки.
В условиях реанимации выявлена гипергликемия, установлен диагноз «Сахарный диабет 2 типа, впервые выявленный», назначена необходимая медикаментозная антигипергликемическая терапия. Пациентка была выписана 30 декабря 2013 г. (на 15 сутки от момента поступления) в удовлетворительном состоянии, приступы загрудинных болей не рецидивировали, ишемических изменений при холтер-мониторировании не зарегистрировано.
Эхо-КГ при выписке: умеренная гипокинезия среднего и базального сегментов нижней стенки, нижне-перегородочного сегмента. Сократительная функция миокарда удовлетворительная. Фракция выброса (ФВ) 62%. Гемоглобин 111 г/л, эритроциты 4,2´1012/л. На этапе амбулаторной реабилитации пациентка соблюдала все рекомендации, в т.ч. связанные с контролем глюкозы крови. Ишемические боли в сердце не возобновлялись. Через 41 день после ЧКВ, выполнявшегося левым бедренным доступом, 27 января 2014 г. в 09:00 (через 41 день после ЧКВ левым бедренным доступом) по дороге в поликлинику «Челябинской областной клинической больницы» на фоне полного благополучия у пациентки появилась интенсивная боль с пульсирующим образованием в верхней трети левого бедра, в течение последующих 30–40 минут развился отек левой нижней конечности (+3-4 см на всем протяжении). Больная была проконсультирована кардиологом и сосудистым хирургом. Во время осмотра появилась разлитая давящая боль за грудиной, одышка, чувство нехватки воздуха, выраженная общая слабость. Артериальное давление 80–90/50–60 мм рт. ст. с тахикардией 100–110 в минуту, частота дыхания 28–30 в минуту. При ЭКГ установлен подъем сегмента ST до 3 мм в отведениях II, III, AVF с соответствующей реципрокной депрессией. Больная была госпитализирована в стационар с предварительным диагнозом: «Пульсирующая гематома левого бедра после коронарного стентирования от 17 декабря 2013 г. Вторичный левосторонний илиофеморальный флеботромбоз. Тромбоэмболия магистральных ветвей легочной артерии. Острый коронарный синдром с подъемом сегмента ST в области нижней стенки. ОСН Killip I».
 В приемном отделении пульсирующая гематома левой бедренной артерии подтверждена данными УЗИ. Установлен окклюзивный тромбоз наружной подвздошной вены. Под УЗИ-контролем наложена давящая повязка в проекцию бедренной артерии с компрессией пульсирующей гематомы. По данным Эхо-КГ: гипокинезия с участками акинезии среднего и базального сегментов нижней стенки, нижне-перегородочного сегмента. Сократительная функция миокарда снижена, ФВ 46%. Высокая легочная гипертензия. Через 2 часа от появления первых симптомов пациентка доставлена в рентгеноперационную для диагностических вмешательств на коронарных артериях, в венозном и легочном бассейнах. По данным экстренной коронарографии (правый бедренный
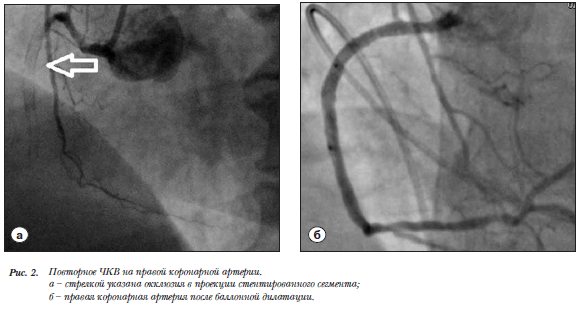
В приемном отделении пульсирующая гематома левой бедренной артерии подтверждена данными УЗИ. Установлен окклюзивный тромбоз наружной подвздошной вены. Под УЗИ-контролем наложена давящая повязка в проекцию бедренной артерии с компрессией пульсирующей гематомы. По данным Эхо-КГ: гипокинезия с участками акинезии среднего и базального сегментов нижней стенки, нижне-перегородочного сегмента. Сократительная функция миокарда снижена, ФВ 46%. Высокая легочная гипертензия. Через 2 часа от появления первых симптомов пациентка доставлена в рентгеноперационную для диагностических вмешательств на коронарных артериях, в венозном и легочном бассейнах. По данным экстренной коронарографии (правый бедренный 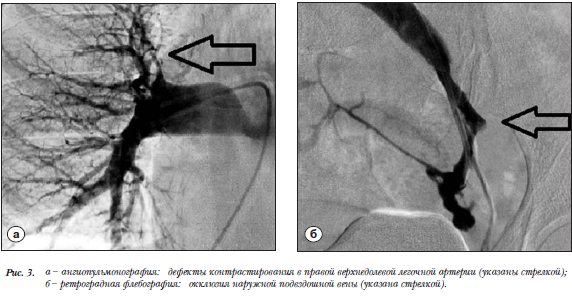 доступ): правый тип кровоснабжения миокарда, окклюзия (тромбоз) ПКА в начальном отделе в проекции проксимального стента без восстановления кровотока (рис. 2а), стенозы передней нисходящей коронарной артерии без отрицательной динамики, рестеноз до 15% стента проксимальной трети огибающей артерии. Произведена реканализация острой окклюзии ПКА с последующей последовательной баллонной ангиопластикой. Кровоток в ПКА восстановлен на уровне TIMI 2–3 (рис. 2б). Пункционное отверстие в правой бедренной артерии закрыто устройством Cordis Exo-Seal с хорошим гемостатическим результатом. Ангиопульмонография: дефекты наполнения округлой формы артерий верхней доли правого легкого, обеднение сосудистого рисунка в проекции верхней и нижней долей правого легкого (рис. 3а). Ретроградная флебография нижней полой и подвздошных вен: отсутствие контрастирования левой наружной подвздошной вены (флеботромбоз? сдавление вены извне?) от средней ее трети без ангиографических признаков флотации тромботических масс (рис. 3б). Учитывая массивную тромбоэмболию легочной артерии, в инфраренальный отдел нижней полой вены на уровне тел позвонков L2-L3 имплантирован экстрагируемый кава-фильтр Cordis OptEase. Через 4 часа от появления первых симптомов проведена экстренная ревизия пульсирующей гематомы. В верхней трети левого бедра обнаружена гематома объемом около 500 мл, пункционное отверстие в передней стенке левой общей бедренной артерии до 0,5 мм в диаметре с пульсирующей струей артериальной крови. Выполнено ушивание дефекта узловым швом с активным дренированием. Контрольные показатели «красной крови»: гемоглобин 97 г/л, эритроциты 3,7–1012. Гемотрансфузии не проводились. После ушивания дефекта пациентка направлена в отделение реанимации, где через 6,5 часов от появления первых симптомов выполнена системная тромболитическая терапия метализе 6 тысяч единиц. В послеоперационном периоде (к концу первых суток) стабилизация состояния: описанные выше жалобы отсутствовали на протяжении всей госпитализации, стабилизация гемодинамики до нормотензии и нормокардии, частота дыхания 18 в минуту. На ЭКГ патологические зубцы Q в отведениях II, III, АVF; сегмент ST на изолинии во всех отведениях с формированием глубоких зубцов Т во II, III, АVF. Тропонин 8,07 нг/мл.
доступ): правый тип кровоснабжения миокарда, окклюзия (тромбоз) ПКА в начальном отделе в проекции проксимального стента без восстановления кровотока (рис. 2а), стенозы передней нисходящей коронарной артерии без отрицательной динамики, рестеноз до 15% стента проксимальной трети огибающей артерии. Произведена реканализация острой окклюзии ПКА с последующей последовательной баллонной ангиопластикой. Кровоток в ПКА восстановлен на уровне TIMI 2–3 (рис. 2б). Пункционное отверстие в правой бедренной артерии закрыто устройством Cordis Exo-Seal с хорошим гемостатическим результатом. Ангиопульмонография: дефекты наполнения округлой формы артерий верхней доли правого легкого, обеднение сосудистого рисунка в проекции верхней и нижней долей правого легкого (рис. 3а). Ретроградная флебография нижней полой и подвздошных вен: отсутствие контрастирования левой наружной подвздошной вены (флеботромбоз? сдавление вены извне?) от средней ее трети без ангиографических признаков флотации тромботических масс (рис. 3б). Учитывая массивную тромбоэмболию легочной артерии, в инфраренальный отдел нижней полой вены на уровне тел позвонков L2-L3 имплантирован экстрагируемый кава-фильтр Cordis OptEase. Через 4 часа от появления первых симптомов проведена экстренная ревизия пульсирующей гематомы. В верхней трети левого бедра обнаружена гематома объемом около 500 мл, пункционное отверстие в передней стенке левой общей бедренной артерии до 0,5 мм в диаметре с пульсирующей струей артериальной крови. Выполнено ушивание дефекта узловым швом с активным дренированием. Контрольные показатели «красной крови»: гемоглобин 97 г/л, эритроциты 3,7–1012. Гемотрансфузии не проводились. После ушивания дефекта пациентка направлена в отделение реанимации, где через 6,5 часов от появления первых симптомов выполнена системная тромболитическая терапия метализе 6 тысяч единиц. В послеоперационном периоде (к концу первых суток) стабилизация состояния: описанные выше жалобы отсутствовали на протяжении всей госпитализации, стабилизация гемодинамики до нормотензии и нормокардии, частота дыхания 18 в минуту. На ЭКГ патологические зубцы Q в отведениях II, III, АVF; сегмент ST на изолинии во всех отведениях с формированием глубоких зубцов Т во II, III, АVF. Тропонин 8,07 нг/мл.
При Эхо-КГ в условиях реанимации умеренная легочная гипертензия до 35 мм рт. ст. ФВ около 55%. Гипокинезия нижней стенки левого желудочка. Пациентка получала эластическую компрессию левой нижней конечности, венотоники, двойную антиагрегантную терапию, а также клексан по схеме в течение 7 дней с последующим переводом на варфарин.
Через 10 дней от поступления явления венозного тромбоза купированы, отек левой нижней конечности − до 1 см в нижней трети голени. Швы паховой области слева сняты. По данным УЗИ: просвет левой бедренной артерии восстановлен на всем протяжении без патологических образований, признаки реканализации левой наружной подвздошной вены. Через 14 суток после имплантации кава-фильтра, 10 февраля 2014 г. (через 14 суток после имплантации кава-фильтра) на контрольной флебография нижней полой и подвздошных вен данных за тромбоз в илиокавальном сегменте и кава-фильтре не получено. Кава-фильтр экстрагирован без технических сложностей. Эхо-КГ при выписке: гипокинезия среднего и базального сегментов нижней стенки, нижне-перегородочного сегмента. Сократительная функция миокарда удовлетворительная. ФВ 55%. Умеренная легочная гипертензия 30–32 мм рт. ст. Лабораторные показатели без критических величин, МНО 2,73 на 5 мг варфарина. Ишемических изменений при холтер-мониторировании не зарегистрировано. Лабораторные показатели в пределах референтных значений, в т.ч. гемостазиограмма. Консультирована в Челябинском городском «Центре гемостаза», назначена двойная антиагрегантная терапия продолжительностью 12 месяцев и варфарин под контролем МНО на 6 месяцев. В удовлетворительном состоянии была выписана на амбулаторное долечивание 14 февраля 2014 г. (через 18 дней) после повторного обращения. При контрольных осмотрах сосудистого хирурга в течение 12 месяцев кровообращение левой нижней конечности компенсированное, пульсация артерий − на всем протяжении, минимальные посттромбофлебитические изменения левой нижней конечности на уровне хронической венозной недостаточности С1 по СЕАР. Через 6 месяцев варфарин отменен. При контрольной консультации кардиолога в январе 2015 г. пациентка предъявляла жалобы на одышку при нагрузках, эквивалентных 1 функциональному классу стенокардии. Диагностика сердца показала отсутствие ишемических нарушений с ФВ 55-58%. Легочная гипертензия до 32 мм рт. ст. Достигнуты целевые уровни гликемии и холестеринемии.
Обсуждение
При поступлении пациентки В., 52 лет, с острой ишемией миокарда на этапе скорой медицинской помощи и регионального сосудистого центра была принята правильная реперфузионная тактика, благодаря которой удалось восстановить кровообращение в ранние сроки от начала заболевания (первые 3–3,5 часа) с минимальной потерей сократительной способности миокарда. Гемодинамически значимые поражения двух магистральных коронарных артерий в трудоспособном возрасте, вероятнее всего, связаны со злокачественным течением атеросклеротического процесса и множественными факторами риска: ранняя менопауза, артериальная гипертензия, гипергликемия и гиперхолестеринемия. Стратегия лечения только инфаркт-ответственной артерии у данной больной абсолютно справедлива, учитывая потребность в имплантации трех стентов при первичном ЧКВ, во время которого наблюдались явления коронарного тромбоза. В пользу такого подхода свидетельствуют купирование болевого синдрома после реваскуляризации правой коронарной артерии, а также отсутствие кардиогенного шока, дающего «право» на множественные коронарные интервенции [1].
Рецидив болевого синдрома во время первой госпитализации, потребовавший имплантации стента в огибающую артерию, возможно, был связан с сохраняющимися нарушениями микроциркуляции в нижней стенке на фоне текущего инфаркта миокарда или явлениями микроэмболизации дистального русла правой коронарной артерии из стентированного
сегмента. Потенциально эти состояния можно было бы пре-дотвратить назначением дополнительного антитромбоцитарного препарата (ингибитора 2b/3a рецепторов тромбоцитов) интраоперационно [2] при первом стентировании тромбированной правой коронарной артерии. Лучшим вариантом было бы стентировать огибающую артерию вторым этапом в плановом порядке (в конце данной госпитализации или через 2–3 недели после выписки), когда отменены антикоагулянты.
К сожалению, вторая эндоваскулярная операция осложнилась значимым постпункционным кровотечением из бедренной артерии. Подобные осложнения прогнозируемы на фоне агрессивного применения антиагрегантной терапии, и в случаях их развития сопровождаются дополнительными расходами. Для приведенного клинического случая это положение особенно актуально как при первом обращении, так и при повторной госпитализации. Проблему постпункционных кровотечений можно решить двумя способами. В первом случае отказаться от пункций бедренной артерии и перейти на лучевой доступ [3]. Во втором варианте рутинно использовать устройства для закрытия пункционных дефектов бедренной артерии. Применение последних безопасно и сопровождается хорошими гемостатическими результатами [4].
Диагностика пункционных кровотечений крайне сложна, приходится ориентироваться на клинику, динамические показатели «красной крови» и ультразвуковые данные, достоверность которых снижается при забрюшинных гематомах. В нашей практике случай позднего кровотечения из сначала тромбированной, а позже реканализированной ложной аневризмы бедренной артерии отмечается впервые. Мы придерживаемся мнения, что консервативная тактика в виде компрессионного метода [5] при первой госпитализации была правильной. Ревизия гематомы при отсутствии продолжающегося кровотечения на фоне массивной кровопотери и пониженной коагуляции могла еще больше усугубить анемию, вплоть до развития синдрома диссеминированного внутрисосудистого свертывания крови.
На примере одной пациентки мы увидели, что последствия постпункционных артериальных кровотечений могут быть крайне разнообразными. С ежегодным ростом экстренных ЧКВ [6] и их сосредоточением в региональных сосудистых центрах, имеющих возможность своевременного проведения любых сердечно-сосудистых и эндоваскулярных лечебно-диагностических операций, оправдано. В приведенном примере все многообразие этих вмешательств применялось в отношении одной конкретной пациентки, поступившей с типичным острым инфарктом миокарда и у которой в первые сутки закономерного течения заболевания не было оснований ожидать последующих осложнений.
Список исп. литературыСкрыть список1. Рекомендации по лечению острого коронарного синдрома без стойкого подъема сегмента ST Европейского общества кардиологов. Рациональная фармакотерапия в кардиологии. 2012; 2: 2–64.
Rekomendacii po lecheniju ostrogo koronarnogo sindroma bez stojkogo pod#joma segmenta ST Evropejskogo obshhestva kardiologov [European cardiological society recommendation: treatment of acute coronary syndrome without stable ST-segment elevation]. Racional'naja farmakoterapija v kardiologii. 2012; 2: 2–64[In Russ].
2. Сулимов В.А. Антитромботическая терапия при чрескожных коронарных вмешательствах. Рациональная фармакотерапия в кардиологии. 2008; 3: 91–100.
Sulimov V.A. Antitromboticheskaja terapija pri chreskozhnyh koronarnyh vmeshatel'stvah [Antithrombotic therapy during percutaneous coronary interventions]. Racional'naja farmakoterapija v kardiologii. 2008; 3: 91–100 [In Russ].
3. Голощапов-Аксeнов Р.С., Ситанов А.С. Лучевой артериальный доступ – приоритетный доступ для выполнения чрескожной коронарной ангиопластики у больных с острым коронарным синдромом Международный журнал интервенционной кардиоангиологии. 2013; 35: 37–38.
Goloshhapov-Aksjonov R.S., Sitanov A.S. Luchevoj arterial'nyj dostup – prioritetnyj dostup dlja vypolnenii chreskozhnoj koronarnoj angioplastiki u bol'nyh s ostrym koronarnym sindromom [Radial artery – is a priority access for coronary angioplasty in patients with acute coronary syndrome]. Mezhdunarodnyj zhurnal intervencionnoj kardioangiologii. 2013; 35: 37–38 [In Russ].
4. Тырышкин А.Г., Панюков А.В., Чайка Ю.Г., Жидков С.В., Подковыркин В.В. и др. Первый опыт Алтайского краевого кардиологического диспансера по применению устройств для закрытия бедренного пункционного доступа при рентгенохирургических вмешательствах. Международный журнал интервенционной кардиоангиологии. 2013; 32: 33–36.
Tyryshkin A.G., Panjukov A.V., Chajka Ju.G., Zhidkov S.V., Podkovyrkin V.V. i dr. Pervyj opyt Altajskogo kraevogo kardiologicheskogo dispansera po primeneniju ustrojstv dlja zakrytija bedrennogo punkcionnogo dostupa pri rentgenohirurgicheskih vmeshatel'stvah [Vascular closure devices during endovascular treatment: first experience in Altay Regional Cardiology Dispensary]. Mezhdunarodnyj zhurnal intervencionnoj kardioangiologii. 2013; 32: 33–36 [In Russ].
5. Панфилов Д.С., Козлов Б.Н., Панфилов С.Д., Кузнецов М.С., Насрашвили Г.Г. и др. Проблема лечения постпункционных ложных аневризм: компрессионный, хирургический и пункционный подходы. Сибирский медицинский журнал. 2012; 27(1): 39-44.
Panfilov D.S., Kozlov B.N., Panfilov S.D., Kuznecov M.S., Nasrashvili G.G. i dr. Problema lechenija postpunkcionnyh lozhnyh anevrizm: kompressionnyj, hirurgicheskij i punkcionnyj podhody [Problems of treatment of post-puncture false aneurysms: compressive, surgical and puncture treatment]. Sibirskij medicinskij zhurnal. 2012; 27(1): 39–44
[In Russ].
6. Бокерия Л.А., Алекян Б.Г. Рентгенэндоваскулярная диагностика и лечение заболеваний сердца и сосудов в Российской Федерации. М.: НЦССХ им. А.Н. Бакулева РАМН, 2013; 172.
Bokerija L.A., Alekjan B.G. Rentgenjendovaskuljarnaja diagnostika i lechenie zabolevanij serdca i sosudov v Rossijskoj Federacii [Endovascular diagnostics and treatment of heart and vessels]. M.: NCSSH im. A.N. Bakuleva RAMN, 2013; 172 [In Russ].
