Диагностическая и интервенционная радиология 2015
Диагностическая и интервенционная радиология 2015
№04 2015
Отдаленные результаты эндоваскулярных вмешательств у пациентов с возвратной стенокардией после коронарного шунтирования №04 2015
Номера страниц в выпуске:39-48
Актуальным остается вопрос о выборе стратегии лечении пациентов с возвратной стенокардией после операции коронарного шунтирования (КШ). Повторное КШ связано с повышенным риском летальности и больших сердечно-сосудистых событий, поэтому чрескожные коронарные вмешательства (ЧКВ) являются основной стратегией у этой категории пациентов. Критерии выбора между стентированием нативного русла или шунтов полностью не изучены, так же как не решён вопрос дифференцированного подхода к выбору поражения для стентирования.
Цель: сравнить отдалённые результаты стентирования шунтов и нативного коронарного русла у пациентов с возвратной стенокардией после КШ при использовании алгоритма предложенного в исследовании.
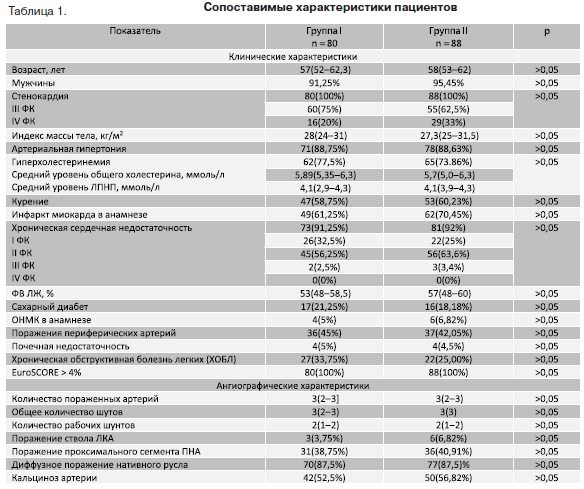
Материалы и методы: исследование проводилось в 2010– 2014 гг. в «3 ЦВКГ им. А.А. Вишневского» МО РФ. Всего было прооперировано 168 пациентов. Реваскуляризация нативного русла – 80 пациентам, стентирование шунтов было выполнено 88 больным. Исследуемые группы были сопоставимы по всем основным клиническим характеристикам пациентов, а так же по количеству пораженных артерий, общему количеству шунтов, количеству работающих шунтов, диффузному поражению нативного русла.Степень стеноза нативного русла была достоверно выше во второй группе, а степень стеноза шунтов была достоверно выше в первой группе. Диффузные поражения шунтов достоверно чаще встречались в первой группе. Отдаленные результаты исследования прослежены у пациентов в срок наблюдения от 3 до 36 месяцев (средний период наблюдения составил 21(14–27) месяц). Средняя продолжительность достоверно не различалась между исследуемыми группами.
Результаты: частота развития ИМ оказалась сопоставимой между группами. В группе реваскуляризации шунтов частота процедур ЧКВ была выше, чем в группе реваскуляризации нативного русла (20,45% и 16,25%, соответственно, p=0,0045), а также была выше частота реваскуляризации целевого поражения (11,36% и 6,25%, соответственно, p=0,0045).
Совокупный показатель основных сердечно-сосудистых осложнений достоверно не отличался, однако была некая тенденция к меньшей частоте больших сердечно-сосудистых событий в группе реваскуляризации нативного русла.
Ключевые слова:
• стентирование шунтов
• стентирование нативного русла
• отдаленные результаты эндоваскулярного лечения
• алгоритм выбора поражения для ЧКВ
Цель: сравнить отдалённые результаты стентирования шунтов и нативного коронарного русла у пациентов с возвратной стенокардией после КШ при использовании алгоритма предложенного в исследовании.
Материалы и методы: исследование проводилось в 2010– 2014 гг. в «3 ЦВКГ им. А.А. Вишневского» МО РФ. Всего было прооперировано 168 пациентов. Реваскуляризация нативного русла – 80 пациентам, стентирование шунтов было выполнено 88 больным. Исследуемые группы были сопоставимы по всем основным клиническим характеристикам пациентов, а так же по количеству пораженных артерий, общему количеству шунтов, количеству работающих шунтов, диффузному поражению нативного русла.Степень стеноза нативного русла была достоверно выше во второй группе, а степень стеноза шунтов была достоверно выше в первой группе. Диффузные поражения шунтов достоверно чаще встречались в первой группе. Отдаленные результаты исследования прослежены у пациентов в срок наблюдения от 3 до 36 месяцев (средний период наблюдения составил 21(14–27) месяц). Средняя продолжительность достоверно не различалась между исследуемыми группами.
Результаты: частота развития ИМ оказалась сопоставимой между группами. В группе реваскуляризации шунтов частота процедур ЧКВ была выше, чем в группе реваскуляризации нативного русла (20,45% и 16,25%, соответственно, p=0,0045), а также была выше частота реваскуляризации целевого поражения (11,36% и 6,25%, соответственно, p=0,0045).
Совокупный показатель основных сердечно-сосудистых осложнений достоверно не отличался, однако была некая тенденция к меньшей частоте больших сердечно-сосудистых событий в группе реваскуляризации нативного русла.
Ключевые слова:
• стентирование шунтов
• стентирование нативного русла
• отдаленные результаты эндоваскулярного лечения
• алгоритм выбора поражения для ЧКВ
Резюме:
Актуальным остается вопрос о выборе стратегии лечении пациентов с возвратной стенокардией после операции коронарного шунтирования (КШ). Повторное КШ связано с повышенным риском летальности и больших сердечно-сосудистых событий, поэтому чрескожные коронарные вмешательства (ЧКВ) являются основной стратегией у этой категории пациентов. Критерии выбора между стентированием нативного русла или шунтов полностью не изучены, так же как не решён вопрос дифференцированного подхода к выбору поражения для стентирования.
Цель: сравнить отдалённые результаты стентирования шунтов и нативного коронарного русла у пациентов с возвратной стенокардией после КШ при использовании алгоритма предложенного в исследовании.
Материалы и методы: исследование проводилось в 2010– 2014 гг. в «3 ЦВКГ им. А.А. Вишневского» МО РФ. Всего было прооперировано 168 пациентов. Реваскуляризация нативного русла – 80 пациентам, стентирование шунтов было выполнено 88 больным. Исследуемые группы были сопоставимы по всем основным клиническим характеристикам пациентов, а так же по количеству пораженных артерий, общему количеству шунтов, количеству работающих шунтов, диффузному поражению нативного русла.Степень стеноза нативного русла была достоверно выше во второй группе, а степень стеноза шунтов была достоверно выше в первой группе. Диффузные поражения шунтов достоверно чаще встречались в первой группе. Отдаленные результаты исследования прослежены у пациентов в срок наблюдения от 3 до 36 месяцев (средний период наблюдения составил 21(14–27) месяц). Средняя продолжительность достоверно не различалась между исследуемыми группами.
Результаты: частота развития ИМ оказалась сопоставимой между группами. В группе реваскуляризации шунтов частота процедур ЧКВ была выше, чем в группе реваскуляризации нативного русла (20,45% и 16,25%, соответственно, p=0,0045), а также была выше частота реваскуляризации целевого поражения (11,36% и 6,25%, соответственно, p=0,0045).
Совокупный показатель основных сердечно-сосудистых осложнений достоверно не отличался, однако была некая тенденция к меньшей частоте больших сердечно-сосудистых событий в группе реваскуляризации нативного русла.
Ключевые слова:
• стентирование шунтов
• стентирование нативного русла
• отдаленные результаты эндоваскулярного лечения
• алгоритм выбора поражения для ЧКВ
Shames A.B. – MD, PhD, professor1
Bazanov I.S. – MD1,2
Ivanov A.V. – MD1
Zharikov S.B. – MD1,2
Tsymbal E.V. – MD1
Maksimkin D.A. – MD2
Polyakov I.I. – MD1
Faybusovich A. – MD2
13rd Central Military Clinical Hospital named after A.A.Vishnevsky
of Ministry of Military Defence, Russian Federation
pos.Novy, p/o Arkhangelsk, Krasnogorsk district, Moscow region, Russian Federation, 143420
2People’s Friendship University of Russia
st. 8, Miklokho-Maklaya, Moscow, Russian Federation, 111000
ABSTRACT:
Choice of treatment strategy in patients with recurrent angina after coronary artery bypass graft surgery (CABG) is still an actual question. Repeat CABG is associated with an increased risk of mortality and large cardiovascular events, so percutaneous coronary intervention (PCI) is the main strategy in these patients. Criteria for choosing between the bypass and the native vessel stenting are not fully understood, as well as not resolved the question of the differentiated approach to the choice of defeat for stenting.
Aim: was to compare long-term results of stenting of bypass and native coronary arteries in patients with recurrent angina after CABG using the algorithm proposed in the study.
Materials and methods: study was conducted in 2010–2014 years. in «3rd Central Military Clinical Hospital named after A.A.Vishnevsky of Ministry of Military Defence». A total of 168 patients with the defeat of coronary bypass graft were operated: revascularization of the native vessel – 80 patients, stenting of coronary bypass graft was performed in 88 patients. Treatment groups were comparable in all major clinical characteristics of patients, as well as on the number of affected arteries, the total number of bypasses, the number of working bypasses, and diffuse lesion of the native channel. The degree of stenosis of the native vessel was significantly higher in the second group, and the degree of stenosis of bypasses was significantly higher in the first group. Diffuse lesions of coronary bypasses were significantly more frequent in the first group.Long-term results of the study were followed up in patients in the observation period of 3 to 36 months (mean follow-up was 21(14–27) months). The average duration was not significantly different between treatment groups.
Results: the incidence of myocardial infarction was comparable between groups. In group of coronary bypass graft stenting, revascularization procedures frequency was higher than in the native vessel revascularization (20,45% and 16,25%, respectively, p = 0,0045), and also had a higher incidence of target lesion revascularization (11.36% and 6.25%, respectively, p = 0,0045).
The cumulative rate of major cardiovascular events did not differ significantly, but there was a certain tendency toward a lower incidence of major cardiovascular events in the group of revascularization of the native vessel.
KEY-WORDS:
• coronary bypass grafts stenting
• stent placement in coronary artery
• long-term outcomes of endovascular treatment
• selection algorithm lesions for PCI
Кроме того, у этих пациентов чаще встречаются хронические окклюзии нативного коронарного русла [9,10]. Анатомия коронарных артерий у них изменена из-за предшествующего КШ, а выключение проксимального сегмента нативной артерии (частичное или полное) из кровотока ускоряет прогрессирование атеросклероза, что, в свою очередь, приводит к увеличению длины поражения и значительному кальцинозу [2,11]. При реканализации хронических окклюзий частота успеха у пациентов после КШ ниже, чем у пациентов без КШ.
Результаты исследований, в которых сравниваются отдаленные результаты стентирования шунтов и нативного русла неоднозначны и из них невозможно сделать вывод о том, какой тактики следует придерживаться у данной группы пациентов.
Цель исследования: сравнить отдаленные результаты стентирования шунтов и нативного коронарного русла у пациентов с возвратной стенокардией после КШ при использовании алгоритма предложенного в исследовании.
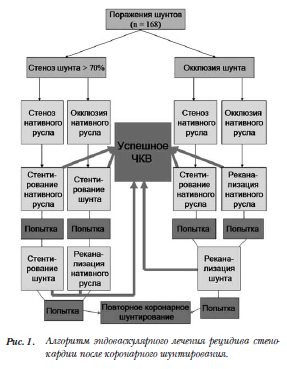 Исследование выполнялось в 3 ЦВКГ им. А.А. Вишневского МО РФ с 2010 г. по 2014 г. в виде проспективного нерандомизированного исследования. Было включено 168 пациентов. Из них 80 пациентам была выполнена реваскуляризация нативного русла (группа 1), 88 больных – реваскуляризация шунтов (группа 2). Распределение между группами происходило на основании алгоритма (рис. 1).
Исследование выполнялось в 3 ЦВКГ им. А.А. Вишневского МО РФ с 2010 г. по 2014 г. в виде проспективного нерандомизированного исследования. Было включено 168 пациентов. Из них 80 пациентам была выполнена реваскуляризация нативного русла (группа 1), 88 больных – реваскуляризация шунтов (группа 2). Распределение между группами происходило на основании алгоритма (рис. 1).
Критериями включения были: наличие значимых поражений шунтов по данным КШГ, стенокардия напряжения II–III ФК, наличие ишемии в зоне кровоснабжения шунта. Критериями исключения являлись: острый инфаркт миокарда, рестеноз ранее установленных стентов, одномоментное стентирование нативного русла и шунтов.
Исследуемые группы были сопоставимы по всем основным клиническим характеристикам пациентов, а так же по количеству пораженных артерий, общему количеству шунтов, количеству работающих шунтов, диффузному поражению нативного русла (табл. 1).
С момента поступления в стационар всем пациентам назначалась ацетилсалициловая кислота (аспирин) 100 мг в сутки если пациент уже находился на терапии аспирином, а если он ранее не принимал аспирин еще и нагрузочная доза в количестве 300 мг аспирина однократно. За 4 дня до операции назначался клопидогрел (плавикс) в дозировке 300 мг однократно, с последующей терапией по 75 мг в сутки. После проведенного ЧКВ был рекомендован прием аспирина в дозе 100 мг в сутки в течение всей последующей жизни. В случае имплантации голометалических стентов (ГМС) прием клопидогрела в дозе 75 мг в сутки рекомендовалось продолжать не менее 6 месяцев, а при установке стентов с лекарственным покрытием (СЛП) – не менее 1 года. Статистически достоверных различий между группами в частоте назначения β-адреноблакаторов, ингибиторов АПФ и статинов получено не было. Отмечалась высокая приверженность к медикаментозной терапии в обеих группах (98,75% и 98,86% соответственно).
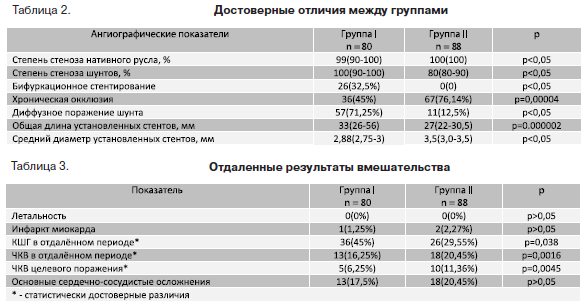
Степень стеноза нативного русла была достоверно выше во второй группе, а степень стеноза шунтов была достоверно выше в первой группе. Поражения ствола левой коронарной артерии (ЛКА), проксимального сегмента передней нисходящей артерии (ПНА) и кальциноз встречались чаще во второй группе, однако это различие не достигло статистической достоверности. Диффузные поражения шунтов достоверно чаще встречались в первой группе. Факторы, по которым были достигнуты достоверные отличия между исследуемыми группами, представлены в таблице 2.
 Отдаленные результаты исследования прослежены у пациентов в срок наблюдения от 3 до 36 месяцев (средний период наблюдения составил 21(14–27) месяц). Средняя продолжительность достоверно не различалась между исследуемыми группами (рис. 2).
Отдаленные результаты исследования прослежены у пациентов в срок наблюдения от 3 до 36 месяцев (средний период наблюдения составил 21(14–27) месяц). Средняя продолжительность достоверно не различалась между исследуемыми группами (рис. 2).
В отдаленном периоде наблюдения оценивалась летальность, частота инфаркта миокарда (ИМ), повторных реваскуляризаций целевого поражения и основных сердечно-сосудистых осложнений, а также клиническая эффективность процедуры реваскуляризации миокарда. Отдаленные результаты оценивали при повторной госпитализации пациентов, по данным предоставленным поликлиниками, к которым прикреплены пациенты, а также по данным анкетирования и телефонного опроса. В случае наличия показаний (рецидива или прогрессирования клиники стенокардии) больной госпитализировался в стационар, где ему проводилась коронарошунтография (КШГ), так же нескольким пациентам была выполнена КШГ перед плановыми операциями, не связанными с сердечно-сосудистой системой.
Рецидив стенокардии в отдаленном периоде определялся как появление у пациента клиники стенокардии, в случае ее отсутствия после ЧКВ, или ее прогрессирование как минимум на один функциональный класс, среди пациентов, у которых клиника стенокардии сохранялась.
Повторные процедуры реваскуляризации целевого сосуда выполнялись в случае прогрессирования стенозирующего атеросклеротического процесса, либо рестеноза (тромбоза) в ранее имплантированном стенте. Рестеноз определялся как возникновение стеноза более 50% по краям или внутри стента.
Статистический анализ результатов исследования проводился с использованием программы MS Statistica 10,0. Различия считались статистически достоверными при значении р ≤0,05. Сопоставление групп по изучаемым параметрам проводили, используя критерии: U-критерий Манна-Уитни, точный Фишера, критерий Вальда-Вольфовица, Пирсона c2. Значимость предполагаемых факторов риска оценивалась при помощи корреляционного анализа и методов регрессии Кокса. Сравнительный анализ показателей выживаемости проводили с помощью теста Гехана-Вилкоксона, а построение кривой выживаемости выполнено по методу Каплана-Майера.
В исследуемых группах в отдаленном периоде летальных исходов зарегистрировано не было (табл. 3).
Частота развития ИМ оказалась сопоставимой между группами. В группе реваскуляризации нативного русла в отдаленном периоде ИМ развился у 1(1,25%) пациента через 26 мес. после ЧКВ. В группе реваскуляризации шунтов в отдаленном периоде ИМ развился у 2(2,3%) пациентов: у одного пациента через 19 мес. после ЧКВ, а у второго − через 28 мес.
Пациентам в отдаленном периоде проводился нагрузочный тест с целью определения наличия ишемии миокарда в зоне кровоснабжения симптом-связанной артерии. В группе реваскуляризации нативного русла ишемия была выявленная у 4(5%) пациентов, в группе реваскуляризации шунтов − также у 4(4,6%) больных была выявлена ишемия в зоне кровоснабжения симптом-связанной артерии.
В группе реваскуляризации шунтов частота процедур ЧКВ была выше, чем в группе реваскуляризации
нативного русла (20,45% и 16,25%, соответственно, p=0,0045), а также была выше частота реваскуляризации целевого поражения (11,36% и 6,25%, соответственно, p=0,0045).
В группе реваскуляризации нативного русла рецидив стенокардии в отдаленном периоде был выявлен у
18 (22,50%) пациентов. Сроки возобновления стенокардии варьировали от 12 до 31 мес. Причиной возобновления стенокардии у 8(12,5%) пациентов из данной группы стало прогрессирование пограничных стенозов или образование нового поражения, в связи с чем им было выполнено ЧКВ. Причиной рецидива стенокардии у 4(5%) пациентов стал рестеноз в ранее имплантированных стентах (табл. 3). Во всех случаях рестеноз наблюдался в ГМС, в связи с чем им была выполнена имплантация СЛП. Срок рецидива стенокардии в случае рестеноза ГМС колебался от 13 до 21 месяцев.
В группе реваскуляризации шунтов рецидив стенокардии в отдаленном периоде наблюдался у 23(26,14%) пациентов. Сроки рецидива стенокардии колебались от 11 до 36 мес. Причиной рецидива стенокардии у
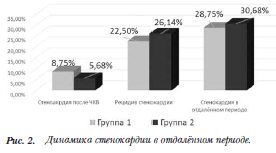
8(9,09%) пациентов стал рестеноз в ранее имплантированном стенте, у 8(9,09%) пациентов из данной группы – прогрессирование пограничных стенозов или образование нового поражения. У 6(6,8%) больных рестеноз развился в ГМС, в связи с чем им был имплантирован СЛП. У одного (1,14%) пациента рестеноз развился в теле ранее имплантированного СЛП Xience V, а еще у одного (1,14%) больного был выявлен краевой рестеноз СЛП Cypher. В обоих случаях была выполнена баллонная ангиопластика рестеноза лекарственным баллонным катетером. Срок рецидива стенокардии в случае имплантации ГМС колебался от 11 до 28 мес., а в случае имплантации СЛП – 13 и 32 мес. Динамика клиники стенокардии представлена на рисунке 2.
В таблице 4 представлены основные причины рецидива стенокардии.
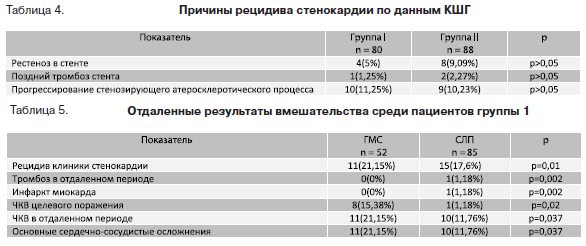
 Таким образом, частота рестеноза и позднего тромбоза была выше в группе ревасуляризации шунтов, чем в группе реваскуляризации нативного русла, однако эти различия не достигли статистической достоверности, а развитие нового поражения и прогрессирование атеросклератического процесса достоверно не различались.
Таким образом, частота рестеноза и позднего тромбоза была выше в группе ревасуляризации шунтов, чем в группе реваскуляризации нативного русла, однако эти различия не достигли статистической достоверности, а развитие нового поражения и прогрессирование атеросклератического процесса достоверно не различались.
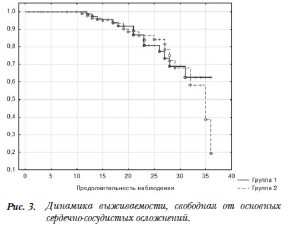
Совокупный показатель основных сердечно-сосудистых осложнений достоверно не отличался, однако была некая тенденция к меньшей частоте больших сердечно-сосудистых событий в группе реваскуляризации нативного русла. Кривая выживаемости, свободная от основных сердечно-сосудистых осложнений, по-строенная по методу Каплана-Майера, представлена на рисунке 3.
В группе стентирования шунтов хоть и отмечалась тенденция к снижению частоты рецидива стенокардии (21,95% СЛП и ГМС 29,79%), ЧКВ в отдаленном периоде (14,63% СЛП и ГМС 25,53%) и ЧКВ целевого поражения (9,76% СЛП и ГМС 12,76%) при использовании СЛП, по сравнению с ГМС, однако статистической достоверности эти различия не достигли.
В группе стентирования нативного русла, напротив, были получены достоверные различия. При использовании СЛП частота рецидивов стенокардии и больших сердечно-сосудистых событий была ниже, чем при использовании ГМС; использование СЛП приводило к снижению повторных ЧКВ почти в 2 раза по сравнению с ГМС (табл. 5).
Статистически достоверных отличий в частоте наступления больших сердечно-сосудистых событий не наблюдалось, однако частота повторных реваскуляризаций целевого поражения и частота ЧКВ в отдаленном периоде была достоверно ниже в группе 1. Также при использовании СЛП в группе 1 наблюдалось снижение повторных ЧКВ в 2 раза по сравнению с ГМС.
По данным литературы летальность в отдаленном периоде при реваскуляризации шунтов составляет от 1% до 5,2% [12–16], а при реваскуляризациях многососудистых поражений коронарного русла 1,2–1,6% [17,18]. В исследуемых группах в отдалeнном периоде летальных исходов зарегистрировано не было.
Результаты первой группы в целом укладываются в частоту ИМ, описанную в исследованиях, посвященных реваскуляризации многососудистых поражений коронарного русла. В среднем еe значения находятся в диапазоне от 1,2% до 9,1% [19,20]. Частота ИМ во второй группе ниже, чем в исследованиях, посвященных лечению поражений шунтов. Она составляет по данным литературы от 4,2% до 6% [12,13,15,16,21-26]. Более низкую частоту ИМ можно объяснить стентированием шунтов согласно алгоритму, практически полным отказом от реканализации окклюзий шунтов, а также высокой приверженностью пациентов к гиполипидемической терапии, которая достоверно снижает частоту больших сердечно-сосудистых событий в отдаленном периоде [27,28].
Тромбозы стентов в отдалeнном периоде в нашем исследовании встречались на втором и третьем году наблюдения, и частота их была выше, чем в литературных источниках [29]. Причины столь поздних тромбозов стентов на данный момент мало изучены.
В группе реваскуляризации шунтов частота ЧКВ была выше, чем в группе реваскуляризации нативного русла (20,45% и 16,25%, соответственно, p=0,0045), а также была выше частота реваскуляризации целевого поражения (11,36% и 6,25%, соответственно, p=0,0045). В литературе, посвящeнной стентированию шунтов, частота реваскуляризаций в отдалeнном периоде варьирует от 11,5% до 22%, в зависимости от сложности поражения и установленных типов стентов [12,13,15,16,22,24,25,30–33], однако в большинстве перечисленных исследований конечными точками являлись реваскуляризация целевого сосуда и/или реваскуляризация целевого поражения. В нашем исследовании частота ЧКВ в отдаленном периоде включала в себя все ЧКВ. Частота реваскуляризаций целевого поражения была посчитана отдельно и является сопоставимой с литературными источниками (7,2%–13,1%) [12,13,15,16,22,24,25,30–33]. В группе реваскуляризации нативного русла частота реваскуляризаций и частота реваскуляризаций целевого поражения совпадают с данными исследований. По литературным данным частота повторных ЧКВ составляет 6,5–24%, в зависимости от вида стента [19,26,34,35]. Например, в исследовании ERACI III частота реваскуляризаций целевого поражения составила от 14,2% до 24,4% [36,37], а в исследовании ARTS II – от 11,8% до 23,6% [38–40].
В группе реваскуляризации нативного русла рецидив стенокардии в отдаленном периоде был выявлен у 18 (22,50%) пациентов, в связи с чем им выполнялись эндоваскулярные вмешательства. В группе реваскуляризации шунтов рецидив стенокардии в отдаленном периоде наблюдался у 23(26,14%) пациентов, в связи с чем проводилось повторное ЧКВ.
Частота рестеноза была выше в группе ревасуляризации шунтов (9,09%), чем в группе реваскуляризации нативного русла (5%), однако эти различия не достигли статистической достоверности, а частота развития нового поражения и прогрессирование атеросклеротического процесса достоверно не различались. Наличие рестенозов в СЛП в группе 2 частично объясняется тем, что у данных пациентов стенты были установлены в шунт внутренней грудной артерии (ВГА), а при стентировании шунтов ВГА частота рестенозов сильно возрастает [19]. Тем не менее, частота рестенозов полностью соответствует литературным данным, согласно которым она варьирует от 6,8% до 15% [12,13,15, 16,22,24,25,30–33]. Частота рестенозов в первой группе также соответствует литературным данным, посвящeнным ЧКВ многососудистого поражения коронарного русла, в которых частота рестеноза описывается от 1,6% до 22% [26,41–45]. Частота рецидива клиники стенокардии в обеих группах также не отличалась от соответствующих исследований.
Совокупный показатель основных сердечно-сосудистых осложнений достоверно не отличался, и был равен в первой группе – 17,5% и 20,45% во второй группе. В нашем исследовании в этот показатель вошли все случаи реваскуляризации в отдаленном периоде, в независимости от того, являлись ли они реваскуляризациями целевого поражения или нет. Во второй группе этот показатель сопоставим с большинством исследований, посвященных реваскуляризации шунтов. Средний показатель повторных ЧКВ шунтов представленный в литературе состовляет 15,4% – 26% [12,13,15,16,22,24,25,31–33]. Однако при ЧКВ диффузно изменeнных или окклюзированных шунтов, этот показатель достигает 30%–68% [30,32]. В первой группе совокупный показатель основных сердечно-сосудистых осложнений соответствовал большинству литературных источников, в которых он был равен от 11,1% до 30,9% [19,26,34,35].
Частота больших сердечно-сосудистых (23,53% ГМС и 13,4% СЛП) событий и реваскуляризации целевого поражения (14,7% ГМС и 5,2% СЛП) в зависимости от типа установленного стента достоверно не отличалась и были сопоставимы с данными большинства иссле-дований, как посвящeнных реваскуляризации шунтов [12,13,15,16,22,24,25,30–33], так и реваскуляризации многососудистых поражений нативного русла [19,26,34,35].
В группе стентирования шунтов хоть и отмечалась тенденция к снижению частоты рецидива стенокардии (21,95% СЛП и ГМС 29,79%), ЧКВ в отдаленном периоде (14,63% СЛП и ГМС 25,53%) и ЧКВ целевого поражения (9,76% СЛП и ГМС 12,76%) при использовании СЛП, по сравнению с ГМС, однако статистической достоверности эти различия не достигли.
В группе стентирования нативного русла, напротив, были получены достоверные различия. При использовании СЛП частота рецидивов стенокардии (21,15% ГМС и 17,6% СЛП, р=0,01) и больших сердечно-сосудистых (21,15% ГМС и 11,76%, р=0,037) событий была ниже, чем при использовании ГМС. Также использование СЛП приводило к снижению повторных ЧКВ почти в 2 раза по сравнению с ГМС (21,15% ГМС и 11,76% СЛП, р=0,037). Эти данные полностью согласуются с данными крупных исследований, посвященных реваскуляризации многососудистых поражений коронарного русла, в которых применение СЛП также связано со снижением частоты больших сердечно-сосудистых осложнений и повторных ЧКВ. Например, в исследовании ARTS II частота повторных реваскуляризаций составила 11,8% при использовании СЛП и 23,6% при использовании ГМС, а частота больших сердечно сосудистых событий 16,3% с СЛП и 30,9% с ГМС [24,36,37].
Путем статистического анализа, с применением регрессионной модели Кокса были выявлены клини-ческие и ангиографические относительные факторы риска наступления больших сердечно-сосудистых событий. Независимыми клиническими предикторами для обеих групп являлись: пожилой и старческий возраст (относительный риск=1,033; 95% ДИ: 0,984–1,08), сахарный диабет второго типа (относительный риск= 2,85; 95% ДИ: 1,13–7,17), инфаркт миокарда в анамнезе (относительный риск=1,54; 95% ДИ: 0,65–3,64) и ожирение второй и третей степени (относительный риск=1,045; 95% ДИ: 0,95–1,15). Данные факторы фигурируют в большей или меньшей степени в разных исследованиях, посвященных реваскуляризации, как предикторы основных сердечно-сосудистых осложнений [12,13,15,16,22,24,25,30–33]. Независимыми ангиографическими предикторами являлись для группы реваскуляризации нативного русла: наличие хронической окклюзии артерии, на которой выполняется ЧКВ (относительный риск=2,357; 95% ДИ: 0,71–7,845), а так же высокая степень стеноза артерии, на которой выполнялось ЧКВ (90%-99%), (относительный риск = 1,015; 95% ДИ: 0,91-1,12). Эти критерии совпадают с факторами риска в литературных источниках [19, 26,34,35]. Для группы 2 независимыми предикторами являлись морфология поражения шунта к ПНА типа С (относительный риск=1,27; 95% ДИ: 0,75–2,15) и морфология поражения шунта к ПКА типа С (относительный риск=1,027; 95% ДИ: 0,99–1,06). Эти 2 фактора в литературных источниках не встречаются, так как немногие исследователи пользуются для определения морфологии поражения шунтов данной классификацией, хотя косвенно они совпадают с факторами риска, наблюдаемыми в других исследованиях. Независимыми предикторами для двух групп явились: многососудистое поражение коронарного русла (относительный риск=5,32; 95% ДИ: 1,03–27,56) и малый диаметр установленных стентов (относительный риск = 1,042; 95% ДИ: 0,99–1,087). Эти факторы риска подтверждены многочисленными исследованиями и присутствуют практически во всех литературных источниках.
1. Стентирование шунтов может рассматриваться в качестве эквивалентной тактики при лечении пациентов с возвратом стенокардии после КШ при соблюдении алгоритма, предложенного в данном исследовании.
2. Тактика реваскуляризации нативного русла является предпочтительной при равнозначных поражениях нативного русла и шунтов, однако при наличии более тяжелого поражения нативного русла следует применять тактику реваскуляризации шунтов.
3. Риски больших сердечно-сосудистых событий в отдаленном периоде при использовании предложенного алгоритма сопоставимы для тактик реваскуляризации шунтов и нативного русла. Однако частота рецидива стенокардии и реваскуляризации целевого поражения достоверно выше при выборе тактики реваскуляризации шунтов.
4. Факторами риска наступления больших сердечно-сосудистых событий в отдалeнном периоде в обеих группах являются: пожилой и старческий возраст, сахарный диабет второго типа, инфаркт миокарда
в анамнезе, ожирение второй и третьей степени,
многососудистое поражение коронарного русла, малый диаметр установленных стентов, а также наличие хронической окклюзии или высокая степень
стеноза.
5. При использовании СЛП наблюдалось снижение частоты больших сердечно-сосудистых событий и повторных реваскуляризаций в обеих группах, однако статистической достоверности эта разница достигла только при использовании тактики реваскуляризации нативного русла.
Актуальным остается вопрос о выборе стратегии лечении пациентов с возвратной стенокардией после операции коронарного шунтирования (КШ). Повторное КШ связано с повышенным риском летальности и больших сердечно-сосудистых событий, поэтому чрескожные коронарные вмешательства (ЧКВ) являются основной стратегией у этой категории пациентов. Критерии выбора между стентированием нативного русла или шунтов полностью не изучены, так же как не решён вопрос дифференцированного подхода к выбору поражения для стентирования.
Цель: сравнить отдалённые результаты стентирования шунтов и нативного коронарного русла у пациентов с возвратной стенокардией после КШ при использовании алгоритма предложенного в исследовании.
Материалы и методы: исследование проводилось в 2010– 2014 гг. в «3 ЦВКГ им. А.А. Вишневского» МО РФ. Всего было прооперировано 168 пациентов. Реваскуляризация нативного русла – 80 пациентам, стентирование шунтов было выполнено 88 больным. Исследуемые группы были сопоставимы по всем основным клиническим характеристикам пациентов, а так же по количеству пораженных артерий, общему количеству шунтов, количеству работающих шунтов, диффузному поражению нативного русла.Степень стеноза нативного русла была достоверно выше во второй группе, а степень стеноза шунтов была достоверно выше в первой группе. Диффузные поражения шунтов достоверно чаще встречались в первой группе. Отдаленные результаты исследования прослежены у пациентов в срок наблюдения от 3 до 36 месяцев (средний период наблюдения составил 21(14–27) месяц). Средняя продолжительность достоверно не различалась между исследуемыми группами.
Результаты: частота развития ИМ оказалась сопоставимой между группами. В группе реваскуляризации шунтов частота процедур ЧКВ была выше, чем в группе реваскуляризации нативного русла (20,45% и 16,25%, соответственно, p=0,0045), а также была выше частота реваскуляризации целевого поражения (11,36% и 6,25%, соответственно, p=0,0045).
Совокупный показатель основных сердечно-сосудистых осложнений достоверно не отличался, однако была некая тенденция к меньшей частоте больших сердечно-сосудистых событий в группе реваскуляризации нативного русла.
Ключевые слова:
• стентирование шунтов
• стентирование нативного русла
• отдаленные результаты эндоваскулярного лечения
• алгоритм выбора поражения для ЧКВ
Long-term outcomes of endovascular interventions in patients with return of angina after coronary bypass
*Ivanov V.A. – MD, PhD, professor1Shames A.B. – MD, PhD, professor1
Bazanov I.S. – MD1,2
Ivanov A.V. – MD1
Zharikov S.B. – MD1,2
Tsymbal E.V. – MD1
Maksimkin D.A. – MD2
Polyakov I.I. – MD1
Faybusovich A. – MD2
13rd Central Military Clinical Hospital named after A.A.Vishnevsky
of Ministry of Military Defence, Russian Federation
pos.Novy, p/o Arkhangelsk, Krasnogorsk district, Moscow region, Russian Federation, 143420
2People’s Friendship University of Russia
st. 8, Miklokho-Maklaya, Moscow, Russian Federation, 111000
ABSTRACT:
Choice of treatment strategy in patients with recurrent angina after coronary artery bypass graft surgery (CABG) is still an actual question. Repeat CABG is associated with an increased risk of mortality and large cardiovascular events, so percutaneous coronary intervention (PCI) is the main strategy in these patients. Criteria for choosing between the bypass and the native vessel stenting are not fully understood, as well as not resolved the question of the differentiated approach to the choice of defeat for stenting.
Aim: was to compare long-term results of stenting of bypass and native coronary arteries in patients with recurrent angina after CABG using the algorithm proposed in the study.
Materials and methods: study was conducted in 2010–2014 years. in «3rd Central Military Clinical Hospital named after A.A.Vishnevsky of Ministry of Military Defence». A total of 168 patients with the defeat of coronary bypass graft were operated: revascularization of the native vessel – 80 patients, stenting of coronary bypass graft was performed in 88 patients. Treatment groups were comparable in all major clinical characteristics of patients, as well as on the number of affected arteries, the total number of bypasses, the number of working bypasses, and diffuse lesion of the native channel. The degree of stenosis of the native vessel was significantly higher in the second group, and the degree of stenosis of bypasses was significantly higher in the first group. Diffuse lesions of coronary bypasses were significantly more frequent in the first group.Long-term results of the study were followed up in patients in the observation period of 3 to 36 months (mean follow-up was 21(14–27) months). The average duration was not significantly different between treatment groups.
Results: the incidence of myocardial infarction was comparable between groups. In group of coronary bypass graft stenting, revascularization procedures frequency was higher than in the native vessel revascularization (20,45% and 16,25%, respectively, p = 0,0045), and also had a higher incidence of target lesion revascularization (11.36% and 6.25%, respectively, p = 0,0045).
The cumulative rate of major cardiovascular events did not differ significantly, but there was a certain tendency toward a lower incidence of major cardiovascular events in the group of revascularization of the native vessel.
KEY-WORDS:
• coronary bypass grafts stenting
• stent placement in coronary artery
• long-term outcomes of endovascular treatment
• selection algorithm lesions for PCI
Введение
После операции коронарного шунтирования (КШ) часто развиваются поражение шунтов, особенно в течение первых лет после операции [1]. ЧКВ является стратегией выбора в лечении больных с рецидивом стенокардии после КШ, так как повторное КШ связано с высокой частотой смерти и больших сердечно-сосудистых осложнений [2]. Однако черезкожные коронарные вмешательства (ЧКВ) у пациентов, перенесших операцию КШ приводит к худшим результатам, чем у пациентов без КШ [3–5]. В некоторых исследованиях сообщается, что процент ЧКВ у пациентов после КШ составляет от 17,5% до 37% от всех ЧКВ, а вмешательства на шунтах составляют от 5% до 10% всех ЧКВ [6,7]. По сравнению со стентированием коронарных артерий (КА), стентирование поражений шунтов связано с более высокой частотой интраоперационных осложнений, а также больших сердечно-сосудистых осложнений в связи с дистальной эмболией, феноменом «no-reflow» и высоким процентом рестенозов [8]. Повышенный риск объясняется, главным образом, рыхлыми нестабильными атеросклеротическими бляшками и фрагментами тромбов, которые образуются при дегенерации венозных шунтов [2].Кроме того, у этих пациентов чаще встречаются хронические окклюзии нативного коронарного русла [9,10]. Анатомия коронарных артерий у них изменена из-за предшествующего КШ, а выключение проксимального сегмента нативной артерии (частичное или полное) из кровотока ускоряет прогрессирование атеросклероза, что, в свою очередь, приводит к увеличению длины поражения и значительному кальцинозу [2,11]. При реканализации хронических окклюзий частота успеха у пациентов после КШ ниже, чем у пациентов без КШ.
Результаты исследований, в которых сравниваются отдаленные результаты стентирования шунтов и нативного русла неоднозначны и из них невозможно сделать вывод о том, какой тактики следует придерживаться у данной группы пациентов.
Цель исследования: сравнить отдаленные результаты стентирования шунтов и нативного коронарного русла у пациентов с возвратной стенокардией после КШ при использовании алгоритма предложенного в исследовании.
Материалы и методы
 Исследование выполнялось в 3 ЦВКГ им. А.А. Вишневского МО РФ с 2010 г. по 2014 г. в виде проспективного нерандомизированного исследования. Было включено 168 пациентов. Из них 80 пациентам была выполнена реваскуляризация нативного русла (группа 1), 88 больных – реваскуляризация шунтов (группа 2). Распределение между группами происходило на основании алгоритма (рис. 1).
Исследование выполнялось в 3 ЦВКГ им. А.А. Вишневского МО РФ с 2010 г. по 2014 г. в виде проспективного нерандомизированного исследования. Было включено 168 пациентов. Из них 80 пациентам была выполнена реваскуляризация нативного русла (группа 1), 88 больных – реваскуляризация шунтов (группа 2). Распределение между группами происходило на основании алгоритма (рис. 1). Критериями включения были: наличие значимых поражений шунтов по данным КШГ, стенокардия напряжения II–III ФК, наличие ишемии в зоне кровоснабжения шунта. Критериями исключения являлись: острый инфаркт миокарда, рестеноз ранее установленных стентов, одномоментное стентирование нативного русла и шунтов.
Исследуемые группы были сопоставимы по всем основным клиническим характеристикам пациентов, а так же по количеству пораженных артерий, общему количеству шунтов, количеству работающих шунтов, диффузному поражению нативного русла (табл. 1).
С момента поступления в стационар всем пациентам назначалась ацетилсалициловая кислота (аспирин) 100 мг в сутки если пациент уже находился на терапии аспирином, а если он ранее не принимал аспирин еще и нагрузочная доза в количестве 300 мг аспирина однократно. За 4 дня до операции назначался клопидогрел (плавикс) в дозировке 300 мг однократно, с последующей терапией по 75 мг в сутки. После проведенного ЧКВ был рекомендован прием аспирина в дозе 100 мг в сутки в течение всей последующей жизни. В случае имплантации голометалических стентов (ГМС) прием клопидогрела в дозе 75 мг в сутки рекомендовалось продолжать не менее 6 месяцев, а при установке стентов с лекарственным покрытием (СЛП) – не менее 1 года. Статистически достоверных различий между группами в частоте назначения β-адреноблакаторов, ингибиторов АПФ и статинов получено не было. Отмечалась высокая приверженность к медикаментозной терапии в обеих группах (98,75% и 98,86% соответственно).

Степень стеноза нативного русла была достоверно выше во второй группе, а степень стеноза шунтов была достоверно выше в первой группе. Поражения ствола левой коронарной артерии (ЛКА), проксимального сегмента передней нисходящей артерии (ПНА) и кальциноз встречались чаще во второй группе, однако это различие не достигло статистической достоверности. Диффузные поражения шунтов достоверно чаще встречались в первой группе. Факторы, по которым были достигнуты достоверные отличия между исследуемыми группами, представлены в таблице 2.

 Отдаленные результаты исследования прослежены у пациентов в срок наблюдения от 3 до 36 месяцев (средний период наблюдения составил 21(14–27) месяц). Средняя продолжительность достоверно не различалась между исследуемыми группами (рис. 2).
Отдаленные результаты исследования прослежены у пациентов в срок наблюдения от 3 до 36 месяцев (средний период наблюдения составил 21(14–27) месяц). Средняя продолжительность достоверно не различалась между исследуемыми группами (рис. 2). В отдаленном периоде наблюдения оценивалась летальность, частота инфаркта миокарда (ИМ), повторных реваскуляризаций целевого поражения и основных сердечно-сосудистых осложнений, а также клиническая эффективность процедуры реваскуляризации миокарда. Отдаленные результаты оценивали при повторной госпитализации пациентов, по данным предоставленным поликлиниками, к которым прикреплены пациенты, а также по данным анкетирования и телефонного опроса. В случае наличия показаний (рецидива или прогрессирования клиники стенокардии) больной госпитализировался в стационар, где ему проводилась коронарошунтография (КШГ), так же нескольким пациентам была выполнена КШГ перед плановыми операциями, не связанными с сердечно-сосудистой системой.
Рецидив стенокардии в отдаленном периоде определялся как появление у пациента клиники стенокардии, в случае ее отсутствия после ЧКВ, или ее прогрессирование как минимум на один функциональный класс, среди пациентов, у которых клиника стенокардии сохранялась.
Повторные процедуры реваскуляризации целевого сосуда выполнялись в случае прогрессирования стенозирующего атеросклеротического процесса, либо рестеноза (тромбоза) в ранее имплантированном стенте. Рестеноз определялся как возникновение стеноза более 50% по краям или внутри стента.
Статистический анализ результатов исследования проводился с использованием программы MS Statistica 10,0. Различия считались статистически достоверными при значении р ≤0,05. Сопоставление групп по изучаемым параметрам проводили, используя критерии: U-критерий Манна-Уитни, точный Фишера, критерий Вальда-Вольфовица, Пирсона c2. Значимость предполагаемых факторов риска оценивалась при помощи корреляционного анализа и методов регрессии Кокса. Сравнительный анализ показателей выживаемости проводили с помощью теста Гехана-Вилкоксона, а построение кривой выживаемости выполнено по методу Каплана-Майера.
Результаты
В исследуемых группах в отдаленном периоде летальных исходов зарегистрировано не было (табл. 3).
Частота развития ИМ оказалась сопоставимой между группами. В группе реваскуляризации нативного русла в отдаленном периоде ИМ развился у 1(1,25%) пациента через 26 мес. после ЧКВ. В группе реваскуляризации шунтов в отдаленном периоде ИМ развился у 2(2,3%) пациентов: у одного пациента через 19 мес. после ЧКВ, а у второго − через 28 мес.
Пациентам в отдаленном периоде проводился нагрузочный тест с целью определения наличия ишемии миокарда в зоне кровоснабжения симптом-связанной артерии. В группе реваскуляризации нативного русла ишемия была выявленная у 4(5%) пациентов, в группе реваскуляризации шунтов − также у 4(4,6%) больных была выявлена ишемия в зоне кровоснабжения симптом-связанной артерии.
В группе реваскуляризации шунтов частота процедур ЧКВ была выше, чем в группе реваскуляризации
нативного русла (20,45% и 16,25%, соответственно, p=0,0045), а также была выше частота реваскуляризации целевого поражения (11,36% и 6,25%, соответственно, p=0,0045).
В группе реваскуляризации нативного русла рецидив стенокардии в отдаленном периоде был выявлен у
18 (22,50%) пациентов. Сроки возобновления стенокардии варьировали от 12 до 31 мес. Причиной возобновления стенокардии у 8(12,5%) пациентов из данной группы стало прогрессирование пограничных стенозов или образование нового поражения, в связи с чем им было выполнено ЧКВ. Причиной рецидива стенокардии у 4(5%) пациентов стал рестеноз в ранее имплантированных стентах (табл. 3). Во всех случаях рестеноз наблюдался в ГМС, в связи с чем им была выполнена имплантация СЛП. Срок рецидива стенокардии в случае рестеноза ГМС колебался от 13 до 21 месяцев.
В группе реваскуляризации шунтов рецидив стенокардии в отдаленном периоде наблюдался у 23(26,14%) пациентов. Сроки рецидива стенокардии колебались от 11 до 36 мес. Причиной рецидива стенокардии у
8(9,09%) пациентов стал рестеноз в ранее имплантированном стенте, у 8(9,09%) пациентов из данной группы – прогрессирование пограничных стенозов или образование нового поражения. У 6(6,8%) больных рестеноз развился в ГМС, в связи с чем им был имплантирован СЛП. У одного (1,14%) пациента рестеноз развился в теле ранее имплантированного СЛП Xience V, а еще у одного (1,14%) больного был выявлен краевой рестеноз СЛП Cypher. В обоих случаях была выполнена баллонная ангиопластика рестеноза лекарственным баллонным катетером. Срок рецидива стенокардии в случае имплантации ГМС колебался от 11 до 28 мес., а в случае имплантации СЛП – 13 и 32 мес. Динамика клиники стенокардии представлена на рисунке 2.
В таблице 4 представлены основные причины рецидива стенокардии.

 Таким образом, частота рестеноза и позднего тромбоза была выше в группе ревасуляризации шунтов, чем в группе реваскуляризации нативного русла, однако эти различия не достигли статистической достоверности, а развитие нового поражения и прогрессирование атеросклератического процесса достоверно не различались.
Таким образом, частота рестеноза и позднего тромбоза была выше в группе ревасуляризации шунтов, чем в группе реваскуляризации нативного русла, однако эти различия не достигли статистической достоверности, а развитие нового поражения и прогрессирование атеросклератического процесса достоверно не различались.Совокупный показатель основных сердечно-сосудистых осложнений достоверно не отличался, однако была некая тенденция к меньшей частоте больших сердечно-сосудистых событий в группе реваскуляризации нативного русла. Кривая выживаемости, свободная от основных сердечно-сосудистых осложнений, по-строенная по методу Каплана-Майера, представлена на рисунке 3.
В группе стентирования шунтов хоть и отмечалась тенденция к снижению частоты рецидива стенокардии (21,95% СЛП и ГМС 29,79%), ЧКВ в отдаленном периоде (14,63% СЛП и ГМС 25,53%) и ЧКВ целевого поражения (9,76% СЛП и ГМС 12,76%) при использовании СЛП, по сравнению с ГМС, однако статистической достоверности эти различия не достигли.
В группе стентирования нативного русла, напротив, были получены достоверные различия. При использовании СЛП частота рецидивов стенокардии и больших сердечно-сосудистых событий была ниже, чем при использовании ГМС; использование СЛП приводило к снижению повторных ЧКВ почти в 2 раза по сравнению с ГМС (табл. 5).
Статистически достоверных отличий в частоте наступления больших сердечно-сосудистых событий не наблюдалось, однако частота повторных реваскуляризаций целевого поражения и частота ЧКВ в отдаленном периоде была достоверно ниже в группе 1. Также при использовании СЛП в группе 1 наблюдалось снижение повторных ЧКВ в 2 раза по сравнению с ГМС.
Обсуждение
По данным литературы летальность в отдаленном периоде при реваскуляризации шунтов составляет от 1% до 5,2% [12–16], а при реваскуляризациях многососудистых поражений коронарного русла 1,2–1,6% [17,18]. В исследуемых группах в отдалeнном периоде летальных исходов зарегистрировано не было.
Результаты первой группы в целом укладываются в частоту ИМ, описанную в исследованиях, посвященных реваскуляризации многососудистых поражений коронарного русла. В среднем еe значения находятся в диапазоне от 1,2% до 9,1% [19,20]. Частота ИМ во второй группе ниже, чем в исследованиях, посвященных лечению поражений шунтов. Она составляет по данным литературы от 4,2% до 6% [12,13,15,16,21-26]. Более низкую частоту ИМ можно объяснить стентированием шунтов согласно алгоритму, практически полным отказом от реканализации окклюзий шунтов, а также высокой приверженностью пациентов к гиполипидемической терапии, которая достоверно снижает частоту больших сердечно-сосудистых событий в отдаленном периоде [27,28].
Тромбозы стентов в отдалeнном периоде в нашем исследовании встречались на втором и третьем году наблюдения, и частота их была выше, чем в литературных источниках [29]. Причины столь поздних тромбозов стентов на данный момент мало изучены.
В группе реваскуляризации шунтов частота ЧКВ была выше, чем в группе реваскуляризации нативного русла (20,45% и 16,25%, соответственно, p=0,0045), а также была выше частота реваскуляризации целевого поражения (11,36% и 6,25%, соответственно, p=0,0045). В литературе, посвящeнной стентированию шунтов, частота реваскуляризаций в отдалeнном периоде варьирует от 11,5% до 22%, в зависимости от сложности поражения и установленных типов стентов [12,13,15,16,22,24,25,30–33], однако в большинстве перечисленных исследований конечными точками являлись реваскуляризация целевого сосуда и/или реваскуляризация целевого поражения. В нашем исследовании частота ЧКВ в отдаленном периоде включала в себя все ЧКВ. Частота реваскуляризаций целевого поражения была посчитана отдельно и является сопоставимой с литературными источниками (7,2%–13,1%) [12,13,15,16,22,24,25,30–33]. В группе реваскуляризации нативного русла частота реваскуляризаций и частота реваскуляризаций целевого поражения совпадают с данными исследований. По литературным данным частота повторных ЧКВ составляет 6,5–24%, в зависимости от вида стента [19,26,34,35]. Например, в исследовании ERACI III частота реваскуляризаций целевого поражения составила от 14,2% до 24,4% [36,37], а в исследовании ARTS II – от 11,8% до 23,6% [38–40].
В группе реваскуляризации нативного русла рецидив стенокардии в отдаленном периоде был выявлен у 18 (22,50%) пациентов, в связи с чем им выполнялись эндоваскулярные вмешательства. В группе реваскуляризации шунтов рецидив стенокардии в отдаленном периоде наблюдался у 23(26,14%) пациентов, в связи с чем проводилось повторное ЧКВ.
Частота рестеноза была выше в группе ревасуляризации шунтов (9,09%), чем в группе реваскуляризации нативного русла (5%), однако эти различия не достигли статистической достоверности, а частота развития нового поражения и прогрессирование атеросклеротического процесса достоверно не различались. Наличие рестенозов в СЛП в группе 2 частично объясняется тем, что у данных пациентов стенты были установлены в шунт внутренней грудной артерии (ВГА), а при стентировании шунтов ВГА частота рестенозов сильно возрастает [19]. Тем не менее, частота рестенозов полностью соответствует литературным данным, согласно которым она варьирует от 6,8% до 15% [12,13,15, 16,22,24,25,30–33]. Частота рестенозов в первой группе также соответствует литературным данным, посвящeнным ЧКВ многососудистого поражения коронарного русла, в которых частота рестеноза описывается от 1,6% до 22% [26,41–45]. Частота рецидива клиники стенокардии в обеих группах также не отличалась от соответствующих исследований.
Совокупный показатель основных сердечно-сосудистых осложнений достоверно не отличался, и был равен в первой группе – 17,5% и 20,45% во второй группе. В нашем исследовании в этот показатель вошли все случаи реваскуляризации в отдаленном периоде, в независимости от того, являлись ли они реваскуляризациями целевого поражения или нет. Во второй группе этот показатель сопоставим с большинством исследований, посвященных реваскуляризации шунтов. Средний показатель повторных ЧКВ шунтов представленный в литературе состовляет 15,4% – 26% [12,13,15,16,22,24,25,31–33]. Однако при ЧКВ диффузно изменeнных или окклюзированных шунтов, этот показатель достигает 30%–68% [30,32]. В первой группе совокупный показатель основных сердечно-сосудистых осложнений соответствовал большинству литературных источников, в которых он был равен от 11,1% до 30,9% [19,26,34,35].
Частота больших сердечно-сосудистых (23,53% ГМС и 13,4% СЛП) событий и реваскуляризации целевого поражения (14,7% ГМС и 5,2% СЛП) в зависимости от типа установленного стента достоверно не отличалась и были сопоставимы с данными большинства иссле-дований, как посвящeнных реваскуляризации шунтов [12,13,15,16,22,24,25,30–33], так и реваскуляризации многососудистых поражений нативного русла [19,26,34,35].
В группе стентирования шунтов хоть и отмечалась тенденция к снижению частоты рецидива стенокардии (21,95% СЛП и ГМС 29,79%), ЧКВ в отдаленном периоде (14,63% СЛП и ГМС 25,53%) и ЧКВ целевого поражения (9,76% СЛП и ГМС 12,76%) при использовании СЛП, по сравнению с ГМС, однако статистической достоверности эти различия не достигли.
В группе стентирования нативного русла, напротив, были получены достоверные различия. При использовании СЛП частота рецидивов стенокардии (21,15% ГМС и 17,6% СЛП, р=0,01) и больших сердечно-сосудистых (21,15% ГМС и 11,76%, р=0,037) событий была ниже, чем при использовании ГМС. Также использование СЛП приводило к снижению повторных ЧКВ почти в 2 раза по сравнению с ГМС (21,15% ГМС и 11,76% СЛП, р=0,037). Эти данные полностью согласуются с данными крупных исследований, посвященных реваскуляризации многососудистых поражений коронарного русла, в которых применение СЛП также связано со снижением частоты больших сердечно-сосудистых осложнений и повторных ЧКВ. Например, в исследовании ARTS II частота повторных реваскуляризаций составила 11,8% при использовании СЛП и 23,6% при использовании ГМС, а частота больших сердечно сосудистых событий 16,3% с СЛП и 30,9% с ГМС [24,36,37].
Путем статистического анализа, с применением регрессионной модели Кокса были выявлены клини-ческие и ангиографические относительные факторы риска наступления больших сердечно-сосудистых событий. Независимыми клиническими предикторами для обеих групп являлись: пожилой и старческий возраст (относительный риск=1,033; 95% ДИ: 0,984–1,08), сахарный диабет второго типа (относительный риск= 2,85; 95% ДИ: 1,13–7,17), инфаркт миокарда в анамнезе (относительный риск=1,54; 95% ДИ: 0,65–3,64) и ожирение второй и третей степени (относительный риск=1,045; 95% ДИ: 0,95–1,15). Данные факторы фигурируют в большей или меньшей степени в разных исследованиях, посвященных реваскуляризации, как предикторы основных сердечно-сосудистых осложнений [12,13,15,16,22,24,25,30–33]. Независимыми ангиографическими предикторами являлись для группы реваскуляризации нативного русла: наличие хронической окклюзии артерии, на которой выполняется ЧКВ (относительный риск=2,357; 95% ДИ: 0,71–7,845), а так же высокая степень стеноза артерии, на которой выполнялось ЧКВ (90%-99%), (относительный риск = 1,015; 95% ДИ: 0,91-1,12). Эти критерии совпадают с факторами риска в литературных источниках [19, 26,34,35]. Для группы 2 независимыми предикторами являлись морфология поражения шунта к ПНА типа С (относительный риск=1,27; 95% ДИ: 0,75–2,15) и морфология поражения шунта к ПКА типа С (относительный риск=1,027; 95% ДИ: 0,99–1,06). Эти 2 фактора в литературных источниках не встречаются, так как немногие исследователи пользуются для определения морфологии поражения шунтов данной классификацией, хотя косвенно они совпадают с факторами риска, наблюдаемыми в других исследованиях. Независимыми предикторами для двух групп явились: многососудистое поражение коронарного русла (относительный риск=5,32; 95% ДИ: 1,03–27,56) и малый диаметр установленных стентов (относительный риск = 1,042; 95% ДИ: 0,99–1,087). Эти факторы риска подтверждены многочисленными исследованиями и присутствуют практически во всех литературных источниках.
Выводы
1. Стентирование шунтов может рассматриваться в качестве эквивалентной тактики при лечении пациентов с возвратом стенокардии после КШ при соблюдении алгоритма, предложенного в данном исследовании.
2. Тактика реваскуляризации нативного русла является предпочтительной при равнозначных поражениях нативного русла и шунтов, однако при наличии более тяжелого поражения нативного русла следует применять тактику реваскуляризации шунтов.
3. Риски больших сердечно-сосудистых событий в отдаленном периоде при использовании предложенного алгоритма сопоставимы для тактик реваскуляризации шунтов и нативного русла. Однако частота рецидива стенокардии и реваскуляризации целевого поражения достоверно выше при выборе тактики реваскуляризации шунтов.
4. Факторами риска наступления больших сердечно-сосудистых событий в отдалeнном периоде в обеих группах являются: пожилой и старческий возраст, сахарный диабет второго типа, инфаркт миокарда
в анамнезе, ожирение второй и третьей степени,
многососудистое поражение коронарного русла, малый диаметр установленных стентов, а также наличие хронической окклюзии или высокая степень
стеноза.
5. При использовании СЛП наблюдалось снижение частоты больших сердечно-сосудистых событий и повторных реваскуляризаций в обеих группах, однако статистической достоверности эта разница достигла только при использовании тактики реваскуляризации нативного русла.
Список исп. литературыСкрыть список1. Goldman S., Zadina K., Moritz T., et al. Long-term patency of saphenous vein and left internal mammary artery grafts after coronary artery bypass surgery: results from a Department of Veterans Affairs Cooperative Study. J. Am. Coll. Cardiol. 2004; 44:2149 –56.
2. Бокерия Л.А., Алекян Б.Г. Руководство по рентгеноэндоваскулярной хирургии сердца и сосудов. Москва. Издательство НЦССХ им. А.Н. Бакулева РАМН. 2008. том 3; 592с.
Bokerija L.A., Alekjan B.G. Rukovodstvo po rentgenojendovaskuljarnoj hirurgii serdca i sosudov [Guideline for endovascular surgery of vesels and heart]. Moskva. Izdatel'stvo NCSSH im. A.N. Bakuleva RAMN. 2008. tom 3; 592s
[In Russ].
3. Brilakis E.S., de Lemos J.A., Cannon C.P., et al. Outcomes of patients with acute coronary syndrome and previous coronary artery bypass grafting (from the Pravastatin or Atorvastatin Evaluation and Infection Therapy [PROVE IT-TIMI 22] and the Aggrastat to Zocor [A to Z] trials). Am.J. Cardiol. 2008;102:552–8.
4. Brilakis E.S., Wang T.Y., Rao S.V., et al. Frequency and predictors of drug-eluting stent use in saphenous vein bypass graft percutaneous coronary interventions: a report from the American College of Cardiology National Cardiovascular Data CathPCI registry. JACC Cardiovasc Interv. 2010; 3:1068-73.
5. Brodie B.R., Wilson H., Stuckey T., et al. Outcomes with drug-eluting versus bare-metal stents in saphenous vein graft intervention results from the STENT (strategic transcatheter evaluation of new therapies) group. JACC Cardiovasc Interv. 2009; 2:1105–12.
6. Brilakis E.S1, Rao S.V., Banerjee S., et al. Percutaneous coronary intervention in native arteries versus bypass grafts in prior coronary artery bypass grafting patients: a report from the National Cardiovascular
Data Registry. JACC Cardiovasc Interv. 2011 Aug;4(8): 844–50.
7. Michael T.T., Karmpaliotis D., Brilakis E.S., et al. Impact of prior coronary artery bypass graft surgery on chronic total occlusion revascularisation: insights from a multicentre US registry. Heart. 2013; 99(20):15151518.
8. Brodie B.R., Versteeg D.S., Brodie M.M., et al. Poor long-term patient and graft survival after primary percutaneous coronary intervention for acute myocardial infarction due to saphenous vein graft occlusion. Catheter Cardiovasc. Interv. 2005; 65:504–9.
9. Babunashvili A. M. Ivanov V. A.: Hronicheskie okkljuzii koronarnyh arterij: anatomija, patofiziologija, jendovaskuljarnoe lechenie: Monografija. Moskva: Izdatel'stvo ACB. 2012; 487–509 [In Russ].
10. Jeroudi OM, Alomar ME, Michael TT, et al. Prevalence and management of coronary chronic total occlusions in a tertiary veterans affairs hospital. J. Am. Coll. Cardiol. 2013; 62(18_S1):B113–B113.
11. Rolf A., Werner G.S., Schuhback A., et al. Preprocedural coronary CT angiography significantly improves success rates of PCI for chronic total occlusion. Int. J. Cardiovasc Imaging. 2013; 29(8):18191827.
12. Hakeem A., Helmy T., Munsif S., et al. Safety and efficacy of drug eluting stents compared with bare metal stents for saphenous vein graft interventions: a comprehensive meta-analysis of randomized trials and observational studies comprising 7,994 patients. Catheter Cardiovasc. Interv. 2011; 77:343–55.
13. Lee M.S., Yang T., Kandzari D.E., et al. Comparison by metaanalysis of drug-eluting stents and bare metal stents for saphenous vein graft intervention. Am. J. Cardiol. 2010;105:1076-82.
14. Rodés-Cabau J., Bertrand O.F., Larose E., et al. Comparison of plaque sealing with paclitaxel-eluting stents versus medical therapy for the treatment of moderate non-significant saphenous vein graft lesions: the moderate vein graft lesion stenting with the taxus stent and intravascular ultrasound (VELETI) pilot trial. Circulation. 2009; 120(20): 1978–1986.
15. Testa L., Agostoni P., Vermeersch P., et al. Drug eluting stents versus bare metal stents in the treatment of saphenous vein graft disease: a systematic review and meta-analysis. EuroIntervention 2010;6:527–36.
16. Wiisanen M.E., bdel-Latif A., Mukherjee D., et al. Drug-eluting stents versus bare-metal stents in saphenous vein graft interventions: a systematic review and meta-analysis. JACC Cardiovasc. Interv. 2010; 3:1262–73.
17. Ijsselmuiden A.J.J., Ezechiels J.P., Westendorp I.C.D. et al. Complete versus culprit vessel percutaneous coronary intervention in multivessel disease: A randomized comparison. Am. Heart J. 2004; 148: 467–474.
18. Sarno G., Garg S., Onuma Y. et al. Impact of completeness of revascularization on the five-year outcome in percutaneous coronary intervention and coronary artery bypass graft patients (from the ARTS-II study). Am. J. Card. 2010; 106: 1369–1375.
19. Ijsselmuiden A.J.J., Ezechiels J.P., Westendorp I.C.D. et al. Complete versus culprit vessel percutaneous coronary intervention in multivessel disease: A randomized comparison. Am. Heart J. 2004; 148: 467–474.
20. Sarno G., Garg S., Onuma Y. et al. Impact of completeness of revascularization on the five-year outcome in percutaneous coronary intervention and coronary artery bypass graft patients (from the ARTS-II study). Am. J. Card. 2010; 106: 1369–1375.
21. Brilakis E.S., Lichtenwalter C., de Lemos J.A., et al. A randomized controlled trial of a paclitaxel-eluting stent versus a similar bare-metal stent in saphenous vein graft lesions the SOS (Stenting of Saphenous Vein Grafts) trial. J. Am. Coll. Cardiol. 2009; 53:919–28.
22. Brilakis E.S., Papayannis A.C., Abdel-Karim A.R., et al. TCT abstract 219: prospective evalation of the Xience V everolimus-eluting stent in saphenous vein graft atherosclerosis: the Xience V-SVG Angiographic Study. J. Am. Coll. Cardiol. 2011; 58:B59.
23. Harskamp R.E., Lopes R.D., Baisden C.E., de Winter R.J., Alexander JH. Saphenous vein graft failure after coronary artery bypass surgery: pathophysiology, management, and future directions. Ann. Surg. 2013;257(5): 824–833.
24. Kitabata H., Loh J.P., Pendyala L.K., et al. Two-year follow-up of outcomes of second-generation everolimus-eluting stents versus first-generation drug-eluting stents for stenosis of saphenous vein grafts used as aortocoronary conduits. Am. J. Cardiol. 2013; 112(1):61–67.
25. Mehilli J., Pache J., Abdel-Wahab M., et al. Drug-eluting versus bare-metal stents in saphenous vein graft lesions (ISAR-CABG): a randomised controlled superiority trial. Lancet. 2011; 378:1071–8.
26. Serruys P.W., Onuma Y., Garg S. et al. 5-year clinical outcomes of the ARTS II (Arterial Revascularization Therapies Study II) of the sirolimus-eluting stent in the treatment of patients with multivessel de novo coronary artery lesions. J. Am. Coll. Cardiol. 2010 Mar 16; 55(11):1093-101.
27. Shah S.J., Waters D.D., Barter P., et al. Intensive lipid-lowering with atorvastatin for secondaryprevention in patients after coronary artery bypass surgery. J. Am. Coll. Cardiol. 2008; 51:1938–43.
28. Zhou Q., Liao J.K.. Statins and cardiovascular diseases: from cholesterol lowering to pleiotropy. Curr. Pharm. Des 2009; 15:467–78.
29. Iakovou I., Schmidt T., Bonizzoni E. et al. Incidence, predictors and outcome of thrombosis after successful implantation of drug-eluting stents. JAMA. 2005; 293: 2126–2130.
30. Al-Lamee R., Ielasi A., Latib A., et al. Clinical and angiographic outcomes after percutaneous recanalization of chronic total saphenous vein graft occlusion using modern techniques. Am. J. Cardiol. 2010;106(12):1721–1727.
31. Hougaard M., Thayssen P., Kaltoft A., et al. Long-term outcome following percutaneous coronary intervention with drug-eluting stents compared with bare-metal stents in saphenous vein graft lesions: from Western Denmark heart registry. Catheter. Cardiovasc. Interv. 2014; 83(7):1035–1042.
32. Meliga E., García-García H.M., Kukreja N., et al. Chronic total occlusion treatment in post-CABG patients: saphenous vein graft versus native vessel recanalization — long-term follow-up in the drug-eluting stent era. Catheter Cardiovasc Interv. 2007; 70(1):21-25.
33. Ybarra L.F., Ribeiro H.B., Pozetti A.H., et al. Long-term follow-up of drug eluting versus bare metal stents in the treatment of saphenous vein graft lesions. Catheter Cardiovasc Interv. 2013;82(7):E856-E863.
34. Hannan E.L., Racz M., Holmes D.R. et al. Impact of completeness of percutaneous coronary intervention revascularization on long-term outcomes in the stent era. Circulation 2006; 113: 2406–2412.
35. Hannan E.L., Wu C., Walford G. et al. Incomplete revascularization in the era of drug-eluting stents: impact on adverse outcomes. J. Am. Coll. Cardiol. Intv. 2009; 2: 17–25.
36. Rodriguez A.E., Maree A.O., Grinfeld L. et al. Revascularization strategies of coronary multiple vessel disease in drug eluting stent era: one year follow-up results of ERACI III trial. Eurointervention. 2006; 2: 53–60.
37. Rodriguez A.E., Maree A.O., Mieres J. et al. Late loss of early benefit from drug-eluting stents when compared with bare-metal stents and coronary artery bypass surgery: 3 years follow-up of the ERACI III registry. Eur. Heart J. 2007; 28: 2118–2125.
38. Kukreja N., Serruys P.W., de Bruyne B. et al. Sirolimus-eluting stents, bare metal stents or coronary artery bypass grafting for patients with multivessel disease including involvement of the proximal left anterior descending artery: analysis of the Arterial Revascularization Therapies study part 2 (ARTS-II). Heart 2009; 95(13): 1061–1066.
39. Serruys P.W., Donohoe D.J., Wittebols K. et al. The clinical outcome of percutaneous treatment of bifurcation lesions in multivessel coronary artery disease with the sirolimus-eluting stent: insights from the Arterial Revascularization Therapies Study part II (ARTS II). Eur. Heart J. 2007; 28(4): 433–442.
40. Serruys P.W., Stoll H.P., Macours N. et al. Multivessel coronary revascularization in patients with and without diabetes mellitus 3-year follow-up of the ARTS-II (Arterial Revascularization Therapies Study-Part II) trial. J. Am. Coll. Cardiol. 2008; 52(24): 1957–1967.
41. Fajadet J., Wijns W., Laarman G.J. et al. Randomized, double-blind, multicenter study of the Endeavor zotarolimus-eluting phosphorylcholine-encapsulated stent for treatment of native coronary artery lesions: clinical and angiographic results of the ENDEAVOR II trial. Circulation. 2006; 114: 798–806.
42. Hodgson J.M.B., Stone G.W., Lincoff A.M. et al. Late stent trombosis: considerations and practical advice for the use of drug-eluting stents: a report from the Society for Cardiovascular Angiography and Interventions Drug-eluting Stent Task Force. Cathet. Cardiovasc. Interv. 2007; 69: 135–142.
43. Lasala J.M., Cox D.A., Morris D.L. et al. Two-year results of paclitaxel-eluting stent in patients with medically treated diabetes mellitus from the TAXUS ARRIVE program. Am. J. Card. 2009; 103(12): 1663–1671.
44. Lotan C., Meredith I.T., Mauri L. et al. Safety and effectiveness of the Endeavor zotarolimus-eluting stent in real-world clinical practice: 12-month data from the E-Five registry. J. Am. Coll. Cardiol. Intv. 2009; 2: 1227–1235.
45. Stone G.W., Ellis S.G., O’Shaughnessy C.D. et al. Paclitaxel-eluting stents vs. vascular brachytherapy for in stent restenosis within bare-metal stents. JAMA. 2006; 295: 1253–1263.
