Диагностическая и интервенционная радиология 2015
Диагностическая и интервенционная радиология 2015
№04 2015
Оценка безопасности и эффективности применения новых отечественных коронарных стентов «Мединж» №04 2015
Номера страниц в выпуске:49-56
Цель исследования – оценить безопасность и эффективность применения коронарных стентов «МедИнж» и сравнить их с результатами использования других коронарных стентов.
Материалы и методы: исследование включало 147 пациентов с ИБС, которым за период с января по март 2014 г. было выполнено стентирование коронарных артерий. Стенты «МедИнж» были установлены 61 пациенту (1 группа). Вторую (контрольную) группу составили 86 пациентов, которым были имплантированы стенты «Driver». Средний период наблюдения составил 6,2±0,5 мес. Конечными точками были: возврат или сохранение стенокардии не ниже 2 функционального класса (по CCS); смерть по кардиальной причине, инфаркт миокарда (ИМ), повторные вмешательства на целевом сосуде. рестеноз >50%, подтвержденный ангиографически и/или по данным оптической когерентной томографии (ОКТ).
Результаты: частота успеха стентирования составила 100%. Летальных исходов и ИМ в период наблюдения не отмечено. Рестеноз был выявлен у 9 (14,7%) пациентов группы «Мединж» и у 13 (15,1%) больных группы «Driver» (р=0,9). Средняя степень рестеноза по данным коронарографии составила 76,1± 8,4% и 76,2 ± 6,4% в первой и во второй группах соответственно (р=0,9). По результатам логистической регрессии применение стентов «Мединж» не являлось предиктором возникновения рестеноза (OR=1,998; 95% ДИ (0,158–312,551); р=0,314).
Выводы: использование стентов «Мединж» являлось безопасным и эффективным при реваскуляризации миокарда. Результаты применения стентов «МедИнж» не отличались от результатов использования стентов «Driver».
Ключевые слова:
• отечественный коронарный стент
• чрескожное коронарное вмешательство
Материалы и методы: исследование включало 147 пациентов с ИБС, которым за период с января по март 2014 г. было выполнено стентирование коронарных артерий. Стенты «МедИнж» были установлены 61 пациенту (1 группа). Вторую (контрольную) группу составили 86 пациентов, которым были имплантированы стенты «Driver». Средний период наблюдения составил 6,2±0,5 мес. Конечными точками были: возврат или сохранение стенокардии не ниже 2 функционального класса (по CCS); смерть по кардиальной причине, инфаркт миокарда (ИМ), повторные вмешательства на целевом сосуде. рестеноз >50%, подтвержденный ангиографически и/или по данным оптической когерентной томографии (ОКТ).
Результаты: частота успеха стентирования составила 100%. Летальных исходов и ИМ в период наблюдения не отмечено. Рестеноз был выявлен у 9 (14,7%) пациентов группы «Мединж» и у 13 (15,1%) больных группы «Driver» (р=0,9). Средняя степень рестеноза по данным коронарографии составила 76,1± 8,4% и 76,2 ± 6,4% в первой и во второй группах соответственно (р=0,9). По результатам логистической регрессии применение стентов «Мединж» не являлось предиктором возникновения рестеноза (OR=1,998; 95% ДИ (0,158–312,551); р=0,314).
Выводы: использование стентов «Мединж» являлось безопасным и эффективным при реваскуляризации миокарда. Результаты применения стентов «МедИнж» не отличались от результатов использования стентов «Driver».
Ключевые слова:
• отечественный коронарный стент
• чрескожное коронарное вмешательство
РЕЗЮМЕ:
Цель исследования – оценить безопасность и эффективность применения коронарных стентов «МедИнж» и сравнить их с результатами использования других коронарных стентов.
Материалы и методы: исследование включало 147 пациентов с ИБС, которым за период с января по март 2014 г. было выполнено стентирование коронарных артерий. Стенты «МедИнж» были установлены 61 пациенту (1 группа). Вторую (контрольную) группу составили 86 пациентов, которым были имплантированы стенты «Driver». Средний период наблюдения составил 6,2±0,5 мес. Конечными точками были: возврат или сохранение стенокардии не ниже 2 функционального класса (по CCS); смерть по кардиальной причине, инфаркт миокарда (ИМ), повторные вмешательства на целевом сосуде. рестеноз >50%, подтвержденный ангиографически и/или по данным оптической когерентной томографии (ОКТ).
Результаты: частота успеха стентирования составила 100%. Летальных исходов и ИМ в период наблюдения не отмечено. Рестеноз был выявлен у 9 (14,7%) пациентов группы «Мединж» и у 13 (15,1%) больных группы «Driver» (р=0,9). Средняя степень рестеноза по данным коронарографии составила 76,1± 8,4% и 76,2 ± 6,4% в первой и во второй группах соответственно (р=0,9). По результатам логистической регрессии применение стентов «Мединж» не являлось предиктором возникновения рестеноза (OR=1,998; 95% ДИ (0,158–312,551); р=0,314).
Выводы: использование стентов «Мединж» являлось безопасным и эффективным при реваскуляризации миокарда. Результаты применения стентов «МедИнж» не отличались от результатов использования стентов «Driver».
Ключевые слова:
• отечественный коронарный стент
• чрескожное коронарное вмешательство
Bazylev V.V. – MD, PhD
Shmatkov M.G. – MD
Pyanzin A. I. – MD
*Morozov Z.A. – MD
Federation National Center of Cardiovascular Surgery
6, Stasova str, Penza, Russian Federation, 440071
ABSTRACT:
Aim: was to evaluate the safety and efficacy of coronary stents «MedEng» and to compare them with results of the use of other coronary stents.
Materials and methods: the study included 147 patients with coronary artery disease, which in the period from January to March 2014 underwent coronary stenting. Stents «MedEng» were implanted in 61 patients (group 1). The second group (control) consisted of 86 patients who underwent implantation of stents «Driver». Average follow-up was 6,2±0,5 months. Endpoints were: the return or retention of not less than 2 angina functional class (on CCS); death by cardiac causes, myocardial infarction (MI), repeated intervention on the target vessel, restenosis> 50%, confirmed by angiography and/or the data of optical coherence tomography (OCT).
Results: success rate of stenting was 100%. Death and MI during follow-up were not observed. Restenosis was observed in 9(14,7%) patients in group «MedEng» and in 13 (15,1%) patients from «Driver» group (p = 0,9). The average degree of coronary restenosis was 76,1±8,4% and 76,2±6,4% in the first and second groups, respectively (p=0.9). According to results of logistic regression, stents «MedEng» was not a predictor of restenosis (OR=1,998; 95% CI (0,158–312,551); p = 0,314).
Conclusions: the use of stents «MedEng» is safe and effective in myocardial revascularization. Results of implantation of stents «MedEng» do not different from results of the use of stents «Driver».
КEY-WORDS:
• domestic coronary stent
• percutaneous coronary intervention.
Появление коронарных стентов улучшило непосредственные результаты чрескожных коронарных вмешательств (ЧКВ) и устранило основные патологические механизмы, ограничивающие эффективность баллонной ангиопластики: эластическое спадение и диссекцию. Усовершенствование дизайна голометалли-ческих коронарных стентов (ГМС) позволило снизить частоту рестеноза с 30% до 24% на начальном этапе и до 15% в настоящее время [1,2].
Более радикально проблема рестеноза была решена с появлением стентов с лекарственным покрытием (СЛП). Однако, в настоящее время, основными факторами предпочтения в пользу ГМС считаются: более низкая стоимость, по сравнению с СЛП; инфаркт миокарда с подъемом ST; артерии большого диаметра; относительные противопоказания к двойной антиагрегантной терапии (ДАГТ) [3, 4].
Учитывая актуальность применения ГМС в настоящее время, считаем целесообразным оценить результаты применения нового отечественного коронарного стента «МедИнж» и сравнить их с результатами использования стента другого производителя в условиях повседневной клинической практики ФГБУ «ФЦССХ» Минздрава России (г. Пенза).
Цель: оценить безопасность и эффективность применения коронарных стентов «МедИнж» и сравнить их с результатами использования других коронарных стентов.
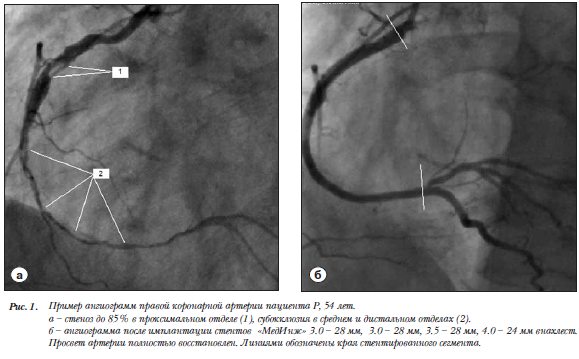 Все пациенты были ознакомились с целями и основными положениями исследования и дали письменное согласие на участие в нем. Исследование было одобрено этическим комитетом и выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинской Декларации.
Все пациенты были ознакомились с целями и основными положениями исследования и дали письменное согласие на участие в нем. Исследование было одобрено этическим комитетом и выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинской Декларации.
Исследование включало 147 пациентов с ИБС, которым за период с января по март 2014 г. было выполнено стентирование коронарных артерий с имплантацией голометаллических стентов «Мединж» и «Driver». Оба стента выполнены из кобальт-хромового сплава и относятся к третьему поколению ГМС. В основе дизайна ячейки стента Driver лежит элипсоид с балками толщиной 91 мкм. Стент МедИнж имеет схожее строение, однако ячейки имеют попеременную структуру, а толщина балки составляет 60 мкм [5].
В первую группу включили 61 пациента, которым были установлены стенты «МедИнж» (рис.1). Вторую (контрольную) группу составили 86 пациентов, которым были имплантированы стенты «Driver». Время наблюдения составило 6 месяцев (в среднем 6,2±0,5 месяца). Конечными клиническими точками были: возврат или сохранение стенокардии не ниже 2 функционального класса (по CCS); смерть по кардиальной причине, инфаркт миокарда (ИМ), повторные вмешательства на целевом сосуде. Конечной ангиографической точкой (на протяжении, в среднем, 6,2 месяцев) стал рестеноз >50%, подтвержденный данными цифровой ангиометрии и/или оптической когерентной томографии (ОКТ). На момент контроля были доступны сведения о клиническом состоянии всех пациентов.
Техника проведения вмешательства
Все пациенты в соответствии с рекомендациями получали двойную антиагрегантную терапию. Непосредственно после пункции общей бедренной артерии и установки интродьюсера внутривенно болюсно вводился нефракционированный гепарин в расчете 100 МЕ/кг. После катетеризации целевого сосуда через проводниковый катетер вводилось 200 мкг изокета для профилактики спазма и адекватной оценки диаметра сосуда. На исходной ангиографии оценивались рентгеноморфологические характеристики поражения при помощи штатных прикладных программ «Siemens artis axiom» и ангиометрией с оценкой базового диаметра сосуда, величины минимального просвета в месте наибольшего сужения. При выполнении оптической когерентной томографии в артерию устанавливался проводник 0,14”, по которому под контролем рентге-носкопии заводился датчик. Внутрисосудистое сканирование выполнялось от дистальных к проксимальным отделам при одновременном тугом контрастировании коронарных артерий в одну или несколько серий
(в зависимости от длины целевого участка). При выполнении ОКТ оценивали: контакт ячеек стента со стенкой сосуда (мальпозиция), эндотелизацию, степень стенозирования (по площади), толщину слоя неоинтимы.
Статистическая обработка данных
Oбработка данных проводилась с помощью системного пакета программ SPSS версии 21 (SPSS, Chicago, IL, USA). При правильном распределении, результаты были представлены как арифметическое среднее ±SD. Для анализа применялся дисперсионный анализ (ANOVA). Если распределение отличалось от нормального, то значения представлялись медианой (Me) и интерквартильным размахом в виде 25-го и 75-го процентилей (Q25%; Q75%). Для анализа использовали критерий Вилкоксона (W). Для сравнения двух групп по качественному признаку использовали c2«хи-квадрат» Пирсона. Результаты представлены в виде м±SD, где
м – среднее значение, SD – стандартное отклонение. Результаты логистической регрессии оценивались для основных ангиографических предикторов рестеноза: хронической окклюзии, стенозов типов «В2» и «С», протяженности стентированного сегмента, степени исходного стенозирования. Для оценки влияния применения исследуемых стентов на частоту возникновения рестеноза использование стентов «МедИнж» как независимая категориальная переменная была включена в логистический регрессионный анализ. При использовании любых статистических методов и средств анализа статистически значимыми принимались различия при значениях р<0,05.
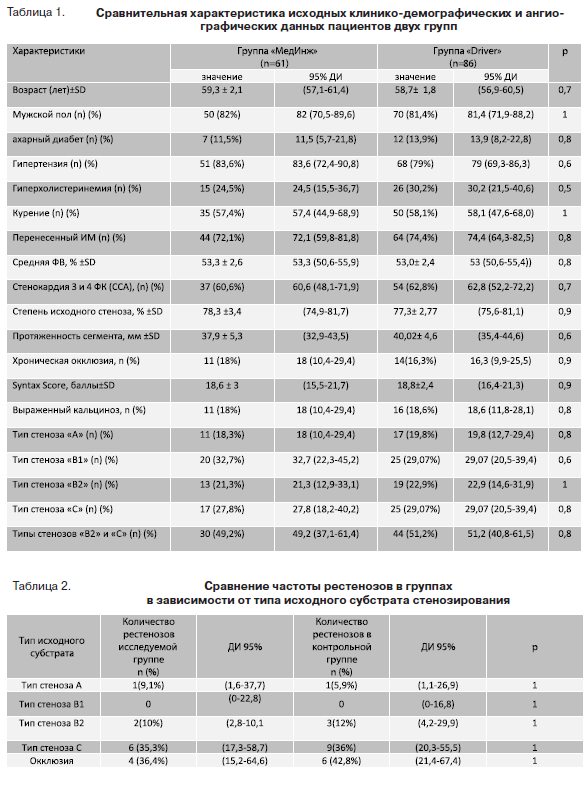
Частота успеха стентирования в обеих группах сос-тавила 100%. В ходе вмешательства не было отме-чено отделения стентов от доставочной системы, а также разрыва баллона при достижении максималь-ных значений давления, указанных изготовителем. Исходно стенокардия 3 и 4 функциональных классов (ФК) выявлена у 37 (60,6%) и у 54 (62,8%) пациентов 1 и 2 групп соответственно (p=0,7). Через 6 месяцев после вмешательства только 6(11,7%) пациентов первой и 9(10,5%) пациентов контрольной групп страдали 3 и 4 ФК стенокардии (р<0,001 в обоих случаях). На протяжении последующих 6 месяцев (6,2±0,5 мес.) клинического наблюдения не было зафиксировано неблагоприятных кардиальных событий, а также летальных исходов в двух группах. У 39 (64%) пациентов первой и у 57 (66,3%) пациентов второй групп в течение срока наблюдения либо отсутствовала клиника стенокардии, либо была на уровне 1 ФК (р=0,89). Остальным 22(36%) пациентам первой и 32(37,2%) контрольной групп с клиникой стенокардии 2–4 ФК была выполнена коронарная ангиография (КАГ) (р=0,9). Из них в 10(16%) и 16(18,6%) случаях в первой и второй группах соответственно проведена оптическая когерентная томография (ОКТ) целевого сосуда. Рестеноз был выявлен у 9 (14,7%) пациентов группы «Мединж» и у 13(15,1%) больных группы «Driver» (р=0,9). Повторная реваскуляризация при исходных стенозах (исключая окклюзии) понадобилась 5 (10%) пациентам исследуемой и 7(9,7%) больным контрольной групп (р=0,07). В соответствии с ангиографической классификацией поражения коронарных артерий американской ассоциации кардиологов стенозы делятся на простые (типы А и В1) и сложные (типы В2 и С) [3].
В первой группе сложные стенозы типа «В2» и «С» выявлены в 21,3% и 27,8% соответственно, суммарно составив 49,2% (N=30). Внутри этой когорты повторная реваскуляризация потребовалась в 20% случаев против 9% у пациентов с простыми стенозами (А и В1) (р=0,4).
Во второй группе стенозы типов «В2» и «С» выявлены в 22% и 25,6% соответственно, всего составив 51,2% (N=44). Внутри данной когорты повторная реваскуляризация потребовалась в 20,4% случаев против 9,5% у пациентов с простыми стенозами (А и В1) (р=0,2).
Таким образом, статистически значимой разницы между частотой возникновения рестенозов у пациентов двух групп со сложными стенозами не достигнуто (р=1).
По результатам унивариантного анализа среди пациентов исследуемой группы с исходными стенозами типа «С» (27,8%) впоследствии чаще выявлялся рестеноз внутри стента (35,3%), чем у пациентов с исходными стенозами типов «А», «В1» и «В2» (6,8%) (р=0,02) (табл. 2).
Эта же зависимость прослеживается и в контрольной группе, где рестеноз при исходном поражении типа «С» достигал 36% против 6,5% со стенозами типов «А», «В1» и «В2»(р=0,001). Статистически значимой разницы между частотой возникновения рестенозов у пациентов двух групп со стенозами типа «С» не достигнуто (р=1).
Частота возникновения рестеноза в первой и второй группах при исходном окклюзирующем поражении составила 4(36,4%) и 6(42,8%) (р=1).
С другой стороны, по результатам анализа когорт с подтвержденными рестенозами относительно исходных субстратов стенозирования в двух группах выявлено схожие соотношения. Основная часть была представлена стенозами типа «С», 66,7% и 69,2% в первой и второй группах соответственно (р=1). Доля исходного окклюзирующего субстрата в исследуемой и контрольной группах составила 44,4% и 46,2% соответственно (р=1).
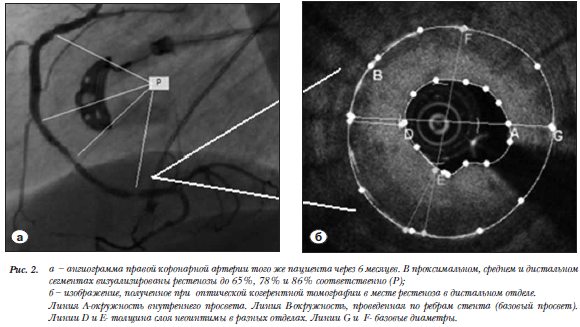 Ангиометрические показатели у пациентов двух групп с рестенозами, полученые по данным КАГ и ОКТ статистически значимо не отличались (табл. 3, рис. 2). По данным внутрисосудистого исследования не было отмечено мальпозиции стентов, 98,7% ячеек стентов «Мединж» и 97,7% ячеек стентов «Driver» были эндо-телизированы (за исключением зон устьев боковых ветвей).
Ангиометрические показатели у пациентов двух групп с рестенозами, полученые по данным КАГ и ОКТ статистически значимо не отличались (табл. 3, рис. 2). По данным внутрисосудистого исследования не было отмечено мальпозиции стентов, 98,7% ячеек стентов «Мединж» и 97,7% ячеек стентов «Driver» были эндо-телизированы (за исключением зон устьев боковых ветвей).
В исследуемой группе потеря просвета по данным КАГ и ОКТ составила 1,538±0,489 мм и 1,551±0,473 мм
соответственно (р=0,9). В контрольной группе потеря просвета по данным КАГ и ОКТ составила 1,521±
0,416 мм 1,456±0,43 мм соответственно (р=0,9). Таким образом, статистически значимой разницы по потере просвета между группами не выявлено (р=0,9).
Средняя степень рестеноза по данным цифровой ангиометрии составила 76,1± 8,4% и 76,2 ± 6,4% в первой и во второй группах соответственно (р=0,9).
По результатам логистической регрессии, вероятность возникновения рестеноза через 6 месяцев после стентирования зависела только от степени исходного стеноза (OR=1,526; 95% ДИ (1,068–2,179); р=0,02) (табл. 4).
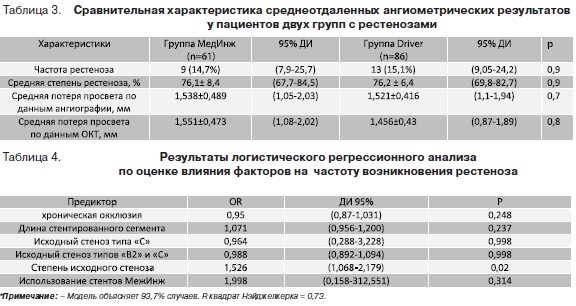
Для повышения статистической мощности, учитывая относительно небольшое количество наблюдений, в анализ были включены основные предикторы рестеноза: хроническая окклюзия, стенозы типа «В2» и «С», протяженность, диаметр, степень исходного стенозирования. Для оценки влияния применения исследуемых стентов на частоту возникновения рестеноза использование стентов «МедИнж» как независимая категориальная переменная была включена в логистический регрессионный анализ. Однако, по результатам логистической регрессии применение стентов «Мединж» не являлось предиктором возникновения рестеноза (OR=1,998; 95% ДИ (0,158–312,551); р=0,314). Модель объясняет 93,7% случаев. R квадрат Нэйджелкерка=0,73.
Среди основных причин предпочтения ГМС (по данным 31 регистра Европы и Азии) по степени значимости выделяют: большой диаметр сосуда (32,4%), ИМ с подъемом ST (17,7%), преклонный возраст (13,4%), сопутствующая антикоагулянтная терапия (11,3%), высокий риск кровотечения (9,5%), стоимость (9,4%), планируемое некардиальное вмешательство (5,5%), низкая вероятность соблюдения двойной антиагрегантной терапии (1,7%) [11].
Результаты исследований свидетельствуют об отсутствии преимуществ СЛП при ЧКВ в коронарных артериях диаметром 3,5 мм и более. В этом случае ГМС и СЛП имели аналогичные показатели не только по частоте возникновения НКС, но и по частоте возникновения рестеноза (4,8% для СЛП и 5,7% для ГМС, р= 0,8) [12,13].
В нашей серии стенты диаметром 3,5 мм и более были имплантированы в 22(36%) случаях исследуемой и 32 (37%) контрольной групп. В течение срока наблюдения реваскуляризация целевого сосуда потребовалась лишь 2(9,1%) пациентам первой и 3 (9,3%) пациентам второй групп (р=1), несмотря на весомую долю сложных стенозов (типов «В2» и «С») в группах.
При продвижении на рынок новых коронарных стентов из пилотных исследований, как правило, исключаются пациенты с морфологически сложными субстратами поражения. Ангиографическими критериями исклю-чения обычно являются: окклюзии давностью более 3 месяцев, стенозы протяженностью более 20 мм, кальциноз, то есть поражения с признаками стеноза типа «С» [3,5,14].
При условии исключения пациентов со стенозами типа «С», частота рестеноза в нашей исследуемой группе составила бы 6,8% (р=0,02) против 6,5 % в контрольной (р=0,9). Однако, в связи с весомой долей (27,8%) поражения типа «С», в нашем исследовании частота рестеноза достигла 14,7% и 15,1% в первой и второй группах соответственно.
Наилучшие показатели для ГМС представлены в коммерческом регистре «Coroflex Blue Registry», включившем результаты стентирования 2315 пациентов с использованием ГМС третьего поколения «Coroflex Blue». Показатель клинически детерминированной реваскуляризации целевого стеноза составил всего лишь 5,5%. Данный факт был скептически воспринят в научной среде, так как показатель соизмерим с результатами использования СЛП [14,15]. Однако, несмотря на заявленные в исследовании реальную популяцию пациентов и достаточно большую подгруппу больных со сложным поражением типов «В2» и «С» (60,3%), из серии были исключены пациенты с протяженными стенозами более 25 мм, требующие имплантации более одного стента. Установка стента в место окклюзии выполнена только в 3,5%.
В нашем исследовании доля реканализаций составила 18% и 16,3% в исследуемой и контрольной группах соответственно (р=0,9), а частота рестеноза при исходном окклюзирующем поражении составила
4(36,4%) и 6 (42,8%) соответственно (р=1).
Показатель реваскуляризации целевого сосуда на протяжении 9 месяцев для «Driver», опубликованный Sketch M. И соавторами, составил 8,8%. Однако, несмотря на весомую долю (50,7%) стенозов типа «В2» и «С» в данном регистре, средняя протяженность поражения составила всего 11,04 мм [5].
В исследовании «Class» частота возникновения рестеноза для стентов Driver на протяжении 6 месяцев составила 12,6% [9]. Однако, средняя протяженность исходного стеноза составила всего 11,4 мм (не превышая 13 мм). В нашем исследовании этот показатель был на уровне 37,9±5,3 мм и 40,02±4,6 мм в первой и второй группах соответственно (табл. 1), что также могло объяснить более высокий процент рестенозов в обеих группах (14,7% и 15,1%).
В нашем исследовании по результатам логистической регрессии (табл.4), вероятность возникновения рестеноза через 6 месяцев после стентирования зависела только от степени исходного стеноза (OR=1,526; 95% ДИ (1,068–2,179); р=0,02). Применение стентов «Мединж» не являлось предиктором возникновения рестеноза (OR=1,998; 95% ДИ (0,158–312,551); р=0,314).
По данным Cassese S. и соавторов другими независимыми предикторами возникновения рестеноза в течение 6–8 месяцев являлись: малый диаметр сосуда, протяженность стентированного сегмента, сложный характер субстрата, наличие сахарного диабета, аортокоронарное шунтирование в анамнезе [15,16].
Отсутствие статистически значимой зависимости рестеноза от перечисленных предикторов, в нашем исследовании, может быть обусловлено недостаточной статистической мощностью для анализа категориальных переменных, в связи с относительно небольшими группами. Однако, по данным разных авторов, имплантация нескольких стентов почти в два раза увеличивает риск развития рестеноза [15].
В качестве дополнительного метода визуализации в нашем исследовании использована ОКТ. Ангиометрические показатели в обеих группах по данным цифровой ангиографии и ОКТ статистически значимо не отличались (табл.2). По данным внутрисосудистого исследования не отмечено мальпозиций, выявлена полная эндотелизация стентов (за исключением ячеек в зонах устьев боковых ветвей). Потеря просвета
по данным КАГ и ОКТ в 1 и 2 группах составила 1,538±0,489 мм 1,551±0,473 мм против 1,521±0,416 мм и 1,456±0,43 мм соответственно (р=0,7; р=0,8). Данный показатель несколько выше показателей других ГМС, для которых значения варьируют от 0,6 мм до 1,1 мм [2]. Причина состоит в том, что в нашей серии в 40% случаев ОКТ выполнялась пациентам с рестенозами, подтвержденными ангиографически.
Предиктором возникновения рестеноза являлась только исходная степень стенозирования (OR=1,526; 95% ДИ (1,068–2,179); р=0,02). Применение стентов «Мединж» не являлось предиктором возникновения рестеноза (OR=1,998; 95% ДИ (0,158–312,551); р=0,314).
Уровень рестеноза при использовании стентов «МедИнж» даже при сложном исходном субстрате поражения, включая окклюзии, протяженные и кальцинированные стенозы, являлся приемлемым и не отличался от показателей другого производителя.
Учитывая данные, полученные в ходе нашего исследования, мы считаем, что стент «МежИнж» может безопасно и эффективно применяться в повседневной практике. Кроме того, данный стент может стать хорошей платформой для нанесения покрытия.
Конфликт интересов. Конфликт интересов не заявляется.
Цель исследования – оценить безопасность и эффективность применения коронарных стентов «МедИнж» и сравнить их с результатами использования других коронарных стентов.
Материалы и методы: исследование включало 147 пациентов с ИБС, которым за период с января по март 2014 г. было выполнено стентирование коронарных артерий. Стенты «МедИнж» были установлены 61 пациенту (1 группа). Вторую (контрольную) группу составили 86 пациентов, которым были имплантированы стенты «Driver». Средний период наблюдения составил 6,2±0,5 мес. Конечными точками были: возврат или сохранение стенокардии не ниже 2 функционального класса (по CCS); смерть по кардиальной причине, инфаркт миокарда (ИМ), повторные вмешательства на целевом сосуде. рестеноз >50%, подтвержденный ангиографически и/или по данным оптической когерентной томографии (ОКТ).
Результаты: частота успеха стентирования составила 100%. Летальных исходов и ИМ в период наблюдения не отмечено. Рестеноз был выявлен у 9 (14,7%) пациентов группы «Мединж» и у 13 (15,1%) больных группы «Driver» (р=0,9). Средняя степень рестеноза по данным коронарографии составила 76,1± 8,4% и 76,2 ± 6,4% в первой и во второй группах соответственно (р=0,9). По результатам логистической регрессии применение стентов «Мединж» не являлось предиктором возникновения рестеноза (OR=1,998; 95% ДИ (0,158–312,551); р=0,314).
Выводы: использование стентов «Мединж» являлось безопасным и эффективным при реваскуляризации миокарда. Результаты применения стентов «МедИнж» не отличались от результатов использования стентов «Driver».
Ключевые слова:
• отечественный коронарный стент
• чрескожное коронарное вмешательство
Evaluation of safety and efficacy of new domestic coronary stents «Medeng»
Bazylev V.V. – MD, PhD
Shmatkov M.G. – MD
Pyanzin A. I. – MD
*Morozov Z.A. – MD
Federation National Center of Cardiovascular Surgery
6, Stasova str, Penza, Russian Federation, 440071
ABSTRACT:
Aim: was to evaluate the safety and efficacy of coronary stents «MedEng» and to compare them with results of the use of other coronary stents.
Materials and methods: the study included 147 patients with coronary artery disease, which in the period from January to March 2014 underwent coronary stenting. Stents «MedEng» were implanted in 61 patients (group 1). The second group (control) consisted of 86 patients who underwent implantation of stents «Driver». Average follow-up was 6,2±0,5 months. Endpoints were: the return or retention of not less than 2 angina functional class (on CCS); death by cardiac causes, myocardial infarction (MI), repeated intervention on the target vessel, restenosis> 50%, confirmed by angiography and/or the data of optical coherence tomography (OCT).
Results: success rate of stenting was 100%. Death and MI during follow-up were not observed. Restenosis was observed in 9(14,7%) patients in group «MedEng» and in 13 (15,1%) patients from «Driver» group (p = 0,9). The average degree of coronary restenosis was 76,1±8,4% and 76,2±6,4% in the first and second groups, respectively (p=0.9). According to results of logistic regression, stents «MedEng» was not a predictor of restenosis (OR=1,998; 95% CI (0,158–312,551); p = 0,314).
Conclusions: the use of stents «MedEng» is safe and effective in myocardial revascularization. Results of implantation of stents «MedEng» do not different from results of the use of stents «Driver».
КEY-WORDS:
• domestic coronary stent
• percutaneous coronary intervention.
Введение
Появление коронарных стентов улучшило непосредственные результаты чрескожных коронарных вмешательств (ЧКВ) и устранило основные патологические механизмы, ограничивающие эффективность баллонной ангиопластики: эластическое спадение и диссекцию. Усовершенствование дизайна голометалли-ческих коронарных стентов (ГМС) позволило снизить частоту рестеноза с 30% до 24% на начальном этапе и до 15% в настоящее время [1,2].
Более радикально проблема рестеноза была решена с появлением стентов с лекарственным покрытием (СЛП). Однако, в настоящее время, основными факторами предпочтения в пользу ГМС считаются: более низкая стоимость, по сравнению с СЛП; инфаркт миокарда с подъемом ST; артерии большого диаметра; относительные противопоказания к двойной антиагрегантной терапии (ДАГТ) [3, 4].
Учитывая актуальность применения ГМС в настоящее время, считаем целесообразным оценить результаты применения нового отечественного коронарного стента «МедИнж» и сравнить их с результатами использования стента другого производителя в условиях повседневной клинической практики ФГБУ «ФЦССХ» Минздрава России (г. Пенза).
Цель: оценить безопасность и эффективность применения коронарных стентов «МедИнж» и сравнить их с результатами использования других коронарных стентов.
Материалы и методы
 Все пациенты были ознакомились с целями и основными положениями исследования и дали письменное согласие на участие в нем. Исследование было одобрено этическим комитетом и выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинской Декларации.
Все пациенты были ознакомились с целями и основными положениями исследования и дали письменное согласие на участие в нем. Исследование было одобрено этическим комитетом и выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинской Декларации.Исследование включало 147 пациентов с ИБС, которым за период с января по март 2014 г. было выполнено стентирование коронарных артерий с имплантацией голометаллических стентов «Мединж» и «Driver». Оба стента выполнены из кобальт-хромового сплава и относятся к третьему поколению ГМС. В основе дизайна ячейки стента Driver лежит элипсоид с балками толщиной 91 мкм. Стент МедИнж имеет схожее строение, однако ячейки имеют попеременную структуру, а толщина балки составляет 60 мкм [5].
В первую группу включили 61 пациента, которым были установлены стенты «МедИнж» (рис.1). Вторую (контрольную) группу составили 86 пациентов, которым были имплантированы стенты «Driver». Время наблюдения составило 6 месяцев (в среднем 6,2±0,5 месяца). Конечными клиническими точками были: возврат или сохранение стенокардии не ниже 2 функционального класса (по CCS); смерть по кардиальной причине, инфаркт миокарда (ИМ), повторные вмешательства на целевом сосуде. Конечной ангиографической точкой (на протяжении, в среднем, 6,2 месяцев) стал рестеноз >50%, подтвержденный данными цифровой ангиометрии и/или оптической когерентной томографии (ОКТ). На момент контроля были доступны сведения о клиническом состоянии всех пациентов.
Техника проведения вмешательства
Все пациенты в соответствии с рекомендациями получали двойную антиагрегантную терапию. Непосредственно после пункции общей бедренной артерии и установки интродьюсера внутривенно болюсно вводился нефракционированный гепарин в расчете 100 МЕ/кг. После катетеризации целевого сосуда через проводниковый катетер вводилось 200 мкг изокета для профилактики спазма и адекватной оценки диаметра сосуда. На исходной ангиографии оценивались рентгеноморфологические характеристики поражения при помощи штатных прикладных программ «Siemens artis axiom» и ангиометрией с оценкой базового диаметра сосуда, величины минимального просвета в месте наибольшего сужения. При выполнении оптической когерентной томографии в артерию устанавливался проводник 0,14”, по которому под контролем рентге-носкопии заводился датчик. Внутрисосудистое сканирование выполнялось от дистальных к проксимальным отделам при одновременном тугом контрастировании коронарных артерий в одну или несколько серий
(в зависимости от длины целевого участка). При выполнении ОКТ оценивали: контакт ячеек стента со стенкой сосуда (мальпозиция), эндотелизацию, степень стенозирования (по площади), толщину слоя неоинтимы.
Статистическая обработка данных
Oбработка данных проводилась с помощью системного пакета программ SPSS версии 21 (SPSS, Chicago, IL, USA). При правильном распределении, результаты были представлены как арифметическое среднее ±SD. Для анализа применялся дисперсионный анализ (ANOVA). Если распределение отличалось от нормального, то значения представлялись медианой (Me) и интерквартильным размахом в виде 25-го и 75-го процентилей (Q25%; Q75%). Для анализа использовали критерий Вилкоксона (W). Для сравнения двух групп по качественному признаку использовали c2«хи-квадрат» Пирсона. Результаты представлены в виде м±SD, где
м – среднее значение, SD – стандартное отклонение. Результаты логистической регрессии оценивались для основных ангиографических предикторов рестеноза: хронической окклюзии, стенозов типов «В2» и «С», протяженности стентированного сегмента, степени исходного стенозирования. Для оценки влияния применения исследуемых стентов на частоту возникновения рестеноза использование стентов «МедИнж» как независимая категориальная переменная была включена в логистический регрессионный анализ. При использовании любых статистических методов и средств анализа статистически значимыми принимались различия при значениях р<0,05.
Результаты
Пациенты двух групп не отличались по основным клинико-демографическим и ангиографическим характеристикам (табл. 1).
Частота успеха стентирования в обеих группах сос-тавила 100%. В ходе вмешательства не было отме-чено отделения стентов от доставочной системы, а также разрыва баллона при достижении максималь-ных значений давления, указанных изготовителем. Исходно стенокардия 3 и 4 функциональных классов (ФК) выявлена у 37 (60,6%) и у 54 (62,8%) пациентов 1 и 2 групп соответственно (p=0,7). Через 6 месяцев после вмешательства только 6(11,7%) пациентов первой и 9(10,5%) пациентов контрольной групп страдали 3 и 4 ФК стенокардии (р<0,001 в обоих случаях). На протяжении последующих 6 месяцев (6,2±0,5 мес.) клинического наблюдения не было зафиксировано неблагоприятных кардиальных событий, а также летальных исходов в двух группах. У 39 (64%) пациентов первой и у 57 (66,3%) пациентов второй групп в течение срока наблюдения либо отсутствовала клиника стенокардии, либо была на уровне 1 ФК (р=0,89). Остальным 22(36%) пациентам первой и 32(37,2%) контрольной групп с клиникой стенокардии 2–4 ФК была выполнена коронарная ангиография (КАГ) (р=0,9). Из них в 10(16%) и 16(18,6%) случаях в первой и второй группах соответственно проведена оптическая когерентная томография (ОКТ) целевого сосуда. Рестеноз был выявлен у 9 (14,7%) пациентов группы «Мединж» и у 13(15,1%) больных группы «Driver» (р=0,9). Повторная реваскуляризация при исходных стенозах (исключая окклюзии) понадобилась 5 (10%) пациентам исследуемой и 7(9,7%) больным контрольной групп (р=0,07). В соответствии с ангиографической классификацией поражения коронарных артерий американской ассоциации кардиологов стенозы делятся на простые (типы А и В1) и сложные (типы В2 и С) [3].
В первой группе сложные стенозы типа «В2» и «С» выявлены в 21,3% и 27,8% соответственно, суммарно составив 49,2% (N=30). Внутри этой когорты повторная реваскуляризация потребовалась в 20% случаев против 9% у пациентов с простыми стенозами (А и В1) (р=0,4).
Во второй группе стенозы типов «В2» и «С» выявлены в 22% и 25,6% соответственно, всего составив 51,2% (N=44). Внутри данной когорты повторная реваскуляризация потребовалась в 20,4% случаев против 9,5% у пациентов с простыми стенозами (А и В1) (р=0,2).
Таким образом, статистически значимой разницы между частотой возникновения рестенозов у пациентов двух групп со сложными стенозами не достигнуто (р=1).
По результатам унивариантного анализа среди пациентов исследуемой группы с исходными стенозами типа «С» (27,8%) впоследствии чаще выявлялся рестеноз внутри стента (35,3%), чем у пациентов с исходными стенозами типов «А», «В1» и «В2» (6,8%) (р=0,02) (табл. 2).
Эта же зависимость прослеживается и в контрольной группе, где рестеноз при исходном поражении типа «С» достигал 36% против 6,5% со стенозами типов «А», «В1» и «В2»(р=0,001). Статистически значимой разницы между частотой возникновения рестенозов у пациентов двух групп со стенозами типа «С» не достигнуто (р=1).
Частота возникновения рестеноза в первой и второй группах при исходном окклюзирующем поражении составила 4(36,4%) и 6(42,8%) (р=1).
С другой стороны, по результатам анализа когорт с подтвержденными рестенозами относительно исходных субстратов стенозирования в двух группах выявлено схожие соотношения. Основная часть была представлена стенозами типа «С», 66,7% и 69,2% в первой и второй группах соответственно (р=1). Доля исходного окклюзирующего субстрата в исследуемой и контрольной группах составила 44,4% и 46,2% соответственно (р=1).
 Ангиометрические показатели у пациентов двух групп с рестенозами, полученые по данным КАГ и ОКТ статистически значимо не отличались (табл. 3, рис. 2). По данным внутрисосудистого исследования не было отмечено мальпозиции стентов, 98,7% ячеек стентов «Мединж» и 97,7% ячеек стентов «Driver» были эндо-телизированы (за исключением зон устьев боковых ветвей).
Ангиометрические показатели у пациентов двух групп с рестенозами, полученые по данным КАГ и ОКТ статистически значимо не отличались (табл. 3, рис. 2). По данным внутрисосудистого исследования не было отмечено мальпозиции стентов, 98,7% ячеек стентов «Мединж» и 97,7% ячеек стентов «Driver» были эндо-телизированы (за исключением зон устьев боковых ветвей). В исследуемой группе потеря просвета по данным КАГ и ОКТ составила 1,538±0,489 мм и 1,551±0,473 мм
соответственно (р=0,9). В контрольной группе потеря просвета по данным КАГ и ОКТ составила 1,521±
0,416 мм 1,456±0,43 мм соответственно (р=0,9). Таким образом, статистически значимой разницы по потере просвета между группами не выявлено (р=0,9).
Средняя степень рестеноза по данным цифровой ангиометрии составила 76,1± 8,4% и 76,2 ± 6,4% в первой и во второй группах соответственно (р=0,9).
По результатам логистической регрессии, вероятность возникновения рестеноза через 6 месяцев после стентирования зависела только от степени исходного стеноза (OR=1,526; 95% ДИ (1,068–2,179); р=0,02) (табл. 4).

Для повышения статистической мощности, учитывая относительно небольшое количество наблюдений, в анализ были включены основные предикторы рестеноза: хроническая окклюзия, стенозы типа «В2» и «С», протяженность, диаметр, степень исходного стенозирования. Для оценки влияния применения исследуемых стентов на частоту возникновения рестеноза использование стентов «МедИнж» как независимая категориальная переменная была включена в логистический регрессионный анализ. Однако, по результатам логистической регрессии применение стентов «Мединж» не являлось предиктором возникновения рестеноза (OR=1,998; 95% ДИ (0,158–312,551); р=0,314). Модель объясняет 93,7% случаев. R квадрат Нэйджелкерка=0,73.
Обсуждение
Для стальных ГМС частота возникновения рестеноза в течение полугода варьирует от 25% до 35,9%. Внед-рение кобальт-хромовых стентов привело к снижению этого показателя примерно до 15% [1–5]. Частота возникновения рестеноза через 12 месяцев после имплантации СЛП по данным разных авторов не превышает 5–10% [6,7]. Несмотря на это очевидное преимущество, в настоящее время сохраняется неопределенность в отношении долгосрочной безопасности СЛП [8–10].Среди основных причин предпочтения ГМС (по данным 31 регистра Европы и Азии) по степени значимости выделяют: большой диаметр сосуда (32,4%), ИМ с подъемом ST (17,7%), преклонный возраст (13,4%), сопутствующая антикоагулянтная терапия (11,3%), высокий риск кровотечения (9,5%), стоимость (9,4%), планируемое некардиальное вмешательство (5,5%), низкая вероятность соблюдения двойной антиагрегантной терапии (1,7%) [11].
Результаты исследований свидетельствуют об отсутствии преимуществ СЛП при ЧКВ в коронарных артериях диаметром 3,5 мм и более. В этом случае ГМС и СЛП имели аналогичные показатели не только по частоте возникновения НКС, но и по частоте возникновения рестеноза (4,8% для СЛП и 5,7% для ГМС, р= 0,8) [12,13].
В нашей серии стенты диаметром 3,5 мм и более были имплантированы в 22(36%) случаях исследуемой и 32 (37%) контрольной групп. В течение срока наблюдения реваскуляризация целевого сосуда потребовалась лишь 2(9,1%) пациентам первой и 3 (9,3%) пациентам второй групп (р=1), несмотря на весомую долю сложных стенозов (типов «В2» и «С») в группах.
При продвижении на рынок новых коронарных стентов из пилотных исследований, как правило, исключаются пациенты с морфологически сложными субстратами поражения. Ангиографическими критериями исклю-чения обычно являются: окклюзии давностью более 3 месяцев, стенозы протяженностью более 20 мм, кальциноз, то есть поражения с признаками стеноза типа «С» [3,5,14].
При условии исключения пациентов со стенозами типа «С», частота рестеноза в нашей исследуемой группе составила бы 6,8% (р=0,02) против 6,5 % в контрольной (р=0,9). Однако, в связи с весомой долей (27,8%) поражения типа «С», в нашем исследовании частота рестеноза достигла 14,7% и 15,1% в первой и второй группах соответственно.
Наилучшие показатели для ГМС представлены в коммерческом регистре «Coroflex Blue Registry», включившем результаты стентирования 2315 пациентов с использованием ГМС третьего поколения «Coroflex Blue». Показатель клинически детерминированной реваскуляризации целевого стеноза составил всего лишь 5,5%. Данный факт был скептически воспринят в научной среде, так как показатель соизмерим с результатами использования СЛП [14,15]. Однако, несмотря на заявленные в исследовании реальную популяцию пациентов и достаточно большую подгруппу больных со сложным поражением типов «В2» и «С» (60,3%), из серии были исключены пациенты с протяженными стенозами более 25 мм, требующие имплантации более одного стента. Установка стента в место окклюзии выполнена только в 3,5%.
В нашем исследовании доля реканализаций составила 18% и 16,3% в исследуемой и контрольной группах соответственно (р=0,9), а частота рестеноза при исходном окклюзирующем поражении составила
4(36,4%) и 6 (42,8%) соответственно (р=1).
Показатель реваскуляризации целевого сосуда на протяжении 9 месяцев для «Driver», опубликованный Sketch M. И соавторами, составил 8,8%. Однако, несмотря на весомую долю (50,7%) стенозов типа «В2» и «С» в данном регистре, средняя протяженность поражения составила всего 11,04 мм [5].
В исследовании «Class» частота возникновения рестеноза для стентов Driver на протяжении 6 месяцев составила 12,6% [9]. Однако, средняя протяженность исходного стеноза составила всего 11,4 мм (не превышая 13 мм). В нашем исследовании этот показатель был на уровне 37,9±5,3 мм и 40,02±4,6 мм в первой и второй группах соответственно (табл. 1), что также могло объяснить более высокий процент рестенозов в обеих группах (14,7% и 15,1%).
В нашем исследовании по результатам логистической регрессии (табл.4), вероятность возникновения рестеноза через 6 месяцев после стентирования зависела только от степени исходного стеноза (OR=1,526; 95% ДИ (1,068–2,179); р=0,02). Применение стентов «Мединж» не являлось предиктором возникновения рестеноза (OR=1,998; 95% ДИ (0,158–312,551); р=0,314).
По данным Cassese S. и соавторов другими независимыми предикторами возникновения рестеноза в течение 6–8 месяцев являлись: малый диаметр сосуда, протяженность стентированного сегмента, сложный характер субстрата, наличие сахарного диабета, аортокоронарное шунтирование в анамнезе [15,16].
Отсутствие статистически значимой зависимости рестеноза от перечисленных предикторов, в нашем исследовании, может быть обусловлено недостаточной статистической мощностью для анализа категориальных переменных, в связи с относительно небольшими группами. Однако, по данным разных авторов, имплантация нескольких стентов почти в два раза увеличивает риск развития рестеноза [15].
В качестве дополнительного метода визуализации в нашем исследовании использована ОКТ. Ангиометрические показатели в обеих группах по данным цифровой ангиографии и ОКТ статистически значимо не отличались (табл.2). По данным внутрисосудистого исследования не отмечено мальпозиций, выявлена полная эндотелизация стентов (за исключением ячеек в зонах устьев боковых ветвей). Потеря просвета
по данным КАГ и ОКТ в 1 и 2 группах составила 1,538±0,489 мм 1,551±0,473 мм против 1,521±0,416 мм и 1,456±0,43 мм соответственно (р=0,7; р=0,8). Данный показатель несколько выше показателей других ГМС, для которых значения варьируют от 0,6 мм до 1,1 мм [2]. Причина состоит в том, что в нашей серии в 40% случаев ОКТ выполнялась пациентам с рестенозами, подтвержденными ангиографически.
Заключение
Стопроцентный непосредственный успех вмешательства даже при весомой доле (49,2%) сложных стенозов типов В2 и С с сопутствующим кальцинозом (18%), говорит о хороших гибкости доставляющей системы и радиальной устойчивости стентов. Нулевой показатель частоты неблагоприятных кардиальных событий в среднеотдаленном периоде, включая период эндотелизации, говорит о безопасности стентов.Предиктором возникновения рестеноза являлась только исходная степень стенозирования (OR=1,526; 95% ДИ (1,068–2,179); р=0,02). Применение стентов «Мединж» не являлось предиктором возникновения рестеноза (OR=1,998; 95% ДИ (0,158–312,551); р=0,314).
Уровень рестеноза при использовании стентов «МедИнж» даже при сложном исходном субстрате поражения, включая окклюзии, протяженные и кальцинированные стенозы, являлся приемлемым и не отличался от показателей другого производителя.
Учитывая данные, полученные в ходе нашего исследования, мы считаем, что стент «МежИнж» может безопасно и эффективно применяться в повседневной практике. Кроме того, данный стент может стать хорошей платформой для нанесения покрытия.
Конфликт интересов. Конфликт интересов не заявляется.
Список исп. литературыСкрыть список1. Hoffmann R., Mintz G. Coronary in-stent restenosis – predictors, treatment and prevention. European Heart Journal 2000; 21: 1739–1749.
2. Ben-Dor I., Waksman R., Pichard A.et al. The Current Role of Bare-Metal Stents. Cardiac interv. 2011; 1: 57–62.
3. Kastrati A., Schömig A., Elezi S., Dirschinger J et al. Prognostic Value of the Modified American College of Cardiology/American Heart Association Stenosis Morphology Classification for Long-Term Angiographic and Clinical Outcome After Coronary Stent Placement. Circulation. 1999; 100: 1285–1290.
4. Lagerqvist B., James S., Stenestrand U., Lindbck J., Nilsson T., Wallentin L. Long-term outcomes with drug-eluting stents versus bare-metal stents in Sweden. N. Engl. J. Med. 2007; 356: 1009–1019
5. Sketch M., Ball M., Rutherford B., Popma J.J., Russell C., Kereiakes D.J. Driver Investigators. Evaluation of the Medtronic (Driver) cobalt-chromium alloy coronary stent system. Am. J. Cardiol. 2005;95:8–12.
6. Farb A., et al., Pathology of acute and chronic coronary stenting in humans. Circulation. 1999; 99(1): p. 44–52.
7. Sarno G., et al. Lower risk of stent thrombosis and restenosis with unrestricted use of newgeneration drug-eluting stents: a report from the nation wide Swedish Coronary Angiography and Angioplasty Registry (SCAAR). Eur. Heart J. 2012; 33(5): p. 606–13.
8. Camenzind E., Steg P., Wijns W. Stent thrombosis late after implantation of First-generation drug-eluting stents: a cause for concern. Circulation. 2007; 115: 1440–155.
9. Lagerqvist B., James S., Stenestrand U., Lindbck J., Nilsson T., Wallentin L. Long-term outcomes with drug-eluting stents versus bare-metal stents in Sweden. N.Engl. J. Med. 2007; 356: 1009–1019.
10. Bavry A., Kumbhani D., Helton T., et al. Late thrombosis of drug-eluting stents: a metaanalysis of randomized clinical trials. Am. J. Med. 2006;119:1056–1061.
11. Morice M., Urban P., Greene S., Schuler G., Chevalier B. Why are we still using Coronary Bare-Metal Stents? JACC. 2013;61;1122–3.
12. Steinberg D., Mishra S., Javaid A., et al. Comparison of effectiveness of bare metal stents versus drug-eluting stents in large (³3.5 mm) coronary arteries. Am. J. Cardiol. 2007;99:599–602.
13. Kim T., Nam C., Hur S., et al. Two-year clinical outcomes after large coronary stent (4.0 mm) placement: comparison of bare-metal stent versus drug-eluting stent. Clin. Cardiol. 2010;33:620–625.
14. Bocksch W., Pomar F., Dziarmaga M., Tresukosol D et al. Clinical safety and efficacy of a novel thin-strut cobalt-chromium coronary stent system: results of the real world Coroflex Blue Registry. Catheter Cardiovasc. Interv. 2010 Jan 1;75(1):78–85.
15. Cassese S., Byrne R., Tada T. et al. Incidence and predictors of restenosis after coronary stenting in 10 004 patients with surveillance angiography. Heart.2014 Jan;100(2):153–9.
16. Serruys P., Morice M., Kappetein A., et al. SYNTAX Investigators. Percutaneous coronary intervention versus coronary-artery bypass grafting for severe coronary artery disease. N. Engl. J. Med. 2009;360:961–972.
1 апреля 2015
Количество просмотров: 4243

