Диагностическая и интервенционная радиология 2015
Диагностическая и интервенционная радиология 2015
№04 2015
Контраст-индуцированная энцефалопатия как редкое осложнение внутрисосудистого введения контрастирующих веществ №04 2015
Номера страниц в выпуске:57-61
Контраст-индуцированная энцефалопатия является редким осложнением внутрисосудистого использования контрастирующих веществ.
Цель: проанализировать доступные литературные данные о распространенности контраст-индуцированной энцефалопатии, ее этиологии и патогенезе, клинических и лучевых проявлениях.
Материал и методы: с помощью поисковой системы Pubmed (www.pubmed.com) отобраны публикации по ключевым словам «contrast-induced encephalopathy». Из 34 источников выбраны 15 полнотекстовых статей с полноценным описанием клинических случаев контраст-индуцированной энцефалопатии. Проанализированы представленные в литературе случаи развития контраст-индуцированной энцефалопатии, представлены данные о причинах и механизмах ее развития, клинических проявлениях, данных лучевых исследований, профилактике и лечении.
Результаты: развитие контраст-индуцированной энцефалопатии может наблюдаться как при введении препарата в церебральные артерии, так и в сосуды других органов. На основании проведенного анализа выделены два основных типа контраст-индуцированной энцефалопатии: стохастическая и детерминированная, описаны их характерные черты.
Выводы: своевременное распознавание контраст-индуцированной энцефалопатии, проведение дифференциальной диагностики с ишемическим и геморрагическим поражением головного мозга позволяет правильно определить прогноз и выбрать адекватную лечебную тактику.
Ключевые слова:
• контраст-индуцированная энцефалопатия
• контрастирующее вещество
Цель: проанализировать доступные литературные данные о распространенности контраст-индуцированной энцефалопатии, ее этиологии и патогенезе, клинических и лучевых проявлениях.
Материал и методы: с помощью поисковой системы Pubmed (www.pubmed.com) отобраны публикации по ключевым словам «contrast-induced encephalopathy». Из 34 источников выбраны 15 полнотекстовых статей с полноценным описанием клинических случаев контраст-индуцированной энцефалопатии. Проанализированы представленные в литературе случаи развития контраст-индуцированной энцефалопатии, представлены данные о причинах и механизмах ее развития, клинических проявлениях, данных лучевых исследований, профилактике и лечении.
Результаты: развитие контраст-индуцированной энцефалопатии может наблюдаться как при введении препарата в церебральные артерии, так и в сосуды других органов. На основании проведенного анализа выделены два основных типа контраст-индуцированной энцефалопатии: стохастическая и детерминированная, описаны их характерные черты.
Выводы: своевременное распознавание контраст-индуцированной энцефалопатии, проведение дифференциальной диагностики с ишемическим и геморрагическим поражением головного мозга позволяет правильно определить прогноз и выбрать адекватную лечебную тактику.
Ключевые слова:
• контраст-индуцированная энцефалопатия
• контрастирующее вещество
Резюме:
Контраст-индуцированная энцефалопатия является редким осложнением внутрисосудистого использования контрастирующих веществ.
Цель: проанализировать доступные литературные данные о распространенности контраст-индуцированной энцефалопатии, ее этиологии и патогенезе, клинических и лучевых проявлениях.
Материал и методы: с помощью поисковой системы Pubmed (www.pubmed.com) отобраны публикации по ключевым словам «contrast-induced encephalopathy». Из 34 источников выбраны 15 полнотекстовых статей с полноценным описанием клинических случаев контраст-индуцированной энцефалопатии. Проанализированы представленные в литературе случаи развития контраст-индуцированной энцефалопатии, представлены данные о причинах и механизмах ее развития, клинических проявлениях, данных лучевых исследований, профилактике и лечении.
Результаты: развитие контраст-индуцированной энцефалопатии может наблюдаться как при введении препарата в церебральные артерии, так и в сосуды других органов. На основании проведенного анализа выделены два основных типа контраст-индуцированной энцефалопатии: стохастическая и детерминированная, описаны их характерные черты.
Выводы: своевременное распознавание контраст-индуцированной энцефалопатии, проведение дифференциальной диагностики с ишемическим и геморрагическим поражением головного мозга позволяет правильно определить прогноз и выбрать адекватную лечебную тактику.
Ключевые слова:
• контраст-индуцированная энцефалопатия
• контрастирующее вещество
*Savello A.V. – MD,PhD
Chair of Neurosurgery , « Military Medical Academy named after S.M.Kirov, Chair of Neurosurgery»
6, Akad. Lebedeva str, St-Petersburg, Russian Federation, 194044
Abstract:
Contrast-induced encephalopathy is a rare complication of endovascular injection of contrast agent.
Aim: was to analyze available medical literature data, concerning the contrast-induced encephalopathy prevalence, etiology and pathogenesis, clinical and imaging manifestation.
Materials and methods: publications with key words «contrast-induced encephalopathy» were selected in Pubmed (www.pubmed.com). From 34 articles, 15 full-text articles with avaliable description of contrast-induced encephalopathy were selected. We analyzed cases of contrast-induced encephalopathy described in literature, presented main causes and pathogenesis, clinical manifestation and imaging findings, prophylaxis and treatment.
Results: development of this complication could be observed after injection of contrast agent into lumen either cerebral arteries or extracerebral ones. Based on the literature analysis, two main types of contrast-induced encephalopathy described: stochastic (accidental) and deterministic (predefined).
Conclusion: contrast-induced encephalopathy recognition, differential diagnostic with stroke and intracranial hemorrhage allow making correct prognosis and getting an adequate treatment tactics, when everything is done promptly.
КEY-WORDS:
• сontrast-induced encephalopathy
• contrast medium
Механизм развития контраст-индуцированной энцефалопатии
Точный механизм развития КИЭ остается неясным, однако основными факторами считаются комбинированное нарушение проницаемости гематоэнцефалического барьера вследствие гиперосмолярности КВ и его прямое токсическое воздействие на нервную систему [1, 2].
Гиперосмолярность плазмы крови (в смеси с КВ) вызывает в микроциркуляторном русле ряд эффектов, таких как вазодилятация и «сморщивание» клеток эндотелия с расширением межклеточных промежутков и повышением проницаемости ГЭБ, а так же сладж-феномен (адгезия, агрегация и агглютинация форменных элементов крови с нарушением микроциркуляции) с последующим вазоспазмом [2].
В норме ГЭБ является непроницаемым для КВ. Однако введение гиперосмолярного КВ приводит к временному «осмотическому» повышению проницаемости ГЭБ, что приводит к проникновению КВ и его прямому токсическому воздействию на головной или спинной мозг, приводящему к нарушению электрической активности нейронов [3, 4]. Повышение концентрации КВ в паренхиме мозга, в свою очередь, снижает онкотическое давление и способствует его отеку [2].
Необходимо отметить, что длительное дробное введение даже относительно «небольших» доз КВ в один сосудистый бассейн в ходе нейрорадиологических вмешательств способно вызвать кумулятивный эффект в нарушении функционирования ГЭБ [5, 6]. У пациентов с нарушением экскреторной функции почек длительный контакт КВ и его более высокая концентрация в плазме крови могут являться дополнительным фактором повреждения ГЭБ и развития КИЭ [4].
Кроме того, внутрисосудистое введение как ионных, так и неионных КВ приводит к возрастанию концентрации в плазме крови иммунореактивного эндотелиина как in vitro, так и in vivo [7]. При этом введение гипертонического раствора NaCl, маннитола или глюкозы не вызывало такого эффекта, что позволяет рассматривать выброс эндотелиина как специфичную для КВ реакцию [7]. Вероятно высвобождение эндотелиина при введении КВ происходит по механизму, сходному с аллергической реакцией.
Эндотелиин является эндогенным вазоконстриктором, высвобождающимся в ответ на различные стимулы. Авторы полагают, что действие эндотелиина может играть роль в развитии контраст-индуцированной нефропатии [7], однако сходный механизм может лежать в основе развития КИЭ. Кроме того, эндотелиин обладает способностью повышать проницаемость ГЭБ для молекул с низким весом, тем самым способствуя развитию отека вещества мозга [8].
Клиническая и лучевая диагностика контраст-индуцированной энцефалопатии
Клиническая картина КИЭ включает как общемозговые симптомы (головную боль, ментальные нарушения, судорожные приступы, расстройства сознания), так и очаговые проявления (топически соответствующие зоне поражения – кортикальную слепоту, гемипарезы, расстройства речи и прочие) [2].
Интересной является точка зрения, согласно которой к клиническим проявлениям КИЭ относятся лишь судорожные приступы, преходящая корковая слепота, отек головного мозга, а так же поражение спинного мозга, в то время как большинство других (кроме преходящей корковой слепоты) очаговых неврологических расстройств объясняются эмболией в результате катетеризации [3].
Тип поражения, при котором после введения КВ страдают преимущественно задние отделы головного мозга и его ствол, некоторыми исследователями считается вариантом синдрома «задней обратимой энцефалопатии» (Posterior Reversible Encephalopathy syndrome, PRES), который в общем случае связан с нарушением механизмов цереброваскулярной ауторегуляции. PRES может развиваться не только при введении КВ, но и у беременных (эклампсия и преэклампсия), при гипертонической болезни, как реакция на некоторые препараты (циклоспорин, эверолимус, иммуносупрессивные препараты и др.) [9–12]. Известно, что артериальная гипертензия и связанное с ней нарушение ауторегуляции церебральных артерий может являться фактором, провоцирующим развитие КИЭ [6, 13]
Данные литературы свидетельствуют о благоприятном, с быстрым восстановлением нарушенных функций, прогнозе КИЭ [13]. В то же время возможно длительное или постоянное сохранение развившихся неврологических нарушений [6].
Верификация морфологических изменений вещества головного мозга при подозрении на развитие КИЭ может быть выполнена с применением компьютерной томографии или магнитно-резонансной томографии.
При компьютерной томографии после введения КВ КИЭ может проявляться повышением рентгеновской плотности в субарахноидальных пространствах, аномальным повышением рентгеновской плотности коры головного мозга и полосатого тела (corpus striatum) из-за накопления КВ, а так же снижением рентгеновской плотности вещества мозга, являющегося признаком его отека [4, 6, 14]. В отличие от свежей крови, имеющей рентгеновскую плотность 60–80 HU, при КИЭ паренхиматозный компонент имеет более высокую плотность (80–160 HU), что может служить дифференциально-диагностическим признаком КИЭ и геморрагических осложнений [2].
Типичными проявлениями КИЭ при МРТ являются зоны повышенного МР-сигнала на Т2 ВИ, FLAIR (fluid-attenuated inversion recovery) и DWI (diffusion-weighted imaging) последовательностях. При этом на картах ADC (apparent diffusion coefficient) изменений не выявляется [6, 13]. Отсутствие изменения на картах ADC является важным дифференциально-диагностическим признаком между КИЭ и зоной ишемии [13].
Однако выявление описанных выше признаков не всегда сопровождается развитием клинической картины КИЭ. Так, в серии из 61 пациента после эмболизации церебральных аневризм аномальное контрастное усиление при КТ в течение первых 2 часов было отмечено почти у половины (43%) больных, в том числе контрастное усиление коры головного мозга в 34%, субарахноидального пространства в 13%, интравентрикулярное в 8%, полосатого тела в 3% случаев [1]. Новый неврологический дефицит не развился ни в одном наблюдении, а изменения при КТ в большинстве случаев разрешались на протяжении последующих суток [1]. Было отмечено, что вероятность развития изменений на КТ была выше у пациентов с низкой массой тела, большим объемом введенного КВ и гепарина [1].
Повышение проницаемости гематоэнцефалического барьера и проникновение КВ через него очевидно развивается в той или иной мере у значительной части пациентов, подвергающихся введению КВ в церебральные артерии в ходе внутрисосудистого вмешательства. Это подтверждается в том числе и повышением содержания йода в цереброспинальной жидкости [5]. В то же время КИЭ развивается гораздо реже, в единичных случаях.
Необходимо отметить, что диагноз КИЭ может быть установлен только при сочетании клинической картины и данных лучевых методов.
С учетом клинической картины, вида выполненной с введением контрастирующего вещества манипуляции (диагностическое внутривенное введение, селективное введение в церебральные или экстрацеребральные артерии, лечебные манипуляции на церебральных или экстрацеребральных артериях) в каждом случае требуется проведение дифференциальной диагностики с другими видами поражений, в первую очередь с геморрагическим инсультом, ишемическим инсультом различного генеза (материальная эмболия из коронарных артерий, дуги аорты, прецеребральных и церебральных артерий, воздушная эмболия, тромбозы церебральных артерий).
С практической точкой зрения могут быть полезны следующие диагностические критерии КИЭ [2]:
1. Начало симптомов после введения йод-содержащего КВ любой осмолярности (при этом интервал времени между введением КВ и клиническими проявлениями КИЭ не установлен).
2. Исключены другая этиология и сопутствующие причины, такие как метаболические расстройства или лекарственное воздействие.
3. Должны быть исключены церебральная эмболия и кровоизлияние (при помощи КТ или МРТ).
4. Хотя КИЭ может в редких случаях приводить к постоянному неврологическому дефициту, у большинства пациентов полное наступает спонтанное выздоровление на фоне только поддерживающей терапии. Точное время до клинического разрешения неизвестно, однако симптомы поражения могут исчезнуть в течение 24 часов.
Особенности возникновения контраст-индуцированной энцефалопатии
В некоторых работах были предприняты попытки выделить основные факторы риска и особенности приме-нения КВ, предрасполагающие к развитию КИЭ.
Так в одном из анализов [6] описанных в литературе наблюдений КИЭ, включавшем 39 подтвержденных при КТ/МРТ случаев, не было найдено взаимосвязи между дозой КВ и развитием клинической картины КИЭ, не было обнаружено «порога» дозировки КВ для появления его кортикального накопления (в 4 случаях клиническая картина энцефалопатии развилась при введении менее 40 мл КВ). Более того, выполненное ранее или позднее диагностическое или лечебное вмешательство с внутрисосудистым введением КВ не приводило к развитию КИЭ, на основании чего сделан вывод об идиосинкразии как механизме КИЭ [6].
Наш анализ подобранных [6] наблюдений позволял выявить интересную закономерность: в тех случаях, когда КИЭ развивалась при введении КВ только в экстрацеребральные сосуды, она была представлена преимущественно синдромом «задней обратимой энцефалопатии» (20 из 23 наблюдений, 87%), значительно реже (3 из 23 наблюдений, 13%) поражались другие отделы головного мозга. В то же время у пациентов, которым КВ вводилось в каротидные бассейны (в сочетании с введением других локализаций или без него) изолированный синдром «задней обратимой энцефалопатии» не развился ни у одного больного, у 6 человек (55%) изменения затронули вещество мозга в каротидном бассейне, а в 5 случаях – изменения имели место как в каротидном бассейне, так и в вертебробазилярном бассейне с развитием клинической картины «задней обратимой энцефалопатии». У 3-х пациентов с введением КВ только в позвоночные артерии так же развилась верифицированная при КТ или МРТ картина «задней обратимой энцефалопатии». Еще 2 пациента нами были исключены из анализа (1 – спинальные проявления КИЭ, 1 – диагноз КИЭ сомнительный).
Аналогичные данные мы получили и при анализе другого обзора 15 клинических наблюдений КИЭ [15]. Поражение по типу «задней обратимой энцефалопатии» после внутрисосудистого внецеребрального введения КВ развилась у 7 из 8(88%) пациентов, лишь у одного больного изменения имели место в другом сосудистом бассейне. При введении КВ в каротидный бассейн (в сочетании с введением других локализаций или без него) изолированный синдром «задней обратимой энцефалопатии» не развился ни у одного больного, у 3(75%) человек изменения затронули вещество мозга в каротидном бассейне, а в 1 случае – изменения имело место сочетание изменений в каротидном и вертебробазилярном бассейнах с развитием картины «задней обратимой энцефалопатии». У 3-х пациентов с введением КВ только в позвоночные артерии так же развилась верифицированная картина синдрома «задней обратимой энцефалопатии».
Таким образом, развитие КИЭ в варианте синдрома «задней обратимой энцефалопатии» с соответствующей локализацией морфологических изменений чаще не связано с попаданием КВ непосредственно в церебральные артерии или артерии вертебробазилярного бассейна и носит непредсказуемый характер. В то же время локализация морфологических изменений при введении КВ в каротидный бассейн четко связана с местом введения, но может сопровождаться приблизительно в половине случаев и синдромом «задней обратимой энцефалопатии».
В наиболее крупном из обнаруженных нами в литературе анализе клинических случаев (39 наблюдений с 1981 по 2011 гг.) [6] КИЭ наблюдалась при использовании различных КВ (табл. 1).
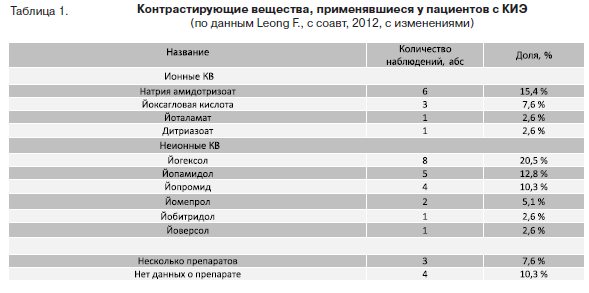
Очевидно, что на частоту появления в литературе описаний клинических случаев КИЭ оказывает влияние их доля на рынке КВ, однако можно выделить и некоторые общие закономерности.
Как видно из таблицы, среди «старых» ионных КВ наибольшее количество сообщений о КИЭ связано с использованием натрия амидотризоата. Среди неионных мономеров наименьшее количество сообщений о КИЭ было связано с препаратами йоверсол и йобитридол. При этом йоверсол, как известно, является самым гидрофильным из группы КВ, относящихся по химической структуре к неионным мономерам, что должно существенно снижать его способность взаимодействовать с клеточными мембранами и вызывать их повреждение. Проведенный нами анализ описанных в литературе клинических случаев и обзоров позволяет условно выделить два различных вида КИЭ: стохастическую и детерминированную.
Стохастическая контраст-индуцированная энцефалопатия
Этот вид КИЭ развивается «случайно» на фоне отсутствия изменений головного мозга и не может быть предскзан. Стохастическая КИЭ не предопределяется объемом, скоростью, продолжительностью введения контрастирующего вещества или его свойствами, местом введения и видом выполняемой диагностической или лечебной манипуляции. Типичным клини-ческим проявлением стохастической КИЭ является преходящая кортикальная слепота (как проявление синдрома «задней обратимой энцефалопатии»), изменения при КТ и МРТ локализуются в зоне кровоснабжения артериями вертебробазилярного бассейна.
Детерминированная (нестохастическая) контраст-индуцированная энцефалопатия
Этот вид КИЭ вызван значительной дозой введенного контрастирующего вещества и закономерно вызванного им повреждения головного мозга, проявляющегося клинически и морфологически в том сосудистом бассейне (бассейнах), куда выполнялось введение. Детерминированная КИЭ развивается при превышении определенного «порога» агрессивного воздействия КВ на центральную нервную систему, при этом существенное значение, очевидно, имеет не только объем введенного КВ, но и скорость, продолжительность его введения, физические свойства (осмолярность, вязкость, температура) и химическая структура применяемого препарата. Фактором, влияющим на вероятность развития детерминированной КИЭ, необходимо считать и экскреторную функцию почек, при снижении которой возможно увеличение концентрации КВ в циркулирующей крови и продолжительнос-ти его контакта с гематоэнцефалическим барьером.
К особой разновидности детерминированной КИЭ можно отнести случаи, когда клиническая и морфологическая картина развивается в зоне мозга с нарушенной проницаемостью ГЭБ, являющейся более чувствительной к воздействию КВ. Это может быть связано как с патологическим процессом (перитуморозный отек, недавний ишемический инсульт или транзиторная ишемическая атака) так и быть результатом медикаментозного воздействия, прорывающего ГЭБ и снижающего «порог» переносимости КВ веществом головного мозга.
Профилактика и лечение контраст-индуцированной энцефалопатии
Редкость КИЭ не позволяет дать исчерпывающих указаний по ее профилактике, однако общие рекомендации могут включать снижение объема вводимого КВ в сочетании с адекватной гидратацией пациента до манипуляции [2,4]. Ряд авторов [6] считают профилактку КИЭ трудной задачей в связи с непредсказуемостью ее возникновения.
Лечение КИЭ включает гидратацию пациента, симптоматическую терапию, назначение при необходимости противосудорожных препаратов, возможно кортикостероидов [2, 6]. У больных с хронической почечной недостаточностью оправдано проведение гемодиализа для выведения КВ из организма [4].
Контраст-индуцированная энцефалопатия является редким осложнением внутрисосудистого использования контрастирующих веществ.
Цель: проанализировать доступные литературные данные о распространенности контраст-индуцированной энцефалопатии, ее этиологии и патогенезе, клинических и лучевых проявлениях.
Материал и методы: с помощью поисковой системы Pubmed (www.pubmed.com) отобраны публикации по ключевым словам «contrast-induced encephalopathy». Из 34 источников выбраны 15 полнотекстовых статей с полноценным описанием клинических случаев контраст-индуцированной энцефалопатии. Проанализированы представленные в литературе случаи развития контраст-индуцированной энцефалопатии, представлены данные о причинах и механизмах ее развития, клинических проявлениях, данных лучевых исследований, профилактике и лечении.
Результаты: развитие контраст-индуцированной энцефалопатии может наблюдаться как при введении препарата в церебральные артерии, так и в сосуды других органов. На основании проведенного анализа выделены два основных типа контраст-индуцированной энцефалопатии: стохастическая и детерминированная, описаны их характерные черты.
Выводы: своевременное распознавание контраст-индуцированной энцефалопатии, проведение дифференциальной диагностики с ишемическим и геморрагическим поражением головного мозга позволяет правильно определить прогноз и выбрать адекватную лечебную тактику.
Ключевые слова:
• контраст-индуцированная энцефалопатия
• контрастирующее вещество
Contrast-induced encephalopathy as a rare complication of intravascular injection of contrast agent
*Savello A.V. – MD,PhD
Chair of Neurosurgery , « Military Medical Academy named after S.M.Kirov, Chair of Neurosurgery»
6, Akad. Lebedeva str, St-Petersburg, Russian Federation, 194044
Abstract:
Contrast-induced encephalopathy is a rare complication of endovascular injection of contrast agent.
Aim: was to analyze available medical literature data, concerning the contrast-induced encephalopathy prevalence, etiology and pathogenesis, clinical and imaging manifestation.
Materials and methods: publications with key words «contrast-induced encephalopathy» were selected in Pubmed (www.pubmed.com). From 34 articles, 15 full-text articles with avaliable description of contrast-induced encephalopathy were selected. We analyzed cases of contrast-induced encephalopathy described in literature, presented main causes and pathogenesis, clinical manifestation and imaging findings, prophylaxis and treatment.
Results: development of this complication could be observed after injection of contrast agent into lumen either cerebral arteries or extracerebral ones. Based on the literature analysis, two main types of contrast-induced encephalopathy described: stochastic (accidental) and deterministic (predefined).
Conclusion: contrast-induced encephalopathy recognition, differential diagnostic with stroke and intracranial hemorrhage allow making correct prognosis and getting an adequate treatment tactics, when everything is done promptly.
КEY-WORDS:
• сontrast-induced encephalopathy
• contrast medium
Введение
Контраст-индуцированная энцефалопатия (КИЭ) − весьма редкое осложнение, возникающее при внутрисосудистом введении контрастирующих веществ (КВ).Механизм развития контраст-индуцированной энцефалопатии
Точный механизм развития КИЭ остается неясным, однако основными факторами считаются комбинированное нарушение проницаемости гематоэнцефалического барьера вследствие гиперосмолярности КВ и его прямое токсическое воздействие на нервную систему [1, 2].
Гиперосмолярность плазмы крови (в смеси с КВ) вызывает в микроциркуляторном русле ряд эффектов, таких как вазодилятация и «сморщивание» клеток эндотелия с расширением межклеточных промежутков и повышением проницаемости ГЭБ, а так же сладж-феномен (адгезия, агрегация и агглютинация форменных элементов крови с нарушением микроциркуляции) с последующим вазоспазмом [2].
В норме ГЭБ является непроницаемым для КВ. Однако введение гиперосмолярного КВ приводит к временному «осмотическому» повышению проницаемости ГЭБ, что приводит к проникновению КВ и его прямому токсическому воздействию на головной или спинной мозг, приводящему к нарушению электрической активности нейронов [3, 4]. Повышение концентрации КВ в паренхиме мозга, в свою очередь, снижает онкотическое давление и способствует его отеку [2].
Необходимо отметить, что длительное дробное введение даже относительно «небольших» доз КВ в один сосудистый бассейн в ходе нейрорадиологических вмешательств способно вызвать кумулятивный эффект в нарушении функционирования ГЭБ [5, 6]. У пациентов с нарушением экскреторной функции почек длительный контакт КВ и его более высокая концентрация в плазме крови могут являться дополнительным фактором повреждения ГЭБ и развития КИЭ [4].
Кроме того, внутрисосудистое введение как ионных, так и неионных КВ приводит к возрастанию концентрации в плазме крови иммунореактивного эндотелиина как in vitro, так и in vivo [7]. При этом введение гипертонического раствора NaCl, маннитола или глюкозы не вызывало такого эффекта, что позволяет рассматривать выброс эндотелиина как специфичную для КВ реакцию [7]. Вероятно высвобождение эндотелиина при введении КВ происходит по механизму, сходному с аллергической реакцией.
Эндотелиин является эндогенным вазоконстриктором, высвобождающимся в ответ на различные стимулы. Авторы полагают, что действие эндотелиина может играть роль в развитии контраст-индуцированной нефропатии [7], однако сходный механизм может лежать в основе развития КИЭ. Кроме того, эндотелиин обладает способностью повышать проницаемость ГЭБ для молекул с низким весом, тем самым способствуя развитию отека вещества мозга [8].
Клиническая и лучевая диагностика контраст-индуцированной энцефалопатии
Клиническая картина КИЭ включает как общемозговые симптомы (головную боль, ментальные нарушения, судорожные приступы, расстройства сознания), так и очаговые проявления (топически соответствующие зоне поражения – кортикальную слепоту, гемипарезы, расстройства речи и прочие) [2].
Интересной является точка зрения, согласно которой к клиническим проявлениям КИЭ относятся лишь судорожные приступы, преходящая корковая слепота, отек головного мозга, а так же поражение спинного мозга, в то время как большинство других (кроме преходящей корковой слепоты) очаговых неврологических расстройств объясняются эмболией в результате катетеризации [3].
Тип поражения, при котором после введения КВ страдают преимущественно задние отделы головного мозга и его ствол, некоторыми исследователями считается вариантом синдрома «задней обратимой энцефалопатии» (Posterior Reversible Encephalopathy syndrome, PRES), который в общем случае связан с нарушением механизмов цереброваскулярной ауторегуляции. PRES может развиваться не только при введении КВ, но и у беременных (эклампсия и преэклампсия), при гипертонической болезни, как реакция на некоторые препараты (циклоспорин, эверолимус, иммуносупрессивные препараты и др.) [9–12]. Известно, что артериальная гипертензия и связанное с ней нарушение ауторегуляции церебральных артерий может являться фактором, провоцирующим развитие КИЭ [6, 13]
Данные литературы свидетельствуют о благоприятном, с быстрым восстановлением нарушенных функций, прогнозе КИЭ [13]. В то же время возможно длительное или постоянное сохранение развившихся неврологических нарушений [6].
Верификация морфологических изменений вещества головного мозга при подозрении на развитие КИЭ может быть выполнена с применением компьютерной томографии или магнитно-резонансной томографии.
При компьютерной томографии после введения КВ КИЭ может проявляться повышением рентгеновской плотности в субарахноидальных пространствах, аномальным повышением рентгеновской плотности коры головного мозга и полосатого тела (corpus striatum) из-за накопления КВ, а так же снижением рентгеновской плотности вещества мозга, являющегося признаком его отека [4, 6, 14]. В отличие от свежей крови, имеющей рентгеновскую плотность 60–80 HU, при КИЭ паренхиматозный компонент имеет более высокую плотность (80–160 HU), что может служить дифференциально-диагностическим признаком КИЭ и геморрагических осложнений [2].
Типичными проявлениями КИЭ при МРТ являются зоны повышенного МР-сигнала на Т2 ВИ, FLAIR (fluid-attenuated inversion recovery) и DWI (diffusion-weighted imaging) последовательностях. При этом на картах ADC (apparent diffusion coefficient) изменений не выявляется [6, 13]. Отсутствие изменения на картах ADC является важным дифференциально-диагностическим признаком между КИЭ и зоной ишемии [13].
Однако выявление описанных выше признаков не всегда сопровождается развитием клинической картины КИЭ. Так, в серии из 61 пациента после эмболизации церебральных аневризм аномальное контрастное усиление при КТ в течение первых 2 часов было отмечено почти у половины (43%) больных, в том числе контрастное усиление коры головного мозга в 34%, субарахноидального пространства в 13%, интравентрикулярное в 8%, полосатого тела в 3% случаев [1]. Новый неврологический дефицит не развился ни в одном наблюдении, а изменения при КТ в большинстве случаев разрешались на протяжении последующих суток [1]. Было отмечено, что вероятность развития изменений на КТ была выше у пациентов с низкой массой тела, большим объемом введенного КВ и гепарина [1].
Повышение проницаемости гематоэнцефалического барьера и проникновение КВ через него очевидно развивается в той или иной мере у значительной части пациентов, подвергающихся введению КВ в церебральные артерии в ходе внутрисосудистого вмешательства. Это подтверждается в том числе и повышением содержания йода в цереброспинальной жидкости [5]. В то же время КИЭ развивается гораздо реже, в единичных случаях.
Необходимо отметить, что диагноз КИЭ может быть установлен только при сочетании клинической картины и данных лучевых методов.
С учетом клинической картины, вида выполненной с введением контрастирующего вещества манипуляции (диагностическое внутривенное введение, селективное введение в церебральные или экстрацеребральные артерии, лечебные манипуляции на церебральных или экстрацеребральных артериях) в каждом случае требуется проведение дифференциальной диагностики с другими видами поражений, в первую очередь с геморрагическим инсультом, ишемическим инсультом различного генеза (материальная эмболия из коронарных артерий, дуги аорты, прецеребральных и церебральных артерий, воздушная эмболия, тромбозы церебральных артерий).
С практической точкой зрения могут быть полезны следующие диагностические критерии КИЭ [2]:
1. Начало симптомов после введения йод-содержащего КВ любой осмолярности (при этом интервал времени между введением КВ и клиническими проявлениями КИЭ не установлен).
2. Исключены другая этиология и сопутствующие причины, такие как метаболические расстройства или лекарственное воздействие.
3. Должны быть исключены церебральная эмболия и кровоизлияние (при помощи КТ или МРТ).
4. Хотя КИЭ может в редких случаях приводить к постоянному неврологическому дефициту, у большинства пациентов полное наступает спонтанное выздоровление на фоне только поддерживающей терапии. Точное время до клинического разрешения неизвестно, однако симптомы поражения могут исчезнуть в течение 24 часов.
Особенности возникновения контраст-индуцированной энцефалопатии
В некоторых работах были предприняты попытки выделить основные факторы риска и особенности приме-нения КВ, предрасполагающие к развитию КИЭ.
Так в одном из анализов [6] описанных в литературе наблюдений КИЭ, включавшем 39 подтвержденных при КТ/МРТ случаев, не было найдено взаимосвязи между дозой КВ и развитием клинической картины КИЭ, не было обнаружено «порога» дозировки КВ для появления его кортикального накопления (в 4 случаях клиническая картина энцефалопатии развилась при введении менее 40 мл КВ). Более того, выполненное ранее или позднее диагностическое или лечебное вмешательство с внутрисосудистым введением КВ не приводило к развитию КИЭ, на основании чего сделан вывод об идиосинкразии как механизме КИЭ [6].
Наш анализ подобранных [6] наблюдений позволял выявить интересную закономерность: в тех случаях, когда КИЭ развивалась при введении КВ только в экстрацеребральные сосуды, она была представлена преимущественно синдромом «задней обратимой энцефалопатии» (20 из 23 наблюдений, 87%), значительно реже (3 из 23 наблюдений, 13%) поражались другие отделы головного мозга. В то же время у пациентов, которым КВ вводилось в каротидные бассейны (в сочетании с введением других локализаций или без него) изолированный синдром «задней обратимой энцефалопатии» не развился ни у одного больного, у 6 человек (55%) изменения затронули вещество мозга в каротидном бассейне, а в 5 случаях – изменения имели место как в каротидном бассейне, так и в вертебробазилярном бассейне с развитием клинической картины «задней обратимой энцефалопатии». У 3-х пациентов с введением КВ только в позвоночные артерии так же развилась верифицированная при КТ или МРТ картина «задней обратимой энцефалопатии». Еще 2 пациента нами были исключены из анализа (1 – спинальные проявления КИЭ, 1 – диагноз КИЭ сомнительный).
Аналогичные данные мы получили и при анализе другого обзора 15 клинических наблюдений КИЭ [15]. Поражение по типу «задней обратимой энцефалопатии» после внутрисосудистого внецеребрального введения КВ развилась у 7 из 8(88%) пациентов, лишь у одного больного изменения имели место в другом сосудистом бассейне. При введении КВ в каротидный бассейн (в сочетании с введением других локализаций или без него) изолированный синдром «задней обратимой энцефалопатии» не развился ни у одного больного, у 3(75%) человек изменения затронули вещество мозга в каротидном бассейне, а в 1 случае – изменения имело место сочетание изменений в каротидном и вертебробазилярном бассейнах с развитием картины «задней обратимой энцефалопатии». У 3-х пациентов с введением КВ только в позвоночные артерии так же развилась верифицированная картина синдрома «задней обратимой энцефалопатии».
Таким образом, развитие КИЭ в варианте синдрома «задней обратимой энцефалопатии» с соответствующей локализацией морфологических изменений чаще не связано с попаданием КВ непосредственно в церебральные артерии или артерии вертебробазилярного бассейна и носит непредсказуемый характер. В то же время локализация морфологических изменений при введении КВ в каротидный бассейн четко связана с местом введения, но может сопровождаться приблизительно в половине случаев и синдромом «задней обратимой энцефалопатии».
В наиболее крупном из обнаруженных нами в литературе анализе клинических случаев (39 наблюдений с 1981 по 2011 гг.) [6] КИЭ наблюдалась при использовании различных КВ (табл. 1).

Очевидно, что на частоту появления в литературе описаний клинических случаев КИЭ оказывает влияние их доля на рынке КВ, однако можно выделить и некоторые общие закономерности.
Как видно из таблицы, среди «старых» ионных КВ наибольшее количество сообщений о КИЭ связано с использованием натрия амидотризоата. Среди неионных мономеров наименьшее количество сообщений о КИЭ было связано с препаратами йоверсол и йобитридол. При этом йоверсол, как известно, является самым гидрофильным из группы КВ, относящихся по химической структуре к неионным мономерам, что должно существенно снижать его способность взаимодействовать с клеточными мембранами и вызывать их повреждение. Проведенный нами анализ описанных в литературе клинических случаев и обзоров позволяет условно выделить два различных вида КИЭ: стохастическую и детерминированную.
Стохастическая контраст-индуцированная энцефалопатия
Этот вид КИЭ развивается «случайно» на фоне отсутствия изменений головного мозга и не может быть предскзан. Стохастическая КИЭ не предопределяется объемом, скоростью, продолжительностью введения контрастирующего вещества или его свойствами, местом введения и видом выполняемой диагностической или лечебной манипуляции. Типичным клини-ческим проявлением стохастической КИЭ является преходящая кортикальная слепота (как проявление синдрома «задней обратимой энцефалопатии»), изменения при КТ и МРТ локализуются в зоне кровоснабжения артериями вертебробазилярного бассейна.
Детерминированная (нестохастическая) контраст-индуцированная энцефалопатия
Этот вид КИЭ вызван значительной дозой введенного контрастирующего вещества и закономерно вызванного им повреждения головного мозга, проявляющегося клинически и морфологически в том сосудистом бассейне (бассейнах), куда выполнялось введение. Детерминированная КИЭ развивается при превышении определенного «порога» агрессивного воздействия КВ на центральную нервную систему, при этом существенное значение, очевидно, имеет не только объем введенного КВ, но и скорость, продолжительность его введения, физические свойства (осмолярность, вязкость, температура) и химическая структура применяемого препарата. Фактором, влияющим на вероятность развития детерминированной КИЭ, необходимо считать и экскреторную функцию почек, при снижении которой возможно увеличение концентрации КВ в циркулирующей крови и продолжительнос-ти его контакта с гематоэнцефалическим барьером.
К особой разновидности детерминированной КИЭ можно отнести случаи, когда клиническая и морфологическая картина развивается в зоне мозга с нарушенной проницаемостью ГЭБ, являющейся более чувствительной к воздействию КВ. Это может быть связано как с патологическим процессом (перитуморозный отек, недавний ишемический инсульт или транзиторная ишемическая атака) так и быть результатом медикаментозного воздействия, прорывающего ГЭБ и снижающего «порог» переносимости КВ веществом головного мозга.
Профилактика и лечение контраст-индуцированной энцефалопатии
Редкость КИЭ не позволяет дать исчерпывающих указаний по ее профилактике, однако общие рекомендации могут включать снижение объема вводимого КВ в сочетании с адекватной гидратацией пациента до манипуляции [2,4]. Ряд авторов [6] считают профилактку КИЭ трудной задачей в связи с непредсказуемостью ее возникновения.
Лечение КИЭ включает гидратацию пациента, симптоматическую терапию, назначение при необходимости противосудорожных препаратов, возможно кортикостероидов [2, 6]. У больных с хронической почечной недостаточностью оправдано проведение гемодиализа для выведения КВ из организма [4].
Заключение
Хотя КИЭ является редкой формой осложнения внутрисосудистого введения КВ, ее своевременное распознавание и проведение дифференциальной диагностики с ишемическим и геморрагическим поражением головного мозга является важным для определения лечебной тактики и прогноза. КИЭ имеет, как правило, благоприятный прогноз с полным или почти полным неврологическим восстановлением, не требует специфического лечения. Риск развития КИЭ возрастает с увеличением объема введенного КВ, однако возможно ее развитие и при небольших дозировках КВ любой осмолярности с преимущественным поражением задних отделов головного мозга и ствола.
Список исп. литературыСкрыть список1. Baik S.K. et al. Immediate CT findings following embolization of cerebral aneurysms: suggestion of blood-brain barrier or vascular permeability change. Neuroradiology. 2008 Mar;50(3):259–266.
2. Yu J.; Dangas G. Commentary: New insights into the risk factors of contrast-induced encephalopathy. Journal of endovascular therapy : an official journal of the International Society of Endovascular Specialists. 2011 Aug;18(4):545–546.
3. Junck L.; Marshall W.H. Neurotoxicity of radiological contrast agents. Ann. Neurol. 1983 May;13(5):469–484.
4. Yan J. Ramanathan V. Severe encephalopathy following cerebral arteriogram in a patient with end-stage
renal disease. Seminars in dialysis. 2013 Mar–Apr; 26(2):203–207.
5. Uchiyama Y. et al. Blood brain-barrier disruption of nonionic iodinated contrast medium following coil embolization of a ruptured intracerebral aneurysm. AJNR Am.J. Neuroradiol. 2004 Nov–Dec;25(10):1783–1786.
6. Leong S. Fanning N.F. Persistent neurological deficit from iodinated contrast encephalopathy following intracranial aneurysm coiling. A case report and review of the literature. Interv. Neuroradiol. 2012 Mar;18(1):33–41.
7. Heyman S.N. et al. Radiocontrast agents induce endothelin release in vivo and in vitro. J. Am. Soc. Nephrol. 1992 Jul;3(1):58–65.
8. Stanimirovic D.B. et al. Arachidonic acid release and permeability changes induced by endothelins in human cerebromicrovascular endothelium. Acta Neurochir Suppl (Wien). 1994;60:71–75.
9. Touhami S. et al. Everolimus-induced posterior reversible encephalopathy syndrome and bilateral optic neuropathy after kidney transplantation. Transplantation. 2014 Dec 27;98(12):e102–104.
10. Nishijima H. et al. Asymmetric Posterior Reversible Encephalopathy Syndrome due to Hypertensive Encephalopathy. Internal. medicine (Tokyo, Japan). 2015;54(8):993–994.
11. Wagih A. et al. Posterior Reversible Encephalopathy Syndrome (PRES): Restricted Diffusion does not Necessarily Mean Irreversibility. Pol. J. Radiol. 2015;80:210–216.
12. Yafour N. et al. Cyclosporine-related brainstem atypical posterior reversible leukoencephalopathy syndrome following hematopoietic stem cell transplant. Hematol. Oncol. Stem. Cell Ther. 2015 Apr 28.
13. Guimaraens L. et al. Transient encephalopathy from angiographic contrast: a rare complication in neurointerventional procedures. Cardiovascular and interventional radiology. 2010 Apr;33(2):383–388.
14. Nagamine Y. et al. Contrast-induced encepha-
lopathy after coil embolization of an unruptured internal carotid artery aneurysm. Internal medicine (Tokyo, Japan). 2014;53(18):2133–2138.
15. Merchut M.P. Richie B. Transient visuospatial disorder from angiographic contrast. Archives of neurology. 2002 May;59(5):851–854.
