Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
Психиатрия Психиатрия и психофармакотерапия им. П.Б. Ганнушкина
№05 2013
Влияние генетического полиморфизма CYP2D6 и MDR1 на эффективность и безопасность терапии антидепрессантами у пациентов с депрессивными расстройствами в условиях психиатрического стационара №05 2013
Номера страниц в выпуске:11-15
По данным Всемирной организации здравоохранения, ежегодно 25% населения Европейского союза (ЕС) страдают от депрессий или тревожных состояний. Психоневрологические нарушения обусловливают около 19,5% бремени болезней в европейском регионе, эта цифра достигает 26% в ЕС. Эти нарушения являются в 40% случаев причиной лет, прожитых с инвалидностью, причем депрессия является лидирующей причиной.
Резюме. Выполнено изучение ассоциации генетических полиморфизмов CYP2D6 и MDR1 с эффективностью и безопасностью терапии антидепрессантами в условиях психиатрического стационара. Показано, что у больных с депрессией с генотипом CYP2D6*1/*1 уровни показателя шкалы оценки побочного действия UKU (Udvald for Kliniske Undersogelser Scale) были значимо ниже в течение всего курса терапии, следовательно, фармакотерапия была более безопасна, чем у пациентов с генотипами СYP2D6*1/*4 и СYP2D6*4/*4. Сравнение динамики показателя шкалы оценки депрессии MARDS (Montgomery–Asberg Depression Rating Scale) в зависимости от генотипа по полиморфному маркеру С3425Т гена MDR1 показало более выраженные изменения у пациентов с аллелем CC. Полученные результаты подтверждают необходимость дальнейших фармакогенетических исследований для индивидуального подбора антидепрессанта, что будет способствовать снижению частоты неблагоприятных реакций и повысит экономическую эффективность лечения больных с депрессией.
Ключевые слова: депрессивные расстройства, антидепрессанты, генетический полиморфизм, безопасность терапии, фармакогенетическое тестирование.
The influence of CYP2D6 and MDR1 genetic polymorphism on the antidepressant therapy efficacy and safety in patients with depressive disorders in a psychiatric hospital
V.G.Kukes, N.N.Ivanets, D.A.Sychev, R.E.Kazakov, N.A.Psareva
I.M.Sechenov First Moscow State Medical University, Ministry of Health of the Russian Federation, Department of personalized medicine and clinical pharmacogenetics CCP SC ESMP, Ministry of Health of the Russian Federation
Summary. It was conducted the investigation of the genetic polymorphisms in CYP2D6 and MDR1 association with the efficacy and safety of antidepressant treatment in a psychiatric hospital. It is shown that depressed patients with genotype CYP2D6*1/*1 level indicator UKU scale (Udvald for Kliniske Undersogelser Scale) were significantly lower during the entire course of therapy, therefore, pharmacotherapy was more secure than in patients with genotypes SYP2D6*1/*4*4 and SYP2D6/*4. The comparison of the MARDS scale (Montgomery–Asberg Depression Rating Scale) of dynamics depending on the genotype at the polymorphic marker S3425T gene MDR1 showed more pronounced changes in patients with allele CC. The results confirm the need for further pharmacogenetic studies for individual selection of an antidepressant that will help to reduce the frequency of adverse reactions and improve the cost-effectiveness of treatment for depression.
Key words: depressive disorder, antidepressants, genetic polymorphism, the safety of therapy, pharmacogenetic testing.
Введение
По данным Всемирной организации здравоохранения, ежегодно 25% населения Европейского союза (ЕС) страдают от депрессий или тревожных состояний. Психоневрологические нарушения обусловливают около 19,5% бремени болезней в европейском регионе, эта цифра достигает 26% в ЕС. Эти нарушения являются в 40% случаев причиной лет, прожитых с инвалидностью, причем депрессия является лидирующей причиной. До 50% длительных отпусков по болезни связано с депрессией/тревожными состояниями, при этом примерно в 50% случаев серьезные депрессии остаются нелеченными [1, 2]. Расстройства настроения и тревожные состояния обходятся ЕС в сумму размером около 170 млрд евро в год. В США, согласно данным Американской психиатрической ассоциации, депрессией страдают 15 млн человек. Ежегодный ущерб экономике США от депрессий оценивается более чем в 50 млрд дол. США [2, 3]. Согласно резолюции Всероссийской конференции с международным участием «Психическое здоровье населения как основа национальной безопасности России» (2012 г.) учетная распространенность психических расстройств в Российской Федерации составляет более 4 млн человек.
Известно, что большинство антидепрессантов метаболизируется в печени с помощью изоферментов цитохрома Р-450 2D6 (CYP2D6) и 2С19 (CYP2C19), поэтому полиморфизмы в данных генах в виде носительства функционально дефектных аллелей могут обусловливать более высокие значения концентраций антидепрессантов в крови и, как следствие, приводить к развитию неблагоприятных побочных реакций вплоть до серьезных [4–9]. Показано, что в РФ распространенность генотипов, ассоциированных с низкой активностью CYP2D6 (гетеро- и гомозиготы по функционально дефектным аллелям, а в европейских популяциях наиболее распространен CYP2D6*4), достигает 20–25% [5].
Эффективность и безопасность антидепрессантов в настоящее время связывают с уровнем их проникновения через гематоэнцефалический барьер в центральной нервной системе. При этом транспортный белок Р-гликопротеин (Р-gp), локализованный на апикальной мембране эндотелиоцитов церебральных сосудов и кодирующийся геном MDR1, не «допускает» некоторое количество антидепрессантов-субстратов Р-gp в центральной нервной системе. Очевидно, что генетический полиморфизм MDR1, который может приводить к снижению активности Р-gp и, как следствие, к более интенсивному проникновению препаратов в центральную нервную систему, может быть ассоциирован как с более высокой эффективностью, так и с развитием «центральных» нежелательных лекарственных реакций (НЛР) [4, 10].
Поскольку в психиатрической практике подбор антидепрессантов, как правило, сопряжен с продолжительным пребыванием пациентов в стационаре вследствие необходимости подбора наиболее эффективного и безопасного препарата при терапии депрессивного расстройства или замены лекарственного средства из-за неэффективности или плохой переносимости препарата, проблема оценки индивидуальной чувствительности к проводимой терапии является высокоактуальной для персонализированного подхода к фармакотерапии конкретного пациента. Очевидно, что одним из путей повышения эффективности и безопасности фармакотерапии антидепрессантами может стать персонализация выбора лекарственного средства в зависимости от результатов генотипирования (т.е. фармакогенетического тестирования) по CYP2D6, CYP2C19, MDR1 [5–7]. Подобные исследования проводятся за рубежом, однако в РФ работы в области клинической фармакогенетики антидепрессантов единичны [3, 5–7].
Цель работы – оценить ассоциации генетических полиморфизмов CYP2D6 и MDR1 с параметрами эффективности и безопасности антидепрессантов у пациентов с депрессивными расстройствами в условиях психиатрического стационара.
Материалы и методы
В работе использованы данные, полученные при лечении больных, госпитализированных в 2012 г. в Клинику психиатрии им. С.С.Корсакова ГБОУ ВПО Первый Московский государственный медицинский университет
им. И.М.Сеченова Минздрава России по поводу депрессивных расстройств. Выборка включает 34 пациента: 7 (20,6%) мужчин и 27 (79,4%) женщин; средний возраст составил 39,5±21,5 года.
При отборе больных использовали диагностические критерии Международной классификации болезней 10-го пересмотра (МКБ-10) под рубриками: F31 Биполярное расстройство – 5 (14,7%) пациентов; F32 Депрессивный эпизод – 3 (8,8%) пациента; F33 Рекуррентное депрессивное расстройство – 24 (70,59%) пациента; F43 Реакции на тяжелый стресс и нарушение адаптации – 2 (5,9%) пациента. Выборку формировали на основании констатации на момент осмотра депрессивного расстройства, соответствующего критериям МКБ-10.
Критериями включения пациентов в исследование были:
• возраст – от 18 до 65 лет;
• соответствие клинической картины наблюдаемого расстройства депрессии тяжелой и средней тяжести;
• информированное согласие на участие в исследовании.
В качестве критериев исключения рассматривали состояния, не позволяющие выполнить психопатологическое обследование в необходимом объеме:
• манифестные психозы (органические/эндогенные);
• деменцию;
• зависимость от психоактивных веществ;
• хронические заболевания печени;
• другие тяжелые соматические заболевания в стадии декомпенсации.
Прием лекарственных средств, алкоголя, продуктов, содержащих грейпфрут, а также курение были исключены за 1 нед до начала приема препарата.
Все пациенты при поступлении в стационар прошли полное клиническое обследование.
В исследуемой группе пациентов применялись следующие антидепрессанты:
• амитриптилин – 12 (35,29%) пациентов;
• кломипрамин – 1 (2,94%) пациент;
• имипрамин – 2 (5,88%) пациента;
• флувоксамин – 8 (23,54%) пациентов;
• миртазапин – 6 (17,65%) пациентов;
• венлафаксин – 2 (5,88%) пациента;
• пароксетин – 3 (8,82%) пациента.
26 пациентов до поступления в стационар находились на поддерживающей терапии, 8 пациентов были первичными.
При обследовании больных, включенных в выборку, использовали клинический метод – изучение данных катамнеза длительностью 1–3 года. Наряду с клиническим методом для оценки выраженности депрессивного состояния и его динамики в процессе терапии использовали объективный психометрический инструментарий: шкалу Монтгомери–Асберг (Montgomery–Asberg Depression Rating Scale, MARDS) для оценки тяжести депрессии и ее динамики в результате проводимой терапии [11].
Для оценки переносимости лекарств использовали шкалу нежелательных побочных явлений UKU (Udvald for Kliniske Undersogelser Scale) [12]. Опросник содержит список из 26 побочных эффектов и отдельную графу «другие побочные эффекты». Для настоящего исследования шкала была модифицирована, были удалены графы, не значимые для исследования антидепрессантов. Наличие и выраженность симптомов оценивались в баллах от 0 до 3. Большинство симптомов требовало оценки на момент обследования, но учитывалось состояние пациента в интервале 3 прошедших дней (менструальный синдром, масса тела, судороги, физическая и психическая зависимость). При расхождении между субъективными жалобами и клиническими признаками, обнаруженными объективно, приоритет отдавали данным клинических наблюдений.
Оценку вероятности связи между симптомами и приемом препарата проводили на основании полученных сведений о пациенте и клиническом суждении о симптомах.
Исследование проводили на 0, 7, 14, 21, 28, 35, 42 и 49-е сутки пребывания пациентов в клинике по шкалам MARDS и UKU в те же сроки, начиная с 7-х суток. Сравнивали изменения показателей шкалы MARDS в начале и в конце исследования и абсолютные показатели шкалы UKU каждые 7 дней, начиная с 7-го дня терапии.
Взятие крови для фармакогенетического исследования осуществляли из кубитальной вены в количестве 5 мл в пробирки с этилендиаминтетраацетатом. Образцы цельной крови и плазмы замораживали и хранили при температуре -20°С до проведения количественного анализа.
ДНК выделяли из цельной крови с помощью наборов Fermentas. Праймеры были подобраны с помощью компьютерной программы «PrimerSelect» версия 4.05 ©DNAStar Inc. Подбор проводился на матрице из банка данных Национального центра биотехнологической информации США, содержащей полную последовательность гена MDR1, CYP2D6, включая все экзоны и интроны, референтный номер NT_007933.
Полимеразную цепную реакцию проводили на амплификаторе модели «Терцик» («ДНК-Технология», Россия) в 12,5 мкл реакционной смеси, содержащей буфер для термостабильной ДНК-полимеразы, 0,2 мМ каждого dNTP, по 10 пикомоль каждого из праймеров, 1–2 мкл раствора геномной ДНК и 0,5 единицы термостабильной ДНК-полимеразы. Концентрацию хлорида магния подбирали эмпирически: она составила 2,0 мМ.
Первый сегмент программы состоял из денатурации геномной ДНК, которую осуществляли при 95°С в течение
3 мин. Затем следовали 35 циклов, каждый из которых состоял из 3 стадий: денатурации, отжига и синтеза. Денатурацию проводили в течение 10 с при 95°С, отжиг – 40 с при 65°С, синтез – 15 с при 72°С.
Аллели разных полиморфных маркеров гена MDR1 идентифицировали путем обработки продуктов полимеразной цепной реакции соответствующими рестриктазами, названия которых и размеры продуктов, получающихся в результате рестрикции, указаны в табл. 1.
Рестриктаза опознавала и разрезала аллель «С».
Для рестрикции в смесь добавляли 1 мкл 10-кратного буфера R, 8 мкл амплификационной смеси, содержащей примерно от 50 до 100 мкг продукта, 2 единицы активности фермента MboI (0,2 мкл при концентрации фермента
10 е.а./мкл), 0,8 мкл бидистиллированной воды. Смесь покрывали минеральным маслом и инкубировали в течение ночи при 37°С.
Фрагменты ДНК после амплификации или рестрикции наносили на полиакриламидный гель. Для продуктов амплификации использовали 5% гель, для рестрикционных фрагментов – 10% гель. Напряженность электрического поля составила 10 В/см. Время, необходимое для полноценного разделения продуктов, рассчитывали, исходя из расстояния, пройденного лидирующими маркерными красителями, – бромфеноловым синим и ксиленцианолом, входящими в состав буфера для внесения проб в гель. По окончании электрофореза гели окрашивали раствором бромистого этидия (0,5 мкг/мл) в течение 10 мин и визуализировали на трансиллюминаторе TCХ-15 M («Vilber Lourmat», Франция) в ультрафиолетовом свете при длине волны 312 нм.
Электрофорез проводили в вертикальной камере VE-4 («ДНК-Технология», Россия) с использованием буфера ТВЕ по следующей схеме: к пробам в объеме 4,5 мкл (в случае продуктов амплификации) или 10 мкл (в случае продуктов рестрикции) добавляли 1/5 объема буфера для внесения проб в гель. Полученную смесь наносили в лунки геля при помощи специального наконечника с вытянутым кончиком. Размер фрагментов определяли с помощью маркеров молекулярного веса, наносимых в количестве 150 нг на дорожку.
Статистическую обработку выполняли с помощью пакетов статистических программ Instat Graf и Microsoft Excel. При анализе зависимости исследуемых показателей от генотипа больных в программу вводили значения А, В, где А – количество лиц с наличием и В – с отсутствием данного аллеля (генотипа) среди пациентов. Методы описательной статистики включали в себя оценку среднего арифметического (М), ошибки среднего значения (m) – для признаков, имеющих непрерывное распределение, а также для частоты встречаемости признаков с дискретными значениями. Определение достоверности различий между качественными показателями сравниваемых групп проводили с помощью критерия c2 с учетом поправки Йетса для сравнения частот бинарного признака в двух несвязанных группах парных сравнений. Для оценки различий значений количественных показателей в разных группах применяли t-критерий Стьюдента для независимых выборок (после проверки распределения признаков на соответствие закону нормального распределения по критерию Колмогорова–Смирнова) или непараметрический U-критерий Манна–Уитни.
Критический уровень достоверности нулевой статистической гипотезы принимали равным 0,05.
Результаты
Оценка распределения пациентов по частоте встречаемости исследуемых аллелей продемонстрировала, что 3/4 (76,5%) пациентов имели генотип СYP2D6*1/*1, у 20,6% обследуемых больных с депрессией был выявлен генотип СYP2D6*1/*4, только у 1 (2,9%) пациента был выявлен генотип СYP2D6*4/4 (табл. 2).
Изучение распределения больных по частоте встречаемости генотипов по полиморфному маркеру С3435Т гена MDR1 дало следующие результаты: генотип СС обнаружен у 10 (29,4%) пациентов, генотип СТ – у 19 (55,9%) пациентов, генотип ТТ обнаружен в 5 (14,7%) случаях (см. табл. 2).
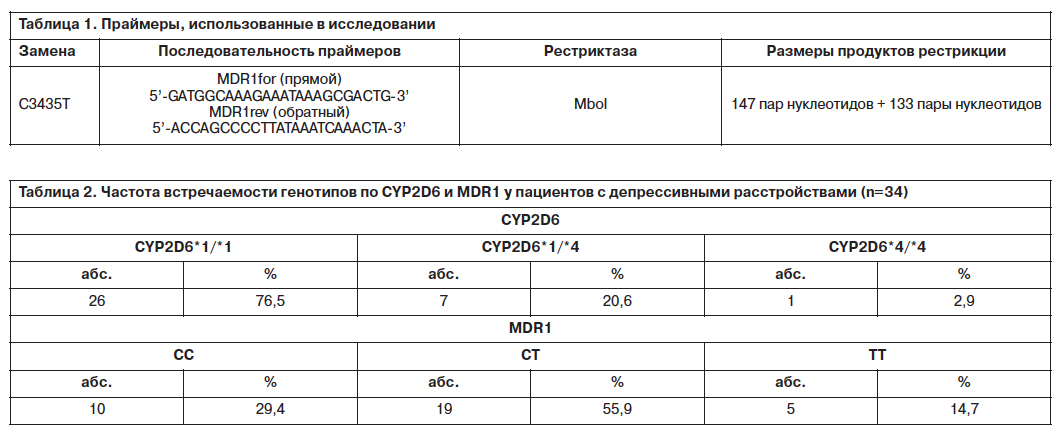
Исследование динамики показателей эффективности антидепрессантов показало выраженное статистически значимое снижение общего количества баллов по шкале MARDS (табл. 3, 4) независимо от генотипов по CYP2D6 и MDR1 (рис. 1).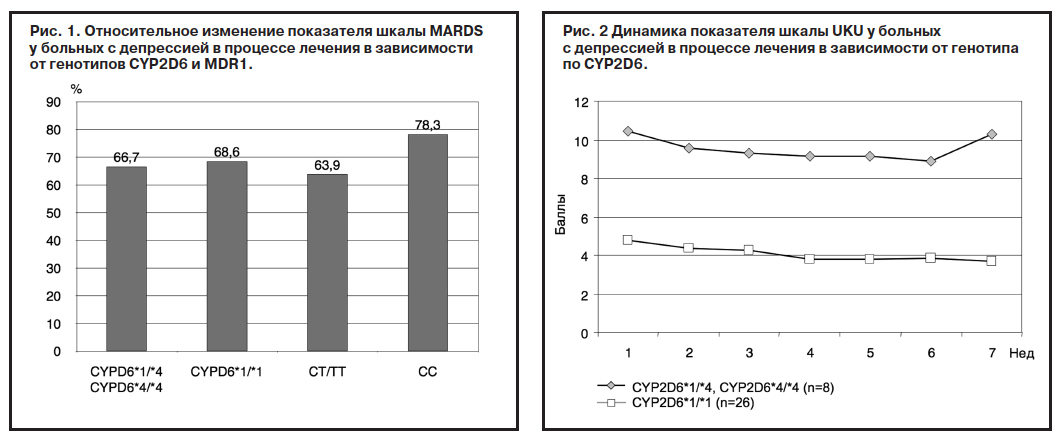
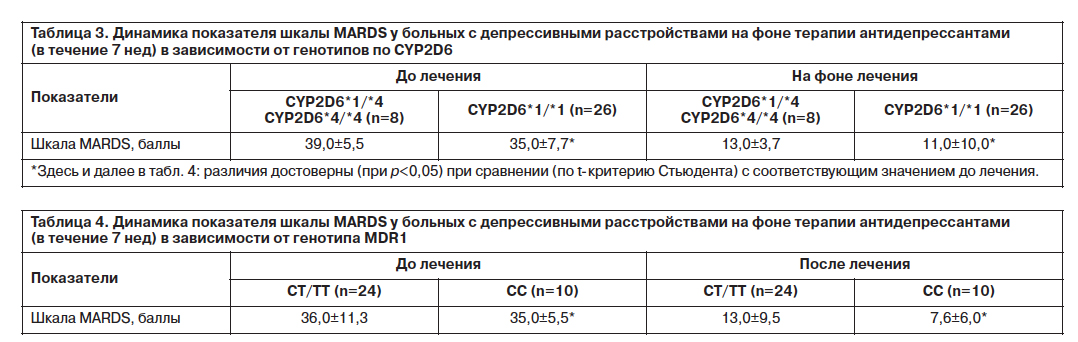
Сравнение показателей шкалы UKU в разные сроки исследования показало различия этого показателя во все сроки исследования у больных с депрессией в зависимости от генотипа по СYP2D6 (рис. 2). Так, значения этого показателя на 1–3-й неделе терапии у пациентов с генотипами СYP2D6*1/*4 и СYP2D6*4/*4 колебались в диапазоне 9,1–9,6 балла, что во все сроки исследования было достоверно (p<0,05) выше соответствующих значений в группе больных с генотипом СYP2D6*1/*1, у которых значения шкалы UKU колебались в диапазоне 3,8–4,4 балла. Аналогичным были различия этого показателя в зависимости от генотипа по CYP2D6 и в последующие сроки (4–6-я неделя исследования). Так, на 6-й неделе терапии у больных с депрессией с генотипами СYP2D6*1/*4 и СYP2D6*4/*4 данный показатель составил 10,3±5,1 балла, в то время как в группе пациентов с генотипом СYP2D6*1/*1 значение показателя было в 2,8 раза ниже (p<0,0002), составив 3,7±3,1 балла.
Сравнение динамики показателя шкалы UKU в зависимости от распределения больных с депрессией по полиморфному маркеру С3435Т гена MDR1 показало, что во все сроки исследования (от 0 до 6-й недели) его значения были в 1,5–1,9 раза ниже в группе больных с генотипом CC по сравнению с пациентами с генотипами CT и TT (рис. 3). Однако значимых межгрупповых отличий выявлено не было, что обусловлено, на наш взгляд, малым размером выборки.
Обсуждение
Несмотря на достижения фармакогенетики как науки, на сегодняшний день имеются лишь единичные попытки использования этих знаний в регламентах, стандартах и рекомендациях по оказанию медицинской помощи больным с психическими расстройствами. Отсутствие должного понимания функциональной вариабельности ферментных систем метаболизма лекарственных средств и подход «одна доза для всех» остаются недостатками оказания психиатрической помощи [5, 13, 14]. В ряде исследований было показано, что «медленные» метаболизаторы по CYP2D6 являются носителями функционально дефектных аллельных вариантов гена CYP2D6 – это пациенты с генотипами CYP2D6*1/*4 и CYP2D6*4/*4 [5, 8–10, 15]. T.Rau и соавт. (2004 г.) выявили, что частота аллельного варианта CYP2D6*4 среди пациентов (20%), у которых наблюдались нежелательные лекарственные реакции при приеме трициклических антидепрессантов (гипотензия, седативный эффект, тремор, кардиотоксичность), была почти в 3 раза выше по сравнению с пациентами (7%), у которых терапия этими препаратами протекала без осложнений [15].
Эти данные согласуются с полученными нами результатами: у больных с генотипом CYP2D6*1/*1 уровни показателя шкалы UKU были значимо ниже в течение всего курса терапии (это значит, что фармакотерапия была более безопасна), чем у пациентов с генотипами СYP2D6*1/*4 и СYP2D6*4/*4. При сравнении динамики показателя шкалы MARDS в зависимости от генотипа по полиморфному маркеру С3425Т гена MDR1 более выраженные изменения были установлены у пациентов с аллелем CC, но это было лишь тенденцией, статистически значимых различий между пациентами с разными генотипами по MDR1 не отмечалось. Вероятно, отсутствие значимых различий между значениями в группах больных может быть объяснено малым размером выборки.
Заключение
Целью данного исследования являлось проведение оценки ассоциации генетических полиморфизмов CYP2D6 и MDR1 с параметрами эффективности и безопасности антидепрессантов у пациентов с депрессивными расстройствами. В результате проведенного исследования выявлена взаимосвязь между наличием у пациента генотипов СYP2D6*1/*4 и СYP2D6*4/*4 и выраженностью проявления НЛР. Отмечается также тенденция к замедленной динамике показателей шкалы MARDS у пациентов с аллелем СС гена MDR1.
Полученные результаты согласуются с приведенными выше данными ряда авторов [3–7] и свидетельствуют о необходимости проведения дальнейших исследований в этом направлении с включением большего количества пациентов и использованием широкого набора методов и показателей, включая «расширение линейки» генов-кандидатов (например, в нашей работе мы не проводили генотипирования по CYP2C19). Можно предполагать, что в перспективе полученные данные будут способствовать снижению длительности индивидуального подбора антидепрессанта, что в свою очередь снизит частоту неблагоприятных побочных реакций, сократит количество койко-дней и, соответственно, повысит экономическую эффективность лечения больных с депрессией.
Сведения об авторах
Кукес Владимир Григорьевич – д-р мед. наук, проф., акад. РАМН, рук. отд. персонализированной медицины и клинической фармакогенетики ЦКФ НЦ ЭСМП Минздрава России, зав. каф. клинической фармакологии и пропедевтики внутренних болезней ГБОУ ВПО Первый МГМУ им. И.М.Сеченова Минздрава России. E-mail: elmed@yandex.ru
Иванец Николай Николаевич – д-р мед. наук, проф., чл.-кор. РАМН, зав. каф. психиатрии и наркологии ГБОУ ВПО Первый МГМУ им. И.М.Сеченова Минздрава России. E-mail: nivanets@mail.ru
Сычев Дмитрий Алексеевич – д-р мед. наук, проф. каф. клинической фармакологии и пропедевтики внутренних болезней ГБОУ ВПО Первый МГМУ им. И.М.Сеченова Минздрава России. E-mail dimasychev@mail.ru
Казаков Руслан Евгеньевич – канд. биол. наук, вед. науч. сотр. ЦКФ НЦ ЭСМП Минздрава России. E-mail rustic100@rambler.ru
Псарева Нелли Александровна – аспирант каф. клинической фармакологии и пропедевтики внутренних болезней ГБОУ ВПО Первый МГМУ им. И.М.Сеченова Минздрава России. E-mail nelly311@mail.ru
Ключевые слова: депрессивные расстройства, антидепрессанты, генетический полиморфизм, безопасность терапии, фармакогенетическое тестирование.
The influence of CYP2D6 and MDR1 genetic polymorphism on the antidepressant therapy efficacy and safety in patients with depressive disorders in a psychiatric hospital
V.G.Kukes, N.N.Ivanets, D.A.Sychev, R.E.Kazakov, N.A.Psareva
I.M.Sechenov First Moscow State Medical University, Ministry of Health of the Russian Federation, Department of personalized medicine and clinical pharmacogenetics CCP SC ESMP, Ministry of Health of the Russian Federation
Summary. It was conducted the investigation of the genetic polymorphisms in CYP2D6 and MDR1 association with the efficacy and safety of antidepressant treatment in a psychiatric hospital. It is shown that depressed patients with genotype CYP2D6*1/*1 level indicator UKU scale (Udvald for Kliniske Undersogelser Scale) were significantly lower during the entire course of therapy, therefore, pharmacotherapy was more secure than in patients with genotypes SYP2D6*1/*4*4 and SYP2D6/*4. The comparison of the MARDS scale (Montgomery–Asberg Depression Rating Scale) of dynamics depending on the genotype at the polymorphic marker S3425T gene MDR1 showed more pronounced changes in patients with allele CC. The results confirm the need for further pharmacogenetic studies for individual selection of an antidepressant that will help to reduce the frequency of adverse reactions and improve the cost-effectiveness of treatment for depression.
Key words: depressive disorder, antidepressants, genetic polymorphism, the safety of therapy, pharmacogenetic testing.
Введение
По данным Всемирной организации здравоохранения, ежегодно 25% населения Европейского союза (ЕС) страдают от депрессий или тревожных состояний. Психоневрологические нарушения обусловливают около 19,5% бремени болезней в европейском регионе, эта цифра достигает 26% в ЕС. Эти нарушения являются в 40% случаев причиной лет, прожитых с инвалидностью, причем депрессия является лидирующей причиной. До 50% длительных отпусков по болезни связано с депрессией/тревожными состояниями, при этом примерно в 50% случаев серьезные депрессии остаются нелеченными [1, 2]. Расстройства настроения и тревожные состояния обходятся ЕС в сумму размером около 170 млрд евро в год. В США, согласно данным Американской психиатрической ассоциации, депрессией страдают 15 млн человек. Ежегодный ущерб экономике США от депрессий оценивается более чем в 50 млрд дол. США [2, 3]. Согласно резолюции Всероссийской конференции с международным участием «Психическое здоровье населения как основа национальной безопасности России» (2012 г.) учетная распространенность психических расстройств в Российской Федерации составляет более 4 млн человек.
Известно, что большинство антидепрессантов метаболизируется в печени с помощью изоферментов цитохрома Р-450 2D6 (CYP2D6) и 2С19 (CYP2C19), поэтому полиморфизмы в данных генах в виде носительства функционально дефектных аллелей могут обусловливать более высокие значения концентраций антидепрессантов в крови и, как следствие, приводить к развитию неблагоприятных побочных реакций вплоть до серьезных [4–9]. Показано, что в РФ распространенность генотипов, ассоциированных с низкой активностью CYP2D6 (гетеро- и гомозиготы по функционально дефектным аллелям, а в европейских популяциях наиболее распространен CYP2D6*4), достигает 20–25% [5].
Эффективность и безопасность антидепрессантов в настоящее время связывают с уровнем их проникновения через гематоэнцефалический барьер в центральной нервной системе. При этом транспортный белок Р-гликопротеин (Р-gp), локализованный на апикальной мембране эндотелиоцитов церебральных сосудов и кодирующийся геном MDR1, не «допускает» некоторое количество антидепрессантов-субстратов Р-gp в центральной нервной системе. Очевидно, что генетический полиморфизм MDR1, который может приводить к снижению активности Р-gp и, как следствие, к более интенсивному проникновению препаратов в центральную нервную систему, может быть ассоциирован как с более высокой эффективностью, так и с развитием «центральных» нежелательных лекарственных реакций (НЛР) [4, 10].
Поскольку в психиатрической практике подбор антидепрессантов, как правило, сопряжен с продолжительным пребыванием пациентов в стационаре вследствие необходимости подбора наиболее эффективного и безопасного препарата при терапии депрессивного расстройства или замены лекарственного средства из-за неэффективности или плохой переносимости препарата, проблема оценки индивидуальной чувствительности к проводимой терапии является высокоактуальной для персонализированного подхода к фармакотерапии конкретного пациента. Очевидно, что одним из путей повышения эффективности и безопасности фармакотерапии антидепрессантами может стать персонализация выбора лекарственного средства в зависимости от результатов генотипирования (т.е. фармакогенетического тестирования) по CYP2D6, CYP2C19, MDR1 [5–7]. Подобные исследования проводятся за рубежом, однако в РФ работы в области клинической фармакогенетики антидепрессантов единичны [3, 5–7].
Цель работы – оценить ассоциации генетических полиморфизмов CYP2D6 и MDR1 с параметрами эффективности и безопасности антидепрессантов у пациентов с депрессивными расстройствами в условиях психиатрического стационара.
В работе использованы данные, полученные при лечении больных, госпитализированных в 2012 г. в Клинику психиатрии им. С.С.Корсакова ГБОУ ВПО Первый Московский государственный медицинский университет
им. И.М.Сеченова Минздрава России по поводу депрессивных расстройств. Выборка включает 34 пациента: 7 (20,6%) мужчин и 27 (79,4%) женщин; средний возраст составил 39,5±21,5 года.
При отборе больных использовали диагностические критерии Международной классификации болезней 10-го пересмотра (МКБ-10) под рубриками: F31 Биполярное расстройство – 5 (14,7%) пациентов; F32 Депрессивный эпизод – 3 (8,8%) пациента; F33 Рекуррентное депрессивное расстройство – 24 (70,59%) пациента; F43 Реакции на тяжелый стресс и нарушение адаптации – 2 (5,9%) пациента. Выборку формировали на основании констатации на момент осмотра депрессивного расстройства, соответствующего критериям МКБ-10.
Критериями включения пациентов в исследование были:
• возраст – от 18 до 65 лет;
• соответствие клинической картины наблюдаемого расстройства депрессии тяжелой и средней тяжести;
• информированное согласие на участие в исследовании.
В качестве критериев исключения рассматривали состояния, не позволяющие выполнить психопатологическое обследование в необходимом объеме:
• манифестные психозы (органические/эндогенные);
• деменцию;
• зависимость от психоактивных веществ;
• хронические заболевания печени;
• другие тяжелые соматические заболевания в стадии декомпенсации.
Прием лекарственных средств, алкоголя, продуктов, содержащих грейпфрут, а также курение были исключены за 1 нед до начала приема препарата.
Все пациенты при поступлении в стационар прошли полное клиническое обследование.
В исследуемой группе пациентов применялись следующие антидепрессанты:
• амитриптилин – 12 (35,29%) пациентов;
• кломипрамин – 1 (2,94%) пациент;
• имипрамин – 2 (5,88%) пациента;
• флувоксамин – 8 (23,54%) пациентов;
• миртазапин – 6 (17,65%) пациентов;
• венлафаксин – 2 (5,88%) пациента;
• пароксетин – 3 (8,82%) пациента.
26 пациентов до поступления в стационар находились на поддерживающей терапии, 8 пациентов были первичными.
При обследовании больных, включенных в выборку, использовали клинический метод – изучение данных катамнеза длительностью 1–3 года. Наряду с клиническим методом для оценки выраженности депрессивного состояния и его динамики в процессе терапии использовали объективный психометрический инструментарий: шкалу Монтгомери–Асберг (Montgomery–Asberg Depression Rating Scale, MARDS) для оценки тяжести депрессии и ее динамики в результате проводимой терапии [11].
Для оценки переносимости лекарств использовали шкалу нежелательных побочных явлений UKU (Udvald for Kliniske Undersogelser Scale) [12]. Опросник содержит список из 26 побочных эффектов и отдельную графу «другие побочные эффекты». Для настоящего исследования шкала была модифицирована, были удалены графы, не значимые для исследования антидепрессантов. Наличие и выраженность симптомов оценивались в баллах от 0 до 3. Большинство симптомов требовало оценки на момент обследования, но учитывалось состояние пациента в интервале 3 прошедших дней (менструальный синдром, масса тела, судороги, физическая и психическая зависимость). При расхождении между субъективными жалобами и клиническими признаками, обнаруженными объективно, приоритет отдавали данным клинических наблюдений.
Оценку вероятности связи между симптомами и приемом препарата проводили на основании полученных сведений о пациенте и клиническом суждении о симптомах.
Исследование проводили на 0, 7, 14, 21, 28, 35, 42 и 49-е сутки пребывания пациентов в клинике по шкалам MARDS и UKU в те же сроки, начиная с 7-х суток. Сравнивали изменения показателей шкалы MARDS в начале и в конце исследования и абсолютные показатели шкалы UKU каждые 7 дней, начиная с 7-го дня терапии.
Взятие крови для фармакогенетического исследования осуществляли из кубитальной вены в количестве 5 мл в пробирки с этилендиаминтетраацетатом. Образцы цельной крови и плазмы замораживали и хранили при температуре -20°С до проведения количественного анализа.
ДНК выделяли из цельной крови с помощью наборов Fermentas. Праймеры были подобраны с помощью компьютерной программы «PrimerSelect» версия 4.05 ©DNAStar Inc. Подбор проводился на матрице из банка данных Национального центра биотехнологической информации США, содержащей полную последовательность гена MDR1, CYP2D6, включая все экзоны и интроны, референтный номер NT_007933.
Полимеразную цепную реакцию проводили на амплификаторе модели «Терцик» («ДНК-Технология», Россия) в 12,5 мкл реакционной смеси, содержащей буфер для термостабильной ДНК-полимеразы, 0,2 мМ каждого dNTP, по 10 пикомоль каждого из праймеров, 1–2 мкл раствора геномной ДНК и 0,5 единицы термостабильной ДНК-полимеразы. Концентрацию хлорида магния подбирали эмпирически: она составила 2,0 мМ.
Первый сегмент программы состоял из денатурации геномной ДНК, которую осуществляли при 95°С в течение
3 мин. Затем следовали 35 циклов, каждый из которых состоял из 3 стадий: денатурации, отжига и синтеза. Денатурацию проводили в течение 10 с при 95°С, отжиг – 40 с при 65°С, синтез – 15 с при 72°С.
Аллели разных полиморфных маркеров гена MDR1 идентифицировали путем обработки продуктов полимеразной цепной реакции соответствующими рестриктазами, названия которых и размеры продуктов, получающихся в результате рестрикции, указаны в табл. 1.

Рестриктаза опознавала и разрезала аллель «С».
Для рестрикции в смесь добавляли 1 мкл 10-кратного буфера R, 8 мкл амплификационной смеси, содержащей примерно от 50 до 100 мкг продукта, 2 единицы активности фермента MboI (0,2 мкл при концентрации фермента
10 е.а./мкл), 0,8 мкл бидистиллированной воды. Смесь покрывали минеральным маслом и инкубировали в течение ночи при 37°С.
Электрофорез проводили в вертикальной камере VE-4 («ДНК-Технология», Россия) с использованием буфера ТВЕ по следующей схеме: к пробам в объеме 4,5 мкл (в случае продуктов амплификации) или 10 мкл (в случае продуктов рестрикции) добавляли 1/5 объема буфера для внесения проб в гель. Полученную смесь наносили в лунки геля при помощи специального наконечника с вытянутым кончиком. Размер фрагментов определяли с помощью маркеров молекулярного веса, наносимых в количестве 150 нг на дорожку.
Статистическую обработку выполняли с помощью пакетов статистических программ Instat Graf и Microsoft Excel. При анализе зависимости исследуемых показателей от генотипа больных в программу вводили значения А, В, где А – количество лиц с наличием и В – с отсутствием данного аллеля (генотипа) среди пациентов. Методы описательной статистики включали в себя оценку среднего арифметического (М), ошибки среднего значения (m) – для признаков, имеющих непрерывное распределение, а также для частоты встречаемости признаков с дискретными значениями. Определение достоверности различий между качественными показателями сравниваемых групп проводили с помощью критерия c2 с учетом поправки Йетса для сравнения частот бинарного признака в двух несвязанных группах парных сравнений. Для оценки различий значений количественных показателей в разных группах применяли t-критерий Стьюдента для независимых выборок (после проверки распределения признаков на соответствие закону нормального распределения по критерию Колмогорова–Смирнова) или непараметрический U-критерий Манна–Уитни.
Критический уровень достоверности нулевой статистической гипотезы принимали равным 0,05.
Результаты
Оценка распределения пациентов по частоте встречаемости исследуемых аллелей продемонстрировала, что 3/4 (76,5%) пациентов имели генотип СYP2D6*1/*1, у 20,6% обследуемых больных с депрессией был выявлен генотип СYP2D6*1/*4, только у 1 (2,9%) пациента был выявлен генотип СYP2D6*4/4 (табл. 2).
Изучение распределения больных по частоте встречаемости генотипов по полиморфному маркеру С3435Т гена MDR1 дало следующие результаты: генотип СС обнаружен у 10 (29,4%) пациентов, генотип СТ – у 19 (55,9%) пациентов, генотип ТТ обнаружен в 5 (14,7%) случаях (см. табл. 2).

Исследование динамики показателей эффективности антидепрессантов показало выраженное статистически значимое снижение общего количества баллов по шкале MARDS (табл. 3, 4) независимо от генотипов по CYP2D6 и MDR1 (рис. 1).

Сравнение показателей шкалы UKU в разные сроки исследования показало различия этого показателя во все сроки исследования у больных с депрессией в зависимости от генотипа по СYP2D6 (рис. 2). Так, значения этого показателя на 1–3-й неделе терапии у пациентов с генотипами СYP2D6*1/*4 и СYP2D6*4/*4 колебались в диапазоне 9,1–9,6 балла, что во все сроки исследования было достоверно (p<0,05) выше соответствующих значений в группе больных с генотипом СYP2D6*1/*1, у которых значения шкалы UKU колебались в диапазоне 3,8–4,4 балла. Аналогичным были различия этого показателя в зависимости от генотипа по CYP2D6 и в последующие сроки (4–6-я неделя исследования). Так, на 6-й неделе терапии у больных с депрессией с генотипами СYP2D6*1/*4 и СYP2D6*4/*4 данный показатель составил 10,3±5,1 балла, в то время как в группе пациентов с генотипом СYP2D6*1/*1 значение показателя было в 2,8 раза ниже (p<0,0002), составив 3,7±3,1 балла.

Обсуждение
Несмотря на достижения фармакогенетики как науки, на сегодняшний день имеются лишь единичные попытки использования этих знаний в регламентах, стандартах и рекомендациях по оказанию медицинской помощи больным с психическими расстройствами. Отсутствие должного понимания функциональной вариабельности ферментных систем метаболизма лекарственных средств и подход «одна доза для всех» остаются недостатками оказания психиатрической помощи [5, 13, 14]. В ряде исследований было показано, что «медленные» метаболизаторы по CYP2D6 являются носителями функционально дефектных аллельных вариантов гена CYP2D6 – это пациенты с генотипами CYP2D6*1/*4 и CYP2D6*4/*4 [5, 8–10, 15]. T.Rau и соавт. (2004 г.) выявили, что частота аллельного варианта CYP2D6*4 среди пациентов (20%), у которых наблюдались нежелательные лекарственные реакции при приеме трициклических антидепрессантов (гипотензия, седативный эффект, тремор, кардиотоксичность), была почти в 3 раза выше по сравнению с пациентами (7%), у которых терапия этими препаратами протекала без осложнений [15].
Эти данные согласуются с полученными нами результатами: у больных с генотипом CYP2D6*1/*1 уровни показателя шкалы UKU были значимо ниже в течение всего курса терапии (это значит, что фармакотерапия была более безопасна), чем у пациентов с генотипами СYP2D6*1/*4 и СYP2D6*4/*4. При сравнении динамики показателя шкалы MARDS в зависимости от генотипа по полиморфному маркеру С3425Т гена MDR1 более выраженные изменения были установлены у пациентов с аллелем CC, но это было лишь тенденцией, статистически значимых различий между пациентами с разными генотипами по MDR1 не отмечалось. Вероятно, отсутствие значимых различий между значениями в группах больных может быть объяснено малым размером выборки.
Заключение
Целью данного исследования являлось проведение оценки ассоциации генетических полиморфизмов CYP2D6 и MDR1 с параметрами эффективности и безопасности антидепрессантов у пациентов с депрессивными расстройствами. В результате проведенного исследования выявлена взаимосвязь между наличием у пациента генотипов СYP2D6*1/*4 и СYP2D6*4/*4 и выраженностью проявления НЛР. Отмечается также тенденция к замедленной динамике показателей шкалы MARDS у пациентов с аллелем СС гена MDR1.
Полученные результаты согласуются с приведенными выше данными ряда авторов [3–7] и свидетельствуют о необходимости проведения дальнейших исследований в этом направлении с включением большего количества пациентов и использованием широкого набора методов и показателей, включая «расширение линейки» генов-кандидатов (например, в нашей работе мы не проводили генотипирования по CYP2C19). Можно предполагать, что в перспективе полученные данные будут способствовать снижению длительности индивидуального подбора антидепрессанта, что в свою очередь снизит частоту неблагоприятных побочных реакций, сократит количество койко-дней и, соответственно, повысит экономическую эффективность лечения больных с депрессией.
Сведения об авторах
Кукес Владимир Григорьевич – д-р мед. наук, проф., акад. РАМН, рук. отд. персонализированной медицины и клинической фармакогенетики ЦКФ НЦ ЭСМП Минздрава России, зав. каф. клинической фармакологии и пропедевтики внутренних болезней ГБОУ ВПО Первый МГМУ им. И.М.Сеченова Минздрава России. E-mail: elmed@yandex.ru
Иванец Николай Николаевич – д-р мед. наук, проф., чл.-кор. РАМН, зав. каф. психиатрии и наркологии ГБОУ ВПО Первый МГМУ им. И.М.Сеченова Минздрава России. E-mail: nivanets@mail.ru
Сычев Дмитрий Алексеевич – д-р мед. наук, проф. каф. клинической фармакологии и пропедевтики внутренних болезней ГБОУ ВПО Первый МГМУ им. И.М.Сеченова Минздрава России. E-mail dimasychev@mail.ru
Казаков Руслан Евгеньевич – канд. биол. наук, вед. науч. сотр. ЦКФ НЦ ЭСМП Минздрава России. E-mail rustic100@rambler.ru
Псарева Нелли Александровна – аспирант каф. клинической фармакологии и пропедевтики внутренних болезней ГБОУ ВПО Первый МГМУ им. И.М.Сеченова Минздрава России. E-mail nelly311@mail.ru
Список исп. литературыСкрыть список1. Зотов П.Б., Уманский М.С. Депрессия в общемедицинской практике (клиника, диагностика, лекарственная терапия). Методическое пособие для врачей. М., 2006.
2. Thieme D, Rolf B, Sachs H, Schmid D. Correlation of inter-individual variations of amitriptyline metabolism examined in hairs with CYP2C19 and CYP2D6 polymorphisms. Int J Legal Med 2008; 122 (2): 149–55.
3. Кукес В.Г., Грачев С.В., Сычев Д.А., Раменская Г.В. Метаболизм лекарственных средств. Научные основы персонализированной медицины. Руководство для врачей. М.: ГЭОТАР-Медиа, 2008.
4. Murphy PJ. The development of drug metabolism research as expressed in the publications of ASPET: Part 3, 1984–2008. Drug Metab Dispos 2008; 36 (10): 1977–82.
5. Кукес В.Г., Савельева М.И., Ташенова А.И. и др. О необходимости генотипирования по CYP2D6 больных, принимающих антидепрессанты. Клин. фармакология и терапия. 2008; 4: 60–1.
6. Ромодановский Д.П., Кукес В.Г. Полиморфизм гена CYP2D6 и серьезные неблагоприятные побочные эффекты антидепрессантов в условиях многопрофильного стационара. Материалы VI съезда Российского общества медицинских генетиков (Ростов-на-Дону, 14–18 мая 2010 г.). Мед. генетика. 2010;
с. 153.
7. Сычев Д.А., Алеева Г.Н., Ромодановский Д.П., Кукес В.Г. Генетический полиморфизм CYP2D6 не влияет на фармакокинетику оригинального российского антидепрессанта пипофезина у пациентов с легкой и среднетяжелой депрессией. Материалы 5-й Международной конференции «Биологические основы индивидуальной чувствительности к психотропным средствам (Московская область, 1–4 июня 2010 г.). Эксперим. и клин. фармакология (Прил.).2010; с. 85.
8. De Vos A, Van der Weide J, Loovers HM. Association between CYP2C19*17 and metabolism of amitriptyline, citalopram and clomipramine in Dutch hospitalized patients. Pharmacogenomics J 2011; 11 (5): 359–67.
9. Grasmader K, Verwohlt PL, Rietschel M et al. Impact of polymorphisms of cytochrome-P-450 isoenzymes 2C9, 2C19 and 2D6 on plasma concentrations and clinical effects of antidepressants in a naturalistic clinical setting. Eur J Clin Pharmacol 2004; 60 (5): 329–36.
10. Van der Weide J, Van Baalen-Benedek EH, Kootstra-Ros JE. Metabolic ratios of psychotropics as indication of cytochrome P-450 2D6/2C19 genotype. Ther Drug Monit 2005; 27 (4): 478–83.
11. Montgomery SA, Asberg M. A new depression scale designed to be sensitive to change. Br J Psychiatr 1979; 134: 382–9.
12. Lingjarde O, Ahlfors UG, Bech P. The UKU side effect rating scale. A new comprehensive rating. Acta Psychiatr Scand (Suppl.) 1987; 334: 1–100.
13. Murphy PJ. The development of drug metabolism research as expressed in the publications of ASPET: Part 3, 1984–2008. Drug Metab Dispos 2008; 36 (10): 1977–82.
14. Koski A, Sistonen J, Ojanpera I et al. CYP2D6 and CYP2C19 genotypes and amitriptyline metabolite ratios in a series of medicolegal autopsies. Forensic Sci Int 2006; 158 (2–3): 177–83.
15. Rau T, Wohileben G, Wuttke H et al. CYP2D6 genotype: impact on adverse effects and nonresponse during treatment with antidepressants – a pilot study. Clin Pharmacol Ther 2004; 75: 386–93.
26 ноября 2013
Количество просмотров: 3223


