Клинический разбор в акушерстве, гинекологии и репродуктологии №01 2021
1 Separate division Women's Consultation “Pletnev City Clinical Hospital”, Moscow, Russia
2 Moscow Regional Perinatal Center, Balashikha, Russia
strizhova.doc@yandex.ru
Abstract
The role of anti-Muller hormone (AMH) in predicting the outcome of IVF-programs is currently significant. AMH is one of the criteria for a woman's ovarian reserve. At the same time, the level of AMH in the blood serum is considered a fairly reliable indicator for predicting the ovarian response to stimulation, but not for predicting the onset of pregnancy in IVF-cycles. It is necessary to predict the outcomes of treatment of patients with infertility, using a combination of factors to affect reproductive health.
Key words: IVF, anti-Muller hormone, fertility, reduced fertility.
For citation: Strizhova T.V., Sergeeva I.V., Besman I.V., Rudakova E.B. Low anti-Mullerian hormone levels during in vitro fertilization cycles and their significance when combined with other factors affecting fertility. Clinical analysis in obstetrics, gynecology and reproductology. 2021; 1: 36–39. DOI: 10.47407/kragr2021.1.1.00007
Внастоящее время количество лечебных ВРТ-циклов в мире неуклонно растет [1, 2]. В нашей стране лечение бесплодия с 2013 г. стало возможным за счет средств обязательного медицинского страхования. Тем самым программы экстракорпорального оплодотворения (ЭКО) стали более доступными для женщин на территории Российской Федерации. По данным ВРТ-регистра Российской ассоциации репродукции человека (РАРЧ), за 2018 г. выполнено более 145 тыс. ВРТ-циклов. Эффективность программ ЭКО и переноса эмбриона (ПЭ) за истекший период составила 36,5%, а программы переноса размороженных эмбрионов в полость матки имели положительный результат в 42% случаев [3].
Известно о наличии факторов, которые уменьшают вероятность зачатия, тем самым снижая эффективность программ вспомогательных репродуктивных технологий (ВРТ) [1, 3, 4]. При этом на часть таких факторов можно оказывать влияние (отказ от курения, употребления алкоголя, наркотических веществ, кофеина). Такой фактор, как ожирение, снижает эффективность лечения бесплодия в 3 раза, также относится к управляемым факторам [5, 6].
Но существуют факторы, повлиять на которые невозможно. Например, возраст пациентки очень важен при лечении бесплодия. С увеличением возраста будущих родителей повышаются риски, как для матери, так и для плода [1, 7]. Наряду со снижением овариального резерва у женщин старшей возрастной группы повышен процент получения аномальных ооцитов и эмбрионов [1, 8]. Также у возрастных пациенток повышен риск осложнений программ ВРТ и течения самой беременности [1, 7, 8].
Антимюллеров гормон (АМГ) – пептидный гормон, ограничивающий процессы чрезмерного роста в репродуктивных органах мужского и женского организма. На сегодняшний день уровень АМГ является одним из критериев оценки овариального резерва у пациенток, планирующих программы ВРТ [1, 4, 9]. Более того, показатель АМГ менее 1,2 нг/мл является ограничением для базовой программы ЭКО в рамках оказания помощи за счет средств фонда обязательного медицинского страхования [10].
Роль АМГ в исходе программ ВРТ невозможно недооценить. Результативность программ ВРТ в зависимости от уровня АМГ отражена во многих исследованиях. Считают, что снижение овариального резерва, а именно уровня АМГ является предиктором отрицательного результата в программах ЭКО [11, 12]. Следует отметить, что уровень АМГ относится к достаточно надежным показателям для прогнозирования количества полученных ооцитов в процессе стимуляции овариальной стимуляции. Но для прогнозирования наступления беременности в результате программ ВРТ этот показатель использовать некорректно.
Представляем вашему вниманию два клинических случая пациенток с низким уровнем АМГ в сыворотке крови, которые получали лечение методом ЭКО и ПЭ в отделении ВРТ.
 Пациентка В., 33 лет, обратилась в 2017 г. в отделение ВРТ с жалобами на отсутствие беременности в течение 6 лет. По данным опроса, семейный анамнез, аллергоанамнез и наследственность не отягощены. Из перенесенных заболеваний: острый пиелонефрит в возрасте 15 лет. Операции в анамнезе не отмечены. Менструальная функция с 16 лет, цикл каждые 27–29 дней, длительность – 5–6 дней, умеренные, безболезненные. Половая жизнь с 18 лет. Контрацепция – барьерная. Беременностей не было. Брак 1, регистрирован. Супругу 34 года, детей нет. Гинекологические заболевания отрицает. Рост – 170 см, масса тела – 55 кг, индекс массы тела (ИМТ) – 19,03 (норма).
Пациентка В., 33 лет, обратилась в 2017 г. в отделение ВРТ с жалобами на отсутствие беременности в течение 6 лет. По данным опроса, семейный анамнез, аллергоанамнез и наследственность не отягощены. Из перенесенных заболеваний: острый пиелонефрит в возрасте 15 лет. Операции в анамнезе не отмечены. Менструальная функция с 16 лет, цикл каждые 27–29 дней, длительность – 5–6 дней, умеренные, безболезненные. Половая жизнь с 18 лет. Контрацепция – барьерная. Беременностей не было. Брак 1, регистрирован. Супругу 34 года, детей нет. Гинекологические заболевания отрицает. Рост – 170 см, масса тела – 55 кг, индекс массы тела (ИМТ) – 19,03 (норма).
Обследование по поводу бесплодия проходили вместе с супругом периодически, лечение методами ВРТ не использовали. Супружеская пара была обследована согласно действующим приказам и стандартам.
По результатам обследования выявлено следующее:
• гормональный профиль (28.03.2017): фолликулостимулирующий гормон (ФСГ) – 10,4 МЕ/л (норма 3,03–8,08); лютеинизирующий гормон (ЛГ) – 3,24 МЕ/л (1,8–11,78); эстрадиол – 136 пмоль/л (77–921); тестостерон – 1,0 нмоль/л (0,48–1,85); пролактин – 21,2 нг/мл (6–29,9); АМГ – 0,19 нг/мл (0,07–7,35); тиреотропный гормон (ТТГ) – 2,37 мМЕ/л (0,40–4,0); антитела к тиреоидной пероксидазе (АТ-ТПО) – 9,01 МЕ/мл (0–34);
• ультразвуковое исследование органов малого таза на 7-й день менструального цикла (30.03.2017):
УЗ-признаки снижения овариального резерва (по одному антральному фолликулу в каждом яичнике);
• TORCH-комплекс (07.04.2017) – без особенностей;
• инфекции, передаваемые половым путем, – ИППП (13.02.2017): не обнаружены;
• обследование супруга (18.11.2017): спермограмма – нормозооспермия; MAR-тест отрицательный;
• кариотипирование обоих супругов (13.04.2017) – 46ХХ, 46ХУ;
• аспирационная пайпель – биопсия эндометрия (06.09.2017) – по гистологии патологии не выявлено.
Выставлен клинический диагноз «бесплодие первичное эндокринного генеза, преждевременное истощение яичников». Предложена программа ЭКО и ПЭ с использованием ооцитов собственных и донора. Стимуляция овуляции проводилась в протоколе с низкими дозами агонистов рилизинг гормонов с первого дня менструального цикла. Доза гонадотропинов на курс составила 1800 МЕ. Получен рост двух фолликулов. На 14-й день овариальной стимуляции (05.12.2017) произведена трансвагинальная пункция яичников с аспирацией фолликулярной жидкости. Получен один ооцит. Параллельно использовались 4 донорских ооцита (стимуляция собственного донора пациентки). Оплодотворение спермой супруга, методом интрацитоплазматической инъекции сперматозоида в яйцеклетку (ИКСИ – Intra Cytoplasmic Sperm Injection, ICSI). Результат оплодотворения представлен в протоколе культивирования эмбрионов (рис. 1).
На 4-е сутки культивирования (09.12.2017) произведен перенос одного эмбриона (полученного после оплодотворения собственной яйцеклетки) на стадии развития морулы. Эмбрионы после оплодотворения донорских ооцитов имели несоответствие в развитии и подверглись утилизации в связи с непригодностью к переносу в полость матки или их криоконсервации.
На 14-й день посттрансферного периода (22.12.2017) уровень хорионического гонадотропина человека (ХГЧ) в сыворотке крови составил 449,45 мМЕ/мл. На 21-й день после переноса эмбриона (29.12.2017) при ультразвуковом исследовании в полости матки обнаружено плодное яйцо. Выставлен диагноз «беременность малого срока». Пациентка с рекомендациями направлена в женскую консультацию для дальнейшего наблюдения по беременности.
В августе 2018 г. произошли самостоятельные своевременные роды. Родился живой, доношенный мальчик, массой 3150 г, ростом 52 см, оценка по Апгар 8/9 баллов. Послеродовый период без особенностей.
 Пациентка Ш., 41 год, в 2013 г. обратилась в отделение ВРТ с жалобами на отсутствие беременности в течение 2 лет. Из анамнеза: наследственные и хронические заболевания отрицает. Менструальная функция с 13 лет, цикл каждые 28 дней, длительность – 5 дней, умеренные, безболезненные. Половая жизнь с 19 лет. Контрацепция – внутриматочный контрацептив, удален в 39 лет. Беременность – 1, роды – 1 (мальчик умер в возрасте 7 лет – онкологическое заболевание головного мозга). Брак 1, регистрирован. Супругу 42 года.
Пациентка Ш., 41 год, в 2013 г. обратилась в отделение ВРТ с жалобами на отсутствие беременности в течение 2 лет. Из анамнеза: наследственные и хронические заболевания отрицает. Менструальная функция с 13 лет, цикл каждые 28 дней, длительность – 5 дней, умеренные, безболезненные. Половая жизнь с 19 лет. Контрацепция – внутриматочный контрацептив, удален в 39 лет. Беременность – 1, роды – 1 (мальчик умер в возрасте 7 лет – онкологическое заболевание головного мозга). Брак 1, регистрирован. Супругу 42 года.
Гинекологические заболевания: миома матки малых размеров, аденомиоз. Рост 168 см, масса тела – 89 кг, ИМТ – 31,5 (ожирение 1-й степени). Супружеская пара была обследована согласно действующему приказу.
По результатам обследования выявлено следующее:
• гормональный профиль (11.09.2013): ФСГ – 11,4 МЕ/л (норма 3,03–8,08); ЛГ – 5,24 МЕ/л (1,8–11,78); эстрадиол – 108 пмоль/л (77–921); тестостерон – 0,44 нмоль/л (0,48–1,85); пролактин – 18,3 нг/мл (6–29,9); АМГ – 0,12 нг/мл (0,07–7,35); ТТГ – 1,95 мМЕ/л (0,40–4,0); АТ-ТПО – 22,1 МЕ/мл (0–34);
• ультразвуковое исследование органов малого таза на 5-й день менструального цикла (07.10.2013): интерстициальный миоматозный узел по передней стенке матки диаметром 27 мм, полость матки не деформирует. В яичниках до 5 антральных фолликулов. УЗ-признаки миомы матки. Аденомиоз.
• ИППП (23.08.2013): не обнаружены;
• обследование супруга (02.10.2013): спермограмма – нормозооспермия; MAR-тест отрицательный;
• кариотипирование обоих супругов (10.07.2012) – 46ХХ, 46ХУ.
Поставлен диагноз «бесплодие вторичное, сочетанного генеза». Предложена программа ЭКО и ПЭ (от использования донорских ооцитов пациентка отказалась).
Проведена программа ЭКО и ПЭ с использованием низких доз агонистов рилизинг гормона в декабре 2013 г. с положительным результатом. На сроке 6–7 нед неразвивающаяся беременность, произведено abrasio cavi uteri, кариотипирование абортуса – трисомия по 18 хромосоме. Спустя 4 мес у пациентки наступает спонтанная самостоятельная беременность, но, к сожалению, снова происходит прерывание по типу неразвивающейся (кариотипирование абортуса не проводилось).
В августе 2015 г. проведено два цикла искусственной инсеминации спермой мужа. Беременность наступила, но на сроке 7 нед гестации снова замершая.
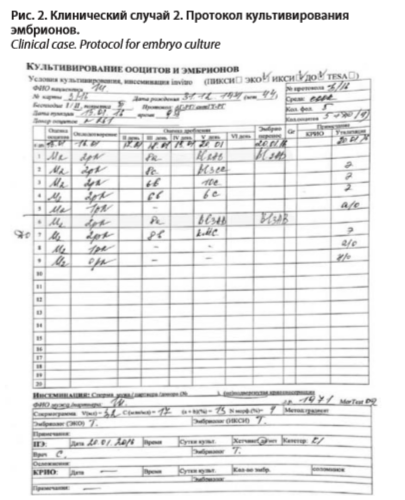
В январе 2016 г. после повторного обследования по действующему приказу пациентка в возрасте 44 лет вступает в протокол овариальной стимуляции с использованием антагонистов рилизинг гормонов. Доза гонадотропинов на курс составила 2100 МЕ. Получен рост 5 фолликулов. На 12-й день овариальной стимуляции (15.01.2016) произведена трансвагинальная пункция яичников с аспирацией фолликулярной жидкости. Получено 5 ооцитов. Параллельно использовались 4 криоконсервированных донорских ооцита. Оплодотворение спермой супруга методом ЭКО+ИКСИ. Результат оплодотворения представлен в протоколе культивирования эмбрионов (рис. 2).
На 5-е сутки культивирования (20.01.2016) произведен перенос двух эмбрионов (один из них после оплодотворения собственной яйцеклетки, другой – донорского ооцита) на стадии развития бластоцисты. Остальные эмбрионы подверглись утилизации в связи с непригодностью их к переносу в полость матки или последующей криоконсервации.
На 14-й день посттрансферного периода (02.02.2016) уровень ХГЧ в сыворотке крови составил 513,1 мМЕ/мл. На 21-й день после переноса эмбриона (09.02.2016) при ультразвуковом исследовании в полости матки обнаружено 2 плодных яйца. Выставлен диагноз «беременность малого срока, дихориальная диамниотическая двойня». Пациентка с рекомендациями направлена в женскую консультацию для дальнейшего наблюдения по беременности.
В октябре 2016 г. произошли оперативные своевременные роды. Родились живые, доношенные девочки, массой 2950 и 3100 г, ростом 49 и 51 см, оценка по
Апгар 8/9 баллов. Послеродовый период без особенностей.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах / Information about the authors
Стрижова Татьяна Владимировна – канд. мед. наук, гинеколог-репродуктолог, ОП ЖК ГБУЗ «ГКБ им. Д.Д. Плетнёва ДЗМ».
E-mail: statyana333@gmail.com; ORCID: 0000-0002-2909-5440
Tatiana V. Strizhova – Cand. Sci. (Med.), Gynecologist, Fertility Specialist, Separate division Women's Consultation “Pletnev City Clinical Hospital”. E-mail: statyana333@gmail.com. ORCID: 0000-0002-2909-5440
Сергеева Ирина Валерьевна – эмбриолог, ОП ЖК ГБУЗ «ГКБ им. Д.Д. Плетнёва ДЗМ»
Irina V. Sergeeva – Fertility Specialist, Separate division Women's Consultation “Pletnev City Clinical Hospital”
Бесман Ирина Владимировна – канд. мед. наук, гинеколог-эндокринолог, ОП ЖК ГБУЗ «ГКБ им. Д.Д. Плетнёва ДЗМ». ORCID: 0000-0001-6903-4987
Irina V. Besman – Cand. Sci. (Med.), Separate division Women's Consultation “Pletnev City Clinical Hospital”. E-mail: ibesman@mail.ru; ORCID: 0000-0001-6903-4987
Рудакова Елена Борисовна – д-р мед. наук, ГБУЗ МО «Московский областной перинатальный центр». E-mail: doctor_rudakova@mail.ru; ORCID: 0000-0001-5387-2804;
Elena B. Rudakova – D. Sci. (Med.), Moscow Regional Perinatal Center. E-mail: doctor_rudakova@mail.ru; ORCID: 0000-0001-5387-2804
Статья поступила в редакцию / The article received: 03.06.2021
Статья принята к печати / The article approved for publication: 24.06.2021
Клинический разбор в акушерстве, гинекологии и репродуктологии №01 2021
Низкий антимюллеров гормон в циклах экстракорпорального оплодотворения и его значение в сочетании с другими факторами, влияющими на фертильность
Номера страниц в выпуске:36-39
Аннотация
Роль антимюллерова гормона (АМГ) при прогнозировании исхода ЭКО-программ в настоящее время значительна. АМГ является одним из критериев овариального резерва женщины. При этом уровень АМГ в сыворотке крови считается достаточно надежным показателем для расчета ответа яичников на стимуляцию, но не для прогнозирования наступления беременности в ЭКО-циклах. Следует предопределять исходы лечения пациентов с бесплодием, используя совокупность факторов, влияющих на репродуктивное здоровье.
Ключевые слова: экстракорпоральное оплодотворение, антимюллеров гормон, фертильность, снижение фертильности.
Для цитирования: Стрижова Т.В., Сергеева И.В., Бесман И.В., Рудакова Е.Б. Низкий антимюллеров гормон в циклах экстракорпорального оплодотворения и его значение в сочетании с другими факторами, влияющими на фертильность. Клинический разбор в акушерстве, гинекологии и репродуктологии. 2021; 1: 36–39. DOI: 10.47407/kragr2021.1.1.00007
Роль антимюллерова гормона (АМГ) при прогнозировании исхода ЭКО-программ в настоящее время значительна. АМГ является одним из критериев овариального резерва женщины. При этом уровень АМГ в сыворотке крови считается достаточно надежным показателем для расчета ответа яичников на стимуляцию, но не для прогнозирования наступления беременности в ЭКО-циклах. Следует предопределять исходы лечения пациентов с бесплодием, используя совокупность факторов, влияющих на репродуктивное здоровье.
Ключевые слова: экстракорпоральное оплодотворение, антимюллеров гормон, фертильность, снижение фертильности.
Для цитирования: Стрижова Т.В., Сергеева И.В., Бесман И.В., Рудакова Е.Б. Низкий антимюллеров гормон в циклах экстракорпорального оплодотворения и его значение в сочетании с другими факторами, влияющими на фертильность. Клинический разбор в акушерстве, гинекологии и репродуктологии. 2021; 1: 36–39. DOI: 10.47407/kragr2021.1.1.00007
Low anti-Mullerian hormone levels during in vitro fertilization cycles and their significance when combined with other factors affecting fertility
Tatiana V. Strizhova1, Irina V. Sergeeva1, Irina V. Besman1, Elena B. Rudakova21 Separate division Women's Consultation “Pletnev City Clinical Hospital”, Moscow, Russia
2 Moscow Regional Perinatal Center, Balashikha, Russia
strizhova.doc@yandex.ru
Abstract
The role of anti-Muller hormone (AMH) in predicting the outcome of IVF-programs is currently significant. AMH is one of the criteria for a woman's ovarian reserve. At the same time, the level of AMH in the blood serum is considered a fairly reliable indicator for predicting the ovarian response to stimulation, but not for predicting the onset of pregnancy in IVF-cycles. It is necessary to predict the outcomes of treatment of patients with infertility, using a combination of factors to affect reproductive health.
Key words: IVF, anti-Muller hormone, fertility, reduced fertility.
For citation: Strizhova T.V., Sergeeva I.V., Besman I.V., Rudakova E.B. Low anti-Mullerian hormone levels during in vitro fertilization cycles and their significance when combined with other factors affecting fertility. Clinical analysis in obstetrics, gynecology and reproductology. 2021; 1: 36–39. DOI: 10.47407/kragr2021.1.1.00007
Внастоящее время количество лечебных ВРТ-циклов в мире неуклонно растет [1, 2]. В нашей стране лечение бесплодия с 2013 г. стало возможным за счет средств обязательного медицинского страхования. Тем самым программы экстракорпорального оплодотворения (ЭКО) стали более доступными для женщин на территории Российской Федерации. По данным ВРТ-регистра Российской ассоциации репродукции человека (РАРЧ), за 2018 г. выполнено более 145 тыс. ВРТ-циклов. Эффективность программ ЭКО и переноса эмбриона (ПЭ) за истекший период составила 36,5%, а программы переноса размороженных эмбрионов в полость матки имели положительный результат в 42% случаев [3].
Известно о наличии факторов, которые уменьшают вероятность зачатия, тем самым снижая эффективность программ вспомогательных репродуктивных технологий (ВРТ) [1, 3, 4]. При этом на часть таких факторов можно оказывать влияние (отказ от курения, употребления алкоголя, наркотических веществ, кофеина). Такой фактор, как ожирение, снижает эффективность лечения бесплодия в 3 раза, также относится к управляемым факторам [5, 6].
Но существуют факторы, повлиять на которые невозможно. Например, возраст пациентки очень важен при лечении бесплодия. С увеличением возраста будущих родителей повышаются риски, как для матери, так и для плода [1, 7]. Наряду со снижением овариального резерва у женщин старшей возрастной группы повышен процент получения аномальных ооцитов и эмбрионов [1, 8]. Также у возрастных пациенток повышен риск осложнений программ ВРТ и течения самой беременности [1, 7, 8].
Антимюллеров гормон (АМГ) – пептидный гормон, ограничивающий процессы чрезмерного роста в репродуктивных органах мужского и женского организма. На сегодняшний день уровень АМГ является одним из критериев оценки овариального резерва у пациенток, планирующих программы ВРТ [1, 4, 9]. Более того, показатель АМГ менее 1,2 нг/мл является ограничением для базовой программы ЭКО в рамках оказания помощи за счет средств фонда обязательного медицинского страхования [10].
Роль АМГ в исходе программ ВРТ невозможно недооценить. Результативность программ ВРТ в зависимости от уровня АМГ отражена во многих исследованиях. Считают, что снижение овариального резерва, а именно уровня АМГ является предиктором отрицательного результата в программах ЭКО [11, 12]. Следует отметить, что уровень АМГ относится к достаточно надежным показателям для прогнозирования количества полученных ооцитов в процессе стимуляции овариальной стимуляции. Но для прогнозирования наступления беременности в результате программ ВРТ этот показатель использовать некорректно.
Представляем вашему вниманию два клинических случая пациенток с низким уровнем АМГ в сыворотке крови, которые получали лечение методом ЭКО и ПЭ в отделении ВРТ.
Клинический случай 1
 Пациентка В., 33 лет, обратилась в 2017 г. в отделение ВРТ с жалобами на отсутствие беременности в течение 6 лет. По данным опроса, семейный анамнез, аллергоанамнез и наследственность не отягощены. Из перенесенных заболеваний: острый пиелонефрит в возрасте 15 лет. Операции в анамнезе не отмечены. Менструальная функция с 16 лет, цикл каждые 27–29 дней, длительность – 5–6 дней, умеренные, безболезненные. Половая жизнь с 18 лет. Контрацепция – барьерная. Беременностей не было. Брак 1, регистрирован. Супругу 34 года, детей нет. Гинекологические заболевания отрицает. Рост – 170 см, масса тела – 55 кг, индекс массы тела (ИМТ) – 19,03 (норма).
Пациентка В., 33 лет, обратилась в 2017 г. в отделение ВРТ с жалобами на отсутствие беременности в течение 6 лет. По данным опроса, семейный анамнез, аллергоанамнез и наследственность не отягощены. Из перенесенных заболеваний: острый пиелонефрит в возрасте 15 лет. Операции в анамнезе не отмечены. Менструальная функция с 16 лет, цикл каждые 27–29 дней, длительность – 5–6 дней, умеренные, безболезненные. Половая жизнь с 18 лет. Контрацепция – барьерная. Беременностей не было. Брак 1, регистрирован. Супругу 34 года, детей нет. Гинекологические заболевания отрицает. Рост – 170 см, масса тела – 55 кг, индекс массы тела (ИМТ) – 19,03 (норма).Обследование по поводу бесплодия проходили вместе с супругом периодически, лечение методами ВРТ не использовали. Супружеская пара была обследована согласно действующим приказам и стандартам.
По результатам обследования выявлено следующее:
• гормональный профиль (28.03.2017): фолликулостимулирующий гормон (ФСГ) – 10,4 МЕ/л (норма 3,03–8,08); лютеинизирующий гормон (ЛГ) – 3,24 МЕ/л (1,8–11,78); эстрадиол – 136 пмоль/л (77–921); тестостерон – 1,0 нмоль/л (0,48–1,85); пролактин – 21,2 нг/мл (6–29,9); АМГ – 0,19 нг/мл (0,07–7,35); тиреотропный гормон (ТТГ) – 2,37 мМЕ/л (0,40–4,0); антитела к тиреоидной пероксидазе (АТ-ТПО) – 9,01 МЕ/мл (0–34);
• ультразвуковое исследование органов малого таза на 7-й день менструального цикла (30.03.2017):
УЗ-признаки снижения овариального резерва (по одному антральному фолликулу в каждом яичнике);
• TORCH-комплекс (07.04.2017) – без особенностей;
• инфекции, передаваемые половым путем, – ИППП (13.02.2017): не обнаружены;
• обследование супруга (18.11.2017): спермограмма – нормозооспермия; MAR-тест отрицательный;
• кариотипирование обоих супругов (13.04.2017) – 46ХХ, 46ХУ;
• аспирационная пайпель – биопсия эндометрия (06.09.2017) – по гистологии патологии не выявлено.
Выставлен клинический диагноз «бесплодие первичное эндокринного генеза, преждевременное истощение яичников». Предложена программа ЭКО и ПЭ с использованием ооцитов собственных и донора. Стимуляция овуляции проводилась в протоколе с низкими дозами агонистов рилизинг гормонов с первого дня менструального цикла. Доза гонадотропинов на курс составила 1800 МЕ. Получен рост двух фолликулов. На 14-й день овариальной стимуляции (05.12.2017) произведена трансвагинальная пункция яичников с аспирацией фолликулярной жидкости. Получен один ооцит. Параллельно использовались 4 донорских ооцита (стимуляция собственного донора пациентки). Оплодотворение спермой супруга, методом интрацитоплазматической инъекции сперматозоида в яйцеклетку (ИКСИ – Intra Cytoplasmic Sperm Injection, ICSI). Результат оплодотворения представлен в протоколе культивирования эмбрионов (рис. 1).
На 4-е сутки культивирования (09.12.2017) произведен перенос одного эмбриона (полученного после оплодотворения собственной яйцеклетки) на стадии развития морулы. Эмбрионы после оплодотворения донорских ооцитов имели несоответствие в развитии и подверглись утилизации в связи с непригодностью к переносу в полость матки или их криоконсервации.
На 14-й день посттрансферного периода (22.12.2017) уровень хорионического гонадотропина человека (ХГЧ) в сыворотке крови составил 449,45 мМЕ/мл. На 21-й день после переноса эмбриона (29.12.2017) при ультразвуковом исследовании в полости матки обнаружено плодное яйцо. Выставлен диагноз «беременность малого срока». Пациентка с рекомендациями направлена в женскую консультацию для дальнейшего наблюдения по беременности.
В августе 2018 г. произошли самостоятельные своевременные роды. Родился живой, доношенный мальчик, массой 3150 г, ростом 52 см, оценка по Апгар 8/9 баллов. Послеродовый период без особенностей.
Клинический случай 2
 Пациентка Ш., 41 год, в 2013 г. обратилась в отделение ВРТ с жалобами на отсутствие беременности в течение 2 лет. Из анамнеза: наследственные и хронические заболевания отрицает. Менструальная функция с 13 лет, цикл каждые 28 дней, длительность – 5 дней, умеренные, безболезненные. Половая жизнь с 19 лет. Контрацепция – внутриматочный контрацептив, удален в 39 лет. Беременность – 1, роды – 1 (мальчик умер в возрасте 7 лет – онкологическое заболевание головного мозга). Брак 1, регистрирован. Супругу 42 года.
Пациентка Ш., 41 год, в 2013 г. обратилась в отделение ВРТ с жалобами на отсутствие беременности в течение 2 лет. Из анамнеза: наследственные и хронические заболевания отрицает. Менструальная функция с 13 лет, цикл каждые 28 дней, длительность – 5 дней, умеренные, безболезненные. Половая жизнь с 19 лет. Контрацепция – внутриматочный контрацептив, удален в 39 лет. Беременность – 1, роды – 1 (мальчик умер в возрасте 7 лет – онкологическое заболевание головного мозга). Брак 1, регистрирован. Супругу 42 года. Гинекологические заболевания: миома матки малых размеров, аденомиоз. Рост 168 см, масса тела – 89 кг, ИМТ – 31,5 (ожирение 1-й степени). Супружеская пара была обследована согласно действующему приказу.
По результатам обследования выявлено следующее:
• гормональный профиль (11.09.2013): ФСГ – 11,4 МЕ/л (норма 3,03–8,08); ЛГ – 5,24 МЕ/л (1,8–11,78); эстрадиол – 108 пмоль/л (77–921); тестостерон – 0,44 нмоль/л (0,48–1,85); пролактин – 18,3 нг/мл (6–29,9); АМГ – 0,12 нг/мл (0,07–7,35); ТТГ – 1,95 мМЕ/л (0,40–4,0); АТ-ТПО – 22,1 МЕ/мл (0–34);
• ультразвуковое исследование органов малого таза на 5-й день менструального цикла (07.10.2013): интерстициальный миоматозный узел по передней стенке матки диаметром 27 мм, полость матки не деформирует. В яичниках до 5 антральных фолликулов. УЗ-признаки миомы матки. Аденомиоз.
• ИППП (23.08.2013): не обнаружены;
• обследование супруга (02.10.2013): спермограмма – нормозооспермия; MAR-тест отрицательный;
• кариотипирование обоих супругов (10.07.2012) – 46ХХ, 46ХУ.
Поставлен диагноз «бесплодие вторичное, сочетанного генеза». Предложена программа ЭКО и ПЭ (от использования донорских ооцитов пациентка отказалась).
Проведена программа ЭКО и ПЭ с использованием низких доз агонистов рилизинг гормона в декабре 2013 г. с положительным результатом. На сроке 6–7 нед неразвивающаяся беременность, произведено abrasio cavi uteri, кариотипирование абортуса – трисомия по 18 хромосоме. Спустя 4 мес у пациентки наступает спонтанная самостоятельная беременность, но, к сожалению, снова происходит прерывание по типу неразвивающейся (кариотипирование абортуса не проводилось).
В августе 2015 г. проведено два цикла искусственной инсеминации спермой мужа. Беременность наступила, но на сроке 7 нед гестации снова замершая.
В январе 2016 г. после повторного обследования по действующему приказу пациентка в возрасте 44 лет вступает в протокол овариальной стимуляции с использованием антагонистов рилизинг гормонов. Доза гонадотропинов на курс составила 2100 МЕ. Получен рост 5 фолликулов. На 12-й день овариальной стимуляции (15.01.2016) произведена трансвагинальная пункция яичников с аспирацией фолликулярной жидкости. Получено 5 ооцитов. Параллельно использовались 4 криоконсервированных донорских ооцита. Оплодотворение спермой супруга методом ЭКО+ИКСИ. Результат оплодотворения представлен в протоколе культивирования эмбрионов (рис. 2).
На 5-е сутки культивирования (20.01.2016) произведен перенос двух эмбрионов (один из них после оплодотворения собственной яйцеклетки, другой – донорского ооцита) на стадии развития бластоцисты. Остальные эмбрионы подверглись утилизации в связи с непригодностью их к переносу в полость матки или последующей криоконсервации.
На 14-й день посттрансферного периода (02.02.2016) уровень ХГЧ в сыворотке крови составил 513,1 мМЕ/мл. На 21-й день после переноса эмбриона (09.02.2016) при ультразвуковом исследовании в полости матки обнаружено 2 плодных яйца. Выставлен диагноз «беременность малого срока, дихориальная диамниотическая двойня». Пациентка с рекомендациями направлена в женскую консультацию для дальнейшего наблюдения по беременности.
В октябре 2016 г. произошли оперативные своевременные роды. Родились живые, доношенные девочки, массой 2950 и 3100 г, ростом 49 и 51 см, оценка по
Апгар 8/9 баллов. Послеродовый период без особенностей.
Заключение
Уровень АМГ в сыворотке крови является одним из маркеров овариального резерва, в результате чего мы можем судить о количестве и возможном качестве полученных ооцитов. Но, как показали эти два клинических случая, возраст также является ведущим фактором в прогнозировании исходов программ ВРТ. Следовательно, пациентки с низким уровнем АМГ не должны быть исключены из попыток протокола ЭКО, основываясь только на этом показателе. Вероятно, есть смысл оценивать и прогнозировать ситуацию исходя из всех известных нам факторов, влияющих на фертильность, и, соответственно, исход программ ЭКО.Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах / Information about the authors
Стрижова Татьяна Владимировна – канд. мед. наук, гинеколог-репродуктолог, ОП ЖК ГБУЗ «ГКБ им. Д.Д. Плетнёва ДЗМ».
E-mail: statyana333@gmail.com; ORCID: 0000-0002-2909-5440
Tatiana V. Strizhova – Cand. Sci. (Med.), Gynecologist, Fertility Specialist, Separate division Women's Consultation “Pletnev City Clinical Hospital”. E-mail: statyana333@gmail.com. ORCID: 0000-0002-2909-5440
Сергеева Ирина Валерьевна – эмбриолог, ОП ЖК ГБУЗ «ГКБ им. Д.Д. Плетнёва ДЗМ»
Irina V. Sergeeva – Fertility Specialist, Separate division Women's Consultation “Pletnev City Clinical Hospital”
Бесман Ирина Владимировна – канд. мед. наук, гинеколог-эндокринолог, ОП ЖК ГБУЗ «ГКБ им. Д.Д. Плетнёва ДЗМ». ORCID: 0000-0001-6903-4987
Irina V. Besman – Cand. Sci. (Med.), Separate division Women's Consultation “Pletnev City Clinical Hospital”. E-mail: ibesman@mail.ru; ORCID: 0000-0001-6903-4987
Рудакова Елена Борисовна – д-р мед. наук, ГБУЗ МО «Московский областной перинатальный центр». E-mail: doctor_rudakova@mail.ru; ORCID: 0000-0001-5387-2804;
Elena B. Rudakova – D. Sci. (Med.), Moscow Regional Perinatal Center. E-mail: doctor_rudakova@mail.ru; ORCID: 0000-0001-5387-2804
Статья поступила в редакцию / The article received: 03.06.2021
Статья принята к печати / The article approved for publication: 24.06.2021
Список исп. литературыСкрыть список1. Рудакова Е.Б. Очерки экстракорпорального оплодотворения. М., 2019.
[Rudakova E.B. Ocherki ekstrakorporal'nogo oplodotvoreniia. Moscow, 2019 (in Russian).]
2. Назаренко Т.А., Мишиева Н.Г. Бесплодие и возраст. М.: МЕДпресс-информ, 2014. С. 7–22.
[Nazarenko T.A., Mishieva N.G. Besplodie i vozrast. Moscow: MEDpress-inform, 2014. S. 7–22 (in Russian).]
3. Корсак В.С., Смирнова А.А., Шурыгина О.В. Регистр ВРТ Российской ассоциации репродукции человека. Отчет за 2018 год. Проблемы репродукции. 2021; 27 (2): 6–20. DOI: 10.17116/ repro2021270216
[Korsak V.S., Smirnova A.A., Shurygina O.V. Registr VRT Rossiiskoi assotsiatsii reproduktsii cheloveka. Otchet za 2018 god. Problemy reproduktsii. 2021; 27 (2): 6–20. DOI: 10.17116/repro2021270216 (in Russian).]
4. Женское бесплодие. Современные подходы к диагностике и лечению. Клинические рекомендации (протокол лечения). М., 2018.
[Zhenskoe besplodie. Sovremennye podkhody k diagnostike i lecheniiu. Klinicheskie rekomendatsii (protokol lecheniia). Moscow, 2018 (in Russian).]
5. Meldrum DR. Introduction: Obesity and reproduction. Fertil Steril 2017; 107 (4): 831–2. DOI: 10.1016/j.fertnstert.2017.02.110. PMID: 28366410.
6. Андреева Е.Н., Карпова Е.А. Репродуктивная функция женщин и ожирение. В кн.: Ожирение: этиология, патогенез, клинические аспекты. Под ред. И.И. Дедова, Г.А. Мельниченко. М.: Медицинское информационное агентство, 2004. С. 159–84.
[Andreeva E.N., Karpova E.A. Reproduktivnaia funktsiia zhenshchin i ozhirenie. In.: Ozhirenie: etiologiia, patogenez, klinicheskie aspekty. Ed. I.I. Dedov, G.A. Mel'nichenko. Moscow: Meditsinskoe informatsionnoe agentstvo, 2004. P. 159–84 (in Russian).]
7. Рудакова Е.Б., Федорова Е.А., Сергеева И.В. Можно ли помочь пациенткам старшей возрастной группы с реализацией репродуктивной функции в программах ЭКО и ПЭ в рамках государственной поддержки. Медицинский совет. 2018; (7): 116–24. DOI: 10.21518/2079-701X-2018-7-116-124
[Rudakova E.B., Fedorova E.A., Sergeeva I.V. Mozhno li pomoch' patsientkam starshei vozrastnoi gruppy s realizatsiei reproduktivnoi funktsii v programmakh EKO i PE v ramkakh gosudarstvennoi podderzhki. Meditsinskii sovet. 2018; (7): 116–24. DOI: 10.21518/2079-701X-2018-7-116-124 (in Russian).]
8. Ata B, Kaplan B, Danzer H et al. Array CGH analysis shows that aneuploidy is not related to the number of embryos generated. Reprod Biomed Online 2012; 24 (6): 614–20. DOI: 10.1016/j.rbmo.2012. 02.009. PMID: 22503277.
9. Боярский К.Ю., Гайдуков С.Н., Машкова Е.А. Роль антимюллерова гормона в норме и при различных гинекологических заболеваниях. Журнал акушерства и женских болезней. 2009; 3.
[Boiarskii K.Iu., Gaidukov S.N., Mashkova E.A. Rol' antimiullerova gormona v norme i pri razlichnykh ginekologicheskikh zabolevaniiakh. Zhurnal akusherstva i zhenskikh boleznei. 2009; 3 (in Russian).]
10. Приказ Минздрава России №803н от 31.07.2020 «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению». М., 2020.
[Prikaz Minzdrava Rossii №803n ot 31.07.2020 "O poriadke ispol'zovaniia vspomogatel'nykh reproduktivnykh tekhnologii, protivopokazaniiakh i ogranicheniiakh k ikh primeneniiu". Moscow, 2020 (in Russian).]
11. Согоян Н.С., Козаченко И.Ф., Адамян Л.В. Роль АМГ в репродуктивной системе женщин (обзор литературы). Проблемы репродукции. 2017; 23 (1): 37–42. DOI: 10.17116/repro201723137-42
[Sogoian N.S., Kozachenko I.F., Adamian L.V. Rol' AMG v reproduktivnoi sisteme zhenshchin (obzor literatury). Problemy reproduktsii. 2017; 23 (1): 37–42. DOI: 10.17116/repro201723137-42 (in Russian).]
12. Сугурова А.Т., Ящук А.Г., Хусаинова Р.И. Клинико-генетические аспекты проблемы овариального ответа при применении вспомогательных репродуктивных технологий. Российский вестник акушера-гинеколога. 2020; 20 (6): 48–55. DOI: 10.17116/rosakush 20202006148
[Sugurova A.T., Iashchuk A.G., Khusainova R.I. Kliniko-geneticheskie aspekty problemy ovarial'nogo otveta pri primenenii vspomogatel'nykh reproduktivnykh tekhnologii. Rossiiskii vestnik akushera-ginekologa. 2020; 20 (6): 48–55. DOI: 10.17116/rosakush20202006148 (in Russian).]
1 августа 2021
Количество просмотров: 2214

