Клинический разбор в общей медицине №03 2020
National Medical Research Center for Cardiology, Moscow, Russia julyprus@mail.ru
Abstract
Statins are the cornerstone of therapy for hypercholesterolemia and coronary artery disease. A large number of studies have demonstrated the effectiveness of lipid-lowering therapy in preventing the progression of atherosclerosis and the development of cardiovascular diseases. The original rosuvastatin is one of the most effective statin medication in its class used to reduce low-density lipoprotein (LDL) cholesterol. The existing fears of patients and doctors about the high doses of rosuvastatin, as well as other drugs in this group, prevent the achievement of the target LDL cholesterol values, and, as a result, contribute to the progression of atherosclerosis. This article demonstrates the efficacy and safety of taking high doses of rosuvastatin in patients of different age groups with various cardiovascular events.
Key words: hypercholesterolemia, low-density lipoproteins, atherosclerosis, ischemic heart disease, rosuvastatin.
For citation: Prus Yu.A., Sergienko I.V. Possibilities of using rosuvastatin to achieve target level of low-density lipoprotein cholesterol in clinical practice. Clinical review for general practice. 2020; 3: 24–28. DOI: 10.47407/kr2020.1.3.00020
Гиперлипидемия – один из основных независимых модифицируемых факторов риска развития ишемической болезни сердца (ИБС), а также других осложнений со стороны сердечно-сосудистой системы. Статины (ингибиторы 3-гидрокси-3-метилглутарил-коэнзимаА-редуктазы – ГМГ-КоА-редуктазы) составляют основу фармакологического лечения гиперлипидемии с целью первичной и вторичной профилактики сердечно-сосудистых заболеваний (ССЗ) [1, 2]. Данная группа препаратов используется для снижения уровня холестерина липопротеидов низкой плотности (ХС ЛПНП), который является одним из важнейших факторов риска развития атеросклероза [3].
Результаты 26 рандомизированных исследований с участием 170 тыс. пациентов показали, что снижение уровня ХС ЛПНП на 1 ммоль/л (приблизительно
38,7 мг/дл) снижает риск серьезных сердечно-сосудистых событий на 22%, а смертность от ИБС на 20% [4].
Среди имеющихся в настоящее время статинов оригинальный розувастатин (Крестор®) является самым активным препаратом данного класса. Свою эффективность и безопасность розувастатин доказал в многочисленных исследованиях. Например, в исследовании STELLAR у 2431 включенных пациентов оценивалась эффективность различных доз розувастатина (10–80 мг), аторвастатина (10–80 мг), симвастатина (10–80 мг), а также правастатина (10–40 мг) на показатели липидного профиля. Снижение уровня ХС ЛПНП на терапии розувастатином 10–40 мг наблюдалось на 8% больше, чем у группы пациентов, принимающих аторвастатин, на 28% больше, чем у больных на терапии правастатином, и на 12–18% больше, чем у больных, получавших симвастатин 10–80 мг (р<0,001 для всех значений). Согласно рекомендациям Национальной образовательной программы по холестерину в США (National Cholesterol Education Program Adult Treatment Panel III – NCEP АТР III), целевой уровень ХС ЛПНП был достигнут у 82–89% пациентов в группе розувастатина 10–40 мг, и у 69–85% – в группе аторвастатина 10–80 мг [5].
В многоцентровом рандомизированном исследовании JUPITER с участием 17802 пациентов с уровнем ХС ЛПНП не более 3,4 ммоль/л (130 мг/дл), уровнем триглицеридов (ТГ) не более 5,6 ммоль/л и высокочувствительным С-реактивным белком (СРБ) более 2 мг/л оценивалась эффективность монотерапии оригинальным розувастатином (Крестор®) 20 мг для первичной профилактики ССЗ по сравнению с группой плацебо. Уровни ХС ЛПНП и СРБ на фоне терапии оригинальным розувастатином 20 мг уменьшились на 50 и 37% соответственно, при этом риск развития инфаркта миокарда снизился на 54% (p<0,00001), инсульта – на 48% (p<0,00001). Общая смертность за период наблюдения (медиана 1,9 года) достоверно снизилась на 20% (p=0,02). При этом частота появления побочных эффектов была одинаковой между группами. Так, частота возникновения миопатии в группе оригинального розувастатина составила 0,1% пациентов, как и в группе плацебо. Повышение уровня аланинаминотрансферазы (АЛТ) более 3 верхних границ нормы в группе розувастатина наблюдалось у 0,2% больных, в группе плацебо – у 0,3% [6]. Безопасность применения розувастатина подтверждена и другими исследованиями [7, 8].
В двухлетнем двойном слепом плацебо-контролируемом исследовании METEOR продемонстрирована эффективность розувастатина 40 мг в замедлении прогрессирования атеросклероза как в целом, так и в отдельных сегментах сонных артерий у группы пациентов среднего возраста с низким риском развития ССЗ по сравнению с группой плацебо (толщина комплекса интима-медиа уменьшалась в группе розувастатина на 0,0014 мм в год, 95% доверительный интервал – ДИ -0,0041–0,0014 мм в год; увеличивалась в группе плацебо на 0,0131 мм в год, 95% ДИ 0,0087–0,0174 мм в год; p<0,001). Кроме того, розувастатин снижал уровни ХС ЛПНП на 49%, общего холестерина – на 34%, ТГ – на 16%, а также увеличивал уровень холестерина липопротеидов высокой плотности (ХС ЛПВП) на 8% (все p<0,001 по сравнению с плацебо) [9]. В исследовании ASTEROID высокоинтенсивная терапия оригинальным розувастатином также способствовала регрессу атеросклеротических бляшек в коронарных артериях у включенных пациентов. На фоне лечения уменьшился общий объем атеромы на 6,8%, по данным внутрисосудистого ультразвукового исследования. Ни одного случая рабдомиолиза выявлено не было [10]. Регресс атеросклеротических бляшек на фоне терапии оригинальным розувастатином 40 мг и аторвастатином 80 мг наблюдался и в 104-недельном исследовании SATURN с участием 1039 пациентов. Однако пациенты, получавшие оригинальный розувастатин, имели тенденцию к более значимому регрессу атеромы (68,5% против 63,2% для группы аторвастатина 80 мг, p=0,07). Кроме этого, терапия розувастатином 40 мг способствовала более значимому снижению уровня ХС ЛПНП по сравнению с аторвастатином 80 мг [1,62±0,03 ммоль/л (62,6±1,0 мг/дл) против 1,82±0,03 ммоль/л (70,2±1,0 мг/дл) соответственно, p<0,001] [11].
Клиническая программа GALAXY включала оценку безопасности и эффективности применения оригинального розувастатина (препарат Крестор®) и у пациентов с метаболическим синдромом и сахарным диабетом 2-го типа. Так, в проспективном рандомизированном исследовании COMETS у пациентов с метаболическим синдромом отмечалось более значимое снижение ХС ЛПНП на фоне терапии оригинальным розувастатином 10 и 20 мг/сут по сравнению с аторвастатином 10 мг/сут и плацебо в течение 6–12 нед [12]. А в исследовании ANDROMEDA, включающем 509 пациентов с сахарным диабетом 2-го типа, снижение уровня ХС ЛПНП на 51 и 57% через 16 нед лечения было выявлено на фоне терапии розувастатином 10 и 20 мг соответственно, а на фоне лечения аторвастатином 10 и 20 мг – на 39 и 46% соответственно. Розувастатин в дозе 10 и 20 мг продемонстрировал свое преимущество и в способности достоверно снижать уровень высокочувствительного СРБ по сравнению с группой аторвастатина 10 и 20 мг (34 и 39,8% против 21 и 33,8% соответственно) [13].
Тем не менее, несмотря на доказанную эффективность и безопасность применения статинов, в настоящее время во всем мире, и в частности в России, практикующими врачами не назначаются высокие дозы статинов, а также многокомпонентные схемы гиполипидемической терапии, что необратимо приводит к недостижению целевых значений ХС ЛПНП и прогрессированию атеросклероза. В качестве примеров, иллюстрирующих необходимость и безопасность применения оригинального розувастатина (Крестора), представляем клинические случаи пациентов с гиперлипидемией и различными сердечно-сосудистыми событиями.
При поступлении пациент предъявлял жалобы на боли за грудиной давящего характера, возникающие при физической нагрузке (ходьба на расстояние 100 м, подъем на один лестничный пролет), иррадиирующие в левую руку, купирующиеся приемом нитратов в течение 1–2 мин.
Из анамнеза известно, что гипертонической болезнью страдает около 10 лет, повышение артериального давления (АД) с максимальными значениями – до 180/100 мм рт. ст., адаптирован к АД 120–130/80 мм рт. ст. Клиника стенокардии в течение 2 лет, постепенно прогрессирует. Семейный анамнез по ССЗ не отягощен, курит более 50 лет до 1 пачки в день.
По результатам биохимического анализа крови на фоне терапии аторвастатином (20 мг) уровень общего холестерина – 4,04 ммоль/л, ХС ЛПНП – 1,9 ммоль/л, ХС ЛПВП – 1,74 ммоль/л, ТГ – 1,09 ммоль/л, аспартатаминотрансферазы (АСТ) – 24 Ед/л, АЛТ – 18 Ед/л. По данным электрокардиографии (ЭКГ), ритм синусовый с частотой сердечных сокращений (ЧСС) – 68 уд/мин, единичная наджелудочковая экстрасистола. Отклонение электрической оси сердца влево.
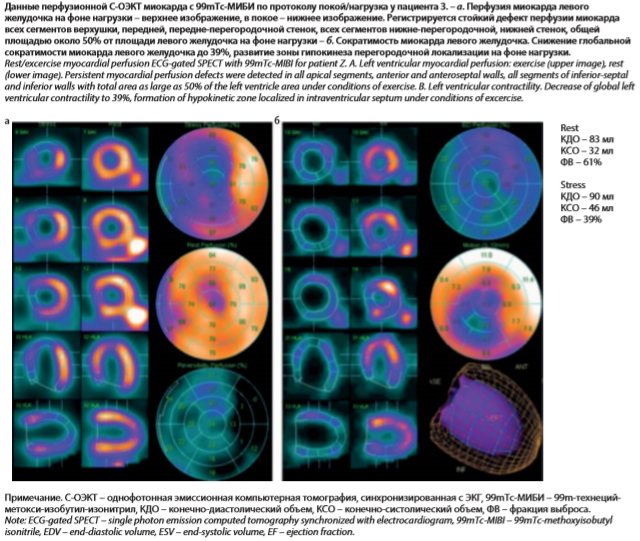
С целью выявления преходящей ишемии миокарда пациенту проведена однофотонная эмиссионная компьютерная томография миокарда, синхронизированная с ЭКГ (С-ОЭКТ) по протоколу покой/нагрузка. Проба на выявление ишемии миокарда – положительная, на максимуме нагрузки при ЧСС 116 уд/мин регистрировалась горизонтальная депрессия сегмента ST II, aVF, V4–V6 до 2,4 мм, сопровождаемая болью за грудиной давящего характера. При данном уровне выполненной нагрузки и достигнутой при этом ЧСС отмечалось ухудшение перфузии миокарда всех сегментов верхушки, передней, передне-перегородочной стенок, всех сегментов нижне-перегородочной, нижней стенок, общей площадью около 50% от площади левого желудочка. После нагрузочной пробы отмечается снижение глобальной сократимости миокарда левого желудочка до 39%, развитие зоны гипокинеза перегородочной локализации (см. рисунок).
Учитывая достоверную преходящую ишемию миокарда, больному проведена коронароангиография, где выявлены 90% стеноз в устье и 70% стеноз в среднем сегменте передней нисходящей артерии, 80% – стеноз в проксимальном сегменте огибающей артерии, 70% – стеноз в среднем сегменте правой коронарной артерии. Одномоментно была выполнена ангиопластика со стентированием проксимального сегмента огибающей артерии и ствола левой коронарной артерии с переходом на проксимальный и средний сегменты передней нисходящей артерии. После оперативного вмешательства пациент отмечал увеличение толерантности к физической нагрузке, приступы стенокардии не рецидивировали.
В рамках обследования пациенту также проведено ультразвуковое исследование брахиоцефальных артерий, по результатам которого выявлен стенозирующий атеросклероз брахиоцефальных артерий, стенозы до 50%.
С учетом изложенного выставлен диагноз: ИБС: стенозирующий атеросклероз коронарных артерий, стенокардия напряжения III функционального класса. Ангиопластика со стентированием проксимального сегмента огибающей артерии стентом Resolute integrity 3,0×34 мм и ствола левой коронарной артерии с переходом на проксимальный и средний сегменты передней нисходящей артерии стентами Resolute Integrity 4,0×34 мм, Resolute Integrity 3,0×12 мм от 21.0.2019 г. Гипертоническая болезнь III стадии. Артериальная гипертония 3-й степени, медикаментозно достигнута 1-я степень. Атеросклероз аорты. Стенозирующий атеросклероз экстракраниального отдела брахиоцефальных артерий. Гиперлипидемия IIA. Риск сердечно-сосудистых осложнений 4 (очень высокий).
Учитывая мультифокальный атеросклероз, многососудистое поражение коронарных артерий, а также недостижение целевых значений ХС ЛПНП, пациенту скорректирована гиполипидемическая терапия, назначен оригинальный розувастатин (Крестор®) 20 мг/сут. Через 4 нед приема препарата отмечается достижение целевых значений ХС ЛПНП – 1,4 ммоль/л, а также отсутствие побочных эффектов (АСТ – 20 Ед/л, АЛТ – 21 Ед/л).
На момент госпитализации пациент предъявлял жалобы на боли за грудиной давящего характера, возникающие при физической нагрузке (быстрая ходьба на расстояние 300–400 м, подъем тяжестей), не ирради-ирующие, купирующиеся самостоятельно в покое.
Из анамнеза известно, что артериальной гипертонией страдает в течение нескольких лет, повышение АД с максимальными значениями до 147/90 мм рт. ст., адаптирован к АД 110–120/70–80 мм рт. ст. Коронарный анамнез с 2016 г., когда без предшествующей клиники стенокардии напряжения перенес инфаркт миокарда нижней локализации. В остром периоде была проведена ангиопластика со стентированием правой коронарной артерии. Тогда же, по данным биохимического анализа крови, впервые выявлено повышение уровня общего холестерина до 8,5 ммоль/л. Возобновление клиники стенокардии напряжения – с марта 2018 г., повторно проведена коронароангиография, где был выявлен субтотальный стеноз передней нисходящей артерии. 06.03.2018 выполнено маммарокоронарное шунтирование передней нисходящей артерии. Операция прошла без осложнений. Кроме этого, в течение нескольких лет регистрируется пароксизмальная форма фибрилляции предсердий, тахисистолия, находится на постоянной антикоагулянтной терапии.
Семейный анамнез по ССЗ не отягощен, курил около 30 лет по 1–2 пачки в день, не курит с марта 2018 г. По результатам биохимического анализа крови на фоне терапии розувастатином (препарат генерик) 40 мг и эзетролом 10 мг уровень общего холестерина – 8,12 ммоль/л, ХС ЛПНП – 6,29 ммоль/л, ХС ЛПВП – 1,15 ммоль/л, ТГ – 1,5 ммоль/л, АСТ – 32 Ед/л, АЛТ – 31 Ед/л.
С целью выявления преходящей ишемии миокарда проведена стресс-эхокардиография, проба на выявление скрытой коронарной недостаточности – отрицательная. По результатам ультразвукового исследования сонных артерий выявлен атеросклероз брахиоцефальных артерий, стенозы до 25%.
Учитывая сомнительную эффективность генерика розувастатина, проведена коррекция гиполипидемической терапии, назначен оригинальный розувастатин (Крестор®) 40 мг и эзетрол 10 мг. На фоне максимальной пероральной гиполипидемической терапии через 4 нед уровень общего холестерина составил 4,6 ммоль/л, ХС ЛПНП – 2,74 ммоль/л, ХС ЛПВП – 1,3 ммоль/л, ТГ – 1,23 ммоль/л, АЛТ – 24,0 Ед/л, АСТ – 29,0 Ед/л. Однако, так как целевые значения ХС ЛПНП не достигнуты (<1,4 ммоль/л), рекомендовано добавить к терапии ингибиторы пропротеиновой конвертазы субтилизин-кексинового типа 9 (PCSK9).
На момент госпитализации пациентка предъявляла жалобы на головную боль, сопровождающуюся эпизодами повышения АД до 180/100 мм рт. ст.
Из анамнеза известно, что артериальной гипертонией страдает в течение 2 лет, повышение АД с максимальными значениями – до 200/110 мм рт. ст., адаптирована к АД 120/80 мм рт. ст., ранее находилась на терапии периндоприлом 5 мг/сут.
У пациентки имеется отягощенный семейный анамнез, мать в возрасте 60 лет перенесла острое нарушение мозгового кровообращения, отец имеет в анамнезе 2 инфаркта миокарда, первый в возрасте 45 лет. Вредные привычки отрицает.
По результатам биохимического анализа крови на чистом фоне уровень общего холестерина – 5,9 ммоль/л, ХС ЛПНП – 3,23 ммоль/л, ХС ЛПВП – 1,17 ммоль/л, ТГ – 3,31 ммоль/л, АСТ – 15 Ед/л, АЛТ – 22 Ед/л.
По данным эхокардиографии, выявлена диастолическая дисфункция 1-го типа, в остальном без патологии. Проба на выявление скрытой коронарной недостаточности отрицательная. По результатам ультразвукового исследования сонных артерий выявлено утолщение комплекса интима-медиа.
Учитывая наличие у пациентки повышенного уровня ХС ЛПНП, высокого риска развития сердечно-сосудистых осложнений, пациентке показана гиполипидемическая терапия. Больной назначен оригинальный розувастатин (Крестор®) 20 мг/сут, через 4 нед на фоне гиполипидемической диеты и терапии общий холестерин – 3,7 ммоль/л, ХС ЛПНП – 1,74 ммоль/л, ХС ЛПВП – 1,2 ммоль/л, ТГ – 1,67 ммоль/л, АСТ – 19 Ед/л, АЛТ – 20 Ед/л.
Таким образом, приведенные нами клинические случаи демонстрируют возможность и безопасность применения высокоинтенсивной терапии оригинальным розувастатином (Крестор®) у пациентов разных возрастных групп, относящихся к категории высокого и очень высокого риска развития сердечно-сосудистых осложнений.
Наша задача, как практикующих врачей, руководствоваться терапевтическими стратегиями первичной и вторичной профилактики, основанными на использовании высокоэффективных статинов, снижающих ХС ЛПНП и замедляющих прогрессирование атеросклероза. Безусловно, каждый гиполипидемический препарат (розувастатин, аторвастатин, питавастатин и др.) имеет свои сильные стороны, и выбор основывается на индивидуальных особенностях пациента. Сильная же сторона оригинального розувастатина (препарат Крестор®) – достижение целевых значений ХС ЛПНП и регресс атеросклеротической бляшки.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах / Information about the authors
Прус Юлия Андреевна – лаборант-исследователь лаб. фенотипов атеросклероза, ФГБУ «НМИЦ кардиологии». E-mail: julyprus@mail.ru; ORCID: 0000-0002-5663-3005
Yuliia A. Prus – Laboratory Researcher, National Medical Research Center for Cardiology. E-mail: julyprus@mail.ru; ORCID: 0000-0002-5663-3005
Сергиенко Игорь Владимирович – д-р мед. наук, гл. науч. сотр. лаб. фенотипов атеросклероза, ФГБУ «НМИЦ кардиологии». E-mail: igorcardio@mail.ru; ORCID: 0000-0003-1534-3965
Igor V. Sergienko – D. Sci. (Med.), National Medical Research Center for Cardiology. E-mail: igorcardio@mail.ru; ORCID: 0000-0003-1534-3965
Статья поступила в редакцию / The article received: 09.12.2020
Статья принята к печати / The article approved for publication: 16.12.2020
Клинический разбор в общей медицине №03 2020
Возможности применения розувастатина для достижения целевых значений холестерина липопротеидов низкой плотности в клинической практике
Номера страниц в выпуске:24-28
Аннотация
Статины являются краеугольным камнем терапии гиперхолестеринемии и ишемической болезни сердца. В большом количестве исследований продемонстрирована эффективность гиполипидемической терапии в предотвращении прогрессирования атеросклероза и развития сердечно-сосудистых заболеваний. Оригинальный розувастатин является наиболее эффективным представителем класса статинов в отношении снижения холестерина липопротеидов низкой плотности (ХС ЛПНП). Имеющиеся страхи у пациентов и врачей по поводу назначения высоких доз розувастатина, а также других препаратов данной группы препятствуют достижению целевых значений ХС ЛПНП, и как следствие способствуют прогрессированию атеросклероза. В данной статье продемонстрирована эффективность и безопасность приема высоких доз розувастатина у пациентов разных возрастных групп, имеющих различные сердечно-сосудистые события.
Ключевые слова: гиперхолестеринемия, липопротеиды низкой плотности, атеросклероз, ишемическая болезнь сердца, розувастатин.
Для цитирования: Прус Ю.А., Сергиенко И.В. Возможности применения розувастатина для достижения целевых значений холестерина липопротеидов низкой плотности в клинической практике. Клинический разбор в общей медицине. 2020; 3: 24–28. DOI: 10.47407/kr2020.1.3.00020
Статины являются краеугольным камнем терапии гиперхолестеринемии и ишемической болезни сердца. В большом количестве исследований продемонстрирована эффективность гиполипидемической терапии в предотвращении прогрессирования атеросклероза и развития сердечно-сосудистых заболеваний. Оригинальный розувастатин является наиболее эффективным представителем класса статинов в отношении снижения холестерина липопротеидов низкой плотности (ХС ЛПНП). Имеющиеся страхи у пациентов и врачей по поводу назначения высоких доз розувастатина, а также других препаратов данной группы препятствуют достижению целевых значений ХС ЛПНП, и как следствие способствуют прогрессированию атеросклероза. В данной статье продемонстрирована эффективность и безопасность приема высоких доз розувастатина у пациентов разных возрастных групп, имеющих различные сердечно-сосудистые события.
Ключевые слова: гиперхолестеринемия, липопротеиды низкой плотности, атеросклероз, ишемическая болезнь сердца, розувастатин.
Для цитирования: Прус Ю.А., Сергиенко И.В. Возможности применения розувастатина для достижения целевых значений холестерина липопротеидов низкой плотности в клинической практике. Клинический разбор в общей медицине. 2020; 3: 24–28. DOI: 10.47407/kr2020.1.3.00020
Possibilities of using rosuvastatin to achieve target level of low-density lipoprotein cholesterol in clinical practice
Yuliia A. Prus, Igor V. SergienkoNational Medical Research Center for Cardiology, Moscow, Russia julyprus@mail.ru
Abstract
Statins are the cornerstone of therapy for hypercholesterolemia and coronary artery disease. A large number of studies have demonstrated the effectiveness of lipid-lowering therapy in preventing the progression of atherosclerosis and the development of cardiovascular diseases. The original rosuvastatin is one of the most effective statin medication in its class used to reduce low-density lipoprotein (LDL) cholesterol. The existing fears of patients and doctors about the high doses of rosuvastatin, as well as other drugs in this group, prevent the achievement of the target LDL cholesterol values, and, as a result, contribute to the progression of atherosclerosis. This article demonstrates the efficacy and safety of taking high doses of rosuvastatin in patients of different age groups with various cardiovascular events.
Key words: hypercholesterolemia, low-density lipoproteins, atherosclerosis, ischemic heart disease, rosuvastatin.
For citation: Prus Yu.A., Sergienko I.V. Possibilities of using rosuvastatin to achieve target level of low-density lipoprotein cholesterol in clinical practice. Clinical review for general practice. 2020; 3: 24–28. DOI: 10.47407/kr2020.1.3.00020
Гиперлипидемия – один из основных независимых модифицируемых факторов риска развития ишемической болезни сердца (ИБС), а также других осложнений со стороны сердечно-сосудистой системы. Статины (ингибиторы 3-гидрокси-3-метилглутарил-коэнзимаА-редуктазы – ГМГ-КоА-редуктазы) составляют основу фармакологического лечения гиперлипидемии с целью первичной и вторичной профилактики сердечно-сосудистых заболеваний (ССЗ) [1, 2]. Данная группа препаратов используется для снижения уровня холестерина липопротеидов низкой плотности (ХС ЛПНП), который является одним из важнейших факторов риска развития атеросклероза [3].
Результаты 26 рандомизированных исследований с участием 170 тыс. пациентов показали, что снижение уровня ХС ЛПНП на 1 ммоль/л (приблизительно
38,7 мг/дл) снижает риск серьезных сердечно-сосудистых событий на 22%, а смертность от ИБС на 20% [4].
Среди имеющихся в настоящее время статинов оригинальный розувастатин (Крестор®) является самым активным препаратом данного класса. Свою эффективность и безопасность розувастатин доказал в многочисленных исследованиях. Например, в исследовании STELLAR у 2431 включенных пациентов оценивалась эффективность различных доз розувастатина (10–80 мг), аторвастатина (10–80 мг), симвастатина (10–80 мг), а также правастатина (10–40 мг) на показатели липидного профиля. Снижение уровня ХС ЛПНП на терапии розувастатином 10–40 мг наблюдалось на 8% больше, чем у группы пациентов, принимающих аторвастатин, на 28% больше, чем у больных на терапии правастатином, и на 12–18% больше, чем у больных, получавших симвастатин 10–80 мг (р<0,001 для всех значений). Согласно рекомендациям Национальной образовательной программы по холестерину в США (National Cholesterol Education Program Adult Treatment Panel III – NCEP АТР III), целевой уровень ХС ЛПНП был достигнут у 82–89% пациентов в группе розувастатина 10–40 мг, и у 69–85% – в группе аторвастатина 10–80 мг [5].
В многоцентровом рандомизированном исследовании JUPITER с участием 17802 пациентов с уровнем ХС ЛПНП не более 3,4 ммоль/л (130 мг/дл), уровнем триглицеридов (ТГ) не более 5,6 ммоль/л и высокочувствительным С-реактивным белком (СРБ) более 2 мг/л оценивалась эффективность монотерапии оригинальным розувастатином (Крестор®) 20 мг для первичной профилактики ССЗ по сравнению с группой плацебо. Уровни ХС ЛПНП и СРБ на фоне терапии оригинальным розувастатином 20 мг уменьшились на 50 и 37% соответственно, при этом риск развития инфаркта миокарда снизился на 54% (p<0,00001), инсульта – на 48% (p<0,00001). Общая смертность за период наблюдения (медиана 1,9 года) достоверно снизилась на 20% (p=0,02). При этом частота появления побочных эффектов была одинаковой между группами. Так, частота возникновения миопатии в группе оригинального розувастатина составила 0,1% пациентов, как и в группе плацебо. Повышение уровня аланинаминотрансферазы (АЛТ) более 3 верхних границ нормы в группе розувастатина наблюдалось у 0,2% больных, в группе плацебо – у 0,3% [6]. Безопасность применения розувастатина подтверждена и другими исследованиями [7, 8].
В двухлетнем двойном слепом плацебо-контролируемом исследовании METEOR продемонстрирована эффективность розувастатина 40 мг в замедлении прогрессирования атеросклероза как в целом, так и в отдельных сегментах сонных артерий у группы пациентов среднего возраста с низким риском развития ССЗ по сравнению с группой плацебо (толщина комплекса интима-медиа уменьшалась в группе розувастатина на 0,0014 мм в год, 95% доверительный интервал – ДИ -0,0041–0,0014 мм в год; увеличивалась в группе плацебо на 0,0131 мм в год, 95% ДИ 0,0087–0,0174 мм в год; p<0,001). Кроме того, розувастатин снижал уровни ХС ЛПНП на 49%, общего холестерина – на 34%, ТГ – на 16%, а также увеличивал уровень холестерина липопротеидов высокой плотности (ХС ЛПВП) на 8% (все p<0,001 по сравнению с плацебо) [9]. В исследовании ASTEROID высокоинтенсивная терапия оригинальным розувастатином также способствовала регрессу атеросклеротических бляшек в коронарных артериях у включенных пациентов. На фоне лечения уменьшился общий объем атеромы на 6,8%, по данным внутрисосудистого ультразвукового исследования. Ни одного случая рабдомиолиза выявлено не было [10]. Регресс атеросклеротических бляшек на фоне терапии оригинальным розувастатином 40 мг и аторвастатином 80 мг наблюдался и в 104-недельном исследовании SATURN с участием 1039 пациентов. Однако пациенты, получавшие оригинальный розувастатин, имели тенденцию к более значимому регрессу атеромы (68,5% против 63,2% для группы аторвастатина 80 мг, p=0,07). Кроме этого, терапия розувастатином 40 мг способствовала более значимому снижению уровня ХС ЛПНП по сравнению с аторвастатином 80 мг [1,62±0,03 ммоль/л (62,6±1,0 мг/дл) против 1,82±0,03 ммоль/л (70,2±1,0 мг/дл) соответственно, p<0,001] [11].
Клиническая программа GALAXY включала оценку безопасности и эффективности применения оригинального розувастатина (препарат Крестор®) и у пациентов с метаболическим синдромом и сахарным диабетом 2-го типа. Так, в проспективном рандомизированном исследовании COMETS у пациентов с метаболическим синдромом отмечалось более значимое снижение ХС ЛПНП на фоне терапии оригинальным розувастатином 10 и 20 мг/сут по сравнению с аторвастатином 10 мг/сут и плацебо в течение 6–12 нед [12]. А в исследовании ANDROMEDA, включающем 509 пациентов с сахарным диабетом 2-го типа, снижение уровня ХС ЛПНП на 51 и 57% через 16 нед лечения было выявлено на фоне терапии розувастатином 10 и 20 мг соответственно, а на фоне лечения аторвастатином 10 и 20 мг – на 39 и 46% соответственно. Розувастатин в дозе 10 и 20 мг продемонстрировал свое преимущество и в способности достоверно снижать уровень высокочувствительного СРБ по сравнению с группой аторвастатина 10 и 20 мг (34 и 39,8% против 21 и 33,8% соответственно) [13].
Тем не менее, несмотря на доказанную эффективность и безопасность применения статинов, в настоящее время во всем мире, и в частности в России, практикующими врачами не назначаются высокие дозы статинов, а также многокомпонентные схемы гиполипидемической терапии, что необратимо приводит к недостижению целевых значений ХС ЛПНП и прогрессированию атеросклероза. В качестве примеров, иллюстрирующих необходимость и безопасность применения оригинального розувастатина (Крестора), представляем клинические случаи пациентов с гиперлипидемией и различными сердечно-сосудистыми событиями.
Клинический случай 1
Пациент З., 79 лет, в 2019 г. госпитализирован в ФГБУ «НМИЦ кардиологии» с диагнозом: ИБС: стенокардия напряжения 3-го функционального класса. Гипертоническая болезнь III стадии. Артериальная гипертония 3-й степени. Гиперлипидемия IIA. Риск сердечно-сосудистых осложнений 4 (очень высокий).При поступлении пациент предъявлял жалобы на боли за грудиной давящего характера, возникающие при физической нагрузке (ходьба на расстояние 100 м, подъем на один лестничный пролет), иррадиирующие в левую руку, купирующиеся приемом нитратов в течение 1–2 мин.
Из анамнеза известно, что гипертонической болезнью страдает около 10 лет, повышение артериального давления (АД) с максимальными значениями – до 180/100 мм рт. ст., адаптирован к АД 120–130/80 мм рт. ст. Клиника стенокардии в течение 2 лет, постепенно прогрессирует. Семейный анамнез по ССЗ не отягощен, курит более 50 лет до 1 пачки в день.
По результатам биохимического анализа крови на фоне терапии аторвастатином (20 мг) уровень общего холестерина – 4,04 ммоль/л, ХС ЛПНП – 1,9 ммоль/л, ХС ЛПВП – 1,74 ммоль/л, ТГ – 1,09 ммоль/л, аспартатаминотрансферазы (АСТ) – 24 Ед/л, АЛТ – 18 Ед/л. По данным электрокардиографии (ЭКГ), ритм синусовый с частотой сердечных сокращений (ЧСС) – 68 уд/мин, единичная наджелудочковая экстрасистола. Отклонение электрической оси сердца влево.
С целью выявления преходящей ишемии миокарда пациенту проведена однофотонная эмиссионная компьютерная томография миокарда, синхронизированная с ЭКГ (С-ОЭКТ) по протоколу покой/нагрузка. Проба на выявление ишемии миокарда – положительная, на максимуме нагрузки при ЧСС 116 уд/мин регистрировалась горизонтальная депрессия сегмента ST II, aVF, V4–V6 до 2,4 мм, сопровождаемая болью за грудиной давящего характера. При данном уровне выполненной нагрузки и достигнутой при этом ЧСС отмечалось ухудшение перфузии миокарда всех сегментов верхушки, передней, передне-перегородочной стенок, всех сегментов нижне-перегородочной, нижней стенок, общей площадью около 50% от площади левого желудочка. После нагрузочной пробы отмечается снижение глобальной сократимости миокарда левого желудочка до 39%, развитие зоны гипокинеза перегородочной локализации (см. рисунок).
Учитывая достоверную преходящую ишемию миокарда, больному проведена коронароангиография, где выявлены 90% стеноз в устье и 70% стеноз в среднем сегменте передней нисходящей артерии, 80% – стеноз в проксимальном сегменте огибающей артерии, 70% – стеноз в среднем сегменте правой коронарной артерии. Одномоментно была выполнена ангиопластика со стентированием проксимального сегмента огибающей артерии и ствола левой коронарной артерии с переходом на проксимальный и средний сегменты передней нисходящей артерии. После оперативного вмешательства пациент отмечал увеличение толерантности к физической нагрузке, приступы стенокардии не рецидивировали.
В рамках обследования пациенту также проведено ультразвуковое исследование брахиоцефальных артерий, по результатам которого выявлен стенозирующий атеросклероз брахиоцефальных артерий, стенозы до 50%.
С учетом изложенного выставлен диагноз: ИБС: стенозирующий атеросклероз коронарных артерий, стенокардия напряжения III функционального класса. Ангиопластика со стентированием проксимального сегмента огибающей артерии стентом Resolute integrity 3,0×34 мм и ствола левой коронарной артерии с переходом на проксимальный и средний сегменты передней нисходящей артерии стентами Resolute Integrity 4,0×34 мм, Resolute Integrity 3,0×12 мм от 21.0.2019 г. Гипертоническая болезнь III стадии. Артериальная гипертония 3-й степени, медикаментозно достигнута 1-я степень. Атеросклероз аорты. Стенозирующий атеросклероз экстракраниального отдела брахиоцефальных артерий. Гиперлипидемия IIA. Риск сердечно-сосудистых осложнений 4 (очень высокий).
Учитывая мультифокальный атеросклероз, многососудистое поражение коронарных артерий, а также недостижение целевых значений ХС ЛПНП, пациенту скорректирована гиполипидемическая терапия, назначен оригинальный розувастатин (Крестор®) 20 мг/сут. Через 4 нед приема препарата отмечается достижение целевых значений ХС ЛПНП – 1,4 ммоль/л, а также отсутствие побочных эффектов (АСТ – 20 Ед/л, АЛТ – 21 Ед/л).

Клинический случай 2
Пациент Я., 45 лет, госпитализирован в ФГБУ «НМИЦ кардиологии» Минздрава России с диагнозом: ИБС: стенозирующий атеросклероз коронарных артерий, стенокардия напряжения II функционального класса, постинфарктный кардиосклероз (инфаркт миокарда нижней локализации от 2016 г.). Ангиопластика со стентированием правой коронарной артерии от 2016 г. Маммарокоронарное шунтирование передней нисходящей артерии от 06.03.2018. Возможная семейная гетерозиготная гиперхолестеринемия (5 баллов, согласно Голландским критериям). Нарушение ритма сердца: пароксизмальная форма фибрилляции предсердий, тахисистолический вариант. Гипертоническая болезнь III стадии. Артериальная гипертония 1-й степени. Атеросклероз аорты, экстракраниального отдела брахиоцефальных артерий. Риск сердечно-сосудистых осложнений 4 (очень высокий). Ожирение 1-й степени по абдоминальному типу.На момент госпитализации пациент предъявлял жалобы на боли за грудиной давящего характера, возникающие при физической нагрузке (быстрая ходьба на расстояние 300–400 м, подъем тяжестей), не ирради-ирующие, купирующиеся самостоятельно в покое.
Из анамнеза известно, что артериальной гипертонией страдает в течение нескольких лет, повышение АД с максимальными значениями до 147/90 мм рт. ст., адаптирован к АД 110–120/70–80 мм рт. ст. Коронарный анамнез с 2016 г., когда без предшествующей клиники стенокардии напряжения перенес инфаркт миокарда нижней локализации. В остром периоде была проведена ангиопластика со стентированием правой коронарной артерии. Тогда же, по данным биохимического анализа крови, впервые выявлено повышение уровня общего холестерина до 8,5 ммоль/л. Возобновление клиники стенокардии напряжения – с марта 2018 г., повторно проведена коронароангиография, где был выявлен субтотальный стеноз передней нисходящей артерии. 06.03.2018 выполнено маммарокоронарное шунтирование передней нисходящей артерии. Операция прошла без осложнений. Кроме этого, в течение нескольких лет регистрируется пароксизмальная форма фибрилляции предсердий, тахисистолия, находится на постоянной антикоагулянтной терапии.
Семейный анамнез по ССЗ не отягощен, курил около 30 лет по 1–2 пачки в день, не курит с марта 2018 г. По результатам биохимического анализа крови на фоне терапии розувастатином (препарат генерик) 40 мг и эзетролом 10 мг уровень общего холестерина – 8,12 ммоль/л, ХС ЛПНП – 6,29 ммоль/л, ХС ЛПВП – 1,15 ммоль/л, ТГ – 1,5 ммоль/л, АСТ – 32 Ед/л, АЛТ – 31 Ед/л.
С целью выявления преходящей ишемии миокарда проведена стресс-эхокардиография, проба на выявление скрытой коронарной недостаточности – отрицательная. По результатам ультразвукового исследования сонных артерий выявлен атеросклероз брахиоцефальных артерий, стенозы до 25%.
Учитывая сомнительную эффективность генерика розувастатина, проведена коррекция гиполипидемической терапии, назначен оригинальный розувастатин (Крестор®) 40 мг и эзетрол 10 мг. На фоне максимальной пероральной гиполипидемической терапии через 4 нед уровень общего холестерина составил 4,6 ммоль/л, ХС ЛПНП – 2,74 ммоль/л, ХС ЛПВП – 1,3 ммоль/л, ТГ – 1,23 ммоль/л, АЛТ – 24,0 Ед/л, АСТ – 29,0 Ед/л. Однако, так как целевые значения ХС ЛПНП не достигнуты (<1,4 ммоль/л), рекомендовано добавить к терапии ингибиторы пропротеиновой конвертазы субтилизин-кексинового типа 9 (PCSK9).
Клинический случай 3
Пациентка М., 58 лет, госпитализирована в ФГБУ «НМИЦ кардиологии» с диагнозом: гипертоническая болезнь II стадии; артериальная гипертония 3-й степени; гиперлипидемия IIБ; риск сердечно-сосудистых осложнений 3 (высокий); ожирение 1-й степени по абдоминальному типу.На момент госпитализации пациентка предъявляла жалобы на головную боль, сопровождающуюся эпизодами повышения АД до 180/100 мм рт. ст.
Из анамнеза известно, что артериальной гипертонией страдает в течение 2 лет, повышение АД с максимальными значениями – до 200/110 мм рт. ст., адаптирована к АД 120/80 мм рт. ст., ранее находилась на терапии периндоприлом 5 мг/сут.
У пациентки имеется отягощенный семейный анамнез, мать в возрасте 60 лет перенесла острое нарушение мозгового кровообращения, отец имеет в анамнезе 2 инфаркта миокарда, первый в возрасте 45 лет. Вредные привычки отрицает.
По результатам биохимического анализа крови на чистом фоне уровень общего холестерина – 5,9 ммоль/л, ХС ЛПНП – 3,23 ммоль/л, ХС ЛПВП – 1,17 ммоль/л, ТГ – 3,31 ммоль/л, АСТ – 15 Ед/л, АЛТ – 22 Ед/л.
По данным эхокардиографии, выявлена диастолическая дисфункция 1-го типа, в остальном без патологии. Проба на выявление скрытой коронарной недостаточности отрицательная. По результатам ультразвукового исследования сонных артерий выявлено утолщение комплекса интима-медиа.
Учитывая наличие у пациентки повышенного уровня ХС ЛПНП, высокого риска развития сердечно-сосудистых осложнений, пациентке показана гиполипидемическая терапия. Больной назначен оригинальный розувастатин (Крестор®) 20 мг/сут, через 4 нед на фоне гиполипидемической диеты и терапии общий холестерин – 3,7 ммоль/л, ХС ЛПНП – 1,74 ммоль/л, ХС ЛПВП – 1,2 ммоль/л, ТГ – 1,67 ммоль/л, АСТ – 19 Ед/л, АЛТ – 20 Ед/л.
Таким образом, приведенные нами клинические случаи демонстрируют возможность и безопасность применения высокоинтенсивной терапии оригинальным розувастатином (Крестор®) у пациентов разных возрастных групп, относящихся к категории высокого и очень высокого риска развития сердечно-сосудистых осложнений.
Наша задача, как практикующих врачей, руководствоваться терапевтическими стратегиями первичной и вторичной профилактики, основанными на использовании высокоэффективных статинов, снижающих ХС ЛПНП и замедляющих прогрессирование атеросклероза. Безусловно, каждый гиполипидемический препарат (розувастатин, аторвастатин, питавастатин и др.) имеет свои сильные стороны, и выбор основывается на индивидуальных особенностях пациента. Сильная же сторона оригинального розувастатина (препарат Крестор®) – достижение целевых значений ХС ЛПНП и регресс атеросклеротической бляшки.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах / Information about the authors
Прус Юлия Андреевна – лаборант-исследователь лаб. фенотипов атеросклероза, ФГБУ «НМИЦ кардиологии». E-mail: julyprus@mail.ru; ORCID: 0000-0002-5663-3005
Yuliia A. Prus – Laboratory Researcher, National Medical Research Center for Cardiology. E-mail: julyprus@mail.ru; ORCID: 0000-0002-5663-3005
Сергиенко Игорь Владимирович – д-р мед. наук, гл. науч. сотр. лаб. фенотипов атеросклероза, ФГБУ «НМИЦ кардиологии». E-mail: igorcardio@mail.ru; ORCID: 0000-0003-1534-3965
Igor V. Sergienko – D. Sci. (Med.), National Medical Research Center for Cardiology. E-mail: igorcardio@mail.ru; ORCID: 0000-0003-1534-3965
Статья поступила в редакцию / The article received: 09.12.2020
Статья принята к печати / The article approved for publication: 16.12.2020
Список исп. литературыСкрыть список1. Mach F, Baigent C, Catapano AL et al. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. Eur Heart J 2020; 41 (1); 111–88.
2. Grundy SM, Stone NJ, Bailey AL et al. 2018 AHA/ACC/AACVPR/AAPA/ABC/ACPM/ADA/AGS/APhA/ASPC/NLA/PCNA Guideline on the Management of Blood Cholesterol: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Circulation 2019; 139 (25): e1082–e1143.
3. Liberale L, Carbone F, Montecucco F, Sahebkar A. Statins reduce vascular inflammation in atherogenesis: A review of underlying molecular mechanisms. Int J Biochem Cell Biol 2020; 122: 105735.
4. Trialists C, Baigent C, Blackwell L et al. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170,000 participants in 26 randomised trials. Lancet 2010; 376 (9753): 1670–81.
5. Jones PH, Hunninghake DB, Ferdinand KC et al. Effects of rosuvastatin versus atorvastatin, simvastatin, and pravastatin on non-high-density lipoprotein cholesterol, apolipoproteins, and lipid ratios in patients with hypercholesterolemia: additional results from the STELLAR trial. Clin Ther 2004; 26 (9): 1388–99.
6. Ridker PM, Danielson E, Fonseca FA et al. Rosuvastatin to prevent vascular events in men and women with elevated C-reactive protein. N Engl J Med 2008; 359 (21): 2195–207.
7. Kjekshus J, Apetrei E, Barrios V et al. Rosuvastatin in older patients with systolic heart failure. N Engl J Med 2007; 357 (22): 2248–61.
8. Tavazzi L, Maggioni AP, Marchioli R et al. Effect of rosuvastatin in patients with chronic heart failure (the GISSI-HF trial): a randomised, double-blind, placebo-controlled trial. Lancet 2008; 372 (9645): 1231–9.
9. Crouse JR, 3rd, Raichlen JS, Riley WA et al. Effect of rosuvastatin on progression of carotid intima-media thickness in low-risk individuals with subclinical atherosclerosis: the METEOR Trial. JAMA 2007; 297 (12): 1344–53.
10. Nissen SE, Nicholls SJ, Sipahi I et al. Effect of very high-intensity statin therapy on regression of coronary atherosclerosis: the ASTEROID trial. JAMA 2006; 295 (13): 1556–65.
11. Nicholls SJ, Ballantyne CM, Barter PJ et al. Effect of two intensive statin regimens on progression of coronary disease. N Engl J Med 2011; 365 (22): 2078–87.
12. Stalenhoef AF, Ballantyne CM, Sarti C et al. A comparative study with rosuvastatin in subjects with metabolic syndrome: results of the COMETS study. Eur Heart J 2005; 26 (24): 2664–72.
13. Betteridge DJ, Gibson JM, Sager PT. Comparison of effectiveness of rosuvastatin versus atorvastatin on the achievement of combined
C-reactive protein (<2 mg/L) and low-density lipoprotein cholesterol (<70 mg/dl) targets in patients with type 2 diabetes mellitus (from the ANDROMEDA study). Am J Cardiol 2007; 100 (8): 1245–8.
30 декабря 2020
Количество просмотров: 10515


