Клинический разбор в общей медицине №02 2021
Elena P. Karpova2, Elena Yu. Radzig6, Svetlana V. Zaitseva3, Evelina E. Lokshina3, Olga U. Stetsyuk1, Irina V. Andreeva1
1Smolensk State Medical University of the Ministry of Health of the Russian Federation, Smolensk, Russia;
2Russian Medical Academy of Continuous Professional Education, Moscow, Russia;
3 Yevdokimov Moscow State University of Medicine and Dentistry, Moscow, Russia;
4The Peoples' Friendship University of Russia, Moscow, Russia;
5City Clinical Hospital 24 DZM, Moscow, Russia;
6Pirogov Russian National Research Medical University, Moscow, Russia
aisyn@list.ru, olga6505963@yandex.ru
Abstract
The meeting of Expert Council, which included representatives of leading Russian research and higher education medical institutions, took place in Moscow. The Council discussed approaches to therapy of respiratory tract infections and ENT infections in children considering the global increase in antimicrobial resistance of respiratory tract pathogens. Special attention was paid to the use of new dosage form of amoxicillin-clavulanate 14:1, as well as to defining the category of patients to whom it is advisable to prescribe the high-dose amoxicillin-clavulanate.
Key words: Expert Council, antibacterial therapy, antimicrobial resistance, community-acquired infections, respiratory tract infections, respiratory infections, amoxicillin-clavulanate, high-dose therapy, children.
For citation: Kozlov R.S., Sinopalnikov A.I., Zaitseva O.V., Zyryanov S.K., Karpova E.P., Radzig E.Yu., Zaitseva S.V., Lokshina E.E.,
Stetsyuk O.U., Andreeva I.V. Inhibitor-protected amoxicillin with increased amoxicillin content and active ingredients ratio of 14:1: the use for treatment of community-acquired respiratory infections and ENT infections in children. Expert Council Resolution. Clinical review for general practice. 2021; 2: 6–14. DOI: 10.47407/kr2021.2.1.00036
25 января 2021 г. в Москве состоялось заседание экспертного совета «Ингибиторозащищенный амоксициллин с повышенным содержанием амоксициллина и соотношением действующих компонентов 14:1: место в лечении внебольничных инфекций дыхательных путей и ЛОР-органов у детей», в состав которого вошли представители ведущих российских научно-исследовательских и образовательных медицинских учреждений, признанные экспертами в области профилактики, диагностики и лечения инфекций дыхательных путей и ЛОР-органов у детей.
Между тем пандемия коронавирусной инфекции не отменила необходимость применения антибиотиков при обычных бактериальных респираторных инфекциях, таких как внебольничная пневмония, острый средний отит (ОСО), острый бактериальный риносинусит (ОБРС), стрептококковый тонзиллофарингит, распространенность которых отнюдь не уменьшилась в период пандемии. Пациенты детского возраста, как правило, переносят COVID-19 легко или бессимптомно, но актуальность перечисленных выше бактериальных инфекций дыхательных путей (ИДП) у педиатрической популяции пациентов очень высока.
Кроме того, перераспределение ресурсов здравоохранения в связи с пандемией COVID-19 в определенной мере лимитировало возможности бактериологических лабораторий в отношении выделения бактериальных патогенов и определения их чувствительности к антибиотикам, а также ограничило представление глобальных (по городу, региону, стране) данных по антибиотикорезистентности основных возбудителей. Насколько ухудшится ситуация с антибиотикорезистентностью ведущих респираторных патогенов после столь широкого нерационального использования АБП (в первую очередь макролидов (азитромицин) и респираторных фторхинолонов) при COVID-19, можно лишь предполагать – многие эксперты вполне обоснованно прогнозируют крайне неблагоприятные исходы [1].
Целью заседания настоящего экспертного совета было определение места ингибиторозащищенного амоксициллина с повышенным содержанием амоксициллина и соотношением действующих компонентов 14:1 в лечении внебольничных ИДП и ЛОР-органов у детей.
Ситуация с антибиотикорезистентностью респираторных патогенов, выделенных у детей в Российской Федерации за период с 2016 по 2018 г., будет рассмотрена в первую очередь по данным онлайн-проекта «Карта антибиотикорезистентности России» – AMRmap (https://amrmap.ru/), который разработан совместно Научно-исследовательским институтом антимикробной химиотерапии ФГБОУ ВО СГМУ Минздрава России и Межрегиональной ассоциацией по клинической микробиологии и антимикробной химиотерапии [5], а также по другим публикациям по этой проблематике за указанный период времени.
S. pneumoniae (пневмококк) – один из наиболее клинически значимых возбудителей ИДП и ЛОР-органов, в отношении которого должна проводиться максимально эффективная антибактериальная терапия [6, 7]. Устойчивая тенденция, наблюдаемая в течение последних 10–15 лет, – повсеместное снижение чувствительности пневмококков к макролидам, а также появление и распространение в последнее десятилетие штаммов со сниженной чувствительностью к пенициллину и цефтриаксону.
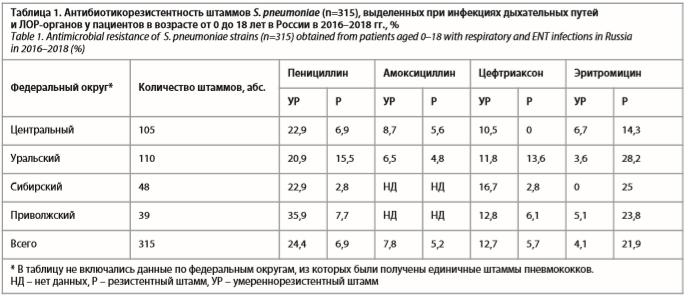
При анализе данных «Карты антибиотикорезистентности России» за 2016–2018 гг. отмечены существенные изменения в антибиотикорезистентности пневмококков, выделенных у пациентов педиатрической популяции, по сравнению с более ранними периодами времени (табл. 1). Так, существенно выросли показатели устойчивости S. pneumoniae к пенициллину: в среднем по России частота умереннорезистентных штаммов составляет около 25%, а резистентных – почти 7%. Распространение пенициллинорезистентных пневмококков сопровождается увеличением числа изолятов, нечувствительных к парентеральным цефалоспоринам III поколения (цефтриаксону), что составляет 12,7% для умереннорезистентных и 5,7% для резистентных штаммов. Частота резистентности S. pneumoniae к макролидам по Российской Федерации превысила 25%. Особенно неблагоприятная ситуация с устойчивостью пневмококков (умереннорезистентные + резистентные штаммы) сложилась в Уральском и Приволжском федеральных округах: к пенициллину были устойчивы 36,4 и 43,6% протестированных штаммов соответственно, к эритромицину (маркеру всех макролидов) – 31,8 и 28,9% соответственно, к цефтриаксону – 25,4% в Уральском федеральном округе (см. табл. 1).
По данным опубликованного в 2018 г. международного исследования антибиотикорезистентности SOAR (Survey of Antibiotic Resistance), в ходе которого были протестированы 279 штаммов S. pneumoniae, выделенных у пациентов в 3 городах Российской Федерации (Москве, Санкт-Петербурге и Смоленске) в 2014–2016 гг., уровень нечувствительности к пенициллину составил 33%, к макролидам были устойчивы 31,2% штаммов.
В то же время подавляющее большинство выделенных штаммов пневмококка (95%) были чувствительны к амоксициллину/клавуланату [8].
Сходная картина антибиотикорезистентности была выявлена по данным определения чувствительности штаммов S. pneumoniae, выделенных при назофарингеальном носительстве у здоровых детей в Москве за период 2013–2017 гг. (n=403): нечувствительными к пенициллину были 35,7% изолятов (из них 2,7% – высокорезистентны), амоксициллин/клавуланат сохранял активность в отношении 97,3% выделенных штаммов пневмококков [9].
Согласно данным глобальной программы мониторинга антимикробной резистентности SENTRY Antimicrobial Surveillance Program за период 2015–2017 гг., чувствительность штаммов S. pneumoniae (n=324), выделенных у пациентов с внебольничной пневмонией в странах Восточной Европы, к пенициллину составила 62%, к цефтриаксону – 89,9%, к амоксициллину/клавуланату – 89,8%, к азитромицину – 64,8% [10].
В исследовании SOAR 2014–2016 гг. также тестировались 279 штаммов H. influenzae, выделенных у пациентов в Российской Федерации [8]. Нечувствительными к амоксициллину были 19% изолятов, при этом продукция β-лактамаз была обнаружена у 15,4% штаммов. Чувствительными к амоксициллину/клавуланату оказались ≥97,5% изолятов гемофильной палочки [8]. По данным SENTRY Antimicrobial Surveillance Program, из 267 протестированных изолятов H. influenzae, выделенных у пациентов с внебольничной пневмонией в Восточной Европе, чувствительными к ампициллину были 85% штаммов, в то время как амоксициллин/клавуланат и цефтриаксон были активны в отношении 99,3 и 100% штаммов соответственно [10].
Таким образом, результаты целого ряда российских и международных исследований, опубликованных в последние годы, выявили тревожные тенденции, в частности, увеличение числа β-лактамазапродуцирующих штаммов H. influenzae, резистентных к незащищенным аминопенициллинам (15–20%), рост резистентности пневмококков к макролидам (~25–30%), распространение штаммов со сниженной чувствительностью и резистентных к пенициллину (>30%), а также, в отдельных регионах, – изолятов S. pneumoniae со сниженной чувствительностью к парентеральным цефалоспоринам III поколения (цефотаксиму и цефтриаксону).
Проблема роста резистентности S. pneumoniae к пенициллину, а H. influenzae – к незащищенным аминопенициллинам не является исключительно российской: аналогичные тенденции на протяжении уже двух десятилетий наблюдаются во всем мире [10–18]. Однако в целом показатели резистентности пневмококков к пенициллину в России выше, чем в большинстве европейских стран [18]. В связи с этим назрела необходимость пересмотра основных подходов к назначению антибиотиков при бактериальных респираторных инфекциях.
Необходимо отметить, что риск селекции резистентных штаммов возрастает при использовании субоптимальных доз АБП, недостаточных для надежной эрадикации возбудителя [19]. Следовательно, для обеспечения максимальной «экологической» безопасности терапии необходимо использовать высокоэффективные АБП в довольно высоких дозах. Именно такой подход соответствует принципу «убитые бактерии не мутируют» [20].
В педиатрической практике при инфекциях, вызванных устойчивыми к пенициллину штаммами пневмококков, гарантированную эффективность обеспечивает только амоксициллин или амоксициллин/клавуланат в высокой дозе (90 мг/кг/сут по амоксициллину) [24]. Благоприятный профиль безопасности и низкая токсичность позволяют безопасно применять высокие дозы амоксициллина/клавуланата [25]. Традиционные же режимы дозирования амоксициллина и амоксициллина/клавуланата (45–60 мг/кг/сут по амоксициллину, детям до 3 месяцев – максимально 30 мг/кг/сут) обладают «пограничной» активностью в отношении штаммов S. pneumoniae со сниженной чувствительностью к пенициллину [21].
Кроме этого, необходимо отметить, что в отличие от амоксициллина, амоксициллин/клавуланат также сохраняет активность в отношении штаммов H. influenzae, продуцирующих β-лактамазы [19]. Таким образом, если у ребенка есть риск, что ИДП вызвана пенициллинорезистентным штаммом S. pneumoniae и/или штаммом гемофильной палочки, продуцирующим β-лактамазы, необходимы высокая доза амоксициллина и комбинация антибиотика с ингибитором β-лактамаз. Высокодозная форма амоксициллина/клавуланата, обладая высокой клинической и микробиологической эффективностью, также минимизирует риск развития антибиотикорезистентности [24].
В 2018 г. на экспертном совете «Принципы рациональной антибиотикотерапии респираторных инфекций у детей. Сохраним антибиотики для будущих поколений» были выделены следующие индивидуальные факторы риска инфицирования лекарственно-устойчивыми возбудителями [26]:
• прием АБП в течение предшествующих 3 месяцев, особенно если их назначение было неадекватным (в субоптимальной дозе и/или на слишком длительный срок);
• посещение детских дошкольных учреждений;
• госпитализация в течение предшествующих 3 месяцев;
• контакт с детьми, посещающими дошкольные учреждения;
• проживание в интернатах, детских домах, учреждениях длительного ухода;
• состояния и заболевания, которые сопровождаются повышенной чувствительностью к инфекции и, соответственно, частым назначением АБП:
• иммуносупрессивные заболевания/состояния;
• применение глюкокортикоидов, цитостатиков;
• лечение гемодиализом;
• сахарный диабет;
• хронические заболевания органов дыхания;
• недавние путешествия.
Можно предполагать, что с учетом прогнозируемого роста антибиотикорезистентности, вследствие часто нерационального применения АБП в настоящее время, актуальность сформулированных положений о факторах риска антибиотикорезистентности будет только возрастать. Именно поэтому при лечении респираторных инфекций выбор стартовой терапии все чаще решается в пользу назначения препарата с более широкими терапевтическими возможностями и микробиологическим спектром – ингибиторозащищенного амоксициллина [26].
В целом в Российской Федерации в настоящее время амоксициллин остается препаратом выбора в качестве стартовой терапии у пациентов с нетяжелым течением инфекции, не имеющих факторов риска инфекции, вызванной антибиотикорезистентными возбудителями. При наличии факторов риска инфекции, вызванной устойчивыми патогенами, а также при неэффективности стартовой антибактериальной терапии следует рассмотреть назначение амоксициллина/клавуланата [26]. Подходы к назначению обычных (45–60 мг/кг/сут) или высоких (90 мг/кг/сут) доз амоксициллина/клавуланата будут детально рассмотрены ниже.
Особое внимание эксперты акцентировали на юридических аспектах применения лекарственных средств, в частности, возможностях использования амоксициллина и амоксициллина/клавуланата в высоких дозах. Эксперты подчеркнули, что назначение лекарственного средства регламентируется инструкцией по медицинскому применению лекарственного препарата, и назначать амоксициллин и амоксициллин/клавуланат в дозе 90 мг/кг/сут (по амоксициллину) можно только при наличии указаний в инструкции на возможность данного режима дозирования. Лишь у нескольких препаратов с активным ингредиентом «амоксициллин» имеется возможность применения в указанной дозе [27–29], причем для ряда лекарственных форм (капсулы по 250 и 500 мг) имеются противопоказания (возраст до 5 лет и/или масса тела до 40 кг) [28, 29], то есть эти препараты не могут применяться у популяции пациентов с наиболее частым выделением пенициллинорезистентных штаммов пневмококков, а именно у детей раннего возраста. То же самое касается и амоксициллина/клавуланата: для применения препарата у детей в дозе 90/6,4 мг/кг/сут необходимы специальные высокодозные формы с соотношением компонентов 14:1, которые выпускаются в виде порошка для приготовления суспензии для приема внутрь (5 мл готовой суспензии содержат 600 мг амоксициллина и 42,9 мг клавулановой кислоты) [30].
В первую очередь следует остановиться на преимуществах высокодозного амоксициллина/клавуланата при лечении нозологических форм ИДП, при которых инфекционный процесс протекает в ограниченных полостях, например полости среднего уха или синуса. С одной стороны, при ОСО и ОБРС крайне важно, чтобы АБП создавал в соответствующей полости значимые концентрации, достаточные для эрадикации причинно-значимых патогенов. С другой стороны, всегда нужно помнить о вероятности развития осложнений (в том числе и интракраниальных) среднего отита и риносинусита, а также о возможности сохранения очага инфекции и перехода в хроническую форму с развитием стойкой перфорации барабанной перепонки или деструктивных процессов в тканях.
Сравнительная эффективность и безопасность амоксициллина/клавуланата с соотношением действующих веществ 14:1 была оценена в ходе проведенного в 19 центрах рандомизированного клинического исследования у более чем 400 детей в возрасте от 3 месяцев до 12 лет с ОСО, вызванным пенициллинорезистентными штаммами S. pneumoniae [31]. Эффективность препарата в дозе 90/6,4 мг/кг/сут была выше, чем в дозе 45/6,4 мг/кг/сут, – клиническая эффективность отмечена у 84,1 и 78,8% пациентов соответственно. При этом число нежелательных явлений в сравниваемых группах существенно не различалось [31].
В многоцентровом клиническом исследовании с участием более 500 детей с ОСО было установлено, что применение амоксициллина/клавуланата в дозе 90/6,4 мг/кг/сут в течение 10 дней обладает высокой клинической (89%) и микробиологической (96%) эффективностью [32]. Так, эрадикация S. pneumoniae была достигнута в 98% случаев (в том числе пенициллинорезистентных штаммов – в 91% случаев), эрадикация H. influenzae – в 94% случаев [32].
Аналогичные результаты были получены еще в одном исследовании с участием более 700 детей с ОСО: на фоне применения высокодозного амоксициллина/клавуланата эрадикация S. pneumoniae была достигнута в 96% случаев (в том числе пенициллинорезистентных штаммов пневмококка – в 92%), H. influenzae – в 89,7% (в том числе β-лактамазапродуцирующих изолятов – в 85,7%) [33].
Высокая клиническая и микробиологическая эффективность амоксициллина/клавуланата в дозе 90/6,4 мг/кг/сут при ОСО у детей была подтверждена и в других клинических исследованиях [34, 35].
Эффективность высокодозной формы амоксициллина/клавуланата также была продемонстрирована при остром бактериальном синусите у детей [36, 37].
В обзоре текущих клинических рекомендаций по тактике ведения детей с ОБРС, опубликованном в 2020 г., дополнительно к обозначенным выше факторам риска выделения резистентных патогенов и показаниям к назначению высокодозной формы амоксициллина/клавуланата указано также проживание в регионе с высокой эндемичностью (≥10%) ампициллинорезистентных штаммов H. influenzae, недавняя госпитализация, посещение детского сада, отказ от вакцинации против пневмококковой инфекции или неполный курс иммунизации [40].
Эксперты подчеркнули, что не следует забывать о возможности использования высокодозной формы амоксициллина/клавуланата для ступенчатой терапии при тяжелом течении ОБРС и госпитализации пациента в стационар, когда первоначально, как правило, в течение 3–4 дней, β-лактамы назначают парентерально (например, амоксициллин/клавуланат внутривенно либо цефалоспорины III поколения внутримышечно или внутривенно), а затем при стабилизации или значительном улучшении состояния пациента переводят на пероральный прием этого же или сходного по спектру активности АБП (например, суспензии высокодозного амоксициллина/клавуланата) [21].
В рекомендациях Американской академии педиатрии (American Academy of Pediatrics, AAP) по диагностике и лечению ОСО, изданных в 2013 г., отмечено, что у детей, которым назначался амоксициллин в течение предыдущих 30 дней, у пациентов с сопутствующим гнойным конъюнктивитом или при подозрении или выделении β-лактамазапродуцирующих H. influenzae терапию следует начинать с высокодозной формы амоксициллина/клавуланата [41].
Высокодозный амоксициллин/клавуланат присутствует в российских и международных рекомендациях по терапии внебольничной пневмонии у детей [43–45]. Так, в российских клинических рекомендациях 2015 г. указано, что в регионах с высоким уровнем резистентности S. pneumoniae к пенициллину и у детей с риском того, что заболевание вызвано резистентным штаммом (в первую очередь к факторам риска относится нахождение в детских учреждениях с круглосуточным пребыванием), рекомендуется использование амоксициллина в дозе 80–90 мг/кг/сут, а в случае, если у ребенка одновременно имеется высокий риск того, что инфекция может быть вызвана β-лактамазапродуцирующим штаммом H. influenzae, лучшим выбором следует признать использование амоксициллина/клавуланата с высоким содержанием амоксициллина (препараты с соотношением амоксициллина и клавуланата 14:1) [45].
В ходе дискуссии эксперты обсудили подходы к выбору препарата и режимов дозирования (амоксициллин, амоксициллин/клавуланат в обычных дозах и назначение высокодозного амоксициллина/клавуланата) в конкретной клинической ситуации с учетом индивидуальных факторов риска. Эксперты резюмировали рассмотренные моменты и предложили внести их в таблицу для удобства использования практикующими врачами и для помощи в принятии решения о правильном выборе АБП у детей с бактериальными ИДП (табл. 2).
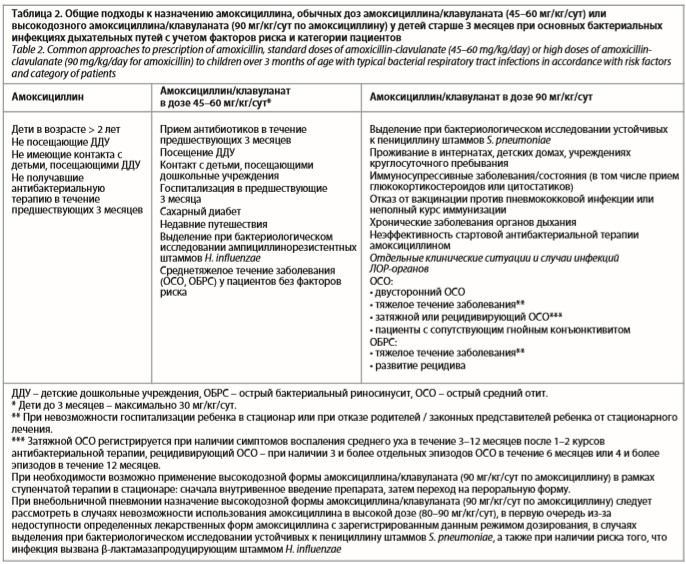
Эксперты отдельно подчеркнули, что с 1 января 2022 г. согласно Федеральному закону от 25.12.2018 № 489-ФЗ станут обязательными для использования клинические рекомендации, в связи с чем очень важно, чтобы в рекомендациях по отдельным нозологическим формам ИДП и ЛОР-органов были детально оговорены все аспекты ведения пациента в клинической практике, включая подходы к выбору АБП и режимов дозирования, для максимально комфортного и продуктивного использования врачом и в конечном итоге для повышения качества медицинской помощи.
В последние годы в России отмечаются тревожные тенденции в формировании и распространении устойчивости респираторных патогенов, а именно рост резистентности пневмококков к макролидам, распространение штаммов со сниженной чувствительностью и резистентных к пенициллину, в отдельных регионах Российской Федерации – достаточно широкое распространение S. pneumoniae с высоким уровнем резистентности к пенициллину и сниженной чувствительностью к парентеральным цефалоспоринам III поколения (цефотаксиму и цефтриаксону), а также увеличение числа β-лактамазапродуцирующих штаммов H. influenzae, резистентных к незащищенным аминопенициллинам.
Главными направлениями в борьбе с ростом антибиотикорезистентности выступают рациональное использование АБП и вакцинопрофилактика.
Использование высокодозной формы амоксициллина/клавуланата в педиатрической практике у пациентов в особых случаях позволяет обеспечить клиническую и микробиологическую эффективность терапии и минимизировать риск селекции антибиотикорезистентности. Особые случаи для назначения высокодозного амоксициллина/клавуланата включают:
• выделение при бактериологическом исследовании устойчивых к пенициллину штаммов S. pneumoniae;
• проживание в интернатах, детских домах, учреждениях круглосуточного пребывания;
• иммуносупрессивные заболевания/состояния (в том числе прием глюкокортикостероидов или цитостатиков);
• отказ от вакцинации против пневмококковой инфекции или неполный курс иммунизации;
• хронические заболевания органов дыхания;
• неэффективность стартовой антибактериальной терапии амоксициллином;
• отдельные клинические ситуации и случаи инфекций ЛОР-органов (ОСО, ОБРС) (см. табл. 2).
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах / Information about the authors
Козлов Роман Сергеевич – д-р мед. наук, профессор, член-корреспондент РАН, главный внештатный специалист Министерства здравоохранения Российской Федерации по клинической микробиологии и антимикробной резистентности, ректор ФГБОУ ВО «Смоленский государственный медицинский университет» Минздрава России, директор Научно-исследовательского института антимикробной химиотерапии ФГБОУ ВО «Смоленский государственный медицинский университет» Минздрава России, президент Межрегиональной ассоциации по клинической микробиологии и антимикробной химиотерапии. ORCID: 0000-0001-8728-1113, Scopus Author ID: 6701555731
Roman S. Kozlov – D. Sci. (med.), Prof., Smolensk State Medical University of the Ministry of Health of the Russian Federation. ORCID: 0000-0001-8728-1113, Scopus Author ID: 6701555731
Синопальников Александр Игоревич – д-р мед. наук, профессор, заведующий кафедрой пульмонологии ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, заслуженный врач Российской Федерации. ORCID: 0000-0002-1990-2042, Scopus Author ID: 7006442148
Alexander I. Sinopalnikov – D. Sci. (med.), Prof., Russian Medical Academy of Continuous Professional Education. ORCID: 0000-0002-1990-2042, Scopus Author ID: 7006442148
Зайцева Ольга Витальевна – д-р мед. наук, профессор, заведующая кафедрой педиатрии ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России, заслуженный врач Российской Федерации. ORCID: 0000-0003-3426-3426
Olga V. Zaitseva – D. Sci. (med.), Prof., Yevdokimov Moscow State University of Medicine and Dentistry. ORCID: 0000-0003-3426-3426
Зырянов Сергей Кенсаринович – д-р мед. наук, профессор, заведующий кафедрой общей и клинической фармакологии ФГАОУ ВО «Российский университет дружбы народов», заместитель главного врача ГБУЗ «Городская клиническая больница № 24 ДЗМ» по терапии, главный внештатный специалист – эксперт по клинической фармакологии Росздравнадзора по Центральному федеральному округу. ORCID: 0000-0002-6348-6867, Scopus Author ID: 35796816700
Sergey K. Zyryanov – D. Sci. (med.), Prof., The Peoples' Friendship University of Russia, City Clinical Hospital 24 DZM. ORCID: 0000-0002-6348-6867, Scopus Author ID: 35796816700
Карпова Елена Петровна – д-р мед. наук, профессор, заведующая кафедрой детской оториноларингологии ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, заслуженный врач Российской Федерации. Scopus Author ID: 7006695944
Elena P. Karpova – D. Sci. (med.), Prof., Russian Medical Academy of Continuous Professional Education. Scopus Author ID: 7006695944
Радциг Елена Юрьевна – д-р мед. наук, профессор, профессор кафедры оториноларингологии педиатрического факультета ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России. Scopus Author ID: 57193905498
Elena Yu. Radzig – D. Sci. (med.), Prof., Pirogov Russian National Research Medical University. Scopus Author ID: 57193905498
Зайцева Светлана Владимировна – канд. мед. наук, доцент кафедры педиатрии ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России. ORCID iD 0000-0003-1685-234X
Svetlana V. Zaitseva – Cand. Sci. (med.), Yevdokimov Moscow State University of Medicine and Dentistry. ORCID iD 0000-0003-1685-234X
Локшина Эвелина Эдуардовна – канд. мед. наук, профессор кафедры педиатрии ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России. ORCID: 0000-0001-6006-7846
Evelina E. Lokshina – Cand. Sci. (med.), Yevdokimov Moscow State University of Medicine and Dentistry. ORCID: 0000-0001-6006-7846
Стецюк Ольга Ульяновна – канд. мед. наук, ст. науч. сотр. Научно-исследовательского института антимикробной химиотерапии ФГБОУ ВО «Смоленский государственный медицинский университет» Минздрава России. ORCID: 0000-0002-7316-9187
Olga U. Stetsyuk – Cand. Sci. (med.), Smolensk State Medical University of the Ministry of Health of the Russian Federation. ORCID: 0000-0002-7316-9187
Андреева Ирина Вениаминовна – канд. мед. наук, доцент, ст. науч. сотр. Научно-исследовательского института антимикробной химиотерапии ФГБОУ ВО «Смоленский государственный медицинский университет» Минздрава России. ORCID: 0000-0001-7916-1488
Irina V. Andreeva – Cand. Sci. (med.), Smolensk State Medical University of the Ministry of Health of the Russian Federation. ORCID: 0000-0001-7916-1488
Статья поступила в редакцию / The article received: 01.03.2021
Статья принята к печати / The article approved for publication: 11.03.2021
Материал подготовлен при поддержке Сандоз RU2103155158
Клинический разбор в общей медицине №02 2021
Ингибиторозащищенный амоксициллин с повышенным содержанием амоксициллина и соотношением действующих компонентов 14:1: место в лечении внебольничных инфекций дыхательных путей и ЛОР-органов у детей. Резолюция экспертного совета
Номера страниц в выпуске:6-14
Аннотация
В Москве состоялось заседание экспертного совета, в состав которого вошли представители ведущих российских научно-исследовательских и высших образовательных медицинских учреждений. Совет был посвящен обсуждению подходов к терапии инфекций дыхательных путей и ЛОР-органов у детей с учетом глобального роста антибиотикорезистентности респираторных патогенов с отдельным акцентом на использование новой лекарственной формы амоксициллина/клавуланата в соотношении 14:1 и с определением категорий пациентов, у которых целесообразно назначение высокодозной лекарственной формы.
Ключевые слова: экспертный совет, антибактериальная терапия, антибиотикорезистентность, внебольничные инфекции, инфекции дыхательных путей, респираторные инфекции, амоксициллин/клавуланат, высокодозная форма, дети.
Для цитирования: Козлов Р.С., Синопальников А.И., Зайцева О.В., Зырянов С.К., Карпова Е.П., Радциг Е.Ю., Зайцева С.В., Локшина Э.Э., Стецюк О.У., Андреева И.В. Ингибиторозащищенный амоксициллин с повышенным содержанием амоксициллина и соотношением действующих компонентов 14:1: место в лечении внебольничных инфекций дыхательных путей и ЛОР-органов у детей.
Резолюция Экспертного совета. Клинический разбор в общей медицине. 2021; 2: 6–14. DOI: 10.47407/kr2021.2.1.00036
В Москве состоялось заседание экспертного совета, в состав которого вошли представители ведущих российских научно-исследовательских и высших образовательных медицинских учреждений. Совет был посвящен обсуждению подходов к терапии инфекций дыхательных путей и ЛОР-органов у детей с учетом глобального роста антибиотикорезистентности респираторных патогенов с отдельным акцентом на использование новой лекарственной формы амоксициллина/клавуланата в соотношении 14:1 и с определением категорий пациентов, у которых целесообразно назначение высокодозной лекарственной формы.
Ключевые слова: экспертный совет, антибактериальная терапия, антибиотикорезистентность, внебольничные инфекции, инфекции дыхательных путей, респираторные инфекции, амоксициллин/клавуланат, высокодозная форма, дети.
Для цитирования: Козлов Р.С., Синопальников А.И., Зайцева О.В., Зырянов С.К., Карпова Е.П., Радциг Е.Ю., Зайцева С.В., Локшина Э.Э., Стецюк О.У., Андреева И.В. Ингибиторозащищенный амоксициллин с повышенным содержанием амоксициллина и соотношением действующих компонентов 14:1: место в лечении внебольничных инфекций дыхательных путей и ЛОР-органов у детей.
Резолюция Экспертного совета. Клинический разбор в общей медицине. 2021; 2: 6–14. DOI: 10.47407/kr2021.2.1.00036
Inhibitor-protected amoxicillin with increased amoxicillin content and active ingredients ratio of 14:1: the use for treatment of community-acquired respiratory infections and ENT infections in children. Expert Council Resolution
Roman S. Kozlov1, Alexander I. Sinopalnikov2, Olga V. Zaitseva3, Sergey K. Zyryanov4,5,Elena P. Karpova2, Elena Yu. Radzig6, Svetlana V. Zaitseva3, Evelina E. Lokshina3, Olga U. Stetsyuk1, Irina V. Andreeva1
1Smolensk State Medical University of the Ministry of Health of the Russian Federation, Smolensk, Russia;
2Russian Medical Academy of Continuous Professional Education, Moscow, Russia;
3 Yevdokimov Moscow State University of Medicine and Dentistry, Moscow, Russia;
4The Peoples' Friendship University of Russia, Moscow, Russia;
5City Clinical Hospital 24 DZM, Moscow, Russia;
6Pirogov Russian National Research Medical University, Moscow, Russia
aisyn@list.ru, olga6505963@yandex.ru
Abstract
The meeting of Expert Council, which included representatives of leading Russian research and higher education medical institutions, took place in Moscow. The Council discussed approaches to therapy of respiratory tract infections and ENT infections in children considering the global increase in antimicrobial resistance of respiratory tract pathogens. Special attention was paid to the use of new dosage form of amoxicillin-clavulanate 14:1, as well as to defining the category of patients to whom it is advisable to prescribe the high-dose amoxicillin-clavulanate.
Key words: Expert Council, antibacterial therapy, antimicrobial resistance, community-acquired infections, respiratory tract infections, respiratory infections, amoxicillin-clavulanate, high-dose therapy, children.
For citation: Kozlov R.S., Sinopalnikov A.I., Zaitseva O.V., Zyryanov S.K., Karpova E.P., Radzig E.Yu., Zaitseva S.V., Lokshina E.E.,
Stetsyuk O.U., Andreeva I.V. Inhibitor-protected amoxicillin with increased amoxicillin content and active ingredients ratio of 14:1: the use for treatment of community-acquired respiratory infections and ENT infections in children. Expert Council Resolution. Clinical review for general practice. 2021; 2: 6–14. DOI: 10.47407/kr2021.2.1.00036
25 января 2021 г. в Москве состоялось заседание экспертного совета «Ингибиторозащищенный амоксициллин с повышенным содержанием амоксициллина и соотношением действующих компонентов 14:1: место в лечении внебольничных инфекций дыхательных путей и ЛОР-органов у детей», в состав которого вошли представители ведущих российских научно-исследовательских и образовательных медицинских учреждений, признанные экспертами в области профилактики, диагностики и лечения инфекций дыхательных путей и ЛОР-органов у детей.
Введение
Глобальная пандемия новой коронавирусной инфекции COVID-19, которая получила широкое распространение в 2020 г. и продолжается по настоящее время, вносит значительные изменения в практику применения антибактериальных препаратов (АБП). Несмотря на то, что COVID-19 является вирусной инфекцией, АБП назначаются массово и нерационально. Так, по данным Всемирной организации здравоохранения и опубликованных зарубежных исследований, более 70–80% пациентов с коронавирусной инфекцией получают антибактериальную терапию как амбулаторно, так и в стационаре, в то время как бактериальная суперинфекция выявляется не более чем у 3,5–8% пациентов [1, 2]. В России ситуация еще более драматичная. Ведущие российские эксперты в области инфекционных болезней, микробиологии и антимикробной химиотерапии в конце 2020 г. опубликовали письмо-обращение к медицинскому сообществу страны, касающееся нерационального применения антибиотиков в подавляющем большинстве случаев терапии COVID-19 и ее осложнений [3]. Согласно тексту письма, «очень серьезное беспокойство вызывает тот факт, что на фоне пандемии новой коронавирусной инфекции в России отмечен значительный рост продажи антибактериальных препаратов в аптеках и закупок их лечебными учреждениями. Более 90% пациентов с COVID-19 в настоящее время получают антибиотики, в том числе комбинированную терапию и парентеральные антибактериальные препараты в амбулаторных условиях» [3]. Сложившаяся ситуация будет способствовать значительному росту антибиотикорезистентности, что может иметь серьезные последствия в будущем [1, 3].Между тем пандемия коронавирусной инфекции не отменила необходимость применения антибиотиков при обычных бактериальных респираторных инфекциях, таких как внебольничная пневмония, острый средний отит (ОСО), острый бактериальный риносинусит (ОБРС), стрептококковый тонзиллофарингит, распространенность которых отнюдь не уменьшилась в период пандемии. Пациенты детского возраста, как правило, переносят COVID-19 легко или бессимптомно, но актуальность перечисленных выше бактериальных инфекций дыхательных путей (ИДП) у педиатрической популяции пациентов очень высока.
Кроме того, перераспределение ресурсов здравоохранения в связи с пандемией COVID-19 в определенной мере лимитировало возможности бактериологических лабораторий в отношении выделения бактериальных патогенов и определения их чувствительности к антибиотикам, а также ограничило представление глобальных (по городу, региону, стране) данных по антибиотикорезистентности основных возбудителей. Насколько ухудшится ситуация с антибиотикорезистентностью ведущих респираторных патогенов после столь широкого нерационального использования АБП (в первую очередь макролидов (азитромицин) и респираторных фторхинолонов) при COVID-19, можно лишь предполагать – многие эксперты вполне обоснованно прогнозируют крайне неблагоприятные исходы [1].
Целью заседания настоящего экспертного совета было определение места ингибиторозащищенного амоксициллина с повышенным содержанием амоксициллина и соотношением действующих компонентов 14:1 в лечении внебольничных ИДП и ЛОР-органов у детей.
Состояние антибиотикорезистентности наиболее актуальных и проблемных возбудителей инфекций дыхательных путей и ЛОР-органов у детей
К основным проблемным возбудителям ИДП и ЛОР-органов у детей в России относят Streptococcus pneumoniae и Haemophilus influenzae. В опубликованном в 2014 г. отчете Всемирной организации здравоохранения, посвященном проблеме глобальной резистентности к антибиотикам, S. pneumoniae указан в перечне из 9 важнейших возбудителей, устойчивость которых к АБП вызывает международную озабоченность [4].Ситуация с антибиотикорезистентностью респираторных патогенов, выделенных у детей в Российской Федерации за период с 2016 по 2018 г., будет рассмотрена в первую очередь по данным онлайн-проекта «Карта антибиотикорезистентности России» – AMRmap (https://amrmap.ru/), который разработан совместно Научно-исследовательским институтом антимикробной химиотерапии ФГБОУ ВО СГМУ Минздрава России и Межрегиональной ассоциацией по клинической микробиологии и антимикробной химиотерапии [5], а также по другим публикациям по этой проблематике за указанный период времени.
S. pneumoniae (пневмококк) – один из наиболее клинически значимых возбудителей ИДП и ЛОР-органов, в отношении которого должна проводиться максимально эффективная антибактериальная терапия [6, 7]. Устойчивая тенденция, наблюдаемая в течение последних 10–15 лет, – повсеместное снижение чувствительности пневмококков к макролидам, а также появление и распространение в последнее десятилетие штаммов со сниженной чувствительностью к пенициллину и цефтриаксону.
При анализе данных «Карты антибиотикорезистентности России» за 2016–2018 гг. отмечены существенные изменения в антибиотикорезистентности пневмококков, выделенных у пациентов педиатрической популяции, по сравнению с более ранними периодами времени (табл. 1). Так, существенно выросли показатели устойчивости S. pneumoniae к пенициллину: в среднем по России частота умереннорезистентных штаммов составляет около 25%, а резистентных – почти 7%. Распространение пенициллинорезистентных пневмококков сопровождается увеличением числа изолятов, нечувствительных к парентеральным цефалоспоринам III поколения (цефтриаксону), что составляет 12,7% для умереннорезистентных и 5,7% для резистентных штаммов. Частота резистентности S. pneumoniae к макролидам по Российской Федерации превысила 25%. Особенно неблагоприятная ситуация с устойчивостью пневмококков (умереннорезистентные + резистентные штаммы) сложилась в Уральском и Приволжском федеральных округах: к пенициллину были устойчивы 36,4 и 43,6% протестированных штаммов соответственно, к эритромицину (маркеру всех макролидов) – 31,8 и 28,9% соответственно, к цефтриаксону – 25,4% в Уральском федеральном округе (см. табл. 1).
По данным опубликованного в 2018 г. международного исследования антибиотикорезистентности SOAR (Survey of Antibiotic Resistance), в ходе которого были протестированы 279 штаммов S. pneumoniae, выделенных у пациентов в 3 городах Российской Федерации (Москве, Санкт-Петербурге и Смоленске) в 2014–2016 гг., уровень нечувствительности к пенициллину составил 33%, к макролидам были устойчивы 31,2% штаммов.

В то же время подавляющее большинство выделенных штаммов пневмококка (95%) были чувствительны к амоксициллину/клавуланату [8].
Сходная картина антибиотикорезистентности была выявлена по данным определения чувствительности штаммов S. pneumoniae, выделенных при назофарингеальном носительстве у здоровых детей в Москве за период 2013–2017 гг. (n=403): нечувствительными к пенициллину были 35,7% изолятов (из них 2,7% – высокорезистентны), амоксициллин/клавуланат сохранял активность в отношении 97,3% выделенных штаммов пневмококков [9].
Согласно данным глобальной программы мониторинга антимикробной резистентности SENTRY Antimicrobial Surveillance Program за период 2015–2017 гг., чувствительность штаммов S. pneumoniae (n=324), выделенных у пациентов с внебольничной пневмонией в странах Восточной Европы, к пенициллину составила 62%, к цефтриаксону – 89,9%, к амоксициллину/клавуланату – 89,8%, к азитромицину – 64,8% [10].
В исследовании SOAR 2014–2016 гг. также тестировались 279 штаммов H. influenzae, выделенных у пациентов в Российской Федерации [8]. Нечувствительными к амоксициллину были 19% изолятов, при этом продукция β-лактамаз была обнаружена у 15,4% штаммов. Чувствительными к амоксициллину/клавуланату оказались ≥97,5% изолятов гемофильной палочки [8]. По данным SENTRY Antimicrobial Surveillance Program, из 267 протестированных изолятов H. influenzae, выделенных у пациентов с внебольничной пневмонией в Восточной Европе, чувствительными к ампициллину были 85% штаммов, в то время как амоксициллин/клавуланат и цефтриаксон были активны в отношении 99,3 и 100% штаммов соответственно [10].
Таким образом, результаты целого ряда российских и международных исследований, опубликованных в последние годы, выявили тревожные тенденции, в частности, увеличение числа β-лактамазапродуцирующих штаммов H. influenzae, резистентных к незащищенным аминопенициллинам (15–20%), рост резистентности пневмококков к макролидам (~25–30%), распространение штаммов со сниженной чувствительностью и резистентных к пенициллину (>30%), а также, в отдельных регионах, – изолятов S. pneumoniae со сниженной чувствительностью к парентеральным цефалоспоринам III поколения (цефотаксиму и цефтриаксону).
Проблема роста резистентности S. pneumoniae к пенициллину, а H. influenzae – к незащищенным аминопенициллинам не является исключительно российской: аналогичные тенденции на протяжении уже двух десятилетий наблюдаются во всем мире [10–18]. Однако в целом показатели резистентности пневмококков к пенициллину в России выше, чем в большинстве европейских стран [18]. В связи с этим назрела необходимость пересмотра основных подходов к назначению антибиотиков при бактериальных респираторных инфекциях.
Необходимо отметить, что риск селекции резистентных штаммов возрастает при использовании субоптимальных доз АБП, недостаточных для надежной эрадикации возбудителя [19]. Следовательно, для обеспечения максимальной «экологической» безопасности терапии необходимо использовать высокоэффективные АБП в довольно высоких дозах. Именно такой подход соответствует принципу «убитые бактерии не мутируют» [20].
Выбор антибактериального препарата и режима дозирования в эру распространения резистентных респираторных патогенов
Принимая во внимание значение амоксициллина и амоксициллина/клавуланата при лечении респираторных инфекций в амбулаторной практике, важно максимально полно использовать и сохранять терапевтический потенциал этих АБП, взвешенно и рационально подходить к их выбору, в определенных клинических ситуациях отдавая предпочтение высокодозному амоксициллину/клавуланату [19, 21]. Результаты исследований при ОСО свидетельствуют о том, что различные АБП и режимы дозирования, обладающие эквивалентной эффективностью против чувствительных патогенов, могут значительно различаться по показателю микробиологической эффективности (или эрадикации патогена) в отношении резистентных штаммов. В отличие от устойчивости к макролидам и фторхинолонам, устойчивость к пенициллину у S. pneumoniae может быть преодолена путем увеличения дозы β-лактама [22, 23].В педиатрической практике при инфекциях, вызванных устойчивыми к пенициллину штаммами пневмококков, гарантированную эффективность обеспечивает только амоксициллин или амоксициллин/клавуланат в высокой дозе (90 мг/кг/сут по амоксициллину) [24]. Благоприятный профиль безопасности и низкая токсичность позволяют безопасно применять высокие дозы амоксициллина/клавуланата [25]. Традиционные же режимы дозирования амоксициллина и амоксициллина/клавуланата (45–60 мг/кг/сут по амоксициллину, детям до 3 месяцев – максимально 30 мг/кг/сут) обладают «пограничной» активностью в отношении штаммов S. pneumoniae со сниженной чувствительностью к пенициллину [21].
Кроме этого, необходимо отметить, что в отличие от амоксициллина, амоксициллин/клавуланат также сохраняет активность в отношении штаммов H. influenzae, продуцирующих β-лактамазы [19]. Таким образом, если у ребенка есть риск, что ИДП вызвана пенициллинорезистентным штаммом S. pneumoniae и/или штаммом гемофильной палочки, продуцирующим β-лактамазы, необходимы высокая доза амоксициллина и комбинация антибиотика с ингибитором β-лактамаз. Высокодозная форма амоксициллина/клавуланата, обладая высокой клинической и микробиологической эффективностью, также минимизирует риск развития антибиотикорезистентности [24].
В 2018 г. на экспертном совете «Принципы рациональной антибиотикотерапии респираторных инфекций у детей. Сохраним антибиотики для будущих поколений» были выделены следующие индивидуальные факторы риска инфицирования лекарственно-устойчивыми возбудителями [26]:
• прием АБП в течение предшествующих 3 месяцев, особенно если их назначение было неадекватным (в субоптимальной дозе и/или на слишком длительный срок);
• посещение детских дошкольных учреждений;
• госпитализация в течение предшествующих 3 месяцев;
• контакт с детьми, посещающими дошкольные учреждения;
• проживание в интернатах, детских домах, учреждениях длительного ухода;
• состояния и заболевания, которые сопровождаются повышенной чувствительностью к инфекции и, соответственно, частым назначением АБП:
• иммуносупрессивные заболевания/состояния;
• применение глюкокортикоидов, цитостатиков;
• лечение гемодиализом;
• сахарный диабет;
• хронические заболевания органов дыхания;
• недавние путешествия.
Можно предполагать, что с учетом прогнозируемого роста антибиотикорезистентности, вследствие часто нерационального применения АБП в настоящее время, актуальность сформулированных положений о факторах риска антибиотикорезистентности будет только возрастать. Именно поэтому при лечении респираторных инфекций выбор стартовой терапии все чаще решается в пользу назначения препарата с более широкими терапевтическими возможностями и микробиологическим спектром – ингибиторозащищенного амоксициллина [26].
В целом в Российской Федерации в настоящее время амоксициллин остается препаратом выбора в качестве стартовой терапии у пациентов с нетяжелым течением инфекции, не имеющих факторов риска инфекции, вызванной антибиотикорезистентными возбудителями. При наличии факторов риска инфекции, вызванной устойчивыми патогенами, а также при неэффективности стартовой антибактериальной терапии следует рассмотреть назначение амоксициллина/клавуланата [26]. Подходы к назначению обычных (45–60 мг/кг/сут) или высоких (90 мг/кг/сут) доз амоксициллина/клавуланата будут детально рассмотрены ниже.
Особое внимание эксперты акцентировали на юридических аспектах применения лекарственных средств, в частности, возможностях использования амоксициллина и амоксициллина/клавуланата в высоких дозах. Эксперты подчеркнули, что назначение лекарственного средства регламентируется инструкцией по медицинскому применению лекарственного препарата, и назначать амоксициллин и амоксициллин/клавуланат в дозе 90 мг/кг/сут (по амоксициллину) можно только при наличии указаний в инструкции на возможность данного режима дозирования. Лишь у нескольких препаратов с активным ингредиентом «амоксициллин» имеется возможность применения в указанной дозе [27–29], причем для ряда лекарственных форм (капсулы по 250 и 500 мг) имеются противопоказания (возраст до 5 лет и/или масса тела до 40 кг) [28, 29], то есть эти препараты не могут применяться у популяции пациентов с наиболее частым выделением пенициллинорезистентных штаммов пневмококков, а именно у детей раннего возраста. То же самое касается и амоксициллина/клавуланата: для применения препарата у детей в дозе 90/6,4 мг/кг/сут необходимы специальные высокодозные формы с соотношением компонентов 14:1, которые выпускаются в виде порошка для приготовления суспензии для приема внутрь (5 мл готовой суспензии содержат 600 мг амоксициллина и 42,9 мг клавулановой кислоты) [30].
Доказательная база, подтверждающая эффективность и безопасность использования высокодозной формы амоксициллина/клавуланата
Эксперты подчеркнули, что на текущий момент имеется существенная доказательная база, подтверждающая эффективность и безопасность применения высокодозных форм амоксициллина/клавуланата в педиатрической практике.В первую очередь следует остановиться на преимуществах высокодозного амоксициллина/клавуланата при лечении нозологических форм ИДП, при которых инфекционный процесс протекает в ограниченных полостях, например полости среднего уха или синуса. С одной стороны, при ОСО и ОБРС крайне важно, чтобы АБП создавал в соответствующей полости значимые концентрации, достаточные для эрадикации причинно-значимых патогенов. С другой стороны, всегда нужно помнить о вероятности развития осложнений (в том числе и интракраниальных) среднего отита и риносинусита, а также о возможности сохранения очага инфекции и перехода в хроническую форму с развитием стойкой перфорации барабанной перепонки или деструктивных процессов в тканях.
Сравнительная эффективность и безопасность амоксициллина/клавуланата с соотношением действующих веществ 14:1 была оценена в ходе проведенного в 19 центрах рандомизированного клинического исследования у более чем 400 детей в возрасте от 3 месяцев до 12 лет с ОСО, вызванным пенициллинорезистентными штаммами S. pneumoniae [31]. Эффективность препарата в дозе 90/6,4 мг/кг/сут была выше, чем в дозе 45/6,4 мг/кг/сут, – клиническая эффективность отмечена у 84,1 и 78,8% пациентов соответственно. При этом число нежелательных явлений в сравниваемых группах существенно не различалось [31].
В многоцентровом клиническом исследовании с участием более 500 детей с ОСО было установлено, что применение амоксициллина/клавуланата в дозе 90/6,4 мг/кг/сут в течение 10 дней обладает высокой клинической (89%) и микробиологической (96%) эффективностью [32]. Так, эрадикация S. pneumoniae была достигнута в 98% случаев (в том числе пенициллинорезистентных штаммов – в 91% случаев), эрадикация H. influenzae – в 94% случаев [32].
Аналогичные результаты были получены еще в одном исследовании с участием более 700 детей с ОСО: на фоне применения высокодозного амоксициллина/клавуланата эрадикация S. pneumoniae была достигнута в 96% случаев (в том числе пенициллинорезистентных штаммов пневмококка – в 92%), H. influenzae – в 89,7% (в том числе β-лактамазапродуцирующих изолятов – в 85,7%) [33].
Высокая клиническая и микробиологическая эффективность амоксициллина/клавуланата в дозе 90/6,4 мг/кг/сут при ОСО у детей была подтверждена и в других клинических исследованиях [34, 35].
Эффективность высокодозной формы амоксициллина/клавуланата также была продемонстрирована при остром бактериальном синусите у детей [36, 37].
Место высокодозной формы амоксициллина/клавуланата в клинических рекомендациях по терапии бактериальных инфекций дыхательных путей в педиатрической практике
В тех странах, где детская суспензия с дозировкой амоксициллина/клавуланата 90/6,4 мг/кг/сут зарегистрирована и применяется на практике уже достаточно давно, в стандартах лечения респираторных инфекций у детей с факторами риска наличия резистентных возбудителей (предшествующее применение антибиотиков, сопутствующая патология, неэффективность стартовой АБТ) при тяжелом течении заболевания отмечается замена обычных форм амоксициллина/клавуланата на высокодозные лекарственные формы [38–42]. Так, в рекомендациях Американского общества инфекционных болезней (Infectious Diseases Society of America, IDSA), изданных в 2012 г., у детей с ОБРС в возрасте <2 лет в регионах с высокой (≥10%) частотой выявления пенициллинорезистентности у штаммов S. pneumoniae, выделенных при инвазивных пневмококковых инфекциях, при тяжелом течении заболевания (то есть с признаками интоксикации или температурой тела >39 °С) и лечении гнойных осложнений, у иммунокомпрометированных лиц и при наличии факторов риска инфекции, вызванной пенициллинонечувствительными штаммами S. pneumoniae, рекомендуется назначение высоких доз амоксициллина/клавуланата (90 мг/кг/сут по амоксициллину внутрь в 2 приема) [38].В обзоре текущих клинических рекомендаций по тактике ведения детей с ОБРС, опубликованном в 2020 г., дополнительно к обозначенным выше факторам риска выделения резистентных патогенов и показаниям к назначению высокодозной формы амоксициллина/клавуланата указано также проживание в регионе с высокой эндемичностью (≥10%) ампициллинорезистентных штаммов H. influenzae, недавняя госпитализация, посещение детского сада, отказ от вакцинации против пневмококковой инфекции или неполный курс иммунизации [40].
Эксперты подчеркнули, что не следует забывать о возможности использования высокодозной формы амоксициллина/клавуланата для ступенчатой терапии при тяжелом течении ОБРС и госпитализации пациента в стационар, когда первоначально, как правило, в течение 3–4 дней, β-лактамы назначают парентерально (например, амоксициллин/клавуланат внутривенно либо цефалоспорины III поколения внутримышечно или внутривенно), а затем при стабилизации или значительном улучшении состояния пациента переводят на пероральный прием этого же или сходного по спектру активности АБП (например, суспензии высокодозного амоксициллина/клавуланата) [21].
В рекомендациях Американской академии педиатрии (American Academy of Pediatrics, AAP) по диагностике и лечению ОСО, изданных в 2013 г., отмечено, что у детей, которым назначался амоксициллин в течение предыдущих 30 дней, у пациентов с сопутствующим гнойным конъюнктивитом или при подозрении или выделении β-лактамазапродуцирующих H. influenzae терапию следует начинать с высокодозной формы амоксициллина/клавуланата [41].
Высокодозный амоксициллин/клавуланат присутствует в российских и международных рекомендациях по терапии внебольничной пневмонии у детей [43–45]. Так, в российских клинических рекомендациях 2015 г. указано, что в регионах с высоким уровнем резистентности S. pneumoniae к пенициллину и у детей с риском того, что заболевание вызвано резистентным штаммом (в первую очередь к факторам риска относится нахождение в детских учреждениях с круглосуточным пребыванием), рекомендуется использование амоксициллина в дозе 80–90 мг/кг/сут, а в случае, если у ребенка одновременно имеется высокий риск того, что инфекция может быть вызвана β-лактамазапродуцирующим штаммом H. influenzae, лучшим выбором следует признать использование амоксициллина/клавуланата с высоким содержанием амоксициллина (препараты с соотношением амоксициллина и клавуланата 14:1) [45].
В ходе дискуссии эксперты обсудили подходы к выбору препарата и режимов дозирования (амоксициллин, амоксициллин/клавуланат в обычных дозах и назначение высокодозного амоксициллина/клавуланата) в конкретной клинической ситуации с учетом индивидуальных факторов риска. Эксперты резюмировали рассмотренные моменты и предложили внести их в таблицу для удобства использования практикующими врачами и для помощи в принятии решения о правильном выборе АБП у детей с бактериальными ИДП (табл. 2).

Эксперты отдельно подчеркнули, что с 1 января 2022 г. согласно Федеральному закону от 25.12.2018 № 489-ФЗ станут обязательными для использования клинические рекомендации, в связи с чем очень важно, чтобы в рекомендациях по отдельным нозологическим формам ИДП и ЛОР-органов были детально оговорены все аспекты ведения пациента в клинической практике, включая подходы к выбору АБП и режимов дозирования, для максимально комфортного и продуктивного использования врачом и в конечном итоге для повышения качества медицинской помощи.
Заключение
Рост устойчивости к АБП ключевых возбудителей респираторных инфекций S. pneumoniae и H. influenzae представляет собой глобальную проблему.В последние годы в России отмечаются тревожные тенденции в формировании и распространении устойчивости респираторных патогенов, а именно рост резистентности пневмококков к макролидам, распространение штаммов со сниженной чувствительностью и резистентных к пенициллину, в отдельных регионах Российской Федерации – достаточно широкое распространение S. pneumoniae с высоким уровнем резистентности к пенициллину и сниженной чувствительностью к парентеральным цефалоспоринам III поколения (цефотаксиму и цефтриаксону), а также увеличение числа β-лактамазапродуцирующих штаммов H. influenzae, резистентных к незащищенным аминопенициллинам.
Главными направлениями в борьбе с ростом антибиотикорезистентности выступают рациональное использование АБП и вакцинопрофилактика.
Использование высокодозной формы амоксициллина/клавуланата в педиатрической практике у пациентов в особых случаях позволяет обеспечить клиническую и микробиологическую эффективность терапии и минимизировать риск селекции антибиотикорезистентности. Особые случаи для назначения высокодозного амоксициллина/клавуланата включают:
• выделение при бактериологическом исследовании устойчивых к пенициллину штаммов S. pneumoniae;
• проживание в интернатах, детских домах, учреждениях круглосуточного пребывания;
• иммуносупрессивные заболевания/состояния (в том числе прием глюкокортикостероидов или цитостатиков);
• отказ от вакцинации против пневмококковой инфекции или неполный курс иммунизации;
• хронические заболевания органов дыхания;
• неэффективность стартовой антибактериальной терапии амоксициллином;
• отдельные клинические ситуации и случаи инфекций ЛОР-органов (ОСО, ОБРС) (см. табл. 2).
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах / Information about the authors
Козлов Роман Сергеевич – д-р мед. наук, профессор, член-корреспондент РАН, главный внештатный специалист Министерства здравоохранения Российской Федерации по клинической микробиологии и антимикробной резистентности, ректор ФГБОУ ВО «Смоленский государственный медицинский университет» Минздрава России, директор Научно-исследовательского института антимикробной химиотерапии ФГБОУ ВО «Смоленский государственный медицинский университет» Минздрава России, президент Межрегиональной ассоциации по клинической микробиологии и антимикробной химиотерапии. ORCID: 0000-0001-8728-1113, Scopus Author ID: 6701555731
Roman S. Kozlov – D. Sci. (med.), Prof., Smolensk State Medical University of the Ministry of Health of the Russian Federation. ORCID: 0000-0001-8728-1113, Scopus Author ID: 6701555731
Синопальников Александр Игоревич – д-р мед. наук, профессор, заведующий кафедрой пульмонологии ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, заслуженный врач Российской Федерации. ORCID: 0000-0002-1990-2042, Scopus Author ID: 7006442148
Alexander I. Sinopalnikov – D. Sci. (med.), Prof., Russian Medical Academy of Continuous Professional Education. ORCID: 0000-0002-1990-2042, Scopus Author ID: 7006442148
Зайцева Ольга Витальевна – д-р мед. наук, профессор, заведующая кафедрой педиатрии ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России, заслуженный врач Российской Федерации. ORCID: 0000-0003-3426-3426
Olga V. Zaitseva – D. Sci. (med.), Prof., Yevdokimov Moscow State University of Medicine and Dentistry. ORCID: 0000-0003-3426-3426
Зырянов Сергей Кенсаринович – д-р мед. наук, профессор, заведующий кафедрой общей и клинической фармакологии ФГАОУ ВО «Российский университет дружбы народов», заместитель главного врача ГБУЗ «Городская клиническая больница № 24 ДЗМ» по терапии, главный внештатный специалист – эксперт по клинической фармакологии Росздравнадзора по Центральному федеральному округу. ORCID: 0000-0002-6348-6867, Scopus Author ID: 35796816700
Sergey K. Zyryanov – D. Sci. (med.), Prof., The Peoples' Friendship University of Russia, City Clinical Hospital 24 DZM. ORCID: 0000-0002-6348-6867, Scopus Author ID: 35796816700
Карпова Елена Петровна – д-р мед. наук, профессор, заведующая кафедрой детской оториноларингологии ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, заслуженный врач Российской Федерации. Scopus Author ID: 7006695944
Elena P. Karpova – D. Sci. (med.), Prof., Russian Medical Academy of Continuous Professional Education. Scopus Author ID: 7006695944
Радциг Елена Юрьевна – д-р мед. наук, профессор, профессор кафедры оториноларингологии педиатрического факультета ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России. Scopus Author ID: 57193905498
Elena Yu. Radzig – D. Sci. (med.), Prof., Pirogov Russian National Research Medical University. Scopus Author ID: 57193905498
Зайцева Светлана Владимировна – канд. мед. наук, доцент кафедры педиатрии ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России. ORCID iD 0000-0003-1685-234X
Svetlana V. Zaitseva – Cand. Sci. (med.), Yevdokimov Moscow State University of Medicine and Dentistry. ORCID iD 0000-0003-1685-234X
Локшина Эвелина Эдуардовна – канд. мед. наук, профессор кафедры педиатрии ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России. ORCID: 0000-0001-6006-7846
Evelina E. Lokshina – Cand. Sci. (med.), Yevdokimov Moscow State University of Medicine and Dentistry. ORCID: 0000-0001-6006-7846
Стецюк Ольга Ульяновна – канд. мед. наук, ст. науч. сотр. Научно-исследовательского института антимикробной химиотерапии ФГБОУ ВО «Смоленский государственный медицинский университет» Минздрава России. ORCID: 0000-0002-7316-9187
Olga U. Stetsyuk – Cand. Sci. (med.), Smolensk State Medical University of the Ministry of Health of the Russian Federation. ORCID: 0000-0002-7316-9187
Андреева Ирина Вениаминовна – канд. мед. наук, доцент, ст. науч. сотр. Научно-исследовательского института антимикробной химиотерапии ФГБОУ ВО «Смоленский государственный медицинский университет» Минздрава России. ORCID: 0000-0001-7916-1488
Irina V. Andreeva – Cand. Sci. (med.), Smolensk State Medical University of the Ministry of Health of the Russian Federation. ORCID: 0000-0001-7916-1488
Статья поступила в редакцию / The article received: 01.03.2021
Статья принята к печати / The article approved for publication: 11.03.2021
Материал подготовлен при поддержке Сандоз RU2103155158
Список исп. литературыСкрыть список1. World Health Organization. COVID-19 Clinical management: living guidance. 25.01.2021. www.who.int/publications/i/item/WHO-2019-nCoV-clinical-2021-1
2. Nori P, Cowman K, Chen V et al. Bacterial and fungal coinfections in COVID-19 patients hospitalized during the New York City pandemic surge. Infect Control Hosp Epidemiol 2021; 42 (1): 84–8. DOI: 10.1017/ice.2020.368
3. Малеев В.В., Зайцев А.А., Яковлев С.В. и др. О применении антибактериальной терапии у пациентов с новой коронавирусной инфекцией COVID-19. Совместное обращение к врачебному сообществу России. Русский медицинский журнал; 17.10.2020. www.rmj.ru/news/o-primenenii-antibakterialnoy-terapii-u-patsientov-s-novoy-koronavirusnoy-infektsiey-covid-19
[Maleev V.V., Zaitsev A.A., Yakovlev S.V. et al. O primenenii antibakterial'noi terapii u patsientov s novoi koronavirusnoi infektsiei COVID-19. Sovmestnoe obrashchenie k vrachebnomu soobshchestvu Rossii. Russian Medical Journal; 17.10.2020. www.rmj.ru/news/o-primenenii-antibakterialnoy-terapii-u-patsientov-s-novoy-koronavirusnoy-infektsiey-covid-19/ (in Russian).]
4. World Health Organization (WHO). Antimicrobial resistance: global report on surveillance 2014. www.who.int/antimicrobial-resistance/publications/surveillancereport/en/
5. Кузьменков А.Ю., Трушин И.В., Авраменко А.А. и др. AMRmap: интернет-платформа мониторинга антибиотикорезистентности. Клиническая микробиология и антимикробная химиотерапия. 2017; 19 (2): 84–90.
[Kuzmenkov A.Yu., Trushin I.V., Avramenko A.A. et al. AMRmap: an online platform for monitoring antibiotic resistance. Clinical Microbiology and Antimicrobial Chemotherapy. 2017; 19 (2): 84–90 (in Russian).]
6. Баранов А.А., Намазова Л.С., Таточенко В.К. Пневмококковая инфекция и связанные с ней заболевания – серьезная проблема современного здравоохранения. Педиатрическая фармакология. 2008; 5 (1): 7–13.
[Baranov A.A., Namazova L.S., Tatochenko V.K. Pneumococcal infection and associated diseases – a serious problem of modern health care. Pediatric Pharmacology. 2008; 5 (1): 7–13 (in Russian).]
7. Стецюк О.У., Андреева И.В., Егорова О.А. Антибиотикорезистентность основных возбудителей ЛОР-заболеваний. Русский медицинский журнал. Медицинское обозрение. 2019; 3 (9-2): 78–83.
[Stetsyuk O.U., Andreeva I.V., Egorova O.A. Antibiotic resistance of the main ENT pathogens. Russian Medical Inquiry. 2019; 3 (9-2): 78–83 (in Russian).]
8. Torumkuney D, Mayanskiy N, Edelstein M et al. Results from the Survey of Antibiotic Resistance (SOAR) 2014-16 in Russia. J Antimicrob Chemother 2018; 73 (suppl_5): v14–21. DOI: 10.1093/jac/dky065
9. Mayanskiy N, Kulichenko T, Alyabieva N et al. Changing serotype distribution and resistance patterns among pediatric nasopharyngeal pneumococci collected in Moscow, 2010-2017. Diagn Microbiol Infect Dis 2019; 94 (4): 385–90. DOI: 10.1016/j.diagmicrobio.2019. 02.010
10. Sader HS, Flamm RK, Streit JM et al. Antimicrobial activity of ceftaroline and comparator agents tested against organisms isolated from patients with community-acquired bacterial pneumonia in Europe, Asia, and Latin America. Int J Infect Dis 2018; 77: 82–6. DOI: 10.1016/j.ijid.2018.10.004
11. Tomic V, Dowzicky MJ. Regional and global antimicrobial susceptibility among isolates of Streptococcus pneumoniae and Haemophilus influenzae collected as part of the Tigecycline Evaluation and Surveillance Trial (T.E.S.T.) from 2009 to 2012 and comparison with previous years of T.E.S.T. (2004–2008). Ann Clin Microbiol Antimicrob 2014; 13: 52. DOI: 10.1186/s12941-014-0052-2
12. Cherazard R, Epstein M, Doan TL et al. Antimicrobial Resistant Streptococcus pneumoniae: Prevalence, Mechanisms, and Clinical Implications. Am J Ther 2017; 24 (3): e361–9. DOI: 10.1097/MJT. 0000000000000551
13. Fong IW, Shlaes D, Drlica K, editors. Antimicrobial Resistance in the 21st Century. 2nd ed. Springer; 2018. DOI: 10.1007/978-3-319-78538-7_2
14. Tadesse BT, Ashley EA, Ongarello S et al. Antimicrobial resistance in Africa: a systematic review. BMC Infect Dis 2017; 17 (1): 616. DOI: 10.1186/s12879-017-2713-1
15. Ho J, Ip M. Antibiotic-Resistant Community-Acquired Bacterial Pneumonia. Infect Dis Clin North Am 2019; 33 (4): 1087–103. DOI: 10.1016/j.idc.2019.07.002
16. Hagiwara E, Baba T, Shinohara T et al. Ten-Year Trends and Clinical Relevance of the Antimicrobial Resistance Genotype in Respiratory Isolates of Streptococcus pneumoniae. Chemotherapy 2017; 62 (4): 256–61. DOI: 10.1159/000470828
17. Wang X, Cong Z, Huang W, Li C. Molecular characterization of Streptococcus pneumoniae isolated from pediatric patients in Shanghai, China. Pediatr Pulmonol 2020; 55 (8): 2135–41. DOI: 10.1002/ppul.24877
18. Antimicrobial resistance in the EU/EEA (EARS-Net) – Annual Epidemiological Report for 2019. www.ecdc.europa.eu/sites/default/ files/documents/surveillance-antimicrobial-resistance-Europe-2019.pdf
19. Жаркова Л.П., Стецюк О.У., Андреева И.В., Егорова О.А. Современные тенденции применения защищенных аминопенициллинов для лечения инфекций респираторного тракта в амбулаторной практике. Фарматека. 2011; 4 (217): 8–16.
[Zharkova L.P., Stetsyuk O.U., Andreeva I.V., Yegorova O.A. Modern trends for use of protected aminopenicillins in the treatment of respiratory tract infections in ambulatory practice. Farmateka. 2011; 4 (217): 8–16 (in Russian).]
20. Stratton CW. Dead bugs don't mutate: susceptibility issues in the emergence of bacterial resistance. Emerg Infect Dis 2003; 9 (1): 10–6. DOI: 10.3201/eid0901.020172
21. Свистушкин В.М., Андреева И.В., Стецюк О.У. Обзор современных рекомендаций по тактике ведения пациентов с острым бактериальным риносинуситом в педиатрической практике. Клиническая микробиология и антимикробная химиотерапия. 2012; 14 (3): 176–90.
[Svistushkin V.M., Andreeva I.V., Stetsiouk O.U. Review of current guidelines on the management of pediatric patients with acute bacterial rhinosinusitis. Clinical Microbiology and Antimicrobial Chemotherapy. 2012; 14 (3): 176–90 (in Russian).]
22. Dagan R. Achieving bacterial eradication using pharmacokinetic/ pharmacodynamic principles. Int J Infect Dis 2003; 7 Suppl 1: S21–6. DOI: 10.1016/s1201-9712(03)90067-1
23. Dagan R. The use of pharmacokinetic/pharmacodynamic principles to predict clinical outcome in paediatric acute otitis media. Int J Antimicrob Agents 2007; 30 Suppl 2: S127–30. DOI: 10.1016/j.ijantimicag.2007.07.039
24. Craig WA. Overview of newer antimicrobial formulations for overcoming pneumococcal resistance. Am J Med 2004; 117 Suppl 3A: 16S–22S. DOI: 10.1016/j.amjmed.2004.07.004
25. Страчунский Л.С., Белоусов Ю.Б., Козлов С.Н. Практическое руководство по антиинфекционной химиотерапии. Смоленск: МАКМАХ, 2007.
[Strachunskiy L.S., Belousov Yu.B., Kozlov S.N., editors. Prakticheskoe rukovodstvo po antiinfektsionnoi khimioterapii. Smolensk: MAKMAKH, 2007 (in Russian).]
26. Лобзин Ю.В., Брико Н.И., Козлов Р.С. и др. Резолюция Экспертного совета «Принципы рациональной антибиотикотерапии респираторных инфекций у детей. Сохраним антибиотики для будущих поколений». 31 марта 2018 г., Москва. Педиатрия (Прил. к журн. Consilium Medicum). 2018; (3): 10–5. DOI: 10.26442/2413-8460_2018.3.10-15
[Lobzin Yu.V., Briko N.I., Kozlov R.S. et al. Rezoliutsiia Ekspertnogo soveta "Printsipy ratsional'noi antibiotikoterapii respiratornykh infektsii u detei. Sokhranim antibiotiki dlia budushchikh pokolenii". 31 marta 2018 g., Moskva. Pediatrics. Consilium Medicum. 2018; (3): 10–5. DOI: 10.26442/2413-8460_2018.3.10-15 (in Russian).]
27. Инструкция по медицинскому применению лекарственного препарата Амоксициллин Диспертаб® (таблетки диспергируемые 125 мг, 250 мг, 500 мг, 1000 мг). Производитель – АВВА РУС ОАО, номер регистрационного удостоверения ЛП-006567-131120.
[Instruktsiia po meditsinskomu primeneniiu lekarstvennogo preparata Amoksitsillin Dispertab® (tabletki dispergiruemye 125 mg, 250 mg, 500 mg, 1000 mg). Proizvoditel' – AVVA RUS OAO, nomer registratsionnogo udostovereniia LP-006567-131120 (in Russian).]
28. Инструкция по медицинскому применению лекарственного препарата Амоксициллин (капсулы 250 мг). Производитель – АВВА РУС ОАО, номер регистрационного удостоверения ЛС-000409-270912.
[Instruktsiia po meditsinskomu primeneniiu lekarstvennogo preparata Amoksitsillin (kapsuly 250 mg). Proizvoditel' – AVVA RUS OAO, nomer registratsionnogo udostovereniia LS-000409-270912 (in Russian).]
29. Инструкция по медицинскому применению лекарственного препарата Амоксициллин (капсулы 250 и 500 мг). Производитель – Хемофарм А.Д. (Сербия), номер регистрационного удостоверения П N011641/01-270919.
[Instruktsiia po meditsinskomu primeneniiu lekarstvennogo preparata Amoksitsillin (kapsuly 250 i 500 mg). Proizvoditel' – Khemofarm A.D. (Serbiia), nomer registratsionnogo udostovereniia P N011641/01-270919 (in Russian).]
30. Инструкция по медицинскому применению лекарственного препарата Амоксиклав (порошок для приготовления суспензии для приема внутрь 600 мг + 42,9 мг / 5 мл). Производитель – Сандоз д.д., номер регистрационного удостоверения ЛП-006516-161020.
[Instruktsiia po meditsinskomu primeneniiu lekarstvennogo preparata Amoksiklav (poroshok dlia prigotovleniia suspenzii dlia priema vnutr' 600 mg + 42,9 mg / 5 ml). Proizvoditel' – Sandoz d.d., nomer registratsionnogo udostovereniia LP-006516-161020 (in Russian).]
31. Bottenfield GW, Burch DJ, Hedrick JA et al. Safety and tolerability of a new formulation (90 mg/kg/day divided every 12 h) of amoxicillin/clavulanate (Augmentin) in the empiric treatment of pediatric acute otitis media caused by drug-resistant Streptococcus pneumoniae. Pediatr Infect Dis J 1998; 17 (10): 963–8. DOI: 10.1097/ 00006454-199810000-00041
32. Dagan R, Hoberman A, Johnson C et al. Bacteriologic and clinical efficacy of high dose amoxicillin/clavulanate in children with acute otitis media. Pediatr Infect Dis J 2001; 20 (9): 829–37. DOI: 10.1097/ 00006454-200109000-00002
33. Hoberman A, Dagan R, Leibovitz E et al. Large dosage amoxicillin/clavulanate, compared with azithromycin, for the treatment of bacterial acute otitis media in children. Pediatr Infect Dis J 2005; 24 (6): 525–32. DOI: 10.1097/01.inf.0000164794.50281.1a
34. Block SL, Schmier JK, Notario GF et al. Efficacy, tolerability, and parent reported outcomes for cefdinir vs. high-dose amoxicillin/clavulanate oral suspension for acute otitis media in young children. Curr Med Res Opin 2006; 22 (9): 1839–47. DOI: 10.1185/030079906 X132406
35. Sher L, Arguedas A, Husseman M et al. Randomized, investigator-blinded, multicenter, comparative study of gatifloxacin versus amoxicillin/clavulanate in recurrent otitis media and acute otitis media treatment failure in children. Pediatr Infect Dis J 2005; 24 (4): 301–8. DOI: 10.1097/01.inf.0000157084.35865.ba
36. Wald ER, Nash D, Eickhoff J. Effectiveness of amoxicillin/clavulanate potassium in the treatment of acute bacterial sinusitis in children. Pediatrics 2009; 124 (1): 9–15. DOI: 10.1542/peds.2008-2902
37. Poachanukoon O, Kitcharoensakkul M. Efficacy of cefditoren pivoxil and amoxicillin/clavulanate in the treatment of pediatric patients with acute bacterial rhinosinusitis in Thailand: a randomized, investigator-blinded, controlled trial. Clin Ther 2008; 30 (10): 1870–9. DOI: 10.1016/j.clinthera.2008.10.001.
38. Chow AW, Benninger MS, Brook I et al. IDSA clinical practice guideline for acute bacterial rhinosinusitis in children and adults. Clin Infect Dis 2012; 54 (8): e72–112. DOI: 10.1093/cid/cir1043
39. Pavez D, Pérez R, Cofré J, Rodríguez J. Recomendaciones para el diagnóstico y tratamiento antimicrobiano de la rinosinusitis aguda bacteriana en pediatría [Recommendations for diagnosis and antimicrobial treatment of acute bacterial rhinosinusitis in pediatrics]. Rev Chilena Infectol 2019; 36 (1): 78–82 (in Spanish). DOI: 10.4067/ S0716-10182019000100078
40. Leung AK, Hon KL, Chu WC. Acute bacterial sinusitis in children: an updated review. Drugs Context 2020; 9: 2020-9-3. DOI: 10.7573/dic.2020-9-3
41. Lieberthal AS, Carroll AE, Chonmaitree T et al. The diagnosis and management of acute otitis media. Pediatrics 2013; 131 (3) :e964–99. DOI: 10.1542/peds.2012-3488. Erratum in: Pediatrics 2014; 133 (2): 346.
42. Wald ER, Applegate KE, Bordley C et al. Clinical practice guideline for the diagnosis and management of acute bacterial sinusitis in children aged 1 to 18 years. Pediatrics 2013; 132 (1): e262–80. DOI: 10.1542/peds.2013-1071
43. Bradley JS, Byington CL, Shah SS et al. The management of community-acquired pneumonia in infants and children older than 3 months of age: clinical practice guidelines by the Pediatric Infectious Diseases Society and the Infectious Diseases Society of America. Clin Infect Dis 2011; 53 (7): e25–76. DOI: 10.1093/cid/cir531
44. Grant GB, Campbell H, Dowell SF et al. Recommendations for treatment of childhood non-severe pneumonia. Lancet Infect Dis 2009; 9 (3): 185–96. DOI: 10.1016/S1473-3099(09)70044-1
45. Российское респираторное общество, Межрегиональное педиатрическое респираторное общество, Федерация педиатров стран СНГ, Московское общество детских врачей. Внебольничная пневмония у детей: клинические рекомендации. М.: Оригинал-макет, 2015.
[Rossiiskoe respiratornoe obshchestvo, Mezhregional'noe pediatricheskoe respiratornoe obshchestvo, Federatsiia pediatrov stran SNG, Moskovskoe obshchestvo detskikh vrachei. Vnebol'nichnaia pnevmoniia u detei: klinicheskie rekomendatsii. Moscow: Original-maket, 2015 (in Russian).]
24 марта 2021
Количество просмотров: 6123


