Клинический разбор в общей медицине №02 2021
Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russia
dvoretski@mail.ru
Abstract
For physicians, every new case of anemia is a clinical problem with multiple unknowns. The case of female patient K. aged 40 with clinical and laboratory manifestations of anemia is reported. Pathogenetic variants of anemia have been studied; each variant characterized by specific laboratory test results determines future direction of diagnosis aimed at search for the cause of anemia (nosological diagnosis). Differential diagnosis has been developed.
Key words: anemia, syndromic diagnosis, nosological diagnosis, clinical case.
For citation: Dvoretsky L.I. Patient with anemia (clinical case study). Clinical review for general practice. 2021; 2: 28–31. DOI: 10.47407/ kr2021.2.2.00039
Каждый случай впервые выявленной анемии представляет для врача клиническую задачу со многими неизвестными, в частности, это расшифровка патогенетического варианта, дифференциальный диагноз, верификация причины, тактика ведения больных.
Больная К., 40 лет, доставлена в стационар после обморочного состояния. В приемном отделении выявлено снижение содержания гемоглобина до 70 г/л. Со слов больной, последние несколько месяцев отмечает слабость, головокружение, одышку при физической нагрузке. Анамнез без особенностей. Две беременности, во время которых отмечалось снижение показателей гемоглобина. Месячные 6–7 дней.
При объективном исследовании обращает внимание выраженная бледность кожи и слизистых, изменения ногтей в виде поперечной исчерченности. Периферические лимфоузлы не увеличены. Костно-мышечная система без особенностей. В легких дыхание везикулярное, хрипы не прослушиваются, частота дыхательных движений – 16/мин, тоны сердца звонкие, ритмичные, частота сердечных сокращений – 88/мин, артериальное давление – 130/80 мм рт. ст. Живот мягкий, при пальпации безболезненный. Печень и селезенка не увеличены. Мочеиспускание свободное, цвет мочи не изменен. Осмотрена хирургом и гинекологом. Выявлена миома матки. По заключению гинеколога, анемия не связана с менструальными кровопотерями. При пальцевом исследовании прямой кишки кал обычного цвета. Больной произведена трансфузия эритроцитов.
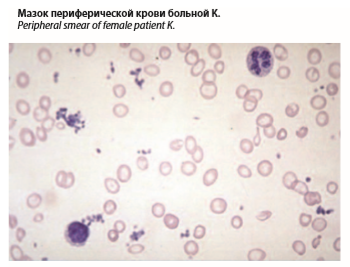
Анализ крови на следующий день: Нb – 80 г/л, эр. – 3,8×1012/л, МСН – 18 pg, МCV – 75 fl, л. – 8×109/л. Формула без особенностей. Тромбоциты – 520×109/л, ретикулоциты – 10%о. Сывороточное железо – 18 мколь/л. Ферритин – 4 мкг/л. Мазок периферической крови: гипохромия эритроцитов и микроцитоз (см. рисунок).
Наиболее вероятно, что больная с выраженной бледностью кожных покровов после обморочного состояния была госпитализирована с предположительным диагнозом «желудочно-кишечное кровотечение». Действительно, выраженность анемии (70 г/л!) при наличии клинических проявлений анемического синдрома (обморочное состояние), явившиеся поводом для госпитализации, не позволяли исключить в первую очередь острую кровопотерю [желудочно-кишечный тракт (ЖКТ), маточную]. В то же время анамнестические данные о наличии у больной клинической симптоматики на протяжении нескольких месяцев (слабость, головокружение, одышка при физической нагрузке) позволяли предполагать вероятность уже имевшейся анемии, которая достигла степени, критичной для жизненно важных органов (головной мозг) и манифестировалась соответствующими клиническими проявлениями.
При обследовании в приемном покое не было получено клинических данных за острую кровопотерю (осмотр хирурга и гинеколога, нормальные гемодинамические показатели). Кроме того, анемия в результате острой кровопотери сопровождается ретикулоцитозом, отсутствующим у больной (количество ретикулоцитов – 10%о). В то же время при гинекологическом исследовании выявлена миома матки, что в сочетании с указаниями на меноррагии должно было определять направление диагностического поиска в расшифровке природы анемии. Однако гинеколог не усмотрел возможной связи между меноррагиями и развитием анемии, которая, по заключению данного специалиста, «не связана с имеющимися у больной менструальными кровопотерями». Учитывая выраженность анемии
(70 г/л), а также признаки гипоксии головного мозга больной произведена трансфузия эритроцитов, оправданная с учетом клинической ситуации и рекомендациями по ведению больных с анемическим синдромом.
Дальнейший диагностический поиск в расшифровке природы анемии у данной пациентки заключался в определении патогенетического варианта анемии (синдромная диагностика) с последующей верификацией причины анемического синдрома (нозологическая диагностика). Принято выделять несколько патогенетических вариантов анемии:
 • железодефицитные;
• железодефицитные;
• сидероахрестические (железонасыщенные);
• железоперераспределительные (анемии воспаления);
• В12- и фолиеводефицитные;
• гемолитические;
• анемии, связанные с костномозговой недостаточностью ;
• анемии, связанные с уменьшением массы эритроцитов.
Каждый из этих патогенетических вариантов характеризуется определенными лабораторными особенностями и определяет дальнейшее направление диагностического поиска для выявления причины анемии (нозологическая диагностика).
Полученные результаты лабораторного исследования свидетельствовали о наличии у больной гипохромной микроцитарной анемии [МСН – 18 pg (норма 27–34 pg), МСV – 80 fl (80–100 fl), морфология эритроцитов]. В мазке периферической крови обращает внимание выраженная гипохромия эритроцитов, которые имеют большое просветление и выглядят в форме колец (анулоцит; см. рисунок). Следует подчеркнуть, что мазок периферической крови представляет для курирующего врача (не специалиста-гематолога) такой же важный диагностический материал, как и электрокардиограмма (ЭКГ) или рентгенограмма органов грудной клетки, позволяющие врачу общей практики дать предварительную оценку таких признаков, как ишемия, нарушения ритма на ЭКГ, размеры сердца, наличие инфильтрации легких, плевральный выпот на рентгенограмме органов грудной клетки.
Наличие у больной гипохромной анемии позволяет в первую очередь предполагать с большой вероятностью железодефицитную анемию (ЖДА), один из наиболее частых патогенетических вариантов анемии. Однако незначительный процент гипохромных анемий не связан с дефицитом железа (все ЖДА – гипохромные, но не все гипохромные анемии являются железодефицитными). Речь может идти о редком патогенетическом варианте сидероахрестической анемии (ахрезия – неусвоение), при которой содержание сывороточного железа (СЖ) оказывается нормальным или даже повышенным, но нарушается его использование молекулой гемоглобина. Причины сидерахрестических анемий могут быть различными (хроническая свинцовая интоксикация, лекарственные воздействия, алкоголизм и др.). Основным лабораторным тестом, позволяющим дифференцировать железодефицитные и сидероахрестические анемии является содержание СЖ. Между тем показатели СЖ у пациентки составляли 18 мкмоль/л, что оказалось в пределах нормы (10–30 мкмоль/л у женщин) и, казалось бы, исключало предположение о наличии в данном случае ЖДА. Однако при трактовке показателей СЖ следует учитывать различные факторы, влияющие на результаты данного исследования. К факторам, влияющим на показатели СЖ у больных ЖДА, относятся:
• прием препаратов железа;
• прием поливитаминов, содержащих железо;
• прием лекарственных препаратов (оральные контрацептивы, метотрексат, этанол);
• трансфузия эритроцитов;
• фаза цикла, в которую проводится исследование.
Наиболее частой ошибкой является исследование содержания СЖ после назначения препаратов железа, что затрудняет адекватную трактовку данного показателя в подобных ситуациях и дальнейший диагностический поиск. Исследование СЖ у пациентки проводилось после трансфузии эритроцитов, в связи с чем полученные показатели не отражают истинное содержание СЖ. В данной ситуации большее диагностическое значение имеет показатель ферритина (ФР) в сыворотке, составляющий 4 мкг/л (норма 10–125 мкг/л). ФР является железосодержащим белком, отражающим запасы железа в организме. От величины этих запасов зависят темпы развития ЖДА при различных патологических (физиологических) процессах (хронические кровопотери, беременность и кормление, алиментарная недостаточность и др.). С учетом анамнестических данных больной о наличии анемии во время двух беременностей есть основания предполагать низкое содержание депонированного железа, а низкие показатели ФР подтверждают железодефицитный характер гипохромной анемии. Следует обратить внимание на наличие у больной клинических признаков гипосидероза (ломкость и поперечная исчерченность ногтей), что также свидетельствует о наличии железодефицита.
В анализе периферической крови у пациентки обращает внимание повышение количества тромбоцитов до 520×109/л (верхняя граница нормы – 450×109/л). Наличие анемии в сочетании с тромбоцитозом нередко вызывает у врачей-терапевтов, не учитывающих железодефицитный характер анемии, подозрение на «заболевание системы крови» и является поводом для консультации больных с гематологом. Между тем у больных ЖДА может выявляться реактивный тромбоцитоз, причем после коррекции дефицита железа количество тромбоцитов нормализуется.
Таким образом, на первом этапе диагностического поиска (синдромная диагностика) у больной диагностирована ЖДА, один из частых патогенетических вариантов анемий. На следующем этапе (нозологическая диагностика) необходимо установить причину ЖДА у данной пациентки, т.е. диагностировать конкретное заболевание.
Наиболее частой причиной ЖДА являются хронические кровопотери различной локализации (носовые, желудочно-кишечные, маточные, почечные). Развитие ЖДА у женщин детородного возраста обычно связано с наличием меноррагий различной причины (миома матки, эндометриоз, дисфункциональные кровотечения и др.). Другими причинами ЖДА могут быть нарушения всасывания железа (патология кишечника, бариатрические операции), алиментарный дефицит, повышенный расход железа (беременность, кормление). В данном случае можно предполагать, что причиной ЖДА у пациентки являются меноррагии, поскольку имеется миома и указания на обильные месячные. Между тем консультирующий гинеколог высказал заключение, что анемия «не связана с имеющимися у больной менструальными кровопотерями».
Здесь уместны комментарии по поводу трактовки механизма развития анемий различными специалистами при кровопотерях, т.е. патогенетическая расшифровка этиологического термина «постгеморрагическая анемия». Клинический опыт взаимодействия с врачами «хирургического профиля» свидетельствует о том, что указанные специалисты ассоциируют наличие выраженной анемии, как правило, с обильными кровопотерями (кровотечения у больных язвенной болезнью, варикозно-расширенными венами пищевода, с травматическими повреждениями сосудов, внематочной беременностью и др.). Механизм развития подобных
«постгеморрагических анемий», обозначаемых как острые кровопотери, связан с уменьшением объема циркулирующих эритроцитов. Анемии при этом носят нормохромный характер, сопровождаются, как правило, ретикулоцитозом, часто реактивным лейкоцитозом и тромбоцитозом, различными гемодинамическими нарушениями и требуют при этом, особенно при больших кровопотерях, трансфузии эритроцитов, что является патогенетической терапией.
Однако существует другой вариант постгеморрагических анемий, в основе которых лежит не уменьшение массы эритроцитов, а развитие дефицита железа. Формально эти анемии являются также постгеморрагическими, поскольку причиной являются хронические кровопотери (носовые, маточные, геморроидальные и др.). При этом важен не объем кровопотери, а ее длительность с постепенным истощением запасов железа (снижение содержания ФР), формированием абсолютного дефицита железа (снижение показателей сывороточного железа) и развитием ЖДА с характерными признаками [гипохромия и микроцитоз эритроцитов, низкие показатели МСН (ниже 27 pg), которые наблюдались у больной]. Следует отметить, что своевременно не диагностированная и не корригированная ЖДА может проявляться значительным снижением показателей гемоглобина, как это имело место у данной пациентки. Именно такие ситуации в виде несоответствия между выраженностью анемии и недостаточной величиной кровопотери служат основанием для отрицания причинно-следственной связи этих событий, свидетельством чего было заключение гинеколога. Если считать, что среднее количество теряемой крови за одну менструацию составляет 50 мл (25 мг железа), то менструальные кровопотери, превышающие это количество, создают дефицит за один месяц, постепенно возрастающий в течение года и накапливающийся на протяжении нескольких лет при продолжающихся меноррагиях. Аналогичная ситуация с частыми незначительными кровопотерями («кровопотери по каплям») встречается у больных кровоточащим геморроем, у которых хирурги не всегда ассоциируют анемию, нередко выраженную, с такими кровопотерями.
Таким образом, у обсуждаемой больной имеется ЖДА, причиной которой являются меноррагии, т.е. длительные хронические кровопотери, способствующие избыточной потери железа. Эти потери не компенсируются поступлением пищевого железа и со временем приводят к истощению запасов железа с развитием абсолютного железодефицита и манифестной анемии. Меноррагии являются наиболее частой причиной ЖДА у женщин. Подобные пациенты должны обследоваться у гинеколога с целью установления причин меноррагий, в частности исключения эндометриоза. Данная патология характеризуется наличием участков эндометриоидной ткани в миометрии, яичниках или экстрагенитально. При этом кровопотери во время менструаций происходят не только естественным путем, но и в замкнутые полости, в связи с чем оценить величину кровопотерь не представляется возможным. Кроме того, у всех больных ЖДА необходимо исключать и другие хронические кровопотери, прежде всего из ЖКТ, даже при отсутствии клинической симптоматики.
Наличие у больной ЖДА требует наряду с коррекцией имеющейся причины (хронические кровопотери, нарушение всасывания железа, алиментарные факторы и т.д.) назначение препаратов железа (ПЖ). При этом необходимо принять несколько решений о тактике лечения ПЖ:
• путь введения ПЖ;
• выбор ПЖ;
• оценка эффективности;
• длительность лечения;
• необходимость поддерживающей терапии.
Пациентке показаны ПЖ для приема внутрь, поскольку отсутствуют показания для применения парентеральных ПЖ (нарушение всасывания, непереносимость пероральных ПЖ). При выборе ПЖ необходимо ориентироваться на содержание элементарного железа в препарате. С целью компенсирования железодефицита больные должны получать в сутки от 100 до 300 мг железа, что может быть обеспечено приемом ПЖ, содержащим не менее 100 мг элементарного железа. Выраженность анемии не всегда является основанием для назначения парентеральных ПЖ, поскольку ПЖ с хорошей биодоступностью обеспечивают адекватный прирост показателей гемоглобина. Длительность лечения ПЖ определяется выраженностью анемии и степенью дефицита железа и его запасов. Целесообразно проведение насыщающей и поддерживающей терапии. У женщин с наличием ЖДА на фоне меноррагий, в частности у обсуждаемой больной, показана насыщающая терапия пероральными ПЖ (ежедневный прием в течение 2–3 мес) с последующей поддерживающей терапией (5–7 дней после каждой менструации в течение нескольких месяцев). Назначение ПЖ для поддерживающей терапии после каждой менструации рекомендовано только с целью напоминания о наступившем сроке очередного приема (окончание менструации служит неким таймером). Поддерживающая терапия ПЖ проводится с целью восполнения запасов железа.
Патогенетическая терапия ПЖ не исключает необходимости обследования больной у гинеколога для выявления причины меноррагий и назначения соответствующей терапии.
Информация об авторе / Information about the author
Дворецкий Леонид Иванович – д-р мед. наук, проф. каф. госпитальной терапии №2 ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: dvoretski@mail.ru; ORCID: 0000-0003-3186-0102
Leonid I. Dvoretsky – D. Sci. (Med.), Full Prof., Sechenov First Moscow State Medical University (Sechenov University). E-mail: dvoretski@mail.ru; ORCID: 0000-0003-3186-0102
Статья поступила в редакцию / The article received: 03.03.2021
Статья принята к печати / The article approved for publication: 12.03.2021
Клинический разбор в общей медицине №02 2021
У больной анемия (клинический разбор)
Номера страниц в выпуске:28-31
Аннотация
Каждый случай впервые выявленной анемии представляет для врача клиническую задачу со многими неизвестными. В статье приводится клинический разбор больной К., 40 лет, с клиническими и лабораторными проявлениями анемии. Разобраны патогенетические варианты анемии, каждый из которых характеризуется определенными лабораторными особенностями и определяет дальнейшее направление диагностического поиска для выявления причины анемии (нозологическая диагностика). Проведена дифференциальная диагностика.
Ключевые слова: анемия, синдромная диагностика, нозологическая диагностика, клинический случай.
Для цитирования: Дворецкий Л.И. У больной анемия (клинический разбор). Клинический разбор в общей медицине. 2021; 2: 28–31. DOI: 10.47407/kr2021.2.2.00039
Каждый случай впервые выявленной анемии представляет для врача клиническую задачу со многими неизвестными. В статье приводится клинический разбор больной К., 40 лет, с клиническими и лабораторными проявлениями анемии. Разобраны патогенетические варианты анемии, каждый из которых характеризуется определенными лабораторными особенностями и определяет дальнейшее направление диагностического поиска для выявления причины анемии (нозологическая диагностика). Проведена дифференциальная диагностика.
Ключевые слова: анемия, синдромная диагностика, нозологическая диагностика, клинический случай.
Для цитирования: Дворецкий Л.И. У больной анемия (клинический разбор). Клинический разбор в общей медицине. 2021; 2: 28–31. DOI: 10.47407/kr2021.2.2.00039
Patient with anemia (clinical case study)
Leonid I. DvoretskySechenov First Moscow State Medical University (Sechenov University), Moscow, Russia
dvoretski@mail.ru
Abstract
For physicians, every new case of anemia is a clinical problem with multiple unknowns. The case of female patient K. aged 40 with clinical and laboratory manifestations of anemia is reported. Pathogenetic variants of anemia have been studied; each variant characterized by specific laboratory test results determines future direction of diagnosis aimed at search for the cause of anemia (nosological diagnosis). Differential diagnosis has been developed.
Key words: anemia, syndromic diagnosis, nosological diagnosis, clinical case.
For citation: Dvoretsky L.I. Patient with anemia (clinical case study). Clinical review for general practice. 2021; 2: 28–31. DOI: 10.47407/ kr2021.2.2.00039
Каждый случай впервые выявленной анемии представляет для врача клиническую задачу со многими неизвестными, в частности, это расшифровка патогенетического варианта, дифференциальный диагноз, верификация причины, тактика ведения больных.
Больная К., 40 лет, доставлена в стационар после обморочного состояния. В приемном отделении выявлено снижение содержания гемоглобина до 70 г/л. Со слов больной, последние несколько месяцев отмечает слабость, головокружение, одышку при физической нагрузке. Анамнез без особенностей. Две беременности, во время которых отмечалось снижение показателей гемоглобина. Месячные 6–7 дней.
При объективном исследовании обращает внимание выраженная бледность кожи и слизистых, изменения ногтей в виде поперечной исчерченности. Периферические лимфоузлы не увеличены. Костно-мышечная система без особенностей. В легких дыхание везикулярное, хрипы не прослушиваются, частота дыхательных движений – 16/мин, тоны сердца звонкие, ритмичные, частота сердечных сокращений – 88/мин, артериальное давление – 130/80 мм рт. ст. Живот мягкий, при пальпации безболезненный. Печень и селезенка не увеличены. Мочеиспускание свободное, цвет мочи не изменен. Осмотрена хирургом и гинекологом. Выявлена миома матки. По заключению гинеколога, анемия не связана с менструальными кровопотерями. При пальцевом исследовании прямой кишки кал обычного цвета. Больной произведена трансфузия эритроцитов.
Анализ крови на следующий день: Нb – 80 г/л, эр. – 3,8×1012/л, МСН – 18 pg, МCV – 75 fl, л. – 8×109/л. Формула без особенностей. Тромбоциты – 520×109/л, ретикулоциты – 10%о. Сывороточное железо – 18 мколь/л. Ферритин – 4 мкг/л. Мазок периферической крови: гипохромия эритроцитов и микроцитоз (см. рисунок).
Наиболее вероятно, что больная с выраженной бледностью кожных покровов после обморочного состояния была госпитализирована с предположительным диагнозом «желудочно-кишечное кровотечение». Действительно, выраженность анемии (70 г/л!) при наличии клинических проявлений анемического синдрома (обморочное состояние), явившиеся поводом для госпитализации, не позволяли исключить в первую очередь острую кровопотерю [желудочно-кишечный тракт (ЖКТ), маточную]. В то же время анамнестические данные о наличии у больной клинической симптоматики на протяжении нескольких месяцев (слабость, головокружение, одышка при физической нагрузке) позволяли предполагать вероятность уже имевшейся анемии, которая достигла степени, критичной для жизненно важных органов (головной мозг) и манифестировалась соответствующими клиническими проявлениями.
При обследовании в приемном покое не было получено клинических данных за острую кровопотерю (осмотр хирурга и гинеколога, нормальные гемодинамические показатели). Кроме того, анемия в результате острой кровопотери сопровождается ретикулоцитозом, отсутствующим у больной (количество ретикулоцитов – 10%о). В то же время при гинекологическом исследовании выявлена миома матки, что в сочетании с указаниями на меноррагии должно было определять направление диагностического поиска в расшифровке природы анемии. Однако гинеколог не усмотрел возможной связи между меноррагиями и развитием анемии, которая, по заключению данного специалиста, «не связана с имеющимися у больной менструальными кровопотерями». Учитывая выраженность анемии
(70 г/л), а также признаки гипоксии головного мозга больной произведена трансфузия эритроцитов, оправданная с учетом клинической ситуации и рекомендациями по ведению больных с анемическим синдромом.
Дальнейший диагностический поиск в расшифровке природы анемии у данной пациентки заключался в определении патогенетического варианта анемии (синдромная диагностика) с последующей верификацией причины анемического синдрома (нозологическая диагностика). Принято выделять несколько патогенетических вариантов анемии:
 • железодефицитные;
• железодефицитные;• сидероахрестические (железонасыщенные);
• железоперераспределительные (анемии воспаления);
• В12- и фолиеводефицитные;
• гемолитические;
• анемии, связанные с костномозговой недостаточностью ;
• анемии, связанные с уменьшением массы эритроцитов.
Каждый из этих патогенетических вариантов характеризуется определенными лабораторными особенностями и определяет дальнейшее направление диагностического поиска для выявления причины анемии (нозологическая диагностика).
Полученные результаты лабораторного исследования свидетельствовали о наличии у больной гипохромной микроцитарной анемии [МСН – 18 pg (норма 27–34 pg), МСV – 80 fl (80–100 fl), морфология эритроцитов]. В мазке периферической крови обращает внимание выраженная гипохромия эритроцитов, которые имеют большое просветление и выглядят в форме колец (анулоцит; см. рисунок). Следует подчеркнуть, что мазок периферической крови представляет для курирующего врача (не специалиста-гематолога) такой же важный диагностический материал, как и электрокардиограмма (ЭКГ) или рентгенограмма органов грудной клетки, позволяющие врачу общей практики дать предварительную оценку таких признаков, как ишемия, нарушения ритма на ЭКГ, размеры сердца, наличие инфильтрации легких, плевральный выпот на рентгенограмме органов грудной клетки.
Наличие у больной гипохромной анемии позволяет в первую очередь предполагать с большой вероятностью железодефицитную анемию (ЖДА), один из наиболее частых патогенетических вариантов анемии. Однако незначительный процент гипохромных анемий не связан с дефицитом железа (все ЖДА – гипохромные, но не все гипохромные анемии являются железодефицитными). Речь может идти о редком патогенетическом варианте сидероахрестической анемии (ахрезия – неусвоение), при которой содержание сывороточного железа (СЖ) оказывается нормальным или даже повышенным, но нарушается его использование молекулой гемоглобина. Причины сидерахрестических анемий могут быть различными (хроническая свинцовая интоксикация, лекарственные воздействия, алкоголизм и др.). Основным лабораторным тестом, позволяющим дифференцировать железодефицитные и сидероахрестические анемии является содержание СЖ. Между тем показатели СЖ у пациентки составляли 18 мкмоль/л, что оказалось в пределах нормы (10–30 мкмоль/л у женщин) и, казалось бы, исключало предположение о наличии в данном случае ЖДА. Однако при трактовке показателей СЖ следует учитывать различные факторы, влияющие на результаты данного исследования. К факторам, влияющим на показатели СЖ у больных ЖДА, относятся:
• прием препаратов железа;
• прием поливитаминов, содержащих железо;
• прием лекарственных препаратов (оральные контрацептивы, метотрексат, этанол);
• трансфузия эритроцитов;
• фаза цикла, в которую проводится исследование.
Наиболее частой ошибкой является исследование содержания СЖ после назначения препаратов железа, что затрудняет адекватную трактовку данного показателя в подобных ситуациях и дальнейший диагностический поиск. Исследование СЖ у пациентки проводилось после трансфузии эритроцитов, в связи с чем полученные показатели не отражают истинное содержание СЖ. В данной ситуации большее диагностическое значение имеет показатель ферритина (ФР) в сыворотке, составляющий 4 мкг/л (норма 10–125 мкг/л). ФР является железосодержащим белком, отражающим запасы железа в организме. От величины этих запасов зависят темпы развития ЖДА при различных патологических (физиологических) процессах (хронические кровопотери, беременность и кормление, алиментарная недостаточность и др.). С учетом анамнестических данных больной о наличии анемии во время двух беременностей есть основания предполагать низкое содержание депонированного железа, а низкие показатели ФР подтверждают железодефицитный характер гипохромной анемии. Следует обратить внимание на наличие у больной клинических признаков гипосидероза (ломкость и поперечная исчерченность ногтей), что также свидетельствует о наличии железодефицита.
В анализе периферической крови у пациентки обращает внимание повышение количества тромбоцитов до 520×109/л (верхняя граница нормы – 450×109/л). Наличие анемии в сочетании с тромбоцитозом нередко вызывает у врачей-терапевтов, не учитывающих железодефицитный характер анемии, подозрение на «заболевание системы крови» и является поводом для консультации больных с гематологом. Между тем у больных ЖДА может выявляться реактивный тромбоцитоз, причем после коррекции дефицита железа количество тромбоцитов нормализуется.
Таким образом, на первом этапе диагностического поиска (синдромная диагностика) у больной диагностирована ЖДА, один из частых патогенетических вариантов анемий. На следующем этапе (нозологическая диагностика) необходимо установить причину ЖДА у данной пациентки, т.е. диагностировать конкретное заболевание.
Наиболее частой причиной ЖДА являются хронические кровопотери различной локализации (носовые, желудочно-кишечные, маточные, почечные). Развитие ЖДА у женщин детородного возраста обычно связано с наличием меноррагий различной причины (миома матки, эндометриоз, дисфункциональные кровотечения и др.). Другими причинами ЖДА могут быть нарушения всасывания железа (патология кишечника, бариатрические операции), алиментарный дефицит, повышенный расход железа (беременность, кормление). В данном случае можно предполагать, что причиной ЖДА у пациентки являются меноррагии, поскольку имеется миома и указания на обильные месячные. Между тем консультирующий гинеколог высказал заключение, что анемия «не связана с имеющимися у больной менструальными кровопотерями».
Здесь уместны комментарии по поводу трактовки механизма развития анемий различными специалистами при кровопотерях, т.е. патогенетическая расшифровка этиологического термина «постгеморрагическая анемия». Клинический опыт взаимодействия с врачами «хирургического профиля» свидетельствует о том, что указанные специалисты ассоциируют наличие выраженной анемии, как правило, с обильными кровопотерями (кровотечения у больных язвенной болезнью, варикозно-расширенными венами пищевода, с травматическими повреждениями сосудов, внематочной беременностью и др.). Механизм развития подобных
«постгеморрагических анемий», обозначаемых как острые кровопотери, связан с уменьшением объема циркулирующих эритроцитов. Анемии при этом носят нормохромный характер, сопровождаются, как правило, ретикулоцитозом, часто реактивным лейкоцитозом и тромбоцитозом, различными гемодинамическими нарушениями и требуют при этом, особенно при больших кровопотерях, трансфузии эритроцитов, что является патогенетической терапией.
Однако существует другой вариант постгеморрагических анемий, в основе которых лежит не уменьшение массы эритроцитов, а развитие дефицита железа. Формально эти анемии являются также постгеморрагическими, поскольку причиной являются хронические кровопотери (носовые, маточные, геморроидальные и др.). При этом важен не объем кровопотери, а ее длительность с постепенным истощением запасов железа (снижение содержания ФР), формированием абсолютного дефицита железа (снижение показателей сывороточного железа) и развитием ЖДА с характерными признаками [гипохромия и микроцитоз эритроцитов, низкие показатели МСН (ниже 27 pg), которые наблюдались у больной]. Следует отметить, что своевременно не диагностированная и не корригированная ЖДА может проявляться значительным снижением показателей гемоглобина, как это имело место у данной пациентки. Именно такие ситуации в виде несоответствия между выраженностью анемии и недостаточной величиной кровопотери служат основанием для отрицания причинно-следственной связи этих событий, свидетельством чего было заключение гинеколога. Если считать, что среднее количество теряемой крови за одну менструацию составляет 50 мл (25 мг железа), то менструальные кровопотери, превышающие это количество, создают дефицит за один месяц, постепенно возрастающий в течение года и накапливающийся на протяжении нескольких лет при продолжающихся меноррагиях. Аналогичная ситуация с частыми незначительными кровопотерями («кровопотери по каплям») встречается у больных кровоточащим геморроем, у которых хирурги не всегда ассоциируют анемию, нередко выраженную, с такими кровопотерями.
Таким образом, у обсуждаемой больной имеется ЖДА, причиной которой являются меноррагии, т.е. длительные хронические кровопотери, способствующие избыточной потери железа. Эти потери не компенсируются поступлением пищевого железа и со временем приводят к истощению запасов железа с развитием абсолютного железодефицита и манифестной анемии. Меноррагии являются наиболее частой причиной ЖДА у женщин. Подобные пациенты должны обследоваться у гинеколога с целью установления причин меноррагий, в частности исключения эндометриоза. Данная патология характеризуется наличием участков эндометриоидной ткани в миометрии, яичниках или экстрагенитально. При этом кровопотери во время менструаций происходят не только естественным путем, но и в замкнутые полости, в связи с чем оценить величину кровопотерь не представляется возможным. Кроме того, у всех больных ЖДА необходимо исключать и другие хронические кровопотери, прежде всего из ЖКТ, даже при отсутствии клинической симптоматики.
Наличие у больной ЖДА требует наряду с коррекцией имеющейся причины (хронические кровопотери, нарушение всасывания железа, алиментарные факторы и т.д.) назначение препаратов железа (ПЖ). При этом необходимо принять несколько решений о тактике лечения ПЖ:
• путь введения ПЖ;
• выбор ПЖ;
• оценка эффективности;
• длительность лечения;
• необходимость поддерживающей терапии.
Пациентке показаны ПЖ для приема внутрь, поскольку отсутствуют показания для применения парентеральных ПЖ (нарушение всасывания, непереносимость пероральных ПЖ). При выборе ПЖ необходимо ориентироваться на содержание элементарного железа в препарате. С целью компенсирования железодефицита больные должны получать в сутки от 100 до 300 мг железа, что может быть обеспечено приемом ПЖ, содержащим не менее 100 мг элементарного железа. Выраженность анемии не всегда является основанием для назначения парентеральных ПЖ, поскольку ПЖ с хорошей биодоступностью обеспечивают адекватный прирост показателей гемоглобина. Длительность лечения ПЖ определяется выраженностью анемии и степенью дефицита железа и его запасов. Целесообразно проведение насыщающей и поддерживающей терапии. У женщин с наличием ЖДА на фоне меноррагий, в частности у обсуждаемой больной, показана насыщающая терапия пероральными ПЖ (ежедневный прием в течение 2–3 мес) с последующей поддерживающей терапией (5–7 дней после каждой менструации в течение нескольких месяцев). Назначение ПЖ для поддерживающей терапии после каждой менструации рекомендовано только с целью напоминания о наступившем сроке очередного приема (окончание менструации служит неким таймером). Поддерживающая терапия ПЖ проводится с целью восполнения запасов железа.
Патогенетическая терапия ПЖ не исключает необходимости обследования больной у гинеколога для выявления причины меноррагий и назначения соответствующей терапии.
Информация об авторе / Information about the author
Дворецкий Леонид Иванович – д-р мед. наук, проф. каф. госпитальной терапии №2 ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: dvoretski@mail.ru; ORCID: 0000-0003-3186-0102
Leonid I. Dvoretsky – D. Sci. (Med.), Full Prof., Sechenov First Moscow State Medical University (Sechenov University). E-mail: dvoretski@mail.ru; ORCID: 0000-0003-3186-0102
Статья поступила в редакцию / The article received: 03.03.2021
Статья принята к печати / The article approved for publication: 12.03.2021


