Клинический разбор в общей медицине №04 2021
Omsk State Medical University, Omsk, Russia
dmitry_trukhan@mail.ru
Abstract
In the diagnosis and subsequent supervision of patients with non-alcoholic fatty liver disease (NAFLD) and obesity in real clinical practice, the role and importance of the doctor of first contact (therapist and general practitioner) increases. Non-alcoholic fatty liver disease is currently considered as the hepatic component of metabolic syndrome. A diagnostic algorithm for NAFLD at the stage of primary health care is presented. The most difficult question at 2–4 levels of the diagnostic algorithm is the differential diagnosis between NAFLD and alcoholic liver disease. During a pandemic of a novel coronavirus infection (COVID-19), patients with NAFLD or NASH, as a rule, have concomitant metabolic diseases such as diabetes mellitus, arterial hypertension and obesity, and also have to take a large number of potentially hepatotoxic drugs, it is advisable to classify them as elevated risk of infection with SARS-CoV-2, and the severe course of this infection. This allows us to consider NAFLD as dangerous in terms of the severe course of COVID-19, as viral hepatitis, autoimmune hepatitis and liver fibrosis / cirrhosis. It is known that NAFLD is an independent predictor of not only high cardiovascular risks, but also hepatocellular carcinoma and malignant neoplasms of various localization, as well as a number of other comorbid conditions. The review concludes with a clinical observation illustrating the difficulty of early diagnosis of intrahepatic cholangiocarcinoma in a patient with NAFLD and other metabolic risk factors.
Key words: non-alcoholic fatty liver disease, obesity, metabolic syndrome, alcoholic liver disease, diagnostics.
For citation: Trukhan D.I. Non-alcoholic fatty liver disease: current aspects of diagnosis in real clinical practice. Clinical review for general practice. 2021; 4: 40–50. DOI: 10.47407/kr2021.2.4.00059
На сегодняшний день основой системы оказания медицинской помощи является первичная медико-санитарная помощь (ПМСП). Взрослому населению ПМСП оказывается врачами первого контакта – терапевтами, участковыми терапевтами и врачами общей практики (семейными врачами). Переход к организации ПМСП по принципу семейного врача (врача общей практики) предполагает значительное расширение функций, выполняемых врачом первого контакта. Важным направлением работы в общетерапевтической практике остается профилактика заболеваний.
К настоящему времени свыше 1/3 взрослых в мире имеют избыточную массу тела – 36,9% мужчин и 38% женщин, а каждый 10-й страдает ожирением (ИМТ – 30 кг/м2 и более) [2].
Широкая распространенность ожирения способствовала появлению в медицинской литературе термина «globesity», подчеркивающего глобальность и значимость данного явления [2]. В нашей стране распространенность избыточной массы тела составляет 59,2%, а непосредственно ожирения – 24,1%, в США – 67,4 и 33,3%, в Великобритании – 63,6 и 25,8% соответственно [2].
Параллельно с увеличением числа лиц с ожирением и избыточной массой тела наблюдается существенный рост сахарного диабета (СД) и сердечно-сосудистых заболеваний, а среди заболеваний органов пищеварения – неалкогольной жировой болезни печени (НАЖБП) и гастроэзофагеальной рефлюксной болезни. В соответствии с данными ВОЗ [1], избыточная масса тела и ожирение предопределяют развитие до 44% всех случаев СД 2-го типа (СД 2), до 23% случаев ишемической болезни сердца. В большинстве европейских стран, по данным EASO (European Association for the Study of Obesity), следствием ожирения среди взрослого населения являются 80% случаев СД 2, 35% – ишемической болезни сердца, 55% – артериальной гипертензии [3].
Ожирение стало чрезвычайно дорогостоящей проблемой здравоохранения и с точки зрения экономики, и с точки зрения индивидуального и общественного здоровья, долголетия и психологического благополучия [1, 4, 5]. На сегодняшний день ожирение не считается только эстетической проблемой, вызванной перееданием и отсутствием самоконтроля. Национальные/международные медицинские/научные общества рекомендуют рассматривать ожирение как хроническое прогрессирующее заболевание, обусловленное избыточным накоплением жировой ткани, в результате многочисленных экологических и генетических факторов – «adiposity-based chronic disease (ABCD)» [6]. Так, в соответствии с определением ASMBS (American Society for Metabolic and Bariatric Surgery), ожирение – хроническое рецидивирующее многофакторное нейроповеденческое заболевание, при котором увеличение жира в организме способствует дисфункции жировой ткани и биомеханическому воздействию жировой ткани на окружающие ткани с развитием метаболических и психосоциальных последствий для здоровья [7].
По характеру распределения жира выделяют 2 основных типа ожирения: абдоминальное и глютеофеморальное. При абдоминальном типе основная масса жира расположена в брюшной полости, на передней брюшной стенке, туловище, шее и лице (андроидный или мужской тип ожирения). При глютеофеморальном типе отмечается преимущественное отложение жира на бедрах и ягодицах (гиноидный или женский тип ожирения). При смешанном типе отмечается равномерное распределение жировых отложений во всем организме человека.
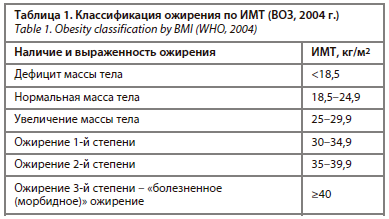 В 1950 г. ожирение было включено ВОЗ в Международную классификацию болезней, а в качестве основного критерия диагностики стал рассматриваться ИМТ (табл. 1). В настоящее время количественная оценка ожирения на основе ИМТ по-прежнему широко используется, поскольку является простым, легко воспроизводимым, надежным скрининговым критерием для оценки нормальной, избыточной массы тела и ожирения.
В 1950 г. ожирение было включено ВОЗ в Международную классификацию болезней, а в качестве основного критерия диагностики стал рассматриваться ИМТ (табл. 1). В настоящее время количественная оценка ожирения на основе ИМТ по-прежнему широко используется, поскольку является простым, легко воспроизводимым, надежным скрининговым критерием для оценки нормальной, избыточной массы тела и ожирения.
В то же время исследования последнего десятилетия демонстрируют, что ИМТ не является достаточным критерием для прогнозирования развития и течения всех заболеваний/состояний, ассоциированных с ожирением и избытком массы тела. Так, в ряде проспективных исследований по оценке влияния избыточного ИМТ и ожирения на показатели смертности получены неоднозначные результаты, в частности, свидетельствующие о лучшей выживаемости пациентов с избыточным ИМТ и небольшим ожирением по сравнению с нормальным и сниженным ИМТ.
В настоящее время активно обсуждается вопрос поиска дополнительных критериев оценки имеющегося у пациента ожирения. Так, алгоритм диагностики ожирения [8], предложенный в рекомендациях ААСЕ/АСЕ (American Association of Clinical Endocrinologists / American College of Endocrinology) 2014 г., включает в себя два компонента: а) оценку ИМТ с коррекцией на этнические особенности для выявления лиц с повышенным количеством жировой ткани и б) оценку значения ожирения на основе наличия или отсутствия связанных с ожирением состояний, заболеваний или осложнений (табл. 2).
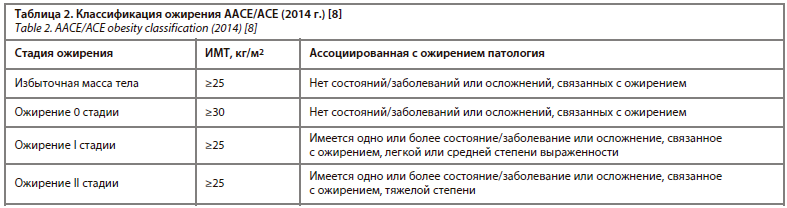
К ассоциированным с ожирением состояниям и заболеваниям относятся: метаболический синдром (МС), нарушенная толерантность к глюкозе, СД 2, дислипидемия, артериальная гипертензия, НАЖБП, гастроэзофагеальная рефлюксная болезнь, ночное апноэ, бронхиальная астма, остеоартроз, затруднение/неспособность активно двигаться, синдром поликистозных яичников, стрессовое и ургентное недержание мочи, психологические расстройства/стигматизация [8].
Данная классификация формирует переход от оценки ожирения на основе ИМТ (ИМТ-ориентированный подход) к оценке ожирения на основе наличия или отсутствия связанных с ожирением заболеваний или болезненных состояний («подход, ориентированный на осложнения») [9, 10].
Одним из наиболее часто ассоциированных с ожирением патологических состояний является МС, характеризующийся увеличением массы висцерального жира, снижением чувствительности периферических тканей к инсулину и гиперинсулинемией, которые вызывают развитие нарушений углеводного, липидного, пуринового обменов и артериальной гипертензии. Базисным критерием МС является центральный (абдоминальный) тип ожирения (объем талии более 80 см у женщин и более 94 см у мужчин) [11]. Практически у всех пациентов с МС имеется жировая дистрофия гепатоцитов, и почти у половины обнаруживается стеатогепатит, что позволяет рассматривать НАЖБП в качестве печеночного компонента МС [12–14].
• жировую дистрофию (стеатоз печени),
• жировую дистрофию с воспалением и повреждением гепатоцитов (неалкогольный или метаболический стеатогепатит – НАСГ) и фиброзом (с возможностью прогрессии с исходом в цирроз).
Первичная НАЖБП, как правило, ассоциирована с ожирением и с эндогенными нарушениями липидного и углеводного обмена. Так, НАЖБП существенно чаще выявляется у пациентов с ожирением и с нарушениями жирового и углеводного обмена: у 90% пациентов с ожирением [15] и дислипидемией [16, 17], у 3 из 5 пациентов с СД 2 [18, 19]. НАЖБП рассматривается в качестве независимого фактора риска сердечно-сосудистых заболеваний [20, 21], СД 2, хронической болезни почек и колоректального рака [14, 22].
Вторичная НАЖБП может индуцироваться внешними воздействиями и развиваться на фоне синдромов избыточного бактериального роста, мальабсорбции и мальдигестии, ряда метаболических расстройств, приема некоторых медикаментов, биологически активных добавок и медицинских изделий [23, 24].
Одним из важных патогенетических механизмов развития и прогрессирования НАЖБП и ассоциированных состояний является «кишечно-печеночная ось», представляющая собой функционально тесную двустороннюю связь между кишечной микробиотой и печенью. Повышенная кишечная проницаемость, бактериальная транслокация и изменения состава микробиоты кишечника являются важными патогенетическими элементами развития стеатоза и стеатогепатита, инициации фиброзных изменений, формирования цирроза печени и его осложнений [25, 26].
Эпидемиологические исследования последних десятилетий показывают, что НАЖБП является одним из самых распространенных гастроэнтерологических заболеваний в США и странах Западной Европы. В общей популяции взрослого населения индустриально развитых стран распространенность НАЖБП варьирует в различных эпидемиологических исследованиях в пределах 20–35% (в среднем 25%), а в некоторых этнических группах, например среди испаноязычных людей, достигает 45% [27]. Распространенность НАЖБП увеличивается с возрастом [20].
В США с 1988 по 2008 г. в рамках исследовательской программы National Health and Nutrition Examination Surveys была изучена распространенность хронических болезней печени (ХБП) [28]. За период наблюдения распространенность гепатита В, гепатита С и алкогольного гепатита практически не изменилась, а доля НАЖБП среди ХБП увеличилась с 46,8% до 75,1%. При этом параллельно росту распространенности НАЖБП отмечен рост распространенности ожирения, инсулинорезистентности, СД 2 и артериальной гипертензии.
В систематическом обзоре и метаанализе популяционных когортных исследований в базах данных
(MEDLINE, EMBASE, Кокрановская библиотека и ClinicalTrials.gov) отмечено, что СД 2 ассоциируется с более чем 2-кратным увеличением риска развития патологии печени [29].
НАСГ имеет место у 10% пациентов с НАЖБП (2–3% всех взрослых). Чаще НАСГ выявляется у женщин в возрасте 40–50 лет в 60–75% случаев [30]. По данным эпидемиологического исследования, проведенного в Великобритании, у 2% пациентов со стеатозом печени в течение 15–20 лет и у 12% пациентов с НАСГ в течение 8 лет отмечается прогрессирование НАЖБП в цирроз печени. Обследование больших групп пациентов с криптогенным циррозом печени, включавшее оценку сопутствующих заболеваний и факторов риска, позволяет предполагать, что во многих случаях (до 60–80%) цирроз печени «неясной этиологии» развивается на фоне недиагностируемого НАСГ.
В России, по данным большого эпидемиологического исследования по выявлению распространенности НАЖБП в российской популяции DIREG_L_01903 (2007 г.), включившего в себя более 30 тыс. амбулаторных пациентов врачей первого контакта, НАЖБП была зарегистрирована у 27% пациентов. Из них неалкогольный стеатоз был выявлен в 80,3%, а НАСГ и цирроз соответственно в 16,8 и 2,9% случаев. При этом о наличии данного заболевания знал лишь 1% из обследованных лиц [12, 31].
В конце 2015 г. экспертами Российской гастроэнтерологической ассоциации (РГА), Российского общества по изучению печени (РОПИП) и Национального интернет общества специалистов по внутренним болезням подведены итоги всероссийского эпидемиологического исследования распространенности неалкогольной жировой болезни печени DIREG2, проводившегося в 16 городах России в 2013–2014 гг. Участниками исследования DIREG2 стали более 50 тыс. амбулаторных пациентов. По результатам этого исследования НАЖБП выявлена у 37,3% участников. При этом отмеченный рост заболеваемости приходится в первую очередь на молодые возрастные группы трудоспособного населения в возрасте от 18 до 39 лет. К основным факторам риска развития НАЖБП отнесены: ИМТ больше
27 кг/м2, ожирение, СД, гиперхолестеринемия. Факторы риска выявлены у 92% пациентов с НАЖБП [32].
Клиника НАЖБП. Главной клинической особенностью течения НАЖБП (стеатоза и НАСГ) является малосимптомность. Симптомы НАЖБП неспецифичны и свидетельствуют лишь о самом факте поражения печени, но не коррелируют со степенью его тяжести [33–35].
Астения (общая слабость, повышенная утомляемость и пр.) является наиболее частым синдромом, выявляемым у пациентов со стеатозом и НАСГ. Выявление при осмотре пациента с НАСГ «бессимптомной» гепатомегалии может достигать по данным литературы 75% случаев. Другие, характерные для хронических заболеваний печени, симптомы у большинства пациентов чаще всего отсутствуют.
Средний возраст больных на момент диагностики НАЖБП составляет 45–50 лет. Большинство пациентов, страдающих стеатозом печени и НАСГ, имеют избыточную массу тела, на 10–40% превышающую идеальную (ИМТ>30 кг/м2). При первичной НАЖБП в клинической картине присутствуют симптомы, связанные с сопутствующими нарушениями углеводного и липидного обмена.
Частой составляющей клинической картины НАЖБП является наличие симптомокомплекса функциональных расстройств билиарного тракта (дисфункции желчного пузыря и желчевыводящих путей) – до 30% больных предъявляют жалобы на боли и дискомфорт в правом подреберье, связанные с приемом пищи [36–38].
Лабораторно-инструментальная диагностика НАЖБП. При лабораторных исследованиях возможно выявление синдромов цитолиза и холестаза [39, 40]. Синдром цитолиза при НАЖБП проявляется повышением активности сывороточной аланинаминотрансферазы (АЛТ) в 2–3 раза и аспартатаминотрансферазы (АСТ) в 2–10 раз по сравнению с нормой. Оценка соотношения АСТ/АЛТ не позволяет провести различия между алкогольным гепатитом и НАСГ. Соотношение АСТ/АЛТ, превышающее «3», обнаруживается примерно у 32% пациентов с НАСГ, свыше «1» – у 40% пациентов.
Синдром холестаза: гипербилирубинемия, в пределах 25–35 ммоль/л, имеет место в 12–17% случаев, чаще уровень сывороточного билирубина сохраняется в пределах нормы. Активность щелочной фосфатазы умеренно повышена у 40–60% пациентов. У 30–60% больных НАСГ возможно повышение активности щелочной фосфатазы и гамма-глутамилтранспептидазы (ГГТП), обычно не более чем до 2 норм.
Мезенхимально-воспалительный синдром или синдром «воспаления» не является характерным для НАСГ, однако возможно выявление гипергаммаглобулинемии у 13–30% больных, антител к ядерному антигену в титре 1:40 – 1:320 – у 40% больных, при этом антитела к гладкой мускулатуре отсутствуют.
Синдром гепатодепрессии также не характерен для НАСГ. Печеночно-клеточная недостаточность развивается лишь при формировании цирроза печени, однако гипоальбуминемия при НАСГ отмечается у больных с диабетической нефропатией [41].
У пациентов часто определяются лабораторные признаки нарушения углеводного (повышение уровня глюкозы крови или нарушенная толерантность к глюкозе) и жирового (гиперхолестеринемия и гипертриглицеридемия) обмена. Гематологические нарушения для НАСГ не характерны вплоть до развития гиперспленизма при циррозе печени.
Инструментальные методы обследования (ультразвуковое исследование – УЗИ, компьютерная томография, магнитно-резонансная томография) позволяют верифицировать гепатомегалию, косвенно оценить степень стеатоза печени и зарегистрировать формирование портальной гипертензии. Радионуклидное сканирование с коллоидом серы, меченным 99mTc, позволяет визуализировать очаговый стеатоз как дефекты накопления изотопа. С помощью методов визуализации не представляется возможным провести различия между стеатозом печени и НАСГ. Фиброгастродуоденоскопия позволяет диагностировать варикозное расширение вен пищевода при трансформации стеатогепатита в цирроз печени [23, 42].
Подтверждена высокая информативность и точность диагностики при применении магнитно-резонансной эластографии, широко метод не применяется вследствие малодоступности [43, 44]. Наиболее чувствительным, специфичным, точным, малоинвазивным и доступным методом диагностики хронических диффузных заболеваний печени признано сочетанное использование транзиентной эластометрии и эластографии сдвиговой волной [45]. При сравнительной оценке эластометрических показателей жесткости печени при алкогольном и жировом поражении печени отмечены достоверно более выраженные патологические изменения органной паренхимы при НАЖБП, чем при алкогольной болезни печени (АБП) в условиях абстиненции (от одного месяца) [46].
В реальной клинической практике НАЖБП чаще всего выявляется случайно, когда при УЗИ органов брюшной полости пациента выявляют признаки жировой дистрофии печени. К УЗ-признакам диффузного жирового поражения печени относятся:
• диффузная гиперэхогенная эхоструктура («яркая» печень);
• усиленная эхоструктура печени по сравнению с почками;
• нечеткость и сглаженность сосудистого рисунка;
• дистальное затухание (ослабление) сигнала.
В ряде случаев на фоне жировой инфильтрации могут визуализироваться участки пониженной эхогенности, соответствующие неизмененной паренхиме печени [47, 48].
Морфологическое исследование печени служит основой диагностики НАЖБП, однако без учета данных анамнеза (исключения употребления пациентом алкоголя в гепатотоксической дозе – более 20 мл этанола в сутки) по гистологической картине невозможно провести различие между алкогольным гепатитом и НАСГ.
В соответствии с рекомендациями Болонской конференции (2009 г.) биопсию печени пациентам с НАЖБП рекомендуется проводить в следующих случаях: наличие мотивации пациента; наличие СД 2; абдоминального (андроидного) ожирения; тромбоцитопении 140×109/л и менее; инсулинорезистентности; любых косвенных признаках цирроза [49]. В тех случаях, когда уровень сывороточных аминотрансфераз в норме, биопсия печени не показана.
Лабораторные тесты крови – ФиброТест и ФиброМетр V могут быть использованы для неинвазивной оценки стадий фиброза печени. ФиброТест (компонент диагностической панели Фибро-АктиТест и ФиброМакс) включает 5 не коррелирующих между собой биохимических показателей: ГГТП, альфа-2-макроглобулин, гаптоглобин, аполипопротеин А1 и общий билирубин, которые позволяют оценивать выраженность фиброза посредством дискриминантной функции. С помощью данного теста можно дифференцировать фиброз (Fl-F3) от цирроза печени (F4).
ФиброМетр V (компонент диагностической панели ФиброМетр) включает 5 показателей биохимического и клинического анализов крови: ГГТП, альфа-2-макроглобулин, протромбиновый индекс (%), мочевина, тромбоциты, позволяющие оценивать выраженность фиброза с помощью дискриминантной функции. ФиброМетр V позволяет дифференцировать умеренный фиброз (Fl-F2) от выраженного фиброза (F3) и от цирроза печени (F4).
Для выявления групп риска стеатоза печени рекомендуется рассчитать индекс стеатоза (St-index), как неинвазивный скрининговый метод оценки риска стеатоза печени, разработанный российскими учеными на основе данных исследования DIREG2. Для расчета величины индекса необходимы следующие данные о пациенте: возраст (количество полных лет), СД 2 – есть (1)/нет (0), соотношение талии (Т, см) к росту (Р, см) (Т/Р=…). Расчетная формула: Y (индекс стеатоза или
St-index)=-3,5856+0,0141×возраст+0,4711×СД2+ 4×4373×Т/Р. Значения: Y>0,405, риск стеатоза высокий (специфичность индекса составляет 91,4%) [25, 50].
При подозрении на НАЖБП рекомендуется оценка наличия и выраженности инсулинорезистентности. Наиболее часто применяемым методом оценки инсулинорезистентности является расчет индекса HOMA-IR (HOmeostasis Model Assesment) по формуле: HOMA-IR= I0×G0/22,5, где I0 – уровень инсулина натощак (мкМЕ/мл), G0 – уровень глюкозы натощак (ммоль/л). Значение HOMA-IR: у здоровых лиц – менее 2,5; при нарушении толерантности к глюкозе, СД 2 – более 4. Значимую диагностическую ценность при НАЖБП имеет увеличение индекса HOMA-IR более 5.
Для выявления групп высокого риска прогрессирования НАСГ с фиброзом используется ряд формул, основанных на простейших и доступных для определения в рутинной практике показателей (ИМТ, пол, наличие толерантности к глюкозе или СД, скрининговые сывороточные показатели). Наибольшую популярность в мире получили шкала NFS (Nonalcoholic Fatty Liver Disease Fibrosis Score), индекс FIB-4 (Fibrosis-4), шкала HAIR (англ. Hypertension, ALT and Insulin Resistance), индекс стеатоза печени FLI (англ. Fatty Liver Index), шкала BARD (англ. BMI, AST/ALT Ratio, and Diabetes Score), шкала BAAT (British Association of Art Therapists), индекс APRI (AST to Platelet Ratio Index), шкала CDS (англ. Cirrhosis Discriminant Score), шкала ELF (англ. European Liver Fibrosis Test) [25].
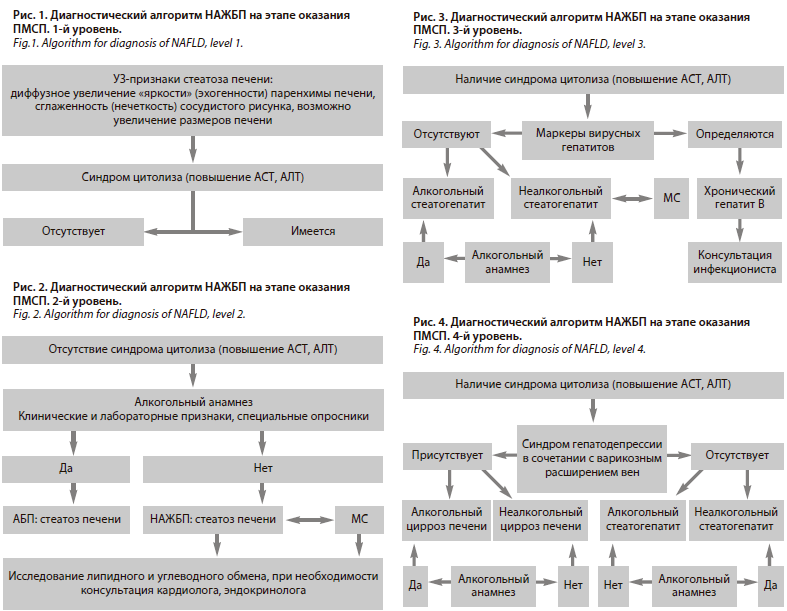
Диагностический алгоритм НАЖБП. В условиях реальной клинической практики диагностический алгоритм НАЖБП на этапе оказания ПМСП [23] можно разделить на 4 последовательных диагностических уровня (рис. 1–4).
Часто именно пациент ставит перед врачом-терапевтом или врачом общей практики вопрос о диагностике НАЖБП, после проведенного УЗИ органов брюшной полости и соответствующего описания: диффузное увеличение «яркости» (эхогенности) паренхимы печени, сглаженность (нечеткость) сосудистого рисунка и возможного умеренного увеличения размеров печени по данным УЗИ (рис. 1).
В ходе диагностического процесса на этапе оказания ПМСП важно не ограничиваться констатацией факта наличия у пациента признаков стеатоза печени и
умеренной гепатомегалии, а продолжить обследование с целью исключения активности воспалительного процесса путем определения концентрации сывороточных трансаминаз (АЛТ и АСТ), поскольку у каждого десятого пациента с УЗ-признаками стеатоза имеется синдром цитолиза (рис. 2).
При наличии синдрома цитолиза необходимо исключить наличие вирусного гепатита. В случае обнаружения острого или хронического вирусного поражения печени, дальнейшее ведение больного осуществляется в соответствии с рекомендациями врача инфекциониста (рис. 3).
При отсутствии маркеров вирусов гепатита в сыворотке крови синдром цитолиза позволяет предполагать возможное наличие у больного стеатогепатита, этиологическими факторами развития которого, кроме НАЖБП, может быть злоупотребление пациентом алкоголем и его суррогатами.
Наличие у больного НАЖБП синдрома гепатодепрессии в сочетании с варикозным расширением вен пищевода предполагает активное выявление врачом цирротической трансформации печени. Ведение больного с НАЖБП на стадии цирроза проводится врачом общей практики в соответствии с рекомендациями гастроэнтеролога или гепатолога (рис. 4).
Наиболее сложный вопрос на 2–4-м уровнях диагностического алгоритма – проведение дифференциальной диагностики между НАЖБП и АБП.
НАЖБП и АБП являются наиболее частыми хроническими заболеваниями печени, а их запущенные формы – НАСГ и алкогольный стеатогепатит – наиболее частые состояния, приводящие к циррозу печени и гепатоцеллюлярной карциноме во всем мире [51]. В патогенезе НАЖБП и АБП прослеживается патогенетическая общность: активация перекисного окисления липидов, окислительный стресс, поражение фосфолипидов мембран митохондрий, нарушение системного и клеточного звеньев липидного обмена. Данный факт объясняет сложности в процессе дифференциальной диагностики, поскольку данные основных объективных,
лабораторных и инструментальных методов дают сходные результаты, не позволяя часто достоверно высказаться об этиологии процесса [52, 53]. Диагноз «НАЖБП» на текущий момент представляется диагнозом исключения [46].
Даже если пациент не употребляет гепатоксические дозы алкоголя (субъективная информация, исходящая от пациента), то необходимо учитывать, что содержание энергии в 1 грамме алкоголя составляет 29 кДж или 7,1 ккал, и употребление алкоголя может способствовать увеличению массы тела [54]. Эпидемиологические исследования предполагают наличие причинной связи между хроническим потреблением алкоголя, даже в умеренных и не гепатотоксических дозах, и прогрессирующим заболеванием печени у лиц с ожирением [55].
Данные экспериментальных исследований указывают на комбинированное патологическое воздействие алкоголя и ожирения на накопление и повреждение гепатоцеллюлярных липидов, а также на воспаление, фиброз и канцерогенез печени [51, 55]. Примечательно, что эти комбинированные патологические эффекты не только являются аддитивными, но даже синергичными. Представляется важным, что алкоголь даже в умеренных дозах, не относящихся к гепатотоксичным, проявляет синергетические патологические эффекты с ожирением, что предполагает значительные различия в пороговой дозе гепатотоксического воздействия алкоголя у худых и страдающих ожирением субъектов, а также имеет важное значение для рекомендаций по «безопасному» потреблению алкоголя [51].
В реальной клинической практике активное выявление лиц, злоупотребляющих спиртными напитками, с поражением печени на фоне хронической алкогольной интоксикации осуществляется по клиническим (одутловатость лица, расширение капиллярной сети на коже лица, увеличение околоушных слюнных желез, гинекомастия, тремор пальцев рук, контрактура Дюпюитрена, «мраморность» кожных покровов, повышенная потливость, раздражительность) и лабораторным критериям. К традиционным, доступным в реальной клинической практике, относятся: соотношение АСТ/АЛТ более 1, увеличение ГГТП и иммуноглобулина А в сыворотке крови. К дополнительным, проведение которых не всегда возможно в реальной клинической практике, относятся – определение в сыворотке крови содержания трансферрина (углероддефицитного) – CDT, гомологов фосфатазы и тензина (PTEN), уровня фосфатидилэтанола и оценка электрических и вязкоупругих параметров эритроцитов.
Используются и специально разработанные опросники (MAST, CAGE, AUDIT, «Здоровье и образ жизни» и др.), однако они предполагают объективные, «честные» ответы на вопросы.
Лечение. Из представленных выше эпидемиологических данных вытекает важный практический вывод: каждый 3–4-й пациент, посещающий врача-терапевта и врача общей практики в поликлиниках России, нуждается в профилактическом лечении стеатоза печени [12, 32].
Патогенетически обоснованными в лечении НАЖБП, связанной с ожирением, являются мероприятия, направленные на модификацию образа жизни, которые включают рациональное питание и регулярные дозированные физические нагрузки.
Общепринятой схемы медикаментозной терапии НАЖБП в настоящее время нет. Однако это не исключает возможность использования лекарственных препаратов в дополнение к рекомендациям по диете и режиму. Лечебные мероприятия при НАЖБП целесообразно проводить как можно ранее, на стадии стеатоза. Большинству пациентов с НАЖБП, связанной с ожирением, показана терапия, сочетающая в себе стабилизацию мембран гепатоцитов, антиоксидантную защиту, иммуномодуляцию, обеспечивающую противовоспалительную активность, а также направленная на купирование проявлений дисфункции желчевыводящих путей [56, 57]. С этой целью в российских и международных обзорах, исследованиях и рекомендациях обосновывается применение в комплексной терапии НАЖБП различных гепатопротекторов.
НАЖБП и новая коронавирусная инфекция COVID-19. Пандемия новой коронавирусной инфекции (COVID-19), распространяемая вирусом SARS-CoV-2, стала вызовом системам здравоохранения всех стран мира. В национальном консенсусе «Особенности ведения коморбидных пациентов в период пандемии новой коронавирусной инфекции (COVID-19)» [58] отмечается, что пациенты с НАЖБП или НАСГ, как правило, имеют сопутствующие метаболические заболевания, такие как СД, артериальная гипертензия и ожирение, а также вынуждены принимать большое количество потенциально гепатотоксичных препаратов, что относит их к группе повышенного риска заражения SARS-CoV-2, а также – тяжелого течения этой инфекции. Это позволяет рассматривать НАЖБП столь же опасной в плане тяжелого течения COVID-19, как вирусные гепатиты, аутоиммунный гепатит и фиброз/цирроз печени.
У пациентов без СД с COVID-19 наличие НАЖБП ассоциируется с 4-кратным повышением риска развития тяжелого течения COVID-19 [59–62]. При этом вероятность осложнений инфекции COVID-19 повышается с увеличением числа метаболических факторов риска [63–65]. Важным моментом является сохранение ассоциации с тяжестью течения COVID-19 и после проведенной коррекции с учетом возраста, пола и сопутствующих патологических состояний [61, 63]. В этой связи, пациенты с НАЖБП в период пандемии COVID-19 нуждаются в особом внимании врачей и контроле над течением заболевания, прежде всего снижении уровня повреждения печени (степени выраженности стеатоза и фиброза) и нормализации печеночных трансаминаз [58, 62, 66].
Приведем наше клиническое наблюдение [67] с рядом уточнений. Пациент С., 55 лет на момент обращения, в течение последних трех лет отмечал общую слабость. В конце августа появился выраженный болевой синдром в поясничной области позвоночника, усиливающийся при движении и подъеме тяжестей.
Anamnesis vitae: курение в течение 40 лет по 1–2 пачки в день, в течение нескольких лет отмечались повышенные цифры артериального давления с максимальным повышением до 190/100 мм рт. ст., антигипертензивные препараты не принимал, в течение последних 5 лет периодически беспокоили неприятные ощущения в области правого подреберья, при УЗИ органов брюшной полости, проведенном 2 года назад, отмечено умеренное увеличение размеров печени, диффузное увеличение «яркости» (эхогенности) паренхимы печени, сглаженность (нечеткость) сосудистого рисунка. Масса тела – 112 кг, рост – 176 см (ИМТ – 36 кг/м2). Работает охранником (суточные дежурства 1 раз в 4 дня), проживает один. После работы обязательно от «стресса» выпивает 1–2 бутылки пива по 0,5 л. В остальном медицинский и хирургический анамнез без особенностей. Диагностирована люмбалгия, назначено лечение нестероидным противовоспалительным препаратом – болевой синдром уменьшился. В первых числах сентября выполнена крупнокадровая флюорография органов грудной клетки и общий анализ крови, не выявившие отклонений.
В конце сентября болевой синдром стал беспокоить в покое, в ночное время суток и распространялся на нижние конечности, параллельно стала нарастать общая слабость и появились затруднения при выполнении движений (ходьба, вставание). После исключения острой неврологической и хирургической патологии был сформулирован клинический диагноз: «Атеросклеротическая болезнь с преимущественным поражением сосудов нижних конечностей, ишемия 3А стадии. Артериальная гипертензия II стадии, риск III. Хроническая сердечная недостаточность I стадии, функциональный класс 1. Ожирение II стадии. НАЖБП» и 18 октября пациент был направлен в хирургическое отделение многопрофильного стационара. Объективное исследование при поступлении не выявило значимых отклонений от нормы. В стационаре неоднократно проводился общий анализ крови, который впервые выявил лейкоцитоз до 18×109 г/л и ускорение СОЭ до 48 мм/ч, биохимическое исследование крови: АЛТ – 56 U/l, АСТ – 45 U/l. общий анализ мочи, электрокардиография, ультразвуковое исследование брюшной полости – без патологии. Глюкоза крови натощак при многократном определении в диапазоне 10,7–7,25 ммоль/л, гликозилированный гемоглобин – 6,0%. При дуплексном сканировании магистральных артерий нижних конечностей выявлены: атеросклероз магистральных артерий нижних конечностей с преобладанием гемодинамически значимыми препятствиями кровотоку по артериям левой нижней конечности, окклюзия левой поверхностной бедренной артерии при входе в Гунтеров канал. Пациенту проводилось лечение антигипертензивными препаратами, статинами, дезагрегантами (клопидогрель, ацетилсалициловая кислота), витаминами группы B, сосудистыми препаратами (реополиглюкин, пентоксифиллин), непрямыми антикоагулянтами. На фоне терапии была отмечена положительная динамика болевого и астенического синдрома, но были зарегистрированы несколько эпизодов повышения температуры тела до 38,0° С, кашель с небольшим количеством мокроты, одышка. Эти симптомы были интерпретированы как проявление хронического бронхита, связанного с длительным стажем табакокурения.
Спустя неделю после выписки из многопрофильного стационара вновь отмечено прогрессирование болевого и астенического синдромов. В ноябре пациент консультирован сосудистым хирургом и направлен для диагностики и планового лечения в отделение сосудистой хирургии областной клинической больницы, в которое поступил 10 декабря.
При объективном осмотре 10 декабря: состояние удовлетворительное, сознание ясное. Питание избыточное: масса тела – 100 кг (при этом, впервые было обращено внимание, что за последние 3 года без приложения каких-либо усилий похудел со 125 кг до 100 кг), рост – 176 см, ИМТ – 32 кг/м2. Периферические и региональные лимфатические узлы, щитовидная железа и суставы не изменены. Кожный покров бледно-розового цвета. Грудная клетка правильной формы, при перкуссии определялся легочный звук, в нижних отделах легких – притупление перкуторного звука, дыхание жесткое, выслушивались влажные хрипы в средних и нижних отделах легких. Частота дыхательных движений – 16 в мин. Тоны сердца приглушены, ритмичные, акцент II тона на аорте. Артериальное давление – 160/100 мм рт. ст., пульс – 80 в минуту. Язык влажный, чистый. Живот правильной формы, увеличен за счет подкожно-жирового слоя. При пальпации мягкий, безболезненный, симптом Щеткина–Блюмберга не определялся. Печень у края реберной дуги. Почки не пальпировались. Симптом поколачивания отрицательный. Пастозность нижних конечностей.
Status localis: кожный покров нижних конечностей с обеих сторон бледной окраски, пульсация на левой бедренной артерии – ослаблена на всем протяжении, на правой конечности сохранена и определялась на a. dorsalis pedis.
Врач приемного отделения обратил внимание на наличие выраженного астенического синдрома и влажных хрипов в легких, снижение массы тела пациента за последние 3 года. Изменения в общем анализе крови (лейкоцитоз, ускорение СОЭ), также не укладывались в диагноз атеросклеротического поражения бедренных артерий. Были назначены: фиброгастродуоденоскопия, выявившая ulcus tumor (?) в желудке, эрозивный гастрит, бульбит; УЗИ брюшной полости: признаки гепатомегалии, диффузные изменения в печени, множественные очаговые образования печени (трактовавшиеся как метастатическое поражение). Рентгенографическое исследование органов грудной клетки – диффузная с обеих сторон мелкоочаговая (лимфогенная) диссеминация больше справа и очаговые тени до 20 мм в диаметре, локальное затемнение паракостальных отделов правого легкого на уровне четвертого межреберья толщиной до 18 мм, протяженность 30 мм. Заключение: метастатическое поражение легких.
Через 3 дня пациент выписан из стационара с диагнозом: «Атеросклеротическая болезнь с преимущественным поражением бедренных артерий. Окклюзия левой бедренной артерии, стадия II Б. Язва – рак желудка?». Ввиду подозрения на онкологическое заболевание в проведении ангиографического исследования было отказано. 16 декабря амбулаторно консультирован онкологом и на основании данных обследования выставлен диагноз: Рак желудка.
19 декабря пациент умирает. При патологоанатомическом осмотре: кожа – желтушного цвета, в легочной ткани – множественные округлой формы узлы в диаметре от 0,5×1 см, 1,5×2 см, белесовато-серого цвета (метастазы), на разрезе выделялось мутное гнойное содержимое. Внутренняя оболочка аорты, бедренных, подвздошных артерий умеренно покрыты атероматозными бляшками. В желудке пусто, слизистая оболочка белесоватая, складчатая, определяется дефект слизистой 1×1 см. Печень была бугристая, с множественными участками разрастания опухолевой ткани в виде узлов (до 2,5 см) с нечеткими границами, размером 30×19×14×8 см, плотной консистенции, белесоватого цвета. Гистологическое исследование – злокачественное новообразование желчных протоков печени, внутрипеченочная холангиокарцинома (М 8160/3). Очаговая серозно-гнойная пневмония, метастазы в легких. Патологоанатомический диагноз: «Злокачественное образование желчных протоков печени (гистологический диагноз – внутрипеченочная холангиокарцинома (М 8160/3) с метастазами в легкие. Серозная двухсторонняя параканкрозная пневмония. Дистрофические изменения внутренних органов».
Данный клинический пример иллюстрирует сложность ранней диагностики внутрипеченочной холангиокарциномы у пациента с НАЖБП и другими метаболическими факторами риска. Клинические проявления опухоли данной локализации неспецифичны, наиболее частые симптомы на операбельной стадии – похудение, недомогание, усталость, «ночная потливость», а основные синдромы – болевой и желтушный [68, 69]. В нашем клиническом наблюдении у пациента желтуха была отмечена только при патологоанатомическом исследовании, при клинической манифестации преобладали астенический синдром и неспецифические симптомы опухолевой прогрессии, в сочетании с болевым синдромом в поясничном отделе позвоночника, который вероятнее всего был проявлением паранеопластического синдрома [70]. Наличие коморбидного заболевания – атеросклеротической болезни с преимущественным поражением бедренных артерий – проявляющегося болевым синдромом сходной локализации, привело к поздней диагностики холангиокарциномы у данного пациента.
Конфликт интересов. Автор заявляет об отсутствии конфликта интересов.
Conflict of interests. The author declares that there is not conflict of interests.
Информация об авторах / Information about the authors
Трухан Дмитрий Иванович – д-р мед. наук, доцент, проф. каф. поликлинической терапии и внутренних болезней, ФГБОУ ВО «Омский ГМУ». E-mail: dmitry_trukhan@mail.ru; ORCID 0000-0002-1597-1876
Dmitry I. Trukhan – D. Sci. (Med.), Assoc. Prof., Prof. of the Chair of Polyclinic therapy and internal diseases, Omsk State Medical University. E-mail: dmitry_trukhan@mail.ru; ORCID 0000-0002-1597-1876
Статья поступила в редакцию / The article received: 05.10.2020
Статья принята к печати / The article approved for publication: 27.05.2021
Клинический разбор в общей медицине №04 2021
Неалкогольная жировая болезнь печени: актуальные аспекты диагностики в реальной клинической практике
Номера страниц в выпуске:40-50
Аннотация
В диагностике и последующей курации пациентов с неалкогольной жировой болезнью печени (НАЖБП) и ожирением в реальной клинической практике возрастает роль и значение врача первого контакта (терапевта и врача общей практики). НАЖБП в настоящее время рассматривается в качестве печеночного компонента метаболического синдрома. Представлен диагностический алгоритм НАЖБП на этапе оказания первичной медико-санитарной помощи. Наиболее сложный вопрос на 2–4-м уровнях диагностического алгоритма – проведение дифференциальной диагностики между НАЖБП и алкогольной болезнью печени. В период пандемии новой коронавирусной инфекции (COVID-19) пациентов с НАЖБП или неалкогольным стеатогепатитом, как правило, имеющих сопутствующие метаболические заболевания, такие как сахарный диабет, артериальная гипертензия и ожирение, и вынужденных принимать большое количество потенциально гепатотоксичных препаратов, целесообразно относить к группе повышенного риска заражения SARS-CoV-2 и тяжелого течения этой инфекции. Это позволяет рассматривать НАЖБП столь же опасной в плане тяжелого течения COVID-19, как и вирусные гепатиты, аутоиммунный гепатит и фиброз/цирроз печени. Известно, что НАЖБП является независимым предиктором не только высоких сердечно-сосудистых рисков, но и гепатоцеллюлярной карциномы и злокачественных новообразований различной локализации, а также целого ряда других коморбидных состояний. В заключение обзора приводится клиническое наблюдение, иллюстрирующее сложность ранней диагностики внутрипеченочной холангиокарциномы у пациента с НАЖБП и другими метаболическими факторами риска.
Ключевые слова: неалкогольная жировая болезнь печени, ожирение, метаболический синдром, алкогольная болезнь печени, диагностика.
Для цитирования: Трухан Д.И. Неалкогольная жировая болезнь печени: актуальные аспекты диагностики в реальной клинической практике. Клинический разбор в общей медицине. 2021; 4: 40–50. DOI: 10.47407/kr2021.2.4.00059
В диагностике и последующей курации пациентов с неалкогольной жировой болезнью печени (НАЖБП) и ожирением в реальной клинической практике возрастает роль и значение врача первого контакта (терапевта и врача общей практики). НАЖБП в настоящее время рассматривается в качестве печеночного компонента метаболического синдрома. Представлен диагностический алгоритм НАЖБП на этапе оказания первичной медико-санитарной помощи. Наиболее сложный вопрос на 2–4-м уровнях диагностического алгоритма – проведение дифференциальной диагностики между НАЖБП и алкогольной болезнью печени. В период пандемии новой коронавирусной инфекции (COVID-19) пациентов с НАЖБП или неалкогольным стеатогепатитом, как правило, имеющих сопутствующие метаболические заболевания, такие как сахарный диабет, артериальная гипертензия и ожирение, и вынужденных принимать большое количество потенциально гепатотоксичных препаратов, целесообразно относить к группе повышенного риска заражения SARS-CoV-2 и тяжелого течения этой инфекции. Это позволяет рассматривать НАЖБП столь же опасной в плане тяжелого течения COVID-19, как и вирусные гепатиты, аутоиммунный гепатит и фиброз/цирроз печени. Известно, что НАЖБП является независимым предиктором не только высоких сердечно-сосудистых рисков, но и гепатоцеллюлярной карциномы и злокачественных новообразований различной локализации, а также целого ряда других коморбидных состояний. В заключение обзора приводится клиническое наблюдение, иллюстрирующее сложность ранней диагностики внутрипеченочной холангиокарциномы у пациента с НАЖБП и другими метаболическими факторами риска.
Ключевые слова: неалкогольная жировая болезнь печени, ожирение, метаболический синдром, алкогольная болезнь печени, диагностика.
Для цитирования: Трухан Д.И. Неалкогольная жировая болезнь печени: актуальные аспекты диагностики в реальной клинической практике. Клинический разбор в общей медицине. 2021; 4: 40–50. DOI: 10.47407/kr2021.2.4.00059
Non-alcoholic fatty liver disease: current aspects of diagnosis in real clinical practice
Dmitry I. TrukhanOmsk State Medical University, Omsk, Russia
dmitry_trukhan@mail.ru
Abstract
In the diagnosis and subsequent supervision of patients with non-alcoholic fatty liver disease (NAFLD) and obesity in real clinical practice, the role and importance of the doctor of first contact (therapist and general practitioner) increases. Non-alcoholic fatty liver disease is currently considered as the hepatic component of metabolic syndrome. A diagnostic algorithm for NAFLD at the stage of primary health care is presented. The most difficult question at 2–4 levels of the diagnostic algorithm is the differential diagnosis between NAFLD and alcoholic liver disease. During a pandemic of a novel coronavirus infection (COVID-19), patients with NAFLD or NASH, as a rule, have concomitant metabolic diseases such as diabetes mellitus, arterial hypertension and obesity, and also have to take a large number of potentially hepatotoxic drugs, it is advisable to classify them as elevated risk of infection with SARS-CoV-2, and the severe course of this infection. This allows us to consider NAFLD as dangerous in terms of the severe course of COVID-19, as viral hepatitis, autoimmune hepatitis and liver fibrosis / cirrhosis. It is known that NAFLD is an independent predictor of not only high cardiovascular risks, but also hepatocellular carcinoma and malignant neoplasms of various localization, as well as a number of other comorbid conditions. The review concludes with a clinical observation illustrating the difficulty of early diagnosis of intrahepatic cholangiocarcinoma in a patient with NAFLD and other metabolic risk factors.
Key words: non-alcoholic fatty liver disease, obesity, metabolic syndrome, alcoholic liver disease, diagnostics.
For citation: Trukhan D.I. Non-alcoholic fatty liver disease: current aspects of diagnosis in real clinical practice. Clinical review for general practice. 2021; 4: 40–50. DOI: 10.47407/kr2021.2.4.00059
На сегодняшний день основой системы оказания медицинской помощи является первичная медико-санитарная помощь (ПМСП). Взрослому населению ПМСП оказывается врачами первого контакта – терапевтами, участковыми терапевтами и врачами общей практики (семейными врачами). Переход к организации ПМСП по принципу семейного врача (врача общей практики) предполагает значительное расширение функций, выполняемых врачом первого контакта. Важным направлением работы в общетерапевтической практике остается профилактика заболеваний.
Ожирение и метаболический синдром
Последние десятилетия ознаменовались существенным ростом распространенности заболеваний, ассоциированных с изменением характера питания и образа жизни населения. На официальном сайте Всемирной организации здравоохранения (ВОЗ) указано, что в 2014 г. в мире более 1,9 млрд взрослых имеют избыточную массу тела, а более 600 млн страдают ожирением [1]. Схожие данные представлены в международном системном метаанализе (1769 отчетов, опросов, исследований) распространенности избыточной массы тела и ожирения за 33 года (период 1980–2013 гг.), наглядно демонстрирующие увеличение в мире доли взрослых и детей с индексом массы тела (ИМТ) 25 кг/м2 и более.К настоящему времени свыше 1/3 взрослых в мире имеют избыточную массу тела – 36,9% мужчин и 38% женщин, а каждый 10-й страдает ожирением (ИМТ – 30 кг/м2 и более) [2].
Широкая распространенность ожирения способствовала появлению в медицинской литературе термина «globesity», подчеркивающего глобальность и значимость данного явления [2]. В нашей стране распространенность избыточной массы тела составляет 59,2%, а непосредственно ожирения – 24,1%, в США – 67,4 и 33,3%, в Великобритании – 63,6 и 25,8% соответственно [2].
Параллельно с увеличением числа лиц с ожирением и избыточной массой тела наблюдается существенный рост сахарного диабета (СД) и сердечно-сосудистых заболеваний, а среди заболеваний органов пищеварения – неалкогольной жировой болезни печени (НАЖБП) и гастроэзофагеальной рефлюксной болезни. В соответствии с данными ВОЗ [1], избыточная масса тела и ожирение предопределяют развитие до 44% всех случаев СД 2-го типа (СД 2), до 23% случаев ишемической болезни сердца. В большинстве европейских стран, по данным EASO (European Association for the Study of Obesity), следствием ожирения среди взрослого населения являются 80% случаев СД 2, 35% – ишемической болезни сердца, 55% – артериальной гипертензии [3].
Ожирение стало чрезвычайно дорогостоящей проблемой здравоохранения и с точки зрения экономики, и с точки зрения индивидуального и общественного здоровья, долголетия и психологического благополучия [1, 4, 5]. На сегодняшний день ожирение не считается только эстетической проблемой, вызванной перееданием и отсутствием самоконтроля. Национальные/международные медицинские/научные общества рекомендуют рассматривать ожирение как хроническое прогрессирующее заболевание, обусловленное избыточным накоплением жировой ткани, в результате многочисленных экологических и генетических факторов – «adiposity-based chronic disease (ABCD)» [6]. Так, в соответствии с определением ASMBS (American Society for Metabolic and Bariatric Surgery), ожирение – хроническое рецидивирующее многофакторное нейроповеденческое заболевание, при котором увеличение жира в организме способствует дисфункции жировой ткани и биомеханическому воздействию жировой ткани на окружающие ткани с развитием метаболических и психосоциальных последствий для здоровья [7].
По характеру распределения жира выделяют 2 основных типа ожирения: абдоминальное и глютеофеморальное. При абдоминальном типе основная масса жира расположена в брюшной полости, на передней брюшной стенке, туловище, шее и лице (андроидный или мужской тип ожирения). При глютеофеморальном типе отмечается преимущественное отложение жира на бедрах и ягодицах (гиноидный или женский тип ожирения). При смешанном типе отмечается равномерное распределение жировых отложений во всем организме человека.
 В 1950 г. ожирение было включено ВОЗ в Международную классификацию болезней, а в качестве основного критерия диагностики стал рассматриваться ИМТ (табл. 1). В настоящее время количественная оценка ожирения на основе ИМТ по-прежнему широко используется, поскольку является простым, легко воспроизводимым, надежным скрининговым критерием для оценки нормальной, избыточной массы тела и ожирения.
В 1950 г. ожирение было включено ВОЗ в Международную классификацию болезней, а в качестве основного критерия диагностики стал рассматриваться ИМТ (табл. 1). В настоящее время количественная оценка ожирения на основе ИМТ по-прежнему широко используется, поскольку является простым, легко воспроизводимым, надежным скрининговым критерием для оценки нормальной, избыточной массы тела и ожирения.В то же время исследования последнего десятилетия демонстрируют, что ИМТ не является достаточным критерием для прогнозирования развития и течения всех заболеваний/состояний, ассоциированных с ожирением и избытком массы тела. Так, в ряде проспективных исследований по оценке влияния избыточного ИМТ и ожирения на показатели смертности получены неоднозначные результаты, в частности, свидетельствующие о лучшей выживаемости пациентов с избыточным ИМТ и небольшим ожирением по сравнению с нормальным и сниженным ИМТ.
В настоящее время активно обсуждается вопрос поиска дополнительных критериев оценки имеющегося у пациента ожирения. Так, алгоритм диагностики ожирения [8], предложенный в рекомендациях ААСЕ/АСЕ (American Association of Clinical Endocrinologists / American College of Endocrinology) 2014 г., включает в себя два компонента: а) оценку ИМТ с коррекцией на этнические особенности для выявления лиц с повышенным количеством жировой ткани и б) оценку значения ожирения на основе наличия или отсутствия связанных с ожирением состояний, заболеваний или осложнений (табл. 2).

К ассоциированным с ожирением состояниям и заболеваниям относятся: метаболический синдром (МС), нарушенная толерантность к глюкозе, СД 2, дислипидемия, артериальная гипертензия, НАЖБП, гастроэзофагеальная рефлюксная болезнь, ночное апноэ, бронхиальная астма, остеоартроз, затруднение/неспособность активно двигаться, синдром поликистозных яичников, стрессовое и ургентное недержание мочи, психологические расстройства/стигматизация [8].
Данная классификация формирует переход от оценки ожирения на основе ИМТ (ИМТ-ориентированный подход) к оценке ожирения на основе наличия или отсутствия связанных с ожирением заболеваний или болезненных состояний («подход, ориентированный на осложнения») [9, 10].
Одним из наиболее часто ассоциированных с ожирением патологических состояний является МС, характеризующийся увеличением массы висцерального жира, снижением чувствительности периферических тканей к инсулину и гиперинсулинемией, которые вызывают развитие нарушений углеводного, липидного, пуринового обменов и артериальной гипертензии. Базисным критерием МС является центральный (абдоминальный) тип ожирения (объем талии более 80 см у женщин и более 94 см у мужчин) [11]. Практически у всех пациентов с МС имеется жировая дистрофия гепатоцитов, и почти у половины обнаруживается стеатогепатит, что позволяет рассматривать НАЖБП в качестве печеночного компонента МС [12–14].
Неалкогольная жировая болезнь печени
В настоящее время понятие НАЖБП четко очерчено и охватывает спектр поражений печени, включающий:• жировую дистрофию (стеатоз печени),
• жировую дистрофию с воспалением и повреждением гепатоцитов (неалкогольный или метаболический стеатогепатит – НАСГ) и фиброзом (с возможностью прогрессии с исходом в цирроз).
Первичная НАЖБП, как правило, ассоциирована с ожирением и с эндогенными нарушениями липидного и углеводного обмена. Так, НАЖБП существенно чаще выявляется у пациентов с ожирением и с нарушениями жирового и углеводного обмена: у 90% пациентов с ожирением [15] и дислипидемией [16, 17], у 3 из 5 пациентов с СД 2 [18, 19]. НАЖБП рассматривается в качестве независимого фактора риска сердечно-сосудистых заболеваний [20, 21], СД 2, хронической болезни почек и колоректального рака [14, 22].
Вторичная НАЖБП может индуцироваться внешними воздействиями и развиваться на фоне синдромов избыточного бактериального роста, мальабсорбции и мальдигестии, ряда метаболических расстройств, приема некоторых медикаментов, биологически активных добавок и медицинских изделий [23, 24].
Одним из важных патогенетических механизмов развития и прогрессирования НАЖБП и ассоциированных состояний является «кишечно-печеночная ось», представляющая собой функционально тесную двустороннюю связь между кишечной микробиотой и печенью. Повышенная кишечная проницаемость, бактериальная транслокация и изменения состава микробиоты кишечника являются важными патогенетическими элементами развития стеатоза и стеатогепатита, инициации фиброзных изменений, формирования цирроза печени и его осложнений [25, 26].
Эпидемиологические исследования последних десятилетий показывают, что НАЖБП является одним из самых распространенных гастроэнтерологических заболеваний в США и странах Западной Европы. В общей популяции взрослого населения индустриально развитых стран распространенность НАЖБП варьирует в различных эпидемиологических исследованиях в пределах 20–35% (в среднем 25%), а в некоторых этнических группах, например среди испаноязычных людей, достигает 45% [27]. Распространенность НАЖБП увеличивается с возрастом [20].
В США с 1988 по 2008 г. в рамках исследовательской программы National Health and Nutrition Examination Surveys была изучена распространенность хронических болезней печени (ХБП) [28]. За период наблюдения распространенность гепатита В, гепатита С и алкогольного гепатита практически не изменилась, а доля НАЖБП среди ХБП увеличилась с 46,8% до 75,1%. При этом параллельно росту распространенности НАЖБП отмечен рост распространенности ожирения, инсулинорезистентности, СД 2 и артериальной гипертензии.
В систематическом обзоре и метаанализе популяционных когортных исследований в базах данных
(MEDLINE, EMBASE, Кокрановская библиотека и ClinicalTrials.gov) отмечено, что СД 2 ассоциируется с более чем 2-кратным увеличением риска развития патологии печени [29].
НАСГ имеет место у 10% пациентов с НАЖБП (2–3% всех взрослых). Чаще НАСГ выявляется у женщин в возрасте 40–50 лет в 60–75% случаев [30]. По данным эпидемиологического исследования, проведенного в Великобритании, у 2% пациентов со стеатозом печени в течение 15–20 лет и у 12% пациентов с НАСГ в течение 8 лет отмечается прогрессирование НАЖБП в цирроз печени. Обследование больших групп пациентов с криптогенным циррозом печени, включавшее оценку сопутствующих заболеваний и факторов риска, позволяет предполагать, что во многих случаях (до 60–80%) цирроз печени «неясной этиологии» развивается на фоне недиагностируемого НАСГ.
В России, по данным большого эпидемиологического исследования по выявлению распространенности НАЖБП в российской популяции DIREG_L_01903 (2007 г.), включившего в себя более 30 тыс. амбулаторных пациентов врачей первого контакта, НАЖБП была зарегистрирована у 27% пациентов. Из них неалкогольный стеатоз был выявлен в 80,3%, а НАСГ и цирроз соответственно в 16,8 и 2,9% случаев. При этом о наличии данного заболевания знал лишь 1% из обследованных лиц [12, 31].
В конце 2015 г. экспертами Российской гастроэнтерологической ассоциации (РГА), Российского общества по изучению печени (РОПИП) и Национального интернет общества специалистов по внутренним болезням подведены итоги всероссийского эпидемиологического исследования распространенности неалкогольной жировой болезни печени DIREG2, проводившегося в 16 городах России в 2013–2014 гг. Участниками исследования DIREG2 стали более 50 тыс. амбулаторных пациентов. По результатам этого исследования НАЖБП выявлена у 37,3% участников. При этом отмеченный рост заболеваемости приходится в первую очередь на молодые возрастные группы трудоспособного населения в возрасте от 18 до 39 лет. К основным факторам риска развития НАЖБП отнесены: ИМТ больше
27 кг/м2, ожирение, СД, гиперхолестеринемия. Факторы риска выявлены у 92% пациентов с НАЖБП [32].
Клиника НАЖБП. Главной клинической особенностью течения НАЖБП (стеатоза и НАСГ) является малосимптомность. Симптомы НАЖБП неспецифичны и свидетельствуют лишь о самом факте поражения печени, но не коррелируют со степенью его тяжести [33–35].
Астения (общая слабость, повышенная утомляемость и пр.) является наиболее частым синдромом, выявляемым у пациентов со стеатозом и НАСГ. Выявление при осмотре пациента с НАСГ «бессимптомной» гепатомегалии может достигать по данным литературы 75% случаев. Другие, характерные для хронических заболеваний печени, симптомы у большинства пациентов чаще всего отсутствуют.
Средний возраст больных на момент диагностики НАЖБП составляет 45–50 лет. Большинство пациентов, страдающих стеатозом печени и НАСГ, имеют избыточную массу тела, на 10–40% превышающую идеальную (ИМТ>30 кг/м2). При первичной НАЖБП в клинической картине присутствуют симптомы, связанные с сопутствующими нарушениями углеводного и липидного обмена.
Частой составляющей клинической картины НАЖБП является наличие симптомокомплекса функциональных расстройств билиарного тракта (дисфункции желчного пузыря и желчевыводящих путей) – до 30% больных предъявляют жалобы на боли и дискомфорт в правом подреберье, связанные с приемом пищи [36–38].
Лабораторно-инструментальная диагностика НАЖБП. При лабораторных исследованиях возможно выявление синдромов цитолиза и холестаза [39, 40]. Синдром цитолиза при НАЖБП проявляется повышением активности сывороточной аланинаминотрансферазы (АЛТ) в 2–3 раза и аспартатаминотрансферазы (АСТ) в 2–10 раз по сравнению с нормой. Оценка соотношения АСТ/АЛТ не позволяет провести различия между алкогольным гепатитом и НАСГ. Соотношение АСТ/АЛТ, превышающее «3», обнаруживается примерно у 32% пациентов с НАСГ, свыше «1» – у 40% пациентов.
Синдром холестаза: гипербилирубинемия, в пределах 25–35 ммоль/л, имеет место в 12–17% случаев, чаще уровень сывороточного билирубина сохраняется в пределах нормы. Активность щелочной фосфатазы умеренно повышена у 40–60% пациентов. У 30–60% больных НАСГ возможно повышение активности щелочной фосфатазы и гамма-глутамилтранспептидазы (ГГТП), обычно не более чем до 2 норм.
Мезенхимально-воспалительный синдром или синдром «воспаления» не является характерным для НАСГ, однако возможно выявление гипергаммаглобулинемии у 13–30% больных, антител к ядерному антигену в титре 1:40 – 1:320 – у 40% больных, при этом антитела к гладкой мускулатуре отсутствуют.
Синдром гепатодепрессии также не характерен для НАСГ. Печеночно-клеточная недостаточность развивается лишь при формировании цирроза печени, однако гипоальбуминемия при НАСГ отмечается у больных с диабетической нефропатией [41].
У пациентов часто определяются лабораторные признаки нарушения углеводного (повышение уровня глюкозы крови или нарушенная толерантность к глюкозе) и жирового (гиперхолестеринемия и гипертриглицеридемия) обмена. Гематологические нарушения для НАСГ не характерны вплоть до развития гиперспленизма при циррозе печени.
Инструментальные методы обследования (ультразвуковое исследование – УЗИ, компьютерная томография, магнитно-резонансная томография) позволяют верифицировать гепатомегалию, косвенно оценить степень стеатоза печени и зарегистрировать формирование портальной гипертензии. Радионуклидное сканирование с коллоидом серы, меченным 99mTc, позволяет визуализировать очаговый стеатоз как дефекты накопления изотопа. С помощью методов визуализации не представляется возможным провести различия между стеатозом печени и НАСГ. Фиброгастродуоденоскопия позволяет диагностировать варикозное расширение вен пищевода при трансформации стеатогепатита в цирроз печени [23, 42].
Подтверждена высокая информативность и точность диагностики при применении магнитно-резонансной эластографии, широко метод не применяется вследствие малодоступности [43, 44]. Наиболее чувствительным, специфичным, точным, малоинвазивным и доступным методом диагностики хронических диффузных заболеваний печени признано сочетанное использование транзиентной эластометрии и эластографии сдвиговой волной [45]. При сравнительной оценке эластометрических показателей жесткости печени при алкогольном и жировом поражении печени отмечены достоверно более выраженные патологические изменения органной паренхимы при НАЖБП, чем при алкогольной болезни печени (АБП) в условиях абстиненции (от одного месяца) [46].
В реальной клинической практике НАЖБП чаще всего выявляется случайно, когда при УЗИ органов брюшной полости пациента выявляют признаки жировой дистрофии печени. К УЗ-признакам диффузного жирового поражения печени относятся:
• диффузная гиперэхогенная эхоструктура («яркая» печень);
• усиленная эхоструктура печени по сравнению с почками;
• нечеткость и сглаженность сосудистого рисунка;
• дистальное затухание (ослабление) сигнала.
В ряде случаев на фоне жировой инфильтрации могут визуализироваться участки пониженной эхогенности, соответствующие неизмененной паренхиме печени [47, 48].
Морфологическое исследование печени служит основой диагностики НАЖБП, однако без учета данных анамнеза (исключения употребления пациентом алкоголя в гепатотоксической дозе – более 20 мл этанола в сутки) по гистологической картине невозможно провести различие между алкогольным гепатитом и НАСГ.
В соответствии с рекомендациями Болонской конференции (2009 г.) биопсию печени пациентам с НАЖБП рекомендуется проводить в следующих случаях: наличие мотивации пациента; наличие СД 2; абдоминального (андроидного) ожирения; тромбоцитопении 140×109/л и менее; инсулинорезистентности; любых косвенных признаках цирроза [49]. В тех случаях, когда уровень сывороточных аминотрансфераз в норме, биопсия печени не показана.
Лабораторные тесты крови – ФиброТест и ФиброМетр V могут быть использованы для неинвазивной оценки стадий фиброза печени. ФиброТест (компонент диагностической панели Фибро-АктиТест и ФиброМакс) включает 5 не коррелирующих между собой биохимических показателей: ГГТП, альфа-2-макроглобулин, гаптоглобин, аполипопротеин А1 и общий билирубин, которые позволяют оценивать выраженность фиброза посредством дискриминантной функции. С помощью данного теста можно дифференцировать фиброз (Fl-F3) от цирроза печени (F4).
ФиброМетр V (компонент диагностической панели ФиброМетр) включает 5 показателей биохимического и клинического анализов крови: ГГТП, альфа-2-макроглобулин, протромбиновый индекс (%), мочевина, тромбоциты, позволяющие оценивать выраженность фиброза с помощью дискриминантной функции. ФиброМетр V позволяет дифференцировать умеренный фиброз (Fl-F2) от выраженного фиброза (F3) и от цирроза печени (F4).
Для выявления групп риска стеатоза печени рекомендуется рассчитать индекс стеатоза (St-index), как неинвазивный скрининговый метод оценки риска стеатоза печени, разработанный российскими учеными на основе данных исследования DIREG2. Для расчета величины индекса необходимы следующие данные о пациенте: возраст (количество полных лет), СД 2 – есть (1)/нет (0), соотношение талии (Т, см) к росту (Р, см) (Т/Р=…). Расчетная формула: Y (индекс стеатоза или
St-index)=-3,5856+0,0141×возраст+0,4711×СД2+ 4×4373×Т/Р. Значения: Y>0,405, риск стеатоза высокий (специфичность индекса составляет 91,4%) [25, 50].
При подозрении на НАЖБП рекомендуется оценка наличия и выраженности инсулинорезистентности. Наиболее часто применяемым методом оценки инсулинорезистентности является расчет индекса HOMA-IR (HOmeostasis Model Assesment) по формуле: HOMA-IR= I0×G0/22,5, где I0 – уровень инсулина натощак (мкМЕ/мл), G0 – уровень глюкозы натощак (ммоль/л). Значение HOMA-IR: у здоровых лиц – менее 2,5; при нарушении толерантности к глюкозе, СД 2 – более 4. Значимую диагностическую ценность при НАЖБП имеет увеличение индекса HOMA-IR более 5.
Для выявления групп высокого риска прогрессирования НАСГ с фиброзом используется ряд формул, основанных на простейших и доступных для определения в рутинной практике показателей (ИМТ, пол, наличие толерантности к глюкозе или СД, скрининговые сывороточные показатели). Наибольшую популярность в мире получили шкала NFS (Nonalcoholic Fatty Liver Disease Fibrosis Score), индекс FIB-4 (Fibrosis-4), шкала HAIR (англ. Hypertension, ALT and Insulin Resistance), индекс стеатоза печени FLI (англ. Fatty Liver Index), шкала BARD (англ. BMI, AST/ALT Ratio, and Diabetes Score), шкала BAAT (British Association of Art Therapists), индекс APRI (AST to Platelet Ratio Index), шкала CDS (англ. Cirrhosis Discriminant Score), шкала ELF (англ. European Liver Fibrosis Test) [25].
Диагностический алгоритм НАЖБП. В условиях реальной клинической практики диагностический алгоритм НАЖБП на этапе оказания ПМСП [23] можно разделить на 4 последовательных диагностических уровня (рис. 1–4).
Часто именно пациент ставит перед врачом-терапевтом или врачом общей практики вопрос о диагностике НАЖБП, после проведенного УЗИ органов брюшной полости и соответствующего описания: диффузное увеличение «яркости» (эхогенности) паренхимы печени, сглаженность (нечеткость) сосудистого рисунка и возможного умеренного увеличения размеров печени по данным УЗИ (рис. 1).
В ходе диагностического процесса на этапе оказания ПМСП важно не ограничиваться констатацией факта наличия у пациента признаков стеатоза печени и
умеренной гепатомегалии, а продолжить обследование с целью исключения активности воспалительного процесса путем определения концентрации сывороточных трансаминаз (АЛТ и АСТ), поскольку у каждого десятого пациента с УЗ-признаками стеатоза имеется синдром цитолиза (рис. 2).
При наличии синдрома цитолиза необходимо исключить наличие вирусного гепатита. В случае обнаружения острого или хронического вирусного поражения печени, дальнейшее ведение больного осуществляется в соответствии с рекомендациями врача инфекциониста (рис. 3).
При отсутствии маркеров вирусов гепатита в сыворотке крови синдром цитолиза позволяет предполагать возможное наличие у больного стеатогепатита, этиологическими факторами развития которого, кроме НАЖБП, может быть злоупотребление пациентом алкоголем и его суррогатами.
Наличие у больного НАЖБП синдрома гепатодепрессии в сочетании с варикозным расширением вен пищевода предполагает активное выявление врачом цирротической трансформации печени. Ведение больного с НАЖБП на стадии цирроза проводится врачом общей практики в соответствии с рекомендациями гастроэнтеролога или гепатолога (рис. 4).

Наиболее сложный вопрос на 2–4-м уровнях диагностического алгоритма – проведение дифференциальной диагностики между НАЖБП и АБП.
НАЖБП и АБП являются наиболее частыми хроническими заболеваниями печени, а их запущенные формы – НАСГ и алкогольный стеатогепатит – наиболее частые состояния, приводящие к циррозу печени и гепатоцеллюлярной карциноме во всем мире [51]. В патогенезе НАЖБП и АБП прослеживается патогенетическая общность: активация перекисного окисления липидов, окислительный стресс, поражение фосфолипидов мембран митохондрий, нарушение системного и клеточного звеньев липидного обмена. Данный факт объясняет сложности в процессе дифференциальной диагностики, поскольку данные основных объективных,
лабораторных и инструментальных методов дают сходные результаты, не позволяя часто достоверно высказаться об этиологии процесса [52, 53]. Диагноз «НАЖБП» на текущий момент представляется диагнозом исключения [46].
Даже если пациент не употребляет гепатоксические дозы алкоголя (субъективная информация, исходящая от пациента), то необходимо учитывать, что содержание энергии в 1 грамме алкоголя составляет 29 кДж или 7,1 ккал, и употребление алкоголя может способствовать увеличению массы тела [54]. Эпидемиологические исследования предполагают наличие причинной связи между хроническим потреблением алкоголя, даже в умеренных и не гепатотоксических дозах, и прогрессирующим заболеванием печени у лиц с ожирением [55].
Данные экспериментальных исследований указывают на комбинированное патологическое воздействие алкоголя и ожирения на накопление и повреждение гепатоцеллюлярных липидов, а также на воспаление, фиброз и канцерогенез печени [51, 55]. Примечательно, что эти комбинированные патологические эффекты не только являются аддитивными, но даже синергичными. Представляется важным, что алкоголь даже в умеренных дозах, не относящихся к гепатотоксичным, проявляет синергетические патологические эффекты с ожирением, что предполагает значительные различия в пороговой дозе гепатотоксического воздействия алкоголя у худых и страдающих ожирением субъектов, а также имеет важное значение для рекомендаций по «безопасному» потреблению алкоголя [51].
В реальной клинической практике активное выявление лиц, злоупотребляющих спиртными напитками, с поражением печени на фоне хронической алкогольной интоксикации осуществляется по клиническим (одутловатость лица, расширение капиллярной сети на коже лица, увеличение околоушных слюнных желез, гинекомастия, тремор пальцев рук, контрактура Дюпюитрена, «мраморность» кожных покровов, повышенная потливость, раздражительность) и лабораторным критериям. К традиционным, доступным в реальной клинической практике, относятся: соотношение АСТ/АЛТ более 1, увеличение ГГТП и иммуноглобулина А в сыворотке крови. К дополнительным, проведение которых не всегда возможно в реальной клинической практике, относятся – определение в сыворотке крови содержания трансферрина (углероддефицитного) – CDT, гомологов фосфатазы и тензина (PTEN), уровня фосфатидилэтанола и оценка электрических и вязкоупругих параметров эритроцитов.
Используются и специально разработанные опросники (MAST, CAGE, AUDIT, «Здоровье и образ жизни» и др.), однако они предполагают объективные, «честные» ответы на вопросы.
Лечение. Из представленных выше эпидемиологических данных вытекает важный практический вывод: каждый 3–4-й пациент, посещающий врача-терапевта и врача общей практики в поликлиниках России, нуждается в профилактическом лечении стеатоза печени [12, 32].
Патогенетически обоснованными в лечении НАЖБП, связанной с ожирением, являются мероприятия, направленные на модификацию образа жизни, которые включают рациональное питание и регулярные дозированные физические нагрузки.
Общепринятой схемы медикаментозной терапии НАЖБП в настоящее время нет. Однако это не исключает возможность использования лекарственных препаратов в дополнение к рекомендациям по диете и режиму. Лечебные мероприятия при НАЖБП целесообразно проводить как можно ранее, на стадии стеатоза. Большинству пациентов с НАЖБП, связанной с ожирением, показана терапия, сочетающая в себе стабилизацию мембран гепатоцитов, антиоксидантную защиту, иммуномодуляцию, обеспечивающую противовоспалительную активность, а также направленная на купирование проявлений дисфункции желчевыводящих путей [56, 57]. С этой целью в российских и международных обзорах, исследованиях и рекомендациях обосновывается применение в комплексной терапии НАЖБП различных гепатопротекторов.
НАЖБП и новая коронавирусная инфекция COVID-19. Пандемия новой коронавирусной инфекции (COVID-19), распространяемая вирусом SARS-CoV-2, стала вызовом системам здравоохранения всех стран мира. В национальном консенсусе «Особенности ведения коморбидных пациентов в период пандемии новой коронавирусной инфекции (COVID-19)» [58] отмечается, что пациенты с НАЖБП или НАСГ, как правило, имеют сопутствующие метаболические заболевания, такие как СД, артериальная гипертензия и ожирение, а также вынуждены принимать большое количество потенциально гепатотоксичных препаратов, что относит их к группе повышенного риска заражения SARS-CoV-2, а также – тяжелого течения этой инфекции. Это позволяет рассматривать НАЖБП столь же опасной в плане тяжелого течения COVID-19, как вирусные гепатиты, аутоиммунный гепатит и фиброз/цирроз печени.
У пациентов без СД с COVID-19 наличие НАЖБП ассоциируется с 4-кратным повышением риска развития тяжелого течения COVID-19 [59–62]. При этом вероятность осложнений инфекции COVID-19 повышается с увеличением числа метаболических факторов риска [63–65]. Важным моментом является сохранение ассоциации с тяжестью течения COVID-19 и после проведенной коррекции с учетом возраста, пола и сопутствующих патологических состояний [61, 63]. В этой связи, пациенты с НАЖБП в период пандемии COVID-19 нуждаются в особом внимании врачей и контроле над течением заболевания, прежде всего снижении уровня повреждения печени (степени выраженности стеатоза и фиброза) и нормализации печеночных трансаминаз [58, 62, 66].
Клиническое наблюдение
Известно, что НАЖБП является независимым предиктором не только высоких сердечно-сосудистых рисков, но и гепатоцеллюлярной карциномы и злокачественных новообразований различной локализации, а также целого ряда других коморбидных состояний [25].Приведем наше клиническое наблюдение [67] с рядом уточнений. Пациент С., 55 лет на момент обращения, в течение последних трех лет отмечал общую слабость. В конце августа появился выраженный болевой синдром в поясничной области позвоночника, усиливающийся при движении и подъеме тяжестей.
Anamnesis vitae: курение в течение 40 лет по 1–2 пачки в день, в течение нескольких лет отмечались повышенные цифры артериального давления с максимальным повышением до 190/100 мм рт. ст., антигипертензивные препараты не принимал, в течение последних 5 лет периодически беспокоили неприятные ощущения в области правого подреберья, при УЗИ органов брюшной полости, проведенном 2 года назад, отмечено умеренное увеличение размеров печени, диффузное увеличение «яркости» (эхогенности) паренхимы печени, сглаженность (нечеткость) сосудистого рисунка. Масса тела – 112 кг, рост – 176 см (ИМТ – 36 кг/м2). Работает охранником (суточные дежурства 1 раз в 4 дня), проживает один. После работы обязательно от «стресса» выпивает 1–2 бутылки пива по 0,5 л. В остальном медицинский и хирургический анамнез без особенностей. Диагностирована люмбалгия, назначено лечение нестероидным противовоспалительным препаратом – болевой синдром уменьшился. В первых числах сентября выполнена крупнокадровая флюорография органов грудной клетки и общий анализ крови, не выявившие отклонений.
В конце сентября болевой синдром стал беспокоить в покое, в ночное время суток и распространялся на нижние конечности, параллельно стала нарастать общая слабость и появились затруднения при выполнении движений (ходьба, вставание). После исключения острой неврологической и хирургической патологии был сформулирован клинический диагноз: «Атеросклеротическая болезнь с преимущественным поражением сосудов нижних конечностей, ишемия 3А стадии. Артериальная гипертензия II стадии, риск III. Хроническая сердечная недостаточность I стадии, функциональный класс 1. Ожирение II стадии. НАЖБП» и 18 октября пациент был направлен в хирургическое отделение многопрофильного стационара. Объективное исследование при поступлении не выявило значимых отклонений от нормы. В стационаре неоднократно проводился общий анализ крови, который впервые выявил лейкоцитоз до 18×109 г/л и ускорение СОЭ до 48 мм/ч, биохимическое исследование крови: АЛТ – 56 U/l, АСТ – 45 U/l. общий анализ мочи, электрокардиография, ультразвуковое исследование брюшной полости – без патологии. Глюкоза крови натощак при многократном определении в диапазоне 10,7–7,25 ммоль/л, гликозилированный гемоглобин – 6,0%. При дуплексном сканировании магистральных артерий нижних конечностей выявлены: атеросклероз магистральных артерий нижних конечностей с преобладанием гемодинамически значимыми препятствиями кровотоку по артериям левой нижней конечности, окклюзия левой поверхностной бедренной артерии при входе в Гунтеров канал. Пациенту проводилось лечение антигипертензивными препаратами, статинами, дезагрегантами (клопидогрель, ацетилсалициловая кислота), витаминами группы B, сосудистыми препаратами (реополиглюкин, пентоксифиллин), непрямыми антикоагулянтами. На фоне терапии была отмечена положительная динамика болевого и астенического синдрома, но были зарегистрированы несколько эпизодов повышения температуры тела до 38,0° С, кашель с небольшим количеством мокроты, одышка. Эти симптомы были интерпретированы как проявление хронического бронхита, связанного с длительным стажем табакокурения.
Спустя неделю после выписки из многопрофильного стационара вновь отмечено прогрессирование болевого и астенического синдромов. В ноябре пациент консультирован сосудистым хирургом и направлен для диагностики и планового лечения в отделение сосудистой хирургии областной клинической больницы, в которое поступил 10 декабря.
При объективном осмотре 10 декабря: состояние удовлетворительное, сознание ясное. Питание избыточное: масса тела – 100 кг (при этом, впервые было обращено внимание, что за последние 3 года без приложения каких-либо усилий похудел со 125 кг до 100 кг), рост – 176 см, ИМТ – 32 кг/м2. Периферические и региональные лимфатические узлы, щитовидная железа и суставы не изменены. Кожный покров бледно-розового цвета. Грудная клетка правильной формы, при перкуссии определялся легочный звук, в нижних отделах легких – притупление перкуторного звука, дыхание жесткое, выслушивались влажные хрипы в средних и нижних отделах легких. Частота дыхательных движений – 16 в мин. Тоны сердца приглушены, ритмичные, акцент II тона на аорте. Артериальное давление – 160/100 мм рт. ст., пульс – 80 в минуту. Язык влажный, чистый. Живот правильной формы, увеличен за счет подкожно-жирового слоя. При пальпации мягкий, безболезненный, симптом Щеткина–Блюмберга не определялся. Печень у края реберной дуги. Почки не пальпировались. Симптом поколачивания отрицательный. Пастозность нижних конечностей.
Status localis: кожный покров нижних конечностей с обеих сторон бледной окраски, пульсация на левой бедренной артерии – ослаблена на всем протяжении, на правой конечности сохранена и определялась на a. dorsalis pedis.
Врач приемного отделения обратил внимание на наличие выраженного астенического синдрома и влажных хрипов в легких, снижение массы тела пациента за последние 3 года. Изменения в общем анализе крови (лейкоцитоз, ускорение СОЭ), также не укладывались в диагноз атеросклеротического поражения бедренных артерий. Были назначены: фиброгастродуоденоскопия, выявившая ulcus tumor (?) в желудке, эрозивный гастрит, бульбит; УЗИ брюшной полости: признаки гепатомегалии, диффузные изменения в печени, множественные очаговые образования печени (трактовавшиеся как метастатическое поражение). Рентгенографическое исследование органов грудной клетки – диффузная с обеих сторон мелкоочаговая (лимфогенная) диссеминация больше справа и очаговые тени до 20 мм в диаметре, локальное затемнение паракостальных отделов правого легкого на уровне четвертого межреберья толщиной до 18 мм, протяженность 30 мм. Заключение: метастатическое поражение легких.
Через 3 дня пациент выписан из стационара с диагнозом: «Атеросклеротическая болезнь с преимущественным поражением бедренных артерий. Окклюзия левой бедренной артерии, стадия II Б. Язва – рак желудка?». Ввиду подозрения на онкологическое заболевание в проведении ангиографического исследования было отказано. 16 декабря амбулаторно консультирован онкологом и на основании данных обследования выставлен диагноз: Рак желудка.
19 декабря пациент умирает. При патологоанатомическом осмотре: кожа – желтушного цвета, в легочной ткани – множественные округлой формы узлы в диаметре от 0,5×1 см, 1,5×2 см, белесовато-серого цвета (метастазы), на разрезе выделялось мутное гнойное содержимое. Внутренняя оболочка аорты, бедренных, подвздошных артерий умеренно покрыты атероматозными бляшками. В желудке пусто, слизистая оболочка белесоватая, складчатая, определяется дефект слизистой 1×1 см. Печень была бугристая, с множественными участками разрастания опухолевой ткани в виде узлов (до 2,5 см) с нечеткими границами, размером 30×19×14×8 см, плотной консистенции, белесоватого цвета. Гистологическое исследование – злокачественное новообразование желчных протоков печени, внутрипеченочная холангиокарцинома (М 8160/3). Очаговая серозно-гнойная пневмония, метастазы в легких. Патологоанатомический диагноз: «Злокачественное образование желчных протоков печени (гистологический диагноз – внутрипеченочная холангиокарцинома (М 8160/3) с метастазами в легкие. Серозная двухсторонняя параканкрозная пневмония. Дистрофические изменения внутренних органов».
Данный клинический пример иллюстрирует сложность ранней диагностики внутрипеченочной холангиокарциномы у пациента с НАЖБП и другими метаболическими факторами риска. Клинические проявления опухоли данной локализации неспецифичны, наиболее частые симптомы на операбельной стадии – похудение, недомогание, усталость, «ночная потливость», а основные синдромы – болевой и желтушный [68, 69]. В нашем клиническом наблюдении у пациента желтуха была отмечена только при патологоанатомическом исследовании, при клинической манифестации преобладали астенический синдром и неспецифические симптомы опухолевой прогрессии, в сочетании с болевым синдромом в поясничном отделе позвоночника, который вероятнее всего был проявлением паранеопластического синдрома [70]. Наличие коморбидного заболевания – атеросклеротической болезни с преимущественным поражением бедренных артерий – проявляющегося болевым синдромом сходной локализации, привело к поздней диагностики холангиокарциномы у данного пациента.
Конфликт интересов. Автор заявляет об отсутствии конфликта интересов.
Conflict of interests. The author declares that there is not conflict of interests.
Информация об авторах / Information about the authors
Трухан Дмитрий Иванович – д-р мед. наук, доцент, проф. каф. поликлинической терапии и внутренних болезней, ФГБОУ ВО «Омский ГМУ». E-mail: dmitry_trukhan@mail.ru; ORCID 0000-0002-1597-1876
Dmitry I. Trukhan – D. Sci. (Med.), Assoc. Prof., Prof. of the Chair of Polyclinic therapy and internal diseases, Omsk State Medical University. E-mail: dmitry_trukhan@mail.ru; ORCID 0000-0002-1597-1876
Статья поступила в редакцию / The article received: 05.10.2020
Статья принята к печати / The article approved for publication: 27.05.2021
Список исп. литературыСкрыть список1. World Health Organization Media Centre. Obesity and overweight. Fact sheet №311. Updated January 2015. www.who.int/mediacentre/factsheets/fs311/en/
2. Ng M, Fleming T, Robinson M et al. Global, regional, and national prevalence of overweight and obesity in children and adults during 1980–2013: a systematic analysis for the Global Burden of Disease Study. Lancet 2014; 384 (9945): 766–81. DOI: 10.1016/S0140-6736(14)60460-8
3. Frühbeck G, Toplak H, Woodward E et al. Obesity: The gateway to ill health – an EASO Position Statement on a rising public health, clinical and scientific challenge in Europe. Obes Facts 2013; 6 (2): 117–20. DOI: 10.1159/000350627
4. Finkelstein EA, Trogdon JG, Cohen JW, Dietz W. Annual medical spending attributable to obesity: payer- and service-specific estimates. Health Aff (Millwood) 2009; 28 (5): 822–31. DOI: 10.1377/hlthaff.28.5.w822
5. Sjöström L. Review of the key results from the Swedish Obese Subjects (SOS) trial – a prospective controlled intervention study of bariatric surgery. J Intern Med 2013; 273 (3): 219–34. DOI: 10.1111/joim.12012
6. World Health Organization Media Centre. Obesity and overweight. Fact sheet no Geneva: World Health Organization; 2013. www.who.int/ news-room/fact-sheets/detail/obesity-and-overweight
7. Defining Obesity. URL: http://asmbs.org/patients/disease-of-obesity
8. Garvey WT, Garber AJ, Mechanick JI et al. American association of clinical endocrinologists and american college of endocrinology position statement on the 2014 advanced framework for a new diagnosis of obesity as a chronic disease. Endocr Pract 2014; 20 (9): 977–89. DOI: 10.4158/EP14280.PS
9. Трухан Д.И., Иванова Д.С. Неалкогольная жировая болезнь печени, ассоциированная с ожирением: терапевтические возможности. Consilium Medicum. 2016; 8: 68–74.
[Трухан Д.И., Иванова Д.С. Неалкогольная жировая болезнь печени, ассоциированная с ожирением: терапевтические возможности. Cонсилиум Медиcум. 2016; 8: 68–74 (in Russian).]
10. Трухан Д.И. Неалкогольная жировая болезнь печени, ассоциированная с ожирением: возможности эссенциальных фосфолипидов. Медицинский совет. 2016; 4: 116–22.
[Trukhan D.I. Nealkogol'naia zhirovaia bolezn' pecheni, assotsiirovannaia s ozhireniem: vozmozhnosti essentsial'nykh fosfolipidov. Meditsinskii sovet. 2016; 4: 116–22 (in Russian).]
11. Рекомендации по ведению больных c метаболическим синдромом. Клинические рекомендации. Минздрав России. М., 2013. URL: http://medpoiskpro.ru/terapiya/klinicheskie-rekomendatsii-po-kardiologii-2013
[Rekomendatsii po vedeniiu bol'nykh c metabolicheskim sindromom. Klinicheskie rekomendatsii. Minzdrav Rossii. Moscow, 2013. URL: http://medpoiskpro.ru/terapiya/klinicheskie-rekomendatsii-po-kardiologii-2013 (in Russian).]
12. Ивашкин В.Т., Драпкина О.М., Шульпекова Ю.О. Диагностика и лечение неалкогольной жировой болезни печени: методические рекомендации. М.: Издательский дом «М-Вести», 2009.
[Ivashkin V.T., Drapkina O.M., Shul'pekova Iu.O. Diagnostika i lechenie nealkogol'noi zhirovoi bolezni pecheni: metodicheskie rekomendatsii. Мoscow: Izdatel'skii dom "M-Vesti', 2009 (in Russian).]
13. Драпкина О.М, Гацолаева Д.С., Ивашкин В.Т. Неалкогольная жировая болезнь печени как компонент метаболического синдрома. Российские медицинские вести. 2010; 2: 72–8.
[Drapkina O.M, Gatsolaeva D.S., Ivashkin V.T. Nealkogol'naia zhirovaia bolezn' pecheni kak komponent metabolicheskogo sindroma. Rossiiskie meditsinskie vesti. 2010; 2: 72–8 (in Russian).]
14. Than NN, Newsome PN. A concise review of non-alcoholic fatty liver disease. Atherosclerosis 2015; 239: 192–202. DOI: 10.1016/j.atherosclerosis.2015.01.001
15. Machado M, Marques-Vidal P, Cortez-Pinto H. Hepatic histology in obesepatients undergoing bariatric surgery. J Hepatol 206; 45 (4): 600–6. DOI: 10.1016/j.jhep.2006.06.013
16. Gaggini M, Morelli M, Buzzigoli E et al. Non-alcoholic fatty liver disease (NAFLD) and its connection with insulin resistance, dyslipidemia, atherosclerosis and coronary heart disease. Nutrients 2013; 5 (5): 1544–60. DOI: 10.3390/nu5051544
17. Chang E, Park CY, Park SW. Role of thiazolidinediones, insulin sensitizers,in non-alcoholic fatty liver disease. J Diabetes Investig 2013; 4 (6): 517–24. DOI: 10.1111/jdi.12107
18. Williamson RM, Price JF, Glancy S et al. Prevalence of and risk factors for hepatic steatosis and nonalcoholic fatty liver disease in people with type 2 diabetes: the Edinburgh type 2 diabetes Study. Diabetes Care 2011; 34 (5): 1139–44. DOI: 10.2337/dc10-2229
19. Трухан Д.И., Филимонов С.Н. Клиника, диагностика и лечение основных эндокринных и гематологических заболеваний. Новокузнецк: Полиграфист, 2015.
[Trukhan D.I., Filimonov S.N. Klinika, diagnostika i lechenie osnovnykh endokrinnykh i gematologicheskikh zabolevanii. Novokuznetsk: Poligrafist, 2015 (in Russian).]
20. Brea A, Puzo J. Non-alcoholic fatty liver disease and cardiovascular risk. Int J Cardiol 2013; 167 (4): 1109–17. DOI: 10.1016/j.ijcard.2012.09.085
21. Targher G, Marra F, Marchesini G. Increased risk of cardiovascular disease in non-alcoholic fatty liver disease: causal effect or epiphenomenon? Diabetologia 2008; 51 (11): 1947–53. DOI: 10.1007/s00125-008-1135-4
22. Armstrong MJ, Adams LA, Canbay A, Syn WK. Extrahepatic complications of nonalcoholic fatty liver disease. Hepatology 2014; 59 (3): 1174–97. DOI: 10.1002/hep.26717
23. Трухан Д.И., Викторова И.А., Сафонов А.Д. Болезни печени. СПб.: СпецЛит, 2019.
[Trukhan D.I., Viktorova I.A., Safonov A.D. Bolezni pecheni. Saint Petersburg: SpetsLit, 2019 (in Russian).]
24. Трухан Д.И., Билевич О.А. Неалкогольная жировая болезнь печени, ассоциированная с ожирением: возможности урсодезоксихолевой кислоты. Медицинский совет. 2019; 6: 86–94.
[Trukhan D.I., Bilevich O.A. Nealkogol'naia zhirovaia bolezn' pecheni, assotsiirovannaia s ozhireniem: vozmozhnosti ursodezoksikholevoi kisloty. Meditsinskii sovet. 2019; 6: 86–94 (in Russian).]
25. Лазебник Л.Б., Голованова Е.В., Туркина С.В. и др. Неалкогольная жировая болезнь печени у взрослых: клиника, диагностика, лечение. Рекомендации для терапевтов, третья версия. Экспериментальная и клиническая гастроэнтерология. 2021; 185 (1): 4–52. DOI: 10.31146/1682-8658-ecg-185-1-4-52
[Lazebnik L.B., Golovanova E.V., Turkina S.V. et al. Nealkogol'naia zhirovaia bolezn' pecheni u vzroslykh: klinika, diagnostika, lechenie. Rekomendatsii dlia terapevtov, tret'ia versiia. Eksperimental'naia i klinicheskaia gastroenterologiia. 2021; 185 (1): 4–52. DOI: 10.31146/1682-8658-ecg-185-1-4-52 (in Russian).]
26. Симаненков В.И., Маев И.В., Ткачева О.Н. и др. Синдром повышенной эпителиальной проницаемости в клинической практике. Мультидисциплинарный национальный консенсус. Кардиоваскулярная терапия и профилактика. 2021; 20 (1): 121–278. DOI: 10.15829/1728-8800-2021-2758
[Simanenkov V.I., Maev I.V., Tkacheva O.N. et al. Sindrom povyshennoi epitelial'noi pronitsaemosti v klinicheskoi praktike. Mul'tidistsiplinarnyi natsional'nyi konsensus. Kardiovaskuliarnaia terapiia i profilaktika. 2021; 20 (1): 121–278. DOI: 10.15829/1728-8800-2021-2758 (in Russian).]
27. Clark JM. The epidemiology of nonalcoholic fatty liver disease in adults. J Clin Gastroenterol 2006; 40: 5–10. DOI: 10.1097/01.mcg. 0000168638.84840.ff
28. Younossi ZM, Stepanova M, Affendy M et al. Изменение распространенности основных хронических болезней печени в США с 1998 по 2008 г. Клиническая гастроэнтерология и гепатология. Русское издание. 2011; 5: 261–7.
[Younossi ZM, Stepanova M, Affendy M et al. Izmenenie rasprostranennosti osnovnykh khronicheskikh boleznei pecheni v SShA s 1998 po 2008 g. Klinicheskaia gastroenterologiia i gepatologiia. Russkoe izdanie. 2011; 5: 261–7 (in Russian).]
29. Jarvis H, Craig D, Barker R et al. Metabolic risk factors and incident advanced liver disease in non-alcoholic fatty liver disease (NAFLD): A systematic review and meta-analysis of population-based observational studies. PLoS Med 2020; 17 (4): e1003100. DOI: 10.1371/journal.pmed.1003100
30. Neuschwander-Tetri BA, Caldwell SH. Nonalcoholic steatohepatitis: Summary of an AASLD Single Topic Conference. Hepatology 2003; 37 (5): 1202–19. DOI: 10.1053/jhep.2003.50193
31. Drapkina O, Ivashkin V. Prevalence and risk factors for non–alcogolic fatty liver disease in Russian federation. International Liver Congress 2010. Abstract book. Р. 138.
32. Подведение итогов всероссийского исследования DIREG-2. URL: http://ria-ami.ru/read/19366
[Podvedenie itogov vserossiiskogo issledovaniia DIREG-2. URL: http://ria-ami.ru/read/19366 (in Russian).]
33. Трухан Д.И. Неалкогольная жировая болезнь печени в практике врача первого контакта. Клинические перспективы гастроэнтерологии, гепатологии. 2012; 1: 3–9.
[Trukhan D.I. Nealkogol'naia zhirovaia bolezn' pecheni v praktike vracha pervogo kontakta. Klinicheskie perspektivy gastroenterologii, gepatologii. 2012; 1: 3–9 (in Russian).]
34. Трухан Д.И., Тарасова Л.В., Викторова И.А. Роль врача общей практики в диагностике и лечении неалкогольной жировой болезни печени. Справочник врача общей практики. 2013; 3: 58–68.
[Trukhan D.I., Tarasova L.V., Viktorova I.A. Rol' vracha obshchei praktiki v diagnostike i lechenii nealkogol'noi zhirovoi bolezni pecheni. Spravochnik vracha obshchei praktiki. 2013; 3: 58–68 (in Russian).]
35. Трухан Д.И. Возможности гепатопротектора с пребиотическим действием. Медицинский совет. 2016; 9: 64–9.
[Trukhan D.I. Vozmozhnosti gepatoprotektora s prebioticheskim deistviem. Meditsinskii sovet. 2016; 9: 64–9 (in Russian).]
36. Бутов М.А., Ардатова В.Б., Шелухина С.В. Дисфункции билиарного тракта: диагностика, медикаментозная коррекция. Рязань, 2004.
[Butov M.A., Ardatova V.B., Shelukhina S.V. Disfunktsii biliarnogo trakta: diagnostika, medikamentoznaia korrektsiia. Riazan', 2004 (in Russian).]
37. Трухан Д.И. Неалкогольная жировая болезнь печени в практике врача первого контакта. Поликлиника. 2013; 1: 63–8.
[Trukhan D.I. Nealkogol'naia zhirovaia bolezn' pecheni v praktike vracha pervogo kontakta. Poliklinika. 2013; 1: 63–8. (in Russian).]
38. Трухан Д.И., Филимонов С.Н. Дифференциальный диагноз основных гастроэнтерологических синдромов и симптомов. М.: Практическая медицина, 2016.
[Trukhan D.I., Filimonov S.N. Differentsial'nyi diagnoz osnovnykh gastroenterologicheskikh sindromov i simptomov. Мoscow: Prakticheskaia meditsina, 2016 (in Russian).]
39. Трухан Д.И. Неалкогольная жировая болезнь печени: лечебные и диетические рекомендации врача первого контакта. Consilium Medicum. Гастроэнтерология. 2014; 2: 10–5.
[Trukhan D.I. Nealkogol'naia zhirovaia bolezn' pecheni: lechebnye i dieticheskie rekomendatsii vracha pervogo kontakta. Consilium Medicum. Gastroenterologiia. 2014; 2: 10–5 (in Russian).]
40. Трухан Д.И. Неалкогольная жировая болезнь печени: лечебные и диетические рекомендации на этапе оказания первичной медико-санитарной помощи. Медицинский совет. 2015; 17: 78–84.
[Trukhan D.I. Nealkogol'naia zhirovaia bolezn' pecheni: lechebnye i dieticheskie rekomendatsii na etape okazaniia pervichnoi mediko-sanitarnoi pomoshchi. Meditsinskii sovet. 2015; 17: 78–84 (in Russian).]
41. Трухан Д.И. Синдром печеночной энцефалопатии. Актуальные аспекты диагностики и лечения. Медицинский совет. 2016; 14: 80–7.
[Trukhan D.I. Sindrom pechenochnoi entsefalopatii. Aktual'nye aspekty diagnostiki i lecheniia. Meditsinskii sovet. 2016; 14: 80–7 (in Russian).]
42. Трухан Д.И., Викторова И.А., Сафонов А.Д. Болезни печени. СПб.: Фолиант, 2010.
[Trukhan D.I., Viktorova I.A., Safonov A.D. Bolezni pecheni. Saint Petersburg: Foliant, 2010 (in Russian).]
43. Banerjee R, Pavlides M, Tunnicliffe EM et al. Multiparametricmagnetic resonance for the non-invasive diagnosis of liver dis-ease. J Hepatol 2014; 60 (1): 69–77. DOI: 10.1016/j.jhep.2013.09.002
44. Sing S, Venkateshh SК, Wang Z et al. Performance of magneticresonance elastographyin staging liver fi brosis. A systematic review and meta-analysis. Clin Gastroenterol Hepatol 2015; 13 (3): 440–51.e6. DOI: 10.1016/j.cgh.2014.09.046
45. Диомидова В.Н., Тарасова Л.В., Трухан Д.И. и др. Информативность эластографии сдвиговой волной с эластометрией при неалкогольной жировой болезни печени. Практическая медицина. 2018; 1 (112): 81–5.
[Diomidova V.N., Tarasova L.V., Trukhan D.I. et al. Informativnost' elastografii sdvigovoi volnoi s elastometriei pri nealkogol'noi zhirovoi bolezni pecheni. Prakticheskaia meditsina. 2018; 1 (112): 81–5 (in Russian).]
46. Диомидова В.Н., Тарасова Л.В., Трухан Д.И, Цыганова Ю.В. Сравнительная оценка эластометрических показателей жесткости печени при алкогольной и неалкогольной ее болезни. Экспериментальная и клиническая гастроэнтерология. 2018; 7: 52–6.
[Diomidova V.N., Tarasova L.V., Trukhan D.I, Tsyganova Iu.V. Sravnitel'naia otsenka elastometricheskikh pokazatelei zhestkosti pecheni pri alkogol'noi i nealkogol'noi ee bolezni. Eksperimental'naia i klinicheskaia gastroenterologiia. 2018; 7: 52–6 (in Russian).]
47. Тарасова Л.В., Трухан Д.И. Неалкогольная жировая болезнь печени: диетические и лечебные рекомендации врача общей практики. Терапевт. 2013; 8: 4–15.
[Tarasova L.V., Trukhan D.I. Nealkogol'naia zhirovaia bolezn' pecheni: dieticheskie i lechebnye rekomendatsii vracha obshchei praktiki. Terapevt. 2013; 8: 4–15 (in Russian).]
48. Трухан Д.И., Мазуров А.Л. Лекарственные поражения печени: актуальные вопросы диагностики и лечения. Медицинский совет. 2016; 5: 70–3.
[Trukhan D.I., Mazurov A.L. Lekarstvennye porazheniia pecheni: aktual'nye voprosy diagnostiki i lecheniia. Meditsinskii sovet. 2016; 5: 70–3 (in Russian).]
49. Ratziu V. A proposal for current and future therapeutic strategies for NASH. EASL Special Conference «NAFLD/NASH and Related Metabolic Disease». Bologna, Italy, 2009. Program and Abstracts. P. 29.
50. Maev IV, Samsonov AA, Lazebnik LB et al. A New, Non-Invasive Scale for Steatosis Developed Using Real-World Data From Russian Outpatients to Aid in the Diagnosis of Non-Alcoholic Fatty Liver Disease. Adv Ther 2020; 37 (11): 4627–40. DOI: 10.1007/s12325-020-01493-w
51. Mahli A, Hellerbrand C. Alcohol and Obesity: A Dangerous Association for Fatty Liver Disease. Dig Dis 2016; 34 (Suppl. 1): 32–9. DOI: 10.1159/000447279
52. Лазебник Л.Б., Голованова Е.В., Тарасова Л.В. и др. Алкогольная болезнь печени (АБП) у взрослых. Экспериментальная и клиническая гастроэнтерология. 2020; 2 (174): 4–28.
[Lazebnik L.B., Golovanova E.V., Tarasova L.V. et al. Alkogol'naia bolezn' pecheni (ABP) u vzroslykh. Eksperimental'naia i klinicheskaia gastroenterologiia. 2020; 2 (174): 4–28 (in Russian).]
53. Лазебник Л.Б., Голованова Е.В., Еремина Е.Ю. и др. Клинические рекомендации: Алкогольная болезнь печени у взрослых. Терапия. 2020; 4: 10–35.
[Lazebnik L.B., Golovanova E.V., Eremina E.Iu. et al. Klinicheskie rekomendatsii: Alkogol'naia bolezn' pecheni u vzroslykh. Terapiia. 2020; 4: 10–35 (in Russian).]
54. Sayon-Orea C, Martinez-Gonzalez MA, Bes-Rastrollo M. Alcohol consumption and body weight: a systematic review. Nutr Rev 2011; 69 (8): 419–31. DOI: 10.1111/j.1753-4887.2011.00403.x
55. Traversy G, Chaput JP. Alcohol Consumption and Obesity: An Update. Curr Obes Rep 2015; 4 (1): 122–30. DOI: 10.1007/s13679-014-0129-4
56. Буеверов А.О., Богомолов П.О. Неалкогольная жировая болезнь печени: обоснование патогенетической терапии. Клинические перспективы гастроэнтерологии, гепатологии. 2009; 1:
3–8.
[Bueverov A.O., Bogomolov P.O. Nealkogol'naia zhirovaia bolezn' pecheni: obosnovanie patogeneticheskoi terapii. Klinicheskie perspektivy gastroenterologii, gepatologii. 2009; 1: 3–8 (in Russian).]
57. Тарасова Л.В., Трухан Д.И. Неалкогольная жировая болезнь печени: диетические и лечебные рекомендации врача общей практики. Терапевт. 2013; 8: 4–15.
[Tarasova L.V., Trukhan D.I. Nealkogol'naia zhirovaia bolezn' pecheni: dieticheskie i lechebnye rekomendatsii vracha obshchei praktiki. Terapevt. 2013; 8: 4–15 (in Russian).]
58. Гриневич В.Б., Губонина И.В., Дощицин В.Л. и др. Особенности ведения коморбидных пациентов в период пандемии новой коронавирусной инфекции (COVID-19). Национальный Консенсус 2020. Кардиоваскулярная терапия и профилактика. 2020; 19 (4): 2630. DOI: 10.15829/1728-8800-2020-2630
[Grinevich V.B., Gubonina I.V., Doshchitsin V.L. et al. Osobennosti vedeniia komorbidnykh patsientov v period pandemii novoi koronavirusnoi infektsii (COVID-19). Natsional'nyi Konsensus 2020. Kardiovaskuliarnaia terapiia i profilaktika. 2020; 19 (4): 2630. DOI: 10.15829/1728-8800-2020-2630 (in Russian).]
59. Mantovani A, Byrne CD, Zheng MH, Targher G. Diabetes as a risk factor for greater COVID-19 severity and in-hospital death: A meta-analysis of observational studies. Nutr Metab Cardiovasc Dis 2020; 30 (8): 1236–48. DOI: 10.1016/j.numecd.2020.05.014
60. Sharma P, Kumar A. Metabolic dysfunction associated fatty liver disease increases risk of severe Covid-19. Diabetes Metab Syndr 2020; 14 (5): 825–7. DOI: 10.1016/j.dsx.2020.06.013
61. Gao F, Zheng KI, Wang XB et al. Metabolic associated fatty liver disease increases coronavirus disease 2019 disease severity in nondiabetic patients. J Gastroenterol Hepatol 2021; 36 (1): 204–7. DOI: 10.1111/jgh.15112
62. Гриневич В.Б., Кравчук Ю.А., Педь В.И. и др. Ведение пациентов с заболеваниями органов пищеварения в период пандемии COVID-19. Клинические рекомендации Российского научного медицинского общества терапевтов и Научного общества гастроэнтерологов России (2-е издание). Экспериментальная и клиническая гастроэнтерология. 2021; 3: 5–82. DOI: 10.31146/1682-8658-ecg-187-3-5-82
[Grinevich V.B., Kravchuk Iu.A., Ped' V.I. et al. Vedenie patsientov s zabolevaniiami organov pishchevareniia v period pandemii COVID-19. Klinicheskie rekomendatsii Rossiiskogo nauchnogo meditsinskogo obshchestva terapevtov i Nauchnogo obshchestva gastroenterologov Rossii (2-e izdanie). Eksperimental'naia i klinicheskaia gastroenterologiia. 2021; 3: 5–82. DOI: 10.31146/1682-8658-ecg-187-3-5-82 (in Russian).]
63. Singh MK, Mobeen A, Chandra A et al. A meta-analysis of comorbidities in COVID-19: Which diseases increase the susceptibility of SARS-CoV-2 infection? Comput Biol Med 2021. 130: 104219. DOI: 10.1016/j.compbiomed.2021.104219
64. Singh A, Hussain S, Antony B. Non-alcoholic fatty liver disease and clinical outcomes in patients with COVID-19: A comprehensive systematic review and meta-analysis. Diabetes Metab Syndr 2021; 15 (3): 813–22. DOI: 10.1016/j.dsx.2021.03.019
65. Hegyi PJ, Váncsa S, Ocskay K et al. Metabolic Associated Fatty Liver Disease Is Associated With an Increased Risk of Severe COVID-19: A Systematic Review With Meta-Analysis. Front Med (Lausanne) 2021; 8: 626425. DOI: 10.3389/fmed.2021.626425
66. Тихонов С.В., Декканова В.Д., Винничук С.А. и др. Ожирение, неалкогольная жировая болезнь печени, COVID-19. Опасные связи. Медицинский совет. 2021; 5: 76–83. DOI: 10.21518/2079-701X-2021-5-76-83
[Tikhonov S.V., Dekkanova V.D., Vinnichuk S.A. et al. Ozhirenie, nealkogol'naia zhirovaia bolezn' pecheni, COVID-19. Opasnye sviazi. Meditsinskii sovet. 2021; 5: 76–83. DOI: 10.21518/2079-701X-2021-5-76-83 (in Russian).]
67. Гришечкина И.А., Викторова И.А., Трухан Д.И., Кондратьева Н.А. Актуальные аспекты диагностики внутрипеченочной холангиокарциномы. Международный журнал прикладных и фундаментальных исследований. 2016; 11–1: 61–5.
[Grishechkina I.A., Viktorova I.A., Trukhan D.I., Kondrat'eva N.A. Aktual'nye aspekty diagnostiki vnutripechenochnoi kholangiokartsinomy. Mezhdunarodnyi zhurnal prikladnykh i fundamental'nykh issledovanii. 2016; 11–1: 61–5 (in Russian).]
68. Rizdi S, Gores GJ. Pathogenesis, Diagnosis and Management of Cholangiocarcinoma. Gastroenterology 2013; 145 (6). DOI: 10.1053/3gastro2013.10.013
69. Brown KM, Parmar AD, Geller DA. Intrahepatic Cholangiocarcinomа. Surg Oncol Clin N Am 2014; 2: 231–46. DOI: 10.1016/j.soc.2013.10.004
70. Дворецкий Л.И. Паранеопластические синдромы. Справочник поликлинического врача, 2003, 3: 23–8.
[Dvoretskii L.I. Paraneoplasticheskie sindromy. Spravochnik poliklinicheskogo vracha, 2003, 3: 23–8 (in Russian).]


