Клинический разбор в общей медицине №08 2021
Аннотация
Кашель встречается в практике врачей различных специальностей и относится к одному из наиболее частых симптомов широкого спектра заболеваний. Более чем у половины взрослых, обращающихся к специалисту с респираторными жалобами, причина кашля остается нерасшифрованной. В статье рассматриваются принципы дифференциальной диагностики и лечения кашля при респираторных заболеваниях, в том числе и в период пандемии, приводятся особенности кашля при легочном фиброзе и при COVID-19. Как пример дифференциальной диагностики кашля рассматривается клинический случай больного 47 лет, показывающий необходимость использования КТ-исследований не только в дебюте, на момент острого течения болезни, но и в период восстановления больных с длительным кашлем.
Ключевые слова: COVID-19, кашель, постковидный синдром, легочный фиброз.
Для цитирования: Попова Е.Н., Пономарева Л.А., Бондаренко И.Б. Актуальные проблемы дифференциальной диагностики и лечения кашля в период пандемии. Клинический разбор в общей медицине. 2021; 8: 20–26. DOI: 10.47407/kr2021.2.8.00094
Клинический разбор в общей медицине №08 2021
Актуальные проблемы дифференциальной диагностики и лечения кашля в период пандемии
Аннотация
Кашель встречается в практике врачей различных специальностей и относится к одному из наиболее частых симптомов широкого спектра заболеваний. Более чем у половины взрослых, обращающихся к специалисту с респираторными жалобами, причина кашля остается нерасшифрованной. В статье рассматриваются принципы дифференциальной диагностики и лечения кашля при респираторных заболеваниях, в том числе и в период пандемии, приводятся особенности кашля при легочном фиброзе и при COVID-19. Как пример дифференциальной диагностики кашля рассматривается клинический случай больного 47 лет, показывающий необходимость использования КТ-исследований не только в дебюте, на момент острого течения болезни, но и в период восстановления больных с длительным кашлем.
Ключевые слова: COVID-19, кашель, постковидный синдром, легочный фиброз.
Для цитирования: Попова Е.Н., Пономарева Л.А., Бондаренко И.Б. Актуальные проблемы дифференциальной диагностики и лечения кашля в период пандемии. Клинический разбор в общей медицине. 2021; 8: 20–26. DOI: 10.47407/kr2021.2.8.00094
Topical issues of differential diagnosis and treatment of cough during the pandemic
Elena N. Popova, Liubov A. Ponomareva, Inna B. Bondarenko
Abstract
A cough is observed by medical practitioners of various specialties, and is among the most common symptoms of the broad range of disorders. The cause of coughing remains unclear in more than half of adults, who visit physicians with complaints of respiratory symptoms. The paper reports the principles of the cough differential diagnosis and treatment in patients with respiratory disorders, including during the pandemic; the cough features, characteristic of pulmonary fibrosis and COVID-19, are discussed. The clinical case of the 47-year-old patient, illustrating the need to use CT not only at onset, during the acute period of the disease, but also during the recovery period in patients with a lingering cough, is discussed as an example of the cough differential diagnosis.
Key words: COVID-19, cough, post-COVID syndrome, pulmonary fibrosis, differential diagnosis of cough.
For citation: Popova E.N., Ponomareva L.A., Bondarenko I.B. Topical issues of differential diagnosis and treatment of cough during the pandemic. Clinical review for general practice. 2021; 8: 20–26. DOI: 10.47407/kr2021.2.8.00094
Кашель относится к одному из наиболее частых симптомов широкого спектра заболеваний и встречается в практике врачей различных направлений. Кашель возникает как при патологии легких, так и при патологии желудочно-кишечного тракта, сердечно-сосудистых нарушениях, является следствием побочного эффекта лекарств и т.д. [1].
Причины кашля:
• газы, пыль, продукты сгорания автомобильного топлива;
• курение;
• патология ЛОР-органов (ринит, сопровождающийся стеканием отделяемого носа по задней стенке глотки – postnasal drip syndrome, синуситы, фарингиты, ларингиты и т.д.);
• острая респираторная вирусная инфекция (ОРВИ), поражение бронхов и паренхимы легких, включая бронхиальную астму, хроническая обструктивная болезнь легких (ХОБЛ), рак, туберкулез и др.;
• патология сердечно-сосудистой системы, сопровождающаяся развитием сердечной недостаточности;
• патология желудочно-кишечного тракта, главным образом гастроэзофагеальная рефлюксная болезнь (ГЭРБ);
• нежелательные эффекты при приеме лекарственных веществ (ингибиторов ангиотензинпревращающего фермента – АПФ, амиодарона и др.), порошковых форм лекарственных препаратов, вдыхании кислорода;
• психоэмоциональные расстройства, в том числе психогенный (привычный) кашель.
Дифференциальная диагностика и лечение кашля сопровождаются значительными трудностями, так как инициирование и развитие кашлевого рефлекса связано с различными триггерами [2].
Более чем у половины взрослых, обращающихся к специалисту с респираторными жалобами, причина кашля остается нерасшифрованной [2]. В целом число лиц с кашлем увеличивается с возрастом, важными факторами риска являются курение, работа в условиях пылевых загрязнений, экологические факторы, наличие коморбидных состояний [3–5].
По продолжительности выделяют острый и хронический кашель. Кашель продолжительностью менее 3 нед определяется как острый, нередко данный симптом проходит самостоятельно. Согласно общепринятым представлениям кашель считается хроническим, если данный симптом сохраняется более 8 нед [1, 2]. Хронический кашель встречается при заболеваниях, вызванных курением, хронических бронхолегочных заболеваниях, гастроэзофагеальном рефлюксе, приеме препаратов (ингибиторы АПФ, цитостатики, НПВП). С другой стороны, даже у людей, выздоравливающих при ОРВИ и не имеющих хронических заболеваний, сухой неприятный кашель может сохраняться и оставаться единственным остаточным симптомом. В реальной практике у подавляющего большинства больных с хроническим кашлем в анамнезе всегда обнаруживается взаимосвязь начала или обострения данного симптома с эпизодом ОРВИ (см. таблицу). С начала пандемии кашель остается главным следствием ОРВИ, коронавирусной инфекции.
По своей сущности кашель – защитный сложнорефлекторный акт, направленный на удаление из дыхательных путей мокроты, частиц пыли и дыма. Кашель возникает при дисфункции дренажного механизма в дыхательных путях, что приводит к накоплению патологического содержимого в их просвете. У больных с поражением органов дыхания кашель возникает при раздражении рецепторов кашлевых рефлексогенных зон верхних и нижних отделов дыхательных путей.
Кашлевой рефлекс включает в себя 5 компонентов [1]:
1. Рецепторы блуждающего нерва в кашлевых рефлексогенных зонах (задняя поверхность надгортанника, передняя межчерпаловидная поверхность гортани, область голосовых складок и подскладочного пространства, бифуркация трахеи, устья долевых, сегментарных бронхов), которые стимулируются медиаторами воспаления.
2. Быстро реагирующие (ирритантные) рецепторы (между эпителиальными стенками воздухоносных путей), стимулирующиеся вдыханием пыли, газов, холодного воздуха, а также рецепторы, расположенные в области наружного уха, в слизистой оболочке носа, на плевре, диафрагмальном синусе, перикарде, пищеводе.
3. Кашлевой стимул передается на чувствительные ветви блуждающего нерва, передающие возбуждение в центр кашля. Кашлевой центр находится в продолговатом мозге, при участии полисинаптических связей ретикулярной формации организует сложноскоординированную реакцию мышц – эффекторов через эфферентные нервы.
4. Эфферентные нервы (глоссафарингеальный нерв, диафрагмальный нерв, тройничный нерв) передают импульс на мышцы-эффекторы (бронхов, гортани, грудной клетки, живота, диафрагмы), последние реагируют на импульс рефлекторным сокращением.
5. Основные раздражители кашлевых рецепторов: колебания температуры и влажности – холодный или сухой воздух, поллютанты (дым, пыль, крошки во вдыхаемом воздухе), мокрота, назальная слизь, аллергены, воспаление. Причинами кашля становятся аспирация инородного тела, давление опухоли, гипервентиляция, микроаспирация вследствие гастроэзофагеального рефлюкса [1, 2].
Особую группу как индукторы кашлевого толчка составляют ингибиторы ренин-ангиотензин-альдостероновой системы, β-адреноблокаторы, цитостатики и т.д. [6]. Формирование кашлевого рефлекса контролируется корой головного мозга, он может быть подавлен или вызван произвольно, раздражением рецепторов, расположенных вне органов дыхания.
Кашлевой порог имеет индивидуальные различия и может колебаться у одного и того же человека в различные фазы течения болезни. Частота и интенсивность кашля зависят не только от силы раздражителя и его локализации в органах дыхания, но и от возбудимости кашлевых рецепторов (кашлевого порога).
Кашель при острой респираторной вирусной инфекции
Пандемия во многом повлияла на общие признаки ОРВИ в целом, и прежде всего изменился кашель по частоте, продолжительности, взаимосвязи с хронологией заболевания.
Общие симптомы у госпитализированных пациентов включают жар (70–90%), сухой кашель (60–86%), одышку (53–80%), усталость (38%), миалгии (15–44%), тошноту/рвоту или диарею (15–39%), головную боль, слабость (25%) и ринорею (7%). Аносмия или агевзия могут быть единственным симптомом примерно у 3% людей с COVID-19 [7].
Общие лабораторные отклонения среди госпитализированных пациентов включают лимфопению (83%), повышенные воспалительные маркеры [например, скорость оседания эритроцитов, С-реактивный белок, ферритин, фактор некроза опухоли (ФНО)-α, интерлейкин (ИЛ)-1 и ИЛ-6] и аномальные параметры свертывания крови [например, пролонгированное протромбиновое время, тромбоцитопения, повышенный уровень D-димера (46% пациентов), низкий уровень фибриногена] [8].
Рентгенологические находки у людей с COVID-19 включают двусторонние инфильтраты с преобладанием нижних долей на рентгенографических изображениях грудной клетки и двусторонние, периферические помутнения нижних долей матового стекла и/или уплотнения на компьютерных томографических изображениях грудной клетки.
Общие осложнения среди госпитализированных пациентов с COVID-19 включают пневмонию (75%); острый респираторный дистресс-синдром (15%); острое повреждение печени, характеризующееся повышением уровня аспартатаминотрансферазы, аланинаминотрансферазы и билирубина (19%); сердечное повреждение, включая повышение уровня тропонина (7–17%), острую сердечную недостаточность, аритмии и миокардит; протромботическую коагулопатию, приводящую к венозным и артериальным тромбоэмболическим явлениям (10–25%); острое повреждение почек (9%); неврологические проявления, включая нарушение сознания (8%) и острые цереброваскулярные заболевания (3%) и шок (6%) [9].
Редкие осложнения среди тяжелобольных пациентов с COVID-19 включают цитокиновый шторм и синдром активации макрофагов (так называемый вторичный гемофагоцитарный лимфогистиоцитоз). COVID-19 отличается от других вирусных инфекций реакциями взаимодействия вируса с эпителием дыхательных путей, запускающих механизмы неконтролируемого выброса медиаторов повреждения.
Под влиянием вируса клетки высвобождают множество факторов роста и цитокинов, которые могут взаимодействовать с рецепторами и ионными каналами на периферических окончаниях сенсорных нервов дыхательных путей, вызывая кашель [10].
Повреждение эндотелия, вызванное либо вирусной инвазией, либо воспалением, повышение свертываемости крови, склонность к коагулопатии и тромбоэмболическим осложнениям, повреждение микроциркуляторного русла создают замкнутый круг воспаления в дыхательных путях, и, как следствие, – длительный кашель в разгаре заболевания и на этапе постковидных нарушений.
Молекулярный механизм, лежащий в основе клеточной инвазии SARS-CoV-2, связан с его способностью избирательно связываться с рецепторами АПФ2. Эти рецепторы активно экспрессируются во многих органах, таких как легкие, сердце, почки, кишечник и мозг. Рецепторы к АПФ расположены в эпителиальных клетках верхних и нижних дыхательных путей, и, помимо множества его функций, этот фермент регулирует концентрацию в слизистой оболочке провоспалительного пептида брадикинина [11]. Было высказано предположение, что неконтролируемое образование брадикинина при коронавирусной инфекции, а также колебания медиаторов воспаления в период цитокинового выброса вызывают длительное раздражение нейрональных окончаний, трансформируя кашель из респираторного симптома, по сути, в неврологический. Кашель сохраняется длительное время, а накопление медиаторов в головном мозге определяет интенсивность и частоту кашлевых толчков, может быть причиной серьезных системных последствий инфекции SARS-CoV-2.
Вирус может напрямую инфицировать нейроны на периферии или нейроны обонятельной чувствительности и, таким образом, использовать аксональный транспорт для получения доступа в центральную нервную систему. Экспериментальные исследования с использованием трансгенных мышей показали, что SARS-CoV-2 при интраназальном введении попадает в мозг, возможно, через обонятельные нервы, а затем быстро распространяется на некоторые области мозга (таламус, ствол мозга) [11, 12].
Следовательно, если репликация вируса в носу достаточно высока, возможно, что эти высокие титры вируса могут проникнуть в обонятельный нерв. Мазки из носа у пациентов с COVID-19 имеют более высокую вирусную нагрузку, чем мазки из горла, что позволяет предположить, что эти клетки могут быть локусами репликации вируса и возможными резервуарами для распространения в полости носа к обонятельному нерву [12].
В головном мозге AПФ2 присутствует на глиальных клетках, нейрональных окончаниях, эндотелии церебральных сосудов, в областях ствола мозга, которые влияют на кардиореспираторные функции. Экспериментальные исследования показали особую уязвимость гиппокампа с большей потерей нейронов в областях CA1 и CA3, что может быть напрямую связано с кашлем, потерей вкусовых и обонятельных ощущений, присоединением когнитивных и респираторных нарушений [13].
 Провоспалительные цитокины, среди которых лидируют в цепи межклеточных взаимодействий ИЛ-1β, ИЛ-6, ФНО-α и ИЛ-1, накапливаясь в легких, повреждают аэрогематический барьер, вызывая нарушение диффузии газов и респираторные проявления, включая кашель, одновременно с этим повышается проницаемость гематоэнцефалического барьера, что приводит к усилению и повторению кашлевого стимула [14].
Провоспалительные цитокины, среди которых лидируют в цепи межклеточных взаимодействий ИЛ-1β, ИЛ-6, ФНО-α и ИЛ-1, накапливаясь в легких, повреждают аэрогематический барьер, вызывая нарушение диффузии газов и респираторные проявления, включая кашель, одновременно с этим повышается проницаемость гематоэнцефалического барьера, что приводит к усилению и повторению кашлевого стимула [14].
Кашель при коронавирусной инфекции может сохраняться длительное время, и тогда заболевание трактуют как постковидный синдром. Были предложены различные механизмы для объяснения кашля после вирусных инфекций, и в частности при SARS-CoV-2. Клинические исследования, включающие провокацию капсаицином при кашле, распространенный метод измерения чувствительности кашлевого рефлекса, продемонстрировали, что кашлевой рефлекс повышается во время острой стадии ОРВИ и остается в течение месяца или более после разрешения вирусной инфекции [15, 16].
В исходе коронавирусной инфекции, особенно осложнившейся пневмонией, в легких возможно развитие фиброзных изменений [17]. При этом кашель приобретает признаки заболеваний из группы нозологий с прогрессирующим фиброзирующим фенотипом, определяемых, как и легочный фиброз.
Кашель при легочном фиброзе
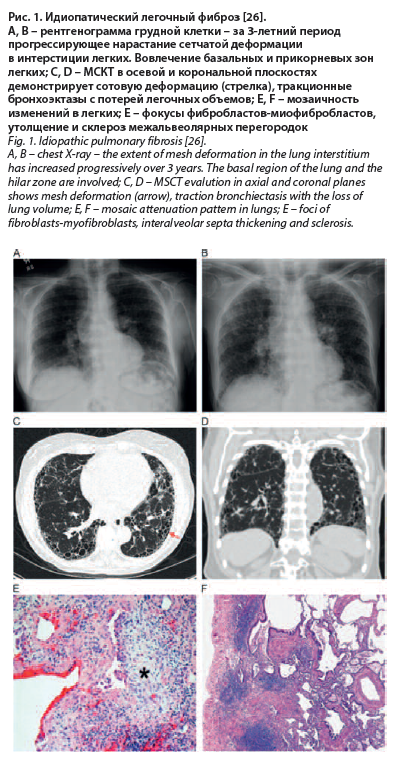
На современном этапе группа интерстициальных болезней легких объединяет более 200 острых и хронических заболеваний, характеризующихся повреждением, воспалением и фиброзом на территории аэрогематического барьера и отличающихся прогрессированием необратимых изменений в легких. В последнее время интерстициальные болезни легких стали обозначать как заболевания с прогрессирующим фиброзирующим фенотипом или прогрессирующий фиброз легких. Наиболее тяжелый вариант представлен идиопатическим легочным фиброзом, который по тяжести течения и количеству «потерь лет жизни» сравним с раком легкого (рис. 1). Близки по морфологическому субстрату поражения легких, обусловленные, например, иммунными нарушениями при ревматических заболеваниях, хотя и более благоприятны по прогнозу, но так же, как и идиопатичесий легочный фиброз, представляют значительный экономический и социальный ущерб по причине затрат на диагностику и лечение. Эти заболевания представляют большие трудности для диагностики, так как сходны по клинике, рентгенологическим признакам с болезнями легких микробной природы и, в особенности, с пневмониями или туберкулезом [18, 19].
Близки по морфологическому субстрату поражения легких, обусловленные, например, иммунными нарушениями при ревматических заболеваниях, хотя и более благоприятны по прогнозу, но так же, как и идиопатичесий легочный фиброз, представляют значительный экономический и социальный ущерб по причине затрат на диагностику и лечение. Эти заболевания представляют большие трудности для диагностики, так как сходны по клинике, рентгенологическим признакам с болезнями легких микробной природы и, в особенности, с пневмониями или туберкулезом [18, 19].
Клинический пример
О трудностях диагностики заболеваний легких из группы прогрессирующего фиброза легких свидетельствует следующее наблюдение.
Больной М., 47 лет, руководитель торгового предприятия. По роду профессии часто ездит в командировки по России, а также в районы Средней Азии. Заболел остро весной 2018 г. с приступообразного кашля, лихорадки до 39 °С, потливости, слабости, головной боли. При обследовании в клинической больнице г. Москвы выявлены диффузные пневмониеподобные инфильтраты в легких, усиление интерстициального рисунка, нарушение функции внешнего дыхания по рестриктивному типу со снижением показателей форсированной жизненной емкость легких до 60% от должного; увеличение СОЭ до 36 мм/ч; лейкоцитоз – до 9,8×103; умеренный сдвиг лейкоцитарной формулы влево; эозинофилы – до 6%; повышение антинуклеарного фактора – 1:320; снижение показателей сатурации до 92–94%. Через несколько недель от начала болезни лихорадка приняла волнообразное течение с пиками в первую половину дня до 40 °С. Проводились антибиотикотерапия и противотуберкулезная терапия без эффекта в общей сложности в течение месяца. Исследования маркеров вирусов гепатита В и С, обследования на предмет поиска других возбудителей инфекционных и паразитарных заболеваний оказались безуспешным. При проведении компьютерной томографии (КТ) были обнаружены: диссеминация с картиной «матового стекла», сетчатость легочного рисунка с деформацией бронхиального дерева, умеренно выраженным пневмосклерозом в периферической зоне легких (рис. 2); высказывались диагностические концепции интерстициальной болезни легких, васкулита, неоплазии. Для уточнения диагноза проведена торакоскопическая биопсия легкого. При последующем гистологическом исследовании материала легочных биопсий выявлены склероз межальвеолярных перегородок с участками инфильтрации лимфогистиоцитарными, десквамация альвеолярного эпителия и выявлены участки бронхиолярного эпителия с очагами плоскоклеточной метаплазии. На основании клинико-рентгенологической картины, иммунологических (повышение антинуклеарного фактора) и морфологических данных был установлен диагноз – «идиопатическая интерстициальная пневмония с аутоиммунными чертами». Начата терапия преднизолоном, в том числе с «пульсовым» введением глюкокортикостероидов. Состояние больного несколько улучшилось, снизилась температура, уменьшились кашель и одышка. При цитологическом изучении бронхоальвеолярного лаважа обнаружено преобладание нейтрофилов с примесью эозинофилов. При контрольной КТ легких установлена положительная динамика в виде снижения площади «матового стекла» и без убедительных признаков прогрессирования пневмосклероза. По причине сохраняющегося кашля пациент продолжал принимать мукоактивные препараты. Таким образом, диагноз заболевания был поставлен на основании сопоставления результатов морфологического исследования биоптатов легкого с клиническими и лабораторными данными.
Обсуждение
Следует отметить, что кашель при легочном фиброзе (интерстициальных пневмониях) сопровождается крепитацией. Крепитацию следует расценивать как наиболее достоверный клинический ориентир, указывающий на вовлечение легочного интерстиция. При идиопатических вариантах интерстициальных пневмоний крепитация имеет свои особенности: на ранней стадии выслушивается симметрично преимущественно над базальными отделами легких и по мере прогрессирования болезни распространяется постепенно на все легочные поля вплоть до верхушек легких. Грубая крепитация, выслушиваемая над ограниченными участками легких, исчезающая при глубоком дыхании и особенно сопровождающаяся хрипами, в большей степени относится к дыхательным шумам, возникающим в старческом легком, при пневмосклерозе в исходе хронической обструктивной болезни легких либо при инфекционных поражениях легких, в том числе и вирусной или бактериальной пневмонии [19].
Для решения проблем, возникающих в процессе установления диагноза и определения программы терапии важен мультидисциплинарный подход, предусматривающий участие специалистов по лучевой диагностике, торакальных хирургов, что позволяет рационально использовать методы обследования легких, и своевременно назначить обоснованную имунносупрессивную и антифиброгенную терапию [20].
Принципы терапии
Вне зависимости от природы заболевания принципы лечения кашля включают назначение неспецифических средств, направленных на поддержание мукоцилирного аппарата, обеспечение муколитического, противовоспалительного эффекта, когда контролируется не только один симптом, но и в целом клиническая картина заболевания. Постковидная астения как причина плохого сна, снижения качества жизни и работоспособности усугубляет также и тяжесть кашля за счет сохраняющейся активности медиаторов воспаления, продолжающих стимулировать кашлевые рецепторы. Это определяет необходимость использования препаратов, снижающих уровень брадикинина у больных с ОРВИ и улучшающих когнитивные функции, оказывающих нейропротективное действие на головной мозг (Ренгалин, среди новых разработок – препарат Проспекта) [21].
В последнее время все шире применяются комбинированные препараты, улучшающие легочный клиренс, в состав которых входят амброксол, а также растительный компонент и сальбутамол. Проведенное в реальной клинической практике рандомизированное исследование по сравнительной оценке назначения муколитика/β2-агониста или одного муколитика (амброксол) для лечения кашля при вирусных инфекциях (препарат содержит 30,0 мг амброксола гидрохлорида, 100 мг гвайфенезина, 2,4 мг сальбутамола сульфата [2,0 мг в пересчете на сальбутамол]) показало, что кашель сохранялся у больных относительно недолго. К концу наблюдения в группе, принимавшей амброксол в сочетании с сальбутамолом, кашляющих больных было значительно меньше. В группе, принимавшей амброксол в комбинации с растительными компонентами, этот показатель составил 10,6±3,7 дня, в группе сравнения – 13,4±2,8 дня. Отсутствие динамики изменения артериального давления в обеих группах продемонстрировало, что сальбутамол не вызывал подъема артериального давления, что доказывает безопасность препарата при терапии кашля любой природы.
Амброксол увеличивает синтез сурфактанта и уменьшает его распад в легочной ткани [21], что снижает адгезивность внутрибронхиального секрета и, следовательно, облегчает отхождение слизи [22].
Амброксол помимо мукокинетического и секретолитического действия оказывает противовоспалительный, антиоксидантный и местный анестетический эффект [18]. Увеличение уровня эндогенных ингибиторов протеаз в бронхиальном секрете в ранней фазе вирусной инфекции, стимуляция выработки сурфактанта, иммуноглобулинов А и G объясняют противовирусное, иммуномодулирующее свойство препарата [23, 24, 25].
Заключение
Таким образом, рациональная терапия кашля в современной популяции основана на принципе комплексного воздействия на органы дыхания, когда мишенями становятся не только дыхательные пути, но и механизмы, реализующие кашлевой рефлекс посредством мукоактивных и нейротропных влияний.
Вовлечение легочного интерстиция при большинстве вирусных инфекций определяет необходимость использования КТ-исследований не только в дебюте, на момент острого течения болезни, но и в период восстановления больных с длительным кашлем и особенно при наличии коморбидных состояний, на фоне уже существовавшей ранее патологии легких.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declares that there is not conflict of interests.
Попова Елена Николаевна – д-р мед. наук, проф. каф. внутренних, профессиональных болезней и ревматологии, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: ela12@yandex.ru
Elena N. Popova – D. Sci. (Med.), Prof., Sechenov First Moscow State Medical University (Sechenov University). E-mail: ela12@yandex.ru
Пономарева Любовь Андреевна – студент, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет).
E-mail: liubaponomareva18@yandex.ru
Liubov A. Ponomareva – Student, Sechenov First Moscow State Medical University (Sechenov University).
E-mail: liubaponomareva18@yandex.ru
Бондаренко Инна Борисовна – канд. мед. наук, ассистент каф. внутренних, профессиональных болезней и ревматологии, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет)
Inna B. Bondarenko – Cand. Sci. (Med.), Sechenov First Moscow State Medical University (Sechenov University)
Статья поступила в редакцию / The article received: 02.11.2021
Статья принята к печати / The article approved for publication: 04.11.2021
Elena N. Popova, Liubov A. Ponomareva, Inna B. Bondarenko
Abstract
A cough is observed by medical practitioners of various specialties, and is among the most common symptoms of the broad range of disorders. The cause of coughing remains unclear in more than half of adults, who visit physicians with complaints of respiratory symptoms. The paper reports the principles of the cough differential diagnosis and treatment in patients with respiratory disorders, including during the pandemic; the cough features, characteristic of pulmonary fibrosis and COVID-19, are discussed. The clinical case of the 47-year-old patient, illustrating the need to use CT not only at onset, during the acute period of the disease, but also during the recovery period in patients with a lingering cough, is discussed as an example of the cough differential diagnosis.
Key words: COVID-19, cough, post-COVID syndrome, pulmonary fibrosis, differential diagnosis of cough.
For citation: Popova E.N., Ponomareva L.A., Bondarenko I.B. Topical issues of differential diagnosis and treatment of cough during the pandemic. Clinical review for general practice. 2021; 8: 20–26. DOI: 10.47407/kr2021.2.8.00094
Кашель относится к одному из наиболее частых симптомов широкого спектра заболеваний и встречается в практике врачей различных направлений. Кашель возникает как при патологии легких, так и при патологии желудочно-кишечного тракта, сердечно-сосудистых нарушениях, является следствием побочного эффекта лекарств и т.д. [1].
Причины кашля:
• газы, пыль, продукты сгорания автомобильного топлива;
• курение;
• патология ЛОР-органов (ринит, сопровождающийся стеканием отделяемого носа по задней стенке глотки – postnasal drip syndrome, синуситы, фарингиты, ларингиты и т.д.);
• острая респираторная вирусная инфекция (ОРВИ), поражение бронхов и паренхимы легких, включая бронхиальную астму, хроническая обструктивная болезнь легких (ХОБЛ), рак, туберкулез и др.;
• патология сердечно-сосудистой системы, сопровождающаяся развитием сердечной недостаточности;
• патология желудочно-кишечного тракта, главным образом гастроэзофагеальная рефлюксная болезнь (ГЭРБ);
• нежелательные эффекты при приеме лекарственных веществ (ингибиторов ангиотензинпревращающего фермента – АПФ, амиодарона и др.), порошковых форм лекарственных препаратов, вдыхании кислорода;
• психоэмоциональные расстройства, в том числе психогенный (привычный) кашель.
Дифференциальная диагностика и лечение кашля сопровождаются значительными трудностями, так как инициирование и развитие кашлевого рефлекса связано с различными триггерами [2].
Более чем у половины взрослых, обращающихся к специалисту с респираторными жалобами, причина кашля остается нерасшифрованной [2]. В целом число лиц с кашлем увеличивается с возрастом, важными факторами риска являются курение, работа в условиях пылевых загрязнений, экологические факторы, наличие коморбидных состояний [3–5].
По продолжительности выделяют острый и хронический кашель. Кашель продолжительностью менее 3 нед определяется как острый, нередко данный симптом проходит самостоятельно. Согласно общепринятым представлениям кашель считается хроническим, если данный симптом сохраняется более 8 нед [1, 2]. Хронический кашель встречается при заболеваниях, вызванных курением, хронических бронхолегочных заболеваниях, гастроэзофагеальном рефлюксе, приеме препаратов (ингибиторы АПФ, цитостатики, НПВП). С другой стороны, даже у людей, выздоравливающих при ОРВИ и не имеющих хронических заболеваний, сухой неприятный кашель может сохраняться и оставаться единственным остаточным симптомом. В реальной практике у подавляющего большинства больных с хроническим кашлем в анамнезе всегда обнаруживается взаимосвязь начала или обострения данного симптома с эпизодом ОРВИ (см. таблицу). С начала пандемии кашель остается главным следствием ОРВИ, коронавирусной инфекции.
По своей сущности кашель – защитный сложнорефлекторный акт, направленный на удаление из дыхательных путей мокроты, частиц пыли и дыма. Кашель возникает при дисфункции дренажного механизма в дыхательных путях, что приводит к накоплению патологического содержимого в их просвете. У больных с поражением органов дыхания кашель возникает при раздражении рецепторов кашлевых рефлексогенных зон верхних и нижних отделов дыхательных путей.
Кашлевой рефлекс включает в себя 5 компонентов [1]:
1. Рецепторы блуждающего нерва в кашлевых рефлексогенных зонах (задняя поверхность надгортанника, передняя межчерпаловидная поверхность гортани, область голосовых складок и подскладочного пространства, бифуркация трахеи, устья долевых, сегментарных бронхов), которые стимулируются медиаторами воспаления.
2. Быстро реагирующие (ирритантные) рецепторы (между эпителиальными стенками воздухоносных путей), стимулирующиеся вдыханием пыли, газов, холодного воздуха, а также рецепторы, расположенные в области наружного уха, в слизистой оболочке носа, на плевре, диафрагмальном синусе, перикарде, пищеводе.
3. Кашлевой стимул передается на чувствительные ветви блуждающего нерва, передающие возбуждение в центр кашля. Кашлевой центр находится в продолговатом мозге, при участии полисинаптических связей ретикулярной формации организует сложноскоординированную реакцию мышц – эффекторов через эфферентные нервы.
4. Эфферентные нервы (глоссафарингеальный нерв, диафрагмальный нерв, тройничный нерв) передают импульс на мышцы-эффекторы (бронхов, гортани, грудной клетки, живота, диафрагмы), последние реагируют на импульс рефлекторным сокращением.
5. Основные раздражители кашлевых рецепторов: колебания температуры и влажности – холодный или сухой воздух, поллютанты (дым, пыль, крошки во вдыхаемом воздухе), мокрота, назальная слизь, аллергены, воспаление. Причинами кашля становятся аспирация инородного тела, давление опухоли, гипервентиляция, микроаспирация вследствие гастроэзофагеального рефлюкса [1, 2].
Особую группу как индукторы кашлевого толчка составляют ингибиторы ренин-ангиотензин-альдостероновой системы, β-адреноблокаторы, цитостатики и т.д. [6]. Формирование кашлевого рефлекса контролируется корой головного мозга, он может быть подавлен или вызван произвольно, раздражением рецепторов, расположенных вне органов дыхания.
Кашлевой порог имеет индивидуальные различия и может колебаться у одного и того же человека в различные фазы течения болезни. Частота и интенсивность кашля зависят не только от силы раздражителя и его локализации в органах дыхания, но и от возбудимости кашлевых рецепторов (кашлевого порога).
Кашель при острой респираторной вирусной инфекции
Пандемия во многом повлияла на общие признаки ОРВИ в целом, и прежде всего изменился кашель по частоте, продолжительности, взаимосвязи с хронологией заболевания.
Общие симптомы у госпитализированных пациентов включают жар (70–90%), сухой кашель (60–86%), одышку (53–80%), усталость (38%), миалгии (15–44%), тошноту/рвоту или диарею (15–39%), головную боль, слабость (25%) и ринорею (7%). Аносмия или агевзия могут быть единственным симптомом примерно у 3% людей с COVID-19 [7].
Общие лабораторные отклонения среди госпитализированных пациентов включают лимфопению (83%), повышенные воспалительные маркеры [например, скорость оседания эритроцитов, С-реактивный белок, ферритин, фактор некроза опухоли (ФНО)-α, интерлейкин (ИЛ)-1 и ИЛ-6] и аномальные параметры свертывания крови [например, пролонгированное протромбиновое время, тромбоцитопения, повышенный уровень D-димера (46% пациентов), низкий уровень фибриногена] [8].
Рентгенологические находки у людей с COVID-19 включают двусторонние инфильтраты с преобладанием нижних долей на рентгенографических изображениях грудной клетки и двусторонние, периферические помутнения нижних долей матового стекла и/или уплотнения на компьютерных томографических изображениях грудной клетки.
Общие осложнения среди госпитализированных пациентов с COVID-19 включают пневмонию (75%); острый респираторный дистресс-синдром (15%); острое повреждение печени, характеризующееся повышением уровня аспартатаминотрансферазы, аланинаминотрансферазы и билирубина (19%); сердечное повреждение, включая повышение уровня тропонина (7–17%), острую сердечную недостаточность, аритмии и миокардит; протромботическую коагулопатию, приводящую к венозным и артериальным тромбоэмболическим явлениям (10–25%); острое повреждение почек (9%); неврологические проявления, включая нарушение сознания (8%) и острые цереброваскулярные заболевания (3%) и шок (6%) [9].
Редкие осложнения среди тяжелобольных пациентов с COVID-19 включают цитокиновый шторм и синдром активации макрофагов (так называемый вторичный гемофагоцитарный лимфогистиоцитоз). COVID-19 отличается от других вирусных инфекций реакциями взаимодействия вируса с эпителием дыхательных путей, запускающих механизмы неконтролируемого выброса медиаторов повреждения.
Под влиянием вируса клетки высвобождают множество факторов роста и цитокинов, которые могут взаимодействовать с рецепторами и ионными каналами на периферических окончаниях сенсорных нервов дыхательных путей, вызывая кашель [10].
Повреждение эндотелия, вызванное либо вирусной инвазией, либо воспалением, повышение свертываемости крови, склонность к коагулопатии и тромбоэмболическим осложнениям, повреждение микроциркуляторного русла создают замкнутый круг воспаления в дыхательных путях, и, как следствие, – длительный кашель в разгаре заболевания и на этапе постковидных нарушений.
Молекулярный механизм, лежащий в основе клеточной инвазии SARS-CoV-2, связан с его способностью избирательно связываться с рецепторами АПФ2. Эти рецепторы активно экспрессируются во многих органах, таких как легкие, сердце, почки, кишечник и мозг. Рецепторы к АПФ расположены в эпителиальных клетках верхних и нижних дыхательных путей, и, помимо множества его функций, этот фермент регулирует концентрацию в слизистой оболочке провоспалительного пептида брадикинина [11]. Было высказано предположение, что неконтролируемое образование брадикинина при коронавирусной инфекции, а также колебания медиаторов воспаления в период цитокинового выброса вызывают длительное раздражение нейрональных окончаний, трансформируя кашель из респираторного симптома, по сути, в неврологический. Кашель сохраняется длительное время, а накопление медиаторов в головном мозге определяет интенсивность и частоту кашлевых толчков, может быть причиной серьезных системных последствий инфекции SARS-CoV-2.
Вирус может напрямую инфицировать нейроны на периферии или нейроны обонятельной чувствительности и, таким образом, использовать аксональный транспорт для получения доступа в центральную нервную систему. Экспериментальные исследования с использованием трансгенных мышей показали, что SARS-CoV-2 при интраназальном введении попадает в мозг, возможно, через обонятельные нервы, а затем быстро распространяется на некоторые области мозга (таламус, ствол мозга) [11, 12].
Следовательно, если репликация вируса в носу достаточно высока, возможно, что эти высокие титры вируса могут проникнуть в обонятельный нерв. Мазки из носа у пациентов с COVID-19 имеют более высокую вирусную нагрузку, чем мазки из горла, что позволяет предположить, что эти клетки могут быть локусами репликации вируса и возможными резервуарами для распространения в полости носа к обонятельному нерву [12].
В головном мозге AПФ2 присутствует на глиальных клетках, нейрональных окончаниях, эндотелии церебральных сосудов, в областях ствола мозга, которые влияют на кардиореспираторные функции. Экспериментальные исследования показали особую уязвимость гиппокампа с большей потерей нейронов в областях CA1 и CA3, что может быть напрямую связано с кашлем, потерей вкусовых и обонятельных ощущений, присоединением когнитивных и респираторных нарушений [13].
Кашель при коронавирусной инфекции может сохраняться длительное время, и тогда заболевание трактуют как постковидный синдром. Были предложены различные механизмы для объяснения кашля после вирусных инфекций, и в частности при SARS-CoV-2. Клинические исследования, включающие провокацию капсаицином при кашле, распространенный метод измерения чувствительности кашлевого рефлекса, продемонстрировали, что кашлевой рефлекс повышается во время острой стадии ОРВИ и остается в течение месяца или более после разрешения вирусной инфекции [15, 16].
В исходе коронавирусной инфекции, особенно осложнившейся пневмонией, в легких возможно развитие фиброзных изменений [17]. При этом кашель приобретает признаки заболеваний из группы нозологий с прогрессирующим фиброзирующим фенотипом, определяемых, как и легочный фиброз.
Кашель при легочном фиброзе
На современном этапе группа интерстициальных болезней легких объединяет более 200 острых и хронических заболеваний, характеризующихся повреждением, воспалением и фиброзом на территории аэрогематического барьера и отличающихся прогрессированием необратимых изменений в легких. В последнее время интерстициальные болезни легких стали обозначать как заболевания с прогрессирующим фиброзирующим фенотипом или прогрессирующий фиброз легких. Наиболее тяжелый вариант представлен идиопатическим легочным фиброзом, который по тяжести течения и количеству «потерь лет жизни» сравним с раком легкого (рис. 1).
Клинический пример
О трудностях диагностики заболеваний легких из группы прогрессирующего фиброза легких свидетельствует следующее наблюдение.
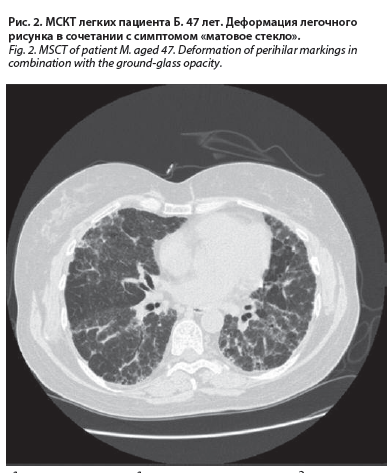
Больной М., 47 лет, руководитель торгового предприятия. По роду профессии часто ездит в командировки по России, а также в районы Средней Азии. Заболел остро весной 2018 г. с приступообразного кашля, лихорадки до 39 °С, потливости, слабости, головной боли. При обследовании в клинической больнице г. Москвы выявлены диффузные пневмониеподобные инфильтраты в легких, усиление интерстициального рисунка, нарушение функции внешнего дыхания по рестриктивному типу со снижением показателей форсированной жизненной емкость легких до 60% от должного; увеличение СОЭ до 36 мм/ч; лейкоцитоз – до 9,8×103; умеренный сдвиг лейкоцитарной формулы влево; эозинофилы – до 6%; повышение антинуклеарного фактора – 1:320; снижение показателей сатурации до 92–94%. Через несколько недель от начала болезни лихорадка приняла волнообразное течение с пиками в первую половину дня до 40 °С. Проводились антибиотикотерапия и противотуберкулезная терапия без эффекта в общей сложности в течение месяца. Исследования маркеров вирусов гепатита В и С, обследования на предмет поиска других возбудителей инфекционных и паразитарных заболеваний оказались безуспешным. При проведении компьютерной томографии (КТ) были обнаружены: диссеминация с картиной «матового стекла», сетчатость легочного рисунка с деформацией бронхиального дерева, умеренно выраженным пневмосклерозом в периферической зоне легких (рис. 2); высказывались диагностические концепции интерстициальной болезни легких, васкулита, неоплазии. Для уточнения диагноза проведена торакоскопическая биопсия легкого. При последующем гистологическом исследовании материала легочных биопсий выявлены склероз межальвеолярных перегородок с участками инфильтрации лимфогистиоцитарными, десквамация альвеолярного эпителия и выявлены участки бронхиолярного эпителия с очагами плоскоклеточной метаплазии. На основании клинико-рентгенологической картины, иммунологических (повышение антинуклеарного фактора) и морфологических данных был установлен диагноз – «идиопатическая интерстициальная пневмония с аутоиммунными чертами». Начата терапия преднизолоном, в том числе с «пульсовым» введением глюкокортикостероидов. Состояние больного несколько улучшилось, снизилась температура, уменьшились кашель и одышка. При цитологическом изучении бронхоальвеолярного лаважа обнаружено преобладание нейтрофилов с примесью эозинофилов. При контрольной КТ легких установлена положительная динамика в виде снижения площади «матового стекла» и без убедительных признаков прогрессирования пневмосклероза. По причине сохраняющегося кашля пациент продолжал принимать мукоактивные препараты. Таким образом, диагноз заболевания был поставлен на основании сопоставления результатов морфологического исследования биоптатов легкого с клиническими и лабораторными данными.
Обсуждение
Следует отметить, что кашель при легочном фиброзе (интерстициальных пневмониях) сопровождается крепитацией. Крепитацию следует расценивать как наиболее достоверный клинический ориентир, указывающий на вовлечение легочного интерстиция. При идиопатических вариантах интерстициальных пневмоний крепитация имеет свои особенности: на ранней стадии выслушивается симметрично преимущественно над базальными отделами легких и по мере прогрессирования болезни распространяется постепенно на все легочные поля вплоть до верхушек легких. Грубая крепитация, выслушиваемая над ограниченными участками легких, исчезающая при глубоком дыхании и особенно сопровождающаяся хрипами, в большей степени относится к дыхательным шумам, возникающим в старческом легком, при пневмосклерозе в исходе хронической обструктивной болезни легких либо при инфекционных поражениях легких, в том числе и вирусной или бактериальной пневмонии [19].
Для решения проблем, возникающих в процессе установления диагноза и определения программы терапии важен мультидисциплинарный подход, предусматривающий участие специалистов по лучевой диагностике, торакальных хирургов, что позволяет рационально использовать методы обследования легких, и своевременно назначить обоснованную имунносупрессивную и антифиброгенную терапию [20].
Принципы терапии
Вне зависимости от природы заболевания принципы лечения кашля включают назначение неспецифических средств, направленных на поддержание мукоцилирного аппарата, обеспечение муколитического, противовоспалительного эффекта, когда контролируется не только один симптом, но и в целом клиническая картина заболевания. Постковидная астения как причина плохого сна, снижения качества жизни и работоспособности усугубляет также и тяжесть кашля за счет сохраняющейся активности медиаторов воспаления, продолжающих стимулировать кашлевые рецепторы. Это определяет необходимость использования препаратов, снижающих уровень брадикинина у больных с ОРВИ и улучшающих когнитивные функции, оказывающих нейропротективное действие на головной мозг (Ренгалин, среди новых разработок – препарат Проспекта) [21].
В последнее время все шире применяются комбинированные препараты, улучшающие легочный клиренс, в состав которых входят амброксол, а также растительный компонент и сальбутамол. Проведенное в реальной клинической практике рандомизированное исследование по сравнительной оценке назначения муколитика/β2-агониста или одного муколитика (амброксол) для лечения кашля при вирусных инфекциях (препарат содержит 30,0 мг амброксола гидрохлорида, 100 мг гвайфенезина, 2,4 мг сальбутамола сульфата [2,0 мг в пересчете на сальбутамол]) показало, что кашель сохранялся у больных относительно недолго. К концу наблюдения в группе, принимавшей амброксол в сочетании с сальбутамолом, кашляющих больных было значительно меньше. В группе, принимавшей амброксол в комбинации с растительными компонентами, этот показатель составил 10,6±3,7 дня, в группе сравнения – 13,4±2,8 дня. Отсутствие динамики изменения артериального давления в обеих группах продемонстрировало, что сальбутамол не вызывал подъема артериального давления, что доказывает безопасность препарата при терапии кашля любой природы.
Амброксол увеличивает синтез сурфактанта и уменьшает его распад в легочной ткани [21], что снижает адгезивность внутрибронхиального секрета и, следовательно, облегчает отхождение слизи [22].
Амброксол помимо мукокинетического и секретолитического действия оказывает противовоспалительный, антиоксидантный и местный анестетический эффект [18]. Увеличение уровня эндогенных ингибиторов протеаз в бронхиальном секрете в ранней фазе вирусной инфекции, стимуляция выработки сурфактанта, иммуноглобулинов А и G объясняют противовирусное, иммуномодулирующее свойство препарата [23, 24, 25].
Заключение
Таким образом, рациональная терапия кашля в современной популяции основана на принципе комплексного воздействия на органы дыхания, когда мишенями становятся не только дыхательные пути, но и механизмы, реализующие кашлевой рефлекс посредством мукоактивных и нейротропных влияний.
Вовлечение легочного интерстиция при большинстве вирусных инфекций определяет необходимость использования КТ-исследований не только в дебюте, на момент острого течения болезни, но и в период восстановления больных с длительным кашлем и особенно при наличии коморбидных состояний, на фоне уже существовавшей ранее патологии легких.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declares that there is not conflict of interests.
Попова Елена Николаевна – д-р мед. наук, проф. каф. внутренних, профессиональных болезней и ревматологии, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: ela12@yandex.ru
Elena N. Popova – D. Sci. (Med.), Prof., Sechenov First Moscow State Medical University (Sechenov University). E-mail: ela12@yandex.ru
Пономарева Любовь Андреевна – студент, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет).
E-mail: liubaponomareva18@yandex.ru
Liubov A. Ponomareva – Student, Sechenov First Moscow State Medical University (Sechenov University).
E-mail: liubaponomareva18@yandex.ru
Бондаренко Инна Борисовна – канд. мед. наук, ассистент каф. внутренних, профессиональных болезней и ревматологии, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет)
Inna B. Bondarenko – Cand. Sci. (Med.), Sechenov First Moscow State Medical University (Sechenov University)
Статья поступила в редакцию / The article received: 02.11.2021
Статья принята к печати / The article approved for publication: 04.11.2021
26 октября 2021
Количество просмотров: 3025


