Клинический разбор в общей медицине №08 2021
Клинический разбор в общей медицине №08 2021
Не все гипохромные анемии – железодефицитные. Клиническое наблюдение
Аннотация
Клиническое наблюдение больной гипохромной анемией, получавшей длительное время препараты железа по поводу железодефицитной анемии. В связи с неэффективностью лечения проведено электрофоретическое исследование гемоглобина и диагностирована
β-талассемия (малая форма). Приводятся краткие данные о β-талассемии и подходы к дифференциальной диагностике при гипохромных анемиях.
Ключевые слова: гипохромная анемия, железодефицитная анемия, гемоглобинопатии, β-талассемия, электрофорез гемоглобина.
Для цитирования: Дворецкий Л.И., Асанов А.Ю., Папко К.С., Туаева М.Г. Не все гипохромные анемии – железодефицитные. Клиническое наблюдение. Клинический разбор в общей медицине. 2021; 8: 42–46. DOI: 10.47407/kr2021.2.8.00099
Клиническое наблюдение больной гипохромной анемией, получавшей длительное время препараты железа по поводу железодефицитной анемии. В связи с неэффективностью лечения проведено электрофоретическое исследование гемоглобина и диагностирована
β-талассемия (малая форма). Приводятся краткие данные о β-талассемии и подходы к дифференциальной диагностике при гипохромных анемиях.
Ключевые слова: гипохромная анемия, железодефицитная анемия, гемоглобинопатии, β-талассемия, электрофорез гемоглобина.
Для цитирования: Дворецкий Л.И., Асанов А.Ю., Папко К.С., Туаева М.Г. Не все гипохромные анемии – железодефицитные. Клиническое наблюдение. Клинический разбор в общей медицине. 2021; 8: 42–46. DOI: 10.47407/kr2021.2.8.00099
Not every hypochromic anemia is an iron deficiency anemia. Case study
Leonid I. Dvoretsky, Alii Yu. Asanov, Kira S. Papko, Margarita G. Tuaeva
Abstract
Case study of female patient with hypochromic anemia, who has been treated with iron preparations for iron deficiency anemia for a long time, is reported. A hemoglobin electrophoresis test has been performed due to treatment failure, and β-thalassemia (thalassemia minor) has been diagnosed. The data on β-thalassemia and approaches to differential diagnosis of hypochromic anemias are summarized.
Key words: hypochromic anemia, iron deficiency anemia, hemoglobinopathies, β-thalassemia, hemoglobin electrophoresis.
For citation: Dvoretsky L.I., Asanov A.Yu., Papko K.S., Tuaeva M.G. Not every hypochromic anemia is an iron deficiency anemia. Case study. Clinical review for general practice. 2021; 8: 42–46. DOI: 10.47407/kr2021.2.8.00099
Гипохромные анемии, являющиеся одним из частых гематологических синдромов в клинической практике, чаще всего ассоциируются с железодефицитной анемией (ЖДА). Однако в основе развития гипохромных анемией могут лежать другие патогенетические механизмы, не связанные с дефицитом железа.
К ним относятся нарушение включения железа в молекулу гемоглобина (сидероахрестические анемии), перераспределение железа в клетки макрофагальной системы при воспалительных процессах (анемии воспаления), нарушение синтеза цепей глобина или его структуры (наследственные гемоглобинопатии).
Несвоевременное распознавание этих состояний (недостаточная осведомленность врачей, трудности диагностики, атипичность течения и др.) и ошибочная трактовка гипохромной анемии как ЖДА (преобладание среди гипохромных анемий) влечет за собой назначение препаратов железа (ПЖ), неэффективных и противопоказанных данной категории пациентов.
Одной из редких причин развития гипохромных анемий являются гемоглобинопатии – генетически гетерогенная и клинически полиморфная группа наследственных нарушений синтеза глобина. В настоящее время, по крайней мере, 300 млн человек (или более 5% населения планеты) являются носителями потенциально патологических генов гемоглобинопатий. Наиболее значимой в клиническом и эпидемиологическом отношении патологией среди гемоглобинопатий является талассемия – группа аутосомно-рецессивно наследуемых болезней, характеризующихся нарушением синтеза полипептидных цепей гемоглобина. Каждая молекула гемоглобина представляет собой тетрамер и образована двумя парами гемоглобиновых цепей:
α-глобиновых и β-глобиновых. Синтез этих цепей контролируется двумя кластерами, расположенных в
16 (кластер α-генов) и 11 (кластер β-генов) хромосомах соответственно. В основе патогенеза талассемии лежит дисбаланс субъединиц глобина, причем степень дисбаланса пропорциональна тяжести болезни. Наиболее распространенными формами являются α- и β-талассемия.
α-Талассемия в большинстве случаев обусловлена делецией одного или двух генов (в одной хромосоме два гена α-глобина), реже – неделеционной мутацией. Клиническая картина и тяжесть заболевания определяется числом пораженных генов.
β-Талассемия, напротив, возникает чаще всего в результате неделеционных (точечных) мутаций, что приводит к снижению или полному отсутствию синтеза
β цепей глобина (в одной хромосоме расположен один ген β-глобина). Существует два варианта β-талассемии – большая талассемия (наиболее тяжелая форма заболевания), возникающая при наличии мутаций в обоих аллелях гена β-глобина и малая β-талассемия (легко протекающая и не требующая лечения), связанная с мутацией в одном из аллелей гена β-глобина. Современное название болезнь получила в 1933 г. и происходит от греческих слов thalassa (море) и haima (кровь) в связи с тем, что заболевание особенно часто регистрировалось в странах Средиземноморья (Греция и Италия). Наиболее распространена β-талассемия в регионах эндемичных по малярии, вызванной Plasmodium falciparum, включая Средиземноморье, северную Африку, регионы Ближнего Востока, Индию, Юго-Восточную Азию и южные районы Китая. Высокие частоты β-талассемии регистрируются в Дагестане и в бывших республиках СССР (Азербайджан, Узбекистан, Таджикистан). Частота носителей β-талассемии в этих областях варьирует от 1 до 20%. По оценкам, в мире насчитывается 270 млн носителей аномальных гемоглобинов и талассемии, из которых 80 млн являются носителями β-талассемии. Ежегодно рождается от 300 тыс. до 400 тыс. детей с серьезным нарушением гемоглобина (23 тыс. с большой β-талассемией) и до 90% этих родов происходят в странах с низким или средним уровнем дохода [1]. Миграция населения и смешанные браки между различными этническими группами привели к возникновению талассемии почти во всех странах мира, включая Северную Европу, где талассемия ранее отсутствовала. По современным оценкам, около 1,5% мирового населения (от 80 до 90 млн человек) являются носителями
β-талассемии. Общая ежегодная заболеваемость β-талассемией с наличием симптомов составляет 1/100 000 во всем мире и 1/10 000 человек в странах Евросоюза [2].
Распространенность анемий, связанных с талассемией в некоторых регионах превышает частоту ЖДА. Так, в одной из провинций Северного Таиланда среди гипохромных анемий соотношение диагностированных ЖДА, талассемий и сочетания ЖДА с талассемией составляло 10,2%, 53,8% и 30,8%, а в другой провинции – 7,7%, 67,3% и 9,6% соответственно [3]. При обследовании жителей филиппинской столицы Манилы с наличием анемии установлено, что ЖДА и гемоглобинопатии, в том числе талассемия, диагностировались в 37,6% и 27,8% случаев, в то время как у 34,7% лиц выявлялись другие причины анемии. У больных с талассемией отмечалась умеренно выраженная анемия с нормальным или повышенным содержанием сывороточного железа [4].
Клинически различают тяжелую, промежуточную и малую β-талассемию. Тяжелая форма протекает в виде выраженной анемии (Hb<60 г/л), высокой потребности в постоянных гемотрансфузиях. Нелеченые или неадекватно леченные больные обычно погибают в первом или втором десятилетии жизни [5]. Промежуточная форма обычно гомозиготна. Уровень гемоглобина может колебаться в пределах 60–100 г/л, однако клиническая картина весьма вариабельна. При этом наблюдается умеренная или тяжелая микроцитарная гипохромная анемия с признаками гемолиза. У некоторых больных с гомозиготной формой отсутствуют признаки тяжелой патологии, анемия умеренно выражена, что не требует постоянных гемотрансфузий. Малая
β-талассемия проявляется умеренно выраженной гипохромной микроцитарной анемией
Поскольку основой лечения большинства больных талассемией является трансфузионная терапия, а потребность в трансфузиях эритроцитов косвенно отражает тяжесть заболевания, выделяют трансфузионно-зависимую и трансфузионно-независимую талассемию. Однако два этих состояния могут быть непостоянными и отражают текущее состояние пациента [6].
В клинической практике наиболее частые трудности и ошибки в диагностике возникают у больных малой
β-талассемией, проявляющейся умеренно выраженной гипохромной анемией при отсутствии других признаков заболевания. Неправильная трактовка причины гипохромной анемии и ошибочная диагностика ЖДА влечет за собой неоправданные обследования и назначение ПЖ, что, кроме неэффективности лечения, может иметь негативные последствия для больных талассемией [7].
В качестве иллюстрации ошибочной диагностики ЖДА у больной β-талассемией приводим клиническое наблюдение.
Больная А., 63 года, обратилась с жалобами на слабость, головокружение. По данным анамнеза, в возрасте 23 лет во время беременности впервые было выявлено снижение содержания гемоглобина до 60 г/л, диагностирована ЖДА и назначены ПЖ. После родов отмечено повышение показателей гемоглобина, не достигавших, однако, нормальных величин. В дальнейшем в анализах периферической крови постоянно выявлялась гипохромная микроцитарная анемия, рефрактерная к лечению ПЖ. При периодически проводившихся обследованиях причину анемии выявить не удавалось, что наряду с отсутствием эффекта от длительной ферротерапии побудило врачей пересмотреть диагноз ЖДА. Было проведено электрофоретическое исследование гемоглобина
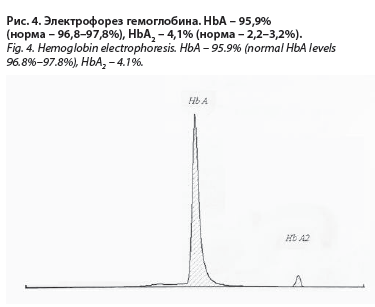
(Гематологический центр Минздрава России), по данным которого выявлено повышение уровня HbA2
(см. рис. 4) до 4,1% (норма 2,2–3,2%). Полученные результаты позволили диагностировать β-талассемию. В дополнение к анамнезу установлено, что мать пациентки также страдала анемией, природа которой осталась неясной. Для верификации формы гемоглобинопатии было рекомендовано проведение молекулярно-генетического исследования, от которого больная отказалась.
Объективно: состояние удовлетворительное. Кожные покровы умеренной бледности. Периферические лимфоузлы не увеличены. Костно-мышечная система без особенностей. В легких дыхание везикулярное, хрипов нет. Тоны сердца ритмичные. Частота сердечных сокращений – 78/мин. Артериальное давление –
140/85 мм рт. ст. Живот мягкий. Печень и селезенка не увеличены.
Общий анализ крови: Нb – 106 г/л, эритроциты – 4,34×1012/л, средний объем эритроцита (MCV) – 73 фл, среднее содержание гемоглобина в 1 эритроците
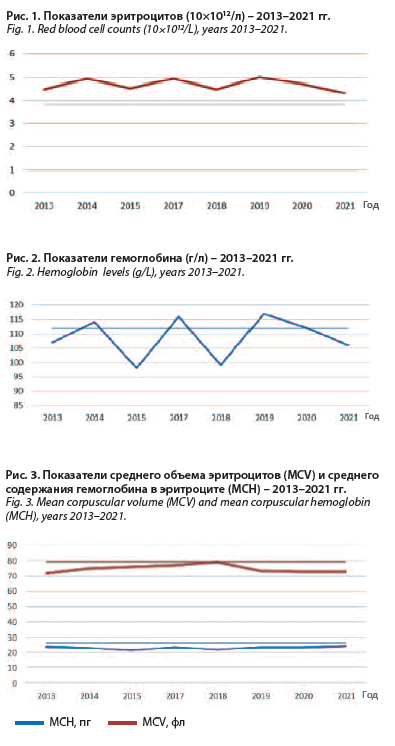
(МСН) – 24,3 пг, лейкоциты – 3,6×109/л, нейтрофилы (NEU) – 51,8%. При исследовании периферической крови было обращено внимание на снижение показателей лейкоцитов и абсолютного количества нейтрофилов, что регистрировалось на протяжении длительного времени. На рис. 1–3 представлены показатели гемоглобина, эритроцитов, MCV и МСН.
Биохимический анализ крови: гликированный Hb – 6,0%, железо – 10,01 мкмоль/л, фолиевая кислота – 25 нг/мл.
 После получения результатов обследования, выявившего повышение содержания НbА2, были отменены ПЖ и рекомендован прием фолиевой кислоты
После получения результатов обследования, выявившего повышение содержания НbА2, были отменены ПЖ и рекомендован прием фолиевой кислоты
(4 мг/сут 2 мес с перерывом в 1 мес) и антиоксидантов (Омега-3 по 1 к/сут 1,5 мес 3 раза в год).
Обсуждение
С одной стороны, трактовка гипохромной микроцитарной анемии у больной как ЖДА послужило основанием для назначения ПЖ. При этом отсутствие эффекта от лечения на протяжении длительного времени побуждало врачей лишь к замене одного ПЖ на другой. Между тем отсутствие у больной очевидных причин ЖДА (хронические кровопотери различной локализации, меноррагии, нарушение всасывания и др.) наряду с неэффективностью ПЖ является основанием для пересмотра диагноза ЖДА. Необходимо помнить положение, ставшее неким клиническим афоризмом: «все ЖДА являются гипохромными, но не все гипохромные анемии являются ЖДА». Иными словами, если у больной с подозрением на ЖДА анемия оказывается нормохромной или гиперхромной, то диагноз ЖДА маловероятен («все ЖДА являются гипохромными»). С другой стороны, при наличии у больной гипохромной анемии в первую очередь предполагается ЖДА (большинство гипохромных анемий), но в то же время не исключается и другая природа анемий («не все гипохромные являются железодефицитными»). Вот последний вариант, по-видимому, не подозревался наблюдавшими больную врачами, и не обсуждались другие возможные варианты гипохромной анемии (гемоглобинопатии, сидероахрестические анемии, анемии воспаления), тем более при отсутствии эффекта от применения ПЖ. Отсутствие у больной признаков воспаления на протяжении длительного наблюдения исключало связь анемии с наличием воспалительного процесса (анемии воспаления). Поэтому наиболее обоснованным было предположение о наличии у больной заболеваний из группы гемоглобинопатий – наследственной патологии, связанной с нарушением синтеза цепей глобина, в частности малой формой β-талассемии, вызывающие трудности дифференциальной диагностики с ЖДА.
 С целью выявления у больных гипохромными анемиями признаков β-талассемии, определяющих дальнейшее направление диагностического поиска, предложено использовать 5 лабораторных показателей – количество эритроцитов, средний объем эритроцитов (MCV), среднее содержание гемоглобина в эритроците (MCH), средняя концентрация гемоглобина в эритроцитах (MCHC), относительная ширина распределения эритроцитов по объему – индекс распределения эритроцитов (RDW). Указанные показатели предлагается использовать в многочисленных формулах, имеющих различную чувствительностью, специфичность и предсказательную ценность (положительную и отрицательную). Используются они в качестве диагностических ориентиров для скрининговой дифференциальной диагностики ЖДА и малых форм талассемии [8, 9].
С целью выявления у больных гипохромными анемиями признаков β-талассемии, определяющих дальнейшее направление диагностического поиска, предложено использовать 5 лабораторных показателей – количество эритроцитов, средний объем эритроцитов (MCV), среднее содержание гемоглобина в эритроците (MCH), средняя концентрация гемоглобина в эритроцитах (MCHC), относительная ширина распределения эритроцитов по объему – индекс распределения эритроцитов (RDW). Указанные показатели предлагается использовать в многочисленных формулах, имеющих различную чувствительностью, специфичность и предсказательную ценность (положительную и отрицательную). Используются они в качестве диагностических ориентиров для скрининговой дифференциальной диагностики ЖДА и малых форм талассемии [8, 9].
Наиболее достоверным в диагностике малой β-талассемии в ряде ретроспективных исследований признан индекс 11T, основанный на результатах одиннадцати формул, каждый положительный результат которых оценивается в 1 балл. Сумма баллов выше 8 при чувствительности теста 85,71 и специфичности 97,50 может свидетельствовать о диагнозе малой β-талассемии [9]. Индекс Грина и Кинга также неплохо зарекомендовал себя в нескольких исследованиях [8, 9]. Тем не менее разнящаяся чувствительность и специфичность этих формул приводит к частым ложноотрицательным результатам. Так, в рассматриваемом нами клиническом случае, индекс Mentzler (16,8) – [10], England и Fraser (12,26) – [11], Ehsani (29,6) – [12] не показали достоверного результата, в то время как полученный результат по формуле Shine и Lal (1294) – [13] удовлетворил поставленному диагнозу. Однако в развивающихся странах, где зачастую лабораторные методы диагностики малодоступны, использование данной методики может значительно улучшить выявляемость малых форм заболевания. Важно, что скрининг β-талассемий с использованием формул значительно более чувствителен, чем при
α-талассемиях [8].
В связи с отсутствием эффекта от ПЖ у пациентки было проведено электрофоретическое исследование гемоглобина, при котором выявлено повышение содержания HbА2 (4,1%) – (рис. 4), что является признаком β-талассемии. С учетом клинического течения заболевания (умеренно выраженная анемия, отсутствие выраженных клинико-лабораторных признаков гемолиза и необходимости эксфузии железа) данный вариант β-талассемии правомерно считать как легкую форму. Верификация причины гипохромной анемии и исключение ЖДА позволило отменить ПЖ, применение которых в течение длительного времени у данной пациентки следует считать неоправданным. В подобных случаях применение ПЖ у больных недиагностированной β-талассемии, ошибочно расцениваемой как ЖДА, может приводить к избыточному накоплению железа в органах и тканях (вторичный гемосидероз), что является одним из проявлений талассемии и требует обычно медикаментозной эксфузии железа (препарат десфериоксиамин). Однако признаков перегрузки железом (нормальные показатели сывороточного железа и ферритина) у обсуждаемой пациентки не выявлено.
Таким образом, данное клиническое наблюдение свидетельствует о том, что, несмотря на ведущую роль железодефицита при гипохромной анемии, необходимо в процессе диагностического поиска у данной категории пациентов, а также при неэффективности ПЖ исключать другие причины анемии, в частности легкие формы β-талассемии.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах / Information about the authors
Дворецкий Леонид Иванович – д-р. мед. наук, проф. кафедры госпитальной терапии №2, ФГАОУ ВО «Первый МГМУ
им. И.М. Сеченова» (Сеченовский Университет). E-mail: dvoretski@mail.ru; ORCID: 0000-0003-3186-0102
Leonid I. Dvoretsky – D. Sci. (Med.), Full Prof., Sechenov First Moscow State Medical University (Sechenov University).
E-mail: dvoretski@mail.ru; ORCID: 0000-0003-3186-0102
Асанов Алий Юрьевич – д-р. мед. наук, проф. кафедры клинической генетики, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: aliy@rambltr.ru
Alii Yu. Asanov – D. Sci. (Med.), Prof., Sechenov First Moscow State Medical University (Sechenov University). E-mail: aliy@rambltr.ru
Папко Кира Сергоевна – студентка, ФГАОУ ВО «Первый МГМУ им. И.М.Сеченова» (Сеченовский Университет).
E-mail: kirapapko16@mail.ru
Kira S. Papko – Student, Sechenov First Moscow State Medical University (Sechenov University). E-mail: kirapapko16@mail.ru
Туаева Маргарита Георгиевна – студентка, ФГАОУ ВО «Первый МГМУ им. И.М.Сеченова» (Сеченовский Университет).
E-mail: 340357@mail.ru
Margarita G. Tuaeva – Student, Sechenov First Moscow State Medical University (Sechenov University). E-mail: 340357@mail.ru
Статья поступила в редакцию / The article received: 10.11.2021
Статья принята к печати / The article approved for publication: 18.11.2021
Leonid I. Dvoretsky, Alii Yu. Asanov, Kira S. Papko, Margarita G. Tuaeva
Abstract
Case study of female patient with hypochromic anemia, who has been treated with iron preparations for iron deficiency anemia for a long time, is reported. A hemoglobin electrophoresis test has been performed due to treatment failure, and β-thalassemia (thalassemia minor) has been diagnosed. The data on β-thalassemia and approaches to differential diagnosis of hypochromic anemias are summarized.
Key words: hypochromic anemia, iron deficiency anemia, hemoglobinopathies, β-thalassemia, hemoglobin electrophoresis.
For citation: Dvoretsky L.I., Asanov A.Yu., Papko K.S., Tuaeva M.G. Not every hypochromic anemia is an iron deficiency anemia. Case study. Clinical review for general practice. 2021; 8: 42–46. DOI: 10.47407/kr2021.2.8.00099
Гипохромные анемии, являющиеся одним из частых гематологических синдромов в клинической практике, чаще всего ассоциируются с железодефицитной анемией (ЖДА). Однако в основе развития гипохромных анемией могут лежать другие патогенетические механизмы, не связанные с дефицитом железа.
К ним относятся нарушение включения железа в молекулу гемоглобина (сидероахрестические анемии), перераспределение железа в клетки макрофагальной системы при воспалительных процессах (анемии воспаления), нарушение синтеза цепей глобина или его структуры (наследственные гемоглобинопатии).
Несвоевременное распознавание этих состояний (недостаточная осведомленность врачей, трудности диагностики, атипичность течения и др.) и ошибочная трактовка гипохромной анемии как ЖДА (преобладание среди гипохромных анемий) влечет за собой назначение препаратов железа (ПЖ), неэффективных и противопоказанных данной категории пациентов.
Одной из редких причин развития гипохромных анемий являются гемоглобинопатии – генетически гетерогенная и клинически полиморфная группа наследственных нарушений синтеза глобина. В настоящее время, по крайней мере, 300 млн человек (или более 5% населения планеты) являются носителями потенциально патологических генов гемоглобинопатий. Наиболее значимой в клиническом и эпидемиологическом отношении патологией среди гемоглобинопатий является талассемия – группа аутосомно-рецессивно наследуемых болезней, характеризующихся нарушением синтеза полипептидных цепей гемоглобина. Каждая молекула гемоглобина представляет собой тетрамер и образована двумя парами гемоглобиновых цепей:
α-глобиновых и β-глобиновых. Синтез этих цепей контролируется двумя кластерами, расположенных в
16 (кластер α-генов) и 11 (кластер β-генов) хромосомах соответственно. В основе патогенеза талассемии лежит дисбаланс субъединиц глобина, причем степень дисбаланса пропорциональна тяжести болезни. Наиболее распространенными формами являются α- и β-талассемия.
α-Талассемия в большинстве случаев обусловлена делецией одного или двух генов (в одной хромосоме два гена α-глобина), реже – неделеционной мутацией. Клиническая картина и тяжесть заболевания определяется числом пораженных генов.
β-Талассемия, напротив, возникает чаще всего в результате неделеционных (точечных) мутаций, что приводит к снижению или полному отсутствию синтеза
β цепей глобина (в одной хромосоме расположен один ген β-глобина). Существует два варианта β-талассемии – большая талассемия (наиболее тяжелая форма заболевания), возникающая при наличии мутаций в обоих аллелях гена β-глобина и малая β-талассемия (легко протекающая и не требующая лечения), связанная с мутацией в одном из аллелей гена β-глобина. Современное название болезнь получила в 1933 г. и происходит от греческих слов thalassa (море) и haima (кровь) в связи с тем, что заболевание особенно часто регистрировалось в странах Средиземноморья (Греция и Италия). Наиболее распространена β-талассемия в регионах эндемичных по малярии, вызванной Plasmodium falciparum, включая Средиземноморье, северную Африку, регионы Ближнего Востока, Индию, Юго-Восточную Азию и южные районы Китая. Высокие частоты β-талассемии регистрируются в Дагестане и в бывших республиках СССР (Азербайджан, Узбекистан, Таджикистан). Частота носителей β-талассемии в этих областях варьирует от 1 до 20%. По оценкам, в мире насчитывается 270 млн носителей аномальных гемоглобинов и талассемии, из которых 80 млн являются носителями β-талассемии. Ежегодно рождается от 300 тыс. до 400 тыс. детей с серьезным нарушением гемоглобина (23 тыс. с большой β-талассемией) и до 90% этих родов происходят в странах с низким или средним уровнем дохода [1]. Миграция населения и смешанные браки между различными этническими группами привели к возникновению талассемии почти во всех странах мира, включая Северную Европу, где талассемия ранее отсутствовала. По современным оценкам, около 1,5% мирового населения (от 80 до 90 млн человек) являются носителями
β-талассемии. Общая ежегодная заболеваемость β-талассемией с наличием симптомов составляет 1/100 000 во всем мире и 1/10 000 человек в странах Евросоюза [2].
Распространенность анемий, связанных с талассемией в некоторых регионах превышает частоту ЖДА. Так, в одной из провинций Северного Таиланда среди гипохромных анемий соотношение диагностированных ЖДА, талассемий и сочетания ЖДА с талассемией составляло 10,2%, 53,8% и 30,8%, а в другой провинции – 7,7%, 67,3% и 9,6% соответственно [3]. При обследовании жителей филиппинской столицы Манилы с наличием анемии установлено, что ЖДА и гемоглобинопатии, в том числе талассемия, диагностировались в 37,6% и 27,8% случаев, в то время как у 34,7% лиц выявлялись другие причины анемии. У больных с талассемией отмечалась умеренно выраженная анемия с нормальным или повышенным содержанием сывороточного железа [4].
Клинически различают тяжелую, промежуточную и малую β-талассемию. Тяжелая форма протекает в виде выраженной анемии (Hb<60 г/л), высокой потребности в постоянных гемотрансфузиях. Нелеченые или неадекватно леченные больные обычно погибают в первом или втором десятилетии жизни [5]. Промежуточная форма обычно гомозиготна. Уровень гемоглобина может колебаться в пределах 60–100 г/л, однако клиническая картина весьма вариабельна. При этом наблюдается умеренная или тяжелая микроцитарная гипохромная анемия с признаками гемолиза. У некоторых больных с гомозиготной формой отсутствуют признаки тяжелой патологии, анемия умеренно выражена, что не требует постоянных гемотрансфузий. Малая
β-талассемия проявляется умеренно выраженной гипохромной микроцитарной анемией
Поскольку основой лечения большинства больных талассемией является трансфузионная терапия, а потребность в трансфузиях эритроцитов косвенно отражает тяжесть заболевания, выделяют трансфузионно-зависимую и трансфузионно-независимую талассемию. Однако два этих состояния могут быть непостоянными и отражают текущее состояние пациента [6].
В клинической практике наиболее частые трудности и ошибки в диагностике возникают у больных малой
β-талассемией, проявляющейся умеренно выраженной гипохромной анемией при отсутствии других признаков заболевания. Неправильная трактовка причины гипохромной анемии и ошибочная диагностика ЖДА влечет за собой неоправданные обследования и назначение ПЖ, что, кроме неэффективности лечения, может иметь негативные последствия для больных талассемией [7].
В качестве иллюстрации ошибочной диагностики ЖДА у больной β-талассемией приводим клиническое наблюдение.
Больная А., 63 года, обратилась с жалобами на слабость, головокружение. По данным анамнеза, в возрасте 23 лет во время беременности впервые было выявлено снижение содержания гемоглобина до 60 г/л, диагностирована ЖДА и назначены ПЖ. После родов отмечено повышение показателей гемоглобина, не достигавших, однако, нормальных величин. В дальнейшем в анализах периферической крови постоянно выявлялась гипохромная микроцитарная анемия, рефрактерная к лечению ПЖ. При периодически проводившихся обследованиях причину анемии выявить не удавалось, что наряду с отсутствием эффекта от длительной ферротерапии побудило врачей пересмотреть диагноз ЖДА. Было проведено электрофоретическое исследование гемоглобина
(Гематологический центр Минздрава России), по данным которого выявлено повышение уровня HbA2
(см. рис. 4) до 4,1% (норма 2,2–3,2%). Полученные результаты позволили диагностировать β-талассемию. В дополнение к анамнезу установлено, что мать пациентки также страдала анемией, природа которой осталась неясной. Для верификации формы гемоглобинопатии было рекомендовано проведение молекулярно-генетического исследования, от которого больная отказалась.
Объективно: состояние удовлетворительное. Кожные покровы умеренной бледности. Периферические лимфоузлы не увеличены. Костно-мышечная система без особенностей. В легких дыхание везикулярное, хрипов нет. Тоны сердца ритмичные. Частота сердечных сокращений – 78/мин. Артериальное давление –
140/85 мм рт. ст. Живот мягкий. Печень и селезенка не увеличены.
Общий анализ крови: Нb – 106 г/л, эритроциты – 4,34×1012/л, средний объем эритроцита (MCV) – 73 фл, среднее содержание гемоглобина в 1 эритроците
(МСН) – 24,3 пг, лейкоциты – 3,6×109/л, нейтрофилы (NEU) – 51,8%. При исследовании периферической крови было обращено внимание на снижение показателей лейкоцитов и абсолютного количества нейтрофилов, что регистрировалось на протяжении длительного времени. На рис. 1–3 представлены показатели гемоглобина, эритроцитов, MCV и МСН.
Биохимический анализ крови: гликированный Hb – 6,0%, железо – 10,01 мкмоль/л, фолиевая кислота – 25 нг/мл.
(4 мг/сут 2 мес с перерывом в 1 мес) и антиоксидантов (Омега-3 по 1 к/сут 1,5 мес 3 раза в год).
Обсуждение
С одной стороны, трактовка гипохромной микроцитарной анемии у больной как ЖДА послужило основанием для назначения ПЖ. При этом отсутствие эффекта от лечения на протяжении длительного времени побуждало врачей лишь к замене одного ПЖ на другой. Между тем отсутствие у больной очевидных причин ЖДА (хронические кровопотери различной локализации, меноррагии, нарушение всасывания и др.) наряду с неэффективностью ПЖ является основанием для пересмотра диагноза ЖДА. Необходимо помнить положение, ставшее неким клиническим афоризмом: «все ЖДА являются гипохромными, но не все гипохромные анемии являются ЖДА». Иными словами, если у больной с подозрением на ЖДА анемия оказывается нормохромной или гиперхромной, то диагноз ЖДА маловероятен («все ЖДА являются гипохромными»). С другой стороны, при наличии у больной гипохромной анемии в первую очередь предполагается ЖДА (большинство гипохромных анемий), но в то же время не исключается и другая природа анемий («не все гипохромные являются железодефицитными»). Вот последний вариант, по-видимому, не подозревался наблюдавшими больную врачами, и не обсуждались другие возможные варианты гипохромной анемии (гемоглобинопатии, сидероахрестические анемии, анемии воспаления), тем более при отсутствии эффекта от применения ПЖ. Отсутствие у больной признаков воспаления на протяжении длительного наблюдения исключало связь анемии с наличием воспалительного процесса (анемии воспаления). Поэтому наиболее обоснованным было предположение о наличии у больной заболеваний из группы гемоглобинопатий – наследственной патологии, связанной с нарушением синтеза цепей глобина, в частности малой формой β-талассемии, вызывающие трудности дифференциальной диагностики с ЖДА.
Наиболее достоверным в диагностике малой β-талассемии в ряде ретроспективных исследований признан индекс 11T, основанный на результатах одиннадцати формул, каждый положительный результат которых оценивается в 1 балл. Сумма баллов выше 8 при чувствительности теста 85,71 и специфичности 97,50 может свидетельствовать о диагнозе малой β-талассемии [9]. Индекс Грина и Кинга также неплохо зарекомендовал себя в нескольких исследованиях [8, 9]. Тем не менее разнящаяся чувствительность и специфичность этих формул приводит к частым ложноотрицательным результатам. Так, в рассматриваемом нами клиническом случае, индекс Mentzler (16,8) – [10], England и Fraser (12,26) – [11], Ehsani (29,6) – [12] не показали достоверного результата, в то время как полученный результат по формуле Shine и Lal (1294) – [13] удовлетворил поставленному диагнозу. Однако в развивающихся странах, где зачастую лабораторные методы диагностики малодоступны, использование данной методики может значительно улучшить выявляемость малых форм заболевания. Важно, что скрининг β-талассемий с использованием формул значительно более чувствителен, чем при
α-талассемиях [8].
В связи с отсутствием эффекта от ПЖ у пациентки было проведено электрофоретическое исследование гемоглобина, при котором выявлено повышение содержания HbА2 (4,1%) – (рис. 4), что является признаком β-талассемии. С учетом клинического течения заболевания (умеренно выраженная анемия, отсутствие выраженных клинико-лабораторных признаков гемолиза и необходимости эксфузии железа) данный вариант β-талассемии правомерно считать как легкую форму. Верификация причины гипохромной анемии и исключение ЖДА позволило отменить ПЖ, применение которых в течение длительного времени у данной пациентки следует считать неоправданным. В подобных случаях применение ПЖ у больных недиагностированной β-талассемии, ошибочно расцениваемой как ЖДА, может приводить к избыточному накоплению железа в органах и тканях (вторичный гемосидероз), что является одним из проявлений талассемии и требует обычно медикаментозной эксфузии железа (препарат десфериоксиамин). Однако признаков перегрузки железом (нормальные показатели сывороточного железа и ферритина) у обсуждаемой пациентки не выявлено.
Таким образом, данное клиническое наблюдение свидетельствует о том, что, несмотря на ведущую роль железодефицита при гипохромной анемии, необходимо в процессе диагностического поиска у данной категории пациентов, а также при неэффективности ПЖ исключать другие причины анемии, в частности легкие формы β-талассемии.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах / Information about the authors
Дворецкий Леонид Иванович – д-р. мед. наук, проф. кафедры госпитальной терапии №2, ФГАОУ ВО «Первый МГМУ
им. И.М. Сеченова» (Сеченовский Университет). E-mail: dvoretski@mail.ru; ORCID: 0000-0003-3186-0102
Leonid I. Dvoretsky – D. Sci. (Med.), Full Prof., Sechenov First Moscow State Medical University (Sechenov University).
E-mail: dvoretski@mail.ru; ORCID: 0000-0003-3186-0102
Асанов Алий Юрьевич – д-р. мед. наук, проф. кафедры клинической генетики, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: aliy@rambltr.ru
Alii Yu. Asanov – D. Sci. (Med.), Prof., Sechenov First Moscow State Medical University (Sechenov University). E-mail: aliy@rambltr.ru
Папко Кира Сергоевна – студентка, ФГАОУ ВО «Первый МГМУ им. И.М.Сеченова» (Сеченовский Университет).
E-mail: kirapapko16@mail.ru
Kira S. Papko – Student, Sechenov First Moscow State Medical University (Sechenov University). E-mail: kirapapko16@mail.ru
Туаева Маргарита Георгиевна – студентка, ФГАОУ ВО «Первый МГМУ им. И.М.Сеченова» (Сеченовский Университет).
E-mail: 340357@mail.ru
Margarita G. Tuaeva – Student, Sechenov First Moscow State Medical University (Sechenov University). E-mail: 340357@mail.ru
Статья поступила в редакцию / The article received: 10.11.2021
Статья принята к печати / The article approved for publication: 18.11.2021


