Клинический разбор в общей медицине №3 2022
Difficulties of assessing heart damages and stratification of cardiovacular risk in patients with rheumatoid arthritis
Margarita A. Gromova1, Vladimir V. Tsurko1, Oxana A. Kislyak1, Stefka G. Radenska-Lopovok2, Yulia B. Chervyakova1
Abstract
Rheumatoid arthritis (RA) is a chronic systemic inflammatory disease of the connective tissue with a progressive lesion of predominantly peripheral joints with frequent extra-articular manifestations, among which heart damage, according to autopsy data, is observed in up to 60% of cases. At the same time, clinical changes in the heart, as a rule, are minimal and rarely come to the fore in the overall picture of the underlying disease. This review considers lesions of the membranes of the heart, pathology of the coronary arteries, secondary amyloidosis of the heart in RA. With damage to the joints, when physical activity is noticeably reduced, cardiac pathology is often masked, which requires a more careful and thorough examination of the patient from the doctor. In addition, the doctor will receive information about the stratification of cardiovascular risk in RA, learn to identify groups of patients with RA who are predisposed to the development of cardiovascular complications, and be able to develop a set of preventive and therapeutic measures aimed at reducing the risk individually for each patient; to create a system of dynamic control and monitoring of the development of cardiovascular pathology in this category of patients and purposefully treat comorbid patients.
Key words: rheumatoid arthritis, heart disease, pericarditis, myocarditis, endocarditis, valvulitis, arteritis, cardiovascular risk, cardiovascular risk stratification, comorbidity.
For citation: Gromova M.A., Tsurko V.V., Kislyak O.A. et al. Difficulties of assessing heart damages and stratification of cardiovacular risk in patients with rheumatoid arthritis
Введение
Ревматоидный артрит (РА) является системным процессом с поражением не только суставов, но и различных внутренних органов, включая сердце. Изменения в сердце при РА в недавнем прошлом выделяли в суставно-сердечную форму заболевания. При поражении суставов, когда заметно снижается физическая активность, сердечная патология часто маскируется: клинические изменения со стороны сердца, как правило, минимальные и редко выходят на первый план в общей картине основной болезни, что усложняет оценку поражений сердца при РА и требует от врача более внимательного и тщательного обследования больного. У пациентов с РА примерно на 50% выше риск развития сердечно-сосудистых событий [1] и сердечно-сосудистой смерти [2]. Величина этих рисков различается в различных исследованиях, что обусловлено особенностями когорт включенных пациентов, особенностями и эффективностью проводившейся терапии, временем наблюдения [3, 4]. Имеются данные о величине объединенного относительного риска 1,68 для инфаркта миокарда (ИМ) и 1,87 для застойной сердечной недостаточности [5]. А в другом исследовании пациенты с РА имели повышенный риск ИМ с отношением шансов (ОШ) 2,50 (95% доверительный интервал – ДИ 0,77–8,14) [6], на 60% более высокий риск смерти от сердечно-сосудистых заболеваний (ССЗ) по сравнению с населением в целом [6].
Таким образом, РА является фактором риска развития ССЗ и их осложнений, а системные проявления (поражения сердца) у пациентов с РА являются клинически значимыми, определяют прогноз в целом, поэтому важно их раннее распознавание и целенаправленное лечение [1].
Особенности поражения сердца у больных ревматоидным артритом Миокардит
 Частота поражения миокарда при РА в форме миокардита не выяснена. Это обусловлено, с одной стороны, трудностью диагностики миокардита у лиц с ограниченной двигательной активностью, с другой – отставанием клинических проявлений от морфологических изменений сердца [6, 7]. Патология миокарда носит полиморфный характер в связи с наличием различной давности сосудистых поражений. В одних сосудах имеется васкулит, в других – гиалиноз, в третьих – склероз. Характер васкулита может быть пролиферативным и редко пролиферативно-деструктивным.
Частота поражения миокарда при РА в форме миокардита не выяснена. Это обусловлено, с одной стороны, трудностью диагностики миокардита у лиц с ограниченной двигательной активностью, с другой – отставанием клинических проявлений от морфологических изменений сердца [6, 7]. Патология миокарда носит полиморфный характер в связи с наличием различной давности сосудистых поражений. В одних сосудах имеется васкулит, в других – гиалиноз, в третьих – склероз. Характер васкулита может быть пролиферативным и редко пролиферативно-деструктивным.
В воспалительном инфильтрате преобладают лимфогистиоцитарные элементы как в периваскулярном пространстве (рис. 1), так и в стенке сосудов. Следует отметить, что при активации основного процесса наблюдается сочетание старых и свежих сосудистых изменений. Наряду с этим встречается очаговый, или диффузный, интерстициальный миокардит, заканчивающийся развитием мелкоочагового кардиосклероза. У больных РА нередко развивается бурая атрофия миокарда с накоплением липофусцина в кардиомиоцитах (рис. 2). Эти изменения могут являться причиной стенокардии. Патогномоничным признаком РА являются ревматоидные узелки в миокарде, перикарде и эндокарде в основании митрального и аортального клапанов, в области фиброзного кольца. В исходе узелка развивается склероз, вызывающий формирование недостаточности клапанов. Миокардит проявляется и диагностируется, как правило, на высоте активности основного ревматоидного процесса, т.е. при очередном выраженном обострении суставного синдрома.
Ведущей жалобой при миокардите в дебюте поражения сердца являются неприятные ощущения в области сердца (кардиалгии), невыраженные, длительные, разлитые и без четкой локализации, как правило, без иррадиации и некупирующиеся нитратами. К основным жалобам относятся сердцебиение, перебои и реже одышка при физической нагрузке. Быструю утомляемость, повышенную потливость и субфебрилитет врачи обычно связывают с очередным обострением РА, а не с кардиальной патологией [7].
При аускультации физикальные данные выявляют тахикардию и ослабление I тона с систолическим шумом, нередко удается выслушать III тон. Как правило, миокардит при РА не склонен к прогрессированию, признаки сердечной недостаточности отсутствуют [7].
При обычном ЭКГ-исследовании могут отмечаться снижение зубцов Т, опущение ST-интервалов, небольшие нарушения внутрижелудочковой проводимости. Эти изменения неспецифичны и могут сопровождать различные заболевания. Более характерное для миокардитов замедление атриовентрикулярной проводимости бывает редко.
Дифференциальная диагностика миокардита и миокардиодистрофии, нередко проводящаяся у больных РА, длительно получающих массивную лекарственную терапию, затруднена, так как клинические проявления в том и другом случае близки [5, 6]. Наличие миокардита подтвердит положительная динамика его проявлений под влиянием правильно подобранного и назначаемого в адекватных дозах противоревматического лечения.
Перикардит
Перикардит является наиболее характерным поражением сердца при РА [1]. Патологоанатомически он выявляется в подавляющем большинстве случаев в виде фиброзного, реже геморрагического перикардита; нередко обнаружение характерных ревматических гранулем. Отличительной особенностью перикардита при РА является участие в воспалении крупных базофильных гистиоцитов под зоной фибринозных наложений. Глубже формируется грануляционная ткань, содержащая лимфоциты и плазматические клетки, с утолщением перикарда и формированием грубого склероза (рис. 3).
Больной может предъявлять жалобы на боли в области сердца разной интенсивности и длительности. Частота клинической диагностики перикардита различна (20–40%) и зависит в основном от тщательности клинического изучения больного и уровня компетентности клинициста. В большинстве случаев анатомически определяются спайки в полости перикарда и утолщение последнего за счет склеротического процесса, нередко рецидивирующего. Выпот обычно небольшой, без признаков тампонады. Подтверждается, как правило, данными рентгенологического исследования, указывающими на нечеткость и неровность контуров сердца. Шумы трения перикарда непостоянны, выслушиваются далеко не у всех больных, хотя в некоторых случаях остаются длительно в виде перикардиальных щелчков в различные фазы сердечного цикла, что фиксируется качественным ФКГ-исследованием.
ЭКГ-изменения у большинства больных неспецифичны для перикардита. Но в случае появления даже умеренного экссудата можно наблюдать снижение вольтажа QRS с положительной динамикой при уменьшении выпота. Перикардиты при РА склонны к рецидивированию. В части случаев перикардиты сопровождаются появлением конкордантных отрицательных зубцов Т на многих ЭКГ-отведениях, что может приводить к постановке ошибочного диагноза ИМ. Большое значение в обнаружении РА-перикардитов имеет эхокардиография, позволяющая выявлять изменения перикарда (его уплотнение, утолщение, наличие жидкости) и динамику этих изменений при повторных исследованиях. Во многих случаях эхокардиографические изменения перикардита являются неожиданной находкой как для больного, так и для лечащего врача [7].
Эндокардит
Эндокардит при РА отмечается значительно реже, чем перикардит. Патологоанатомические данные свидетельствуют о нередком вовлечении в процесс эндокарда, в том числе клапанного, в виде неспецифических воспалительных изменений в створках и клапанном кольце, а также специфических гранулем. У большинства больных вальвулит протекает благоприятно, не приводит к значительной деформации створок и не имеет ярких клинических проявлений. Однако у некоторых больных течение вальвулита может осложняться деформацией створок и сопровождаться выраженной недостаточностью пораженного клапана, чаще митрального, что диктует необходимость хирургической коррекции порока. Обычно эндокардит сочетается с миокардитом и перикардитом [6].
При обнаружении у больного РА митрального стеноза всегда необходимо исключать ревматическую этиологию его, так как сочетание РА с предшествующим ревматическим пороком признается многими авторами. Кроме того, необходимо исключить атеросклеротический генез пороков сердца. Вместе с тем вполне вероятно, что собственно ревматоидное поражение клапанов может служить тем благоприятным фоном, на котором в дальнейшем развиваются выраженные структурные изменения створок, патология которых доминирует как в клинической, так и в эхокардиографической картине атеросклеротического поражения клапанов сердца. В каждом случае вопрос о генезе порока при РА требует учета всех имеющихся клинических данных [7].
Вторичный амилоидоз сердца Амилоидная кардиомиопатия – поражение сердца, обусловленное внеклеточным отложением амилоида.
В ряде случаев может быть локальное поражение структур сердца, например предсердий, чаще поражение сердца является частью системной (генерализованной) патологии. В зависимости от белка-предшественника амилоида выделяют 36 типов амилоидоза. Сердце поражается при системном AL – (70–80%), ATTR – (15–25%), AA – (2–7%), Аβ2m-, AApoAI-амилоидозе и локальном AANF-амилоидозе предсердий (табл. 1) [8, 9, 14].
АА-амилоидоз (реактивный, вторичный амилоидоз) развивается при хронических воспалительных заболеваниях, которые обычно сложно поддаются контролю: серопозитивных и серонегативных полиартритах, хронических воспалительных заболеваниях кишечника, хронических нагноениях, туберкулезе, злокачественных солидных опухолях, аутовоспалительных заболеваниях. АА-амилоид образуется из сывороточного предшественника SAA (serum amyloid A) – острофазового белка, продуцируемого печенью в ответ на воспаление [10, 13, 14]. Поскольку SAA активно продуцируется синовиальной оболочкой суставов, дополнительным фактором риска амилоидоза является манифестация воспалительного заболевания с суставным синдромом [10, 13, 14].
Амилоидоз сердца необходимо диагностировать как при выявлении амилоидной инфильтрации при эндомиокардиальной биопсии, так и при утолщении стенки левого желудочка >12 мм в отсутствии артериальной гипертензии или других причин для развития гипертрофии левого желудочка при выявлении амилоида внесердечной локализации. Скрининговое обследование на амилоидоз необходимо при хронической сердечной недостаточности (ХСН) неясной этиологии (особенно c сохраненной фракцией выброса левого желудочка), рефрактерной к терапии, в сочетании с протеинурией и хронической болезнью почек 4–5-й стадии; идиопатической фибрилляции предсердий и нарушениях проводимости, утолщении стенки левого желудочка неясной этиологии, наличии низкого вольтажа зубцов при электрокардиографии, необъяснимой артериальной гипотензии и легочной гипертензии.
При развитии у больного РА сердечной недостаточности (особенно c сохраненной фракцией выброса левого желудочка), резистентной к обычной терапии, следует иметь в виду вторичный амилоидоз сердца. Скрининг на амилоидоз должен включать как неинвазивные методы, в том числе электрофорез и иммунофиксацию белков крови и мочи, исследование на свободные легкие цепи иммуноглобулинов лямбда и каппа, 99Tc-DPD-сцинтиграфию, генетическое тестирование (при подозрении на наследственные варианты амилоидоза), так и морфологическое исследование биоптатов различной локализации с окраской Конго красным и поляризационной микроскопией. Для профилактики развития AA-амилоидоза необходимо адекватное лечение основного заболевания. При оценке риска развития и прогрессирования АА-амилоидоза необходим контроль за уровнем SAA, C-реактивного белка, ферритина, кальгранулина (сывороточный маркер нейтрофильной активности S100A12) [14].
Какие основные пути поражения сердца у больных ревматоидным артритом?
Первый путь – поражение коронарных артерий с формированием ишемической болезни сердца (ИБС). Разрыв атеросклеротических бляшек может вызвать образование тромбов, которые могут локально блокировать коронарные кровеносные сосуды и приводить к острому коронарному синдрому. Недостаточное поступление кислорода в миокард может привести к дисфункции кардиомиоцитов, что определяет снижение сократительной функции сердечной мышцы. Поражение коронарных артерий может проявляться стенокардией, приводить к развитию кардиомиопатии или аритмии. В острой форме полная окклюзия крупных артерий может привести к ИМ и внезапной сердечной смерти [15].
Другой путь поражения сердца – развитие неишемической болезни сердца с изменениями клеточного состава и структуры сердечной мышцы. Кардиомиопатия представляет собой наиболее распространенный тип неишемической болезни сердца, при которой развивается гипертрофия миокарда желудочков, а сам миокард становится жестким [16].
Современные диагностические возможности позволяют выявлять субклинические и бессимптомные изменения в сердце на самых ранних этапах развития РА, обеспечивают точное представление о структуре и функциях сердечно-сосудистой системы. Так, результаты магнитно-резонансной томографии (МРТ) сердца и позитронно-эмиссионной томографии (ПЭТ-КТ) у пациентов с РА без диагноза ССЗ свидетельствуют, что практически у 50% пациентов уже имеются признаки фиброза или воспаления миокарда [17, 18]. Изменения в миокарде являются причиной выявляемой увеличенной массы миокарда левого желудочка у пациентов с РА без артериальной гипертонии и других ССЗ [19], а гипертрофия миокарда может на определенном этапе сопровождаться снижением сократительной функции. Примечательно, что снижение систолической и диастолической функций левого желудочка установлено у 50% пациентов с РА без клинических признаков сердечной недостаточности [20, 21]. У пациентов без клинически выраженного сердечного повреждения установлено ухудшение систолической функции левого желудочка, оцениваемой по деформации миокарда левого желудочка, измеренной с помощью отслеживания характеристик магнитного резонанса сердца [17–21].
Важным является установленный факт формирования концентрического ремоделирования миокарда левого желудочка у пациентов с РА еще до клинических проявлений ССЗ и в отсутствие общих сердечно-сосудистых факторов риска [22]. При изучении деформации миокарда во время сокращения и релаксации желудочков при использовании эхокардиографии слежения (STE) установлено, что продольная структура стенки левого и правого желудочков на систолическом пике значительно ухудшается у пациентов с сохраненной диастолической функцией. Этот результат сохранялся после корректировки на возраст, пол, артериальное давление, индекс массы тела (ИМТ) и сердечный ритм, после сравнения пациентов с контролем [22].
У пациентов с РА выявлены субклинические изменения и в коронарной микроциркуляции [23]. Так, при измерении резерва потока миокарда установлено, что у 1/3 пациентов с РА без клинических сердечно-сосудистых проявлений имеется сердечная микрососудистая дисфункция [23, 24]. В отсутствие клинических проявлений поражения коронарных артерий у пациентов с РА имеются более высокие распространенность, степень и тяжесть всех типов коронарных бляшек, измеренных с помощью КТ-ангиографии. При этом у пациентов с РА в 2 раза чаще развиваются эпизоды «немого» (нераспознанного) ИМ. Эти субклинические изменения в миокарде и в коронарных артериях являются причиной серьезных ишемических и неишемических осложнений [5, 6]. ИБС является важной причиной сердечно-сосудистой смерти у пациентов с РА [5–8, 25–27].
Нарушение ритма сердца и проводимости у больных ревматоидным артритом
У пациентов с РА в 2 раза выше риск внезапной сердечной смерти, при этом у них реже имеются клинические проявления стенокардии. В общей популяции внезапная сердечная смерть обычно вызывается фатальными аритмиями, которые являются результатом электрофизиологических нарушений в сердце. У пациентов с ранним артритом встречаемость удлиненного интервала QTc не выше, чем в популяции лиц без артрита, но со временем при продолжающемся процессе у них прогрессирует проаритмическая пролонгация QTc [27–29]. Основным патофизиологическим механизмом, лежащим в основе удлинения QTc, является системное воспаление, действующее как косвенно, ускоряя развитие ССЗ, так и непосредственно, влияя на электрофизиологию сердца. Установлено, что воспалительные цитокины – интерлейкин (ИЛ)-6, фактор некроза опухоли альфа (ФНО-α), ИЛ-1 вызывают глубокие изменения в экспрессии и функции калиевых и кальциевых каналов с увеличением потенциала действия, что приводит к удлинению интервала QT [27–33]. Так, было установлено, что у пациентов с РА уровни циркулирующих воспалительных цитокинов коррелируют с продолжительностью QTc [27–29].
Известно, что длина QTc является независимым фактором риска ССЗ [19]. Как умеренное (QTc 420–440 мс), так и значительное удлинение QTc (>440 мс) являются прогностическими факторами смертности от всех причин в здоровых популяциях среднего возраста. У пациентов с РА установлено, что увеличение интервала QTc на 50 мс связано с удвоением риска общей смертности, ассоциация опосредована уровнями С-реактивного белка (СРБ) [27–29].
Нарушения проводимости у больных РА в целом встречаются чаще, чем нарушения ритма [27]. При этом нарушения ритма имеют различные патофизиологические механизмы, наиболее важными из которых являются воспаление миокарда и фиброз. Воспалительные процессы и окислительный стресс приводят к некрозу кардиомиоцитов с последующим электрическим и структурным ремоделированием. Хроническое воспаление приводит к вегетативной дисфункции, а именно гиперактивации симпатической нервной системы и снижению парасимпатической функции. Аритмии, опосредованные аутоантителами и лекарственными препаратами, также часто наблюдаются у больных с РА [30–33]. В то же время установлено, что у пациентов с РА на фоне терапии тоцилизумабом (антитела против рецептора ИЛ-6) происходит быстрое (в течение 3 мес) и значительное укорочение QTc, которое коррелировало со снижением уровня СРБ [34]. Исследование большой группы женщин с РА продемонстрировало, что воспаление, оцениваемое по уровням циркулирующего ИЛ-6, сильнее коррелирует с фатальными, чем нефатальными сердечно-сосудистыми событиями [34].
Фиброз предсердий рассматривается как общий признак клинической фибрилляции предсердий (ФП) и признак аритмогенного структурного ремоделирования миокарда. Заболеваемость ФП у пациентов с РА на 40% выше, чем в общей популяции, может возникать в любое время в течение заболевания, даже может быть первым проявлением болезни [27]. Хотя патофизиология ФП при РА сложна, однако системное воспаление, вызывающее повышение концентрации циркулирующих воспалительных белков, ИБС и сердечная недостаточность являются важными факторами для инициации и рецидива ФП у этих пациентов [27–29].
Дисфункция вегетативной нервной системы (ВНС) из-за нейротоксического эффекта хронического системного воспалительного процесса и побочных эффектов препаратов выявляется у 60% пациентов с РА. При этом сама дисфункция ВНС считается возможной патогенетической причиной сердечных аритмий у пациентов с РА [34, 35]. Основным типом дерегуляции ВНС является нарушение сердечно-сосудистых рефлексов и изменение вариабельности сердечного ритма, что свидетельствует о снижении сердечной парасимпатической активности и повышенной сердечной симпатической активности, проявляющейся в виде эктопических сокращений предсердий, сердечной недостаточности, нарушения контроля частоты сердечных сокращений и несоответствующей предсердной тахикардии [27, 34, 35].
Наиболее частой причиной внезапной сердечной смерти у пациентов с РА является атеросклеротическое поражение коронарных артерий, приводящее к острому коронарному синдрому и желудочковой тахикардии [27]. Хотя основные механизмы, лежащие в основе проаритмогенного субстрата при РА, сложны, но ведущая роль, по-видимому, принадлежит также хронической системной воспалительной активации, способствующей развитию аритмий как косвенно, ускоряя развитие ИБС и застойной сердечной недостаточности, так и напрямую влияя на электрофизиологию сердца [36]. Сегодня имеются доказательства того, что воспалительные цитокины, в основном ФНО-α, ИЛ-1 и ИЛ-6, могут модулировать экспрессию и функцию ионных каналов, напрямую воздействуя на кардиомиоциты [36].
В настоящее время появились новые данные о роли и значении антицитрулиновых антител в поражении сердца. Антицитрулированные антитела являются ключевым специфическим признаком РА, они относительно специфичны, появляются еще в доклинической фазе заболевания [32]. Сегодня свидетельством роли и значения аутоиммунного процесса в поражении сердца при РА является установление взаимосвязи между высоким уровнем антицитрулиновых антител, нацеленных на цитвиментин и белок или пептиды цитфибриногена миокарда, и более высоким средним значением индекса массы миокарда левого желудочка. Цитруллинирование виментина, промежуточного филаментного компонента мезенхимных клеток, приводит к коллапсу сети филаментов, а цитруллинирование миозина и тропомиозина изменяет их сборку и паттерны сократимости [32]. Эти данные в определенной степени могут объяснить выявляемые ранние изменения миокарда у пациентов с РА еще до развития ССЗ, так как аутоиммунный процесс начинается задолго до клинической манифестации поражения суставов.
В отличие от хорошо описанного вклада системного воспаления в раннее развитие и прогрессирование атеросклероза при РА, его роль в развитии неишемической болезни сердца менее изучена. Активные воспалительные процессы в сердце могут приводить к чрезмерному фиброзу миокарда, вызывая жесткость желудочков, и способствовать систолической и диастолической дисфункции и аритмии сердца [33]. Данные МРТ и ПЭТ-КТ сердца подтвердили наличие взаимосвязей между активностью заболевания и воспалением миокарда, его фиброзом [33]. Структурные изменения в миокарде, наблюдаемые при МРТ сердца, также взаимосвязаны с диагностическими маркерами системного воспаления. Высокая активность заболевания и повышенный уровень СРБ связаны с повышенной распространенностью диастолической сердечной недостаточности.
«Лечение до цели»
Улучшение стратегии лечения пациентов с РА в определенной степени позволило снизить риск ССЗ [34]. Учитывая ключевую роль хронического воспаления и аутоиммунных нарушений в развитии атеросклероза и связанных с ним сердечно-сосудистых осложнений (ССО) при РА, важное место в их профилактике занимает проведение эффективной противовоспалительной терапии, которая позволяет не только модифицировать течение болезни, но и снизить риск кардиоваскулярных катастроф.
Следует особо подчеркнуть, что данные, полученные в отношении кардиоваскулярных эффектов противовоспалительных препаратов, использующихся для лечения РА, могут иметь существенное значение для разработки новой стратегии профилактики и лечения атеросклеротического поражения сосудов. Полагают, что эти препараты, с одной стороны, обладают антиатерогенным действием за счет подавления «воспалительного» компонента атеротромбоза, с другой – могут оказывать как позитивное, так и негативное влияние на сосудистую стенку, систему транспорта холестерина (ХС) и свертывание крови, тем самым разнонаправленно влияя на риск ССО. По данным эпидемиологических исследований, высокая активность РА ассоциируется с увеличением кардиоваскулярного риска, а применение базисных противовоспалительных препаратов – БПВП (метотрексат – МТ) и генно-инженерных биологических препаратов – ГИБП (ингибиторы ФНО-α) – со снижением риска ССО. В течение последних 20 лет наблюдается снижение общей летальности при РА, во многом связанное с совершенствованием стратегии противовоспалительной терапии («Лечение до достижения цели» – Treat to target, Т2Т), направленной на достижение ремиссии заболевания [35].
Напомним, что эта стратегия основана на применении МТ, начиная с ранних стадий болезни, а при недостаточной эффективности монотерапии МТ – комбинированной терапии МТ и ГИБП. После внедрения в повседневную клиническую практику стратегии раннего назначения БПВП и ГИБП активность и тяжесть РА уменьшились, однако возможности снижения риска ССО при использовании стратегии Т2Т остаются недостаточно изученными. С одной стороны, тенденция к снижению смертности от ССЗ при РА отсутствует, несмотря на внедрение новых высокоэффективных методов лечения заболевания [36], с другой – новые подходы к лечению РА и достижение ремиссии заболевания ассоциируются со значительным снижением общей смертности и частоты ССО [37]. Риск развития ССО у больных РА, находящихся в ремиссии, на 53% ниже, чем у больных с сохраняющейся высокой активностью заболевания. Интересными представляются данные первого проспективного исследования влияния низкой активности РА на риск ССО [38]. Частота фатальных ССО у больных с низкой активностью РА значимо ниже (6,9%), чем у пациентов с умеренной и высокой активностью заболевания (52,9%), причем только использование МТ явилось значимым кардиопротективным фактором.
В настоящее время убедительно показано, что МТ позволяет не только эффективно контролировать клиническую активность РА, но и снижать риск кардиоваскулярной патологии [39, 40]. Механизмы действия МТ связаны с подавлением образования таких медиаторов воспаления и атерогенеза, как ИЛ-6, ИЛ-1 и ФНО-α [41], который, в свою очередь, обусловлен индукцией образования аденозина, обладающего мощной противовоспалительной активностью. Однако имеются данные и о прямом антиатерогенном эффекте МТ. Недавно появились данные, позволяющие по-новому оценить механизмы антиатерогенного действия МТ [39]. Считается, что, поскольку дисфункция эндотелия предшествует развитию атеросклероза, большое значение имеет применение препаратов, способных активировать цитопротективные сигнальные пути, предотвращающие (или отменяющие) дисфункцию эндотелия. Один из этих важных цитопротективных путей регулируется аденозин-монофосфат-активированной киназой (АМФК). Установлено, что в клетках сосудистого эндотелия АМФК проявляет многообразные протективные эффекты, включающие усиление образования синтетазы оксида азота, предотвращение апоптоза и окислительного повреждения эндотелиальных клеток. Введение МТ NZWxBXSB F1 мышам, у которых спонтанно развивается воспалительная васкулопатия, существенно снижает выраженность повреждения сосудов. Этот эффект связан с активацией АМФК, опосредуемой фосфорилированием CREB (cyclic AMF response element-binding protein), и не зависит от синтеза аденозина. У пациентов, страдающих РА, отмечается снижение противовоспалительной и антиоксидантной активности ХС липопротеидов высокой плотности (ЛПВП) и нарушение обратного транспорта ХС из клеток, коррелирующее с активностью воспаления. Следует напомнить, что обратный транспорт ХС из макрофагов осуществляется главным образом за счет мембранных транспортеров, к которым относятся SR-B1 (scavenger receptor class B type 1), ABCA1 (ATPbinding cassette A1) и ABCG1 (ATP-binding cassette G1).
При этом параметр, получивший название «способность к обратному транспорту ХС» (CEC-serum cholesterol efflux capacity), коррелирует с нарушениями функции сосудистой стенки и риском развития атеросклероза. Установлено, что лечение МТ ассоциируется с увеличением концентрации ХС ЛПВП в сыворотке на фоне усиления ABCA1- и SR-B1-опосредованного обратного транспорта ХС из макрофагов. Таким образом, снижение риска ССО на фоне лечения МТ при РА определяется не только противовоспалительными эффектами этого препарата, но и способностью оказывать специфический антиатерогенный эффект, связанный с прямым влиянием на функцию липопротеидов, их транспорт и поглощение ХС макрофагами.
Выраженное противовоспалительное и антиатерогенное действие, положительный профиль безопасности и многочисленные данные о кардиопротективном эффекте МТ при РА послужили основанием для проведения контролируемых исследований, цель которых – подтверждение гипотезы о воспалительной природе атеросклероза как в общей популяции пациентов, страдающих ИБС, так и у больных ИБС и РА. В исследование CIRT (The Cardiovascular Inflammation Reduction Trial) планируется включить более 7 тыс. пациентов, перенесших ИМ и/или страдающих сахарным диабетом 2-го типа либо метаболическим синдромом [40]. Больные будут разделены на две группы, в одной из которых будут назначены низкие дозы МТ (15–20 мг/нед), в другой – плацебо. Основным показателем эффективности будет частота развития ИМ, инсульта и летальных исходов, связанных с кардиоваскулярной патологией, а дополнительным – общая летальность, потребность в реваскуляризации миокарда, частота развития ХСН. В исследование CADERA (Coronary Artery Disease Evaluation in Rheumatoid Arthritis) войдут пациенты, которые будут получать МТ или комбинированную терапию МТ и ингибитором ФНО-α этанерцептом [41]. Основным показателем эффективности будет широкий спектр параметров МРТ, отражающих патологию коронарных сосудов и миокарда. В свете современной концепции о воспалительной природе атеросклероза несомненный интерес представляет изучение кардиоваскулярных эффектов глюкокортикоидов (ГК) [40]. В большинстве рандомизированных клинических исследований показано, что у больных РА низкие дозы ГК в течение 1–3 лет значимо не увеличивают кардиоваскулярный риск, но длительное использование ГК приводит к увеличению риска ССЗ. Комбинированная терапия ГК в низких дозах (<7,5 мг/сут) и БПВП способствует нормализации индекса атерогенности, улучшению эндотелиальной функции, снижению инсулинорезистентности параллельно со снижением активности болезни. Длительное (2–5 лет) применение низких доз ГК (4–6 мг/сут) ассоциируется с увеличением риска развития артериальной гипертензии на 30%, свыше 5 лет – с увеличением риска развития артериальной гипертензии на 37% и ИМ на 16%. В популяционном исследовании (регистр CORRONA) доказано 5-кратное увеличение риска ССО в группе больных, получающих ГК в дозе >7,5 мг/сут. ФНО-α рассматривают как один из ключевых медиаторов атерогенеза, поскольку он индуцирует дисфункцию эндотелия; усиливает экспрессию клеточных молекул, способствующих миграции лейкоцитов в сосудистую стенку; принимает участие в «дестабилизации» атеросклеротических бляшек; подавляет антикоагулянтные и усиливает прокоагулянтные свойства сосудистого эндотелия; вызывает нарушение сократимости миокарда; принимает участие в синтезе острофазовых белков [42]. Данные клинико-эпидемиологических исследований и их метаанализы свидетельствуют о снижении частоты ССО у пациентов, получавших ингибиторы ФНО-α [40], несмотря на увеличение уровней ХС липопротеидов низкой плотности (ЛПНП) и общего ХС. Таким образом, положительный кардиоваскулярный эффект ингибиторов ФНО-α у больных РА трудно объяснить динамикой изменения концентрации ЛП в крови. Хотя гиперпродукция ФНО-α участвует в развитии ХСН, применение ингибиторов ФНО-α у пациентов с ХСН (в том числе с РА) не только не приводит к улучшению состояния больных, но и способствует декомпенсации ХСН. Многочисленные исследования указывают на связь между повышением уровня ИЛ-6, прогрессированием атеросклероза и развитием сосудистых осложнений как в общей популяции пациентов с ИБС, так и при ее сочетании с РА [43]. В рамках программы скрининга генома (Genome Wide Association Studies) выявлена ассоциация между носительством однонуклеотидных полиморфизмов (Single nucleotide polymorphism – SNP) гена, кодирующего ИЛ-6-рецептор (IL6R re7529229) и риском развития ИБС [44]. Это позволило предположить, что моноклональные антитела, блокирующие рецептор ИЛ-6 тоцилизумаб (ТЦЗ), которые с успехом применяются для лечения РА, могут предотвращать развитие атеросклеротического поражения сосудов [45]. Однако, по нашим данным, на фоне лечения ТЦЗ параллельно снижению воспалительной активности заболевания наблюдаются повышение концентрации ХС и ХС ЛПНП, увеличение толщины комплекса «интима-медиа» (КИМ) сонных артерий, а у ряда пациентов отмечено появление атеросклеротических бляшек в сонных артериях [46]. Разумеется, эти результаты требуют дополнительного анализа и динамического наблюдения больных РА. Предполагается, что, несмотря на повышение концентрации атерогенных ЛП на фоне лечения ТЦЗ, подавление активности воспаления опосредованно приводит к улучшению качественного состава частиц ХС ЛПВП, тем самым нивелируя негативные эффекты гиперлипидемии. Ретроспективный анализ результатов контролируемых исследований свидетельствует о том, что развитие ССО у пациентов с РА на фоне лечения ТЗЦ ассоциируется не с негативной динамикой липидов сыворотки, а с сохраняющейся активностью воспалительного процесса [47].
По данным анализа результатов исследований абатацепта (АБЦ), у больных РА отмечен относительно благоприятный профиль кардиоваскулярной безопасности (отсутствие достоверных различий по частоте развития ИМ, остановки сердца, артериальной гипертензии и ХСН между пациентами, получающими АБЦ в сочетании с БПВП, и больными на терапии БПВП и плацебо) [39].
Изучение влияния ритуксимаба (РТМ) на развитие атеросклеротического поражения сосудов позволяет по-новому взглянуть на роль В-клеточного (гуморального) звена иммунитета в патогенезе этой патологии. По нашим данным, при РА эффективная терапия РТМ ассоциируется с повышением концентрации ХС ЛПВП, снижением индекса атерогенности, минимальным увеличением уровней ХС, ХС ЛПНП, а также положительной динамикой толщины КИМ сонных артерий. Кроме того, отмечено стойкое благоприятное влияние РТМ на такой предиктор внезапной сердечной смерти, как вариабельность ритма сердца. Таким образом, подавление активности РА на фоне лечения РТМ приводит к снижению риска кардиоваскулярной патологии [48].
Несмотря на применение препаратов, снижающих активность РА, риск ССО остается повышенным по сравнению с общей популяцией. И это не удивительно, так как уменьшение активности РА – лишь одна «сторона медали». Другим важным пунктом профилактики ССО является адекватный контроль традиционных факторов риска ССЗ. Наряду с противовоспалительной терапией существенное место в профилактике кардиоваскулярной летальности при РА принадлежит статинам, которые, помимо снижения ЛП, обладают многообразными противовоспалительными и иммуномодулирующими плейотропными эффектами, имеющими прямое отношение к иммунопатогенезу этого заболевания.
При РА применение статинов ассоциируется с подавлением клинических и лабораторных показателей активности и снижением общей летальности на 20%. Статины являются «краеугольным камнем» первичной и вторичной профилактики ССО, в том числе и у больных РА. Недавно доказано, что низкая приверженность лечению статинами ведет к увеличению кардиоваскулярного риска как при первичной, так и при вторичной профилактике ССО, особенно у больных сахарным диабетом и РА [49, 50].
Планирование новых клинических исследований по эффективности различных терапевтических подходов у пациентов с РА должно осуществляться с учетом эффективности терапии не только на снижение активности заболевания, но и эффективности по защите сердечно-сосудистой системы, снижения риска развития сердечно-сосудистых событий [51, 52].
Стратификация кардиоваскулярного риска у пациентов с ревматоидным артритом
Коморбидность оказывает неблагоприятное влияние на течение и прогноз РА, а ССЗ являются наиболее распространенными и социально значимыми сопутствующими заболеваниями и основной причиной преждевременной летальности при РА [53]. Традиционные факторы сердечно-сосудистого риска (ССР), такие как курение, сахарный диабет, гипертония, дислипидемия и ожирение, оказывают значимое влияние на развитие ССЗ у пациентов с РА. Однако, помимо традиционных кардиоваскулярных факторов риска, важное место занимают РА-ассоциированные (нетрадиционные) факторы риска: активность РА, длительность РА, серопозитивность по ревматоидному фактору и антителам к циклическому цитруллинированному пептиду. Следует обратить внимание на существование общих факторов риска развития РА и атеросклеротического поражения сосудов, к которым относятся полиморфизмы ряда генов, кодирующих антигены главного комплекса гистосовместимости (HLA-DR-B1), ФНО-308 (rs1800629), а также факторы транскрипции, регулирующие синтез провоспалительных медиаторов – NFκB (nuclear factor kappa-light-chain-enhancer of activated B cells), MHC2TA (Class II, Major Histocompatibility Complex, Transactivator), IFR (interferon regulatory factor). Таким образом, аутоиммунное воспаление – основной фактор риска развития клинических и субклинических проявлений атеросклероза, поэтому не случайно хронический артрит рассматривают как «естественную» модель для изучения атеросклероза, и фактически ускоренное развитие последнего можно рассматривать как своеобразное системное проявление РА [53, 54].
К основным традиционным шкалам риска ССЗ относят: Framingham Risk Score [54], Systematic COronary Risk Evaluation (SCORE) [55], Reynolds Risk Score (RRS) [56] и Алгоритм, разработанный Американским колледжем кардиологов / Американской кардиологической ассоциацией в 2013 г. (ACC/AHA 2013) [57].
Шкала SCORE [55] разработана на основе крупных европейских когортных исследований. Эта модель оценивает 10-летний риск первого фатального события, связанного с атеросклерозом (ИМ, инсульт, аневризма аорты), и рассчитывается с учетом возраста, пола, привычек курения, общего холестерина (ОХС) и систолического артериального давления пациента. В соответствии с рекомендациями Европейской антиревматической лиги (EULAR) для прогнозирования ССР для пациентов с РА следует использовать модифицированный индекс SCORE (mSCORE), который рассчитывается посредством умножения SCORE на коэффициент 1,5. Шкала RRS [56] оценивает 10-летний суммарный риск развития ССЗ (ИМ, инсульт, аневризма аорты), а также риск смерти от ССЗ. При расчете данной шкалы учитываются такие факторы риска, как отягощенная наследственность по ССО, а также высокочувствительный СРБ, что в конечном итоге улучшает качество прогнозирования суммарного ССР по сравнению с расчетом по шкалам Framingham Risk Score и SCORE. Указанные шкалы протестированы на пациентах с РА, и все они показали недостаточную прогностическую ценность, приводящую к недооценке кардиоваскулярного риска у этой категории больных [58].
Стратификация пациентов с РА в соответствии с риском ССЗ до сих пор остается сложной проблемой, особенно в случаях с низким или промежуточным ССР. Продолжается поиск эффективных инструментов стратификации риска ССЗ, специфичных для пациентов с РА. Разработаны три шкалы (ASSIGN, QRISK3,
ERS-RА), при расчете которых учитывается само заболевание – РА. Шкала риска Assessing Cardiovascular Risk to Scottish Intercollegiate Guidelines Network/SIGN to Assign Preventative Treatment (ASSIGN) [59], разработанная на основе репрезентативной базы данных в Шотландии, также оценивает 10-летний ССР, включая смерть от ССЗ, или диагноз ИБС, цереброваскулярную болезнь при выписке из больницы, или вмешательство на коронарной артерии. Помимо учета традиционных факторов риска система оценки ASSIGN включает индекс социального статуса, с помощью которого могут учитываться социальные градиенты болезни. Шкала риска QRISK (алгоритм QRESEARCH Cardiovascular Risk Algorithm) [60] разработана на основании данных общемедицинской практики в Великобритании и оценивает 10-летний риск ССЗ, включая ИМ, ИБС, инсульт. Оцениваемыми факторами риска стали возраст, пол, курение, систолическое артериальное давление, соотношение ХС к ХС ЛПВП, курение, ИМТ, семейный анамнез ИБС, социальный статус и терапия антигипертензивными средствами. Проверка валидности шкалы проводилась в той же популяции, на которой шкала разработана, что является основным недостатком данной шкалы. Калькулятор QRISK3 в отличие от предыдущих шкал QRISK и QRISK2 рассматривает РА как отдельный фактор риска ССЗ и включает в себя больше факторы риска развития ССЗ (хроническое заболевание почек, мигрень, прием ГК, системная красная волчанка, тяжелые психические заболевания, эректильная дисфункция и т.д.).
Калькулятор расширенной оценки ССР при РА Expanded Risk Score in RA (ERS-RA) [61] рассчитан в 2015 г. с использованием данных из реестра Консорциума исследователей ревматологии Северной Америки (CORRONA). Особенностью калькулятора ERS-RA является включение в оценку риска ССЗ таких специфических для РА характеристик, как длительность, активность РА, функциональная недостаточность, прием ГК. Ранее показано, что учет РА-ассоциированных (нетрадиционных) факторов риска может вносить значительный вклад в улучшение качества прогнозирования сердечно-сосудистых событий при РА [62]. Основные параметры, входящие в шкалы, суммированы в табл. 2. В последние годы для улучшения стратификации суммарного риска ССО ведется поиск и разработка новых различных моделей, с помощью которых можно оценить индивидуальный риск для каждого пациента с РА. Трансатлантический сердечно-сосудистый консорциум по РА (ATACC-RA consortium – A TransAtlantic Cardiovascular Risk Calculator for Rheumatoid Arthritis) недавно выпустил калькулятор сердечно-сосудистого риска РА [63]. Существует много препятствий при внедрении такого калькулятора в клиническую практику. Калькулятор риска, который включает в себя как сердечно-сосудистые, так и ревматологические факторы, может потребовать скоординированной помощи как ревматолога, так и кардиолога или врачей общей практики, чтобы получить все меры, необходимые для его оценки, особенно если требуется совместный подсчет. Даже такие показатели, о которых сообщают пациенты, такие как HAQ, требуют времени для расчета. Для прогнозирования повышенного риска ССЗ наряду со шкалами применяется ультразвуковая оценка толщины КИМ сонной артерии, что является безопасным, неинвазивным и экономичным методом раннего выявления атеросклероза. Считается, что атеросклеротические бляшки сонных артерий являются суррогатным маркером ИБС и используются для превентивной оценки риска ССЗ. А внедрение толщины КИМ в интегрированные показатели кардиоваскулярного риска значительно улучшает стратификацию ССР по сравнению с традиционными калькуляторами у пациентов без РА [64–66].
Определение наиболее точной шкалы риска ССЗ, прогнозирующей атеросклеротическое поражение сонных артерий, поможет более качественно выявлять пациентов с высоким ССР на основе оценки традиционных и нетрадиционных кардиоваскулярных факторов риска при РА. Представленный далеко не полный перечень проблем, находящихся на стыке ревматологии, кардиологии и терапии, свидетельствует об актуальности изучения кардиоваскулярной патологии при иммуновоспалительных ревматоидных заболеваниях. Эти исследования имеют важное теоретическое и практическое значение для разработки новых подходов к профилактике и лечению патологии сердечно-сосудистой системы при ревматоидных заболеваниях.
Заключение
В настоящее время установлена высокая частота поражений сердца у больных РА с существенным повышением риска неблагоприятных сердечно-сосудистых событий: развитием ИМ, сердечной недостаточности, нарушений ритма, внезапной сердечной смерти и общей сердечно-сосудистой смерти. Важным фактом является установление дисфункции миокарда у пациентов с момента манифестации РА, прогрессирования атеросклероза коронарных артерий.
У большинства пациентов с РА в течение многих лет, особенно на фоне боли в суставах, скованности, ограничения физической активности, клиническая симптоматика, характерная для поражения коронарных артерий и миокарда, не выступает на первый план, что, по-видимому, и является основой для мнения о клинически незначимом поражении сердца. При этом для больных с РА характерна худшая выживаемость после перенесенного ИМ как в ближайшем, так и в отдаленном периоде.
Стратификация ССР при РА представляет серьезную проблему. Шкалы ССР, одобренные для населения в целом, часто недооценивают кардиоваскулярный риск у больных РА. Калькуляторы mSCORE, RRS, ASSIGN, QRISK3 в равной степени прогнозируют атеросклеротическое поражение сонных артерий у больных РА. Для идентификации риска развития ССЗ у больных РА наиболее информативными являются вычисление mSCORE и определение толщины КИМ сонных артерий.
Имеющиеся на сегодняшний день факты позволяют говорить о РА как о заболевании, вносящем существенный вклад в сердечно-сосудистую заболеваемость и смертность. А это обусловливает необходимость пересмотра тактики ведения пациентов с РА с определением новых терапевтических целей и в конечном итоге разработки успешных кардиопротективных методов лечения пациентов.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Клинический разбор в общей медицине №3 2022
Сложности оценки поражений сердца и стратификации кардиоваскулярного риска у больных с ревматоидным артритом
Аннотация
Ревматоидный артрит (РА) – хроническое системное воспалительное заболевание соединительной ткани с прогрессирующим поражением преимущественно периферических суставов с частыми внесуставными проявлениями, среди которых поражение сердца, по данным вскрытия, отмечается до 60% случаев. При этом клинические изменения со стороны сердца, как правило, минимальные и редко выходят на первый план в общей картине основной болезни. В настоящем обзоре рассмотрены поражения оболочек сердца, патология коронарных артерий, вторичный амилоидоз сердца при РА. При поражении суставов, когда заметно снижается физическая активность, сердечная патология часто маскируется, что требует от врача более внимательного и тщательного обследования больного. Кроме того, врач получит информацию о стратификации кардиоваскулярного риска при РА, научится выделять группы пациентов с РА, предрасположенных к развитию сердечно-сосудистых осложнений, сможет разработать комплекс профилактических и лечебных мероприятий, направленных на снижение риска индивидуально для каждого больного; создать систему динамического контроля и наблюдения за развитием сердечно-сосудистой патологии у данной категории больных и целенаправленно лечить коморбидных пациентов. Ключевые слова: ревматоидный артрит, поражение сердца, перикардит, миокардит, эндокардит, вальвулит, артериит, сердечно-сосудистый риск, стратификация кардиоваскулярного риска, коморбидность. Для цитирования: Громова М.А., Цурко В.В., Кисляк О.А. и др. Сложности оценки поражений сердца и стратификации кардиоваскулярного риска у больных с ревматоидным артритом. Клинический разбор в общей медицине. 2022; 3: 29–42. DOI: 10.47407/kr2022.3.3.00132
Difficulties of assessing heart damages and stratification of cardiovacular risk in patients with rheumatoid arthritis
Margarita A. Gromova1, Vladimir V. Tsurko1, Oxana A. Kislyak1, Stefka G. Radenska-Lopovok2, Yulia B. Chervyakova1
Abstract
Rheumatoid arthritis (RA) is a chronic systemic inflammatory disease of the connective tissue with a progressive lesion of predominantly peripheral joints with frequent extra-articular manifestations, among which heart damage, according to autopsy data, is observed in up to 60% of cases. At the same time, clinical changes in the heart, as a rule, are minimal and rarely come to the fore in the overall picture of the underlying disease. This review considers lesions of the membranes of the heart, pathology of the coronary arteries, secondary amyloidosis of the heart in RA. With damage to the joints, when physical activity is noticeably reduced, cardiac pathology is often masked, which requires a more careful and thorough examination of the patient from the doctor. In addition, the doctor will receive information about the stratification of cardiovascular risk in RA, learn to identify groups of patients with RA who are predisposed to the development of cardiovascular complications, and be able to develop a set of preventive and therapeutic measures aimed at reducing the risk individually for each patient; to create a system of dynamic control and monitoring of the development of cardiovascular pathology in this category of patients and purposefully treat comorbid patients.
Key words: rheumatoid arthritis, heart disease, pericarditis, myocarditis, endocarditis, valvulitis, arteritis, cardiovascular risk, cardiovascular risk stratification, comorbidity.
For citation: Gromova M.A., Tsurko V.V., Kislyak O.A. et al. Difficulties of assessing heart damages and stratification of cardiovacular risk in patients with rheumatoid arthritis
Введение
Ревматоидный артрит (РА) является системным процессом с поражением не только суставов, но и различных внутренних органов, включая сердце. Изменения в сердце при РА в недавнем прошлом выделяли в суставно-сердечную форму заболевания. При поражении суставов, когда заметно снижается физическая активность, сердечная патология часто маскируется: клинические изменения со стороны сердца, как правило, минимальные и редко выходят на первый план в общей картине основной болезни, что усложняет оценку поражений сердца при РА и требует от врача более внимательного и тщательного обследования больного. У пациентов с РА примерно на 50% выше риск развития сердечно-сосудистых событий [1] и сердечно-сосудистой смерти [2]. Величина этих рисков различается в различных исследованиях, что обусловлено особенностями когорт включенных пациентов, особенностями и эффективностью проводившейся терапии, временем наблюдения [3, 4]. Имеются данные о величине объединенного относительного риска 1,68 для инфаркта миокарда (ИМ) и 1,87 для застойной сердечной недостаточности [5]. А в другом исследовании пациенты с РА имели повышенный риск ИМ с отношением шансов (ОШ) 2,50 (95% доверительный интервал – ДИ 0,77–8,14) [6], на 60% более высокий риск смерти от сердечно-сосудистых заболеваний (ССЗ) по сравнению с населением в целом [6].
Таким образом, РА является фактором риска развития ССЗ и их осложнений, а системные проявления (поражения сердца) у пациентов с РА являются клинически значимыми, определяют прогноз в целом, поэтому важно их раннее распознавание и целенаправленное лечение [1].
Особенности поражения сердца у больных ревматоидным артритом Миокардит
В воспалительном инфильтрате преобладают лимфогистиоцитарные элементы как в периваскулярном пространстве (рис. 1), так и в стенке сосудов. Следует отметить, что при активации основного процесса наблюдается сочетание старых и свежих сосудистых изменений. Наряду с этим встречается очаговый, или диффузный, интерстициальный миокардит, заканчивающийся развитием мелкоочагового кардиосклероза. У больных РА нередко развивается бурая атрофия миокарда с накоплением липофусцина в кардиомиоцитах (рис. 2). Эти изменения могут являться причиной стенокардии. Патогномоничным признаком РА являются ревматоидные узелки в миокарде, перикарде и эндокарде в основании митрального и аортального клапанов, в области фиброзного кольца. В исходе узелка развивается склероз, вызывающий формирование недостаточности клапанов. Миокардит проявляется и диагностируется, как правило, на высоте активности основного ревматоидного процесса, т.е. при очередном выраженном обострении суставного синдрома.
Ведущей жалобой при миокардите в дебюте поражения сердца являются неприятные ощущения в области сердца (кардиалгии), невыраженные, длительные, разлитые и без четкой локализации, как правило, без иррадиации и некупирующиеся нитратами. К основным жалобам относятся сердцебиение, перебои и реже одышка при физической нагрузке. Быструю утомляемость, повышенную потливость и субфебрилитет врачи обычно связывают с очередным обострением РА, а не с кардиальной патологией [7].
При аускультации физикальные данные выявляют тахикардию и ослабление I тона с систолическим шумом, нередко удается выслушать III тон. Как правило, миокардит при РА не склонен к прогрессированию, признаки сердечной недостаточности отсутствуют [7].
При обычном ЭКГ-исследовании могут отмечаться снижение зубцов Т, опущение ST-интервалов, небольшие нарушения внутрижелудочковой проводимости. Эти изменения неспецифичны и могут сопровождать различные заболевания. Более характерное для миокардитов замедление атриовентрикулярной проводимости бывает редко.
Дифференциальная диагностика миокардита и миокардиодистрофии, нередко проводящаяся у больных РА, длительно получающих массивную лекарственную терапию, затруднена, так как клинические проявления в том и другом случае близки [5, 6]. Наличие миокардита подтвердит положительная динамика его проявлений под влиянием правильно подобранного и назначаемого в адекватных дозах противоревматического лечения.
Перикардит
Перикардит является наиболее характерным поражением сердца при РА [1]. Патологоанатомически он выявляется в подавляющем большинстве случаев в виде фиброзного, реже геморрагического перикардита; нередко обнаружение характерных ревматических гранулем. Отличительной особенностью перикардита при РА является участие в воспалении крупных базофильных гистиоцитов под зоной фибринозных наложений. Глубже формируется грануляционная ткань, содержащая лимфоциты и плазматические клетки, с утолщением перикарда и формированием грубого склероза (рис. 3).
Больной может предъявлять жалобы на боли в области сердца разной интенсивности и длительности. Частота клинической диагностики перикардита различна (20–40%) и зависит в основном от тщательности клинического изучения больного и уровня компетентности клинициста. В большинстве случаев анатомически определяются спайки в полости перикарда и утолщение последнего за счет склеротического процесса, нередко рецидивирующего. Выпот обычно небольшой, без признаков тампонады. Подтверждается, как правило, данными рентгенологического исследования, указывающими на нечеткость и неровность контуров сердца. Шумы трения перикарда непостоянны, выслушиваются далеко не у всех больных, хотя в некоторых случаях остаются длительно в виде перикардиальных щелчков в различные фазы сердечного цикла, что фиксируется качественным ФКГ-исследованием.
ЭКГ-изменения у большинства больных неспецифичны для перикардита. Но в случае появления даже умеренного экссудата можно наблюдать снижение вольтажа QRS с положительной динамикой при уменьшении выпота. Перикардиты при РА склонны к рецидивированию. В части случаев перикардиты сопровождаются появлением конкордантных отрицательных зубцов Т на многих ЭКГ-отведениях, что может приводить к постановке ошибочного диагноза ИМ. Большое значение в обнаружении РА-перикардитов имеет эхокардиография, позволяющая выявлять изменения перикарда (его уплотнение, утолщение, наличие жидкости) и динамику этих изменений при повторных исследованиях. Во многих случаях эхокардиографические изменения перикардита являются неожиданной находкой как для больного, так и для лечащего врача [7].
Эндокардит
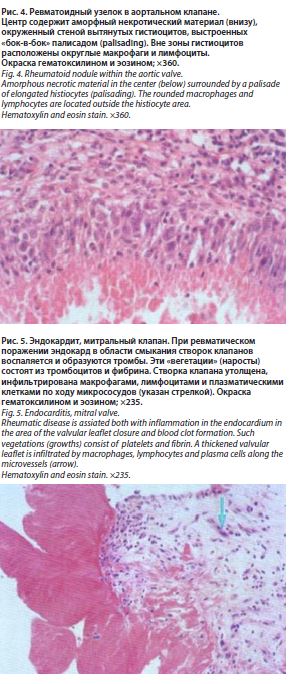
Эндокардит при РА отмечается значительно реже, чем перикардит. Патологоанатомические данные свидетельствуют о нередком вовлечении в процесс эндокарда, в том числе клапанного, в виде неспецифических воспалительных изменений в створках и клапанном кольце, а также специфических гранулем. У большинства больных вальвулит протекает благоприятно, не приводит к значительной деформации створок и не имеет ярких клинических проявлений. Однако у некоторых больных течение вальвулита может осложняться деформацией створок и сопровождаться выраженной недостаточностью пораженного клапана, чаще митрального, что диктует необходимость хирургической коррекции порока. Обычно эндокардит сочетается с миокардитом и перикардитом [6].
При обнаружении у больного РА митрального стеноза всегда необходимо исключать ревматическую этиологию его, так как сочетание РА с предшествующим ревматическим пороком признается многими авторами. Кроме того, необходимо исключить атеросклеротический генез пороков сердца. Вместе с тем вполне вероятно, что собственно ревматоидное поражение клапанов может служить тем благоприятным фоном, на котором в дальнейшем развиваются выраженные структурные изменения створок, патология которых доминирует как в клинической, так и в эхокардиографической картине атеросклеротического поражения клапанов сердца. В каждом случае вопрос о генезе порока при РА требует учета всех имеющихся клинических данных [7].
Вторичный амилоидоз сердца Амилоидная кардиомиопатия – поражение сердца, обусловленное внеклеточным отложением амилоида.
В ряде случаев может быть локальное поражение структур сердца, например предсердий, чаще поражение сердца является частью системной (генерализованной) патологии. В зависимости от белка-предшественника амилоида выделяют 36 типов амилоидоза. Сердце поражается при системном AL – (70–80%), ATTR – (15–25%), AA – (2–7%), Аβ2m-, AApoAI-амилоидозе и локальном AANF-амилоидозе предсердий (табл. 1) [8, 9, 14].
АА-амилоидоз (реактивный, вторичный амилоидоз) развивается при хронических воспалительных заболеваниях, которые обычно сложно поддаются контролю: серопозитивных и серонегативных полиартритах, хронических воспалительных заболеваниях кишечника, хронических нагноениях, туберкулезе, злокачественных солидных опухолях, аутовоспалительных заболеваниях. АА-амилоид образуется из сывороточного предшественника SAA (serum amyloid A) – острофазового белка, продуцируемого печенью в ответ на воспаление [10, 13, 14]. Поскольку SAA активно продуцируется синовиальной оболочкой суставов, дополнительным фактором риска амилоидоза является манифестация воспалительного заболевания с суставным синдромом [10, 13, 14].
Амилоидоз сердца необходимо диагностировать как при выявлении амилоидной инфильтрации при эндомиокардиальной биопсии, так и при утолщении стенки левого желудочка >12 мм в отсутствии артериальной гипертензии или других причин для развития гипертрофии левого желудочка при выявлении амилоида внесердечной локализации. Скрининговое обследование на амилоидоз необходимо при хронической сердечной недостаточности (ХСН) неясной этиологии (особенно c сохраненной фракцией выброса левого желудочка), рефрактерной к терапии, в сочетании с протеинурией и хронической болезнью почек 4–5-й стадии; идиопатической фибрилляции предсердий и нарушениях проводимости, утолщении стенки левого желудочка неясной этиологии, наличии низкого вольтажа зубцов при электрокардиографии, необъяснимой артериальной гипотензии и легочной гипертензии.
При развитии у больного РА сердечной недостаточности (особенно c сохраненной фракцией выброса левого желудочка), резистентной к обычной терапии, следует иметь в виду вторичный амилоидоз сердца. Скрининг на амилоидоз должен включать как неинвазивные методы, в том числе электрофорез и иммунофиксацию белков крови и мочи, исследование на свободные легкие цепи иммуноглобулинов лямбда и каппа, 99Tc-DPD-сцинтиграфию, генетическое тестирование (при подозрении на наследственные варианты амилоидоза), так и морфологическое исследование биоптатов различной локализации с окраской Конго красным и поляризационной микроскопией. Для профилактики развития AA-амилоидоза необходимо адекватное лечение основного заболевания. При оценке риска развития и прогрессирования АА-амилоидоза необходим контроль за уровнем SAA, C-реактивного белка, ферритина, кальгранулина (сывороточный маркер нейтрофильной активности S100A12) [14].
Какие основные пути поражения сердца у больных ревматоидным артритом?
Первый путь – поражение коронарных артерий с формированием ишемической болезни сердца (ИБС). Разрыв атеросклеротических бляшек может вызвать образование тромбов, которые могут локально блокировать коронарные кровеносные сосуды и приводить к острому коронарному синдрому. Недостаточное поступление кислорода в миокард может привести к дисфункции кардиомиоцитов, что определяет снижение сократительной функции сердечной мышцы. Поражение коронарных артерий может проявляться стенокардией, приводить к развитию кардиомиопатии или аритмии. В острой форме полная окклюзия крупных артерий может привести к ИМ и внезапной сердечной смерти [15].
Другой путь поражения сердца – развитие неишемической болезни сердца с изменениями клеточного состава и структуры сердечной мышцы. Кардиомиопатия представляет собой наиболее распространенный тип неишемической болезни сердца, при которой развивается гипертрофия миокарда желудочков, а сам миокард становится жестким [16].
Современные диагностические возможности позволяют выявлять субклинические и бессимптомные изменения в сердце на самых ранних этапах развития РА, обеспечивают точное представление о структуре и функциях сердечно-сосудистой системы. Так, результаты магнитно-резонансной томографии (МРТ) сердца и позитронно-эмиссионной томографии (ПЭТ-КТ) у пациентов с РА без диагноза ССЗ свидетельствуют, что практически у 50% пациентов уже имеются признаки фиброза или воспаления миокарда [17, 18]. Изменения в миокарде являются причиной выявляемой увеличенной массы миокарда левого желудочка у пациентов с РА без артериальной гипертонии и других ССЗ [19], а гипертрофия миокарда может на определенном этапе сопровождаться снижением сократительной функции. Примечательно, что снижение систолической и диастолической функций левого желудочка установлено у 50% пациентов с РА без клинических признаков сердечной недостаточности [20, 21]. У пациентов без клинически выраженного сердечного повреждения установлено ухудшение систолической функции левого желудочка, оцениваемой по деформации миокарда левого желудочка, измеренной с помощью отслеживания характеристик магнитного резонанса сердца [17–21].
Важным является установленный факт формирования концентрического ремоделирования миокарда левого желудочка у пациентов с РА еще до клинических проявлений ССЗ и в отсутствие общих сердечно-сосудистых факторов риска [22]. При изучении деформации миокарда во время сокращения и релаксации желудочков при использовании эхокардиографии слежения (STE) установлено, что продольная структура стенки левого и правого желудочков на систолическом пике значительно ухудшается у пациентов с сохраненной диастолической функцией. Этот результат сохранялся после корректировки на возраст, пол, артериальное давление, индекс массы тела (ИМТ) и сердечный ритм, после сравнения пациентов с контролем [22].
У пациентов с РА выявлены субклинические изменения и в коронарной микроциркуляции [23]. Так, при измерении резерва потока миокарда установлено, что у 1/3 пациентов с РА без клинических сердечно-сосудистых проявлений имеется сердечная микрососудистая дисфункция [23, 24]. В отсутствие клинических проявлений поражения коронарных артерий у пациентов с РА имеются более высокие распространенность, степень и тяжесть всех типов коронарных бляшек, измеренных с помощью КТ-ангиографии. При этом у пациентов с РА в 2 раза чаще развиваются эпизоды «немого» (нераспознанного) ИМ. Эти субклинические изменения в миокарде и в коронарных артериях являются причиной серьезных ишемических и неишемических осложнений [5, 6]. ИБС является важной причиной сердечно-сосудистой смерти у пациентов с РА [5–8, 25–27].
Нарушение ритма сердца и проводимости у больных ревматоидным артритом
У пациентов с РА в 2 раза выше риск внезапной сердечной смерти, при этом у них реже имеются клинические проявления стенокардии. В общей популяции внезапная сердечная смерть обычно вызывается фатальными аритмиями, которые являются результатом электрофизиологических нарушений в сердце. У пациентов с ранним артритом встречаемость удлиненного интервала QTc не выше, чем в популяции лиц без артрита, но со временем при продолжающемся процессе у них прогрессирует проаритмическая пролонгация QTc [27–29]. Основным патофизиологическим механизмом, лежащим в основе удлинения QTc, является системное воспаление, действующее как косвенно, ускоряя развитие ССЗ, так и непосредственно, влияя на электрофизиологию сердца. Установлено, что воспалительные цитокины – интерлейкин (ИЛ)-6, фактор некроза опухоли альфа (ФНО-α), ИЛ-1 вызывают глубокие изменения в экспрессии и функции калиевых и кальциевых каналов с увеличением потенциала действия, что приводит к удлинению интервала QT [27–33]. Так, было установлено, что у пациентов с РА уровни циркулирующих воспалительных цитокинов коррелируют с продолжительностью QTc [27–29].
Известно, что длина QTc является независимым фактором риска ССЗ [19]. Как умеренное (QTc 420–440 мс), так и значительное удлинение QTc (>440 мс) являются прогностическими факторами смертности от всех причин в здоровых популяциях среднего возраста. У пациентов с РА установлено, что увеличение интервала QTc на 50 мс связано с удвоением риска общей смертности, ассоциация опосредована уровнями С-реактивного белка (СРБ) [27–29].
Нарушения проводимости у больных РА в целом встречаются чаще, чем нарушения ритма [27]. При этом нарушения ритма имеют различные патофизиологические механизмы, наиболее важными из которых являются воспаление миокарда и фиброз. Воспалительные процессы и окислительный стресс приводят к некрозу кардиомиоцитов с последующим электрическим и структурным ремоделированием. Хроническое воспаление приводит к вегетативной дисфункции, а именно гиперактивации симпатической нервной системы и снижению парасимпатической функции. Аритмии, опосредованные аутоантителами и лекарственными препаратами, также часто наблюдаются у больных с РА [30–33]. В то же время установлено, что у пациентов с РА на фоне терапии тоцилизумабом (антитела против рецептора ИЛ-6) происходит быстрое (в течение 3 мес) и значительное укорочение QTc, которое коррелировало со снижением уровня СРБ [34]. Исследование большой группы женщин с РА продемонстрировало, что воспаление, оцениваемое по уровням циркулирующего ИЛ-6, сильнее коррелирует с фатальными, чем нефатальными сердечно-сосудистыми событиями [34].
Фиброз предсердий рассматривается как общий признак клинической фибрилляции предсердий (ФП) и признак аритмогенного структурного ремоделирования миокарда. Заболеваемость ФП у пациентов с РА на 40% выше, чем в общей популяции, может возникать в любое время в течение заболевания, даже может быть первым проявлением болезни [27]. Хотя патофизиология ФП при РА сложна, однако системное воспаление, вызывающее повышение концентрации циркулирующих воспалительных белков, ИБС и сердечная недостаточность являются важными факторами для инициации и рецидива ФП у этих пациентов [27–29].
Дисфункция вегетативной нервной системы (ВНС) из-за нейротоксического эффекта хронического системного воспалительного процесса и побочных эффектов препаратов выявляется у 60% пациентов с РА. При этом сама дисфункция ВНС считается возможной патогенетической причиной сердечных аритмий у пациентов с РА [34, 35]. Основным типом дерегуляции ВНС является нарушение сердечно-сосудистых рефлексов и изменение вариабельности сердечного ритма, что свидетельствует о снижении сердечной парасимпатической активности и повышенной сердечной симпатической активности, проявляющейся в виде эктопических сокращений предсердий, сердечной недостаточности, нарушения контроля частоты сердечных сокращений и несоответствующей предсердной тахикардии [27, 34, 35].
Наиболее частой причиной внезапной сердечной смерти у пациентов с РА является атеросклеротическое поражение коронарных артерий, приводящее к острому коронарному синдрому и желудочковой тахикардии [27]. Хотя основные механизмы, лежащие в основе проаритмогенного субстрата при РА, сложны, но ведущая роль, по-видимому, принадлежит также хронической системной воспалительной активации, способствующей развитию аритмий как косвенно, ускоряя развитие ИБС и застойной сердечной недостаточности, так и напрямую влияя на электрофизиологию сердца [36]. Сегодня имеются доказательства того, что воспалительные цитокины, в основном ФНО-α, ИЛ-1 и ИЛ-6, могут модулировать экспрессию и функцию ионных каналов, напрямую воздействуя на кардиомиоциты [36].
В настоящее время появились новые данные о роли и значении антицитрулиновых антител в поражении сердца. Антицитрулированные антитела являются ключевым специфическим признаком РА, они относительно специфичны, появляются еще в доклинической фазе заболевания [32]. Сегодня свидетельством роли и значения аутоиммунного процесса в поражении сердца при РА является установление взаимосвязи между высоким уровнем антицитрулиновых антител, нацеленных на цитвиментин и белок или пептиды цитфибриногена миокарда, и более высоким средним значением индекса массы миокарда левого желудочка. Цитруллинирование виментина, промежуточного филаментного компонента мезенхимных клеток, приводит к коллапсу сети филаментов, а цитруллинирование миозина и тропомиозина изменяет их сборку и паттерны сократимости [32]. Эти данные в определенной степени могут объяснить выявляемые ранние изменения миокарда у пациентов с РА еще до развития ССЗ, так как аутоиммунный процесс начинается задолго до клинической манифестации поражения суставов.
В отличие от хорошо описанного вклада системного воспаления в раннее развитие и прогрессирование атеросклероза при РА, его роль в развитии неишемической болезни сердца менее изучена. Активные воспалительные процессы в сердце могут приводить к чрезмерному фиброзу миокарда, вызывая жесткость желудочков, и способствовать систолической и диастолической дисфункции и аритмии сердца [33]. Данные МРТ и ПЭТ-КТ сердца подтвердили наличие взаимосвязей между активностью заболевания и воспалением миокарда, его фиброзом [33]. Структурные изменения в миокарде, наблюдаемые при МРТ сердца, также взаимосвязаны с диагностическими маркерами системного воспаления. Высокая активность заболевания и повышенный уровень СРБ связаны с повышенной распространенностью диастолической сердечной недостаточности.
«Лечение до цели»
Улучшение стратегии лечения пациентов с РА в определенной степени позволило снизить риск ССЗ [34]. Учитывая ключевую роль хронического воспаления и аутоиммунных нарушений в развитии атеросклероза и связанных с ним сердечно-сосудистых осложнений (ССО) при РА, важное место в их профилактике занимает проведение эффективной противовоспалительной терапии, которая позволяет не только модифицировать течение болезни, но и снизить риск кардиоваскулярных катастроф.
Следует особо подчеркнуть, что данные, полученные в отношении кардиоваскулярных эффектов противовоспалительных препаратов, использующихся для лечения РА, могут иметь существенное значение для разработки новой стратегии профилактики и лечения атеросклеротического поражения сосудов. Полагают, что эти препараты, с одной стороны, обладают антиатерогенным действием за счет подавления «воспалительного» компонента атеротромбоза, с другой – могут оказывать как позитивное, так и негативное влияние на сосудистую стенку, систему транспорта холестерина (ХС) и свертывание крови, тем самым разнонаправленно влияя на риск ССО. По данным эпидемиологических исследований, высокая активность РА ассоциируется с увеличением кардиоваскулярного риска, а применение базисных противовоспалительных препаратов – БПВП (метотрексат – МТ) и генно-инженерных биологических препаратов – ГИБП (ингибиторы ФНО-α) – со снижением риска ССО. В течение последних 20 лет наблюдается снижение общей летальности при РА, во многом связанное с совершенствованием стратегии противовоспалительной терапии («Лечение до достижения цели» – Treat to target, Т2Т), направленной на достижение ремиссии заболевания [35].
Напомним, что эта стратегия основана на применении МТ, начиная с ранних стадий болезни, а при недостаточной эффективности монотерапии МТ – комбинированной терапии МТ и ГИБП. После внедрения в повседневную клиническую практику стратегии раннего назначения БПВП и ГИБП активность и тяжесть РА уменьшились, однако возможности снижения риска ССО при использовании стратегии Т2Т остаются недостаточно изученными. С одной стороны, тенденция к снижению смертности от ССЗ при РА отсутствует, несмотря на внедрение новых высокоэффективных методов лечения заболевания [36], с другой – новые подходы к лечению РА и достижение ремиссии заболевания ассоциируются со значительным снижением общей смертности и частоты ССО [37]. Риск развития ССО у больных РА, находящихся в ремиссии, на 53% ниже, чем у больных с сохраняющейся высокой активностью заболевания. Интересными представляются данные первого проспективного исследования влияния низкой активности РА на риск ССО [38]. Частота фатальных ССО у больных с низкой активностью РА значимо ниже (6,9%), чем у пациентов с умеренной и высокой активностью заболевания (52,9%), причем только использование МТ явилось значимым кардиопротективным фактором.
В настоящее время убедительно показано, что МТ позволяет не только эффективно контролировать клиническую активность РА, но и снижать риск кардиоваскулярной патологии [39, 40]. Механизмы действия МТ связаны с подавлением образования таких медиаторов воспаления и атерогенеза, как ИЛ-6, ИЛ-1 и ФНО-α [41], который, в свою очередь, обусловлен индукцией образования аденозина, обладающего мощной противовоспалительной активностью. Однако имеются данные и о прямом антиатерогенном эффекте МТ. Недавно появились данные, позволяющие по-новому оценить механизмы антиатерогенного действия МТ [39]. Считается, что, поскольку дисфункция эндотелия предшествует развитию атеросклероза, большое значение имеет применение препаратов, способных активировать цитопротективные сигнальные пути, предотвращающие (или отменяющие) дисфункцию эндотелия. Один из этих важных цитопротективных путей регулируется аденозин-монофосфат-активированной киназой (АМФК). Установлено, что в клетках сосудистого эндотелия АМФК проявляет многообразные протективные эффекты, включающие усиление образования синтетазы оксида азота, предотвращение апоптоза и окислительного повреждения эндотелиальных клеток. Введение МТ NZWxBXSB F1 мышам, у которых спонтанно развивается воспалительная васкулопатия, существенно снижает выраженность повреждения сосудов. Этот эффект связан с активацией АМФК, опосредуемой фосфорилированием CREB (cyclic AMF response element-binding protein), и не зависит от синтеза аденозина. У пациентов, страдающих РА, отмечается снижение противовоспалительной и антиоксидантной активности ХС липопротеидов высокой плотности (ЛПВП) и нарушение обратного транспорта ХС из клеток, коррелирующее с активностью воспаления. Следует напомнить, что обратный транспорт ХС из макрофагов осуществляется главным образом за счет мембранных транспортеров, к которым относятся SR-B1 (scavenger receptor class B type 1), ABCA1 (ATPbinding cassette A1) и ABCG1 (ATP-binding cassette G1).
При этом параметр, получивший название «способность к обратному транспорту ХС» (CEC-serum cholesterol efflux capacity), коррелирует с нарушениями функции сосудистой стенки и риском развития атеросклероза. Установлено, что лечение МТ ассоциируется с увеличением концентрации ХС ЛПВП в сыворотке на фоне усиления ABCA1- и SR-B1-опосредованного обратного транспорта ХС из макрофагов. Таким образом, снижение риска ССО на фоне лечения МТ при РА определяется не только противовоспалительными эффектами этого препарата, но и способностью оказывать специфический антиатерогенный эффект, связанный с прямым влиянием на функцию липопротеидов, их транспорт и поглощение ХС макрофагами.
Выраженное противовоспалительное и антиатерогенное действие, положительный профиль безопасности и многочисленные данные о кардиопротективном эффекте МТ при РА послужили основанием для проведения контролируемых исследований, цель которых – подтверждение гипотезы о воспалительной природе атеросклероза как в общей популяции пациентов, страдающих ИБС, так и у больных ИБС и РА. В исследование CIRT (The Cardiovascular Inflammation Reduction Trial) планируется включить более 7 тыс. пациентов, перенесших ИМ и/или страдающих сахарным диабетом 2-го типа либо метаболическим синдромом [40]. Больные будут разделены на две группы, в одной из которых будут назначены низкие дозы МТ (15–20 мг/нед), в другой – плацебо. Основным показателем эффективности будет частота развития ИМ, инсульта и летальных исходов, связанных с кардиоваскулярной патологией, а дополнительным – общая летальность, потребность в реваскуляризации миокарда, частота развития ХСН. В исследование CADERA (Coronary Artery Disease Evaluation in Rheumatoid Arthritis) войдут пациенты, которые будут получать МТ или комбинированную терапию МТ и ингибитором ФНО-α этанерцептом [41]. Основным показателем эффективности будет широкий спектр параметров МРТ, отражающих патологию коронарных сосудов и миокарда. В свете современной концепции о воспалительной природе атеросклероза несомненный интерес представляет изучение кардиоваскулярных эффектов глюкокортикоидов (ГК) [40]. В большинстве рандомизированных клинических исследований показано, что у больных РА низкие дозы ГК в течение 1–3 лет значимо не увеличивают кардиоваскулярный риск, но длительное использование ГК приводит к увеличению риска ССЗ. Комбинированная терапия ГК в низких дозах (<7,5 мг/сут) и БПВП способствует нормализации индекса атерогенности, улучшению эндотелиальной функции, снижению инсулинорезистентности параллельно со снижением активности болезни. Длительное (2–5 лет) применение низких доз ГК (4–6 мг/сут) ассоциируется с увеличением риска развития артериальной гипертензии на 30%, свыше 5 лет – с увеличением риска развития артериальной гипертензии на 37% и ИМ на 16%. В популяционном исследовании (регистр CORRONA) доказано 5-кратное увеличение риска ССО в группе больных, получающих ГК в дозе >7,5 мг/сут. ФНО-α рассматривают как один из ключевых медиаторов атерогенеза, поскольку он индуцирует дисфункцию эндотелия; усиливает экспрессию клеточных молекул, способствующих миграции лейкоцитов в сосудистую стенку; принимает участие в «дестабилизации» атеросклеротических бляшек; подавляет антикоагулянтные и усиливает прокоагулянтные свойства сосудистого эндотелия; вызывает нарушение сократимости миокарда; принимает участие в синтезе острофазовых белков [42]. Данные клинико-эпидемиологических исследований и их метаанализы свидетельствуют о снижении частоты ССО у пациентов, получавших ингибиторы ФНО-α [40], несмотря на увеличение уровней ХС липопротеидов низкой плотности (ЛПНП) и общего ХС. Таким образом, положительный кардиоваскулярный эффект ингибиторов ФНО-α у больных РА трудно объяснить динамикой изменения концентрации ЛП в крови. Хотя гиперпродукция ФНО-α участвует в развитии ХСН, применение ингибиторов ФНО-α у пациентов с ХСН (в том числе с РА) не только не приводит к улучшению состояния больных, но и способствует декомпенсации ХСН. Многочисленные исследования указывают на связь между повышением уровня ИЛ-6, прогрессированием атеросклероза и развитием сосудистых осложнений как в общей популяции пациентов с ИБС, так и при ее сочетании с РА [43]. В рамках программы скрининга генома (Genome Wide Association Studies) выявлена ассоциация между носительством однонуклеотидных полиморфизмов (Single nucleotide polymorphism – SNP) гена, кодирующего ИЛ-6-рецептор (IL6R re7529229) и риском развития ИБС [44]. Это позволило предположить, что моноклональные антитела, блокирующие рецептор ИЛ-6 тоцилизумаб (ТЦЗ), которые с успехом применяются для лечения РА, могут предотвращать развитие атеросклеротического поражения сосудов [45]. Однако, по нашим данным, на фоне лечения ТЦЗ параллельно снижению воспалительной активности заболевания наблюдаются повышение концентрации ХС и ХС ЛПНП, увеличение толщины комплекса «интима-медиа» (КИМ) сонных артерий, а у ряда пациентов отмечено появление атеросклеротических бляшек в сонных артериях [46]. Разумеется, эти результаты требуют дополнительного анализа и динамического наблюдения больных РА. Предполагается, что, несмотря на повышение концентрации атерогенных ЛП на фоне лечения ТЦЗ, подавление активности воспаления опосредованно приводит к улучшению качественного состава частиц ХС ЛПВП, тем самым нивелируя негативные эффекты гиперлипидемии. Ретроспективный анализ результатов контролируемых исследований свидетельствует о том, что развитие ССО у пациентов с РА на фоне лечения ТЗЦ ассоциируется не с негативной динамикой липидов сыворотки, а с сохраняющейся активностью воспалительного процесса [47].
По данным анализа результатов исследований абатацепта (АБЦ), у больных РА отмечен относительно благоприятный профиль кардиоваскулярной безопасности (отсутствие достоверных различий по частоте развития ИМ, остановки сердца, артериальной гипертензии и ХСН между пациентами, получающими АБЦ в сочетании с БПВП, и больными на терапии БПВП и плацебо) [39].
Изучение влияния ритуксимаба (РТМ) на развитие атеросклеротического поражения сосудов позволяет по-новому взглянуть на роль В-клеточного (гуморального) звена иммунитета в патогенезе этой патологии. По нашим данным, при РА эффективная терапия РТМ ассоциируется с повышением концентрации ХС ЛПВП, снижением индекса атерогенности, минимальным увеличением уровней ХС, ХС ЛПНП, а также положительной динамикой толщины КИМ сонных артерий. Кроме того, отмечено стойкое благоприятное влияние РТМ на такой предиктор внезапной сердечной смерти, как вариабельность ритма сердца. Таким образом, подавление активности РА на фоне лечения РТМ приводит к снижению риска кардиоваскулярной патологии [48].
Несмотря на применение препаратов, снижающих активность РА, риск ССО остается повышенным по сравнению с общей популяцией. И это не удивительно, так как уменьшение активности РА – лишь одна «сторона медали». Другим важным пунктом профилактики ССО является адекватный контроль традиционных факторов риска ССЗ. Наряду с противовоспалительной терапией существенное место в профилактике кардиоваскулярной летальности при РА принадлежит статинам, которые, помимо снижения ЛП, обладают многообразными противовоспалительными и иммуномодулирующими плейотропными эффектами, имеющими прямое отношение к иммунопатогенезу этого заболевания.
При РА применение статинов ассоциируется с подавлением клинических и лабораторных показателей активности и снижением общей летальности на 20%. Статины являются «краеугольным камнем» первичной и вторичной профилактики ССО, в том числе и у больных РА. Недавно доказано, что низкая приверженность лечению статинами ведет к увеличению кардиоваскулярного риска как при первичной, так и при вторичной профилактике ССО, особенно у больных сахарным диабетом и РА [49, 50].
Планирование новых клинических исследований по эффективности различных терапевтических подходов у пациентов с РА должно осуществляться с учетом эффективности терапии не только на снижение активности заболевания, но и эффективности по защите сердечно-сосудистой системы, снижения риска развития сердечно-сосудистых событий [51, 52].
Стратификация кардиоваскулярного риска у пациентов с ревматоидным артритом
Коморбидность оказывает неблагоприятное влияние на течение и прогноз РА, а ССЗ являются наиболее распространенными и социально значимыми сопутствующими заболеваниями и основной причиной преждевременной летальности при РА [53]. Традиционные факторы сердечно-сосудистого риска (ССР), такие как курение, сахарный диабет, гипертония, дислипидемия и ожирение, оказывают значимое влияние на развитие ССЗ у пациентов с РА. Однако, помимо традиционных кардиоваскулярных факторов риска, важное место занимают РА-ассоциированные (нетрадиционные) факторы риска: активность РА, длительность РА, серопозитивность по ревматоидному фактору и антителам к циклическому цитруллинированному пептиду. Следует обратить внимание на существование общих факторов риска развития РА и атеросклеротического поражения сосудов, к которым относятся полиморфизмы ряда генов, кодирующих антигены главного комплекса гистосовместимости (HLA-DR-B1), ФНО-308 (rs1800629), а также факторы транскрипции, регулирующие синтез провоспалительных медиаторов – NFκB (nuclear factor kappa-light-chain-enhancer of activated B cells), MHC2TA (Class II, Major Histocompatibility Complex, Transactivator), IFR (interferon regulatory factor). Таким образом, аутоиммунное воспаление – основной фактор риска развития клинических и субклинических проявлений атеросклероза, поэтому не случайно хронический артрит рассматривают как «естественную» модель для изучения атеросклероза, и фактически ускоренное развитие последнего можно рассматривать как своеобразное системное проявление РА [53, 54].
К основным традиционным шкалам риска ССЗ относят: Framingham Risk Score [54], Systematic COronary Risk Evaluation (SCORE) [55], Reynolds Risk Score (RRS) [56] и Алгоритм, разработанный Американским колледжем кардиологов / Американской кардиологической ассоциацией в 2013 г. (ACC/AHA 2013) [57].
Шкала SCORE [55] разработана на основе крупных европейских когортных исследований. Эта модель оценивает 10-летний риск первого фатального события, связанного с атеросклерозом (ИМ, инсульт, аневризма аорты), и рассчитывается с учетом возраста, пола, привычек курения, общего холестерина (ОХС) и систолического артериального давления пациента. В соответствии с рекомендациями Европейской антиревматической лиги (EULAR) для прогнозирования ССР для пациентов с РА следует использовать модифицированный индекс SCORE (mSCORE), который рассчитывается посредством умножения SCORE на коэффициент 1,5. Шкала RRS [56] оценивает 10-летний суммарный риск развития ССЗ (ИМ, инсульт, аневризма аорты), а также риск смерти от ССЗ. При расчете данной шкалы учитываются такие факторы риска, как отягощенная наследственность по ССО, а также высокочувствительный СРБ, что в конечном итоге улучшает качество прогнозирования суммарного ССР по сравнению с расчетом по шкалам Framingham Risk Score и SCORE. Указанные шкалы протестированы на пациентах с РА, и все они показали недостаточную прогностическую ценность, приводящую к недооценке кардиоваскулярного риска у этой категории больных [58].
Стратификация пациентов с РА в соответствии с риском ССЗ до сих пор остается сложной проблемой, особенно в случаях с низким или промежуточным ССР. Продолжается поиск эффективных инструментов стратификации риска ССЗ, специфичных для пациентов с РА. Разработаны три шкалы (ASSIGN, QRISK3,
ERS-RА), при расчете которых учитывается само заболевание – РА. Шкала риска Assessing Cardiovascular Risk to Scottish Intercollegiate Guidelines Network/SIGN to Assign Preventative Treatment (ASSIGN) [59], разработанная на основе репрезентативной базы данных в Шотландии, также оценивает 10-летний ССР, включая смерть от ССЗ, или диагноз ИБС, цереброваскулярную болезнь при выписке из больницы, или вмешательство на коронарной артерии. Помимо учета традиционных факторов риска система оценки ASSIGN включает индекс социального статуса, с помощью которого могут учитываться социальные градиенты болезни. Шкала риска QRISK (алгоритм QRESEARCH Cardiovascular Risk Algorithm) [60] разработана на основании данных общемедицинской практики в Великобритании и оценивает 10-летний риск ССЗ, включая ИМ, ИБС, инсульт. Оцениваемыми факторами риска стали возраст, пол, курение, систолическое артериальное давление, соотношение ХС к ХС ЛПВП, курение, ИМТ, семейный анамнез ИБС, социальный статус и терапия антигипертензивными средствами. Проверка валидности шкалы проводилась в той же популяции, на которой шкала разработана, что является основным недостатком данной шкалы. Калькулятор QRISK3 в отличие от предыдущих шкал QRISK и QRISK2 рассматривает РА как отдельный фактор риска ССЗ и включает в себя больше факторы риска развития ССЗ (хроническое заболевание почек, мигрень, прием ГК, системная красная волчанка, тяжелые психические заболевания, эректильная дисфункция и т.д.).
Калькулятор расширенной оценки ССР при РА Expanded Risk Score in RA (ERS-RA) [61] рассчитан в 2015 г. с использованием данных из реестра Консорциума исследователей ревматологии Северной Америки (CORRONA). Особенностью калькулятора ERS-RA является включение в оценку риска ССЗ таких специфических для РА характеристик, как длительность, активность РА, функциональная недостаточность, прием ГК. Ранее показано, что учет РА-ассоциированных (нетрадиционных) факторов риска может вносить значительный вклад в улучшение качества прогнозирования сердечно-сосудистых событий при РА [62]. Основные параметры, входящие в шкалы, суммированы в табл. 2. В последние годы для улучшения стратификации суммарного риска ССО ведется поиск и разработка новых различных моделей, с помощью которых можно оценить индивидуальный риск для каждого пациента с РА. Трансатлантический сердечно-сосудистый консорциум по РА (ATACC-RA consortium – A TransAtlantic Cardiovascular Risk Calculator for Rheumatoid Arthritis) недавно выпустил калькулятор сердечно-сосудистого риска РА [63]. Существует много препятствий при внедрении такого калькулятора в клиническую практику. Калькулятор риска, который включает в себя как сердечно-сосудистые, так и ревматологические факторы, может потребовать скоординированной помощи как ревматолога, так и кардиолога или врачей общей практики, чтобы получить все меры, необходимые для его оценки, особенно если требуется совместный подсчет. Даже такие показатели, о которых сообщают пациенты, такие как HAQ, требуют времени для расчета. Для прогнозирования повышенного риска ССЗ наряду со шкалами применяется ультразвуковая оценка толщины КИМ сонной артерии, что является безопасным, неинвазивным и экономичным методом раннего выявления атеросклероза. Считается, что атеросклеротические бляшки сонных артерий являются суррогатным маркером ИБС и используются для превентивной оценки риска ССЗ. А внедрение толщины КИМ в интегрированные показатели кардиоваскулярного риска значительно улучшает стратификацию ССР по сравнению с традиционными калькуляторами у пациентов без РА [64–66].
Определение наиболее точной шкалы риска ССЗ, прогнозирующей атеросклеротическое поражение сонных артерий, поможет более качественно выявлять пациентов с высоким ССР на основе оценки традиционных и нетрадиционных кардиоваскулярных факторов риска при РА. Представленный далеко не полный перечень проблем, находящихся на стыке ревматологии, кардиологии и терапии, свидетельствует об актуальности изучения кардиоваскулярной патологии при иммуновоспалительных ревматоидных заболеваниях. Эти исследования имеют важное теоретическое и практическое значение для разработки новых подходов к профилактике и лечению патологии сердечно-сосудистой системы при ревматоидных заболеваниях.
Заключение
В настоящее время установлена высокая частота поражений сердца у больных РА с существенным повышением риска неблагоприятных сердечно-сосудистых событий: развитием ИМ, сердечной недостаточности, нарушений ритма, внезапной сердечной смерти и общей сердечно-сосудистой смерти. Важным фактом является установление дисфункции миокарда у пациентов с момента манифестации РА, прогрессирования атеросклероза коронарных артерий.
У большинства пациентов с РА в течение многих лет, особенно на фоне боли в суставах, скованности, ограничения физической активности, клиническая симптоматика, характерная для поражения коронарных артерий и миокарда, не выступает на первый план, что, по-видимому, и является основой для мнения о клинически незначимом поражении сердца. При этом для больных с РА характерна худшая выживаемость после перенесенного ИМ как в ближайшем, так и в отдаленном периоде.
Стратификация ССР при РА представляет серьезную проблему. Шкалы ССР, одобренные для населения в целом, часто недооценивают кардиоваскулярный риск у больных РА. Калькуляторы mSCORE, RRS, ASSIGN, QRISK3 в равной степени прогнозируют атеросклеротическое поражение сонных артерий у больных РА. Для идентификации риска развития ССЗ у больных РА наиболее информативными являются вычисление mSCORE и определение толщины КИМ сонных артерий.
Имеющиеся на сегодняшний день факты позволяют говорить о РА как о заболевании, вносящем существенный вклад в сердечно-сосудистую заболеваемость и смертность. А это обусловливает необходимость пересмотра тактики ведения пациентов с РА с определением новых терапевтических целей и в конечном итоге разработки успешных кардиопротективных методов лечения пациентов.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
22 сентября 2022
Количество просмотров: 1130

