Клинический разбор в общей медицине №5 2023
Leonid B. Likhterman, Vladimir A. Okhlopkov, Marina V. Ryzhova, Galina P. Snigireva,
Liudmila V. Shishkina, Igor N. Pronin, Natalia E. Zakharova, Artem I. Batalov, Valeriy N. Kornienko
Burdenko National Medical Research Centre for Neurosurgery, Moscow, Russia
Likhterman@nsi.ru
Abstract
The paper reports methodology of the current phase of brain tumor recognition. The World Health Organization classification of the central nervous system tumors issued in 2021 and its main differences from the previous version are provided. The molecular genetic methods, the use of which is necessary to establish the comprehensive integrated pathological diagnosis required for selection of adequate brain tumor therapy, are disclosed.
The potential of using neuroimaging techniques for comprehensive brain tumor diagnosis is discussed.
Key words: brain tumors, diagnosis methodology, molecular genetic detection, neuroimaging.
For citation: Likhterman L.B., Okhlopkov V.A., Ryzhova M.V. et al. Principles of modern brain tumor diagnosis. Clinical review for general practice. 2023; 4 (5): 6–16 (In Russ.). DOI: 10.47407/kr2023.4.5.00229
Нейроонкология относится к классическим базисным разделам нейрохирургии.
Число больных с первичными и особенно метастатическими опухолями головного мозга растет. Их распознавание определяет и тактику лечения, и прогнозные оценки. Между тем сама нейродиагностика претерпела за последние десятилетия настолько значительные изменения, что стала концептуально иной.
Общение с пациентом неотделимо от врачевания. Данные анамнеза и клинико-неврологического исследования имеют огромное распознавательное значение. Но их недостаточно для уточненной топической и нозологической диагностики поражений головного мозга. Это вызвало необходимость на этапе становления нейрохирургии как самостоятельной клинической дисциплины в начале ХХ в. разработки рентгеновских методов визуализации – вентрикулографии, пневмоэнцефалографии, ангиографии [1]. Однако они болезненны и кровавы, тяжело переносились, были чреваты осложнениями, а иногда летальным исходом. Применение этих методов являлось вынужденным.
Начиная с 70-х годов прошлого века наступает качественно новый период нейрохирургической диагностики. Она приближается к критериям идеального метода, обеспечивая безболезненное, бескровное, безопасное и дистантное видение структур головного мозга. Диагноз через страдания и риски ушел в историю. Более того, современные методы нейровизуализации, такие как магнитно-резонансная (МРТ), компьютерная (КТ), ультразвуковая томография и другие, способны выявлять патологию мозга, прежде всего его опухоли, в доклиническую стадию – при полной сохранности здоровья и работоспособности человека. Возникла превентивная нейроонкология.
Учитывая все нарастающее многообразие методов лечения опухолей головного мозга – оперативных, радиологических, химических, гормональных и других, актуальным стало долечебное уточнение не только их топики, размеров, отношения к оболочкам, мозговому веществу и ликворным пространствам, но и гистобиологических характеристик, включая молекулярно-генетические особенности.
Следует констатировать: наступил новый этап диагностики опухолей головного мозга, который требует своего осмысления и формулировки принципов.
В настоящее время всегда необходимо нейровизуализационное подтверждение и уточнение патологии для выработки окончательного диагноза и адекватной тактики лечения, сфера которого, как мы уже упоминали, стала чрезвычайно широкой.
Современная методология диагноза опухолей головного мозга базируется на определенных принципах, каждый из которых важен и имеет свою историю. Их совокупность способна обеспечить полноценный развернутый индивидуальный диагноз, позволяющий избирать адекватную тактику лечения и давать надежный прогноз.
Мы выделяем следующие принципы построения клинического диагноза: синдромология поражения, нозология поражения, топика поражения, возрастной подход, фазный подход, визуализация поражения, уточнение биологических качеств поражения, достаточность данных, интеграция данных, индивидуальный подход [2].
Принцип синдромологии. Определяют ведущий в клинике синдром: оболочечный, эпилептический, пирамидный, подкорковый, среднемозговой, мозжечковый и т.д.
Принцип нозологии. Определяют опухолевую природу поражения и предположительно гистобиологические качества, первичность или вторичность поражения.
Принцип топики. Определяют полушарную или мозжечковую латерализацию, долевую или стволовую локализацию поражения, конвекситальную, базальную или перивентрикулярную топику и т.д.
Принцип возрастного подхода. Учитывают анатомо-физиологические особенности организма и его реакций у детей, молодых, лиц среднего, пожилого и старческого возраста.
Принцип фазного подхода. С учетом уровня компенсаторно-приспособительных возможностей организма (определяемых по общемозговым, очаговым, стволовым и соматическим показателям) устанавливают клиническую фазу опухоли: компенсации, субкомпенсации, умеренной или грубой декомпенсации, а также терминальную. В упрощенном варианте – состояние больного – от удовлетворительного до крайне тяжелого.
Принцип визуализации. Благодаря методам интроскопии возможно неинвазивное прижизненное видение анатомии и топографии структур головного мозга, их патологии, а также ряда функциональных показателей мозговой деятельности. Это резко изменило понимание сущности и динамики бластоматозного процесса, несоизмеримо расширило возможности диагностики и лечения, глубоко отразилось на психологии врача, заставило пересмотреть многие привычные представления.
Методы неинвазивной визуализации придали нейрохирургическому диагнозу также новые функции – исследовательские и контрольные.
КТ и МРТ внесли значительную определенность в представления о различных опухолях головного мозга. Методы неинвазивной визуализации диалектически привели к существенному углублению лечебной концепции при опухолях головного мозга.
Принцип долечебного уточнения биологических качеств бластоматозного процесса. Выбор различных методов лечения требует максимального уточнения биологических качеств опухоли. Этому способствуют применение КТ и МРТ с контрастным усилением, позитронно-эмиссионная томография (ПЭТ) и ряд других методик. Особую ценность, наряду с рутинной микроскопией дооперационных биоптатов, играют современные молекулярно-генетические исследования.
Принцип достаточности данных. Процесс распознавания часто должен быть сжат во времени. Поэтому используют методы, способные сразу разрешить, если не все, то главные диагностические затруднения. Исследование начинают с наиболее информативных способов. Многие диагностические вопросы разрешает комбинация неврологического и КТ, МРТ методов. Если отпадает необходимость в каких-либо дополнительных уточняющих диагноз исследованиях, то реализуется принцип достаточности данных.
Принцип интеграции данных. Все полученные данные о больном (анамнестические, клинические, инструментальные, лабораторные и др.) сопоставляются и обобщаются для уточнения диагноза и тактики лечения опухолей головного мозга.
Принцип индивидуального подхода. Всегда должен доминировать индивидуальный диагноз конкретного больного, учитывающий его антропометрические данные, анамнез жизни и болезни, свойственные ему особенности проявления и течения опухоли головного мозга. Индивидуальный подход к диагностике опухолей головного мозга включает также деонтологические аспекты с учетом состояния сознания и личности больного, его социального положения, характерологических особенностей родных, близких и т.д.
Применительно к случайно обнаруженным асимптомным опухолям головного мозга изложенная методология диагноза, сохраняя свою силу, требует определенной коррекции.
Тактику ведения практически здорового человека с выявленной опухолью мозга необходимо рассматривать дифференцированно с учетом локализации и гистобиологических качеств бластоматозного процесса. Решающим фактором в предпочтении наблюдения в динамике или определенного метода лечения является сохранение качества жизни во временной ее протяженности. Тактика нейрохирурга исключительно подчинена врачебному принципу non nocere.
Превентивная нейрохирургия, как и любая иная предупредительная хирургия, должна быть гарантированной. В каждом случае необходимо со стороны нейрохирурга четкое обоснование предложения превентивной операции, а со стороны пациента – столь же четкое понимание ее предупредительной спасительности. Превентивная нейроонкология должна максимально учитывать особенности психики пациента.
Поэтому, наряду с аргументированными нейрохирургическими соображениями, определяющим в решении прибегнуть к хирургии случайных находок является по-настоящему информированное согласие пациента с полным пониманием и той ответственности по отношению к самому себе, которую он добровольно берет.
Превентивная нейроонкология остро нуждается в разработке своей особой философии, которой должны проникнуться нейрохирурги, решившие ею заниматься. Только философское осмысление позволит за картинкой увидеть, в отличие от больного, нестрадающего человека, и, по-врачебному представив угрозы его будущему, решить, надо ли ему помогать, когда и как.
К лечению асимптомных опухолей головного мозга следует прибегать только тогда, когда есть уверенность, что это обеспечит лучший исход, чем естественное течение патологии головного мозга [3].
В отличие от клинической нейроонкологии, диагноз асимптомной опухоли мозга является только картиночным и иным быть не может. Но решение о выборе тактики – наблюдение или активное лечение – всегда должно быть клинико-философским.
Необходимо помнить, что идеологии клинической нейрохирургии и превентивной нейрохирургии – разные: для первой – это восстановление утраченного здоровья, а для второй – его сохранение.
Диалектика «действие или бездействие» мучительна для нейрохирурга, поскольку он видит патологический субстрат, сам по себе подлежащий удалению, но, соизмеряя, что лучше для практически здорового человека, нередко выбирает бездействие как оптимальный тактический вариант.
В заключение, подчеркнем, что повсеместное приближение специализированной помощи к населению, распространение методов нейровизуализации резко усилили темп диагностического процесса в нейроонкологии. Пассивная диагностика опухолей головного мозга (установление диагноза путем наблюдения) сменилось активным опережающим их распознаванием, благодаря прежде всего нейровизуализации.
Эффективное использование ее возможностей требует подхода к носителю патологии с позиций клинического мышления, осуществляющего системный подход, оптимальный для здоровья человека.
Диффузные глиомы взрослого типа:
• астроцитома IDH-мутантная:
- астроцитома IDH-мутантная, grade 2;
- астроцитома IDH-мутантная, grade 3;
- астроцитома IDH- мутантная, grade 4;
• олигодендроглиома IDH-мутантная с коделецией 1p/19q:
- олигодендроглиома IDH-мутантная grade 2;
- олигодендроглиома IDH-мутантная grade 3;
• глиобластома IDH-дикий тип.
Диффузные глиомы низкой степени злокачественности детского типа:
• диффузная астроцитома с нарушениями MYB MYBL1;
• ангиоцентрическая глиома;
• диффузная глиома низкой степени злокачественности с нарушениями сигнального пути MAPK;
• полиморфноклеточная нейроэпителиальная опухоль низкой степени злокачественности молодых PLNTY WHO grade 1.
Диффузные глиомы высокой степени злокачественности детского типа:
• диффузная срединная глиома H3 K27-мутантная;
• диффузная полушарная глиома H3 G34-мутантная;
• диффузная глиома высокой степени злокачественности детского типа Н3-дикого типа и IDH-дикого типа WHO grade 4;
• глиома полушарий младенческого типа.
Отграниченные астроцитарные глиомы:
• пилоцитарная астроцитома;
• астроцитома высокой степени злокачественности с пилоцитарными признаками;
• плеоморфная ксантоастроцитома;
• субэпендимарная гигантоклеточная астроцитома;
• хордоидная глиома;
• астробластома с нарушением MN1.
Глионейрональные и нейрональные опухоли:
• ганглиоглиома;
• ганглиоцитома;
• десмопластическая инфантильная ганглиоглиома;
• десмопластическая инфантильная астроцитома;
• дизэмбриопластическая нейроэпителиальная опухоль;
• диффузная глионейрональная опухоль с олигодендроглиальными признаками и кластерами ядер;
• папиллярная глионейрональная опухоль;
• розеткоформирующая глионейрональная опухоль;
• миксоидная глионейрональная опухоль;
• диффузная лептоменингиальная глионейрональная опухоль NOS;
• мультинодулярная и вакуолизирующая нейрональная опухоль;
• диспластическая церебеллярная ганглиоцитома (Лермитта–Дюкло);
• центральная нейроцитома;
• экстравентрикулярная нейроцитома;
• церебеллярная липонейроцитома.
Эпендимальные опухоли:
• супратенториальная эпендимома NOS;
• супратенториальная эпендимома ZFTA Fusion-позитивная;
• супратенториальная эпендимома YAP1 Fusion-позитивная;
• эпендимома задней черепной ямки NOS;
• эпендимома задней черепной ямки группа А (PFA);
• эпендимома задней черепной ямки группа В (PFB);
• спинальная эпендимома NOS;
• спинальная эпендимома с амплификацией MYCN;
• миксопапиллярная эпендимома;
• субэпендимома.
Опухоли сосудистого сплетения:
• папиллома сосудистого сплетения;
• атипическая папиллома сосудистого сплетения;
• карцинома сосудистого сплетения.
Эмбриональные опухоли:
• медулобластомы молекулярно определяемые;
• медуллобластома WNT-activated;
• медуллобластома SHH-activated and T53-wildtype;
• медуллобластома SHH-activated and T53-mutant;
• медуллобластома non-WNT/non-SHH;
• медуллобластомы гистологически определяемые;
• медуллобластома десмопластческая нодуллярная;
• медуллобластома с экстенсивной нодуллярностью;
• медуллобластома крупноклеточная;
• медуллобластома анапластическая.
Другие эмбриональные опухоли ЦНС:
• атипическая терпатоидно-рабдоидная опухоль;
• крибриформная нейроэпителиальная опухоль;
• эмбриональная опухоль с многослойными розетками;
• ЦНС нейробластома FOXR2-activated;
• ЦНС нейробластома с BCOR тандемной амплификацией;
• ЦНС нейробластома NOS/NEC.
Опухоли пинеальной области:
• пинеоцитома;
• паренхиматозная опухоль шишковидной железы промежуточной дифференцировки;
• пинеобластома;
• папиллярная опухоль пинеальной области;
• десмопластическая миксоидная опухоль пинеальной области с мутацией SMARCB.
В приведенной классификации внутримозговых опухолей более половины содержат в своем названии конкретные молекулярные альтерации, без которых постановка современного диагноза невозможна.
В настоящую версию добавлен ряд недавно признанных типов: диффузная астроцитома, измененная MYB или MYBL1; полиморфная низкозлокачественная нейроэпителиальная опухоль молодого возраста; диффузная глиома низкой степени злокачественности с повреждением МАРК-сигнального пути; диффузная полушарная глиома с H3 G34-мутантный тип, диффузная глиома высокой степени злокачественности детского типа, H3-дикого типа и IDH-дикого типа; полушарная глиома младенческого типа; астроцитома высокой степени злокачественности с пилоидными чертами, а также отдельные виды глионейрональных и эмбриональных опухолей.
Впервые диффузные глиомы детского типа отделены от диффузных глиом взрослого типа. В то время как для диффузных глиом взрослого типа их классификация была упрощена до трех основных типов: астроцитомы диффузные IDH-мутантные, олигодендроглиомы IDH-мутантные, глиобластомы IDH-дикий тип.
Такое разделение продиктовано, прежде всего, клиническими и молекулярными различиями, существующими между диффузными глиомами, возникающими в основном у взрослых (называемые «взрослым типом»), и глиомами, возникающими преимущественно у детей (называемые «педиатрическим типом»). Конечно, опухоли детского типа иногда могут возникать у взрослых, особенно у молодых людей, а опухоли взрослого типа могут (реже) встречаться у детей. Тем не менее разделение классификации на диффузные глиомы взрослого и детского типа станет важным шагом вперед в четком разделении этих клинически и биологически различных групп опухолей. Возможно, выявленные молекулярные различия позволят усовершенствовать тактику противоопухолевой терапии у детей с опухолями мозга.
Радикальные изменения претерпела группа эпендимом, где в основу классификации положено деление по локализационному (супратенториальные, субтенториальные и спинальные эпендимомы) и генетическому принципам.
Претерпела некоторые изменения и градация степени малигнизации опухолей, заключающаяся во внедрении арабской нумерации, что делает ее более сопоставимой с градациями, принятыми в общей онкологии. Не рекомендуется теперь использование термина «анапластическая» для обозначения астроцитом, эпендимом, хориоидпапиллом.
Выделено множество подвидов опухолей мозга с различным генетическим профилем, которые имеют отличительный прогноз течения заболевания и требуют индивидуальных подходов к комбинированному лечению и использованию таргетной терапии. Диагностика этих опухолей включает в себя не только гистологическое исследование и иммуногистохимическую верификацию, но и определенный спектр молекулярно-генетических характеристик для каждой группы опухолей, что на современном уровне требует интегрированного гистологически-молекулярного диагноза.
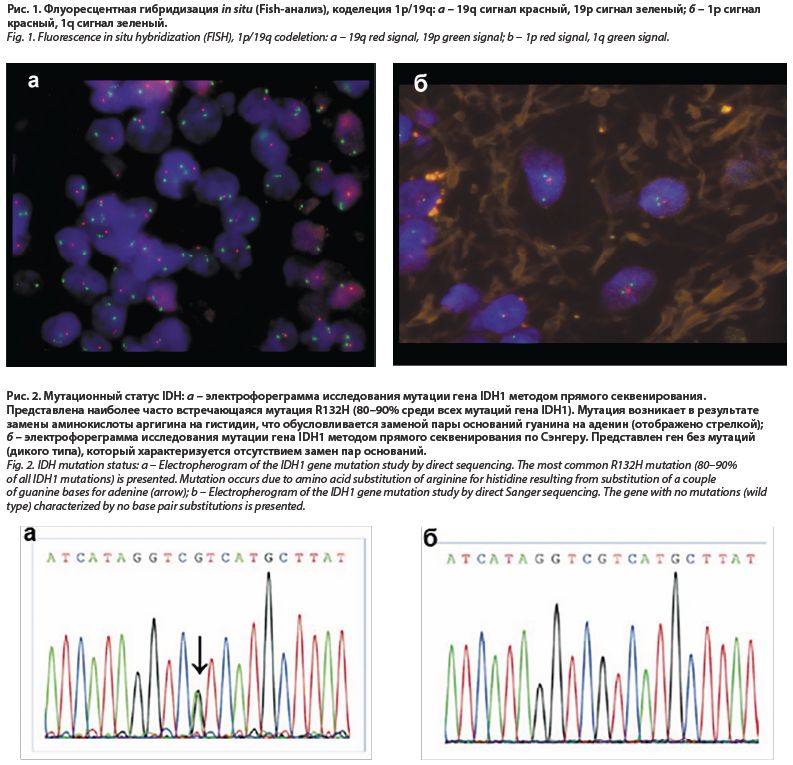
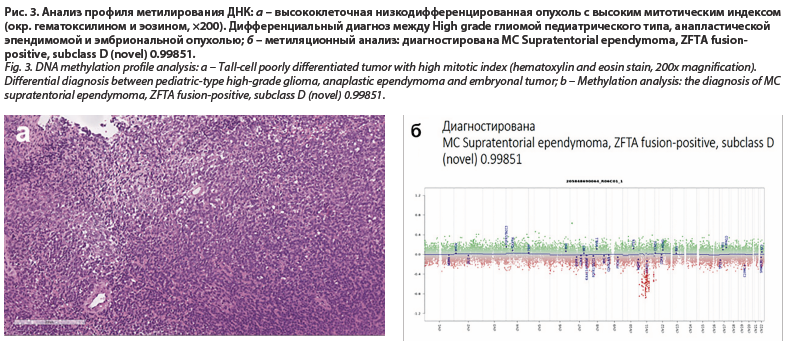
Для постановки такого интегрированного диагноза опухоли ЦНС на практике, помимо рутинных методов гистологического исследования и иммуногистохимической верификации тканевой принадлежности опухоли, стали необходимы: флуоресцентная гибридизация in situ (выявляет хромосомные изменения: амплификации, делеции, транслокации), рис. 1; полимеразная цепная реакция (выявляет слияния генов); секвенирование по Сэнгеру (выявляет мутации в конкретных регионах генов), рис. 2; таргетное высокопроизводительное секвенирование (NGS-next-generation sequencing – позволяет проводить комплексный анализ множества генов); методы анализа профиля метилирования ДНК.
Важно отметить, что анализ профиля метилирования ДНК приобретает особое значение в диагностике опухолей ЦНС. Он основан на анализе профиля метилирования 850 тыс. CpG-динуклеотидов (CpG-динуклеотид представляет собой цитозин и гуанин, разделенный фосфатом Cytosine–phosphate–Guanine; участки ДНК, богатые CpG-динуклеотидами, называют CpG-островками) и сравнении с данными метилирования 2800 различных видов референсных образцов опухолей ЦНС, имеющих характерные профили метилирования.
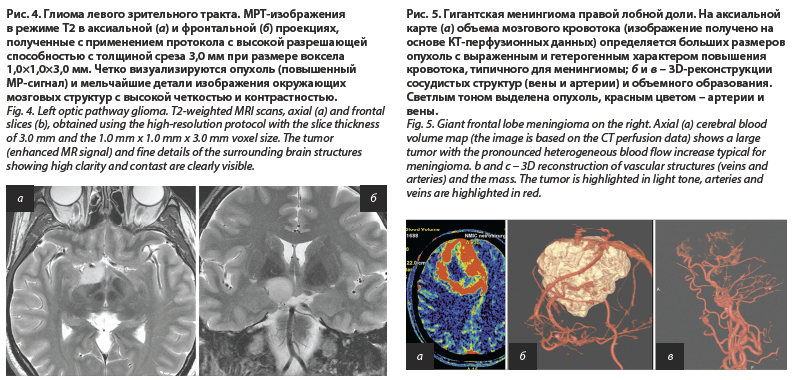
Анализ профиля метилирования ДНК применяется в основном для диагностики детских злокачественных супратенториальных опухолей, для определения молекулярной группы эмбриональных и глиальных опухолей [6]. С помощью этого метода можно выявлять делеции, добавки, амплификации отдельных генов и оценивать статус метилирования гена MGMT (рис. 3). Для проведения исследования возможно использовать как замороженную опухолевую ткань, так и фиксированную в формалине и залитую в парафин ткань опухоли. Однако метод не всегда позволяет диагностировать детские супратенториальные опухоли. В подобных случаях исследование рекомендуется расширить высокопроизводительным секвенированием с панелью, позволяющей диагностировать ключевые повторяющиеся мутации и слияния генов.
Редкие случаи диффузных опухолей, при которых молекулярное тестирование не удалось осуществить технически (например, из-за ограниченной доступности ткани или низкого содержания опухолевых клеток), могут быть гистологически классифицированы как глиома NOS (Not Otherwise Specified) или русским термином БДУ – «без дополнительного уточнения» и обозначены как опухоль ЦНС 2-й или 3-й степени по классификации ВОЗ в зависимости от наличия или отсутствия гистологических признаков анаплазии. Для особых случаев опухолей с неоднозначным результатом
генотипирования и фенотипирования применяется термин NEC (Not Elsewhere Classified) или неклассифицируемая опухоль [7].
В текущей классификации есть несколько подвидов опухолей, которые можно диагностировать только с помощью анализа профиля метилирования ДНК, например: астроцитома высокой степени злокачественности с пилоидными признаками, эпендимома ЗЧЯ группа PFB, медуллобластома без активации сигнальных каскадов WNT/SHH и другие, а для большинства эмбриональных опухолей этот метод используется как полезный альтернативный подход. Кроме того, анализ профиля метилирования ДНК желательно использовать при сложном дифференциальном диагнозе, когда другие молекулярно-генетические характеристики в сочетании с иммунофенотипом опухоли выглядят противоречивыми.
В последние годы в связи с появлением и распространением новых молекулярных технологий, использование которых становится все более востребованным онкологами в связи с выбором тактики последующего лечения больного и возможности применения персонифицированного подхода при выборе противоопухолевых препаратов, становится крайне актуальным принцип интегрированного патоморфологического и молекулярного диагноза, суть которого заключается в совместном участии морфологов и биологов при его постановке, а выбор метода исследования определяется после гистологического и иммуногистохимического исследования опухоли.
Итак, в соответствии с требованиями последней версии классификации опухолей ЦНС ВОЗ, стандартом современной диагностики внутримозговых опухолей на сегодняшний день является интегрированный диагноз, включающий гистологический диагноз (с иммуногистохимической верификацией), степень злокачественности и молекулярно-генетический профиль опухоли. Именно этот диагноз считается окончательным, так как позволяет определять возможные варианты лечения и прогноз заболевания. В случаях технического отсутствия такой возможности либо в силу других обстоятельств следует использовать термины БДУ либо NOS/NEC с рекомендациями для верификации диагноза конкретных молекулярно-генетических исследований в других учреждениях. Весьма актуальным в этих случаях становится обращение в центры референс-диагностики, обеспеченные высокотехнологичным оборудованием и квалифицированными специалистами, что позволит усовершенствовать современную многоуровневую диагностику опухолей мозга.
Нейровизуализация представляет собой комплексное диагностическое направление, объединяющее в себе методы лучевой диагностики, к которым относятся ультразвуковые исследования, рентгеновская КТ, МРТ, а в последнее время и ПЭТ, совмещенная с КТ. В рамках этого направления врачи-диагносты (по специализации – это врачи функциональной диагностики, рентгенологи и радиологи) занимаются исследованиями заболеваний и поражений ЦНС, а проще говоря, исследованиями головного мозга, спинного мозга и позвоночника.
Если рассматривать нейровизуализацию без учета специфики применяемых диагностических технологий – можно выделить несколько основных направлений, по которым идет ее развитие и совершенствование.
Первое направление нейровизуализации – это высокая скорость получения диагностических изображений. Сама по себе скорость не главная, но очень важная черта современных диагностических модальностей. Так, современные КТ-сканеры могут получать тысячи изображений за считанные секунды. Интересно, но сейчас сама подготовка к проведению диагностического исследования длится в несколько раз дольше, чем сам процесс сканирования. К примеру, длительность диагностического сканирования головного мозга человека (если, конечно, мы не говорим о сложных динамических и мультифазных протоколах) составляет 3–5 с.
И за это короткое время можно получить до 1 тыс. диагностических изображений. А все начиналось с односрезовых КТ-приборов, где 1 анатомический срез (или изображение) реконструировался в течение 1–2 мин. Сегодня во многих клиниках России работают многосрезовые КТ-аппараты с впечатляющей скоростью получения рентгеновских изображений.
Современная МРТ не может «похвастаться» такой быстротой, как КТ. В то же время за последние 10–15 лет и в МРТ произошли существенные сдвиги в сторону ускорения получения диагностических данных. Сейчас на многих МРТ-сканерах установлены протоколы, способные сократить время сканирования в два, а то и в три раза. Например, для получения изображения сосудистой системы головного мозга (при одинаковом объеме анатомической области) раньше требовалось 8–12 мин, а с внедрением технологий ускорения сбора данных и новых математических алгоритмов идентичное качество может быть достигнуто вдвое короче. Кажется, что это не много, но если учесть тот факт, что за время МРТ-исследования необходимо провести 5–6 различных сканирований, сокращение в каждой программе приводит к уменьшению общего времени МРТ-протокола, например с 30–40 мин до 15–20 мин. И это не только увеличение пропускной способности МРТ-аппарата (больше пациентов можно исследовать за одну рабочую смену), что, конечно же, очень важно в современных условиях, но и больший комфорт для пациента, которому приходится меньше времени проводить внутри аппарата, соблюдая условия неподвижности. При этом не следует сбрасывать со счетов «шумность» МР-оборудования и определенную ограниченность пространства (по сравнению все с той же КТ), которые снижают толерантность пациентов к длительности процедуры сканирования.
Второе и очень важное направление в развитии нейровизуализации – это достижение высокой точности диагностики, основу которой составляет высокая разрешающая способность диагностического оборудования. Это касается и КТ, и МРТ. Современные КТ-сканеры в рутинном режиме способны получать изображения с толщиной среза 0,625 мм и даже тоньше. Так как в МРТ процесс сканирования и реконструкции изображений протекает сложнее, чем при КТ, то стандартная толщина среза обычно составляет 3–5 мм. Однако и в МРТ достигнуты существенные результаты с точки зрения разрешающей способности – в некоторых 3D режимах толщина среза достигает 0,6–1,0 мм. Это означает, что элемент изображения или воксел, из которых потом реконструируется привычная для нас картинка, равен 1,0 мм и даже меньше.
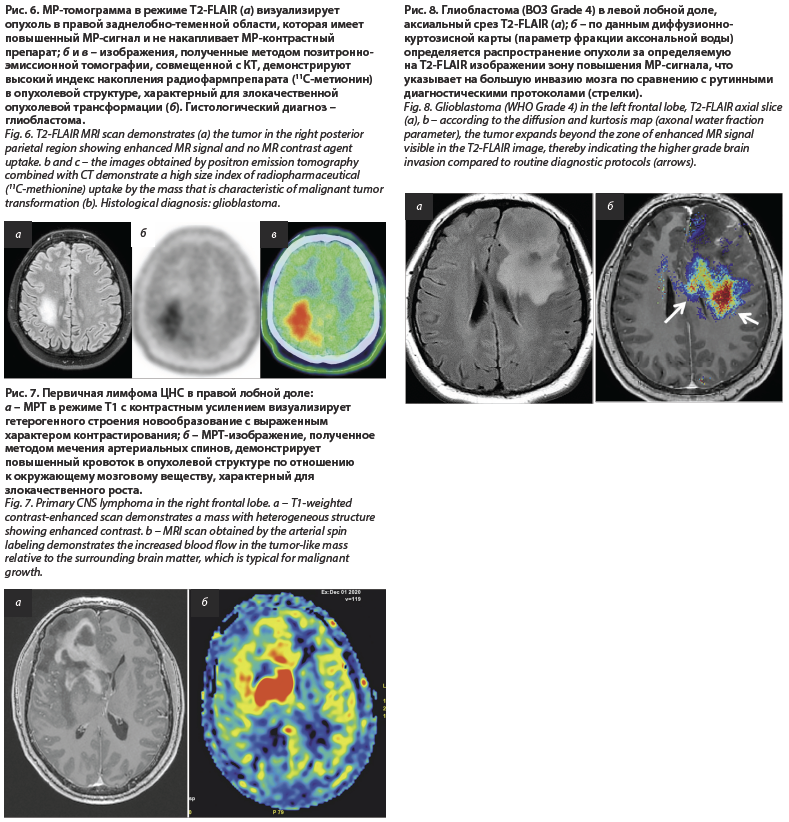
Что это дает? Основная цель – это визуализация мелких или точнее сказать микроскопических деталей с высокой степенью контрастности (или дифференцировки). В нашем случае – это разграничение здоровых и опухолевых тканей с высочайшей точностью. Представьте опухоль, которая имеет размер 1,0–2,0 мм. При стандартном подходе при МРТ-исследовании с толщиной среза 5 мм (т.е. очаг меньше по размерам, чем конечный элемент построения изображения) она может быть легко пропущена. В итоге будет потеряно время, опухоль к моменту следующего повторного МРТ может катастрофически увеличиться в размерах и стать неоперабельной. Использование тонких срезов с высоким пространственным разрешением деталей помогает избежать возможных ошибок и раньше заподозрить появление патологических изменений и начать контролирование состояния пациента на самых ранних этапах болезни (рис. 4).
Высокая точность важна и при планировании нейрохирургических операций с использованием нейронавигации. Чем точнее отображена картина опухоли и окружающего ее здорового мозга, чем лучше прорисованы важные анатомические структуры, тем успешнее будет достигнута поставленная цель, например успешное взятие прицельной биопсии патологического объекта и постановка гистологического диагноза еще на этапах подготовки к операции.
С другой стороны, высокая разрешающая способность и тонкие срезы позволяют реконструировать высококачественные 3D-модели различных интракраниальных объектов в их взаимоотношении с мозговыми, сосудистыми и костными структурам (рис. 5). Это свойство широко используется в 3D-навигации в ходе оперативного вмешательства, а также при 3D-печати объемных моделей и объектов.
Еще одна очень важная черта, которая ярко характеризует современную нейровизуализацию, – это высокая специфичность проводимой диагностики. Для этой цели используется широкий спектр новых технологий и подходов, а также контрастные препараты, которые, проникая в патологическую область, «подкрашивают» ее, выделяя на фоне здоровых тканей. Это касается и КТ, и МРТ. Например, при КТ-ангиографии и при КТ-перфузионных исследованиях внутривенно вводимый рентгеноконтрастный препарат, двигаясь вместе с кровью по сосудам, делает их высококонтрастными по отношению к окружающему их мозгу. На основе этого в дальнейшем реконструируется сосудистая (артериальная и/или венозная) система головного мозга, позволяя выявить мельчайшие патологические отклонения и детали в ее строении. Так, например, проходит один из этапов диагностики патологических расширений в сосудах мозга – диагностика артериальных интракраниальных аневризм и артерио-венозных мальформаций, а также диагностика особенностей кровотока в опухолях головного и спинного мозга. Разработанные современные перфузионные алгоритмы исследования при КТ существенно облегчают последующую нейрохирургическую операцию, заранее предсказывая гистологический вариант опухоли мозга, степень ее злокачественности и степень патологического кровотока в ее структуре (см. рис. 5).
В МРТ также широко применяются так называемые МР-контрастные препараты, где основная (но, конечно, не единственная) цель их использования – это диагностика опухолевых поражений ЦНС. Указанные препараты при их внутривенном введении, способны проникать в опухоль через разрушенный как раз этой опухолью гематоэнцефалический/гематоопухолевый барьер и накапливаться в патологической области. Как раз особенности формы контрастирования, степень выраженности контрастного усиления, динамические особенности распространения контрастного препарата в опухолевой структуре и некоторые другие характеристики и являются специфическими маркерами различных гистологических типов новообразований головного мозга. Кроме контрастирования, в МРТ широко используются бесконтрастные методики, например диффузионно-взвешенные изображения, мечение артериальных спинов, МР-спектроскопия, которые вносят свой вклад в повышение специфичности предоперационной диагностики различных поражений ЦНС, включая новообразования мозга. Так диффузионно-взвешенные изображения стали надежным и высокоспецифичным методом неинвазивной верификации первичных лимфом ЦНС, разграничения степени злокачественности опухолей мозга еще задолго до того, как пациент поступит в операционную для ее хирургического удаления.
В последние 5–10 лет наблюдается рост интереса клиницистов и диагностов к технологии ПЭТ, совмещенной с КТ. Прежде всего это вызвано большей доступностью метода в нашей стране, а с другой стороны, высокими показателями специфичности, проводимой диагностики. В большей мере последнее качество обусловлено тем, что в ходе выполнения ПЭТ-КТ пациенту внутривенно вводится специализированный радиофармпрепарат, который может селективно включаться в нормальные (или патологические) физиологические процессы, протекающие в клетках мозга. Это позволяет увидеть патологические процессы, протекающие на внутриклеточном уровне – недаром эту методику еще называют молекулярной визуализацией (рис. 6). ПЭТ-КТ с аминокислотами – признанный лидер в диагностике и дифференциальной диагностике различных опухолей головного мозга, в диагностике рецидива злокачественных новообразований и постлучевых/посттерапевтических изменений, которые требуют абсолютно разного лечебного подхода. Широкий спектр новых специализированных радиофармпрепаратов позволяет добиться в отдельных случаях 100% специфичности в диагностике отдельных опухолей головного мозга.
Еще одна важная черта современной нейровизуализации – это низкий уровень инвазивности. Из клинической практики ушел целый ряд технологий и методов с введением воздуха и некоторых рентгеноконтрастных препаратов, считавшихся в свое время «золотым стандартом» диагностики опухолей ЦНС. Большинство современных диагностических процедур стали малоинвазивными. Повысилось качество и безопасность внутривенно вводимых рентген- и МР-контрастных препаратов. Были пересмотрены диагностические протоколы при различных заболеваниях ЦНС с преимущественным применением «щадящих» диагностических технологий, особенно на амбулаторном или начальном этапах диагностики. Более сложные процедуры, например КТ-миелография и ангиография сосудов головного мозга, стали проводиться только в стационарных условиях и как завершающий этап диагностического процесса, да и то только в тех случаях, когда другие малоинвазивные методы нейровизуализации не смогли получить полного спектра информации, необходимого для принятия решения о тактике лечения.
Накопленный клинический опыт применения различных технологий с оценкой их специфичности и чувствительности в выявлении опухолей головного и спинного мозга позволил существенно ограничить частоту применения инвазивных диагностических манипуляций или полностью их вытеснить из диагностической практики. В качестве примера можно привести современный подход к диагностике некоторых новообразований головного мозга, в частности менингиом, – в большинстве случаев для принятия решения нейрохирурги раньше ориентировались на результаты прямой церебральной ангиографии, где контрастный препарат напрямую вводился внутрь артерий, питающих головного мозг. Эта технология, несмотря на ее высокую диагностическую ценность, имеет целый ряд недостатков и сложна в проведении, а также обладает высоким риском осложнений, включая тромбоз сосудов и образование гематом в месте инъекции контрастного препарата.
Еще одним наглядным примером может стать применение методики оценки опухолевой гемодинамики. Для этих целей в МРТ стала широко использоваться методика мечения артериальных спинов, которая с успехом в большинстве случаев заменяет МРТ-методику, основанную на внутривенном контрастном усилении (рис. 7). Метод абсолютно неинвазивен, проведенные исследования доказали его высокую информативность и специфичность в дифференциальной диагностике между доброкачественными и злокачественными глиомами головного мозга.
Современные возможности нейровизуализации не ограничены перечисленными выше чертами. Особый интерес сегодня представляют научно-фундаментальные исследования развития и роста интракраниальных опухолей на основе новейших достижений в области ПЭТ-КТ и МР-томографии. Одним из научных направлений в сфере первичной диагностики злокачественных глиом головного мозга является изучение распространенности опухолевой инвазии окружающего мозга. Для этих целей привлекаются уникальные возможности МР-томографии (исследования диффузионно-куртозисных и перфузионных МРТ-биомаркеров), способные «увидеть» границы опухолевой инвазии мозга, недоступные для стандартных методик нейровизуализации. В итоге строятся индивидуальные карты распространенности злокачественных глиом, необходимые не только для нейрохирургической резекции, но также для последующей прицельной персонифицированной лучевой и химиотерапии (рис. 8).
Таким образом, современная нейровизуализация характеризуется наличием широкого спектра диагностического оборудования, обладающего высокой точностью и специфичностью, которые могут быть достигнуты на фоне высочайшей скорости получения изображений и минимальной инвазивности.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах:
Лихтерман Леонид Болеславович – д-р мед. наук, проф., гл. науч. сотр. 9-го нейрохирургического отделения, ФГАУ «НМИЦ нейрохирургии им. акад. Н.Н. Бурденко».
E-mail:Likhterman@nsi.ru; ORCID: 0000-0002-9948-9816
Leonid B. Likhterman – Dr. Sci. (Med.), Prof., Burdenko National Medical Research Center for Neurosurgery.
E-mail: Likhterman@nsi.ru; ORCID: 0000-0002-9948-9816
Охлопков Владимир Александрович – канд. мед. наук, доц., ст. науч. сотр. 9-го нейрохирургического отделения, ФГАУ «НМИЦ нейрохирургии им. акад. Н.Н. Бурденко».
ORCID: 0000-0001-8911-2372
Vladimir A. Okhlopkov – Cand. Sci. (Med.), Assoc. Prof., Burdenko National Medical Research Center for Neurosurgery. ORCID: 0000-0001-8911-2372
Рыжова Марина Владимировна – д-р мед. наук, зав. патологоанатомическим отделением, ФГАУ «НМИЦ нейрохирургии им. акад. Н.Н. Бурденко». ORCID: 0000-0001-7206-6365
Marina V. Ryzhova – Dr. Sci. (Med.), Burdenko National Medical Research Center for Neurosurgery. ORCID: 0000-0001-7206-6365
Снигирева Галина Петровна – д-р биол. наук, вед. науч. сотр. патологоанатомического отделения, ФГАУ «НМИЦ нейрохирургии им. акад. Н.Н. Бурденко».
ORCID: 0000-0002-2584-802X
Galina P. Snigireva – Dr. Sci. (Biolog.), Burdenko National Medical Research Center for Neurosurgery. ORCID: 0000-0002-2584-802X
Шишкина Людмила Валентиновна – канд. мед. наук, врач патологоанатомического отделения, ФГАУ «НМИЦ нейрохирургии им. акад. Н.Н. Бурденко». ORCID: 0000-0001-7045-2370
Liudmila V. Shishkina – Cand. Sci. (Med.), Burdenko National Medical Research Center for Neurosurgery. ORCID: 0000-0001-7045-2370
Пронин Игорь Николаевич – акад. РАН, д-р мед. наук, проф., зав. отделением рентгеновских и радиоизотопных методов диагностики, ФГАУ «НМИЦ нейрохирургии им. акад. Н.Н. Бурденко». ORCID: 0000-0002-4480-0275
Igor N. Pronin – Acad. RAS, Dr. Sci. (Med.), Full Prof., Burdenko National Medical Research Center for Neurosurgery. ORCID: 0000-0002-4480-0275
Захарова Наталья Евгеньевна – д-р мед. наук, проф. РАН, вед. науч. сотр. отделения рентгеновских и радиоизотопных методов диагностики, ФГАУ «НМИЦ нейрохирургии им. акад.
Н.Н. Бурденко». ORCID: 0000-0002-0516-3613
Natalia E. Zakharova – Dr. Sci. (Med.), Prof. RAS, Burdenko National Medical Research Center for Neurosurgery. ORCID: 0000-0002-0516-3613
Баталов Артем Игоревич – канд. мед. наук, науч. сотр. отделения рентгеновских и радиоизотопных методов диагностики, ФГАУ «НМИЦ нейрохирургии им. акад. Н.Н. Бурденко». ORCID: 0000-0002-8924-7346
Artem I. Batalov – Cand. Sci. (Med.), Burdenko National Medical Research Center for Neurosurgery. ORCID: 0000-0002-8924-7346
Корниенко Валерий Николаевич – д-р мед. наук, проф., акад. РАН. ORCID: 0000-0002-5170-8039
Valeriy N. Kornienko – Dr. Sci. (Med.), Full Prof., Acad. RAS.
ORCID: 0000-0002-5170-8039
Поступила в редакцию: 02.06.2023
Поступила после рецензирования: 08.06.2023
Принята к публикации: 29.06.2023
Received: 02.06.2023
Revised: 08.06.2023
Accepted: 29.06.2023
Клинический разбор в общей медицине №5 2023
Принципы современной диагностики опухолей головного мозга
Номера страниц в выпуске:6-16
Аннотация
Изложена методология современного этапа распознавания опухолей головного мозга. Представлена классификация опухолей центральной нервной системы Всемирной организации здравоохранения от 2021 г. и ее основные отличия от предыдущей версии. Раскрыты молекулярно-генетические методы, использование которых необходимо для постановки полного интегрированного патоморфологического диагноза, необходимого для выбора адекватной терапии опухолей головного мозга. Рассмотрены возможности нейровизуализационных методик для исчерпывающей диагностики опухолей головного мозга.
Ключевые слова: опухоли головного мозга, методология диагноза, молекулярно-генетическое распознавание, нейровизуализация.
Для цитирования: Лихтерман Л.Б., Охлопков В.А., Рыжова М.В. и др. Принципы современной диагностики опухолей головного мозга. Клинический разбор в общей медицине. 2023; 4 (5): 6–16. DOI: 10.47407/kr2023.4.5.00229
Изложена методология современного этапа распознавания опухолей головного мозга. Представлена классификация опухолей центральной нервной системы Всемирной организации здравоохранения от 2021 г. и ее основные отличия от предыдущей версии. Раскрыты молекулярно-генетические методы, использование которых необходимо для постановки полного интегрированного патоморфологического диагноза, необходимого для выбора адекватной терапии опухолей головного мозга. Рассмотрены возможности нейровизуализационных методик для исчерпывающей диагностики опухолей головного мозга.
Ключевые слова: опухоли головного мозга, методология диагноза, молекулярно-генетическое распознавание, нейровизуализация.
Для цитирования: Лихтерман Л.Б., Охлопков В.А., Рыжова М.В. и др. Принципы современной диагностики опухолей головного мозга. Клинический разбор в общей медицине. 2023; 4 (5): 6–16. DOI: 10.47407/kr2023.4.5.00229
Lecture Principles of modern brain tumor diagnosis
Leonid B. Likhterman, Vladimir A. Okhlopkov, Marina V. Ryzhova, Galina P. Snigireva,
Liudmila V. Shishkina, Igor N. Pronin, Natalia E. Zakharova, Artem I. Batalov, Valeriy N. Kornienko
Burdenko National Medical Research Centre for Neurosurgery, Moscow, Russia
Likhterman@nsi.ru
Abstract
The paper reports methodology of the current phase of brain tumor recognition. The World Health Organization classification of the central nervous system tumors issued in 2021 and its main differences from the previous version are provided. The molecular genetic methods, the use of which is necessary to establish the comprehensive integrated pathological diagnosis required for selection of adequate brain tumor therapy, are disclosed.
The potential of using neuroimaging techniques for comprehensive brain tumor diagnosis is discussed.
Key words: brain tumors, diagnosis methodology, molecular genetic detection, neuroimaging.
For citation: Likhterman L.B., Okhlopkov V.A., Ryzhova M.V. et al. Principles of modern brain tumor diagnosis. Clinical review for general practice. 2023; 4 (5): 6–16 (In Russ.). DOI: 10.47407/kr2023.4.5.00229
Нейроонкология относится к классическим базисным разделам нейрохирургии.
Число больных с первичными и особенно метастатическими опухолями головного мозга растет. Их распознавание определяет и тактику лечения, и прогнозные оценки. Между тем сама нейродиагностика претерпела за последние десятилетия настолько значительные изменения, что стала концептуально иной.
Общение с пациентом неотделимо от врачевания. Данные анамнеза и клинико-неврологического исследования имеют огромное распознавательное значение. Но их недостаточно для уточненной топической и нозологической диагностики поражений головного мозга. Это вызвало необходимость на этапе становления нейрохирургии как самостоятельной клинической дисциплины в начале ХХ в. разработки рентгеновских методов визуализации – вентрикулографии, пневмоэнцефалографии, ангиографии [1]. Однако они болезненны и кровавы, тяжело переносились, были чреваты осложнениями, а иногда летальным исходом. Применение этих методов являлось вынужденным.
Начиная с 70-х годов прошлого века наступает качественно новый период нейрохирургической диагностики. Она приближается к критериям идеального метода, обеспечивая безболезненное, бескровное, безопасное и дистантное видение структур головного мозга. Диагноз через страдания и риски ушел в историю. Более того, современные методы нейровизуализации, такие как магнитно-резонансная (МРТ), компьютерная (КТ), ультразвуковая томография и другие, способны выявлять патологию мозга, прежде всего его опухоли, в доклиническую стадию – при полной сохранности здоровья и работоспособности человека. Возникла превентивная нейроонкология.
Учитывая все нарастающее многообразие методов лечения опухолей головного мозга – оперативных, радиологических, химических, гормональных и других, актуальным стало долечебное уточнение не только их топики, размеров, отношения к оболочкам, мозговому веществу и ликворным пространствам, но и гистобиологических характеристик, включая молекулярно-генетические особенности.
Следует констатировать: наступил новый этап диагностики опухолей головного мозга, который требует своего осмысления и формулировки принципов.
Методология
Применительно к клиническим манифестным опухолям головного мозга первостепенным остается значение анамнеза и неврологического обследования пациента, формирующих предварительный диагноз, стремящийся в первом приближении ответить на основные вопросы в нейрохирургии: что (нозологический диагноз), где (топический диагноз) и что делать (тактический диагноз).В настоящее время всегда необходимо нейровизуализационное подтверждение и уточнение патологии для выработки окончательного диагноза и адекватной тактики лечения, сфера которого, как мы уже упоминали, стала чрезвычайно широкой.
Современная методология диагноза опухолей головного мозга базируется на определенных принципах, каждый из которых важен и имеет свою историю. Их совокупность способна обеспечить полноценный развернутый индивидуальный диагноз, позволяющий избирать адекватную тактику лечения и давать надежный прогноз.
Мы выделяем следующие принципы построения клинического диагноза: синдромология поражения, нозология поражения, топика поражения, возрастной подход, фазный подход, визуализация поражения, уточнение биологических качеств поражения, достаточность данных, интеграция данных, индивидуальный подход [2].
Принцип синдромологии. Определяют ведущий в клинике синдром: оболочечный, эпилептический, пирамидный, подкорковый, среднемозговой, мозжечковый и т.д.
Принцип нозологии. Определяют опухолевую природу поражения и предположительно гистобиологические качества, первичность или вторичность поражения.
Принцип топики. Определяют полушарную или мозжечковую латерализацию, долевую или стволовую локализацию поражения, конвекситальную, базальную или перивентрикулярную топику и т.д.
Принцип возрастного подхода. Учитывают анатомо-физиологические особенности организма и его реакций у детей, молодых, лиц среднего, пожилого и старческого возраста.
Принцип фазного подхода. С учетом уровня компенсаторно-приспособительных возможностей организма (определяемых по общемозговым, очаговым, стволовым и соматическим показателям) устанавливают клиническую фазу опухоли: компенсации, субкомпенсации, умеренной или грубой декомпенсации, а также терминальную. В упрощенном варианте – состояние больного – от удовлетворительного до крайне тяжелого.
Принцип визуализации. Благодаря методам интроскопии возможно неинвазивное прижизненное видение анатомии и топографии структур головного мозга, их патологии, а также ряда функциональных показателей мозговой деятельности. Это резко изменило понимание сущности и динамики бластоматозного процесса, несоизмеримо расширило возможности диагностики и лечения, глубоко отразилось на психологии врача, заставило пересмотреть многие привычные представления.
Методы неинвазивной визуализации придали нейрохирургическому диагнозу также новые функции – исследовательские и контрольные.
КТ и МРТ внесли значительную определенность в представления о различных опухолях головного мозга. Методы неинвазивной визуализации диалектически привели к существенному углублению лечебной концепции при опухолях головного мозга.
Принцип долечебного уточнения биологических качеств бластоматозного процесса. Выбор различных методов лечения требует максимального уточнения биологических качеств опухоли. Этому способствуют применение КТ и МРТ с контрастным усилением, позитронно-эмиссионная томография (ПЭТ) и ряд других методик. Особую ценность, наряду с рутинной микроскопией дооперационных биоптатов, играют современные молекулярно-генетические исследования.
Принцип достаточности данных. Процесс распознавания часто должен быть сжат во времени. Поэтому используют методы, способные сразу разрешить, если не все, то главные диагностические затруднения. Исследование начинают с наиболее информативных способов. Многие диагностические вопросы разрешает комбинация неврологического и КТ, МРТ методов. Если отпадает необходимость в каких-либо дополнительных уточняющих диагноз исследованиях, то реализуется принцип достаточности данных.
Принцип интеграции данных. Все полученные данные о больном (анамнестические, клинические, инструментальные, лабораторные и др.) сопоставляются и обобщаются для уточнения диагноза и тактики лечения опухолей головного мозга.
Принцип индивидуального подхода. Всегда должен доминировать индивидуальный диагноз конкретного больного, учитывающий его антропометрические данные, анамнез жизни и болезни, свойственные ему особенности проявления и течения опухоли головного мозга. Индивидуальный подход к диагностике опухолей головного мозга включает также деонтологические аспекты с учетом состояния сознания и личности больного, его социального положения, характерологических особенностей родных, близких и т.д.
Применительно к случайно обнаруженным асимптомным опухолям головного мозга изложенная методология диагноза, сохраняя свою силу, требует определенной коррекции.
Тактику ведения практически здорового человека с выявленной опухолью мозга необходимо рассматривать дифференцированно с учетом локализации и гистобиологических качеств бластоматозного процесса. Решающим фактором в предпочтении наблюдения в динамике или определенного метода лечения является сохранение качества жизни во временной ее протяженности. Тактика нейрохирурга исключительно подчинена врачебному принципу non nocere.
Превентивная нейрохирургия, как и любая иная предупредительная хирургия, должна быть гарантированной. В каждом случае необходимо со стороны нейрохирурга четкое обоснование предложения превентивной операции, а со стороны пациента – столь же четкое понимание ее предупредительной спасительности. Превентивная нейроонкология должна максимально учитывать особенности психики пациента.
Поэтому, наряду с аргументированными нейрохирургическими соображениями, определяющим в решении прибегнуть к хирургии случайных находок является по-настоящему информированное согласие пациента с полным пониманием и той ответственности по отношению к самому себе, которую он добровольно берет.
Превентивная нейроонкология остро нуждается в разработке своей особой философии, которой должны проникнуться нейрохирурги, решившие ею заниматься. Только философское осмысление позволит за картинкой увидеть, в отличие от больного, нестрадающего человека, и, по-врачебному представив угрозы его будущему, решить, надо ли ему помогать, когда и как.
К лечению асимптомных опухолей головного мозга следует прибегать только тогда, когда есть уверенность, что это обеспечит лучший исход, чем естественное течение патологии головного мозга [3].
В отличие от клинической нейроонкологии, диагноз асимптомной опухоли мозга является только картиночным и иным быть не может. Но решение о выборе тактики – наблюдение или активное лечение – всегда должно быть клинико-философским.
Необходимо помнить, что идеологии клинической нейрохирургии и превентивной нейрохирургии – разные: для первой – это восстановление утраченного здоровья, а для второй – его сохранение.
Диалектика «действие или бездействие» мучительна для нейрохирурга, поскольку он видит патологический субстрат, сам по себе подлежащий удалению, но, соизмеряя, что лучше для практически здорового человека, нередко выбирает бездействие как оптимальный тактический вариант.
В заключение, подчеркнем, что повсеместное приближение специализированной помощи к населению, распространение методов нейровизуализации резко усилили темп диагностического процесса в нейроонкологии. Пассивная диагностика опухолей головного мозга (установление диагноза путем наблюдения) сменилось активным опережающим их распознаванием, благодаря прежде всего нейровизуализации.
Эффективное использование ее возможностей требует подхода к носителю патологии с позиций клинического мышления, осуществляющего системный подход, оптимальный для здоровья человека.
Новая классификация и молекулярно-генетическое распознавание опухолей центральной нервной системы
Современная диагностика опухолей центральной нервной системы (ЦНС) осуществляется на основе Классификации Всемирной организации здравоохранения (ВОЗ) от 2021 г. По сравнению с предыдущей версией от 2016 г. наибольшие изменения внесены в основную часть классификации, которая касается внутримозговых опухолей [4, 5]. Представим этот раздел.Диффузные глиомы взрослого типа:
• астроцитома IDH-мутантная:
- астроцитома IDH-мутантная, grade 2;
- астроцитома IDH-мутантная, grade 3;
- астроцитома IDH- мутантная, grade 4;
• олигодендроглиома IDH-мутантная с коделецией 1p/19q:
- олигодендроглиома IDH-мутантная grade 2;
- олигодендроглиома IDH-мутантная grade 3;
• глиобластома IDH-дикий тип.
Диффузные глиомы низкой степени злокачественности детского типа:
• диффузная астроцитома с нарушениями MYB MYBL1;
• ангиоцентрическая глиома;
• диффузная глиома низкой степени злокачественности с нарушениями сигнального пути MAPK;
• полиморфноклеточная нейроэпителиальная опухоль низкой степени злокачественности молодых PLNTY WHO grade 1.
Диффузные глиомы высокой степени злокачественности детского типа:
• диффузная срединная глиома H3 K27-мутантная;
• диффузная полушарная глиома H3 G34-мутантная;
• диффузная глиома высокой степени злокачественности детского типа Н3-дикого типа и IDH-дикого типа WHO grade 4;
• глиома полушарий младенческого типа.
Отграниченные астроцитарные глиомы:
• пилоцитарная астроцитома;
• астроцитома высокой степени злокачественности с пилоцитарными признаками;
• плеоморфная ксантоастроцитома;
• субэпендимарная гигантоклеточная астроцитома;
• хордоидная глиома;
• астробластома с нарушением MN1.
Глионейрональные и нейрональные опухоли:
• ганглиоглиома;
• ганглиоцитома;
• десмопластическая инфантильная ганглиоглиома;
• десмопластическая инфантильная астроцитома;
• дизэмбриопластическая нейроэпителиальная опухоль;
• диффузная глионейрональная опухоль с олигодендроглиальными признаками и кластерами ядер;
• папиллярная глионейрональная опухоль;
• розеткоформирующая глионейрональная опухоль;
• миксоидная глионейрональная опухоль;
• диффузная лептоменингиальная глионейрональная опухоль NOS;
• мультинодулярная и вакуолизирующая нейрональная опухоль;
• диспластическая церебеллярная ганглиоцитома (Лермитта–Дюкло);
• центральная нейроцитома;
• экстравентрикулярная нейроцитома;
• церебеллярная липонейроцитома.
Эпендимальные опухоли:
• супратенториальная эпендимома NOS;
• супратенториальная эпендимома ZFTA Fusion-позитивная;
• супратенториальная эпендимома YAP1 Fusion-позитивная;
• эпендимома задней черепной ямки NOS;
• эпендимома задней черепной ямки группа А (PFA);
• эпендимома задней черепной ямки группа В (PFB);
• спинальная эпендимома NOS;
• спинальная эпендимома с амплификацией MYCN;
• миксопапиллярная эпендимома;
• субэпендимома.
Опухоли сосудистого сплетения:
• папиллома сосудистого сплетения;
• атипическая папиллома сосудистого сплетения;
• карцинома сосудистого сплетения.
Эмбриональные опухоли:
• медулобластомы молекулярно определяемые;
• медуллобластома WNT-activated;
• медуллобластома SHH-activated and T53-wildtype;
• медуллобластома SHH-activated and T53-mutant;
• медуллобластома non-WNT/non-SHH;
• медуллобластомы гистологически определяемые;
• медуллобластома десмопластческая нодуллярная;
• медуллобластома с экстенсивной нодуллярностью;
• медуллобластома крупноклеточная;
• медуллобластома анапластическая.
Другие эмбриональные опухоли ЦНС:
• атипическая терпатоидно-рабдоидная опухоль;
• крибриформная нейроэпителиальная опухоль;
• эмбриональная опухоль с многослойными розетками;
• ЦНС нейробластома FOXR2-activated;
• ЦНС нейробластома с BCOR тандемной амплификацией;
• ЦНС нейробластома NOS/NEC.
Опухоли пинеальной области:
• пинеоцитома;
• паренхиматозная опухоль шишковидной железы промежуточной дифференцировки;
• пинеобластома;
• папиллярная опухоль пинеальной области;
• десмопластическая миксоидная опухоль пинеальной области с мутацией SMARCB.
В приведенной классификации внутримозговых опухолей более половины содержат в своем названии конкретные молекулярные альтерации, без которых постановка современного диагноза невозможна.
В настоящую версию добавлен ряд недавно признанных типов: диффузная астроцитома, измененная MYB или MYBL1; полиморфная низкозлокачественная нейроэпителиальная опухоль молодого возраста; диффузная глиома низкой степени злокачественности с повреждением МАРК-сигнального пути; диффузная полушарная глиома с H3 G34-мутантный тип, диффузная глиома высокой степени злокачественности детского типа, H3-дикого типа и IDH-дикого типа; полушарная глиома младенческого типа; астроцитома высокой степени злокачественности с пилоидными чертами, а также отдельные виды глионейрональных и эмбриональных опухолей.
Впервые диффузные глиомы детского типа отделены от диффузных глиом взрослого типа. В то время как для диффузных глиом взрослого типа их классификация была упрощена до трех основных типов: астроцитомы диффузные IDH-мутантные, олигодендроглиомы IDH-мутантные, глиобластомы IDH-дикий тип.
Такое разделение продиктовано, прежде всего, клиническими и молекулярными различиями, существующими между диффузными глиомами, возникающими в основном у взрослых (называемые «взрослым типом»), и глиомами, возникающими преимущественно у детей (называемые «педиатрическим типом»). Конечно, опухоли детского типа иногда могут возникать у взрослых, особенно у молодых людей, а опухоли взрослого типа могут (реже) встречаться у детей. Тем не менее разделение классификации на диффузные глиомы взрослого и детского типа станет важным шагом вперед в четком разделении этих клинически и биологически различных групп опухолей. Возможно, выявленные молекулярные различия позволят усовершенствовать тактику противоопухолевой терапии у детей с опухолями мозга.
Радикальные изменения претерпела группа эпендимом, где в основу классификации положено деление по локализационному (супратенториальные, субтенториальные и спинальные эпендимомы) и генетическому принципам.
Претерпела некоторые изменения и градация степени малигнизации опухолей, заключающаяся во внедрении арабской нумерации, что делает ее более сопоставимой с градациями, принятыми в общей онкологии. Не рекомендуется теперь использование термина «анапластическая» для обозначения астроцитом, эпендимом, хориоидпапиллом.
Выделено множество подвидов опухолей мозга с различным генетическим профилем, которые имеют отличительный прогноз течения заболевания и требуют индивидуальных подходов к комбинированному лечению и использованию таргетной терапии. Диагностика этих опухолей включает в себя не только гистологическое исследование и иммуногистохимическую верификацию, но и определенный спектр молекулярно-генетических характеристик для каждой группы опухолей, что на современном уровне требует интегрированного гистологически-молекулярного диагноза.
Для постановки такого интегрированного диагноза опухоли ЦНС на практике, помимо рутинных методов гистологического исследования и иммуногистохимической верификации тканевой принадлежности опухоли, стали необходимы: флуоресцентная гибридизация in situ (выявляет хромосомные изменения: амплификации, делеции, транслокации), рис. 1; полимеразная цепная реакция (выявляет слияния генов); секвенирование по Сэнгеру (выявляет мутации в конкретных регионах генов), рис. 2; таргетное высокопроизводительное секвенирование (NGS-next-generation sequencing – позволяет проводить комплексный анализ множества генов); методы анализа профиля метилирования ДНК.
Важно отметить, что анализ профиля метилирования ДНК приобретает особое значение в диагностике опухолей ЦНС. Он основан на анализе профиля метилирования 850 тыс. CpG-динуклеотидов (CpG-динуклеотид представляет собой цитозин и гуанин, разделенный фосфатом Cytosine–phosphate–Guanine; участки ДНК, богатые CpG-динуклеотидами, называют CpG-островками) и сравнении с данными метилирования 2800 различных видов референсных образцов опухолей ЦНС, имеющих характерные профили метилирования.

Анализ профиля метилирования ДНК применяется в основном для диагностики детских злокачественных супратенториальных опухолей, для определения молекулярной группы эмбриональных и глиальных опухолей [6]. С помощью этого метода можно выявлять делеции, добавки, амплификации отдельных генов и оценивать статус метилирования гена MGMT (рис. 3). Для проведения исследования возможно использовать как замороженную опухолевую ткань, так и фиксированную в формалине и залитую в парафин ткань опухоли. Однако метод не всегда позволяет диагностировать детские супратенториальные опухоли. В подобных случаях исследование рекомендуется расширить высокопроизводительным секвенированием с панелью, позволяющей диагностировать ключевые повторяющиеся мутации и слияния генов.

Редкие случаи диффузных опухолей, при которых молекулярное тестирование не удалось осуществить технически (например, из-за ограниченной доступности ткани или низкого содержания опухолевых клеток), могут быть гистологически классифицированы как глиома NOS (Not Otherwise Specified) или русским термином БДУ – «без дополнительного уточнения» и обозначены как опухоль ЦНС 2-й или 3-й степени по классификации ВОЗ в зависимости от наличия или отсутствия гистологических признаков анаплазии. Для особых случаев опухолей с неоднозначным результатом
генотипирования и фенотипирования применяется термин NEC (Not Elsewhere Classified) или неклассифицируемая опухоль [7].
В текущей классификации есть несколько подвидов опухолей, которые можно диагностировать только с помощью анализа профиля метилирования ДНК, например: астроцитома высокой степени злокачественности с пилоидными признаками, эпендимома ЗЧЯ группа PFB, медуллобластома без активации сигнальных каскадов WNT/SHH и другие, а для большинства эмбриональных опухолей этот метод используется как полезный альтернативный подход. Кроме того, анализ профиля метилирования ДНК желательно использовать при сложном дифференциальном диагнозе, когда другие молекулярно-генетические характеристики в сочетании с иммунофенотипом опухоли выглядят противоречивыми.
В последние годы в связи с появлением и распространением новых молекулярных технологий, использование которых становится все более востребованным онкологами в связи с выбором тактики последующего лечения больного и возможности применения персонифицированного подхода при выборе противоопухолевых препаратов, становится крайне актуальным принцип интегрированного патоморфологического и молекулярного диагноза, суть которого заключается в совместном участии морфологов и биологов при его постановке, а выбор метода исследования определяется после гистологического и иммуногистохимического исследования опухоли.
Итак, в соответствии с требованиями последней версии классификации опухолей ЦНС ВОЗ, стандартом современной диагностики внутримозговых опухолей на сегодняшний день является интегрированный диагноз, включающий гистологический диагноз (с иммуногистохимической верификацией), степень злокачественности и молекулярно-генетический профиль опухоли. Именно этот диагноз считается окончательным, так как позволяет определять возможные варианты лечения и прогноз заболевания. В случаях технического отсутствия такой возможности либо в силу других обстоятельств следует использовать термины БДУ либо NOS/NEC с рекомендациями для верификации диагноза конкретных молекулярно-генетических исследований в других учреждениях. Весьма актуальным в этих случаях становится обращение в центры референс-диагностики, обеспеченные высокотехнологичным оборудованием и квалифицированными специалистами, что позволит усовершенствовать современную многоуровневую диагностику опухолей мозга.
Возможности нейровизуализации
Со времени открытия Конрадом Рентгеном «волшебных лучей» прошло чуть больше одного века, но за этот промежуток времени произошли поистине ошеломляющие изменения в медицинской технике и в специальности «рентгенология». От простых рентгеновских аппаратов технология шагнула к сверхпроводящим магнитно-резонансным системам получения изображений, быстродействующим КТ-сканером молекулярной визуализации на основе ПЭТ. Абсолютно новыми стали методы гистологического анализа патологических тканей, появились новые методы молекулярного анализа опухолей ЦНС.Нейровизуализация представляет собой комплексное диагностическое направление, объединяющее в себе методы лучевой диагностики, к которым относятся ультразвуковые исследования, рентгеновская КТ, МРТ, а в последнее время и ПЭТ, совмещенная с КТ. В рамках этого направления врачи-диагносты (по специализации – это врачи функциональной диагностики, рентгенологи и радиологи) занимаются исследованиями заболеваний и поражений ЦНС, а проще говоря, исследованиями головного мозга, спинного мозга и позвоночника.
Если рассматривать нейровизуализацию без учета специфики применяемых диагностических технологий – можно выделить несколько основных направлений, по которым идет ее развитие и совершенствование.
Первое направление нейровизуализации – это высокая скорость получения диагностических изображений. Сама по себе скорость не главная, но очень важная черта современных диагностических модальностей. Так, современные КТ-сканеры могут получать тысячи изображений за считанные секунды. Интересно, но сейчас сама подготовка к проведению диагностического исследования длится в несколько раз дольше, чем сам процесс сканирования. К примеру, длительность диагностического сканирования головного мозга человека (если, конечно, мы не говорим о сложных динамических и мультифазных протоколах) составляет 3–5 с.
И за это короткое время можно получить до 1 тыс. диагностических изображений. А все начиналось с односрезовых КТ-приборов, где 1 анатомический срез (или изображение) реконструировался в течение 1–2 мин. Сегодня во многих клиниках России работают многосрезовые КТ-аппараты с впечатляющей скоростью получения рентгеновских изображений.
Современная МРТ не может «похвастаться» такой быстротой, как КТ. В то же время за последние 10–15 лет и в МРТ произошли существенные сдвиги в сторону ускорения получения диагностических данных. Сейчас на многих МРТ-сканерах установлены протоколы, способные сократить время сканирования в два, а то и в три раза. Например, для получения изображения сосудистой системы головного мозга (при одинаковом объеме анатомической области) раньше требовалось 8–12 мин, а с внедрением технологий ускорения сбора данных и новых математических алгоритмов идентичное качество может быть достигнуто вдвое короче. Кажется, что это не много, но если учесть тот факт, что за время МРТ-исследования необходимо провести 5–6 различных сканирований, сокращение в каждой программе приводит к уменьшению общего времени МРТ-протокола, например с 30–40 мин до 15–20 мин. И это не только увеличение пропускной способности МРТ-аппарата (больше пациентов можно исследовать за одну рабочую смену), что, конечно же, очень важно в современных условиях, но и больший комфорт для пациента, которому приходится меньше времени проводить внутри аппарата, соблюдая условия неподвижности. При этом не следует сбрасывать со счетов «шумность» МР-оборудования и определенную ограниченность пространства (по сравнению все с той же КТ), которые снижают толерантность пациентов к длительности процедуры сканирования.
Второе и очень важное направление в развитии нейровизуализации – это достижение высокой точности диагностики, основу которой составляет высокая разрешающая способность диагностического оборудования. Это касается и КТ, и МРТ. Современные КТ-сканеры в рутинном режиме способны получать изображения с толщиной среза 0,625 мм и даже тоньше. Так как в МРТ процесс сканирования и реконструкции изображений протекает сложнее, чем при КТ, то стандартная толщина среза обычно составляет 3–5 мм. Однако и в МРТ достигнуты существенные результаты с точки зрения разрешающей способности – в некоторых 3D режимах толщина среза достигает 0,6–1,0 мм. Это означает, что элемент изображения или воксел, из которых потом реконструируется привычная для нас картинка, равен 1,0 мм и даже меньше.
Что это дает? Основная цель – это визуализация мелких или точнее сказать микроскопических деталей с высокой степенью контрастности (или дифференцировки). В нашем случае – это разграничение здоровых и опухолевых тканей с высочайшей точностью. Представьте опухоль, которая имеет размер 1,0–2,0 мм. При стандартном подходе при МРТ-исследовании с толщиной среза 5 мм (т.е. очаг меньше по размерам, чем конечный элемент построения изображения) она может быть легко пропущена. В итоге будет потеряно время, опухоль к моменту следующего повторного МРТ может катастрофически увеличиться в размерах и стать неоперабельной. Использование тонких срезов с высоким пространственным разрешением деталей помогает избежать возможных ошибок и раньше заподозрить появление патологических изменений и начать контролирование состояния пациента на самых ранних этапах болезни (рис. 4).
Высокая точность важна и при планировании нейрохирургических операций с использованием нейронавигации. Чем точнее отображена картина опухоли и окружающего ее здорового мозга, чем лучше прорисованы важные анатомические структуры, тем успешнее будет достигнута поставленная цель, например успешное взятие прицельной биопсии патологического объекта и постановка гистологического диагноза еще на этапах подготовки к операции.
С другой стороны, высокая разрешающая способность и тонкие срезы позволяют реконструировать высококачественные 3D-модели различных интракраниальных объектов в их взаимоотношении с мозговыми, сосудистыми и костными структурам (рис. 5). Это свойство широко используется в 3D-навигации в ходе оперативного вмешательства, а также при 3D-печати объемных моделей и объектов.

Еще одна очень важная черта, которая ярко характеризует современную нейровизуализацию, – это высокая специфичность проводимой диагностики. Для этой цели используется широкий спектр новых технологий и подходов, а также контрастные препараты, которые, проникая в патологическую область, «подкрашивают» ее, выделяя на фоне здоровых тканей. Это касается и КТ, и МРТ. Например, при КТ-ангиографии и при КТ-перфузионных исследованиях внутривенно вводимый рентгеноконтрастный препарат, двигаясь вместе с кровью по сосудам, делает их высококонтрастными по отношению к окружающему их мозгу. На основе этого в дальнейшем реконструируется сосудистая (артериальная и/или венозная) система головного мозга, позволяя выявить мельчайшие патологические отклонения и детали в ее строении. Так, например, проходит один из этапов диагностики патологических расширений в сосудах мозга – диагностика артериальных интракраниальных аневризм и артерио-венозных мальформаций, а также диагностика особенностей кровотока в опухолях головного и спинного мозга. Разработанные современные перфузионные алгоритмы исследования при КТ существенно облегчают последующую нейрохирургическую операцию, заранее предсказывая гистологический вариант опухоли мозга, степень ее злокачественности и степень патологического кровотока в ее структуре (см. рис. 5).
В МРТ также широко применяются так называемые МР-контрастные препараты, где основная (но, конечно, не единственная) цель их использования – это диагностика опухолевых поражений ЦНС. Указанные препараты при их внутривенном введении, способны проникать в опухоль через разрушенный как раз этой опухолью гематоэнцефалический/гематоопухолевый барьер и накапливаться в патологической области. Как раз особенности формы контрастирования, степень выраженности контрастного усиления, динамические особенности распространения контрастного препарата в опухолевой структуре и некоторые другие характеристики и являются специфическими маркерами различных гистологических типов новообразований головного мозга. Кроме контрастирования, в МРТ широко используются бесконтрастные методики, например диффузионно-взвешенные изображения, мечение артериальных спинов, МР-спектроскопия, которые вносят свой вклад в повышение специфичности предоперационной диагностики различных поражений ЦНС, включая новообразования мозга. Так диффузионно-взвешенные изображения стали надежным и высокоспецифичным методом неинвазивной верификации первичных лимфом ЦНС, разграничения степени злокачественности опухолей мозга еще задолго до того, как пациент поступит в операционную для ее хирургического удаления.
В последние 5–10 лет наблюдается рост интереса клиницистов и диагностов к технологии ПЭТ, совмещенной с КТ. Прежде всего это вызвано большей доступностью метода в нашей стране, а с другой стороны, высокими показателями специфичности, проводимой диагностики. В большей мере последнее качество обусловлено тем, что в ходе выполнения ПЭТ-КТ пациенту внутривенно вводится специализированный радиофармпрепарат, который может селективно включаться в нормальные (или патологические) физиологические процессы, протекающие в клетках мозга. Это позволяет увидеть патологические процессы, протекающие на внутриклеточном уровне – недаром эту методику еще называют молекулярной визуализацией (рис. 6). ПЭТ-КТ с аминокислотами – признанный лидер в диагностике и дифференциальной диагностике различных опухолей головного мозга, в диагностике рецидива злокачественных новообразований и постлучевых/посттерапевтических изменений, которые требуют абсолютно разного лечебного подхода. Широкий спектр новых специализированных радиофармпрепаратов позволяет добиться в отдельных случаях 100% специфичности в диагностике отдельных опухолей головного мозга.
Еще одна важная черта современной нейровизуализации – это низкий уровень инвазивности. Из клинической практики ушел целый ряд технологий и методов с введением воздуха и некоторых рентгеноконтрастных препаратов, считавшихся в свое время «золотым стандартом» диагностики опухолей ЦНС. Большинство современных диагностических процедур стали малоинвазивными. Повысилось качество и безопасность внутривенно вводимых рентген- и МР-контрастных препаратов. Были пересмотрены диагностические протоколы при различных заболеваниях ЦНС с преимущественным применением «щадящих» диагностических технологий, особенно на амбулаторном или начальном этапах диагностики. Более сложные процедуры, например КТ-миелография и ангиография сосудов головного мозга, стали проводиться только в стационарных условиях и как завершающий этап диагностического процесса, да и то только в тех случаях, когда другие малоинвазивные методы нейровизуализации не смогли получить полного спектра информации, необходимого для принятия решения о тактике лечения.
Накопленный клинический опыт применения различных технологий с оценкой их специфичности и чувствительности в выявлении опухолей головного и спинного мозга позволил существенно ограничить частоту применения инвазивных диагностических манипуляций или полностью их вытеснить из диагностической практики. В качестве примера можно привести современный подход к диагностике некоторых новообразований головного мозга, в частности менингиом, – в большинстве случаев для принятия решения нейрохирурги раньше ориентировались на результаты прямой церебральной ангиографии, где контрастный препарат напрямую вводился внутрь артерий, питающих головного мозг. Эта технология, несмотря на ее высокую диагностическую ценность, имеет целый ряд недостатков и сложна в проведении, а также обладает высоким риском осложнений, включая тромбоз сосудов и образование гематом в месте инъекции контрастного препарата.
Еще одним наглядным примером может стать применение методики оценки опухолевой гемодинамики. Для этих целей в МРТ стала широко использоваться методика мечения артериальных спинов, которая с успехом в большинстве случаев заменяет МРТ-методику, основанную на внутривенном контрастном усилении (рис. 7). Метод абсолютно неинвазивен, проведенные исследования доказали его высокую информативность и специфичность в дифференциальной диагностике между доброкачественными и злокачественными глиомами головного мозга.
Современные возможности нейровизуализации не ограничены перечисленными выше чертами. Особый интерес сегодня представляют научно-фундаментальные исследования развития и роста интракраниальных опухолей на основе новейших достижений в области ПЭТ-КТ и МР-томографии. Одним из научных направлений в сфере первичной диагностики злокачественных глиом головного мозга является изучение распространенности опухолевой инвазии окружающего мозга. Для этих целей привлекаются уникальные возможности МР-томографии (исследования диффузионно-куртозисных и перфузионных МРТ-биомаркеров), способные «увидеть» границы опухолевой инвазии мозга, недоступные для стандартных методик нейровизуализации. В итоге строятся индивидуальные карты распространенности злокачественных глиом, необходимые не только для нейрохирургической резекции, но также для последующей прицельной персонифицированной лучевой и химиотерапии (рис. 8).

Таким образом, современная нейровизуализация характеризуется наличием широкого спектра диагностического оборудования, обладающего высокой точностью и специфичностью, которые могут быть достигнуты на фоне высочайшей скорости получения изображений и минимальной инвазивности.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах:
Лихтерман Леонид Болеславович – д-р мед. наук, проф., гл. науч. сотр. 9-го нейрохирургического отделения, ФГАУ «НМИЦ нейрохирургии им. акад. Н.Н. Бурденко».
E-mail:Likhterman@nsi.ru; ORCID: 0000-0002-9948-9816
Leonid B. Likhterman – Dr. Sci. (Med.), Prof., Burdenko National Medical Research Center for Neurosurgery.
E-mail: Likhterman@nsi.ru; ORCID: 0000-0002-9948-9816
Охлопков Владимир Александрович – канд. мед. наук, доц., ст. науч. сотр. 9-го нейрохирургического отделения, ФГАУ «НМИЦ нейрохирургии им. акад. Н.Н. Бурденко».
ORCID: 0000-0001-8911-2372
Vladimir A. Okhlopkov – Cand. Sci. (Med.), Assoc. Prof., Burdenko National Medical Research Center for Neurosurgery. ORCID: 0000-0001-8911-2372
Рыжова Марина Владимировна – д-р мед. наук, зав. патологоанатомическим отделением, ФГАУ «НМИЦ нейрохирургии им. акад. Н.Н. Бурденко». ORCID: 0000-0001-7206-6365
Marina V. Ryzhova – Dr. Sci. (Med.), Burdenko National Medical Research Center for Neurosurgery. ORCID: 0000-0001-7206-6365
Снигирева Галина Петровна – д-р биол. наук, вед. науч. сотр. патологоанатомического отделения, ФГАУ «НМИЦ нейрохирургии им. акад. Н.Н. Бурденко».
ORCID: 0000-0002-2584-802X
Galina P. Snigireva – Dr. Sci. (Biolog.), Burdenko National Medical Research Center for Neurosurgery. ORCID: 0000-0002-2584-802X
Шишкина Людмила Валентиновна – канд. мед. наук, врач патологоанатомического отделения, ФГАУ «НМИЦ нейрохирургии им. акад. Н.Н. Бурденко». ORCID: 0000-0001-7045-2370
Liudmila V. Shishkina – Cand. Sci. (Med.), Burdenko National Medical Research Center for Neurosurgery. ORCID: 0000-0001-7045-2370
Пронин Игорь Николаевич – акад. РАН, д-р мед. наук, проф., зав. отделением рентгеновских и радиоизотопных методов диагностики, ФГАУ «НМИЦ нейрохирургии им. акад. Н.Н. Бурденко». ORCID: 0000-0002-4480-0275
Igor N. Pronin – Acad. RAS, Dr. Sci. (Med.), Full Prof., Burdenko National Medical Research Center for Neurosurgery. ORCID: 0000-0002-4480-0275
Захарова Наталья Евгеньевна – д-р мед. наук, проф. РАН, вед. науч. сотр. отделения рентгеновских и радиоизотопных методов диагностики, ФГАУ «НМИЦ нейрохирургии им. акад.
Н.Н. Бурденко». ORCID: 0000-0002-0516-3613
Natalia E. Zakharova – Dr. Sci. (Med.), Prof. RAS, Burdenko National Medical Research Center for Neurosurgery. ORCID: 0000-0002-0516-3613
Баталов Артем Игоревич – канд. мед. наук, науч. сотр. отделения рентгеновских и радиоизотопных методов диагностики, ФГАУ «НМИЦ нейрохирургии им. акад. Н.Н. Бурденко». ORCID: 0000-0002-8924-7346
Artem I. Batalov – Cand. Sci. (Med.), Burdenko National Medical Research Center for Neurosurgery. ORCID: 0000-0002-8924-7346
Корниенко Валерий Николаевич – д-р мед. наук, проф., акад. РАН. ORCID: 0000-0002-5170-8039
Valeriy N. Kornienko – Dr. Sci. (Med.), Full Prof., Acad. RAS.
ORCID: 0000-0002-5170-8039
Поступила в редакцию: 02.06.2023
Поступила после рецензирования: 08.06.2023
Принята к публикации: 29.06.2023
Received: 02.06.2023
Revised: 08.06.2023
Accepted: 29.06.2023
Список исп. литературыСкрыть список1. Лихтерман Б.Л., Лихтерман Л.Б. Становление нейрохирургии как самостоятельной клинической дисциплины. В кн.: Нейрохирургия. Национальное руководство. Т. I. Диагностика и принципы лечения. Под ред. Д.Ю. Усачева. М., 2022. C. 31–46.
Lihterman B.L., Lihterman L.B. Formation of neurosurgery as an independent clinical discipline. In: Neurosurgery. National Guidelines. V. I. Diagnostics and principles of treatment. Ed. D.Yu. Usachev. Moscow, 2022. P. 31–46. (in Russian).
2. Likhterman L, Long D, Lichterman B. Clinical Philosophy of Neurosurgery. Modena, Italy, Athena, 2018. P. 229.
3. Лихтерман Л.Б. Высокие технологии и клиническое мышление в нейрохирургии и неврологии. Нейрохирургия. 2012; 12 (1): 9–17.
Lihterman L.B. High technology and clinical thinking in neurosurgery and neurology. Neurosurgery. 2012; 12 (1): 9–17 (in Russian).
4. WHO Classification of Tumours Editorial Board. Central nervous system tumours. Lyon (France): International Agency for Research on Cancer; 2021 [cited YYYY Mmm D]. (WHO classification of tumours series, 5th ed.; vol. 6). URL: https://tumorclassification.iarc.who.int/chapters/45
5. WHO Classification of Tumors of the Central Nervous System (Revised 4th edition). Eds David N. Louis, Hiroko Ohgaki, Otmar D. Wiestler, Webster K. Cavenee. IARC: Lyon, 2016.
6. Диникина Ю.В., Белогурова М.Б. Особенности новой классификации опухолей центральной нервной системы ВОЗ 2021: взгляд клинициста. Российский журнал персонализированной медицины. 2022; 2 (4): 77–90. DOI: 10.18705/2782-3806-2022-2-4-77-90
Dinikina Yu.V., Belogurova M.B. Major features of the 2021 WHO Classification of Tumors of the Central Nervous System: clinician’s view. Russian Journal for Personalized Medicine. 2022; 2 (4): 77–90. DOI: 10.18705/2782-3806-2022-2-4-77-90 (in Russian).
7. David N. Louis, Arie Perry, Pieter Wesseling et al. The 2021 WHO Classification of Tumours of the Central Nervous System: a summary. Neuro-Oncology 2021; XX (XX): 1–21. DOI: 10.1093/neuroonc/noaab106/
8. Баталов А.И., Захарова Н.Е., Погосбекян Э.Л. и др. Бесконтрастная ASL-перфузия в предоперационной диагностике супратенториальных глиом. Вопросы нейрохирургии. 2018; 82 (6): 15–22.
Batalov A.I., Zaharova N.E., Pogosbekyan E.L. et al. Contrast-free ASL perfusion in the preoperative diagnosis of supratentorial gliomas. Questions of neurosurgery. 2018; 82 (6): 15–22 (in Russian).
9. Тюрина А.Н., Пронин И.Н., Фадеева Л.М. и др. Протонная 3D МР-спектроскопия в диагностике глиальных опухолей головного мозга. Медицинская визуализация. 2019; 23 (3): 8–18.
Tyurina A.N., Pronin I.N., Fadeeva L.M. et al. Proton 3D MR spectroscopy in the diagnosis of glial brain tumors. Medical Visualization. 2019; 23 (3): 8–18 (in Russian).
10. Скворцова Т.Ю., Захс Д.В., Гурчин А.Ф. ПЭТ-КТ с 11С-метионином в диагностике глиальных опухолей головного мозга. Вестник РОНЦ им. Н.Н. Блохина РАМН. 2016; 27 (4): 61–9.
Skvorcova T.Yu., Zahs D.V., Gurchin A.F. PET-CT with 11C-methionine in the diagnosis of glial brain tumors. Bulletin of the N.N. Blokhin Russian Research Center of the RAMS. 2016; 27 (4): 61–9 (in Russian).
11. Sunwoo L, Yun TJ, You SH et al. Differentiation of Glioblastoma from Brain Metastasis: Qualitative and Quantitative Analysis Using Arterial Spin Labeling MR Imaging. PLoS One 2016; 11 (11): e0166662.
12. Пронин И.Н., Захарова Н.Е., Фадеева Л.М. и др. Импульсная последовательность SWI/SWAN в МРТ-диагностике микрокровоизлияний и сосудистых мальформаций. Онкологический журнал: лучевая диагностика, лучевая терапия. 2018; 1 (3): 49–59.
Pronin I.N., Zaharova N.E., Fadeeva L.M. et al. Pulse Sequence SWI/SWAN in Diagnosis of Microhemorrhage and Cerebral Vascular Micromalformations. Journal of oncology: diagnostic radiology and radiotherapy. 2018; 1 (3): 49–59 (in Russian).
13. Ellingson B, Bendszus M, Boxerman J et al. Consensus recommendations for a standardized Brain Tumor Imaging Protocol in clinical trials. Neuro Oncol 2015; 17 (9): 1188–98.
14. Jain R, Essig M (Eds). Brain tumor imaging. Thieme Medical Publishers 2016.
15. Kornienko V, Pronin I. Diagnostic Neuroradiology. Berlin-Heidelberg: Springer-Verlag, 2009.
16. Jung J, Ahn B. C. Current Radiopharmaceuticals for Positron Emission Tomography of Brain Tumors. Brain Tumor Res Treat 2018;
6 (2): 47–53.
17. Osborn A (ed). Osborn’s brain: Imaging, Pathology, and Anatomy, 2d edition. 2017.
18. Трофимова Т.Н., Скворцова Т.Ю., Савинцева Ж.И., Журавлева М.А. Радиология церебральных глиом: диагностика и мониторинг. СПб.: Фолиант, 2020.
Trofimova T.N., Skvorcova T.YU., Savinceva ZH.I., ZHuravleva M.A. Radiology of cerebral gliomas: diagnosis and monitoring. 2020 (in Russian).
19. Zakharova NE, Batalov AI, Pogosbekian et al. Perifocal Zone of Brain Gliomas: Application of Diffusion Kurtosis and Perfusion MRI Values for Tumor Invasion Border Determination. Cancers 2023; 15: 2760.
31 июля 2023
Количество просмотров: 2127


