Клинический разбор в общей медицине №5 2023
1 Burdenko National Medical Research Centre for Neurosurgery, Moscow, Russia;
2 Center “Gamma-Knife”, Moscow, Russia;
3 Russian Medical Academy of Continuous Professional Education, Moscow, Russia
smbanov@gmail.com
Abstract
The improvement of neuroimaging methods and introduction of the principles of microsurgery and radiosurgery involving the use of the Gamma Knife and CyberKnife systems into clinical practice have significantly changed the treatment outcomes in patients with metastatic brain tumors, thereby allowing to formulate new principles of treating this group of patients. The reported literature review summarizes the available treatment methods for patients with metastatic brain tumors with a focus on overall survival, local control, quality of life, and the capabilities of potential combinations of the existing treatment methods. The paper shows that personalized approaches to treatment of patients with brain metastases are optimal and improve the treatment outcomes.
Key words: brain metastases, radiosurgery, microsurgery, whole brain radiotherapy.
For citation: Golanov A.V., Banov S.M., Vetlova E.R., Vartanyan K.F., Zhmaeva E.N. Metastatic brain tumor. Clinical features, diagnosis and treatment. Clinical review for general practice. 2023; 4 (5): 37–44 (In Russ.). DOI: 10.47407/kr2023.4.5.00233
Частота МГМ, вероятно, увеличивается в результате совершенствования методов нейровизуализации и улучшения системных методов лечения онкологических заболеваний. Большинство пациентов, у которых развиваются МГМ, имеют ограниченную продолжительность жизни, так как их появление является признаком диссеминации онкологической болезни. Однако у пациентов с олигометастатическим (1–4 очага) характером болезни или с благоприятным прогнозом можно ожидать увеличение показателей общей выживаемости (ОВ) при использовании локальных и системных методов лечения [1].
Ежегодные показатели частоты МГМ при метастатической форме онкологической болезни соответственно составляют: 26,8% при раке легкого; 28,2% при меланоме; 11,5% при раке молочной железы; 10,9% при раке почки и 5,3% при раке пищевода. При раке легкого частота МГМ зависит от молекулярно-генетических характеристик опухоли и составляет при наличии: EGFR мутации – 15–20%; KRAS G12C мутации – 10–12%; ALK транслокации – 4–5%. С учетом накопленной выживаемости у 40% с меланомой и у 30% пациенток с генерализованной формой рака молочной железы в течение курса болезни развиваются метастазы в головном мозге [2].
Магнитно-резонансную томографию (МРТ) головного мозга с внутривенным контрастированием в рамках скрининга с целью выявления возможного наличия МГМ рекомендуется проводить у пациентов с мелкоклеточным раком легких (на всех стадиях заболевания), немелкоклеточным раком легких (начиная со II стадии), меланомой (начиная с IIIC стадии), метастатическим раком молочной железы (HER2-положительный и трижды негативный подтип) [2].
В остальных случаях МРТ головного мозга с внутривенным контрастированием рекомендуется проводить у онкологических пациентов при появлении неврологической симптоматики. Такой подход приведет к более высокой частоте обнаружения бессимптомных метастазов в головной мозг.
Очаговые симптомы и рентгенологические признаки зависят от локализации МГМ. Кровоизлияния, как правило, присутствуют у пациентов с МГМ меланомы или рака почки. Обструктивная гидроцефалия, особенно при МГМ мозжечка, может вызвать быстрое неврологическое ухудшение.
В настоящее время оптимальной шкалой прогноза ОВ пациентов с МГМ является диагноз-адаптированная шкала GPA c учетом клинических и биологических факторов прогноза в крупных когортах пациентов с МГМ [3].
Медиана ОВ пациентов сильно различается в зависимости от суммы баллов по шкале прогноза GPA для пациентов с МГМ немелкоклеточного рака легких (от 7 до 47 мес), рака молочной железы (от 3 до 36 мес), меланомы (от 5 до 34 мес), злокачественных опухолей желудочно-кишечного тракта (от 3 до 17 мес) и рака почки (от 4 до 35 мес).
Обновленная шкала прогноза GPA (доступна на сайте brainmetgpa.com) предоставляет точный инструмент прогноза для ОВ, персонализации лечения и стратификации пациентов в клинические исследования.
МРТ головного мозга рекомендуется выполнять в следующих режимах: до внутривенного введения контрастного вещества в режимах Т1 в аксиальной проекции (толщина среза 1–1,5 мм), Т2, ДВИ, FLAIR (толщина среза 3–5 мм). После внутривенного введения контрастного вещества: Т1 в аксиальной проекции (толщина среза 1–1,5 мм), 3D T1 взвешенные изображения высокого разрешения в аксиальной (или сагиттальной) плоскости с захватом всей головы с применением технологии изотропного воксела (1×1×1 мм).
Характерные МРТ-признаки включают солидное или кольцевое накопление контраста, перифокальный отек и склонность к локализации в переходе серо-белого вещества мозга. Чувствительность МРТ для обнаружения МГМ зависит от дозы контрастного вещества и временем его введения и сканированием [6].
При использовании двойной дозы контрастного вещества чувствительность изображения повышается. Между введением контрастного вещества и получением изображения должна быть задержка, обычно достигаемая путем выполнения дополнительных последовательностей между введением контрастного вещества и постконтрастным Т1-взвешенным изображением [7].
Компьютерная томография головного мозга менее чувствительна, чем МРТ, и должна применяться только у пациентов с противопоказаниями к МРТ. Позитронно-эмиссионная томография с использованием меченных радиоактивным изотопом аминокислот имеет дополнительную диагностическую ценность в дифференциальной диагностике локального рецидива и постлучевых изменений [2].
Оптимальной методикой лечения у пациентов с МГМ является комбинация методов локального лечения. Варианты комбинации локальных методов лечения определяются числом, объемом и локализацией МГМ. План лечения пациентов с МГМ определяется на основе решений мультидисциплинарного консилиума, который проводится в соответствии с приказом Министерства здравоохранения Российской Федерации от 19.02.2021 № 116н «Об утверждении Порядка оказания медицинской помощи взрослому населению при онкологических заболеваниях».
Терапевтическая ценность нейрохирургической резекции одиночных МГМ у пациентов с контролируемым системным заболеванием остается бесспорной: тотальное удаление обеспечивает хороший локальный контроль в ложе удаленного очага [12, 13].
Удаление метастатического очага единым блоком (en-block резекция) обеспечивает снижение рисков локального рецидива и лептоменингеальной прогрессии в сравнении с фрагментарным удалением [14].
Возможность выполнения тотального удаления МГМ с низкой частотой послеоперационных осложнений достигается с помощью применения предоперационной функциональной МРТ, интраоперационной нейронавигации и нейрофизиологических методик [15].
У пациентов с множественными МГМ возможно проведение нейрохирургического лечения, если оставшееся экстра- и интракраниальные метастатические очаги контролируются с помощью других лечебных мероприятий. Кроме того, существуют определенные клинические ситуации, при которых нейрохирургическое лечение следует рассматривать из-за его немедленного терапевтического эффекта у пациентов с множественными МГМ, когда метастатические очаги вызывают повышение внутричерепного давления или неврологические нарушения (рис. 1).
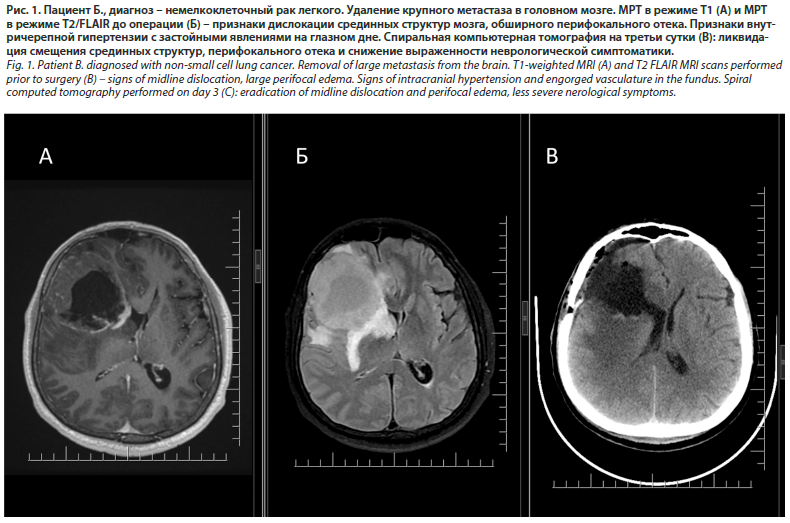
Локализация МГМ в задней черепной ямке часто является показанием к хирургическому вмешательству из-за риска обструктивной гидроцефалии.
Метастатический очаг в головном мозге в ряде случаев может быть единственным проявлением болезни. В этом случае удаление очага с последующим патоморфологическим исследованием и уточнением молекулярно-биологических характеристик опухоли позволяет установить диагноз и начать проведение системной противоопухолевой терапии.
В соответствие с рекомендациями ASCO [16], проведение нейрохирургического лечения у пациентов с МГМ следует рассматривать при наличии:
• крупного метастатического очага в головном мозге;
• метастатического очага любого размера, определяющего клиническую картину внутричерепной гипертензии, дислокации срединных структур мозга, обширного перифокального отека, а также при наличии окклюзии ликворных путей;
• очага, подозрительного на метастатический при отсутствии установленного первичного опухолевого очага или когда есть сомнения в метастатическом характере поражения головного мозга. В этой клинической ситуации нейрохирургическая операция является единственным методом морфологической верификации диагноза;
• клинических ситуаций, контроль которых невозможен с помощью других лечебных мероприятий (например, симптоматический локальный рецидив или радионекроз после СРТ, резистентный к проводимой терапии).
Все показания к хирургическим вмешательствам при МГМ, за исключением неотложных ситуаций, должны оцениваться в междисциплинарном онкологическом консилиуме.
с помощью специализированного оборудования, генерирующего направленный пучок фотонного (гамма или тормозного излучения) или корпускулярного (протонного) ионизирующего излучения.
Проведение радиотерапии рекомендуется у пациентов с симптоматическими МГМ независимо от объема проводимой системной противоопухолевой терапии. Радиотерапия противопоказана:
• у пациентов с бессимптомными МГМ с низким функциональным статусом (индекс Карновского 50 и меньше) или с низким функциональным статусом (индекс Карновского 70 и меньше) и отсутствием резервов системной противоопухолевой терапии;
• у пациентов с наличием клинических симптомов внутричерепной гипертензии, неконтролируемым судорожным состоянием, психическими и мнестическими нарушениями, сопутствующими заболеваниями в стадии декомпенсации.
СРТ в режиме радиохирургии обеспечивает доставку ионизирующего излучения к метастатическому очагу в диапазоне доз от 18 до 24 Гр. СРТ в режиме гипофракционирования обычно проводится за 3 фракции до суммарной дозы 24/27 Гр или за 5 фракций до суммарной дозы 30 Гр и является режимом выбора у пациентов с крупными МГМ (>2 см в максимальном измерении), локализованными в функциональных зонах мозга, или у ранее облученных пациентов.
В настоящее время проведение СРТ в режиме радиохирургии рекомендуется у пациентов с наличием до 10 первично выявленных МГМ, до 2 см в максимальном измерении и хорошим прогнозом ОВ. Выбор режима фракционирования СРТ (радиохирургия или гипофракционирование) определяется суммарным объемом очагов, дозовой нагрузкой на окружающие ткани и числом МГМ. СРТ в режиме радиохирургии проводится в отношении МГМ, для которых объем (объем облучаемого очага и перифокальной части нормальной ткани мозга) облученной дозой 12 Гр не превышает 10 см3 (V12Гр ≤10 см3). Любые метастатические очаги, для которых V12Гр >10 см3, с целью снижения риска развития радионекроза, рассматриваются для проведения СРТ в режиме гипофракционирования [17].
СРТ в режиме гипофракционирования является оптимальной опцией у пациентов при наличии МГМ, локализованных в критических структурах мозга (зрительные тракты, ствол головного мозга и пр.). Рекомендуемыми режимами гипофракционирования являются 3 фракции по 8/9 Гр, 5 фракций по 6 Гр и 7 фракций по 5 Гр. При проведении гипофракционирования необходимо учитывать, что объем 10 см3 (объем облучаемого очага и перифокальной части нормальной ткани мозга) не должен быть облучен дозой выше: 19,2 Гр (за 3 фракции); 23,4 Гр (за 5 фракций); 26,5 Гр (за 7 фракций) [17].
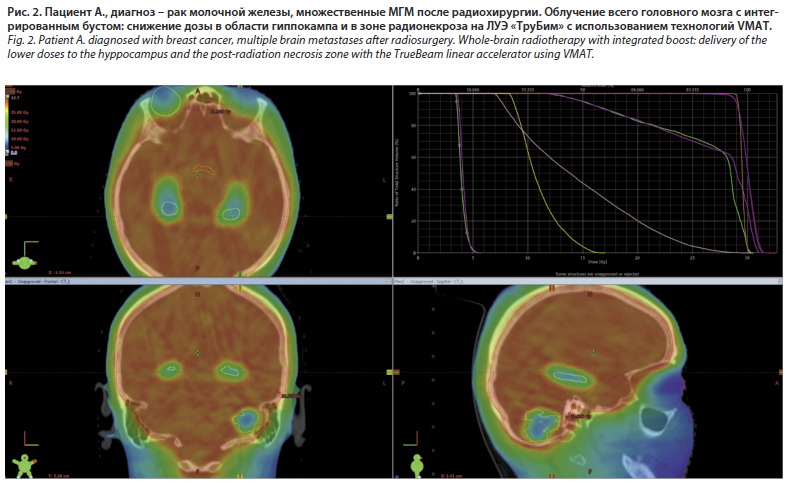
Для уменьшения риска развития когнитивных нарушений при проведении ОВГМ возможно назначение мемантина, начиная с 1-го дня проведения ОВГМ, и снижение дозы ионизирующего излучения в области гиппокампальных извилин с обеих сторон (рис. 2) [18, 19].
Показатели локального контроля крупных МГМ после нейрохирургической резекции или проведения СРТ в режиме радиохирургии находятся в диапазоне от 40% до 60% [20]. С учетом высокого риска развития локального рецидива после нейрохирургической резекции применение радиотерапии является обязательным компонентом комбинированного лечения [21].
Исторически ОВГМ обычно применялась после нейрохирургической резекции. Однако, несмотря на то, что ОВГМ эффективно обеспечивает локальный контроль метастатических очагов, лечение МГМ эволюционировало в пользу применения СРТ для исключения риска когнитивных расстройств, связанных с ОВГМ. По сравнению с ОВГМ послеоперационная СРТ в режиме радиохирургии обеспечивает увеличение ОВ без ухудшения когнитивной функции у пациентов с единичным метастазом в головной мозг и улучшает локальный контроль у пациентов с множественными МГМ [22].
Отказ от применения ОВГМ после нейрохирургической резекции МГМ привел к увеличению частоты поражения лептоменингеальных оболочек вследствие интраоперационного попадания клеток опухоли в ликвор. Дополнительными факторами риска развития лептоменингеального поражения в послеоперационном периоде являются наличие метастазов рака молочной железы в головном мозге, фрагментарной резекции очага, частичного его удаления, локализации очага в задней черепной ямке, множественных МГМ, геморрагических осложнений и кистозных метастазов [23, 24].
С целью снижения риска лептоменингеального поражения разработана методика предоперационной радиохирургии, которая заключается в проведении радиохирургии МГМ с последующим его удалением в течение ближайших 24–48 ч (рис. 3).
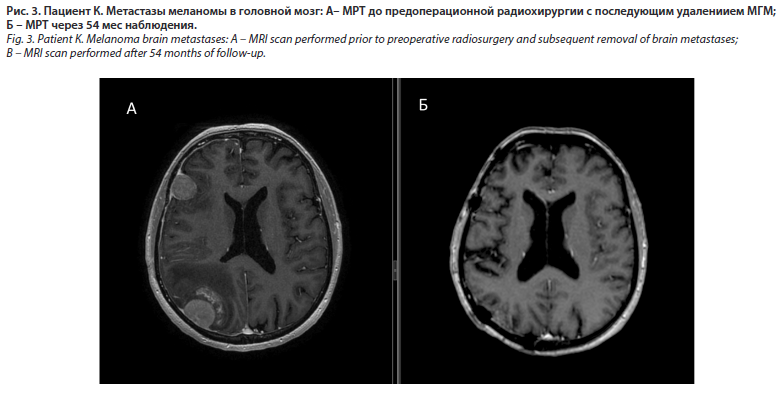
В клинических исследованиях показано снижение частоты лептоменингеальной прогрессии в группе пациентов с предоперационной радиохирургией в сравнении с проведением послеоперационной СРX (3,2% и 16,2% соответственно), частоты радионекроза (4,9% и 16,4% соответственно) и эквивалентные показатели частоты лептоменингеального поражения в сравнении с проведением послеоперационного ОВГМ [25].
Анализ результатов исследования предоперационной радиохирургии крупных МГМ, проведенного в НМИЦ нейрохирургии им. акад. Н.Н. Бурденко (53 пациентов со 110 крупными МГМ) на сроке 12 мес показал низкую частоту локальных рецидивов (10,7%), радионекрозов (4,3%) и высокие показатели ОВ (62,5%). Лептоменингеальное поражение зарегистрировано у 1 пациента [26].
Сравнительные результаты предоперационной радиохирургии и послеоперационной СРТ в настоящее время ограничены и требуют уточнения в дальнейших проспективных клинических исследованиях.
У пациентов с бессимптомными МГМ в случае решения вопроса об отсрочке локального лечения необходимо учитывать характер и локализацию очагов в головном мозге. Некоторым пациентам с бессимптомными метастазами, локализованными в функциональных зонах мозга, желательно проведение локального лечения с целью снижения возможного риска развития неврологического дефицита вследствие роста метастатического очага.
В соответствии с клиническими рекомендациями ASCO [16] и ESMO-EANO [27] локальную терапию можно отложить до последующей интракраниальной прогрессии у пациентов с первично выявленными бессимптомными МГМ:
• немелкоклеточного рака легких с наличием мутации/транслокации EGFR/ALK/ROS1. Следует проводить таргетную терапию в 1-й линии лечения (осимертиниб, алектиниб, бригатиниб);
• немелкоклеточного рака легких без мутации/транслокации EGFR/ALK/ROS1. Следует проводить монотерапию ингибиторами иммунных контрольных точек, если PD-L1>50% или системную химиотерапию в сочетании с ингибиторами иммунных контрольных точек, если PD-L1<50%;
• меланомы независимо от BRAF статуса опухоли. Следует проводить терапию ипилимумабом и ниволумабом.
МРТ головного мозга следует проводить каждые
2–3 мес или при любом подозрении на интракраниальную прогрессию. МРТ является стандартным методом оценки ответа и последующего наблюдения у пациентов с МГМ.
Однако обычная МРТ не всегда может надежно различить особенности, связанные с лечением (псевдопрогрессии, радионекроз и прогрессирование опухоли).
В этой клинической ситуации позитронно-эмиссионная томография головного мозга с использованием радиоактивных индикаторов, меченных 18F тирозином и 11C метионином, рекомендована для дифференциальной диагностики рецидива опухоли от радионекроза. Проведение СКТ перфузии головного мозга позволяет измерить объем церебрального кровотока опухоли и нормальной ткани мозга и применяется для дифференциальной диагностики рецидива опухоли и радионекроза.
Выполнение нейрохирургической резекции показано у пациентов с наличием крупных МГМ или очагов с выраженным отеком и масс-эффектом. Лучшие показатели ОВ достигаются у пациентов со стабилизацией экстракраниальных метастазов и наличием эффективных опций системной противоопухолевой терапии.
СРТ применяется у пациентов с небольшими по размеру МГМ или при наличии крупных очагов и противопоказаний к проведению нейрохирургии. ОВГМ по-прежнему является стандартным методом лечения пациентов с МГМ и неблагоприятным прогнозом ОВ или при наличии лептоменингеальной прогрессии.
Определение оптимальных комбинаций лечебных опций для пациентов с МГМ требует дальнейшей оценки. Новые технологические разработки в нейрохирургии и радиотерапии могут улучшить результаты лечения пациентов с метастатическим поражением головного мозга.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Голанов Андрей Владимирович – чл.-корр. РАН, д-р мед наук, проф., врач-радиотерапевт, отд-ние радиохирургии и радиотерапии, ФГАУ «НМИЦ нейрохирургии им. акад. Н.Н. Бурденко»
Andrey V. Golanov – Corr. Memb. RAS, Dr. Sci. (Med.), Prof., Burdenko National Medical Research Center for Neurosurgery
Банов Сергей Михайлович – д-р мед наук, науч. сотр., врач-радиотерапевт, отд-ние радиохирургии и радиотерапии
ФГАУ «НМИЦ нейрохирургии им. акад. Н.Н. Бурденко»; Центр «Гамма-нож». E-mail: smbanov@gmail.com
Sergey M. Banov – Dr. Sci. (Med.), Burdenko National Medical Research Center for Neurosurgery, Center “Gamma-Knife”.
E-mail: smbanov@gmail.com
Ветлова Елена Рэмовна – канд. мед. наук, ст. науч. сотр., врач-радиотерапевт, отд-ние радиохирургии и радиотерапии ФГАУ «НМИЦ нейрохирургии им. акад. Н.Н. Бурденко»
Elena R. Vetlova – Cand. Sci. (Med.), Burdenko National Medical Research Center for Neurosurgery
Вартанян Карэн Феликсович – д-р мед наук, проф., врач-радиолог, каф. радиологии, ФГБОУ ДПО РМАНПО
Karen F. Vartanyan – Dr. Sci. (Med.), Prof., Russian Medical Academy of Continuous Professional Education
Жмаева Елена Михайловна – д-р мед наук, доц., врач-радиолог, каф. радиологии, ФГБОУ ДПО РМАНПО
Elena M. Zhmaeva – Dr. Sci. (Med.), Russian Medical Academy of Continuous Professional Education
Поступила в редакцию: 25.05.2023
Поступила после рецензирования: 31.05.2023
Принята к публикации: 15.06.2023
Received: 25.05.2023
Revised: 31.05.2023
Accepted: 15.06.2023
Клинический разбор в общей медицине №5 2023
Метастатическое поражение головного мозга: клиника, диагностика и лечение
Номера страниц в выпуске:37-44
Аннотация
Совершенствование методик нейровизуализации, внедрение в клиническую практику принципов микрохирургии и радиохирургии с использованием аппаратов «Гамма-нож», «Кибер-нож» существенно изменило результаты лечения пациентов с метастатическим поражением головного мозга, что позволило сформулировать новые принципы лечения этой группы пациентов. Представленный литературный обзор подводит итог имеющихся методов лечения пациентов с метастатическим поражением головного мозга с акцентом на общую выживаемость, локальный контроль, качество жизни, а также на возможности потенциальных комбинаций существующих методов лечения. В статье показано, что персонализированные подходы в лечении пациентов с метастазами в головной мозг являются оптимальными и улучшают результаты лечения.
Ключевые слова: метастазы в головной мозг, радиохирургия, микрохирургия, облучение всего головного мозга.
Для цитирования: Голанов А.В., Банов С.М., Ветлова Е.Р., Вартанян К.Ф., Жмаева Е.Н. Метастатическое поражение головного мозга: клиника, диагностика и лечение. Клинический разбор в общей медицине. 2023; 4 (5): 37–44. DOI: 10.47407/kr2023.4.5.00233
Совершенствование методик нейровизуализации, внедрение в клиническую практику принципов микрохирургии и радиохирургии с использованием аппаратов «Гамма-нож», «Кибер-нож» существенно изменило результаты лечения пациентов с метастатическим поражением головного мозга, что позволило сформулировать новые принципы лечения этой группы пациентов. Представленный литературный обзор подводит итог имеющихся методов лечения пациентов с метастатическим поражением головного мозга с акцентом на общую выживаемость, локальный контроль, качество жизни, а также на возможности потенциальных комбинаций существующих методов лечения. В статье показано, что персонализированные подходы в лечении пациентов с метастазами в головной мозг являются оптимальными и улучшают результаты лечения.
Ключевые слова: метастазы в головной мозг, радиохирургия, микрохирургия, облучение всего головного мозга.
Для цитирования: Голанов А.В., Банов С.М., Ветлова Е.Р., Вартанян К.Ф., Жмаева Е.Н. Метастатическое поражение головного мозга: клиника, диагностика и лечение. Клинический разбор в общей медицине. 2023; 4 (5): 37–44. DOI: 10.47407/kr2023.4.5.00233
Metastatic brain tumor. Clinical features, diagnosis and treatment
Andrey V. Golanov1, Sergey M. Banov1,2, Elena R. Vetlova1, Karen F. Vartanyan3, Elena M. Zhmaeva31 Burdenko National Medical Research Centre for Neurosurgery, Moscow, Russia;
2 Center “Gamma-Knife”, Moscow, Russia;
3 Russian Medical Academy of Continuous Professional Education, Moscow, Russia
smbanov@gmail.com
Abstract
The improvement of neuroimaging methods and introduction of the principles of microsurgery and radiosurgery involving the use of the Gamma Knife and CyberKnife systems into clinical practice have significantly changed the treatment outcomes in patients with metastatic brain tumors, thereby allowing to formulate new principles of treating this group of patients. The reported literature review summarizes the available treatment methods for patients with metastatic brain tumors with a focus on overall survival, local control, quality of life, and the capabilities of potential combinations of the existing treatment methods. The paper shows that personalized approaches to treatment of patients with brain metastases are optimal and improve the treatment outcomes.
Key words: brain metastases, radiosurgery, microsurgery, whole brain radiotherapy.
For citation: Golanov A.V., Banov S.M., Vetlova E.R., Vartanyan K.F., Zhmaeva E.N. Metastatic brain tumor. Clinical features, diagnosis and treatment. Clinical review for general practice. 2023; 4 (5): 37–44 (In Russ.). DOI: 10.47407/kr2023.4.5.00233
Введение
Метастатическое поражение головного мозга (МГМ) – это гетерогенная группа интракраниальных новообразований, объединяющих различные по происхождению, гистологической структуре, клиническому течению и результатам лечения новообразования, являющихся следствием гематогенного метастазирования экстракраниальных злокачественных опухолей.Частота МГМ, вероятно, увеличивается в результате совершенствования методов нейровизуализации и улучшения системных методов лечения онкологических заболеваний. Большинство пациентов, у которых развиваются МГМ, имеют ограниченную продолжительность жизни, так как их появление является признаком диссеминации онкологической болезни. Однако у пациентов с олигометастатическим (1–4 очага) характером болезни или с благоприятным прогнозом можно ожидать увеличение показателей общей выживаемости (ОВ) при использовании локальных и системных методов лечения [1].
Эпидемиология и скрининг
По имеющимся оценкам ежегодный диапазон впервые выявленного МГМ составляет от 10 до 17% всех онкологических пациентов [2].Ежегодные показатели частоты МГМ при метастатической форме онкологической болезни соответственно составляют: 26,8% при раке легкого; 28,2% при меланоме; 11,5% при раке молочной железы; 10,9% при раке почки и 5,3% при раке пищевода. При раке легкого частота МГМ зависит от молекулярно-генетических характеристик опухоли и составляет при наличии: EGFR мутации – 15–20%; KRAS G12C мутации – 10–12%; ALK транслокации – 4–5%. С учетом накопленной выживаемости у 40% с меланомой и у 30% пациенток с генерализованной формой рака молочной железы в течение курса болезни развиваются метастазы в головном мозге [2].
Магнитно-резонансную томографию (МРТ) головного мозга с внутривенным контрастированием в рамках скрининга с целью выявления возможного наличия МГМ рекомендуется проводить у пациентов с мелкоклеточным раком легких (на всех стадиях заболевания), немелкоклеточным раком легких (начиная со II стадии), меланомой (начиная с IIIC стадии), метастатическим раком молочной железы (HER2-положительный и трижды негативный подтип) [2].
В остальных случаях МРТ головного мозга с внутривенным контрастированием рекомендуется проводить у онкологических пациентов при появлении неврологической симптоматики. Такой подход приведет к более высокой частоте обнаружения бессимптомных метастазов в головной мозг.
Клиническая симптоматика
Клинический анамнез у пациентов с МГМ обычно короткий, с развитием неврологических симптомов и признаков в течение нескольких недель. МГМ могут вызывать головные боли, эпилептические припадки, двигательные расстройства и нарушение чувствительности, изменения личности, афазию, нарушения зрения или признаки повышенного внутричерепного давления.Очаговые симптомы и рентгенологические признаки зависят от локализации МГМ. Кровоизлияния, как правило, присутствуют у пациентов с МГМ меланомы или рака почки. Обструктивная гидроцефалия, особенно при МГМ мозжечка, может вызвать быстрое неврологическое ухудшение.
Прогноз общей выживаемости
Пациенты с МГМ являются гетерогенной группой с различными клинико-биологическими характеристиками опухоли и широким разбросом показателей выживаемости. Поэтому важно учитывать различные клинические факторы, влияющие на прогноз ОВ пациентов с МГМ до принятия лечебных решений.В настоящее время оптимальной шкалой прогноза ОВ пациентов с МГМ является диагноз-адаптированная шкала GPA c учетом клинических и биологических факторов прогноза в крупных когортах пациентов с МГМ [3].
Медиана ОВ пациентов сильно различается в зависимости от суммы баллов по шкале прогноза GPA для пациентов с МГМ немелкоклеточного рака легких (от 7 до 47 мес), рака молочной железы (от 3 до 36 мес), меланомы (от 5 до 34 мес), злокачественных опухолей желудочно-кишечного тракта (от 3 до 17 мес) и рака почки (от 4 до 35 мес).
Обновленная шкала прогноза GPA (доступна на сайте brainmetgpa.com) предоставляет точный инструмент прогноза для ОВ, персонализации лечения и стратификации пациентов в клинические исследования.
Нейровизуализация
МРТ головного мозга с введением контрастного вещества и напряженностью поля не менее 1,5 Тл является золотым стандартом для нейрорадиологического обследования пациентов с подозрением на МГМ [4, 5].МРТ головного мозга рекомендуется выполнять в следующих режимах: до внутривенного введения контрастного вещества в режимах Т1 в аксиальной проекции (толщина среза 1–1,5 мм), Т2, ДВИ, FLAIR (толщина среза 3–5 мм). После внутривенного введения контрастного вещества: Т1 в аксиальной проекции (толщина среза 1–1,5 мм), 3D T1 взвешенные изображения высокого разрешения в аксиальной (или сагиттальной) плоскости с захватом всей головы с применением технологии изотропного воксела (1×1×1 мм).
Характерные МРТ-признаки включают солидное или кольцевое накопление контраста, перифокальный отек и склонность к локализации в переходе серо-белого вещества мозга. Чувствительность МРТ для обнаружения МГМ зависит от дозы контрастного вещества и временем его введения и сканированием [6].
При использовании двойной дозы контрастного вещества чувствительность изображения повышается. Между введением контрастного вещества и получением изображения должна быть задержка, обычно достигаемая путем выполнения дополнительных последовательностей между введением контрастного вещества и постконтрастным Т1-взвешенным изображением [7].
Компьютерная томография головного мозга менее чувствительна, чем МРТ, и должна применяться только у пациентов с противопоказаниями к МРТ. Позитронно-эмиссионная томография с использованием меченных радиоактивным изотопом аминокислот имеет дополнительную диагностическую ценность в дифференциальной диагностике локального рецидива и постлучевых изменений [2].
Лечение пациентов с метастатическим поражением головного мозга
У пациентов с МГМ применяются локальные и системные методы лечения. К локальным методам лечения относятся: нейрохирургия и дистанционная радиотерапия, которая может быть реализована в виде стереотаксической радиотерапии (СРТ) и облучения всего головного мозга (ОВГМ) [9].Оптимальной методикой лечения у пациентов с МГМ является комбинация методов локального лечения. Варианты комбинации локальных методов лечения определяются числом, объемом и локализацией МГМ. План лечения пациентов с МГМ определяется на основе решений мультидисциплинарного консилиума, который проводится в соответствии с приказом Министерства здравоохранения Российской Федерации от 19.02.2021 № 116н «Об утверждении Порядка оказания медицинской помощи взрослому населению при онкологических заболеваниях».
Нейрохирургия
Цель нейрохирургии (микрохирургического удаления новообразований головного мозга) – обеспечение локального контроля метастатических очагов, уменьшение выраженности неврологической симптоматики, ликвидация угрожающих жизни состояний, уменьшение риска летального исхода от интракраниальной прогрессии, сохранение качества жизни и улучшение показателей ОВ в отдельных клинических ситуациях. Необходимым условием проведения нейрохирургического лечения является расположение метастатического очага в зонах мозга, где его удаление не сопровождается развитием неврологического дефицита [10, 11].Терапевтическая ценность нейрохирургической резекции одиночных МГМ у пациентов с контролируемым системным заболеванием остается бесспорной: тотальное удаление обеспечивает хороший локальный контроль в ложе удаленного очага [12, 13].
Удаление метастатического очага единым блоком (en-block резекция) обеспечивает снижение рисков локального рецидива и лептоменингеальной прогрессии в сравнении с фрагментарным удалением [14].
Возможность выполнения тотального удаления МГМ с низкой частотой послеоперационных осложнений достигается с помощью применения предоперационной функциональной МРТ, интраоперационной нейронавигации и нейрофизиологических методик [15].
У пациентов с множественными МГМ возможно проведение нейрохирургического лечения, если оставшееся экстра- и интракраниальные метастатические очаги контролируются с помощью других лечебных мероприятий. Кроме того, существуют определенные клинические ситуации, при которых нейрохирургическое лечение следует рассматривать из-за его немедленного терапевтического эффекта у пациентов с множественными МГМ, когда метастатические очаги вызывают повышение внутричерепного давления или неврологические нарушения (рис. 1).

Локализация МГМ в задней черепной ямке часто является показанием к хирургическому вмешательству из-за риска обструктивной гидроцефалии.
Метастатический очаг в головном мозге в ряде случаев может быть единственным проявлением болезни. В этом случае удаление очага с последующим патоморфологическим исследованием и уточнением молекулярно-биологических характеристик опухоли позволяет установить диагноз и начать проведение системной противоопухолевой терапии.
В соответствие с рекомендациями ASCO [16], проведение нейрохирургического лечения у пациентов с МГМ следует рассматривать при наличии:
• крупного метастатического очага в головном мозге;
• метастатического очага любого размера, определяющего клиническую картину внутричерепной гипертензии, дислокации срединных структур мозга, обширного перифокального отека, а также при наличии окклюзии ликворных путей;
• очага, подозрительного на метастатический при отсутствии установленного первичного опухолевого очага или когда есть сомнения в метастатическом характере поражения головного мозга. В этой клинической ситуации нейрохирургическая операция является единственным методом морфологической верификации диагноза;
• клинических ситуаций, контроль которых невозможен с помощью других лечебных мероприятий (например, симптоматический локальный рецидив или радионекроз после СРТ, резистентный к проводимой терапии).
Все показания к хирургическим вмешательствам при МГМ, за исключением неотложных ситуаций, должны оцениваться в междисциплинарном онкологическом консилиуме.
Радиотерапия
Цель радиотерапии заключается в обеспечении локального контроля метастатических очагов для снижения риска летального исхода от интракраниальной прогрессии, сохранения качества жизни и улучшение показателей ОВ. Радиотерапия при метастатическом поражении центральной нервной системы реализуетсяс помощью специализированного оборудования, генерирующего направленный пучок фотонного (гамма или тормозного излучения) или корпускулярного (протонного) ионизирующего излучения.
Проведение радиотерапии рекомендуется у пациентов с симптоматическими МГМ независимо от объема проводимой системной противоопухолевой терапии. Радиотерапия противопоказана:
• у пациентов с бессимптомными МГМ с низким функциональным статусом (индекс Карновского 50 и меньше) или с низким функциональным статусом (индекс Карновского 70 и меньше) и отсутствием резервов системной противоопухолевой терапии;
• у пациентов с наличием клинических симптомов внутричерепной гипертензии, неконтролируемым судорожным состоянием, психическими и мнестическими нарушениями, сопутствующими заболеваниями в стадии декомпенсации.
Стереотаксическая радиотерапия
СРТ – вариант дистанционной лучевой терапии с использованием методов стереотаксической навигации и соответствующего технического оборудования, обеспечивающих прецизионную доставку максимально возможной дозы ионизирующего излучения к четко отграниченной мишени за минимальное число фракций, при этом величина дозы радиации ограничивается риском развития постлучевых осложнений со стороны здоровых тканей. СРТ может быть реализована в режиме радиохирургии (за 1 фракцию) или гипофракционирования (от 3 до 7 фракций).СРТ в режиме радиохирургии обеспечивает доставку ионизирующего излучения к метастатическому очагу в диапазоне доз от 18 до 24 Гр. СРТ в режиме гипофракционирования обычно проводится за 3 фракции до суммарной дозы 24/27 Гр или за 5 фракций до суммарной дозы 30 Гр и является режимом выбора у пациентов с крупными МГМ (>2 см в максимальном измерении), локализованными в функциональных зонах мозга, или у ранее облученных пациентов.
В настоящее время проведение СРТ в режиме радиохирургии рекомендуется у пациентов с наличием до 10 первично выявленных МГМ, до 2 см в максимальном измерении и хорошим прогнозом ОВ. Выбор режима фракционирования СРТ (радиохирургия или гипофракционирование) определяется суммарным объемом очагов, дозовой нагрузкой на окружающие ткани и числом МГМ. СРТ в режиме радиохирургии проводится в отношении МГМ, для которых объем (объем облучаемого очага и перифокальной части нормальной ткани мозга) облученной дозой 12 Гр не превышает 10 см3 (V12Гр ≤10 см3). Любые метастатические очаги, для которых V12Гр >10 см3, с целью снижения риска развития радионекроза, рассматриваются для проведения СРТ в режиме гипофракционирования [17].
СРТ в режиме гипофракционирования является оптимальной опцией у пациентов при наличии МГМ, локализованных в критических структурах мозга (зрительные тракты, ствол головного мозга и пр.). Рекомендуемыми режимами гипофракционирования являются 3 фракции по 8/9 Гр, 5 фракций по 6 Гр и 7 фракций по 5 Гр. При проведении гипофракционирования необходимо учитывать, что объем 10 см3 (объем облучаемого очага и перифокальной части нормальной ткани мозга) не должен быть облучен дозой выше: 19,2 Гр (за 3 фракции); 23,4 Гр (за 5 фракций); 26,5 Гр (за 7 фракций) [17].
Облучение всего головного мозга
ОВГМ применяется у пациентов с наличием МГМ, не подходящих для проведения локального лечения (нейрохирургия и/или СРТ). Стандартным режимом фракционирования ОВГМ является суммарная очаговая доза (СОД) 30 Гр, разовая очаговая доза (РОД) 3 Гр (10 фракций) или СОД 37,5 Гр, РОД 2,5 Гр (15 фракций). Увеличение РОД при ОВГМ более 3 Гр приводит к увеличению частоты нейрокогнитивных расстройств и не улучшает результаты лечения [17].Для уменьшения риска развития когнитивных нарушений при проведении ОВГМ возможно назначение мемантина, начиная с 1-го дня проведения ОВГМ, и снижение дозы ионизирующего излучения в области гиппокампальных извилин с обеих сторон (рис. 2) [18, 19].

Комбинированное лечение крупных метастатических поражений головного мозга
Крупные (>2 см в максимальном измерении) МГМ представляют собой отдельную клиническую проблему для проведения СРТ в режиме радиохирургии, поскольку, с учетом высокого риска постлучевых изменений, требуется редукция дозы радиации, что определяет необходимость проведения нейрохирургической резекции или фракционирования дозы СРТ.Показатели локального контроля крупных МГМ после нейрохирургической резекции или проведения СРТ в режиме радиохирургии находятся в диапазоне от 40% до 60% [20]. С учетом высокого риска развития локального рецидива после нейрохирургической резекции применение радиотерапии является обязательным компонентом комбинированного лечения [21].
Исторически ОВГМ обычно применялась после нейрохирургической резекции. Однако, несмотря на то, что ОВГМ эффективно обеспечивает локальный контроль метастатических очагов, лечение МГМ эволюционировало в пользу применения СРТ для исключения риска когнитивных расстройств, связанных с ОВГМ. По сравнению с ОВГМ послеоперационная СРТ в режиме радиохирургии обеспечивает увеличение ОВ без ухудшения когнитивной функции у пациентов с единичным метастазом в головной мозг и улучшает локальный контроль у пациентов с множественными МГМ [22].
Отказ от применения ОВГМ после нейрохирургической резекции МГМ привел к увеличению частоты поражения лептоменингеальных оболочек вследствие интраоперационного попадания клеток опухоли в ликвор. Дополнительными факторами риска развития лептоменингеального поражения в послеоперационном периоде являются наличие метастазов рака молочной железы в головном мозге, фрагментарной резекции очага, частичного его удаления, локализации очага в задней черепной ямке, множественных МГМ, геморрагических осложнений и кистозных метастазов [23, 24].
С целью снижения риска лептоменингеального поражения разработана методика предоперационной радиохирургии, которая заключается в проведении радиохирургии МГМ с последующим его удалением в течение ближайших 24–48 ч (рис. 3).

В клинических исследованиях показано снижение частоты лептоменингеальной прогрессии в группе пациентов с предоперационной радиохирургией в сравнении с проведением послеоперационной СРX (3,2% и 16,2% соответственно), частоты радионекроза (4,9% и 16,4% соответственно) и эквивалентные показатели частоты лептоменингеального поражения в сравнении с проведением послеоперационного ОВГМ [25].
Анализ результатов исследования предоперационной радиохирургии крупных МГМ, проведенного в НМИЦ нейрохирургии им. акад. Н.Н. Бурденко (53 пациентов со 110 крупными МГМ) на сроке 12 мес показал низкую частоту локальных рецидивов (10,7%), радионекрозов (4,3%) и высокие показатели ОВ (62,5%). Лептоменингеальное поражение зарегистрировано у 1 пациента [26].
Сравнительные результаты предоперационной радиохирургии и послеоперационной СРТ в настоящее время ограничены и требуют уточнения в дальнейших проспективных клинических исследованиях.
Системная противоопухолевая терапия
Цель системной противоопухолевой терапии заключается в улучшении показателей ОВ посредством достижения контроля экстракраниальных метастатических очагов, снижения риска развития новых (дистантных) МГМ, а также достижения регрессии МГМ в отдельных клинических ситуациях. Кроме того, одной из задач системной терапии у пациентов с МГМ является возможность отложить локальное лечение (радиотерапию/нейрохирургию) до дальнейшей интракраниальной прогрессии заболевания, потенциально избегая риска возможных осложнений локальной терапии без значимого снижения ОВ. Любое решение об отсрочке локального лечения должно приниматься после междисциплинарного обсуждения, включающего как минимум нейрохирурга, нейрорадиолога, онколога и радиотерапевта. Кроме того, если локальная терапия откладывается, МРТ мониторинг головного мозга имеет решающее значение для своевременного старта локальной терапии [16].У пациентов с бессимптомными МГМ в случае решения вопроса об отсрочке локального лечения необходимо учитывать характер и локализацию очагов в головном мозге. Некоторым пациентам с бессимптомными метастазами, локализованными в функциональных зонах мозга, желательно проведение локального лечения с целью снижения возможного риска развития неврологического дефицита вследствие роста метастатического очага.
В соответствии с клиническими рекомендациями ASCO [16] и ESMO-EANO [27] локальную терапию можно отложить до последующей интракраниальной прогрессии у пациентов с первично выявленными бессимптомными МГМ:
• немелкоклеточного рака легких с наличием мутации/транслокации EGFR/ALK/ROS1. Следует проводить таргетную терапию в 1-й линии лечения (осимертиниб, алектиниб, бригатиниб);
• немелкоклеточного рака легких без мутации/транслокации EGFR/ALK/ROS1. Следует проводить монотерапию ингибиторами иммунных контрольных точек, если PD-L1>50% или системную химиотерапию в сочетании с ингибиторами иммунных контрольных точек, если PD-L1<50%;
• меланомы независимо от BRAF статуса опухоли. Следует проводить терапию ипилимумабом и ниволумабом.
Мониторинг и наблюдение
Пациенты с МГМ в анамнезе должны проходить неврологическое обследование и МРТ головного мозга с внутривенным контрастированием с интервалом в 3 мес. Оценка ответа на лечение основывается на критериях RANO, которые учитывают изменения таргетных и нетаргетных очагов на МРТ, неврологический статус и необходимость применения стероидов [28].МРТ головного мозга следует проводить каждые
2–3 мес или при любом подозрении на интракраниальную прогрессию. МРТ является стандартным методом оценки ответа и последующего наблюдения у пациентов с МГМ.
Однако обычная МРТ не всегда может надежно различить особенности, связанные с лечением (псевдопрогрессии, радионекроз и прогрессирование опухоли).
В этой клинической ситуации позитронно-эмиссионная томография головного мозга с использованием радиоактивных индикаторов, меченных 18F тирозином и 11C метионином, рекомендована для дифференциальной диагностики рецидива опухоли от радионекроза. Проведение СКТ перфузии головного мозга позволяет измерить объем церебрального кровотока опухоли и нормальной ткани мозга и применяется для дифференциальной диагностики рецидива опухоли и радионекроза.
Заключение
Локальное лечение пациентов с МГМ является важным компонентом мультидисциплинарного подхода в лечении онкологических пациентов, обеспечивающее снижение риска смерти от неврологических расстройств, сохранение качества жизни и увеличение ОВ. Выбор соответствующих опций локального и системного лечения имеет решающее значение для обеспечения локального контроля МГМ, снижения риска осложнений, связанных с лечением, и увеличения ОВ.Выполнение нейрохирургической резекции показано у пациентов с наличием крупных МГМ или очагов с выраженным отеком и масс-эффектом. Лучшие показатели ОВ достигаются у пациентов со стабилизацией экстракраниальных метастазов и наличием эффективных опций системной противоопухолевой терапии.
СРТ применяется у пациентов с небольшими по размеру МГМ или при наличии крупных очагов и противопоказаний к проведению нейрохирургии. ОВГМ по-прежнему является стандартным методом лечения пациентов с МГМ и неблагоприятным прогнозом ОВ или при наличии лептоменингеальной прогрессии.
Определение оптимальных комбинаций лечебных опций для пациентов с МГМ требует дальнейшей оценки. Новые технологические разработки в нейрохирургии и радиотерапии могут улучшить результаты лечения пациентов с метастатическим поражением головного мозга.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Голанов Андрей Владимирович – чл.-корр. РАН, д-р мед наук, проф., врач-радиотерапевт, отд-ние радиохирургии и радиотерапии, ФГАУ «НМИЦ нейрохирургии им. акад. Н.Н. Бурденко»
Andrey V. Golanov – Corr. Memb. RAS, Dr. Sci. (Med.), Prof., Burdenko National Medical Research Center for Neurosurgery
Банов Сергей Михайлович – д-р мед наук, науч. сотр., врач-радиотерапевт, отд-ние радиохирургии и радиотерапии
ФГАУ «НМИЦ нейрохирургии им. акад. Н.Н. Бурденко»; Центр «Гамма-нож». E-mail: smbanov@gmail.com
Sergey M. Banov – Dr. Sci. (Med.), Burdenko National Medical Research Center for Neurosurgery, Center “Gamma-Knife”.
E-mail: smbanov@gmail.com
Ветлова Елена Рэмовна – канд. мед. наук, ст. науч. сотр., врач-радиотерапевт, отд-ние радиохирургии и радиотерапии ФГАУ «НМИЦ нейрохирургии им. акад. Н.Н. Бурденко»
Elena R. Vetlova – Cand. Sci. (Med.), Burdenko National Medical Research Center for Neurosurgery
Вартанян Карэн Феликсович – д-р мед наук, проф., врач-радиолог, каф. радиологии, ФГБОУ ДПО РМАНПО
Karen F. Vartanyan – Dr. Sci. (Med.), Prof., Russian Medical Academy of Continuous Professional Education
Жмаева Елена Михайловна – д-р мед наук, доц., врач-радиолог, каф. радиологии, ФГБОУ ДПО РМАНПО
Elena M. Zhmaeva – Dr. Sci. (Med.), Russian Medical Academy of Continuous Professional Education
Поступила в редакцию: 25.05.2023
Поступила после рецензирования: 31.05.2023
Принята к публикации: 15.06.2023
Received: 25.05.2023
Revised: 31.05.2023
Accepted: 15.06.2023
Список исп. литературыСкрыть список1. Davis FG, Dolecek TA, McCarthy BJ, Villano JL. Toward determining the lifetime occurrence of metastatic brain tumors estimated from 2007 United States cancer incidence data. Neuro-Oncology 2012; 14 (9): 1171–7.
2. Lamba N, Wen PY, Aizer AA. Epidemiology of brain metastases and leptomeningeal disease. Neuro-oncology 2021; 23 (9): 1447–56.
3. Sperduto PW, Mesko S, Li J et al. Survival in Patients With Brain Metastases: Summary Report on the Updated Diagnosis-Specific Graded Prognostic Assessment and Definition of the Eligibility Quotient. J Clinic Oncol 2020; 38 (32): 3773–84.
4. Долгушин М.Б., Корниенко В.Н., Пронин И.Н. Metastases in the brain. Diagnostic neuroradiology. М.: ИП «Т.А. Алексеева», 2017.
Dolgushin M.B., Kornienko V.N., Pronin I.N. Metastazy v golovnom mozge. Diagnosticheskaya nejroradiologiya. Moscow: IP «T.A. Alekseeva», 2017 (in Russian).
5. Kaufmann TJ, Smits M, Boxerman J et al. Consensus recommendations for a standardized brain tumor imaging protocol for clinical trials in brain metastases. Neuro-Oncology 2020; 22 (6): 757–72.
6. Suh CH, Jung SC, Kim KW, Pyo J. The detectability of brain metastases using contrast-enhanced spin-echo or gradient-echo images: a systematic review and meta-analysis. J Neuro-Oncol 2016; 129 (2): 363–71.
7. Jeon JY, Choi JW, Roh HG, Moon WJ. Effect of imaging time in the magnetic resonance detection of intracerebral metastases using single dose gadobutrol. Korean J Radiol 2014; 15 (1): 145–50.
8. Galldiks N, Langen K-J, Albert NL et al. PET imaging in patients with brain metastasis-report of the RANO/PET group. Neuro-Oncology 2019; 21 (5): 585–95.
9. Банов С.М., Голанов А.В., Зайцев А.М. и др. Метастатическое поражение головного мозга, современные стандарты лечения. Русский медицинский журнал. 2017; 25 (16): 1181–5.
Banov S.M., Golanov A.V., Zajcev A.M. et al. Metastatic brain damage, modern standards of treatment. Russ Med J. 2017; 25 (16): 1181–5 (in Russian).
10. Современные технологии и клинические исследования в нейрохирургии. Ред. А.Н. Коновалов. М.: ИП «Т.А. Алексеева», 2012.
Modern technologies and clinical research in neurosurgery. Ed. by A.N. Konovalov. Moscow: IP «T.A. Alekseeva», 2012 (in Russian).
11. Лошаков В.А. Хирургия метастазов головного мозга. Вестник Московского онкологического общества. 2004; 1: 7–8.
Loshakov V.A. Surgery of brain metastases. Bulletin of the Moscow Oncological Society. 2004; 1: 7–8 (in Russian).
12. Kamp MA, Rapp M, Slotty PJ et al. Incidence of local in-brain progression after supramarginal resection of cerebral metastases. Acta Neurochirurgica 2015; 157 (6): 905–10; discussion 910–1.
13. Yoo H, Kim YZ, Nam BH et al. Reduced local recurrence of a single brain metastasis through microscopic total resection. J Neurosurgery 2009; 110 (40): 730–6.
14. Patel AJ, Suki D, Hatiboglu MA et al. Impact of surgical methodology on the complication rate and functional outcome of patients with a single brain metastasis. J Neurosurgery 2015; 122 (5): 1132–43.
15. Chua TH, See AAQ, Ang BT, King NKK. Awake Craniotomy for Resection of Brain Metastases: A Systematic Review. World neurosurgery 2018; 120: e1128-e1135.
16. Vogelbaum MA, Brown PD, Messersmith H et al. Treatment for Brain Metastases: ASCO-SNO-ASTRO Guideline. J Clin Oncol 2022; 40 (5): 492–16.
17. Gondi V, Bauman G, Bradfield L et al. Radiation Therapy for Brain Metastases: An ASTRO Clinical Practice Guideline. Practical radiation oncology 2022; 12 (4): 265–82.
18. Brown PD, Pugh S, Laack NN et al. Memantine for the prevention of cognitive dysfunction in patients receiving whole-brain radiotherapy: a randomized, double-blind, placebo-controlled trial. Neuro-oncology 2013; 15 (10): 1429–37.
19. Gondi V, Pugh SL, Tome WA et al. Preservation of memory with conformal avoidance of the hippocampal neural stem-cell compartment during whole-brain radiotherapy for brain metastases (RTOG 0933): a phase II multi-institutional trial. J Clin Oncol 2014; 32 (34):
3810–6.
20. Mahajan A, Ahmed S, McAleer MF et al. Post-operative stereotactic radiosurgery versus observation for completely resected brain metastases: a single-centre, randomised, controlled, phase 3 trial. Lancet Oncol 2017; 18 (8): 1040–8.
21. Щиголев Ю.С. Комплексное лечение метастазов злокачественных опухолей в головной мозг (хирургический аспект). М.: НИИ Нейрохирургии им. ак. Н.Н. Бурденко, 1996.
Shchigolev Yu.S. Complex treatment of metastases of malignant tumors in the brain (surgical aspect). Moscow: Burdenko Research Institute of Neurosurgery, 1996 (in Russian).
22. Kocher M, Soffietti R, Abacioglu U et al. Adjuvant whole-brain radiotherapy versus observation after radiosurgery or surgical resection of one to three cerebral metastases: results of the EORTC 22952-26001 study. J Clini Oncol 2011; 29 (2): 134–41.
23. Foreman PM, Jackson BE, Singh KP et al. Postoperative radiosurgery for the treatment of metastatic brain tumor: Evaluation of local failure and leptomeningeal disease. J Clin Neuroscience 2018; 49: 48–55.
24. Patel KR, Burri SH, Boselli D et al. Comparing pre-operative stereotactic radiosurgery (SRS) to post-operative whole brain radiation therapy (WBRT) for resectable brain metastases: a multi-institutional analysis. J Neuro-Oncology 2017; 131 (3): 611–8.
25. Patel KR, Burri SH, Asher AL et al. Comparing Preoperative With Postoperative Stereotactic Radiosurgery for Resectable Brain Metastases: A Multi-institutional Analysis. Neurosurgery 2016; 79 (2): 279–85.
26. Vetlova ER, Golbin AD, Golanov AV et al. Preoperative Stereotactic Radiosurgery of Brain Metastases: Preliminary Results. Cureus 2017; 9 (12).
27. EANO-ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up of patients with brain metastasis from solid tumours. Rhun ELe, Guckenberger M, Smits M et al. Ann Oncol 2021; 32 (11): 1332–47.
28. Lin NU, Lee EQ, Aoyama H et al. Response assessment criteria for brain metastases: proposal from the RANO group. Lancet Oncol 2015; 16 (6): e270-8.
31 июля 2023
Количество просмотров: 1130

