Клинический разбор в общей медицине №11 2023
Nigar N. Muradova1, Anna D. Kondrashova1, Ilona A. Shcherbanyuk1, Aysun A. Khalilova1,
Anna V. Chukanova1
1 Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russia;
2 Speransky Children City Clinical Hospital №9, Moscow, Russia
aminova_a_i@staff.sechenov.ru
Abstract
Tuberculosis is an infectious disease, with many forms and localizations, caused by Mycobacterium tuberculosis, which can affect any organs and tissues of the body. The paper presents a clinical case of tuberculosis of multiple locations, with the presence of resistance of M. tuberculosis to anti-tuberculosis drugs (moxifloxacin, amikacin, bedaquiline), manifesting with sluggish lymphadenopathy of the submandibular lymph nodes in a child who arrived in Russia from Pakistan.
Key words: child, migrants, tuberculosis, lymphadenopathy, lymphadenectomy, drug resistance.
For citation: Aminova A.I., Feldfiks L.I., Ibatullina A.I., Eryushova T.Yu., Muradova N.N., Kondrashova A.D., Shcherbanyuk I.A., Khalilova A.A., Chukanova A.V. A clinical case. Tuberculous lymphadenitis in a 10-year-old girl: what should not be forgotten. Clinical review for general practice. 2023; 4 (11): 41–44 (In Russ.). DOI: 10.47407/kr2023.4.11.00303
Туберкулез является основной причиной смертности от инфекций в мире. Дети составляют ~5–15% всех заболевших туберкулезом. По оценкам Всемирной организации здравоохранения в 2015 г. во всем мире туберкулезом страдали 1 млн детей; из них умирают более 136 тыс. в год. По оценкам другого исследования,
67 млн детей страдают латентным туберкулезом, который развивается в активную форму, причем ежегодно это происходит примерно у 850 тыс. детей [1]. К 2019 г. отмечается отрицательная динамика эпидемиологических данных по туберкулезу. По данным Всемирной организации здравоохранения, в 2019 г. заболели туберкулезом 10,0 млн человек (9,0–11,1 млн), из них 1,0 млн детей 0–14 лет; умерли 1,6 млн человек, из них 233 тыс. детей 0–14 лет, среди которых 80% – дети до 5 лет, 17% (39 тыс.) – с ВИЧ-инфекцией [2].
В Российской Федерации в настоящее время в течение последних 5 лет отмечается значительное снижение заболеваемости туберкулезом (по отчетным формам №8 и №33): с 12,4 на 100 тыс. детей 0–14 лет – в 2015 г. до 6,2 – в 2020 г. Заболеваемость детей 15–17 лет вдвое превышала заболеваемость детей 0–14 лет, однако была существенно ниже заболеваемости взрослых и составила в 2020 г. 12,7 на 100 тыс. подросткового населения (26,8 – в 2015 г.). Доля больных с бактериовыделением различалась в возрастных группах: 5–6 лет – 3,0%, 7–14 лет – 8,4%, 15–17 лет – 25,8% [3].
Однако существует риск ухудшения показателей заболеваемости в связи с усилением миграционных потоков из стран с неблагоприятной эпидемической ситуацией по туберкулезу и снижением врачебной настороженности в отношении данной инфекции. Еще в 2013 г. данные Организации Объединенных Наций показали, что глобальное число мигрантов составило 232 млн, что связано с военными конфликтами и финансовыми проблемами на территории их государств [4–7]. У лиц, приехавших из стран с низким доходом, туберкулез возникает по одной из трех причин:
1) либо мигранты из-за границы имеют активный туберкулез по прибытии;
2) либо мигранты имеют дистанционно приобретенную латентную туберкулезную инфекцию, которая реактивируется после прибытия;
3) либо мигранты заражаются туберкулезом по прибытии.
Проблемой в детской фтизиатрии является рост заболеваемости в связи с миграцией населения с эпидемиологически неблагоприятных территорий по туберкулезу, низкой комплаентностью при лечении туберкулеза в развивающихся странах, что формирует лекарственную устойчивость микобактерий туберкулеза.
Клиническая картина туберкулеза в детской возрастной группе отличается от таковой у взрослых, что делает туберкулез особой проблемой:
а) риск развития заболевания после заражения выше у детей, а латентный период короче по сравнению с взрослым;
б) у детей выше вероятность развития внелегочного туберкулеза и тяжелого течения заболевания;
в) клинико-рентгенологические проявления неоднородны и часто неспецифичны;
г) у детей сбор проб на микробиологическое исследование затруднен, заболевание чаще носит малобациллярный характер [8–11].
Цель исследования – демонстрация клинического случая туберкулеза шейных лимфатических узлов (ЛУ) у девочки, прибывшей из страны, эпидемиологически неблагополучной в отношении данного заболевания.
Пациентка Б., девочка 10 лет, поступила в многопрофильную детскую городскую клиническую больницу
г. Москвы с жалобами на увеличенные, уплотненные ЛУ в подчелюстной области слева и справа.
Из анамнеза жизни известно, что ребенок из многодетной семьи. В июне 2021 г. прибыла с родителями в РФ из Пакистана. В Пакистане семья проживала в сельской местности, девочка летом часто употребляла молоко без термической обработки, контактировала с домашними животными (коровами, лошадьми). У матери пациентки в 2009–2010 гг. (до рождения дочери) был диагностирован туберкулез легких. Получала лечение в течение 6 мес. В настоящий момент лечение не получает. Девочка вакцинирована по календарю (со слов отца): БЦЖ в 1–1,5 года, рубец 8 мм.
 Анамнез заболевания. В течение двух лет родители периодически отмечали увеличение подчелюстных и шейных ЛУ. В январе 2022 г. обратились в частную клинику г. Москвы, где на ультразвуковом исследовании мягких тканей шеи был заподозрен абсцесс слюнной железы. Девочка экстренно направлена в хирургическое отделение ГБУЗ г. Москвы «Морозовская детская городская клиническая больница» с жалобами на увеличение ЛУ в области шеи (со слов папы, в течение 5 мес). В приемном отделении диагноз не подтвердился, при осмотре слева в области шеи выявлено мягкое опухолевидное образование 3,0×2,5 см, болезненное, малоподвижное. На ультразвуковом исследовании мягких тканей визуализирован деструктивно измененный ЛУ? 25×15 мм, с неровными контурами, с эхонеоднородной аваскулярной жидкостной зоной в центре до 11 мм, кровоток по периферии усилен, рядом выявлены увеличенные до 12–13 мм ЛУ с увеличенным кровотоком в режиме цветового доплеровского картирования, окружающие ткани умеренно инфильтрированы. В общем анализе крови отмечался умеренный относительный лимфоцитоз (до 44%). В связи с отсутствием показаний к хирургическому вмешательству девочка выписана с рекомендациями провести дообследование амбулаторно. До апреля 2022 г. ЛУ увеличивались, к врачу не обращались, лечение не получали. В апреле 2022 г. девочка стала жаловаться на боли в горле при глотании и увеличение шейных ЛУ, была направлена на госпитализацию в ГБУЗ «Детская городская клиническая больница №9 им. Г.Н. Сперанского» в связи с обнаружением в крови вируса Эбштейна–Барр (положительный результат полимеразной цепной реакции).
Анамнез заболевания. В течение двух лет родители периодически отмечали увеличение подчелюстных и шейных ЛУ. В январе 2022 г. обратились в частную клинику г. Москвы, где на ультразвуковом исследовании мягких тканей шеи был заподозрен абсцесс слюнной железы. Девочка экстренно направлена в хирургическое отделение ГБУЗ г. Москвы «Морозовская детская городская клиническая больница» с жалобами на увеличение ЛУ в области шеи (со слов папы, в течение 5 мес). В приемном отделении диагноз не подтвердился, при осмотре слева в области шеи выявлено мягкое опухолевидное образование 3,0×2,5 см, болезненное, малоподвижное. На ультразвуковом исследовании мягких тканей визуализирован деструктивно измененный ЛУ? 25×15 мм, с неровными контурами, с эхонеоднородной аваскулярной жидкостной зоной в центре до 11 мм, кровоток по периферии усилен, рядом выявлены увеличенные до 12–13 мм ЛУ с увеличенным кровотоком в режиме цветового доплеровского картирования, окружающие ткани умеренно инфильтрированы. В общем анализе крови отмечался умеренный относительный лимфоцитоз (до 44%). В связи с отсутствием показаний к хирургическому вмешательству девочка выписана с рекомендациями провести дообследование амбулаторно. До апреля 2022 г. ЛУ увеличивались, к врачу не обращались, лечение не получали. В апреле 2022 г. девочка стала жаловаться на боли в горле при глотании и увеличение шейных ЛУ, была направлена на госпитализацию в ГБУЗ «Детская городская клиническая больница №9 им. Г.Н. Сперанского» в связи с обнаружением в крови вируса Эбштейна–Барр (положительный результат полимеразной цепной реакции).
Физикальный статус. Антропометрические данные: масса тела 35 кг; длина тела 140 см; индекс массы тела 17,8 кг/м2. Рост и масса тела соответствуют возрасту (все показатели в интервале 15–85-го перцентиля или -1 и +1 SSD), масса тела соответствует росту (все показатели в пределах 15–85-го перцентиля или -1 и +1 SSD).
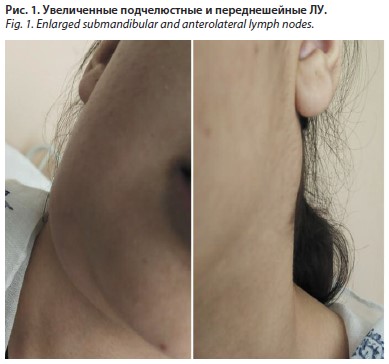
Общее состояние средней тяжести, сознание ясное, конституция нормостеническая, питание удовлетворительное. Кожные покровы бледно-розовые, чистые. Развитие подкожно-жировой клетчатки умеренное, распределение равномерное. Тургор сохранен. ЛУ: подчелюстные и переднешейные справа до 10 см, плотные, безболезненные, спаяны между собой, малоподвижные, кожа на поверхности ЛУ без изменений, слева ЛУ плотные до 5–7 см, безболезненные, не спаяны, околоушные ЛУ единичные (рис. 1). Слизистая оболочка задней стенки глотки – с фолликулярной гиперплазией; небные дужки гиперемированы.
Обследование. В анализе крови относительное количество лимфоцитов 26,36% (норма 30–46%), отмечается умеренное повышение С-реактивного белка до 9,3 мг/л (норма 0,1–8,2 мг/л). Иммуноферментный анализ крови – обнаружены антитела класса иммуноглобулина G к Coronavirus (SARS-CoV-2) – 642,65 (референс <10), к Cytomegalovirus – более 250,0, к Toxoplasma gondii – 29,7. Полимеразная цепная реакция крови на ДНК вируса Эпштейна–Барр слабоположительная.
При проведении ультразвукового исследования ЛУ при сканировании боковых поверхностей шеи, подчелюстных областей определяются множественные ЛУ шаровидной формы с неровными, относительно четкими контурами, с тенденцией к агломерации, образованию «пакетов». Общий размер справа – 55×29 мм, слева – 35×21 мм. Нормальная эхоструктура ЛУ не прослеживается. Ткань пониженной эхогенности с множественными гипоэхогенными зонами. При цветовом доплеровском картировании кровоток мозаичен, с зонами усиления/ослабления. Ход сосудов хаотичен. Выявлены признаки лимфоидной метаплазии, отмечается отсутствие нормальной дифференцировки.
 При компьютерной томографии (КТ) органов грудной клетки определена КТ-картина билатеральных патологических образований шеи неясного генеза. Убедительных КТ-данных в пользу наличия инфильтративных и очаговых изменений легочной паренхимы не получено, КТ-признаки петрификации внутригрудных ЛУ.
При компьютерной томографии (КТ) органов грудной клетки определена КТ-картина билатеральных патологических образований шеи неясного генеза. Убедительных КТ-данных в пользу наличия инфильтративных и очаговых изменений легочной паренхимы не получено, КТ-признаки петрификации внутригрудных ЛУ.
При проведении МРТ шеи установлены конгломераты ЛУ в правой нижнечелюстной области размерами 37×23×31 мм, аналогично слева размерами 20×25×28 мм, признаки воспаления отсутствовали.
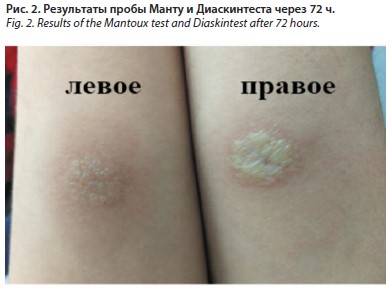
Для исключения туберкулеза проведены пробы: правое предплечье – реакция Манту, левое предплечье – Диаскинтест. Проба Манту – гиперергическая реакция, папула 20 мм; Диаскинтест 0,1 мл – папула 15 мм (рис. 2).
На основании жалоб, анамнеза заболевания, данных физикального, лабораторных и инструментальных методов обследования был поставлен диагноз «острый шейный лимфаденит вероятно туберкулезной этиологии». Ребенок выписан под наблюдение участкового врача-педиатра и фтизиатра по месту жительства.
Через 10 дней после выписки из стационара ребенок поступил в ФГБУ «Национальный медицинский исследовательский центр фтизиопульмонологии и инфекционных заболеваний» Минздрава России, где находился на лечении с диагнозом: «Туберкулез периферических ЛУ, шейная группа, двусторонний, фаза абсцедирования. Остаточные изменения перенесенного первичного туберкулезного комплекса S8 левого легкого.
I группа диспансерного наблюдения». Была выполнена подчелюстная лимфаденэктомия справа (в операционном материале – ДНК микобактерий туберкулеза, лекарственная устойчивость к фторхинолонам). На биопсии выявлены сливающиеся очаги гранулематозного воспаления с некрозом в центре. Получена ДНК микобактерий туберкулеза, чувствительных к изониазиду, рифампицину, бактериологический посев с лекарственной устойчивостью к амикацину, бедаквилину, моксифлоксацину. Назначена противотуберкулезная терапия по I режиму химиотерапии в интенсивную фазу – не менее 4 мес 4 противотуберкулезных препарата: изониазид 0,45 г, рифампицин 0,3 г, пиразинамид 0,75 г, этамбутол 0,6 г перорально. На фоне лечения отмечалась положительная динамика.
Таким образом, представлен клинический случай туберкулеза у девочки из эпидемически неблагополучной территории, проживающей в семье, где имелись случаи туберкулеза у родственников. Трудность постановки диагноза обусловлена вялотекущим, атипичным течением, необходимостью проводить дифференциальную диагностику с другими лимфаденопатиями, низкой фтизиатрической настороженностью врачей. В представленном клиническом случае верификация окончательного диагноза и назначение специфического лечения произошли только через год после приезда девочки в РФ.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Аминова Альфия Иршадовна – д-р мед. наук, проф. каф. пропедевтики детских болезней Клинического института детского здоровья им. Н.Ф. Филатова ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: aminova_a_i@staff.sechenov.ru; ORCID: 0000-0002-1951-6424; SPIN-код: 2529-8975
Alfiya I. Aminova – D. Sci. (Med.), Professor, Sechenov First Moscow State Medical University (Sechenov University). E-mail: aminova_a_i@staff.sechenov.ru; ORCID: 0000-0002-1951-6424; SPIN code: 2529-8975
Фельдфикс Лариса Изевна – зав. инфекционным отд-нием №11 ГБУЗ «ДГКБ №9 им. Г.Н. Сперанского»
Larisa I. Feldfiks – Head of the Infectious Diseases Department №11, Speransky Children City Clinical Hospital №9
Ибатуллина Алия Ильнаровна – студентка 4-го курса Клинического института детского здоровья им. Н.Ф. Филатова ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: ilnarovna99@mail.ru
Aliya I. Ibatullina – Student, Sechenov First Moscow State Medical University (Sechenov University). E-mail: ilnarovna99@mail.ru
Ерюшова Татьяна Юрьевна – ассистент каф. пропедевтики детских болезней Клинического института детского здоровья им. Н.Ф. Филатова ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: eryushova_t_yu@staff.sechenov.ru
Tatiana Yu. Eryushova – Assistant, Sechenov First Moscow State Medical University (Sechenov University). E-mail: eryushova_t_yu@staff.sechenov.ru
Мурадова Нигар Намиг кызы – студентка 3-го курса Клинического института детского здоровья им. Н.Ф. Филатова ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: nmuradova631@gmail.com
Nigar N. Muradova – Student, Sechenov First Moscow State Medical University (Sechenov University). E-mail: nmuradova631@gmail.com
Кондрашова Анна Дмитриевна – студентка 4-го курса Клинического института детского здоровья им. Н.Ф. Филатова ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет)
Anna D. Kondrashova – Student, Sechenov First Moscow State Medical University (Sechenov University)
Щербанюк Илона Андреевна – студентка 3-го курса Клинического института детского здоровья им. Н.Ф. Филатова ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: sherbanyukilona@yandex.ru
Ilona A. Shcherbanyuk – Student, Sechenov First Moscow State Medical University (Sechenov University). E-mail: sherbanyukilona@yandex.ru
Халилова Айсун Аббасали кызы – студентка 3-го курса Клинического института детского здоровья им. Н.Ф. Филатова ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: aysskh@mail.ru
Aysun A. Khalilova – Student, Sechenov First Moscow State Medical University (Sechenov University). E-mail: aysskh@mail.ru
Чуканова Анна Витальевна – студентка 3-го курса Клинического института детского здоровья им. Н.Ф. Филатова ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: chukanovaaaa@gmail.com
Anna V. Chukanova – Student, Sechenov First Moscow State Medical University (Sechenov University). E-mail: chukanovaaaa@gmail.com
Поступила в редакцию: 30.10.2023
Поступила после рецензирования: 07.11.2023
Принята к публикации: 16.11.2023
Received: 30.10.2023
Revised: 07.11.2023
Accepted: 16.11.2023
Клинический разбор в общей медицине №11 2023
Клинический случай. Туберкулезный лимфаденит у девочки 10 лет: о чем не надо забывать
Номера страниц в выпуске:41-44
Аннотация
В работе представлен клинический случай туберкулеза множественных локализаций с наличием микобактерий туберкулеза с устойчивостью к противотуберкулезным препаратам (моксифлоксацину, амикацину, бедаквилину), манифестирующего с вялотекущей лимфаденопатии подчелюстных лимфатических узлов у ребенка, прибывшего в Россию из Пакистана.
Ключевые слова: дети, мигранты, туберкулез, лимфаденопатия, лимфаденэктомия, лекарственная устойчивость.
Для цитирования: Аминова А.И., Фельдфикс Л.И., Ибатуллина А.И., Ерюшова Т.Ю., Мурадова Н.Н., Кондрашова А.Д., Щербанюк И.А., Халилова А.А., Чуканова А.В. Клинический случай. Туберкулезный лимфаденит у девочки 10 лет: о чем не надо забывать. Клинический разбор в общей медицине. 2023; 4 (11): 41–44. DOI: 10.47407/kr2023.4.11.00303
В работе представлен клинический случай туберкулеза множественных локализаций с наличием микобактерий туберкулеза с устойчивостью к противотуберкулезным препаратам (моксифлоксацину, амикацину, бедаквилину), манифестирующего с вялотекущей лимфаденопатии подчелюстных лимфатических узлов у ребенка, прибывшего в Россию из Пакистана.
Ключевые слова: дети, мигранты, туберкулез, лимфаденопатия, лимфаденэктомия, лекарственная устойчивость.
Для цитирования: Аминова А.И., Фельдфикс Л.И., Ибатуллина А.И., Ерюшова Т.Ю., Мурадова Н.Н., Кондрашова А.Д., Щербанюк И.А., Халилова А.А., Чуканова А.В. Клинический случай. Туберкулезный лимфаденит у девочки 10 лет: о чем не надо забывать. Клинический разбор в общей медицине. 2023; 4 (11): 41–44. DOI: 10.47407/kr2023.4.11.00303
A clinical case. Tuberculous lymphadenitis in a 10-year-old girl: what should not be forgotten
Alfiya I. Aminova1, Larisa I. Feldfiks2, Aliya I. Ibatullina1, Tatiana Yu. Eryushova1,Nigar N. Muradova1, Anna D. Kondrashova1, Ilona A. Shcherbanyuk1, Aysun A. Khalilova1,
Anna V. Chukanova1
1 Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russia;
2 Speransky Children City Clinical Hospital №9, Moscow, Russia
aminova_a_i@staff.sechenov.ru
Abstract
Tuberculosis is an infectious disease, with many forms and localizations, caused by Mycobacterium tuberculosis, which can affect any organs and tissues of the body. The paper presents a clinical case of tuberculosis of multiple locations, with the presence of resistance of M. tuberculosis to anti-tuberculosis drugs (moxifloxacin, amikacin, bedaquiline), manifesting with sluggish lymphadenopathy of the submandibular lymph nodes in a child who arrived in Russia from Pakistan.
Key words: child, migrants, tuberculosis, lymphadenopathy, lymphadenectomy, drug resistance.
For citation: Aminova A.I., Feldfiks L.I., Ibatullina A.I., Eryushova T.Yu., Muradova N.N., Kondrashova A.D., Shcherbanyuk I.A., Khalilova A.A., Chukanova A.V. A clinical case. Tuberculous lymphadenitis in a 10-year-old girl: what should not be forgotten. Clinical review for general practice. 2023; 4 (11): 41–44 (In Russ.). DOI: 10.47407/kr2023.4.11.00303
Туберкулез является основной причиной смертности от инфекций в мире. Дети составляют ~5–15% всех заболевших туберкулезом. По оценкам Всемирной организации здравоохранения в 2015 г. во всем мире туберкулезом страдали 1 млн детей; из них умирают более 136 тыс. в год. По оценкам другого исследования,
67 млн детей страдают латентным туберкулезом, который развивается в активную форму, причем ежегодно это происходит примерно у 850 тыс. детей [1]. К 2019 г. отмечается отрицательная динамика эпидемиологических данных по туберкулезу. По данным Всемирной организации здравоохранения, в 2019 г. заболели туберкулезом 10,0 млн человек (9,0–11,1 млн), из них 1,0 млн детей 0–14 лет; умерли 1,6 млн человек, из них 233 тыс. детей 0–14 лет, среди которых 80% – дети до 5 лет, 17% (39 тыс.) – с ВИЧ-инфекцией [2].
В Российской Федерации в настоящее время в течение последних 5 лет отмечается значительное снижение заболеваемости туберкулезом (по отчетным формам №8 и №33): с 12,4 на 100 тыс. детей 0–14 лет – в 2015 г. до 6,2 – в 2020 г. Заболеваемость детей 15–17 лет вдвое превышала заболеваемость детей 0–14 лет, однако была существенно ниже заболеваемости взрослых и составила в 2020 г. 12,7 на 100 тыс. подросткового населения (26,8 – в 2015 г.). Доля больных с бактериовыделением различалась в возрастных группах: 5–6 лет – 3,0%, 7–14 лет – 8,4%, 15–17 лет – 25,8% [3].
Однако существует риск ухудшения показателей заболеваемости в связи с усилением миграционных потоков из стран с неблагоприятной эпидемической ситуацией по туберкулезу и снижением врачебной настороженности в отношении данной инфекции. Еще в 2013 г. данные Организации Объединенных Наций показали, что глобальное число мигрантов составило 232 млн, что связано с военными конфликтами и финансовыми проблемами на территории их государств [4–7]. У лиц, приехавших из стран с низким доходом, туберкулез возникает по одной из трех причин:
1) либо мигранты из-за границы имеют активный туберкулез по прибытии;
2) либо мигранты имеют дистанционно приобретенную латентную туберкулезную инфекцию, которая реактивируется после прибытия;
3) либо мигранты заражаются туберкулезом по прибытии.
Проблемой в детской фтизиатрии является рост заболеваемости в связи с миграцией населения с эпидемиологически неблагоприятных территорий по туберкулезу, низкой комплаентностью при лечении туберкулеза в развивающихся странах, что формирует лекарственную устойчивость микобактерий туберкулеза.
Клиническая картина туберкулеза в детской возрастной группе отличается от таковой у взрослых, что делает туберкулез особой проблемой:
а) риск развития заболевания после заражения выше у детей, а латентный период короче по сравнению с взрослым;
б) у детей выше вероятность развития внелегочного туберкулеза и тяжелого течения заболевания;
в) клинико-рентгенологические проявления неоднородны и часто неспецифичны;
г) у детей сбор проб на микробиологическое исследование затруднен, заболевание чаще носит малобациллярный характер [8–11].
Цель исследования – демонстрация клинического случая туберкулеза шейных лимфатических узлов (ЛУ) у девочки, прибывшей из страны, эпидемиологически неблагополучной в отношении данного заболевания.
Пациентка Б., девочка 10 лет, поступила в многопрофильную детскую городскую клиническую больницу
г. Москвы с жалобами на увеличенные, уплотненные ЛУ в подчелюстной области слева и справа.
Из анамнеза жизни известно, что ребенок из многодетной семьи. В июне 2021 г. прибыла с родителями в РФ из Пакистана. В Пакистане семья проживала в сельской местности, девочка летом часто употребляла молоко без термической обработки, контактировала с домашними животными (коровами, лошадьми). У матери пациентки в 2009–2010 гг. (до рождения дочери) был диагностирован туберкулез легких. Получала лечение в течение 6 мес. В настоящий момент лечение не получает. Девочка вакцинирована по календарю (со слов отца): БЦЖ в 1–1,5 года, рубец 8 мм.
 Анамнез заболевания. В течение двух лет родители периодически отмечали увеличение подчелюстных и шейных ЛУ. В январе 2022 г. обратились в частную клинику г. Москвы, где на ультразвуковом исследовании мягких тканей шеи был заподозрен абсцесс слюнной железы. Девочка экстренно направлена в хирургическое отделение ГБУЗ г. Москвы «Морозовская детская городская клиническая больница» с жалобами на увеличение ЛУ в области шеи (со слов папы, в течение 5 мес). В приемном отделении диагноз не подтвердился, при осмотре слева в области шеи выявлено мягкое опухолевидное образование 3,0×2,5 см, болезненное, малоподвижное. На ультразвуковом исследовании мягких тканей визуализирован деструктивно измененный ЛУ? 25×15 мм, с неровными контурами, с эхонеоднородной аваскулярной жидкостной зоной в центре до 11 мм, кровоток по периферии усилен, рядом выявлены увеличенные до 12–13 мм ЛУ с увеличенным кровотоком в режиме цветового доплеровского картирования, окружающие ткани умеренно инфильтрированы. В общем анализе крови отмечался умеренный относительный лимфоцитоз (до 44%). В связи с отсутствием показаний к хирургическому вмешательству девочка выписана с рекомендациями провести дообследование амбулаторно. До апреля 2022 г. ЛУ увеличивались, к врачу не обращались, лечение не получали. В апреле 2022 г. девочка стала жаловаться на боли в горле при глотании и увеличение шейных ЛУ, была направлена на госпитализацию в ГБУЗ «Детская городская клиническая больница №9 им. Г.Н. Сперанского» в связи с обнаружением в крови вируса Эбштейна–Барр (положительный результат полимеразной цепной реакции).
Анамнез заболевания. В течение двух лет родители периодически отмечали увеличение подчелюстных и шейных ЛУ. В январе 2022 г. обратились в частную клинику г. Москвы, где на ультразвуковом исследовании мягких тканей шеи был заподозрен абсцесс слюнной железы. Девочка экстренно направлена в хирургическое отделение ГБУЗ г. Москвы «Морозовская детская городская клиническая больница» с жалобами на увеличение ЛУ в области шеи (со слов папы, в течение 5 мес). В приемном отделении диагноз не подтвердился, при осмотре слева в области шеи выявлено мягкое опухолевидное образование 3,0×2,5 см, болезненное, малоподвижное. На ультразвуковом исследовании мягких тканей визуализирован деструктивно измененный ЛУ? 25×15 мм, с неровными контурами, с эхонеоднородной аваскулярной жидкостной зоной в центре до 11 мм, кровоток по периферии усилен, рядом выявлены увеличенные до 12–13 мм ЛУ с увеличенным кровотоком в режиме цветового доплеровского картирования, окружающие ткани умеренно инфильтрированы. В общем анализе крови отмечался умеренный относительный лимфоцитоз (до 44%). В связи с отсутствием показаний к хирургическому вмешательству девочка выписана с рекомендациями провести дообследование амбулаторно. До апреля 2022 г. ЛУ увеличивались, к врачу не обращались, лечение не получали. В апреле 2022 г. девочка стала жаловаться на боли в горле при глотании и увеличение шейных ЛУ, была направлена на госпитализацию в ГБУЗ «Детская городская клиническая больница №9 им. Г.Н. Сперанского» в связи с обнаружением в крови вируса Эбштейна–Барр (положительный результат полимеразной цепной реакции).Физикальный статус. Антропометрические данные: масса тела 35 кг; длина тела 140 см; индекс массы тела 17,8 кг/м2. Рост и масса тела соответствуют возрасту (все показатели в интервале 15–85-го перцентиля или -1 и +1 SSD), масса тела соответствует росту (все показатели в пределах 15–85-го перцентиля или -1 и +1 SSD).
Общее состояние средней тяжести, сознание ясное, конституция нормостеническая, питание удовлетворительное. Кожные покровы бледно-розовые, чистые. Развитие подкожно-жировой клетчатки умеренное, распределение равномерное. Тургор сохранен. ЛУ: подчелюстные и переднешейные справа до 10 см, плотные, безболезненные, спаяны между собой, малоподвижные, кожа на поверхности ЛУ без изменений, слева ЛУ плотные до 5–7 см, безболезненные, не спаяны, околоушные ЛУ единичные (рис. 1). Слизистая оболочка задней стенки глотки – с фолликулярной гиперплазией; небные дужки гиперемированы.
Обследование. В анализе крови относительное количество лимфоцитов 26,36% (норма 30–46%), отмечается умеренное повышение С-реактивного белка до 9,3 мг/л (норма 0,1–8,2 мг/л). Иммуноферментный анализ крови – обнаружены антитела класса иммуноглобулина G к Coronavirus (SARS-CoV-2) – 642,65 (референс <10), к Cytomegalovirus – более 250,0, к Toxoplasma gondii – 29,7. Полимеразная цепная реакция крови на ДНК вируса Эпштейна–Барр слабоположительная.
При проведении ультразвукового исследования ЛУ при сканировании боковых поверхностей шеи, подчелюстных областей определяются множественные ЛУ шаровидной формы с неровными, относительно четкими контурами, с тенденцией к агломерации, образованию «пакетов». Общий размер справа – 55×29 мм, слева – 35×21 мм. Нормальная эхоструктура ЛУ не прослеживается. Ткань пониженной эхогенности с множественными гипоэхогенными зонами. При цветовом доплеровском картировании кровоток мозаичен, с зонами усиления/ослабления. Ход сосудов хаотичен. Выявлены признаки лимфоидной метаплазии, отмечается отсутствие нормальной дифференцировки.
 При компьютерной томографии (КТ) органов грудной клетки определена КТ-картина билатеральных патологических образований шеи неясного генеза. Убедительных КТ-данных в пользу наличия инфильтративных и очаговых изменений легочной паренхимы не получено, КТ-признаки петрификации внутригрудных ЛУ.
При компьютерной томографии (КТ) органов грудной клетки определена КТ-картина билатеральных патологических образований шеи неясного генеза. Убедительных КТ-данных в пользу наличия инфильтративных и очаговых изменений легочной паренхимы не получено, КТ-признаки петрификации внутригрудных ЛУ.При проведении МРТ шеи установлены конгломераты ЛУ в правой нижнечелюстной области размерами 37×23×31 мм, аналогично слева размерами 20×25×28 мм, признаки воспаления отсутствовали.
Для исключения туберкулеза проведены пробы: правое предплечье – реакция Манту, левое предплечье – Диаскинтест. Проба Манту – гиперергическая реакция, папула 20 мм; Диаскинтест 0,1 мл – папула 15 мм (рис. 2).
На основании жалоб, анамнеза заболевания, данных физикального, лабораторных и инструментальных методов обследования был поставлен диагноз «острый шейный лимфаденит вероятно туберкулезной этиологии». Ребенок выписан под наблюдение участкового врача-педиатра и фтизиатра по месту жительства.
Через 10 дней после выписки из стационара ребенок поступил в ФГБУ «Национальный медицинский исследовательский центр фтизиопульмонологии и инфекционных заболеваний» Минздрава России, где находился на лечении с диагнозом: «Туберкулез периферических ЛУ, шейная группа, двусторонний, фаза абсцедирования. Остаточные изменения перенесенного первичного туберкулезного комплекса S8 левого легкого.
I группа диспансерного наблюдения». Была выполнена подчелюстная лимфаденэктомия справа (в операционном материале – ДНК микобактерий туберкулеза, лекарственная устойчивость к фторхинолонам). На биопсии выявлены сливающиеся очаги гранулематозного воспаления с некрозом в центре. Получена ДНК микобактерий туберкулеза, чувствительных к изониазиду, рифампицину, бактериологический посев с лекарственной устойчивостью к амикацину, бедаквилину, моксифлоксацину. Назначена противотуберкулезная терапия по I режиму химиотерапии в интенсивную фазу – не менее 4 мес 4 противотуберкулезных препарата: изониазид 0,45 г, рифампицин 0,3 г, пиразинамид 0,75 г, этамбутол 0,6 г перорально. На фоне лечения отмечалась положительная динамика.
Таким образом, представлен клинический случай туберкулеза у девочки из эпидемически неблагополучной территории, проживающей в семье, где имелись случаи туберкулеза у родственников. Трудность постановки диагноза обусловлена вялотекущим, атипичным течением, необходимостью проводить дифференциальную диагностику с другими лимфаденопатиями, низкой фтизиатрической настороженностью врачей. В представленном клиническом случае верификация окончательного диагноза и назначение специфического лечения произошли только через год после приезда девочки в РФ.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Аминова Альфия Иршадовна – д-р мед. наук, проф. каф. пропедевтики детских болезней Клинического института детского здоровья им. Н.Ф. Филатова ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: aminova_a_i@staff.sechenov.ru; ORCID: 0000-0002-1951-6424; SPIN-код: 2529-8975
Alfiya I. Aminova – D. Sci. (Med.), Professor, Sechenov First Moscow State Medical University (Sechenov University). E-mail: aminova_a_i@staff.sechenov.ru; ORCID: 0000-0002-1951-6424; SPIN code: 2529-8975
Фельдфикс Лариса Изевна – зав. инфекционным отд-нием №11 ГБУЗ «ДГКБ №9 им. Г.Н. Сперанского»
Larisa I. Feldfiks – Head of the Infectious Diseases Department №11, Speransky Children City Clinical Hospital №9
Ибатуллина Алия Ильнаровна – студентка 4-го курса Клинического института детского здоровья им. Н.Ф. Филатова ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: ilnarovna99@mail.ru
Aliya I. Ibatullina – Student, Sechenov First Moscow State Medical University (Sechenov University). E-mail: ilnarovna99@mail.ru
Ерюшова Татьяна Юрьевна – ассистент каф. пропедевтики детских болезней Клинического института детского здоровья им. Н.Ф. Филатова ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: eryushova_t_yu@staff.sechenov.ru
Tatiana Yu. Eryushova – Assistant, Sechenov First Moscow State Medical University (Sechenov University). E-mail: eryushova_t_yu@staff.sechenov.ru
Мурадова Нигар Намиг кызы – студентка 3-го курса Клинического института детского здоровья им. Н.Ф. Филатова ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: nmuradova631@gmail.com
Nigar N. Muradova – Student, Sechenov First Moscow State Medical University (Sechenov University). E-mail: nmuradova631@gmail.com
Кондрашова Анна Дмитриевна – студентка 4-го курса Клинического института детского здоровья им. Н.Ф. Филатова ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет)
Anna D. Kondrashova – Student, Sechenov First Moscow State Medical University (Sechenov University)
Щербанюк Илона Андреевна – студентка 3-го курса Клинического института детского здоровья им. Н.Ф. Филатова ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: sherbanyukilona@yandex.ru
Ilona A. Shcherbanyuk – Student, Sechenov First Moscow State Medical University (Sechenov University). E-mail: sherbanyukilona@yandex.ru
Халилова Айсун Аббасали кызы – студентка 3-го курса Клинического института детского здоровья им. Н.Ф. Филатова ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: aysskh@mail.ru
Aysun A. Khalilova – Student, Sechenov First Moscow State Medical University (Sechenov University). E-mail: aysskh@mail.ru
Чуканова Анна Витальевна – студентка 3-го курса Клинического института детского здоровья им. Н.Ф. Филатова ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: chukanovaaaa@gmail.com
Anna V. Chukanova – Student, Sechenov First Moscow State Medical University (Sechenov University). E-mail: chukanovaaaa@gmail.com
Поступила в редакцию: 30.10.2023
Поступила после рецензирования: 07.11.2023
Принята к публикации: 16.11.2023
Received: 30.10.2023
Revised: 07.11.2023
Accepted: 16.11.2023
Список исп. литературыСкрыть список1. Velayati AA. Tuberculosis in children. Int J Mycobacteriol 2016; 5 (Suppl. 1): S1–S2. DOI: 10.1016/j.ijmyco.2016.10.038; PMID: 28043486.
2. Available at: https://www.who.int/tb/publications/global_report/gtbr2018_executive_summaryru.pdf.4
3. Туберкулез у детей. Клинические рекомендации РФ. 2022. Режим доступа: https://diseases.medelement.com/disease 84-2022/17149
Tuberculosis in children. Clinical recommendations of the Russian Federation. 2022. Available at: https://diseases.medelement.com/disease 84-2022/17149 (in Russian).
4. United Nations Department of Economic and Social Affairs Population Division. International migration report 2013. Geneva: United Nations, 2013.
5. International Organisation for Migration. World migration report 2015. Geneva: IOM, 2015.
6. Gilbert RL, Antoine D, French CE et al. The impact of immigration on tuberculosis rates in the United Kingdom compared with other
European countries. Int J Tuberc Lung Dis 2009; 13: 645–51.
7. Foreign-born population (indicator). 2016. Available at: https://data.oecd.org/migration/foreign-born-population.htm#indicator-chart (accessed 19.01.2016).
8. Lamb GS, Starke JR. Tuberculosis in Infants and Children. Microbiol Spectr 2017; 5 (2): 1–27.
9. Mandal N, Anand PK, Gautam S et al. Diagnosis and treatment of paediatric tuberculosis: An insight review. Crit Rev Microbiol 2017; 43 (4): 466–80.
10. Britton P, Perez-Velez CM, Marais BJ. Diagnosis, treatment and prevention of tuberculosis in children. N S W Public Health Bull 2013; 24 (1): 15–21.
11. Carvalho I, Goletti D, Manga S et al. Managing latent tuberculosis infection and tuberculosis in children. Pulmonology 2018; 24 (2):
106–14.
28 декабря 2023
Количество просмотров: 1102
