Клинический разбор в общей медицине №9 2023
In December 2023 an Endocrine Health Day expert workshop was held that involved more than 50 experts in gynecological endocrinology and menopausal hormone therapy from all regions of Russia. During the expert meeting, the issues related to management of women at their late repro-ductive and postreproductive (menopause) stages most important for clinicians were discussed. The leading experts discussed the upward trends of car-diovascular risk factors in the female population, the role of progesterone at the late reproductive stage and during perimenopause, treatment options for menstrual disorders during this period. The workshop was focused mainly on menopausal hormone therapy (MHT) selection and principles of MHT prescription to patients with premature ovarian failure and peri- and postmenopausal patients with comorbidities, management options for thrombosis risk in terms of evidence-based medicine, features of MHT selection in patients with metabolic disorders.
Keywords: late reproductive stage, perimenopause, menopausal hormone therapy, cardiovascular risk, metabolic disorders.
For citation: Expert council safeguarding female endocrine health. Clinical review for general practice. 2023; 4 (9): 85–92 (In Russ.). DOI: 10.47407/kr2023.4.9.00314
В декабре 2023 г. состоялось рабочее совещание экспертов «День гормонального здоровья», в рамках которого обсуждались важнейшие для клиницистов проблемы менопаузального возраста.
им. М.Ф. Владимирского».
Известно, что колебания менструального цикла (МЦ) отражают снижение уровня прогестерона и числа гормонпродуцирующих фолликулов. Этот период начинается с нарушения регулярности МЦ, сигнализирующего о снижении гормональной секреции эстрадиола и прогестерона, поэтому для профилактики гиперпластических процессов эндометрия и регуляции МЦ женщинам в периоде менопаузального перехода рекомендуется назначение монотерапии прогестагенами. Еще одним сигналом наступления переходного периода становится увеличение массы тела. В поздний репродуктивный и перименопаузальный период происходит прогрессирование метаболических нарушений.
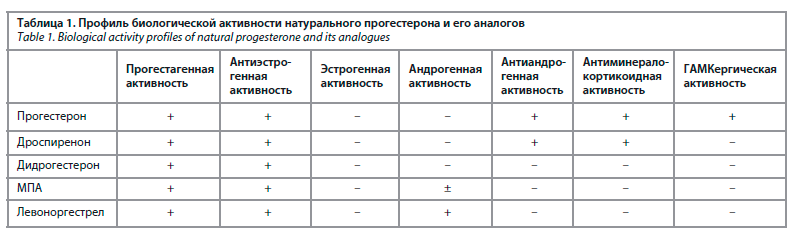
Результаты российского многоцентрового наблюдательного исследования показали эффективность терапии нарушений МЦ микронизированным прогестероном. Он обладает плейотропным действием, играя большую роль не только во время беременности, но и в перименопаузальный период, выступая естественным положительным модулятором нейрональных ГАМК-рецепторов, обладая, по данным разных авторов, антидепрессивным, антистрессовым, седативным и анксиолитическим эффектами. Низкие уровни прогестерона в период перименопаузы могут быть ассоциированы с аффективными симптомами, усилением некоторых психосоматических синдромов, изменением эмоционального фона. Прогестерон оказывает моделирующее влияние на настроение женщины, непосредственно влияет на центральную нервную систему через ядерные и мембранные прогестероновые рецепторы, опосредованно является источником для синтеза аллопрегнанолона, который взаимодействует с ГАМКергической системой центральной нервной системы (табл. 1).
Европейские исследователи отметили прямую корреляцию между уровнями аллопрегнанолона в крови и временем, прошедшим с момента последней менструации, интенсивностью климактерических симптомов, проявлениями депрессии и степенью нарушения сна. Канадские и американские ученые продемонстрировали снижение симптомов депрессии у женщин в перименопаузе на фоне приема менопаузальной гормональной терапии (МГТ) с микронизированным прогестероном. К другим внерепродуктивным эффектам препарата относят благоприятное влияние на костный метаболизм и снижение риска венозных тромбозов.
Нарушения овуляции проявляются симптомами, связанными с менструацией: изменением частоты или регулярности, продолжительными или обильными менструальными кровотечениями или даже их полным отсутствием (аменореей). На дальней границе репродуктивного возраста (после 45 лет), когда женщины вступают в менопаузальный переход, цикл становится более редким или нерегулярным и завершается аменореей. Согласно отечественным клиническим рекомендациям, микронизированный прогестерон можно использовать в диагностических целях: пациенткам с аменореей после исключения беременности для оценки степени выраженности гипоэстрогении и маточной формы аменореи рекомендуется провести пробу с прогестагенами (10-дневный прием микронизированного прогестерона 400 мг/сут или дидрогестерона 20 мг/сут). Появление закономерной менструальноподобной реакции (положительная проба) позволяет исключить маточную форму аменореи и низкую эстрогенную насыщенность. Микронизированный прогестерон может стать компонентом лечебной гормонзаместительной стратегии: так, в документах прописана возможность назначения его в циклическом режиме в сочетании с эстрадиолом пациенткам с первичным гипогонадотропным гипогонадизмом (в том числе синдромом Каллмана), послеродовым гипопитуитаризмом (синдром Шихана), при преждевременной недостаточности яичников (ПНЯ). Учитывая наличие у пациенток в периоде менопаузального перехода относительной гиперэстрогении, назначение микронизированного прогестерона при наличии нарушений МЦ целесообразно также с позиции профилактики гиперпластических процессов эндометрия. Как было показано в исследовании, опубликованном в 2023 г., применение микронизированного прогестерона у женщин в период менопаузального перехода у пациенток с простой гиперплазией без атипии так же эффективно в отношение регресса гиперплазии, как и применение левоноргестрелсодержащей внутриматочной системы, и сопряжено с меньшим риском побочных эффектов. Также на фоне интравагинального применения микронизированного прогестерона было отмечено меньше эпизодов кровомазания и кровотечений по сравнению с левоноргестрелсодержащей внутриматочной системой (ВМС-ЛНГ). По данным опросника MCQ, пациентки, получавшие микронизированный прогестерон, также отметили существенное улучшение качества жизни.
Балан, доктор медицинских наук, профессор, руководитель поликлинического отделения ГБУЗ МО МОНИИАГ, президент Междисциплинарной ассоциации специалистов по здоровому старению и антивозрастной медицине, профессор кафедры акушерства и гинекологии факультета усовершенствования врачей ГБУЗ МО «МОНИКИ им. М.Ф. Владимирского».
Согласно статистике, ССЗ – это главная причина смертности женщин. Повышение риска ССЗ выявляется у 37,2% женщин в возрасте 40–59 лет, 71,9% – 60–79 лет и у 86,7% – старше 80 лет. Частота ишемической болезни сердца (ИБС) увеличивается уже в перименопаузе, но экспоненциально возрастает в постменопаузе. Показана связь между возрастом наступления менопаузы и ССЗ: более раннее наступление менопаузы ассоциировано с повышенными рисками. В частности, у женщин с ранней менопаузой и ПНЯ повышается риск смерти от ИБС по сравнению с женщинами с нормальным возрастом естественной менопаузы, а если женщины вступают в менопаузу до 45 лет, повышается риск развития артериальной гипертензии. Женщины с естественной ранней менопаузой имеют более высокую генетическую предрасположенность к ССЗ.
Эндотелиальная дисфункция – центральный механизм формирования различных форм ИБС, связанных как с классическими, так и со специфическими факторами риска ССЗ. Функциональные изменения сосудистой стенки начинаются на самых ранних стадиях репродуктивного старения. Назначение МГТ в период пери- и ранней постменопаузы способствует снижению риска ССЗ за счет протективных механизмов эстрогенов: усиления ангиогенеза и расширения сосудов, уменьшения фиброза и окислительного стресса, защиты эндотелия.
Гормональная терапия должна стартовать не позже периода перименопаузы, что позволяет нормализовать пока еще обратимые изменения артериальной функции с возможностью частично восстановить состояние эндотелия. Согласно исследованию, у тех пациенток, кому гормональная терапия была назначена в переходный период, снижения индекса растяжимости артерий в постменопаузу не происходило. У женщин с приливами МГТ устраняет эндотелиальную дисфункцию и повышает чувствительность к инсулину, снижает частоту заболеваний коронарных артерий. Согласно теории «терапевтического окна», МГТ оказывает благоприятный эффект у женщин, недавно вступивших в менопаузу, с приливами и здоровыми коронарными артериями.
МГТ способствует устранению возникающих в менопаузальном переходе обменных и вегетативных сдвигов и коррекции начинающихся со стороны сердечно-сосудистой системы изменений. С помощью сцинтиграфических методик показано, что МГТ улучшает микроциркуляцию и метаболизм миокарда. Доказано, что терапия эстрогенами может оказывать кардиопротективное действие, если она начата в период, близкий ко времени наступления менопаузы (и может причинять вред, если она начата более чем через 10 лет после менопаузы). Считается, что вклад МГТ в снижение смертности у женщин существенно выше, чем вклад гиполипидемических средств и ацетилсалициловой кислоты.
Отдельное внимание в докладе было уделено принципу индивидуализации МГТ. Для женщин, имеющих сердечно-сосудистые факторы риска, в том числе полоспецифичные, предпочтительным является назначение трансдермальных эстрогенов (ТДЭ) в комбинации с микронизированным прегестероном. Национальное регистрационное исследование Дании показало статистически значимое снижение развития инфаркта миокарда при трансдермальном применении эстрогенов.
Специфические для женщин факторы риска развития ССЗ:
• Ранний возраст менархе.
• Масса тела ребенка при рождении более 4 кг.
• Гестационный СД.
• Прибавка массы тела более 12 кг за беременность.
• Преэклампсия.
• Число беременностей в жизни.
• Невынашивание беременностей.
• Возраст наступления последней беременности.
• Возраст наступления менопаузы и длительность
постменопаузы.
Последствия этого заболевания однозначно негативны: возрастание риска сексуальной дисфункции в 2,8 раза, повышение уровня депрессии, тревожности, стресса, снижение самооценки и качества жизни, нарушение когнитивной функции, повышение риска остеопороза, сердечно-сосудистых и цереброваскулярных заболеваний. У пациенток с ПНЯ дислипидемия становится фактором риска ССЗ: в исследованиях у больных отмечен достоверно более высокий уровень липопротеидов низкой плотности по сравнению с контрольной группой, поэтому для профилактики риска ССЗ женщинам с ПНЯ необходимо проводить ранний скрининг и контроль метаболического здоровья.
ПНЯ повышает даже риски летальных исходов: продолжительность жизни может стать на два года короче, чем у женщин с естественной менопаузой. Но ЗГТ может снизить заболеваемость и смертность в этой группе населения. Показано, что у женщин с ПНЯ, использующих ЗГТ, по сравнению с контрольной группой с сохраненной функцией яичников наблюдаются одинаковые уровни глюкозы, инсулина, индекса инсулинорезистентности (HOMA-IR), липопротеидов низкой плотности. Имеются данные о том, что у женщин с ПНЯ, принимавших ЗГТ, не выявлено худших кардиометаболических маркеров или сопутствующих заболеваний по сравнению с женщинами того же возраста и индекса массы тела (ИМТ) с сохраненной функцией яичников.
На базе ФГБУ «НМИЦ АГП им. В.И. Кулакова» в 2022 г. было проведено исследование, целью которого стал анализ удовлетворенности лечением различными схемами ЗГТ у 223 пациенток с ПНЯ. Пациентки применяли комбинированные оральные контрацептивы (КОК), комбинированные пероральные эстроген-гестагенные препараты и свободные комбинации трансдермального эстрадиола с микронизированным прогестероном. Использовались низкие, стандартные и высокие дозы эстрогенов.
Согласно полученным результатам, 50–60% пациенток, которые принимали ЗГТ, содержащие стандартные дозы эстрогенов, были удовлетворены лечением. Низкие показатели удовлетворенности лечением отмечались среди пациенток, которые принимали ЗГТ с низкой дозой эстрадиола и КОК. И все пациентки, которые принимали ЗГТ с дозой эстрадиола, превышающей стандартную, были удовлетворены лечением. На основе полученных данных высказано предположение о том, что ЗГТ, содержащая низкие и, в ряде случаев, стандартные дозы эстрадиола, не позволяет полностью купировать симптомы эстрогенодефицита у женщин с ПНЯ и обеспечивать высокий уровень качества жизни.
Авторы еще одной работы, реализованной на этой же базе, поставили перед собой цель сравнить качество жизни женщин с сохраненной функцией яичников и пациенток с ПНЯ, использующих ЗГТ с низкой, стандартной и высокой дозой эстрадиола и КОК. Анализ качества жизни пациенток с ПНЯ показал, что общий балл интегрального показателя психического и физического компонента здоровья зависел от дозы эстрогенного компонента в составе ЗГТ: к нормальному
50-балльному порогу приблизились оценки только тех участниц, которые принимали высокодозированную, а не самую часто назначаемую ЗГТ со стандартной дозой эстрадиола. Улучшение показателей качества жизни с увеличением дозы эстрадиола в составе ЗГТ соответствует результатам анализа удовлетворенности лечением пациенток с ПНЯ: положительная оценка терапии в 100% случаев была дана только пациентками, которые использовали высокодозированную ЗГТ, тогда как пользователи наиболее часто назначаемой ЗГТ со стандартной дозой эстрадиола были довольны терапией только в 55% случаев.
Таким образом, основная стратегия для улучшения качества жизни женщин с ПНЯ – это адекватное восполнение дефицита эстрогенов путем назначения достаточных доз ЗГТ.
При ПНЯ парентеральные пути введения эстрогенов имеют преимущества из-за отсутствия первичного прохождения через печень и минимизации протромботических эффектов. Женщины с ранней (<40 лет) и поздней (>55 лет) менопаузой имеют больший (в 1,5–1,8 раза) риск наступления венозной тромбоэмболии (ВТЭ) по сравнению с женщинами с возрастом прихода менопаузы в 40–49 лет, поэтому важно, чтобы женщины, имеющие такие риски, получали трансдермальные формы эстрогенов. Это подтверждают и клинические рекомендации, согласно которым стоит отдавать предпочтение трансдермальному пути введения эстрогенов у женщин с климактерическими симптомами и наличием коморбидных состояний. Согласно клиническим рекомендациям, пациенткам с ПНЯ могут потребоваться более высокие дозы эстрадиола в составе ЗГТ для купирования менопаузальных симптомов и профилактики постменопаузального остеопороза. Учитывая благоприятный профиль безопасности ТДЭ и необходимость длительного лечения, следует отдавать предпочтение парентеральному пути введения эстрогенов в составе ЗГТ.
Предполагается, что использование микронизированного прогестерона в составе комбинированной ЗГТ имеет преимущества в виде отсутствия тромбогенности и меньшего риска развития рака молочной железы (РМЖ). Дозы эстрогенов должны быть выше, чем при МГТ, это же касается и доз прогестерона: при ПНЯ стандартных доз может не хватить для защиты эндометрия. Когда необходимо применение прогестагенов, наиболее безопасным представляется микронизированный прогестерон. Пероральный прием микронизированного прогестерона (например, Утрожестана) оказывает средневыраженный седативный эффект, улучшает сон и не оказывает влияния на когнитивные функции в дневное время, что может быть связано с воздействием на ГАМК-рецепторы.
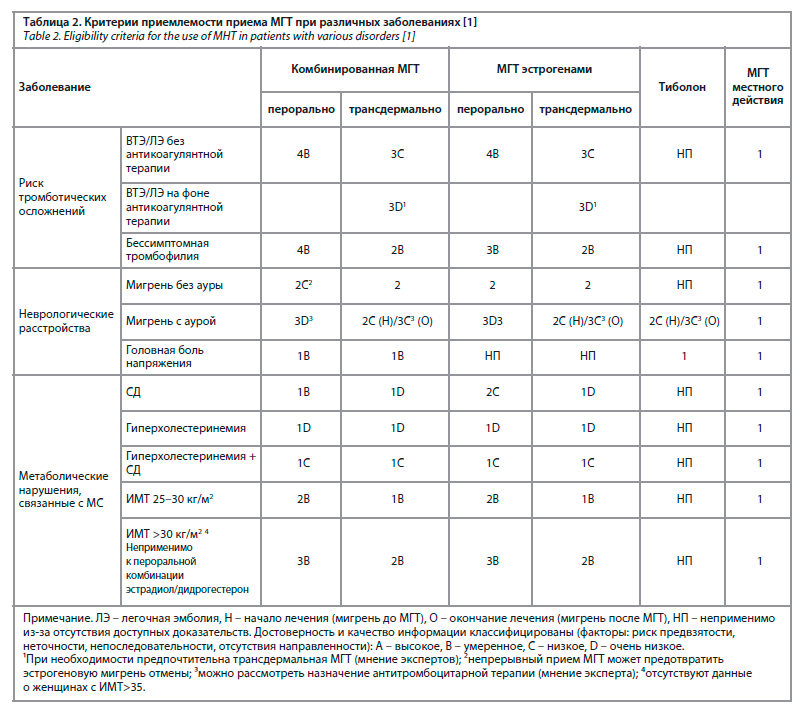
Критерии приемлемости приема МГТ дифференцированы в зависимости от заболевания (табл. 2).
Так, исследования показывают, что эстроген-прогестагенная терапия либо не влияет на массу тела, либо связана с меньшим увеличением массы у женщин, которые ее используют, чем у женщин, не получающих МГТ. Однако, учитывая, что ожирение само по себе – это независимый фактор риска развития ВТЭ, инсульта и инфаркта, необходимо индивидуализированно подходить к выбору варианта МГТ у пациенток с ожирением. Были приведены данные исследования ESTER, в котором было достоверно продемонстрировано, что при использовании ТДЭ у пациенток с ожирением риск ВТЭ в 5 раз ниже, чем при применении пероральных эстрогенов (ПОЭ).
В клинических рекомендациях «Менопауза и климактерическое состояние у женщины» от 2021 г. ожирение включено в перечень коморбидных состояний, при которых предпочтительно назначение ТДЭ. Это лечение может быть рассмотрено в качестве терапии менопаузальных симптомов у пациенток с СД 2, поскольку оказывает благоприятный эффект (который прекращается при отмене терапии) на углеводный обмен. Согласно клиническим исследованиям, с точки зрения влияния на липопротеиды высокой и низкой плотности эффекты ПОЭ и ТДЭ сопоставимы. При этом важно, что применение ТДЭ в отличие от пероральных не приводит к гипертриглицеридемии, которая является самостоятельным сердечно-сосудистым фактором риска. При своевременном назначении в периоде перименопаузы ранний прием МГТ может оказать не только профилактическое, но и лечебное воздействие на сердечно-сосудистую систему.
При неалкогольной жировой болезни печени и варикозном расширении вен предпочтительна трансдермальная терапия, она же становится объектом выбора при ожирении. При бронхиальной астме рекомендуется применять эстрогены, идентичные натуральным (17b-эстрадиол или его эфиры), с обязательной комбинацией их с прогестагенами: МГТ в этом режиме не только хорошо переносится, но и способствует предупреждению обострений болезни, уменьшению дозы ингаляционных и системных глюкокортикостероидов.
Назначение ПОЭ сопровождается самой высокой частотой тромботических событий, однако и в этой группе лекарственных средств важную роль играет тип эстрогена: у эстрадиола частота ВТЭ меньше, чем у конъюгированных лошадиных эстрогенов. Важен и тип гестагена: например, медроксипрогестерона ацетат (МПА) и производные непрегнанового ряда увеличивают вероятность венозного тромбоза практически в 2,5 раза. Дополнительно риски ВТЭ увеличиваются при добавлении этих гестагенов к любому эстрогенному компоненту.
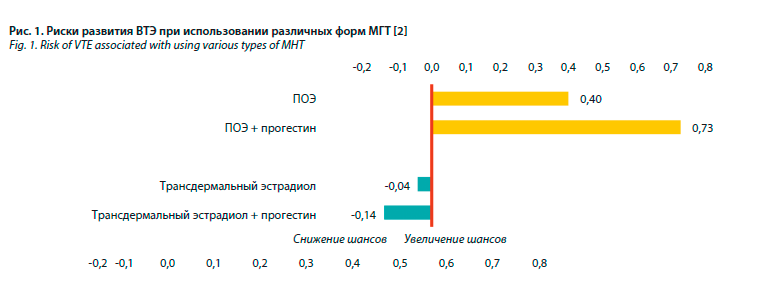
В когортном исследовании «случай–контроль» (2019 г.) оценивали риск ВТЭ при использовании разных типов МГТ. Ученые отметили, что повышение риска ВТЭ при монотерапии трансдермальным эстрадиолом и при использовании комбинации трансдермальный эстрадиол + прогестин отсутствует (рис. 1), в то время как при терапии ПОЭ риск повышается вне зависимости от наличия прогестина.
Систематический обзор медицинских баз MEDLINE, EMBASE, Cochrane и ClinicalTrials.gov, включивший 9 исследований «случай–контроль», 9 когортных исследований и 4 рандомизированных клинических исследования, показал снижение риска ВТЭ при использовании ТДЭ (как в монотерапии, так и в сочетании с прогестином) в отличие от пероральных – это позволяет утверждать, что трансдермальный путь введения эстрадиола является наиболее безопасным в отношении венозных тромбоэмболических осложнений (ВТЭО) по сравнению с пероральным.
Важным вопросом в плане венозных тромбозов становится период начала МГТ. Объединенный анализ данных датских популяционных когортных исследований (88 914 женщин) показал, что ранняя инициация МГТ не связана с повышенным риском развития острых нарушений мозгового кровообращения (ОНМК) независимо от типа МГТ. Назначение МГТ в течение 5 лет после наступления менопаузы ассоциировано со снижением риска развития ОНМК по сравнению с отказом от терапии. Использование ТДЭ не было связано с повышенным риском развития ОНМК как при раннем, так и при позднем начале МГТ. А позднее начало комбинированной МГТ связано с риском развития ОНМК по геморрагическому типу.
Согласно клиническим исследованиям, при применении ТДЭ у пациенток с ожирением риск ВТЭ в 5 раз ниже, чем при применении ПОЭ (исследование
ESTER). В завершение доклада Лейля Рафаэлевна привела выдержку из документа, опубликованного в октябре 2023 г. на сайте Международной ассоциации по менопаузе (IMS), «Белая книга» (White Paper): «Для женщин с риском ССЗ предпочтительнее трансдермальная терапия эстрадиолом и микронизированным прогестероном, если это необходимо для защиты матки. Трансдермальные препараты эстрадиола в меньшей степени влияют на факторы свертывания крови, показатели артериального давления, триглицеридов, С-реактивного белка и глобулина, связывающего половые гормоны, и в низких дозах предпочтительны для женщин с риском ВТЭ, гипертензией, гипертриглицеридемией, ожирением, МС, диабетом и болезнью желчного пузыря в анамнезе. Нейтральным в отношении риска тромбоза считается микронизированный прогестерон».
Ознакомиться с документом «White Paper»на русском языке на сайте IMS
Комбинация трансдермального эстрадиола и прогестерона представляется более безопасным вариантом МГТ. Результаты исследования позволяют предполагать, что 2 мес. терапии трансдермальным эстрадиолом в комбинации с микронизированным прогестероном обладают менее выраженными неблагоприятными эффектами в отношении пролиферации нормальных клеток молочной железы in vivo. Важно помнить, что МГТ не влияет на клиническую картину доброкачественных заболеваний молочной железы у женщин в постменопаузе и у женщин с повышенным риском развития РМЖ (отягощенный наследственный анамнез).
Согласно данным российских и зарубежных клинических рекомендаций и гайдлайнов по МГТ, ТДЭ имеют более благоприятный профиль безопасности в отношении ВТЭО, чем эквивалентные дозы ПОЭ; риск ВТЭО при ТДЭ не превышает исходный популяционный риск, в отличие от ПОЭ, которые повышают риск ВТЭ в общей популяции в 1,7 раза по сравнению с плацебо. Более низкие дозы ПОЭ в меньшей степени ассоциированы с риском ВТЭ, чем высокие; при трансдермальном применении эстрогенов риск ВТЭ отсутствует.
Выбор прогестагена также может влиять на риск ВТЭ, при этом микронизированный прогестерон считается потенциально менее тромбогенным (биоидентичный прогестерон не связан с повышенным риском ВТЭ в отличие от синтетических прогестинов), а риск ВТЭО при сочетании ТДЭ и перорального микронизированного прогестерона или дидрогестерона нейтрален. При повышении риска ВТЭО следует назначать ТДЭ в сочетании с дидрогестероном или микронизированным прогестероном. У женщин с ВТЭ в анамнезе ПОЭ повышает риск рецидивов, поэтому этот тип препаратов МГТ им противопоказан. ТДЭ следует рассматривать в качестве терапии первой линии у женщин с соответствующими факторами риска (повышение артериального давления и ИМТ, ожирение) и с повышенными рисками развития ВТЭО, включая ИМТ>30 кг/м² (в монотерапии или в сочетании с микронизированным прогестероном). Вне зависимости от ИМТ, терапия эстрадиолом как в монорежиме, так и в комбинации с любым гестагеном в целом нейтральна в отношении риска ВТЭ.
Сегодня алгоритм принятия решений о приемлемости назначения МГТ основывается на трех «да» и трех «нет» (рис. 2).
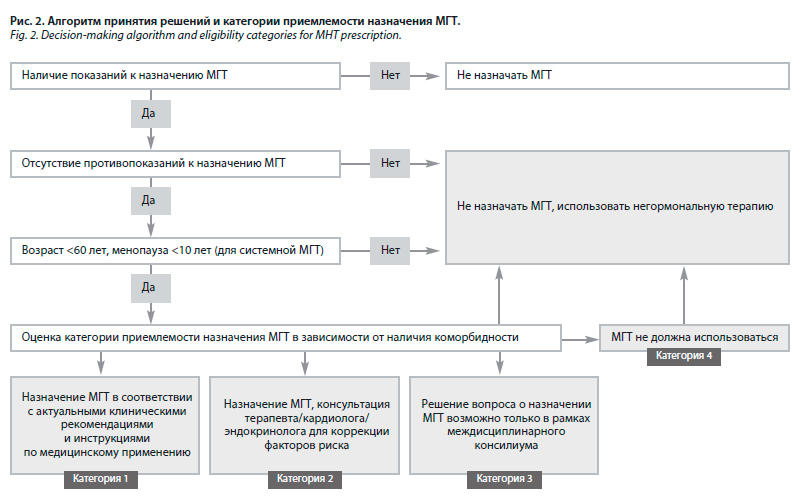
Клиницист должен ответить на три базовых вопроса о наличии показаний и отсутствии противопоказаний для проведения лечения, а также оценить возраст женщины и длительность менопаузы. Решающим фактором в выборе препарата может стать наличие коморбидных состояний.
В заключительной дискуссии кардиолог Виктория Борисовна Мычка, доктор медицинских наук, профессор, выступила с предложением включить в список коморбидных состояний, при которых предпочтительно назначение ТДЭ, СД 2 и МС, так как согласно обширной доказательной базе СД 2 и МС – это самостоятельные факторы сердечно-сосудистого риска.
В.Б. Мычка обратила внимание аудитории на тот факт, что СД 2 и МС не бывают без осложнений. Эти состояния всегда сопровождаются эндотелиальной дисфункцией. Докладчица привела цитату академика В.Н. Серова, который, выступая на конгрессе «Мать и дитя» в сентябре 2023 г., предложил рассматривать МС как тромбофилическое состояние.
Предложение Виктории Борисовны было поддержано со стороны эндокринологов. В частности, доктор медицинских наук Ирэна Адольфовна Иловайская отметила, что на приеме эндокринолога в ее клинической практике еще не встречались пациенты с СД 2, у которых течение этого заболевания не сопровождалось бы наличием сердечно-сосудистых осложнений. Также В.Б. Мычка предложила внести изменения в отношении артериальной гипертензии и рассматривать предпочтительное назначение ТДЭ, ориентируясь не на показатели артериального давления выше 170/100 мм рт. ст., как в указано в клинических рекомендациях «Менопауза и климактерическое состояние у женщины» от 2021 г., а на сам факт наличия диагноза «артериальная гипертензия» (артериальное давление ≥140/90 мм рт. ст.), так как доказано, что у женщин, в отличие от мужчин, даже 1-я степень повышения артериального давления является фактором высокого риска сердечно-сосудистых осложнений (например, инсульта).
Завершила дискуссию Лариса Ивановна Мальцева, доктор медицинских наук, профессор кафедры акушерства и гинекологии ФГБОУ ВО «Казанский ГМУ». Она отметила оптимальный профиль безопасности трансдермальных форм эстрадиола, особенно в отношении инициации МГТ, учитывая трудности тщательного сбора анамнеза, как личного, так и наследственного, и достоверной оценки кардиоваскулярного риска у большинства пациенток на рутинном приеме у врача акушера-гинеколога.
Редакционный материал. Обзор подготовлен по материалам рабочего совещания экспертов «День гормонального здоровья» (09.12.2023).
Клинический разбор в общей медицине №9 2023
Совет экспертов на страже гормонального здоровья женщины
Номера страниц в выпуске:85-92
Аннотация
В декабре 2023 г. состоялось рабочее совещание экспертов «День гормонального здоровья», в котором принимали участие более пятидесяти экспертов в области гинекологической эндокринологии и менопаузальной гормональной терапии (МГТ) из всех регионов России. В рамках совещания экспертов обсуждались важнейшие для клиницистов проблемы ведения женщин позднего репродуктивного и пострепродуктивного («менопаузального») возраста. Ведущие специалисты обсудили тенденции повышения сердечно-сосудистых факторов риска в женской популяции, роль прогестерона в позднем репродуктивном периоде и перименопаузе, возможности терапии нарушений менструального цикла в этот период. Большая часть заседания была посвящена подбору МГТ и принципам ее назначения пациенткам с преждевременной недостаточностью яичников и коморбидным пациенткам в пери- и постменопаузе, возможностям управления тромботическими рисками с позиции доказательной медицины, особенностям выбора МГТ у пациенток с метаболическими нарушениями.
Ключевые слова: поздний репродуктивный период, перименопауза, менопаузальная гормональная терапия, сердечно-сосудистый риск, метаболические нарушения.
Для цитирования: Совет экспертов на страже гормонального здоровья женщины. Клинический разбор в общей медицине. 2023; 4 (9): 85–92. DOI: 10.47407/kr2023.4.9.00314
В декабре 2023 г. состоялось рабочее совещание экспертов «День гормонального здоровья», в котором принимали участие более пятидесяти экспертов в области гинекологической эндокринологии и менопаузальной гормональной терапии (МГТ) из всех регионов России. В рамках совещания экспертов обсуждались важнейшие для клиницистов проблемы ведения женщин позднего репродуктивного и пострепродуктивного («менопаузального») возраста. Ведущие специалисты обсудили тенденции повышения сердечно-сосудистых факторов риска в женской популяции, роль прогестерона в позднем репродуктивном периоде и перименопаузе, возможности терапии нарушений менструального цикла в этот период. Большая часть заседания была посвящена подбору МГТ и принципам ее назначения пациенткам с преждевременной недостаточностью яичников и коморбидным пациенткам в пери- и постменопаузе, возможностям управления тромботическими рисками с позиции доказательной медицины, особенностям выбора МГТ у пациенток с метаболическими нарушениями.
Ключевые слова: поздний репродуктивный период, перименопауза, менопаузальная гормональная терапия, сердечно-сосудистый риск, метаболические нарушения.
Для цитирования: Совет экспертов на страже гормонального здоровья женщины. Клинический разбор в общей медицине. 2023; 4 (9): 85–92. DOI: 10.47407/kr2023.4.9.00314
Expert council safeguarding female endocrine health
AbstractIn December 2023 an Endocrine Health Day expert workshop was held that involved more than 50 experts in gynecological endocrinology and menopausal hormone therapy from all regions of Russia. During the expert meeting, the issues related to management of women at their late repro-ductive and postreproductive (menopause) stages most important for clinicians were discussed. The leading experts discussed the upward trends of car-diovascular risk factors in the female population, the role of progesterone at the late reproductive stage and during perimenopause, treatment options for menstrual disorders during this period. The workshop was focused mainly on menopausal hormone therapy (MHT) selection and principles of MHT prescription to patients with premature ovarian failure and peri- and postmenopausal patients with comorbidities, management options for thrombosis risk in terms of evidence-based medicine, features of MHT selection in patients with metabolic disorders.
Keywords: late reproductive stage, perimenopause, menopausal hormone therapy, cardiovascular risk, metabolic disorders.
For citation: Expert council safeguarding female endocrine health. Clinical review for general practice. 2023; 4 (9): 85–92 (In Russ.). DOI: 10.47407/kr2023.4.9.00314
В декабре 2023 г. состоялось рабочее совещание экспертов «День гормонального здоровья», в рамках которого обсуждались важнейшие для клиницистов проблемы менопаузального возраста.
Поздний репродуктивный период и перименопауза. Роль прогестерона
Гормональным изменениям в позднем репродуктивном периоде и при переходе к менопаузе было посвящено выступление Ирэны Адольфовны Иловайской, доктора медицинских наук, руководителя отделения нейроэндокринных заболеваний отдела общей эндокринологии, профессора курса частной эндокринологии при кафедре эндокринологии факультета усовершенствования врачей ГБУЗ МО «МОНИКИим. М.Ф. Владимирского».
Известно, что колебания менструального цикла (МЦ) отражают снижение уровня прогестерона и числа гормонпродуцирующих фолликулов. Этот период начинается с нарушения регулярности МЦ, сигнализирующего о снижении гормональной секреции эстрадиола и прогестерона, поэтому для профилактики гиперпластических процессов эндометрия и регуляции МЦ женщинам в периоде менопаузального перехода рекомендуется назначение монотерапии прогестагенами. Еще одним сигналом наступления переходного периода становится увеличение массы тела. В поздний репродуктивный и перименопаузальный период происходит прогрессирование метаболических нарушений.
Результаты российского многоцентрового наблюдательного исследования показали эффективность терапии нарушений МЦ микронизированным прогестероном. Он обладает плейотропным действием, играя большую роль не только во время беременности, но и в перименопаузальный период, выступая естественным положительным модулятором нейрональных ГАМК-рецепторов, обладая, по данным разных авторов, антидепрессивным, антистрессовым, седативным и анксиолитическим эффектами. Низкие уровни прогестерона в период перименопаузы могут быть ассоциированы с аффективными симптомами, усилением некоторых психосоматических синдромов, изменением эмоционального фона. Прогестерон оказывает моделирующее влияние на настроение женщины, непосредственно влияет на центральную нервную систему через ядерные и мембранные прогестероновые рецепторы, опосредованно является источником для синтеза аллопрегнанолона, который взаимодействует с ГАМКергической системой центральной нервной системы (табл. 1).

Европейские исследователи отметили прямую корреляцию между уровнями аллопрегнанолона в крови и временем, прошедшим с момента последней менструации, интенсивностью климактерических симптомов, проявлениями депрессии и степенью нарушения сна. Канадские и американские ученые продемонстрировали снижение симптомов депрессии у женщин в перименопаузе на фоне приема менопаузальной гормональной терапии (МГТ) с микронизированным прогестероном. К другим внерепродуктивным эффектам препарата относят благоприятное влияние на костный метаболизм и снижение риска венозных тромбозов.
Функциональные нарушения менструального цикла
Возможности диагностики аменореи и коррекции нарушений овуляции с помощью микронизированного прогестерона продемонстрировала Антонина Александровна Сметник, кандидат медицинских наук, заведующая отделением гинекологической эндокринологии ФГБУ «НМИЦ АГП им. В.И. Кулакова», президент Российского общества специалистов по гинекологической эндокринологии и менопаузе, член правления Европейского общества по менопаузе и андропаузе.Нарушения овуляции проявляются симптомами, связанными с менструацией: изменением частоты или регулярности, продолжительными или обильными менструальными кровотечениями или даже их полным отсутствием (аменореей). На дальней границе репродуктивного возраста (после 45 лет), когда женщины вступают в менопаузальный переход, цикл становится более редким или нерегулярным и завершается аменореей. Согласно отечественным клиническим рекомендациям, микронизированный прогестерон можно использовать в диагностических целях: пациенткам с аменореей после исключения беременности для оценки степени выраженности гипоэстрогении и маточной формы аменореи рекомендуется провести пробу с прогестагенами (10-дневный прием микронизированного прогестерона 400 мг/сут или дидрогестерона 20 мг/сут). Появление закономерной менструальноподобной реакции (положительная проба) позволяет исключить маточную форму аменореи и низкую эстрогенную насыщенность. Микронизированный прогестерон может стать компонентом лечебной гормонзаместительной стратегии: так, в документах прописана возможность назначения его в циклическом режиме в сочетании с эстрадиолом пациенткам с первичным гипогонадотропным гипогонадизмом (в том числе синдромом Каллмана), послеродовым гипопитуитаризмом (синдром Шихана), при преждевременной недостаточности яичников (ПНЯ). Учитывая наличие у пациенток в периоде менопаузального перехода относительной гиперэстрогении, назначение микронизированного прогестерона при наличии нарушений МЦ целесообразно также с позиции профилактики гиперпластических процессов эндометрия. Как было показано в исследовании, опубликованном в 2023 г., применение микронизированного прогестерона у женщин в период менопаузального перехода у пациенток с простой гиперплазией без атипии так же эффективно в отношение регресса гиперплазии, как и применение левоноргестрелсодержащей внутриматочной системы, и сопряжено с меньшим риском побочных эффектов. Также на фоне интравагинального применения микронизированного прогестерона было отмечено меньше эпизодов кровомазания и кровотечений по сравнению с левоноргестрелсодержащей внутриматочной системой (ВМС-ЛНГ). По данным опросника MCQ, пациентки, получавшие микронизированный прогестерон, также отметили существенное улучшение качества жизни.
Полоспецифичные сердечно-сосудистые факторы риска у женщин
О связи менопаузы с риском развития сердечно-сосудистых заболеваний (ССЗ) говорила Вера ЕфимовнаБалан, доктор медицинских наук, профессор, руководитель поликлинического отделения ГБУЗ МО МОНИИАГ, президент Междисциплинарной ассоциации специалистов по здоровому старению и антивозрастной медицине, профессор кафедры акушерства и гинекологии факультета усовершенствования врачей ГБУЗ МО «МОНИКИ им. М.Ф. Владимирского».
Согласно статистике, ССЗ – это главная причина смертности женщин. Повышение риска ССЗ выявляется у 37,2% женщин в возрасте 40–59 лет, 71,9% – 60–79 лет и у 86,7% – старше 80 лет. Частота ишемической болезни сердца (ИБС) увеличивается уже в перименопаузе, но экспоненциально возрастает в постменопаузе. Показана связь между возрастом наступления менопаузы и ССЗ: более раннее наступление менопаузы ассоциировано с повышенными рисками. В частности, у женщин с ранней менопаузой и ПНЯ повышается риск смерти от ИБС по сравнению с женщинами с нормальным возрастом естественной менопаузы, а если женщины вступают в менопаузу до 45 лет, повышается риск развития артериальной гипертензии. Женщины с естественной ранней менопаузой имеют более высокую генетическую предрасположенность к ССЗ.
Эндотелиальная дисфункция – центральный механизм формирования различных форм ИБС, связанных как с классическими, так и со специфическими факторами риска ССЗ. Функциональные изменения сосудистой стенки начинаются на самых ранних стадиях репродуктивного старения. Назначение МГТ в период пери- и ранней постменопаузы способствует снижению риска ССЗ за счет протективных механизмов эстрогенов: усиления ангиогенеза и расширения сосудов, уменьшения фиброза и окислительного стресса, защиты эндотелия.
Гормональная терапия должна стартовать не позже периода перименопаузы, что позволяет нормализовать пока еще обратимые изменения артериальной функции с возможностью частично восстановить состояние эндотелия. Согласно исследованию, у тех пациенток, кому гормональная терапия была назначена в переходный период, снижения индекса растяжимости артерий в постменопаузу не происходило. У женщин с приливами МГТ устраняет эндотелиальную дисфункцию и повышает чувствительность к инсулину, снижает частоту заболеваний коронарных артерий. Согласно теории «терапевтического окна», МГТ оказывает благоприятный эффект у женщин, недавно вступивших в менопаузу, с приливами и здоровыми коронарными артериями.
МГТ способствует устранению возникающих в менопаузальном переходе обменных и вегетативных сдвигов и коррекции начинающихся со стороны сердечно-сосудистой системы изменений. С помощью сцинтиграфических методик показано, что МГТ улучшает микроциркуляцию и метаболизм миокарда. Доказано, что терапия эстрогенами может оказывать кардиопротективное действие, если она начата в период, близкий ко времени наступления менопаузы (и может причинять вред, если она начата более чем через 10 лет после менопаузы). Считается, что вклад МГТ в снижение смертности у женщин существенно выше, чем вклад гиполипидемических средств и ацетилсалициловой кислоты.
Отдельное внимание в докладе было уделено принципу индивидуализации МГТ. Для женщин, имеющих сердечно-сосудистые факторы риска, в том числе полоспецифичные, предпочтительным является назначение трансдермальных эстрогенов (ТДЭ) в комбинации с микронизированным прегестероном. Национальное регистрационное исследование Дании показало статистически значимое снижение развития инфаркта миокарда при трансдермальном применении эстрогенов.
Специфические для женщин факторы риска развития ССЗ:
• Ранний возраст менархе.
• Масса тела ребенка при рождении более 4 кг.
• Гестационный СД.
• Прибавка массы тела более 12 кг за беременность.
• Преэклампсия.
• Число беременностей в жизни.
• Невынашивание беременностей.
• Возраст наступления последней беременности.
• Возраст наступления менопаузы и длительность
постменопаузы.
Особенности назначения заместительной гормональной терапии при ПНЯ: вопросы эффективности и безопасности
Особенности назначения заместительной гормональной терапии (ЗГТ) при ПНЯ рассмотрела Мария Игоревна Ярмолинская, профессор РАН, доктор медицинских наук, профессор, заведующая отделом гинекологии и эндокринологии ФГБНУ «НИИ АГиР им. Д.О. Отта», руководитель Центра «Инновационных методов диагностики и лечения эндометриоза», профессор кафедры акушерства и гинекологии ФГБОУ ВО «СЗГМУ им. И.И. Мечникова», президент общества акушеров-гинекологов Санкт-Петербурга и СЗФО.Последствия этого заболевания однозначно негативны: возрастание риска сексуальной дисфункции в 2,8 раза, повышение уровня депрессии, тревожности, стресса, снижение самооценки и качества жизни, нарушение когнитивной функции, повышение риска остеопороза, сердечно-сосудистых и цереброваскулярных заболеваний. У пациенток с ПНЯ дислипидемия становится фактором риска ССЗ: в исследованиях у больных отмечен достоверно более высокий уровень липопротеидов низкой плотности по сравнению с контрольной группой, поэтому для профилактики риска ССЗ женщинам с ПНЯ необходимо проводить ранний скрининг и контроль метаболического здоровья.
ПНЯ повышает даже риски летальных исходов: продолжительность жизни может стать на два года короче, чем у женщин с естественной менопаузой. Но ЗГТ может снизить заболеваемость и смертность в этой группе населения. Показано, что у женщин с ПНЯ, использующих ЗГТ, по сравнению с контрольной группой с сохраненной функцией яичников наблюдаются одинаковые уровни глюкозы, инсулина, индекса инсулинорезистентности (HOMA-IR), липопротеидов низкой плотности. Имеются данные о том, что у женщин с ПНЯ, принимавших ЗГТ, не выявлено худших кардиометаболических маркеров или сопутствующих заболеваний по сравнению с женщинами того же возраста и индекса массы тела (ИМТ) с сохраненной функцией яичников.
На базе ФГБУ «НМИЦ АГП им. В.И. Кулакова» в 2022 г. было проведено исследование, целью которого стал анализ удовлетворенности лечением различными схемами ЗГТ у 223 пациенток с ПНЯ. Пациентки применяли комбинированные оральные контрацептивы (КОК), комбинированные пероральные эстроген-гестагенные препараты и свободные комбинации трансдермального эстрадиола с микронизированным прогестероном. Использовались низкие, стандартные и высокие дозы эстрогенов.
Согласно полученным результатам, 50–60% пациенток, которые принимали ЗГТ, содержащие стандартные дозы эстрогенов, были удовлетворены лечением. Низкие показатели удовлетворенности лечением отмечались среди пациенток, которые принимали ЗГТ с низкой дозой эстрадиола и КОК. И все пациентки, которые принимали ЗГТ с дозой эстрадиола, превышающей стандартную, были удовлетворены лечением. На основе полученных данных высказано предположение о том, что ЗГТ, содержащая низкие и, в ряде случаев, стандартные дозы эстрадиола, не позволяет полностью купировать симптомы эстрогенодефицита у женщин с ПНЯ и обеспечивать высокий уровень качества жизни.
Авторы еще одной работы, реализованной на этой же базе, поставили перед собой цель сравнить качество жизни женщин с сохраненной функцией яичников и пациенток с ПНЯ, использующих ЗГТ с низкой, стандартной и высокой дозой эстрадиола и КОК. Анализ качества жизни пациенток с ПНЯ показал, что общий балл интегрального показателя психического и физического компонента здоровья зависел от дозы эстрогенного компонента в составе ЗГТ: к нормальному
50-балльному порогу приблизились оценки только тех участниц, которые принимали высокодозированную, а не самую часто назначаемую ЗГТ со стандартной дозой эстрадиола. Улучшение показателей качества жизни с увеличением дозы эстрадиола в составе ЗГТ соответствует результатам анализа удовлетворенности лечением пациенток с ПНЯ: положительная оценка терапии в 100% случаев была дана только пациентками, которые использовали высокодозированную ЗГТ, тогда как пользователи наиболее часто назначаемой ЗГТ со стандартной дозой эстрадиола были довольны терапией только в 55% случаев.
Таким образом, основная стратегия для улучшения качества жизни женщин с ПНЯ – это адекватное восполнение дефицита эстрогенов путем назначения достаточных доз ЗГТ.
При ПНЯ парентеральные пути введения эстрогенов имеют преимущества из-за отсутствия первичного прохождения через печень и минимизации протромботических эффектов. Женщины с ранней (<40 лет) и поздней (>55 лет) менопаузой имеют больший (в 1,5–1,8 раза) риск наступления венозной тромбоэмболии (ВТЭ) по сравнению с женщинами с возрастом прихода менопаузы в 40–49 лет, поэтому важно, чтобы женщины, имеющие такие риски, получали трансдермальные формы эстрогенов. Это подтверждают и клинические рекомендации, согласно которым стоит отдавать предпочтение трансдермальному пути введения эстрогенов у женщин с климактерическими симптомами и наличием коморбидных состояний. Согласно клиническим рекомендациям, пациенткам с ПНЯ могут потребоваться более высокие дозы эстрадиола в составе ЗГТ для купирования менопаузальных симптомов и профилактики постменопаузального остеопороза. Учитывая благоприятный профиль безопасности ТДЭ и необходимость длительного лечения, следует отдавать предпочтение парентеральному пути введения эстрогенов в составе ЗГТ.
Предполагается, что использование микронизированного прогестерона в составе комбинированной ЗГТ имеет преимущества в виде отсутствия тромбогенности и меньшего риска развития рака молочной железы (РМЖ). Дозы эстрогенов должны быть выше, чем при МГТ, это же касается и доз прогестерона: при ПНЯ стандартных доз может не хватить для защиты эндометрия. Когда необходимо применение прогестагенов, наиболее безопасным представляется микронизированный прогестерон. Пероральный прием микронизированного прогестерона (например, Утрожестана) оказывает средневыраженный седативный эффект, улучшает сон и не оказывает влияния на когнитивные функции в дневное время, что может быть связано с воздействием на ГАМК-рецепторы.
Коморбидные пациенты и МГТ: принципы индивидуализации терапии
Профессор Вера Ефимовна Балан рассказала о принципах индивидуализации МГТ у коморбидных пациенток. К наиболее частым коморбидным при климактерических нарушениях состояниям относят висцеральное ожирение, метаболический синдром (МС), неалкогольную жировую болезнь печени, артериальную гипертензию, заболевания вен и щитовидной железы, сахарный диабет 2-го типа (СД 2). Поэтому клиницисту важно оценивать влияние назначаемого препарата МГТ на здоровье женщины.Критерии приемлемости приема МГТ дифференцированы в зависимости от заболевания (табл. 2).

Так, исследования показывают, что эстроген-прогестагенная терапия либо не влияет на массу тела, либо связана с меньшим увеличением массы у женщин, которые ее используют, чем у женщин, не получающих МГТ. Однако, учитывая, что ожирение само по себе – это независимый фактор риска развития ВТЭ, инсульта и инфаркта, необходимо индивидуализированно подходить к выбору варианта МГТ у пациенток с ожирением. Были приведены данные исследования ESTER, в котором было достоверно продемонстрировано, что при использовании ТДЭ у пациенток с ожирением риск ВТЭ в 5 раз ниже, чем при применении пероральных эстрогенов (ПОЭ).
В клинических рекомендациях «Менопауза и климактерическое состояние у женщины» от 2021 г. ожирение включено в перечень коморбидных состояний, при которых предпочтительно назначение ТДЭ. Это лечение может быть рассмотрено в качестве терапии менопаузальных симптомов у пациенток с СД 2, поскольку оказывает благоприятный эффект (который прекращается при отмене терапии) на углеводный обмен. Согласно клиническим исследованиям, с точки зрения влияния на липопротеиды высокой и низкой плотности эффекты ПОЭ и ТДЭ сопоставимы. При этом важно, что применение ТДЭ в отличие от пероральных не приводит к гипертриглицеридемии, которая является самостоятельным сердечно-сосудистым фактором риска. При своевременном назначении в периоде перименопаузы ранний прием МГТ может оказать не только профилактическое, но и лечебное воздействие на сердечно-сосудистую систему.
При неалкогольной жировой болезни печени и варикозном расширении вен предпочтительна трансдермальная терапия, она же становится объектом выбора при ожирении. При бронхиальной астме рекомендуется применять эстрогены, идентичные натуральным (17b-эстрадиол или его эфиры), с обязательной комбинацией их с прогестагенами: МГТ в этом режиме не только хорошо переносится, но и способствует предупреждению обострений болезни, уменьшению дозы ингаляционных и системных глюкокортикостероидов.
Управление тромботическими рисками МГТ с позиции доказательной медицины, клинических рекомендаций и здравого смысла
Важную тему возможных рисков венозного тромбоза на фоне приема МГТ обсудила с коллегами Ольга Вадимовна Дженина, кандидат медицинских наук, ведущий специалист-флеболог сети клиник «Первый флебологический центр».Назначение ПОЭ сопровождается самой высокой частотой тромботических событий, однако и в этой группе лекарственных средств важную роль играет тип эстрогена: у эстрадиола частота ВТЭ меньше, чем у конъюгированных лошадиных эстрогенов. Важен и тип гестагена: например, медроксипрогестерона ацетат (МПА) и производные непрегнанового ряда увеличивают вероятность венозного тромбоза практически в 2,5 раза. Дополнительно риски ВТЭ увеличиваются при добавлении этих гестагенов к любому эстрогенному компоненту.
В когортном исследовании «случай–контроль» (2019 г.) оценивали риск ВТЭ при использовании разных типов МГТ. Ученые отметили, что повышение риска ВТЭ при монотерапии трансдермальным эстрадиолом и при использовании комбинации трансдермальный эстрадиол + прогестин отсутствует (рис. 1), в то время как при терапии ПОЭ риск повышается вне зависимости от наличия прогестина.

Систематический обзор медицинских баз MEDLINE, EMBASE, Cochrane и ClinicalTrials.gov, включивший 9 исследований «случай–контроль», 9 когортных исследований и 4 рандомизированных клинических исследования, показал снижение риска ВТЭ при использовании ТДЭ (как в монотерапии, так и в сочетании с прогестином) в отличие от пероральных – это позволяет утверждать, что трансдермальный путь введения эстрадиола является наиболее безопасным в отношении венозных тромбоэмболических осложнений (ВТЭО) по сравнению с пероральным.
Важным вопросом в плане венозных тромбозов становится период начала МГТ. Объединенный анализ данных датских популяционных когортных исследований (88 914 женщин) показал, что ранняя инициация МГТ не связана с повышенным риском развития острых нарушений мозгового кровообращения (ОНМК) независимо от типа МГТ. Назначение МГТ в течение 5 лет после наступления менопаузы ассоциировано со снижением риска развития ОНМК по сравнению с отказом от терапии. Использование ТДЭ не было связано с повышенным риском развития ОНМК как при раннем, так и при позднем начале МГТ. А позднее начало комбинированной МГТ связано с риском развития ОНМК по геморрагическому типу.
Инсулинорезистентность, ожирение и СД: особенности выбора МГТ у пациенток с метаболическими нарушениями
Обсуждать вопросы назначения МГТ коморбидным пациенткам продолжила Лейля Рафаэлевна Гайсина, кандидат медицинских наук, доцент кафедры внутренних болезней ФГАОУ ВО «Казанский (Приволжский) федеральный университет», магистр Оксфордского университета по специальности «экспериментальная терапия». В соответствии с международной номенклатурой Всемирной организации здравоохранения ТДЭ как в комбинированной, так и в монотерапии для женщин с ожирением относятся к категории 2: польза от такой МГТ превышает риски. У некоторых женщин дефицит эстрогена, возникающий после менопаузы, может представлять собой фундаментальный шаг в процессе диабетогенеза, поэтому назначение им МГТ представляется правильным: анализ 107 рандомизированных исследований сравнения применения МГТ и плацебо у женщин без диабета показал снижение инсулинорезистентности в среднем на 13% (индекс HOMA), гликемии натощак на 11% и риска развития СД в среднем на 30% при приеме МГТ на протяжении 4–6 лет. Для женщин с риском ССЗ предпочтительна трансдермальная терапия эстрадиолом и микронизированным прогестероном (если это необходимо).Согласно клиническим исследованиям, при применении ТДЭ у пациенток с ожирением риск ВТЭ в 5 раз ниже, чем при применении ПОЭ (исследование
ESTER). В завершение доклада Лейля Рафаэлевна привела выдержку из документа, опубликованного в октябре 2023 г. на сайте Международной ассоциации по менопаузе (IMS), «Белая книга» (White Paper): «Для женщин с риском ССЗ предпочтительнее трансдермальная терапия эстрадиолом и микронизированным прогестероном, если это необходимо для защиты матки. Трансдермальные препараты эстрадиола в меньшей степени влияют на факторы свертывания крови, показатели артериального давления, триглицеридов, С-реактивного белка и глобулина, связывающего половые гормоны, и в низких дозах предпочтительны для женщин с риском ВТЭ, гипертензией, гипертриглицеридемией, ожирением, МС, диабетом и болезнью желчного пузыря в анамнезе. Нейтральным в отношении риска тромбоза считается микронизированный прогестерон».
Ознакомиться с документом «White Paper»на русском языке на сайте IMS
Онкологические риски МГТ: эстрогены или гестагены?
Чрезвычайно важный вопрос об онконастороженности при назначении МГТ подняла Анна Эдуардовна Протасова, доктор медицинских наук, профессор кафедры онкологии медицинского факультета ФГБОУ ВО СПбГУ, профессор кафедры акушерства и гинекологии ФГБУ «НМИЦ им. В.А. Алмазова». Известно, что длительная МГТ (более 10 лет) относится к наиболее значимым факторам риска РМЖ. Но значит ли это, что клиницисты должны отказываться от назначаемого лечения? Исследования показывают, что монотерапия эстрогенами достаточно безопасна: в течение 10,7 года после ее отмены снижение заболеваемости РМЖ сохранялось и составило 0,27 по сравнению с 0,35 в группе плацебо. Что касается гестагенов, то риск при применении разных прогестагенов отличается и применение прогестерона может оказаться предпочтительнее. Согласно новым данным, прогестерон (и, возможно, дидрогестерон) в комбинации с эстрогенами не увеличивает риск РМЖ, если продолжительность терапии не превышает 5 лет. Крупные европейские наблюдательные исследования позволяют предполагать, что разница в риске между терапией только эстрогенами и комбинированной терапией эстрогенами/прогестагенами наблюдается для некоторых категорий прогестагенов, но не для производных натурального прогестерона. При применении прогестерона в комбинации с эстрогенами риск развития РМЖ был ниже, чем при применении синтетических прогестинов.Комбинация трансдермального эстрадиола и прогестерона представляется более безопасным вариантом МГТ. Результаты исследования позволяют предполагать, что 2 мес. терапии трансдермальным эстрадиолом в комбинации с микронизированным прогестероном обладают менее выраженными неблагоприятными эффектами в отношении пролиферации нормальных клеток молочной железы in vivo. Важно помнить, что МГТ не влияет на клиническую картину доброкачественных заболеваний молочной железы у женщин в постменопаузе и у женщин с повышенным риском развития РМЖ (отягощенный наследственный анамнез).
Обзор российских и зарубежных клинических рекомендаций и гайдлайнов по МГТ
Выступление Светланы Владимировны Юреневой, доктора медицинских наук, заместителя директора по науке Института онкогинекологии и маммологии, профессора кафедры акушерства и гинекологии Института профессионального образования ФГБУ «НМИЦ АГП им. В.И. Кулакова» было посвящено правилам индивидуального подхода к назначению МГТ. Клиницисту важно учитывать особенности женского организма: возраст, длительность постменопаузы, наличие матки или ее отсутствие, наличие ПНЯ, синдрома поликистозных яичников и ССЗ, метаболический статус (ИМТ, объем талии, наличие СД 2), а также особенности назначаемого лекарственного средства (тип эстрогена и/или гестагена, дозу вводимого вещества, путь введения, лекарственную форму и режим приема). Так, трансдермальный путь введения обеспечивает возможность доставки неметаболизированного эстрадиола в ткани-мишени с минимальной стимуляцией синтеза белков в печени (глобулин, связывающий половые гормоны, С-реактивный белок и др.), что позволяет назначать эстрадиол в меньших дозах.Согласно данным российских и зарубежных клинических рекомендаций и гайдлайнов по МГТ, ТДЭ имеют более благоприятный профиль безопасности в отношении ВТЭО, чем эквивалентные дозы ПОЭ; риск ВТЭО при ТДЭ не превышает исходный популяционный риск, в отличие от ПОЭ, которые повышают риск ВТЭ в общей популяции в 1,7 раза по сравнению с плацебо. Более низкие дозы ПОЭ в меньшей степени ассоциированы с риском ВТЭ, чем высокие; при трансдермальном применении эстрогенов риск ВТЭ отсутствует.
Выбор прогестагена также может влиять на риск ВТЭ, при этом микронизированный прогестерон считается потенциально менее тромбогенным (биоидентичный прогестерон не связан с повышенным риском ВТЭ в отличие от синтетических прогестинов), а риск ВТЭО при сочетании ТДЭ и перорального микронизированного прогестерона или дидрогестерона нейтрален. При повышении риска ВТЭО следует назначать ТДЭ в сочетании с дидрогестероном или микронизированным прогестероном. У женщин с ВТЭ в анамнезе ПОЭ повышает риск рецидивов, поэтому этот тип препаратов МГТ им противопоказан. ТДЭ следует рассматривать в качестве терапии первой линии у женщин с соответствующими факторами риска (повышение артериального давления и ИМТ, ожирение) и с повышенными рисками развития ВТЭО, включая ИМТ>30 кг/м² (в монотерапии или в сочетании с микронизированным прогестероном). Вне зависимости от ИМТ, терапия эстрадиолом как в монорежиме, так и в комбинации с любым гестагеном в целом нейтральна в отношении риска ВТЭ.
Сегодня алгоритм принятия решений о приемлемости назначения МГТ основывается на трех «да» и трех «нет» (рис. 2).

Клиницист должен ответить на три базовых вопроса о наличии показаний и отсутствии противопоказаний для проведения лечения, а также оценить возраст женщины и длительность менопаузы. Решающим фактором в выборе препарата может стать наличие коморбидных состояний.
В заключительной дискуссии кардиолог Виктория Борисовна Мычка, доктор медицинских наук, профессор, выступила с предложением включить в список коморбидных состояний, при которых предпочтительно назначение ТДЭ, СД 2 и МС, так как согласно обширной доказательной базе СД 2 и МС – это самостоятельные факторы сердечно-сосудистого риска.
В.Б. Мычка обратила внимание аудитории на тот факт, что СД 2 и МС не бывают без осложнений. Эти состояния всегда сопровождаются эндотелиальной дисфункцией. Докладчица привела цитату академика В.Н. Серова, который, выступая на конгрессе «Мать и дитя» в сентябре 2023 г., предложил рассматривать МС как тромбофилическое состояние.
Предложение Виктории Борисовны было поддержано со стороны эндокринологов. В частности, доктор медицинских наук Ирэна Адольфовна Иловайская отметила, что на приеме эндокринолога в ее клинической практике еще не встречались пациенты с СД 2, у которых течение этого заболевания не сопровождалось бы наличием сердечно-сосудистых осложнений. Также В.Б. Мычка предложила внести изменения в отношении артериальной гипертензии и рассматривать предпочтительное назначение ТДЭ, ориентируясь не на показатели артериального давления выше 170/100 мм рт. ст., как в указано в клинических рекомендациях «Менопауза и климактерическое состояние у женщины» от 2021 г., а на сам факт наличия диагноза «артериальная гипертензия» (артериальное давление ≥140/90 мм рт. ст.), так как доказано, что у женщин, в отличие от мужчин, даже 1-я степень повышения артериального давления является фактором высокого риска сердечно-сосудистых осложнений (например, инсульта).
Завершила дискуссию Лариса Ивановна Мальцева, доктор медицинских наук, профессор кафедры акушерства и гинекологии ФГБОУ ВО «Казанский ГМУ». Она отметила оптимальный профиль безопасности трансдермальных форм эстрадиола, особенно в отношении инициации МГТ, учитывая трудности тщательного сбора анамнеза, как личного, так и наследственного, и достоверной оценки кардиоваскулярного риска у большинства пациенток на рутинном приеме у врача акушера-гинеколога.
Редакционный материал. Обзор подготовлен по материалам рабочего совещания экспертов «День гормонального здоровья» (09.12.2023).
Список исп. литературыСкрыть список1. Mendoza N et al. Eligibility criteria for Menopausal Hormone Therapy (MHT): a position statement from a consortium of scientific societies for the use of MHT in women with medical conditions. MHT Eligibility Criteria Group. Maturitas 2022; 166: 65–85.
2. Vinogradova Y et al. Use of hormone replacement therapy and risk of venous thromboembolism: nested case-control studies using the QResearch and CPRD databases. BMJ 2019; 364: k4810. DOI: 10.1136/bmj.k4810

