Клинический разбор в общей медицине №8 2023
Natalia I. Ilina1,2,3
1 National Research Center Institute of Immunology, Federal Medical and Biological Agency of Russia, Moscow, Russia;
2 Yevdokimov Moscow State University of Medicine and Dentistry, Moscow, Russia;
3 Pirogov Russian National Research Medical University, Moscow, Russia
ksenimedical@gmail.com
Abstract
Asthma and chronic rhinosinusitis with nasal polyps (CRSwNP) are concomitant diseases that are based on common pathogenetic mechanisms and have negative impact on the each other severity. A modern strategy in the severe asthma and CRSwNP treatment is the use of biologicals – monoclonal antibodies that block various pathways of the T2-inflammation, which underlies the development of these diseases. Despite the fact that biologicals used in the asthma and CRSwNP treatment are highly effective and safe, they are not universal and have some limitations associated with their action mechanism. Hence, the biologicals selection should be personalized, taking into account all the patient’s phenotypic and endotypic characteristics. Moreover, an important condition for the effective and safe therapy with biologicals is dynamic observation with regular clinical and laboratory asessments. The importance of these aspects was shown by a clinical case.
Key words: asthma, chronic rhinosinusitis with nasal polyps, biologicals, biologics, monoclonal antibodies, dupilumab, mepolizumab, peripheral blood eosinophilia, hypereosiniphilia.
For citation: Pavlova K.S., Timoshenko D.O., Rodionova M.A. et al. Personalized approach to the biologicals selection and therapy in patients with asthma and chronic rhinosinusitis with nasal polyps: clinical case analysis. Clinical review for general practice. 2023; 4 (8): 24–28 (In Russ.). DOI: 10.47407/kr2023.4.8.00327
В основе патогенеза как БА, так и ПРС лежат общие триггерные факторы и механизмы развития воспаления. Ключевую роль при этом играют цитокины, присущие клеткам 2-го типа: Th2 (T лимфоцитам хелперам
2-го типа) и ILC2 (врожденным лимфоидным клеткам 2-го типа): IL-4, IL-5, IL-9 и IL-13, в связи с чем данный тип воспаления был назван Т2-воспалением. Глубокое понимание механизмов, лежащих в основе развития БА и ПРС, сделало возможным применение в терапии тяжелых форм генно-инженерных иммунобиологических препаратов (ГИБП) – моноклональных антител, таргетно блокирующих ключевые звенья Т2-воспаления. Использование данной терапевтической стратегии позволяет улучшить контроль над симптомами БА и ПРС, снизить число тяжелых обострений и оперативных вмешательств, предотвратить будущие риски, связанные с осложнениями как самой болезни, так и побочным действием других препаратов, главным образом системных глюкокортикостероидов (сГКС) [7, 8].
На сегодняшний день в терапии тяжелой бронхиальной астмы (ТБА) уже успешно используют антитела, связывающие иммуноглобулин Е (анти-IgE – омализумаб), антагонисты интерлейкина 5 (анти-IL-5 – меполизумаб, реслизумаб) и его рецептора (анти-IL-5Rα – бенрализумаб), антитела, избирательно связывающиеся с альфа-цепью рецептора интерлейкинов 4 и 13 (анти-IL-4/13Rα – дупилумаб), а также антагонисты тимусного стромального лимфопоэтина (анти-TSLP – тезепелумаб). Указанные ГИБП были также изучены в отношении ПРС, но на сегодняшний день убедительная доказательная база собрана только для дупилумаба, омализумаба и меполизумаба, что позволило выделить ПРС как отдельное показание в инструкциях к данным препаратам [9].
Разные ГИБП, используемые в лечении сопутствующих БА и ПРС, блокируют определенные звенья Т2-воспаления, поэтому для достижения наилучших результатов назначение и выбор таргетного препарата должны быть целенаправленными и фенотип-ориентированными с учетом всех клинических особенностей пациента, лабораторных и инструментальных биомаркеров, а также молекулярных механизмов действия ГИБП [9, 10]. Такой прецизионный подход не только способствует достижению высокой эффективности терапии, но и ее безопасности, минимизируя риски развития нежелательных эффектов. Также на фоне проведения генно-инженерной иммунобиологической терапии (ГИБТ) важно внимательное динамическое наблюдение за состоянием пациента с целью контроля эффективности и безопасности лечения.
Описанный далее клинический случай демонстрирует необходимость мониторинга за клиническими и лабораторными показателями у пациентов, получающих терапию ГИБП.
Анамнез заболевания. Считает себя больным с 2013 г., когда после смены места жительства отметил появление заложенности носа, ринорею, постепенное снижение обоняния до полного отсутствия, сухой кашель, свистящее дыхание, слабость, головную боль. Поскольку аналогичные симптомы «аллергии» отметили все члены семьи, проживающие в квартире, пациент провел замеры содержания токсичных веществ, выявлено превышение ПДК в 6 раз. Пациент самостоятельно проводил ремонтные работы, используя токсичные вещества, растворяющие старую краску, обладающие интенсивным запахом. Обращался к токсикологу, эндокринологу, выявлен аутоиммунный тиреоидит с исходом в гипотиреоз, назначен левотироксин (получает до настоящего времени в дозе 50 мкг/сут). В последующем обратился к оториноларингологу, выявлен ПРС.
В 2015 г. проведена радикальная полисинусотомия. С этого времени постоянно получал интраназальные ГКС в высоких дозах с неполным эффектом. В 2017 г. отметил появление слабости, боли внизу живота, многократного жидкого стула с примесью крови, проведено стационарное обследование и лечение в гастроэнтерологическом отделении, выставлен диагноз: «Язвенный колит. Синдром Жильбера. Дисахаридазная недостаточность».
С этого времени постоянно принимает месалазин (5-АСК). В последующем неоднократно проходил курсы стационарного лечения в связи с атаками.
В 2020 г. был консультирован пульмонологом, диагностирована БА. Течение БА характеризовалось эозинофильным типом воспаления, с недостаточным контролем на фоне ингаляционной терапии вилантерол/флутиказона фуроат (22/184 мкг/сут). Сенсибилизации к респираторным и пищевым аллергенам у пациента выявлено не было. Наибольшее негативное влияние на качество жизни пациента оказывали симптомы ПРС (SNOT-22 – 78 баллов): несмотря на постоянное применение интраназальных ГКС в высоких дозах, после перенесенной радикальной полисинусотомии в 2015 г. был отмечен стремительный (на 2-е сутки) рецидив роста полипов с заполнением всех пазух в течение последующих 6 мес. Пациент наблюдался оториноларингологами и с учетом тяжелого торпидного течения ПРС была инициирована ГИБТ препаратом дупилумаб 300 мг 1 раз в 2 нед.
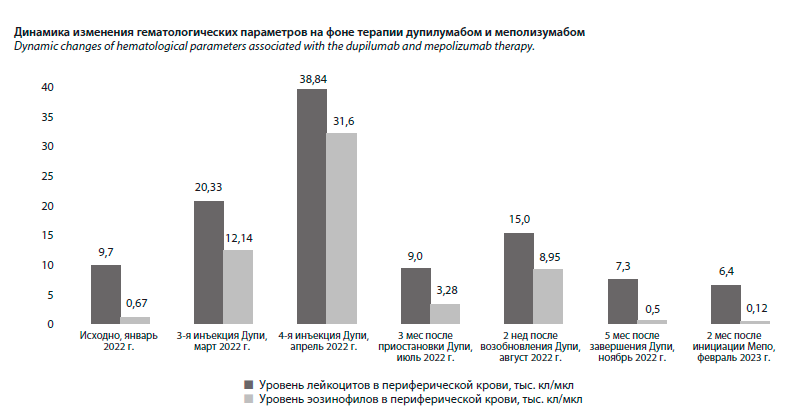
Исходно при общеклиническом обследовании выявлялась умеренная эозинофилия периферической крови 670 кл/мкл. В течение 1-й недели после инициации терапии дупилумабом пациент сообщил о выраженном улучшении в отношении симптомов БА и ПРС (снижение выраженности одышки, появление обоняния, улучшение носового дыхания). Однако после 3-й инъекции (42-й день от начала терапии) пациент отметил появление болей в эпигастрии и мезогастрии, тяжесть в правом подреберье, слабость и увеличение шейных лимфоузлов. При обследовании был выявлен лейкоцитоз (20,33×109/л), экстремально высокий уровень эозинофилов периферической крови (59,7%, 12 140 кл/мкл, см. рисунок), повышение уровня базофилов (2,6%; 530 кл/мкл при норме не более 80 кл/мкл). Несмотря на изменения в самочувствии пациента и отклонения в анализах, терапия дупилумабом была продолжена. После 4-й инъекции эозинофилия периферической крови достигла значений 81,4%, 31 600 кл/мкл (лейкоциты – 38,84×109/л, базофилы 2,5%, 370 кл/мкл), усилились вышеописанные симптомы диспепсии, интоксикации. В биохимическом анализе крови отмечалось повышение печеночных трансаминаз (аланинаминотрансфераза – 306 Ед/л), прямого билирубина (33 мкмоль/л), С-реактивного белка (30,8 мг/л, при норме менее 5 мг/л). Пациент был консультирован гепатологом, вышеописанные лабораторные изменения были расценены как лекарственный гепатит, терапия дупилумабом была приостановлена, назначены гепатопротекторы. Постепенно пациент отметил улучшение общего самочувствия, уменьшение размеров шейных лимфоузлов, снижение выраженности диспепсических симптомов. Через 3 мес наблюдалась нормализация уровня, снижение эозинофилии крови до 36,4%, 3 280 кл/мкл (при общем уровне лейкоцитов 9×109/л), в связи с чем терапия дупилумабом была возобновлена. Через 2 нед вновь выявлен лейкоцитоз, гиперэозинофилия и повышение уровня печеночных трансаминаз (лейкоциты 15×109/л, эозинофилы – 56%; 8 950 кл/мкл, аланинаминотрансфераза – 157 Ед/л, билирубин прямой – 37 мкмоль/л). Терапия дупилумабом была остановлена, отмечено постепенное (в течение 5 мес) самостоятельное снижение уровня эозинофилов до 500 кл/мкл (лейкоциты 7,3×109/л). Пациент консультирован ревматологом, исключен эозинофильный гранулематоз с полиангиитом (p-ANCA, c-ANCA – не обнаружены). Консультирован инфекционистом, не получено данных за наличие паразитарной инвазии.
Пациент обратился в клинику Института иммунологии для определения дальнейшей тактики ведения. На момент обращения отсутствовал контроль над симптомами БА – персистировали приступы затрудненного дыхания, одышка, отмечалось снижение функциональных показателей внешнего дыхания (объем форсированного выдоха за секунду – 58,5%), Asthma Control Test – 10 баллов. Также недостаточным был контроль над симптомами ПРС – отмечалось затруднение носового дыхание, обильное слизистое отделяемое из носа, снижение обоняния (SNOT-22 – 64 балла). С учетом отсутствия контроля над симптомами БА и тяжелым течением ПРС, а также лейкемоидной гиперэозинофильной реакцией при применении дупилумаба, пациенту была назначена анти-IL-5-терапия препаратом меполизумаб 100 мг 1 раз в 4 нед.
На фоне проводимой ГИБТ в течение первых 2 мес был достигнут хороший контроль над симптомами БА – отсутствовали приступы затрудненного дыхания, одышка (Asthma Control Test – 23 балла). В отношении ПРС несколько улучшилось носовое дыхание, обоняние (чувствует только резкие запахи), SNOT-22 – 35 баллов. В настоящее время пациент получает ГИБТ препаратом меполизумаб в течение 9 мес, уровень эозинофилии периферической крови снизился до 120 кл/мкл в течение первого месяца терапии и не превышает эти значения по настоящее время. На фоне применения меполизумаба нежелательные явления не были зафиксированы.
Поскольку в отличие от дупилумаба для меполизумаба менее характерна деградация полипозной ткани, при эндоскопическом и КТ-исследовании у пациента не отмечено значительного уменьшения объема полипозной ткани. Пациент был консультирован оториноларингологом, планируется проведение повторного оперативного лечения.
Хотя исходный уровень эозинофилии периферической крови у описанного нами пациента не превышал 1500 кл/мкл, применение дупилумаба в его случае способствовало росту эозинофилии до экстремальных значений в течение первых месяцев терапии, что привело к развитию гиперэозинофильной лейкемоидной реакции с яркой клинической манифестацией. Представленный клинический пример наглядно демонстрирует тот факт, что эозинофилия периферичеcкой крови нуждается не только в оценке на этапе выбора ГИБП, но и в динамическом контроле на фоне проведения анти-IL-4/13Rα-терапии.
У части пациентов, получающих дупилумаб, число эозинофилов в крови увеличивается и стабилизируется на уровне <2500 кл/мкл в течение первых месяцев терапии и эти лабораторные отклонения не приводят к развитию каких-либо клинических симптомов [15]. Стремительный и безостановочный рост эозинофилии, в свою очередь, должен быть воспринят как настораживающий признак, особенно при наличии других жалоб. В случае описанного нами пациента рост эозинофилии сопровождался выраженным ухудшением общего самочувствия, появлением симптомов интоксикации, диспепсии, лимфаденопатии. Совокупность указанных факторов, несомненно, должна была стать причиной пересмотра терапии на более ранних сроках, несмотря на высокую эффективность терапии в отношении симптомов БА и ПРС.
Выбор альтернативного ГИБП в данном случае – меполизумаба – был обусловлен антиэозинофильной направленностью его действия. Являясь анти-IL5-препаратом, меполизумаб подавляет эозинофильное воспаление посредством блокировки таких процессов, как миграция эозинофилов в кровь, созревание и формирование в них гранул с медиаторами воспаления, инфильтрация эозинофилов в легких и перемещение в очаг воспаления, выживаемость эозинофилов в тканях [16]. С учетом выраженности эозинофильного ответа на фоне терапии дупилумабом, назначение анти-IL5-терапии описанному пациенту привело к значительному улучшению – достигнут полный контроль над симптомами БА, отмечается некоторое улучшение носового дыхания и обоняния. Учитывая недостаточный эффект меполизумаба на симптомы ПРС, незначительное уменьшение объема полипозной ткани, пациенту было рекомендовано проведение повторной полисинусотомии. В связи с тем, что эозинофилы и IL-5 играют ключевую роль в патогенезе ПРС, можно ожидать, что продолжение терапии меполизумабом в данной ситуации позволит снизить риск повторного рецидива роста полипов после хирургического лечения [17].
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Павлова Ксения Сергеевна – канд. мед. наук, вед. науч. сотр., врач-аллерголог отд-ния бронхиальной астмы, ФГБУ «ГНЦ Институт иммунологии» ФМБА России. Е-mail: ksenimedical@gmail.com; ORCID: 0000-0002-4164-4094
Ksenia S. Pavlova – Cand. Sci. (Med.), National Research Center Institute of Immunology, Federal Medical and Biological Agency of Russia. Е-mail: ksenimedical@gmail.com; ORCID: 0000-0002-4164-4094
Тимошенко Дарья Олеговна – аспирант, мл. науч. сотр. отд-ния бронхиальной астмы, ФГБУ «ГНЦ Институт иммунологии» ФМБА России. Е-mail: d.o.timoshenko@gmail.com; ORCID: 0000-0002-7585-1390
Daria O. Timoshenko – Post-graduate student, National Research Center Institute of Immunology, Federal Medical and Biological Agency of Russia; Е-mail: d.o.timoshenko@gmail.com; ORCID: 0000-0002-7585-1390
Родионова Мариола Александровна – врач-аллерголог отд-ния бронхиальной астмы, ФГБУ «ГНЦ Институт иммунологии» ФМБА России. Е-mail: galitskaya.mariola@yandex.ru; ORCID: 0000-0002-2686-024X
Mariola A. Rodionova – Allergist, National Research Center Institute of Immunology, Federal Medical and Biological Agency of Russia. Е-mail: galitskaya.mariola@yandex.ru; ORCID: 0000-0002-2686-024X
Курбачева Оксана Михайловна – д-р мед. наук, проф., зав. отд-нием бронхиальной астмы, ФГБУ «ГНЦ Институт иммунологии» ФМБА России; доц. каф. клин. аллергологии и иммунологии, ФГБОУ ВО «МГМСУ им. А.И. Евдокимова». E-mail: kurbacheva@gmail.com; ORCID: 0000-0003-3250-0694)
Oksana M. Kurbacheva – Dr. Sci. (Med.), Full Prof., Head of the Asthma Department, National Research Center Institute of Immunology, Federal Medical and Biological Agency of Russia; Yevdokimov Moscow State University of Medicine and Dentistry. E-mail: kurbacheva@gmail.com; ORCID: 0000-0003-3250-0694
Ильина Наталья Ивановна – д-р мед. наук, проф., зам. директора по клинической работе, глав. врач ФГБУ «ГНЦ Институт иммунологии» ФМБА России; проф. каф. клин. аллергологии и иммунологии, ФГБОУ ВО «МГМСУ им. А.И. Евдокимова»;
проф. каф. иммунологии, ФГАОУ ВО «РНИМУ им. Н.И. Пирогова». E-mail: instimmun@yandex.ru; ORCID: 0000-0002-3556-969X
Natalia I. Ilina – Dr. Sci. (Med.), Full Prof., Deputy Director for Clinical Affairs, Chief Physician, National Research Center Institute of Immunology, Federal Medical and Biological Agency of Russia; Yevdokimov Moscow State University of Medicine and Dentistry; Pirogov Russian National Research Medical University. E-mail: instimmun@yandex.ru; ORCID: 0000-0002-3556-969X
Поступила в редакцию: 01.11.2023
Поступила после рецензирования: 07.11.2023
Принята к публикации: 09.11.2023
Received: 01.11.2023
Revised: 07.11.2023
Accepted: 09.11.2023
Клинический разбор в общей медицине №8 2023
Персонифицированный подход к выбору и проведению генно-инженерной иммунобиологической терапии у пациентов с бронхиальной астмой и полипозным риносинуситом: разбор клинического случая
Номера страниц в выпуске:24-28
Аннотация
Бронхиальная астма (БА) и полипозный риносинусит (ПРС) являются сопутствующими заболеваниями, имеющими в своей основе общие патогенетические механизмы и оказывающими взаимное влияние на течение этих нозологий. Современной стратегией в лечении тяжелых форм БА и ПРС является применение генно-инженерных иммунобиологических препаратов (ГИБП) – моноклональных антител, блокирующих различные звенья Т2-воспаления, лежащего в основе развития данных заболеваний. Несмотря на то что ГИБП, применяемые в лечении БА и ПРС, обладают высокой эффективностью и безопасностью, они не являются универсальными и имеют некоторые ограничения, связанные с их механизмом действия. В связи с этим выбор ГИБП должен быть персонифицированным с учетом всех фено- и эндотипических особенностей пациента. Также важным условием для эффективного и безопасного проведения терапии ГИБП является динамическое наблюдение за состоянием пациента с регулярным мониторингом клинических и лабораторных показателей. Важность данных аспектов была проиллюстрирована нами на примере клинического случая.
Ключевые слова: бронхиальная астма, полипозный риносинусит, иммунобиологическая терапия, моноклональные антитела, дупилумаб, меполизумаб, эозинофилия периферической крови, гиперэозинофилия.
Для цитирования: Павлова К.С., Тимошенко Д.О., Родионова М.А. и др. Персонифицированный подход к выбору и проведению генно-инженерной иммунобиологической терапии у пациентов с бронхиальной астмой и полипозным риносинуситом: разбор клинического случая. Клинический разбор в общей медицине. 2023; 4 (8): 24–28. DOI: 10.47407/kr2023.4.8.00327
Бронхиальная астма (БА) и полипозный риносинусит (ПРС) являются сопутствующими заболеваниями, имеющими в своей основе общие патогенетические механизмы и оказывающими взаимное влияние на течение этих нозологий. Современной стратегией в лечении тяжелых форм БА и ПРС является применение генно-инженерных иммунобиологических препаратов (ГИБП) – моноклональных антител, блокирующих различные звенья Т2-воспаления, лежащего в основе развития данных заболеваний. Несмотря на то что ГИБП, применяемые в лечении БА и ПРС, обладают высокой эффективностью и безопасностью, они не являются универсальными и имеют некоторые ограничения, связанные с их механизмом действия. В связи с этим выбор ГИБП должен быть персонифицированным с учетом всех фено- и эндотипических особенностей пациента. Также важным условием для эффективного и безопасного проведения терапии ГИБП является динамическое наблюдение за состоянием пациента с регулярным мониторингом клинических и лабораторных показателей. Важность данных аспектов была проиллюстрирована нами на примере клинического случая.
Ключевые слова: бронхиальная астма, полипозный риносинусит, иммунобиологическая терапия, моноклональные антитела, дупилумаб, меполизумаб, эозинофилия периферической крови, гиперэозинофилия.
Для цитирования: Павлова К.С., Тимошенко Д.О., Родионова М.А. и др. Персонифицированный подход к выбору и проведению генно-инженерной иммунобиологической терапии у пациентов с бронхиальной астмой и полипозным риносинуситом: разбор клинического случая. Клинический разбор в общей медицине. 2023; 4 (8): 24–28. DOI: 10.47407/kr2023.4.8.00327
Personalized approach to the biologicals selection and therapy in patients with asthma and chronic rhinosinusitis with nasal polyps: clinical case analysis
Ksenia S. Pavlova1, Daria O. Timoshenko1, Mariola A. Rodionova1, Oksana M. Kurbacheva1,2,Natalia I. Ilina1,2,3
1 National Research Center Institute of Immunology, Federal Medical and Biological Agency of Russia, Moscow, Russia;
2 Yevdokimov Moscow State University of Medicine and Dentistry, Moscow, Russia;
3 Pirogov Russian National Research Medical University, Moscow, Russia
ksenimedical@gmail.com
Abstract
Asthma and chronic rhinosinusitis with nasal polyps (CRSwNP) are concomitant diseases that are based on common pathogenetic mechanisms and have negative impact on the each other severity. A modern strategy in the severe asthma and CRSwNP treatment is the use of biologicals – monoclonal antibodies that block various pathways of the T2-inflammation, which underlies the development of these diseases. Despite the fact that biologicals used in the asthma and CRSwNP treatment are highly effective and safe, they are not universal and have some limitations associated with their action mechanism. Hence, the biologicals selection should be personalized, taking into account all the patient’s phenotypic and endotypic characteristics. Moreover, an important condition for the effective and safe therapy with biologicals is dynamic observation with regular clinical and laboratory asessments. The importance of these aspects was shown by a clinical case.
Key words: asthma, chronic rhinosinusitis with nasal polyps, biologicals, biologics, monoclonal antibodies, dupilumab, mepolizumab, peripheral blood eosinophilia, hypereosiniphilia.
For citation: Pavlova K.S., Timoshenko D.O., Rodionova M.A. et al. Personalized approach to the biologicals selection and therapy in patients with asthma and chronic rhinosinusitis with nasal polyps: clinical case analysis. Clinical review for general practice. 2023; 4 (8): 24–28 (In Russ.). DOI: 10.47407/kr2023.4.8.00327
Введение
Бронхиальная астма (БА) в сочетании с полипозным риносинуситом (ПРС) представляют собой непростую клиническую задачу респираторной медицины. БА и ПРС, являясь сопутствующими заболеваниями с общими патогенетическими механизмами, взаимно влияют на тяжесть течения друг друга. Известно, что ПРС способствует более тяжелому течению БА с большим числом обострений [1]. Более того, ПРС у пациентов с БА является наиболее тяжелой формой из всех риносинуситов как с клинической, так и с терапевтической точки зрения, так как течение заболевания может быть не только агрессивным, но и устойчивым к проводимому лечению [2–6].В основе патогенеза как БА, так и ПРС лежат общие триггерные факторы и механизмы развития воспаления. Ключевую роль при этом играют цитокины, присущие клеткам 2-го типа: Th2 (T лимфоцитам хелперам
2-го типа) и ILC2 (врожденным лимфоидным клеткам 2-го типа): IL-4, IL-5, IL-9 и IL-13, в связи с чем данный тип воспаления был назван Т2-воспалением. Глубокое понимание механизмов, лежащих в основе развития БА и ПРС, сделало возможным применение в терапии тяжелых форм генно-инженерных иммунобиологических препаратов (ГИБП) – моноклональных антител, таргетно блокирующих ключевые звенья Т2-воспаления. Использование данной терапевтической стратегии позволяет улучшить контроль над симптомами БА и ПРС, снизить число тяжелых обострений и оперативных вмешательств, предотвратить будущие риски, связанные с осложнениями как самой болезни, так и побочным действием других препаратов, главным образом системных глюкокортикостероидов (сГКС) [7, 8].
На сегодняшний день в терапии тяжелой бронхиальной астмы (ТБА) уже успешно используют антитела, связывающие иммуноглобулин Е (анти-IgE – омализумаб), антагонисты интерлейкина 5 (анти-IL-5 – меполизумаб, реслизумаб) и его рецептора (анти-IL-5Rα – бенрализумаб), антитела, избирательно связывающиеся с альфа-цепью рецептора интерлейкинов 4 и 13 (анти-IL-4/13Rα – дупилумаб), а также антагонисты тимусного стромального лимфопоэтина (анти-TSLP – тезепелумаб). Указанные ГИБП были также изучены в отношении ПРС, но на сегодняшний день убедительная доказательная база собрана только для дупилумаба, омализумаба и меполизумаба, что позволило выделить ПРС как отдельное показание в инструкциях к данным препаратам [9].
Разные ГИБП, используемые в лечении сопутствующих БА и ПРС, блокируют определенные звенья Т2-воспаления, поэтому для достижения наилучших результатов назначение и выбор таргетного препарата должны быть целенаправленными и фенотип-ориентированными с учетом всех клинических особенностей пациента, лабораторных и инструментальных биомаркеров, а также молекулярных механизмов действия ГИБП [9, 10]. Такой прецизионный подход не только способствует достижению высокой эффективности терапии, но и ее безопасности, минимизируя риски развития нежелательных эффектов. Также на фоне проведения генно-инженерной иммунобиологической терапии (ГИБТ) важно внимательное динамическое наблюдение за состоянием пациента с целью контроля эффективности и безопасности лечения.
Описанный далее клинический случай демонстрирует необходимость мониторинга за клиническими и лабораторными показателями у пациентов, получающих терапию ГИБП.
Клинический случай
Пациент Т., 42 лет, обратился с жалобами на приступы затрудненного дыхания, одышку при незначительной физической нагрузке, свистящее дыхание, сухой кашель, заложенность носа, обильное отделяемое из носа, отсутствие обоняния.Анамнез заболевания. Считает себя больным с 2013 г., когда после смены места жительства отметил появление заложенности носа, ринорею, постепенное снижение обоняния до полного отсутствия, сухой кашель, свистящее дыхание, слабость, головную боль. Поскольку аналогичные симптомы «аллергии» отметили все члены семьи, проживающие в квартире, пациент провел замеры содержания токсичных веществ, выявлено превышение ПДК в 6 раз. Пациент самостоятельно проводил ремонтные работы, используя токсичные вещества, растворяющие старую краску, обладающие интенсивным запахом. Обращался к токсикологу, эндокринологу, выявлен аутоиммунный тиреоидит с исходом в гипотиреоз, назначен левотироксин (получает до настоящего времени в дозе 50 мкг/сут). В последующем обратился к оториноларингологу, выявлен ПРС.
В 2015 г. проведена радикальная полисинусотомия. С этого времени постоянно получал интраназальные ГКС в высоких дозах с неполным эффектом. В 2017 г. отметил появление слабости, боли внизу живота, многократного жидкого стула с примесью крови, проведено стационарное обследование и лечение в гастроэнтерологическом отделении, выставлен диагноз: «Язвенный колит. Синдром Жильбера. Дисахаридазная недостаточность».

С этого времени постоянно принимает месалазин (5-АСК). В последующем неоднократно проходил курсы стационарного лечения в связи с атаками.
В 2020 г. был консультирован пульмонологом, диагностирована БА. Течение БА характеризовалось эозинофильным типом воспаления, с недостаточным контролем на фоне ингаляционной терапии вилантерол/флутиказона фуроат (22/184 мкг/сут). Сенсибилизации к респираторным и пищевым аллергенам у пациента выявлено не было. Наибольшее негативное влияние на качество жизни пациента оказывали симптомы ПРС (SNOT-22 – 78 баллов): несмотря на постоянное применение интраназальных ГКС в высоких дозах, после перенесенной радикальной полисинусотомии в 2015 г. был отмечен стремительный (на 2-е сутки) рецидив роста полипов с заполнением всех пазух в течение последующих 6 мес. Пациент наблюдался оториноларингологами и с учетом тяжелого торпидного течения ПРС была инициирована ГИБТ препаратом дупилумаб 300 мг 1 раз в 2 нед.
Исходно при общеклиническом обследовании выявлялась умеренная эозинофилия периферической крови 670 кл/мкл. В течение 1-й недели после инициации терапии дупилумабом пациент сообщил о выраженном улучшении в отношении симптомов БА и ПРС (снижение выраженности одышки, появление обоняния, улучшение носового дыхания). Однако после 3-й инъекции (42-й день от начала терапии) пациент отметил появление болей в эпигастрии и мезогастрии, тяжесть в правом подреберье, слабость и увеличение шейных лимфоузлов. При обследовании был выявлен лейкоцитоз (20,33×109/л), экстремально высокий уровень эозинофилов периферической крови (59,7%, 12 140 кл/мкл, см. рисунок), повышение уровня базофилов (2,6%; 530 кл/мкл при норме не более 80 кл/мкл). Несмотря на изменения в самочувствии пациента и отклонения в анализах, терапия дупилумабом была продолжена. После 4-й инъекции эозинофилия периферической крови достигла значений 81,4%, 31 600 кл/мкл (лейкоциты – 38,84×109/л, базофилы 2,5%, 370 кл/мкл), усилились вышеописанные симптомы диспепсии, интоксикации. В биохимическом анализе крови отмечалось повышение печеночных трансаминаз (аланинаминотрансфераза – 306 Ед/л), прямого билирубина (33 мкмоль/л), С-реактивного белка (30,8 мг/л, при норме менее 5 мг/л). Пациент был консультирован гепатологом, вышеописанные лабораторные изменения были расценены как лекарственный гепатит, терапия дупилумабом была приостановлена, назначены гепатопротекторы. Постепенно пациент отметил улучшение общего самочувствия, уменьшение размеров шейных лимфоузлов, снижение выраженности диспепсических симптомов. Через 3 мес наблюдалась нормализация уровня, снижение эозинофилии крови до 36,4%, 3 280 кл/мкл (при общем уровне лейкоцитов 9×109/л), в связи с чем терапия дупилумабом была возобновлена. Через 2 нед вновь выявлен лейкоцитоз, гиперэозинофилия и повышение уровня печеночных трансаминаз (лейкоциты 15×109/л, эозинофилы – 56%; 8 950 кл/мкл, аланинаминотрансфераза – 157 Ед/л, билирубин прямой – 37 мкмоль/л). Терапия дупилумабом была остановлена, отмечено постепенное (в течение 5 мес) самостоятельное снижение уровня эозинофилов до 500 кл/мкл (лейкоциты 7,3×109/л). Пациент консультирован ревматологом, исключен эозинофильный гранулематоз с полиангиитом (p-ANCA, c-ANCA – не обнаружены). Консультирован инфекционистом, не получено данных за наличие паразитарной инвазии.
Пациент обратился в клинику Института иммунологии для определения дальнейшей тактики ведения. На момент обращения отсутствовал контроль над симптомами БА – персистировали приступы затрудненного дыхания, одышка, отмечалось снижение функциональных показателей внешнего дыхания (объем форсированного выдоха за секунду – 58,5%), Asthma Control Test – 10 баллов. Также недостаточным был контроль над симптомами ПРС – отмечалось затруднение носового дыхание, обильное слизистое отделяемое из носа, снижение обоняния (SNOT-22 – 64 балла). С учетом отсутствия контроля над симптомами БА и тяжелым течением ПРС, а также лейкемоидной гиперэозинофильной реакцией при применении дупилумаба, пациенту была назначена анти-IL-5-терапия препаратом меполизумаб 100 мг 1 раз в 4 нед.
На фоне проводимой ГИБТ в течение первых 2 мес был достигнут хороший контроль над симптомами БА – отсутствовали приступы затрудненного дыхания, одышка (Asthma Control Test – 23 балла). В отношении ПРС несколько улучшилось носовое дыхание, обоняние (чувствует только резкие запахи), SNOT-22 – 35 баллов. В настоящее время пациент получает ГИБТ препаратом меполизумаб в течение 9 мес, уровень эозинофилии периферической крови снизился до 120 кл/мкл в течение первого месяца терапии и не превышает эти значения по настоящее время. На фоне применения меполизумаба нежелательные явления не были зафиксированы.
Поскольку в отличие от дупилумаба для меполизумаба менее характерна деградация полипозной ткани, при эндоскопическом и КТ-исследовании у пациента не отмечено значительного уменьшения объема полипозной ткани. Пациент был консультирован оториноларингологом, планируется проведение повторного оперативного лечения.
Обсуждение
Несмотря на то что дупилумаб демонстрирует выдающиеся эффекты как в достижении контроля над симптомами БА, так и в отношении деградации полипозной ткани при ПРС, использование данного препарата имеет некоторые ограничения, основанные на его механизме действия [11]. Блокирование пути передачи сигналов IL-4/IL-13 дупилумабом снижает концентрации цитокинов и хемокинов воспаления 2-го типа, предотвращает их последующие действия, в том числе гиперплазию бокаловидных клеток, гиперреактивность гладкомышечных клеток дыхательных путей, рекрутинг эозинофилов и последующее эозинофильное воспаление [12, 13]. Поскольку дупилумаб блокирует ключевые реакции, способствующие миграции эозинофилов в органы-мишени, его применение может приводить к повышению числа эозинофилов в периферической крови. В связи с этим данный лабораторный показатель должен учитываться при назначении дупилумаба (согласно международным рекомендациям экспертов EAACI по биологической терапии БА, исходный уровень эозинофилов периферической крови должен быть не выше 1500 кл/мкл [14]). При этом не существует рекомендаций ни в мировой литературе, ни в руководствах относительно максимального уровня эозинофилии периферической крови, являющегося критическим для отмены терапии дупилумабом и пересмотра ГИБП.Хотя исходный уровень эозинофилии периферической крови у описанного нами пациента не превышал 1500 кл/мкл, применение дупилумаба в его случае способствовало росту эозинофилии до экстремальных значений в течение первых месяцев терапии, что привело к развитию гиперэозинофильной лейкемоидной реакции с яркой клинической манифестацией. Представленный клинический пример наглядно демонстрирует тот факт, что эозинофилия периферичеcкой крови нуждается не только в оценке на этапе выбора ГИБП, но и в динамическом контроле на фоне проведения анти-IL-4/13Rα-терапии.
У части пациентов, получающих дупилумаб, число эозинофилов в крови увеличивается и стабилизируется на уровне <2500 кл/мкл в течение первых месяцев терапии и эти лабораторные отклонения не приводят к развитию каких-либо клинических симптомов [15]. Стремительный и безостановочный рост эозинофилии, в свою очередь, должен быть воспринят как настораживающий признак, особенно при наличии других жалоб. В случае описанного нами пациента рост эозинофилии сопровождался выраженным ухудшением общего самочувствия, появлением симптомов интоксикации, диспепсии, лимфаденопатии. Совокупность указанных факторов, несомненно, должна была стать причиной пересмотра терапии на более ранних сроках, несмотря на высокую эффективность терапии в отношении симптомов БА и ПРС.
Выбор альтернативного ГИБП в данном случае – меполизумаба – был обусловлен антиэозинофильной направленностью его действия. Являясь анти-IL5-препаратом, меполизумаб подавляет эозинофильное воспаление посредством блокировки таких процессов, как миграция эозинофилов в кровь, созревание и формирование в них гранул с медиаторами воспаления, инфильтрация эозинофилов в легких и перемещение в очаг воспаления, выживаемость эозинофилов в тканях [16]. С учетом выраженности эозинофильного ответа на фоне терапии дупилумабом, назначение анти-IL5-терапии описанному пациенту привело к значительному улучшению – достигнут полный контроль над симптомами БА, отмечается некоторое улучшение носового дыхания и обоняния. Учитывая недостаточный эффект меполизумаба на симптомы ПРС, незначительное уменьшение объема полипозной ткани, пациенту было рекомендовано проведение повторной полисинусотомии. В связи с тем, что эозинофилы и IL-5 играют ключевую роль в патогенезе ПРС, можно ожидать, что продолжение терапии меполизумабом в данной ситуации позволит снизить риск повторного рецидива роста полипов после хирургического лечения [17].
Заключение
ГИБТ является эффективным и перспективным методом лечения для пациентов с тяжелым течением БА и ПРС, позволяющим не только достичь контроля над симптомами, но и предотвратить будущие риски, связанные с осложнениями самой болезни и побочными эффектами сГКС-терапии. Выбор ГИБП, в свою очередь, должен осуществляться с учетом фенотипических и эндотипических особенностей заболевания, а также понимания роли ведущих специфических биологических факторов, лежащих в основе патогенеза воспалительного ответа БА и ПРС [9, 14]. Глубокое понимание этих факторов и механизмов действия ГИБП обеспечивает не только рациональный подход к выбору препарата, но и безопасность проведения терапии, минимизируя риски развития нежелательных эффектов. Используемые в настоящее время ГИБП хоть и обладают высокой эффективностью и безопасностью, не являются универсальными и имеют некоторые ограничения, которые должны учитываться как при инициации терапии, так и при ее дальнейшем проведении. Более того, у ГИБП, применяемых в лечении Т2-ассоциированных заболеваний, есть преимущественная направленность действия в отношении различных нозологий. В связи с вышесказанным актуальным становится изучение сочетанного и последовательного применения ГИБП, влияющих на различные звенья патогенеза Т2-воспаления. Однако для возможности внедрения данной стратегии в клиническую практику требуется проведение масштабных клинических исследований.Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Павлова Ксения Сергеевна – канд. мед. наук, вед. науч. сотр., врач-аллерголог отд-ния бронхиальной астмы, ФГБУ «ГНЦ Институт иммунологии» ФМБА России. Е-mail: ksenimedical@gmail.com; ORCID: 0000-0002-4164-4094
Ksenia S. Pavlova – Cand. Sci. (Med.), National Research Center Institute of Immunology, Federal Medical and Biological Agency of Russia. Е-mail: ksenimedical@gmail.com; ORCID: 0000-0002-4164-4094
Тимошенко Дарья Олеговна – аспирант, мл. науч. сотр. отд-ния бронхиальной астмы, ФГБУ «ГНЦ Институт иммунологии» ФМБА России. Е-mail: d.o.timoshenko@gmail.com; ORCID: 0000-0002-7585-1390
Daria O. Timoshenko – Post-graduate student, National Research Center Institute of Immunology, Federal Medical and Biological Agency of Russia; Е-mail: d.o.timoshenko@gmail.com; ORCID: 0000-0002-7585-1390
Родионова Мариола Александровна – врач-аллерголог отд-ния бронхиальной астмы, ФГБУ «ГНЦ Институт иммунологии» ФМБА России. Е-mail: galitskaya.mariola@yandex.ru; ORCID: 0000-0002-2686-024X
Mariola A. Rodionova – Allergist, National Research Center Institute of Immunology, Federal Medical and Biological Agency of Russia. Е-mail: galitskaya.mariola@yandex.ru; ORCID: 0000-0002-2686-024X
Курбачева Оксана Михайловна – д-р мед. наук, проф., зав. отд-нием бронхиальной астмы, ФГБУ «ГНЦ Институт иммунологии» ФМБА России; доц. каф. клин. аллергологии и иммунологии, ФГБОУ ВО «МГМСУ им. А.И. Евдокимова». E-mail: kurbacheva@gmail.com; ORCID: 0000-0003-3250-0694)
Oksana M. Kurbacheva – Dr. Sci. (Med.), Full Prof., Head of the Asthma Department, National Research Center Institute of Immunology, Federal Medical and Biological Agency of Russia; Yevdokimov Moscow State University of Medicine and Dentistry. E-mail: kurbacheva@gmail.com; ORCID: 0000-0003-3250-0694
Ильина Наталья Ивановна – д-р мед. наук, проф., зам. директора по клинической работе, глав. врач ФГБУ «ГНЦ Институт иммунологии» ФМБА России; проф. каф. клин. аллергологии и иммунологии, ФГБОУ ВО «МГМСУ им. А.И. Евдокимова»;
проф. каф. иммунологии, ФГАОУ ВО «РНИМУ им. Н.И. Пирогова». E-mail: instimmun@yandex.ru; ORCID: 0000-0002-3556-969X
Natalia I. Ilina – Dr. Sci. (Med.), Full Prof., Deputy Director for Clinical Affairs, Chief Physician, National Research Center Institute of Immunology, Federal Medical and Biological Agency of Russia; Yevdokimov Moscow State University of Medicine and Dentistry; Pirogov Russian National Research Medical University. E-mail: instimmun@yandex.ru; ORCID: 0000-0002-3556-969X
Поступила в редакцию: 01.11.2023
Поступила после рецензирования: 07.11.2023
Принята к публикации: 09.11.2023
Received: 01.11.2023
Revised: 07.11.2023
Accepted: 09.11.2023
Список исп. литературыСкрыть список1. Fokkens W, Lund V, Bachert C et al. EUFOREA consensus on biologics for CRSwNP with or without asthma. Allergy. 2019; 74: 2312–9. DOI: 10.1111/all.1387
2. Soler Z, Mace J, Litvack J et al. Chronic rhinosinusitis, race, and ethnicity. Am J Rhinol Allergy. 2012; 26 (2): 110–6. DOI: 10.2500/AJRA.2012.26.3741
3. Hamilos DL. Chronic rhinosinusitis: epidemiology and medical management. J Allergy Clin Immunol. 2011; 128 (4): 693–707. DOI: 10.1016/J.JACI.2011.08.004
4. Khalmuratova R, Park JW, Shin HW. Immune Cell Responses and Mucosal Barrier Disruptions in Chronic Rhinosinusitis. Immune Netw. 2017; 17 (1): 60–7. DOI: 10.4110/IN.2017.17.1.60
5. Курбачева О.М., Дынева М.Е., Шиловский И.П. и др. Особенности молекулярных механизмов патогенеза бронхиальной астмы в сочетании с полипозным риносинуситом. Пульмонология. 2021; 31 (1): 7–19. DOI: 10.18093/0869-0189-2021-31-1-7-19
Kurbacheva OM, Dyneva ME, Shilovskiy IP et al. Pathogenetic molecular mechanisms of chronic rhinosinusitis with nasal polyps associated with asthma. Pulmonologiya. 2021; 31 (1): 7–19. DOI: 10.18093/0869-0189-2021-31-1-7-19 (in Russian).
6. Савлевич Е.Л., Курбачева О.М., Егоров В.И. и др. Уровень экспрессии генов цитокинов при разных фенотипах полипозного риносинусита. Вестник оториноларингологии. 2019; 84 (6): 42–7. DOI: 10.17116/otorino20198406142
Savlevich EL, Kurbacheva OM, Egorov VI et al. Gene expression levels of cytokines in different phenotypes of CRSwNP. Vestn Otorinolaringol. 2019; 84 (6): 42–7. DOI: 10.17116/otorino20198406142 (in Russian).
7. Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention. 2023. Available at: https://ginasthma.org/wp-content/uploads/2023/05/GINA-2023-Full-Report-2023-WMS.pdf [Accessed: November 17, 2023].
8. Шиловский И.П., Ерошкина Д.В., Бабахин А.А., Хаитов М.Р. Антицитокиновая терапия бронхиальной астмы. Молекулярная биология. 2017; 51 (1): 3–17. DOI: 10.7868/S0026898416060197
Shilovskiy IP, Eroshkina DV, Babakhin AA, Khaitov MR. Anticytokine therapy of allergic asthma. Mol Biol. 2017; 51 (1): 3–17. DOI: 10.7868/S0026898416060197 (in Russian).
9. Agache I, Song Y, Alonso-Coello P et al. Efficacy and safety of treatment with biologicals for severe chronic rhinosinusitis with nasal polyps: A systematic review for the EAACI guidelines. Allergy. 2021; 76 (8): 2337–53. DOI: 10.1111/ALL.14809
10. Agache I, Beltran J, Akdis C et al. Efficacy and safety of treatment with biologicals (benralizumab, dupilumab, mepolizumab, omalizumab and reslizumab) for severe eosinophilic asthma. A systematic review for the EAACI Guidelines – recommendations on the use of biologicals in severe asthma. Allergy. 2020; 75 (5): 1023–42. DOI: 10.1111/ALL.14221
11. Bachert C, Han J, Desrosiers M et al. Efficacy and safety of dupilumab in patients with severe chronic rhinosinusitis with nasal polyps (LIBERTY NP SINUS-24 and LIBERTY NP SINUS-52): results from two multicentre, randomised, double-blind, placebo-controlled, parallel-group phase 3 trials. Lancet. 2019; 394 (10209): 1638–50. DOI: 10.1016/S0140-6736(19)31881-1
12. Дынева М.E., Аминова Г.Э., Курбачева О.М., Ильина Н.И. Дупилумаб: новые возможности в терапии бронхиальной астмы и полипозного риносинусита. Российский Аллергологический Журнал. 2021; 18 (1): 18–31. DOI: 10.36691/RJA1408
Dyneva ME, Aminova GE, Kurbacheva O, Il'ina NI. Dupilumab: new opportunities for the treatment of asthma and chronic rhinosinusitis with nasal polyps. Russian Journal of Allergy. 2021; 18 (1): 18–31. DOI: 10.36691/RJA1408 (in Russian).
13. Курбачева О.М., Дынева М.Е., Ильина Н.И. Дупилумаб: основные аспекты применения при T2-опосредованных заболеваниях. Медицинский совет. 2021; (16): 186–96. DOI: 10.21518/2079-701X-2021-16-186-196
Kurbacheva OM, Dyneva ME, Ilina NI. Dupilumab: basic aspects and applications to T2-mediated diseases. Medical Council. 2021; (16): 186–96. DOI: 10.21518/2079-701X-2021-16-186-196 (in Russian).
14. Agache I, Akdis C, Akdis M et al. EAACI Biologicals Guidelines – Recommendations for severe asthma. Allergy. 2021; 76 (1): 14–44. DOI: 10.1111/ALL.14425
15. Olaguibel JM, Sastre J, Rodríguez JM, Del Pozo V. Eosinophilia Induced by Blocking the IL-4/IL-13 Pathway: Potential Mechanisms and Clinical Outcomes. J Investig Allergol Clin Immunol. 2022; 32 (3): 165–80. DOI: 10.18176/jiaci.0823
16. Хаитов М.Р., Шиловский И.П. Антицитокиновая терапия аллергических заболеваний: молекулярно-иммунологические механизмы и клинические основы. М.: Медиа Сфера, 2021.
Khaitov MR, Shilovskiy IP. Anticitokinovaya terapiya allergicheskih zabolevanij: molekulyarno-immunologicheskie mekhanizmy i klinicheskie osnovy. Moscow: Media Sfera, 2021 (in Russian).
17. Han J, Bachert C, Fokkens W et al. Mepolizumab for chronic rhinosinusitis with nasal polyps (SYNAPSE): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Respir Med. 2021; 9 (10): 1141–53. DOI: 10.1016/S2213-2600(21)00097-7

