Клинический разбор в общей медицине №10 2023
Privolzhsky Research Medical University, Nizhny Novgorod, Russia
ekaterina_ruina@mail.ru
Abstract
Introduction. Rapidly progressive cerebellar syndrome (RPCS), previously referred to as “subacute cerebellar degeneration” or “paraneoplastic cerebellar degeneration”, is an autoimmune disorder, wich in the most cases is associated with a malignancy located outside the nervous system. RPCS is classified as one of the the paraneoplastic neurological syndromes and manifests in the early, often preclinical stages of oncopathology. Its diagnosis is difficult, but is necessary, since it can become a starting point for further screening for cancer. The article provides a clinical description of a 40-year-old patient with subacute development of hemiataxia and subsequent rapid progression of bilateral cerebellar deficiency associated with brainstem signs. The example of this case shows how difficult the diagnostic path is, since only the use of positron emission tomography and subsequent examination of a biopsy of the lesion in this patient made it possible to identify metastasis of poorly differentiated breast carcinoma in the axillary lymph node. The tumor itself was not found in the mammary gland. Since paraneoplastic antibodies were not detected in the patient’s blood and cerebrospinal fluid, a diagnosis of “probable” (not “definite”) RPCS was diagnosed in accordance with the diagnostic criteria proposed by the panel of experts in 2021. The treatment of cancer stopped progression of neurological deficit in the patient, but she remained severely disabled.
Discussion. The approaches to the examination of patients with RPCS are discussed. Clinical assessment, neuronal antibodies testing and a targeted screening for cancer should be performed. Brief information is provided on the use of the PNS-Care scale in the diagnosis of paraneoplastic neurological syndromes.
Conclusion. The presented case demonstrates the difficulties of diagnosing the RPCS and the associated cancer. The “definite” diagnosis of rapidly progressive cerebellar syndrome requires the presence of high or moderate risk antibodies and cancer that is consistent with the syndrome’s phenotype.
Key words: rapidly progressive cerebellar syndrome, subacute cerebellar degeneration, paraneoplastic neurological syndromes, antineuronal antibodies.
For citation: Grigoryeva V.N., Ruina E.A., Baranceva Yu.V. Rapidly progressive cerebellar syndrome as a manifestation of paraneoplastic brain damage. A case report. Clinical review for general practice. 2023; 4 (10): 26–33 (In Russ.). DOI: 10.47407/kr2023.4.10.00339
ПарНС встречаются, по данным разных исследователей, у 0,1–10,0% больных с онкопатологией [11, 12], и из числа всех этих синдромов БМС составляют около 28% [11, 13]. В настоящее время предложено разделять ПарНС на фенотипы высокого риска (до 2021 г. они обозначались как «классические синдромы»), среднего и низкого риска. БМС относится к фенотипам высокого риска, при которых вероятность онкопатологии у больных превышает 70% [6].
БМС, как и другие ПарНС, дебютирует на ранних стадиях онкопатологии (или ее рецидива), когда ее еще трудно обнаружить. В этой связи особое значение придается своевременному распознанию БМС, идентификация которого диктует необходимость целенаправленного диагностического поиска того злокачественного новообразования, с которым он связан [8]. В то же время распознавание БМС как варианта паранеопластического поражения нервной системы часто вызывает трудности. Приводим собственное клиническое наблюдение.
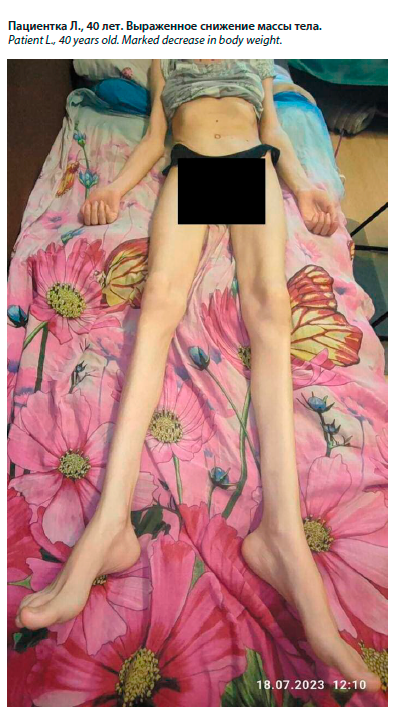 Пациентка 40 лет, бухгалтер. От пациентки получено подписанное информированное согласие на проведение обследования и публикацию его результатов без указания имени.
Пациентка 40 лет, бухгалтер. От пациентки получено подписанное информированное согласие на проведение обследования и публикацию его результатов без указания имени.
Заболела 2,5 года назад (в мае 2022 г.), когда стала отмечать легкую слабость в правой руке и ноге, нарушение почерка, изменение походки.
Вредные привычки, хронические заболевания и травмы отрицает. Семейный анамнез не отягощен.
В неврологическом статусе на момент первичного обращения (2,5 года назад) обнаруживалась правосторонняя умеренная мозжечковая гемиатаксия, без иного неврологического дефицита. Магнитно-резонансная томография (МРТ) головного мозга (ГМ) патологических изменений не выявила. Общий и биохимический анализы крови и общий анализ мочи – без особенностей. Анализы крови на антитела к вирусу иммунодефицита человека, гепатитам В и С, бледной трепонеме, вирусу клещевого энцефалита, боррелиям, токсоплазме – отрицательные.
Результаты общего анализа цереброспинальной жидкости (ЦСЖ): 3 лимфоидные клетки в 1 мм3, белок 0,44 г/л, глюкоза 3,5 ммоль/л. Исследование ЦСЖ на олигоклональный иммуноглобулин (Ig) G выявило 1-й тип синтеза. Таким образом, генез мозжечковой симптоматики оставался неясным. Пациентка была оставлена под наблюдением у неврологов.
На протяжении последующих 2 мес у пациентки постепенно стала снижаться масса тела (на 2–3 кг за каждый месяц), усилилось пошатывание при ходьбе (стала нуждаться в опоре), а затем появились двоение в глазах при взгляде вправо, нарушение речи и поперхивание при глотании. В неврологическом статусе через 2 мес после дебюта заболевания (июль 2022 г.) отмечался горизонтальный крупно-амплитудный взор-индуцированный разнонаправленный нистагм, недостаточность функции правого отводящего нерва, скандированная речь, выраженная атаксия в позе Ромберга и при выполнении координаторных проб, без признаков вовлечения центрального и периферического мотонейронов и сенсорных нарушений. Изменений в общем и биохимических анализах крови, в общем анализе ЦСЖ не выявлено, олигоклональный Ig в ЦСЖ не обнаружен (1-й тип синтеза).
Повторная МРТ ГМ (июль 2022 г.) выявила очаг измененного МР-сигнала в проекции зубчатого ядра мозжечка справа, не имевший четких границ, распространявшийся на верхнюю мозжечковую ножку, без масс-эффекта и признаков накопления контрастного вещества. Больной установлен диагноз «демиелинизирующее заболевание ГМ, клинически изолированный синдром, монофокальный вариант». Назначена пульс-терапия метилпреднизолоном 1000 мг внутривенно,
5 введений на курс. Однако положительного эффекта не достигнуто. Состояние пациентки продолжало прогрессивно ухудшаться. Через 5 мес после дебюта болезни (ноябрь 2022 г.) ее масса тела снизилась на 8 кг (рис. 1), а к резко выраженной статической и динамической мозжечковой атаксии присоединился грубый постуральный тремор головы, туловища и конечностей, бульбарные нарушения в виде дисфагии, усугубились глазодвигательные нарушения в виде пареза отводящих нервов с двух сторон, замедление горизонтальных саккад. Сохранялась дизартрия, крупно-амплитудный взор-индуцированный разнонаправленный нистагм. Больная утратила возможность не только самостоятельно передвигаться, но и удерживать равновесие в положении сидя.
В общем биохимическом анализе крови изменений по-прежнему не выявлялось. По данным МРТ ГМ (ноябрь 2022 г.) сохранялся патологический очаг в проекции зубчатого ядра мозжечка справа с распространением на верхнюю мозжечковую ножку и появилась небольшая зона фокальных корковых структурных изменений в затылочной доли в области клина, расцененная как ишемический очаг. Учитывая неуклонное нарастание неврологического дефицита при относительно стабильной МРТ-картине, ex juvantibus принято решение повторить пульс-терапию метилпреднизолоном, по 1000 мг/сут, на протяжении 5 дней ежедневно. Положительного эффекта вновь не достигнуто. Ввиду стероидорезистентности состояния с целью иммуномодуляции внутривенно вводился Ig в дозе 0,4 г на 1 кг массы тела – 20 г 5 дней подряд без существенного терапевтического эффекта.
На данном этапе заподозрена паранеопластическая этиология процесса и начат онкопоиск. Анализ крови и ЦСЖ на паранеопластические антитела дал отрицательный результат. Ультразвуковое исследование щитовидной железы, маммография, фиброграстродуаденоскопия, колоноскопия, а также мультиспиральная компьютерная томография (КТ) грудной клетки, брюшной полости и малого таза новообразований не выявили.
Проведена полнотельная позитронно-эмиссионная томография (ПЭТ)-КТ, по результатам которой обнаружен аксиллярный лимфоузел с признаками аденопатии, с гиперметаболической активностью метастатического характера. Трепан-биопсия данного лимфоузла указала на наличие метастаза низкодифференцированной карциномы молочной железы (МЖ). Проведена МРТ МЖ с контрастированием, первичный очаг в МЖ так и не обнаружен и рак МЖ (РМЖ) расценен как оккультный.
На основании полученных данных неврологический диагноз был сформулирован как «вероятный паранеопластический БМС (паранеопластическая мозжечковая дегенерация), с выраженной статической и динамической мозжечковой атаксией и экстрацеребеллярной стволовой симптоматикой». Несмотря на обнаружение онкопатологии, отсутствие антител высокого или среднего риска в сыворотке крови и ЦСЖ пациентки не позволило (в соответствии с диагностическими критериями 2021 г.) установить «достоверный» диагноз ПарНС.
Пациентка направлена к онкологам для проведения лечения согласно соответствующему протоколу. Полихимиотерапия включала доксорубицин, циклофосфамид, доцетаксел. Больная также оставалась под наблюдением невролога, осуществлявшего симптоматическую терапию. На этот период времени пациентка находилась в ясном сознании, была ориентирована в месте, времени и личности, адекватно общалась, выполняла все инструкции, при этом была подавлена, высказывала суицидальные мысли. Для уменьшения выраженности тремора назначен клоназепам в суточной дозе 2 мг и в качестве антидепрессанта – вортиоксетин в дозе 10 мг/сут.
После второго курса полихимиотерапии у пациентки появилось онемение в руках и ногах и постепенно возникла гипотрофия мышц кистей и стоп, что было расценено как проявление индуцированной цитостатиками полиневропатии. В этой связи по согласованию с онкологами больной была назначена тиоктовая кислота в дозе 600 мг/сут.
После завершения 6 курсов полихимиотерапии через 15 мес от дебюта заболевания (август 2023 г.) больной повторно выполнена ПЭТ-КТ, результаты которой указали на уменьшение размеров ранее выявленного аксиллярного метастатического лимфатического узла справа. По данным повторной МРТ ГМ отмечалось снижение интенсивности МР-сигнала от очага в проекции зубчатого ядра мозжечка справа. По сравнению с тем состоянием, которое было до начала полихимиотерапии, у пациентки имелись положительные изменения в неврологическом статусе в виде исчезновения нистагма и пареза правого отводящего нерва, существенного уменьшения выраженности бульбарных нарушений и тремора туловища и головы, некоторого улучшения стато-локомоторных функций. Она восстановила способность сидеть, стоять и проходить небольшую дистанцию с посторонней помощью. За последующие 2 мес дополнительного улучшения не отмечалось, и при осмотре через 17 мес после манифестации заболевания (октябрь 2023 г.) сохранялась статическая и динамическая атаксия, и больная оставалась зависимой от посторонней помощи при стоянии и ходьбе.
Аутоиммунные механизмы, лежащие в основе БМС (паранеопластической дегенерации мозжечка), в упрощенном виде описываются следующим образом [17, 18]. Аутоантитела у больных с данным синдромом нацелены на внутриклеточные антигены, которые имеют сходство с антигенами опухоли [15]. После гибели некоторых клеток опухоли ее поверхностные и внутриклеточные белки фагоцитируются и перерабатываются в дендритных клетках, которые мигрируют в периферические лимфатические узлы [7]. Эти клетки презентируют антигены опухоли (например, антиген Hu) и сенситизируют наивные CD4+ T-лимфоциты, которые после этого дифференцируются в антиген-специфичные CD4+ Т-хелперы. Некоторые из этих Т-хелперов затем выделяют цитокины и активируют CD8+ цитотоксические T-лимфоциты (Т-киллеры), которые, в свою очередь, распознают антигенный пептид в составе главного комплекса гистосовместимости первого класса и вызывают апоптоз презентирующих этот антиген клеток, в том числе и клеток нервной системы [17, 19]. Таким образом, гибель нейронов при БМС опосредована цитотоксическим действием
Т-лимфоцитов, а не прямой атакой на них аутоантител [15, 20]. Этим патогенез БМС как паранеопластического расстройства отличается от патогенеза тех аутоиммунных неврологических расстройств, при которых иммунный ответ опосредован В-клетками, и синтезируемые аутоантитела связываются непосредственно с антигенами клеточной поверхности [10, 21].
БМС может манифестировать в возрасте от 26 до 85 лет, но чаще всего – на шестом десятилетии жизни [4, 17]. У наблюдавшейся нами больной отмечалось достаточно раннее развитие данного синдрома, что отчасти послужило причиной первоначальной ошибочной диагностики рассеянного склероза (клинически изолированного синдрома).
Развитие БМС наиболее часто сопряжено с РМЖ, раком яичников, легких (мелкоклеточным и немелкоклеточным) и лимфомами [6, 7, 15]. Симптоматика у 30% больных возникает до проявлений онкопатологии [22]. В этом плане описываемый нами случай является характерным, поскольку БМС у пациентки был сопряжен с карциномой МЖ и манифестировал до возникновения каких-либо признаков онкопатологии.
БМС характеризуется возникающей подостро (за несколько дней/недель) быстро прогрессирующей, как правило, двусторонней тяжелой мозжечковой недостаточностью, приводящей к ограничению жизнедеятельности менее чем за 3 мес, при отсутствии существенной атрофии мозжечка на ранних стадиях заболевания [2, 6]. Гораздо реже в дебюте отмечаются односторонние нарушения, как в описываемом нами случае. В то же время гемиатаксия у наблюдавшейся пациентки вскоре сменилась билатеральной мозжечковой симптоматикой, при этом заболевание быстро прогрессировало, приведя к тяжелой инвалидизации уже через несколько месяцев. Весьма редко БМС имеет сверхострое или, напротив, малозаметное начало с медленным прогрессированием, имитирующее нейродегенеративную патологию [6].
Вначале единственным проявлением может быть статико-локомоторная атаксия – выраженная неустойчивость при стоянии и ходьбе, пошатывание в стороны, разная длина шага, широкая площадь опоры, как это и было в приводимом случае. Несколько позднее присоединяются атаксия и интенционный тремор в конечностях [1, 6, 23]. Характерна также «скандированная» речь ‒ невнятная, отрывистая, с разделением слов на отдельные, произносимые с разной громкостью слоги [5, 16, 17, 24].
В большинстве случаев признаки мозжечковой дисфункции сочетаются с экстрацеребеллярной, преимущественно стволовой симптоматикой. Больные нередко отмечают осциллопсию и диплопию (без явного окулопареза). Объективно выявляются нарушения движений глаз (вертикальный, преимущественно бьющий вниз нистагм; нестабильность произвольной фиксации взора за счет интрузивных микросаккад; прерывистость плавного слежения; гиперметрия произвольных саккад). Возможны пирамидный и бульбарный синдромы [23]. Экстрацеребеллярные нарушения объясняются тем, что поражение ГМ при БМС не ограничивается мозжечком, а распространяется и на связанные с ним структуры центральной нервной системы (ЦНС) [6, 17]. Развитие стволовой симптоматики у описываемой пациентки затруднило распознавание БМС. В этой связи стоит отметить, что изолированная мозжечковая симптоматика характерна преимущественно для больных, у которых выявляются антитела Yo (PCA-1) и Tr [6, 17].
Анализ ЦСЖ при БМС может быть в норме (как у описываемой больной) либо выявлять умеренный лимфоцитарный плеоцитоз, высокую концентрацию белка и/или патологический синтез олигоклонального IgG, указывающий на интратектальный синтез антител [3, 17, 23, 25].
МРТ ГМ на момент появления симптоматики БМС патологических изменений обычно еще не обнаруживает, хотя иногда (очень редко) возможно небольшое контрастное усиление листков мозжечка (лат. folia cerebelli), что требует дифференциального диагноза с лептоменингеальными метастазами. Со временем постепенно прогрессирует атрофия мозжечка, что следует учитывать при дифференциальной диагностике с наследственными мозжечковыми атаксиями [17]. Изменения выявляются прежде всего в режимах Т2-ВИ и FLAIR. При БМС, как и большинстве других паранеопластических неврологических расстройств, функция гематоэнцефалического барьера сохранена, поэтому пораженные области мозга редко накапливают контраст [21]. У описываемой больной при нейровизуализации через 2 мес после дебюта БМС выявлен очаг в зубчатом ядре мозжечка, распространявшийся на верхнюю мозжечковую ножку, однако его природу с позиций вышеизложенного интерпретировать сложно.
МР-спектроскопия выявляет снижение отношения N-ацетиласпартат/креатинин преимущественно в черве мозжечка [17].
Выявить собственно онкопатологию помогают целенаправленное клиническое, лабораторное и инструментальное обследования. Указывается на информативность ПЭТ всего тела с 18F-фтордезоксиглюкозой и исследований на сывороточные онкомаркеры [26]. В этой связи следует отметить, что именно ПЭТ позволила в описываемом случае обнаружить метастаз аденокарциномы МЖ; хотя первичный очаг так и не был найден, это не противоречит диагнозу РМЖ.
Патоморфологическое исследование ГМ при БМС указывает на обширную, иногда глобальную потерю клеток Пуркинье мозжечка, с возможной утратой также клеток зернистого (гранулярного) слоя и корзинчатых нейронов молекулярного слоя коры мозжечка [6].
Диагностика БМС осуществляется по принципам, применимым ко всем ПарНС, и основана на доказательстве причинно-следственной связи между имеющейся у пациента опухолью и клиническим фенотипом неврологического расстройства [6, 9, 10]. Такими доказательствами предложено считать наличие, во-первых, известной «эпидемиологической закономерности», а во-вторых – антител, для которых установлена их ассоциация с конкретными опухолями [19]. Под «эпидемиологической закономерностью» понимают часто встречающуюся (имеющую неслучайный характер, ожидаемую с высокой вероятностью) ассоциацию конкретного ПарНС с определенным злокачественным новообразованием. Для БМС такой закономерностью служит его связь с опухолями легких (анти-Hu, анти-CV2/CRMP5, анти-VGCC и анти-SOX1 антитела), яичников и МЖ (анти-Yo и анти-Ri антитела) и (несколько реже) с лимфомой Ходжкина (анти-Tr и анти-mGluR1 антитела) [20, 22]. На указанную закономерность могут влиять пол и возраст больных [27]. В частности, БМС у женщин в постменопаузе в большинстве случаев ассоциирован с РМЖ и яичников [6].
Другим доказательством БМС как паранеопластического феномена служит обнаружение в крови и/или ЦСЖ тех аутоантител, которые известны своей устойчивой связью с определенными первичными опухолями, при которых они чаще всего обнаруживаются, а также с определенными структурами ЦНС, на которые они оказывают избирательное действие [16, 17].
В 2021 г. консенсус экспертов предложил обозначать те антитела, которые с высокой вероятностью связаны с наличием у пациента опухоли, как антитела, «ассоциированные с высоким (>70%) риском онкопатологии» (ранее они именовались «онконевральными») [6]. Большинство антител высокого риска направлены против внутриклеточных антигенов и рассматриваются не как собственно патогенные агенты, а лишь как биомаркеры ПарНС [6, 9, 10].
В группу антител высокого риска включены антитела к таким белкам, как цитоплазматические антигены клеток Пуркинье (анти-Yo/PCA-1 антитела), Ma2 и/или Ma1 белки (анти-Ма2 и/или Ма1 антитела), MAP1B белок (анти-PCA-2 антитела), нейрональный ядерный антиген I типа (анти-Hu или ANNA-1 антитела), нейрональный ядерный антиген II типа (анти-Ri/ANNA-2 антитела), белок DNER (анти-Tr антитела), CRMP5 (CV2 антитела), белки амфифизин, SOX1 и KLHL11 [6]. Мозжечковая симптоматика как проявление аутоиммунного паранеопластического процесса возможна при наличии каждого из перечисленных АТ [1, 7, 21, 22, 28]. В то же время чаще всего у больных с БМС выявляются анти-Yo (PCA-1) (у 53% больных), анти-Hu (ANNA-1) (у 15% больных), анти-Tr (в 5% случаев), Anti-Ri (ANNA-2) (в 2% случаев) аутоантитела [3, 6, 12, 13, 17, 20, 22, 25]. Такие аутоантитела, как anti-Yo и anti-Tr, избирательно атакуют мозжечок, почти не вовлекая другие отделы ЦНС, поэтому клиническая симптоматика у больных ограничивается мозжечковыми нарушениями и не включает экстрацеребеллярных симптомов [4, 6, 13].
В группу среднего риска (в 30–70% случаев сопряженных с онкопатологией) включают антитела AMPAR, GABAbR, mGluR 5, P/Q VGCC, NMDAR и CASPR2 [6, 9]. Из их числа с БМС ассоциированы антитела к P/Q типам потенциалзависимых кальциевых каналов (англ. voltage gated calcium channels – VGCC) [6, 17, 29]. Хотя эти антитела наиболее характерны для миастенического синдрома Ламберта–Итона, они также могут обнаруживаться (в 2% случаев) у больных с паранеопластической мозжечковой недостаточностью [17].
Группу низкого риска (вероятность онкопатологии – менее 30%) составляют антитела mGluR1, GABAAR, CASPR2, GFAP, GAD65, LGI1, DPPX, GlyR, AQP4 и MOG. С мозжечковой симптоматикой при ПарНС из них ассоциированы mGluR1 и GAD65 антитела [3, 6, 17, 20]. Однако в большинстве случаев эти антитела не ассоциированы с опухолями, поэтому они и отнесены в группу низкого риска онкопатологии.
У больных с БМС могут выявляться также и другие аутоантитела, не включенные в настоящее время в перечень антител риска онкопатологии при ПарНС, например анти-ZIC4 (англ. zinc finger protein of the cerebellum 4 – белок цинкового пальца 4, экспрессируемый в мозжечке), антитела к белку Homer 3 и др. [16, 17].
Наличие определенных онконевральных аутоантител считается диагностическим признаком БМС, а также помогает определить тип новообразования, лежащего в его основе. В то же время указывается на то, что у 30–40% больных с мозжечковой дегенерацией антинейрональные антитела в крови не обнаруживаются. По этой причине отсутствие антинейрональных антител не исключает диагноза БМС, но снижает его вероятность [13]. Именно поэтому у наблюдавшейся нами пациентки диагноз БМС не мог быть установлен со 100%-й вероятностью.
В этой связи важно отметить, что диагноз БМС, как и любого другого ПарНС, может быть «определенным» («достоверным)», «вероятным» и «возможным». Уровень достоверности диагноза предложено определять по шкале PNS-Care (от англ. Paraneoplastic Neurologic Syndromes). Шкала PNS-Care включает три раздела, которые содержат данные, касающиеся:
1) клинического фенотипа неврологических расстройств;
2) типа выявленных у больного сывороточных антител;
3) наличия/отсутствия верифицированной онкопатологии и длительности периода наблюдения за больным.
В первом разделе оценка 3 балла выставляется за соответствие выявленного у больного синдрома фенотипу высокого риска, 2 балла – за соответствие фенотипу среднего риска и 0 баллов – за несоответствие указанным фенотипам (т.е. при отсутствии закономерной связи имеющегося у пациента синдрома с онкопатологией). Во втором разделе обнаружение у больного антител высокого риска оценивается в 3 балла, антител среднего риска – в 2 балла, антител низкого риска либо отсутствие антител – в 0 баллов. В третьем разделе 4 балла начисляется при наличии у пациента опухоли, которая соотносится с имеющимся клиническим синдромом и антителами (при их обнаружении), либо, в случае отсутствия такого соответствия, при установлении экспрессии опухолью антигена, против которого направлены обнаруженные антитела. Так, 1 балл начисляется при нераспознанной или несоответствующей клиническому фенотипу опухоли, если период наблюдения за больным составляет менее 2 лет; 0 баллов выставляется при отсутствии онкопатологии и продолжительности наблюдения за больным 2 года и более [6].
Диагнозу «определенного» («достоверного») ПарНС соответствует оценка 8 баллов и более, что предполагает наличие клинического фенотипа высокого либо среднего риска, выявление антител высокого либо среднего риска и обнаружение онкопатологии. «Вероятный» ПарНС диагностируется при суммарной оценке 6–7 баллов, а «возможный» – при оценке 4–5 баллов. При оценке 3 балла и менее диагноз ПарНС исключается [6, 10].
При подозрении на ПарНС необходимо незамедлительно провести целенаправленный диагностический поиск онкопатологии, руководствуясь клиническим фенотипом неврологических нарушений или типом выявленных антител.
Если первоначальный скрининг опухоли дает отрицательные результаты, его рекомендуется повторять каждые 4–6 мес в течение 2 лет у пациентов с клиническими фенотипами высокого риска, в том числе и БМС.
Поскольку чувствительность и специфичность анализа сыворотки или спинномозговой жидкости различаются для разных антител, рекомендуется выполнять тестирование на антитела и в крови, и в ликворе. Исследование ликвора считается обязательным лишь при подозрении на аутоиммунные энцефалиты, при которых антитела направлены против антигенов поверхности нейронов.
Дифференциальный диагноз БМС (прогрессирующей мозжечковой дегенерации) проводится с прямым неопластическим поражением ГМ (первичные опухоли, церебральные метастазы, карциноматозный менингит) и вторичными повреждениями мозжечка, обусловленными такими связанными с онкопатологией нарушениями, как коагулопатия, дефицит витаминов, побочные эффекты химиотерапии [6, 20, 30].
Наряду с этим в круг дифференциальной диагностики БМС включают неонкологические причины подостро развивающейся дисфункции мозжечка, прежде всего такие, как алкоголизм, дефицит витаминов В1 и Е, интоксикации лекарственными препаратами (в частности, антиконвульсантами), рассеянный склероз, а также иммуноопосредованные мозжечковые атаксии (ИМА) и синдром Миллера–Фишера [6].
ИМА рассматриваются как группа клинических синдромов, при которых мозжечок и связанные с ним структуры служат единственной или основной мишенью для аутоиммунной атаки [17]. В этой связи важно отметить, что БМС расценивается не только как ПарНС, но и ИМА. Другими формами ИМА, требующими дифференциации с БМС, признаны атаксия, ассоциированная с целиакией (глютеновая атаксия), постинфекционный церебеллит, синдром опсоклонуса-миоклонуса (может провоцироваться как онкопатологией, так и инфекционными заболеваниями), атаксия, ассоциированная с антителами к декарбоксилазе глутаминовой кислоты (анти-GAD антителами), и первичная аутоиммунная мозжечковая атаксия [17, 23, 31, 32].
Терапия больного с БМС направлена прежде всего на устранение злокачественного новообразования, в ином случае прогноз для жизни пациента неблагоприятен [19]. Для лечения собственно БМС показаны различные виды иммунотерапии (по отдельности или в комбинациях) с применением кортикостероидов, внутривенного введения Ig, проведение плазмафереза, назначение иммунодепрессантов и/или ритуксимаба [14, 19]. Более чувствительны к терапии церебеллярные синдромы, ассоциированные с анти-Tr и анти-mGluRI антителами, которые иногда формируются при лимфоме Ходжкина [17]. Но в целом БМС наиболее устойчив к терапии из всех паранеопластических синдромов и плохо отвечает на иммунотерапию. В большинстве случаев, несмотря на лечебные воздействия, у больных отмечается прогрессирование симптоматики или ее рецидив [17]. Однако быстро установленный диагноз и своевременное лечение опухоли и иммунотерапия могут привести к стабилизации состояния больного и предотвратить вовлечение других отделов ЦНС.
Представленный клинический случай демонстрирует трудности распознавания этого синдрома и диагностики того злокачественного новообразования, с которым он связан.
Достоверный диагноз БМС может быть установлен лишь при условии выявления у больного антител высокого или среднего риска и обнаружения такой опухоли, для которой известна ассоциация с этим синдромом.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Григорьева Вера Наумовна – д-р мед. наук, проф., зав. каф. нервных болезней, ФГБОУ ВО ПИМУ. Е-mail: vrgr@yandex.ru; ORCID: 0000-0002-6256-3429
Vera N. Grigoryeva – Dr. Sci. (Med.), Prof., Privolzhsky Research Medical University. Е-mail: vrgr@yandex.ru; ORCID: 0000-0002-6256-3429
Руина Екатерина Андреевна – канд. мед. наук, доц. каф. неврологии, психиатрии и наркологии фак-та дополнительного профессионального образования, ФГБОУ ВО ПИМУ. E-mail: ekaterina_ruina@mail.ru; ORCID: 0000-0003-4595-2614;
Ekaterina A. Ruina – Cand. Sci. (Med.), Privolzhsky Research Medical University. Е-mail: ekaterina_ruina@mail.ru; ORCID: 0000-0003-4595-2614
Баранцева Юлия Владимировна – клин. ординатор каф. неврологии, психиатрии и наркологии фак-та дополнительного профессионального образования, ФГБОУ ВО ПИМУ. Е-mail: yulia.baranceva@gmail.com; ORCID: 0009-0003-8271-9595
Yulia V. Baranceva – Clinical Resident, Privolzhsky Research Medical University. Е-mail: yulia.baranceva@gmail.com; ORCID: 0009-0003-8271-9595
Поступила в редакцию: 03.11.2023
Поступила после рецензирования: 10.11.2023
Принята к публикации: 16.11.2023
Received: 03.11.2023
Revised: 10.11.2023
Accepted: 16.11.2023
Клинический разбор в общей медицине №10 2023
Быстропрогрессирующий мозжечковый синдром как проявление паранеопластического поражения головного мозга. Клиническое наблюдение
Номера страниц в выпуске:26-33
Аннотация
Введение. Быстропрогрессирующий мозжечковый синдром (БМС), который ранее обозначался как «подострая мозжечковая дегенерация» или «паранеопластическая мозжечковая дегенерация», представляет собой аутоиммунное поражение мозжечка, в большинстве случаев ассоциированное с локализующимся вне нервной системы злокачественным новообразованием. БМС относится к группе паранеопластических неврологических синдромов и дебютирует на ранних, нередко доклинических стадиях онкопатологии. Своевременная диагностика его трудна, но очень важна, поскольку может стать отправной точкой для дальнейшего целенаправленного онкопоиска.
Результаты. В статье приводится клиническое описание пациентки 40 лет с подострым развитием гемиатаксии и последующим быстрым нарастанием двусторонней мозжечковой симптоматики, к которой присоединились стволовые симптомы. Продемонстрирована сложность онкологического поиска у этой больной, лишь применение позитронно-эмиссионной томографии и последующее исследование биоптата очага поражения позволили идентифицировать метастаз низкодифференцированной карциномы молочной железы в аксиллярный лимфатический узел. При этом сама опухоль в молочной железе так и не была найдена. Поскольку паранеопластические антитела в крови и цереброспинальной жидкости пациентки не были обнаружены, то в соответствии с диагностическими критериями, предложенными международной группой экспертов в 2021 г., установлен диагноз вероятного БМС. Начатая онкологами терапия остановила дальнейшее нарастание неврологического дефицита, однако у пациентки остались выраженные ограничения жизнедеятельности.
Заключение. В статье обсуждаются современные подходы к обследованию больных с БМС, предполагающие наряду с оценкой клинической картины заболевания также исследование на предмет выявления антинейрональных антител и целенаправленный активный поиск онкопатологии. Приводятся краткие сведения об использовании шкалы PNS-Care в диагностике паранеопластических неврологических синдромов.
Выводы. Представленный клинический случай демонстрирует трудности распознавания этого синдрома и диагностики того злокачественного новообразования, с которым он связан. Достоверный диагноз БМС может быть установлен лишь при условии выявления у больного антител высокого или среднего риска и обнаружения такой опухоли, для которой известна ассоциация с этим синдромом.
Ключевые слова: быстропрогрессирующий мозжечковый синдром, подострая мозжечковая дегенерация, паранеопластические неврологические синдромы, антинейрональные антитела.
Для цитирования: Григорьева В.Н., Руина Е.А., Баранцева Ю.В. Быстропрогрессирующий мозжечковый синдром как проявление паранеопластического поражения головного мозга. Клиническое наблюдение. Клинический разбор в общей медицине. 2023; 4 (10): 26–33. DOI: 10.47407/kr2023.4.10.00339
Введение. Быстропрогрессирующий мозжечковый синдром (БМС), который ранее обозначался как «подострая мозжечковая дегенерация» или «паранеопластическая мозжечковая дегенерация», представляет собой аутоиммунное поражение мозжечка, в большинстве случаев ассоциированное с локализующимся вне нервной системы злокачественным новообразованием. БМС относится к группе паранеопластических неврологических синдромов и дебютирует на ранних, нередко доклинических стадиях онкопатологии. Своевременная диагностика его трудна, но очень важна, поскольку может стать отправной точкой для дальнейшего целенаправленного онкопоиска.
Результаты. В статье приводится клиническое описание пациентки 40 лет с подострым развитием гемиатаксии и последующим быстрым нарастанием двусторонней мозжечковой симптоматики, к которой присоединились стволовые симптомы. Продемонстрирована сложность онкологического поиска у этой больной, лишь применение позитронно-эмиссионной томографии и последующее исследование биоптата очага поражения позволили идентифицировать метастаз низкодифференцированной карциномы молочной железы в аксиллярный лимфатический узел. При этом сама опухоль в молочной железе так и не была найдена. Поскольку паранеопластические антитела в крови и цереброспинальной жидкости пациентки не были обнаружены, то в соответствии с диагностическими критериями, предложенными международной группой экспертов в 2021 г., установлен диагноз вероятного БМС. Начатая онкологами терапия остановила дальнейшее нарастание неврологического дефицита, однако у пациентки остались выраженные ограничения жизнедеятельности.
Заключение. В статье обсуждаются современные подходы к обследованию больных с БМС, предполагающие наряду с оценкой клинической картины заболевания также исследование на предмет выявления антинейрональных антител и целенаправленный активный поиск онкопатологии. Приводятся краткие сведения об использовании шкалы PNS-Care в диагностике паранеопластических неврологических синдромов.
Выводы. Представленный клинический случай демонстрирует трудности распознавания этого синдрома и диагностики того злокачественного новообразования, с которым он связан. Достоверный диагноз БМС может быть установлен лишь при условии выявления у больного антител высокого или среднего риска и обнаружения такой опухоли, для которой известна ассоциация с этим синдромом.
Ключевые слова: быстропрогрессирующий мозжечковый синдром, подострая мозжечковая дегенерация, паранеопластические неврологические синдромы, антинейрональные антитела.
Для цитирования: Григорьева В.Н., Руина Е.А., Баранцева Ю.В. Быстропрогрессирующий мозжечковый синдром как проявление паранеопластического поражения головного мозга. Клиническое наблюдение. Клинический разбор в общей медицине. 2023; 4 (10): 26–33. DOI: 10.47407/kr2023.4.10.00339
Rapidly progressive cerebellar syndrome as a manifestation of paraneoplastic brain damage. A case report
Vera N. Grigoryeva, Ekaterina A. Ruina, Yulia V. BarancevaPrivolzhsky Research Medical University, Nizhny Novgorod, Russia
ekaterina_ruina@mail.ru
Abstract
Introduction. Rapidly progressive cerebellar syndrome (RPCS), previously referred to as “subacute cerebellar degeneration” or “paraneoplastic cerebellar degeneration”, is an autoimmune disorder, wich in the most cases is associated with a malignancy located outside the nervous system. RPCS is classified as one of the the paraneoplastic neurological syndromes and manifests in the early, often preclinical stages of oncopathology. Its diagnosis is difficult, but is necessary, since it can become a starting point for further screening for cancer. The article provides a clinical description of a 40-year-old patient with subacute development of hemiataxia and subsequent rapid progression of bilateral cerebellar deficiency associated with brainstem signs. The example of this case shows how difficult the diagnostic path is, since only the use of positron emission tomography and subsequent examination of a biopsy of the lesion in this patient made it possible to identify metastasis of poorly differentiated breast carcinoma in the axillary lymph node. The tumor itself was not found in the mammary gland. Since paraneoplastic antibodies were not detected in the patient’s blood and cerebrospinal fluid, a diagnosis of “probable” (not “definite”) RPCS was diagnosed in accordance with the diagnostic criteria proposed by the panel of experts in 2021. The treatment of cancer stopped progression of neurological deficit in the patient, but she remained severely disabled.
Discussion. The approaches to the examination of patients with RPCS are discussed. Clinical assessment, neuronal antibodies testing and a targeted screening for cancer should be performed. Brief information is provided on the use of the PNS-Care scale in the diagnosis of paraneoplastic neurological syndromes.
Conclusion. The presented case demonstrates the difficulties of diagnosing the RPCS and the associated cancer. The “definite” diagnosis of rapidly progressive cerebellar syndrome requires the presence of high or moderate risk antibodies and cancer that is consistent with the syndrome’s phenotype.
Key words: rapidly progressive cerebellar syndrome, subacute cerebellar degeneration, paraneoplastic neurological syndromes, antineuronal antibodies.
For citation: Grigoryeva V.N., Ruina E.A., Baranceva Yu.V. Rapidly progressive cerebellar syndrome as a manifestation of paraneoplastic brain damage. A case report. Clinical review for general practice. 2023; 4 (10): 26–33 (In Russ.). DOI: 10.47407/kr2023.4.10.00339
Введение
Быстропрогрессирующий мозжечковый синдром (БМС) представляет собой аутоиммунное поражение мозжечка, в большинстве случаев ассоциированное со злокачественным новообразованием вне структур нервной системы [1–4]. Ранее БМС обозначался как «подострая мозжечковая дегенерация», «паранеопластическая мозжечковая дегенерация» или «подострая мозжечковая атаксия» [2, 5], однако международная группа экспертов в 2021 г. предложила отказаться от слов «дегенерация» и «паранеопластическая», поскольку, во-первых, речь идет о клиническом синдроме, а не его морфологической основе, и, во-вторых, вероятность онкопатологии у больных с БМС хотя и высока (более 70%), но не стопроцентна [6]. Тем не менее БМС традиционно причисляется к группе паранеопластических неврологических синдромов (ПарНС) [6–8]. Эти расстройства могут вовлекать любой отдел нервной системы, развиваются в ассоциации с локализующейся вне нервной системы онкопатологией и имеют иммуноопосредованный патогенез, который подтверждается частым присутствием специфических антител, направленных против нейрональных (чаще – внутриклеточных) антигенов [6, 9, 10].ПарНС встречаются, по данным разных исследователей, у 0,1–10,0% больных с онкопатологией [11, 12], и из числа всех этих синдромов БМС составляют около 28% [11, 13]. В настоящее время предложено разделять ПарНС на фенотипы высокого риска (до 2021 г. они обозначались как «классические синдромы»), среднего и низкого риска. БМС относится к фенотипам высокого риска, при которых вероятность онкопатологии у больных превышает 70% [6].
БМС, как и другие ПарНС, дебютирует на ранних стадиях онкопатологии (или ее рецидива), когда ее еще трудно обнаружить. В этой связи особое значение придается своевременному распознанию БМС, идентификация которого диктует необходимость целенаправленного диагностического поиска того злокачественного новообразования, с которым он связан [8]. В то же время распознавание БМС как варианта паранеопластического поражения нервной системы часто вызывает трудности. Приводим собственное клиническое наблюдение.
 Пациентка 40 лет, бухгалтер. От пациентки получено подписанное информированное согласие на проведение обследования и публикацию его результатов без указания имени.
Пациентка 40 лет, бухгалтер. От пациентки получено подписанное информированное согласие на проведение обследования и публикацию его результатов без указания имени.Заболела 2,5 года назад (в мае 2022 г.), когда стала отмечать легкую слабость в правой руке и ноге, нарушение почерка, изменение походки.
Вредные привычки, хронические заболевания и травмы отрицает. Семейный анамнез не отягощен.
В неврологическом статусе на момент первичного обращения (2,5 года назад) обнаруживалась правосторонняя умеренная мозжечковая гемиатаксия, без иного неврологического дефицита. Магнитно-резонансная томография (МРТ) головного мозга (ГМ) патологических изменений не выявила. Общий и биохимический анализы крови и общий анализ мочи – без особенностей. Анализы крови на антитела к вирусу иммунодефицита человека, гепатитам В и С, бледной трепонеме, вирусу клещевого энцефалита, боррелиям, токсоплазме – отрицательные.
Результаты общего анализа цереброспинальной жидкости (ЦСЖ): 3 лимфоидные клетки в 1 мм3, белок 0,44 г/л, глюкоза 3,5 ммоль/л. Исследование ЦСЖ на олигоклональный иммуноглобулин (Ig) G выявило 1-й тип синтеза. Таким образом, генез мозжечковой симптоматики оставался неясным. Пациентка была оставлена под наблюдением у неврологов.
На протяжении последующих 2 мес у пациентки постепенно стала снижаться масса тела (на 2–3 кг за каждый месяц), усилилось пошатывание при ходьбе (стала нуждаться в опоре), а затем появились двоение в глазах при взгляде вправо, нарушение речи и поперхивание при глотании. В неврологическом статусе через 2 мес после дебюта заболевания (июль 2022 г.) отмечался горизонтальный крупно-амплитудный взор-индуцированный разнонаправленный нистагм, недостаточность функции правого отводящего нерва, скандированная речь, выраженная атаксия в позе Ромберга и при выполнении координаторных проб, без признаков вовлечения центрального и периферического мотонейронов и сенсорных нарушений. Изменений в общем и биохимических анализах крови, в общем анализе ЦСЖ не выявлено, олигоклональный Ig в ЦСЖ не обнаружен (1-й тип синтеза).
Повторная МРТ ГМ (июль 2022 г.) выявила очаг измененного МР-сигнала в проекции зубчатого ядра мозжечка справа, не имевший четких границ, распространявшийся на верхнюю мозжечковую ножку, без масс-эффекта и признаков накопления контрастного вещества. Больной установлен диагноз «демиелинизирующее заболевание ГМ, клинически изолированный синдром, монофокальный вариант». Назначена пульс-терапия метилпреднизолоном 1000 мг внутривенно,
5 введений на курс. Однако положительного эффекта не достигнуто. Состояние пациентки продолжало прогрессивно ухудшаться. Через 5 мес после дебюта болезни (ноябрь 2022 г.) ее масса тела снизилась на 8 кг (рис. 1), а к резко выраженной статической и динамической мозжечковой атаксии присоединился грубый постуральный тремор головы, туловища и конечностей, бульбарные нарушения в виде дисфагии, усугубились глазодвигательные нарушения в виде пареза отводящих нервов с двух сторон, замедление горизонтальных саккад. Сохранялась дизартрия, крупно-амплитудный взор-индуцированный разнонаправленный нистагм. Больная утратила возможность не только самостоятельно передвигаться, но и удерживать равновесие в положении сидя.
В общем биохимическом анализе крови изменений по-прежнему не выявлялось. По данным МРТ ГМ (ноябрь 2022 г.) сохранялся патологический очаг в проекции зубчатого ядра мозжечка справа с распространением на верхнюю мозжечковую ножку и появилась небольшая зона фокальных корковых структурных изменений в затылочной доли в области клина, расцененная как ишемический очаг. Учитывая неуклонное нарастание неврологического дефицита при относительно стабильной МРТ-картине, ex juvantibus принято решение повторить пульс-терапию метилпреднизолоном, по 1000 мг/сут, на протяжении 5 дней ежедневно. Положительного эффекта вновь не достигнуто. Ввиду стероидорезистентности состояния с целью иммуномодуляции внутривенно вводился Ig в дозе 0,4 г на 1 кг массы тела – 20 г 5 дней подряд без существенного терапевтического эффекта.
На данном этапе заподозрена паранеопластическая этиология процесса и начат онкопоиск. Анализ крови и ЦСЖ на паранеопластические антитела дал отрицательный результат. Ультразвуковое исследование щитовидной железы, маммография, фиброграстродуаденоскопия, колоноскопия, а также мультиспиральная компьютерная томография (КТ) грудной клетки, брюшной полости и малого таза новообразований не выявили.
Проведена полнотельная позитронно-эмиссионная томография (ПЭТ)-КТ, по результатам которой обнаружен аксиллярный лимфоузел с признаками аденопатии, с гиперметаболической активностью метастатического характера. Трепан-биопсия данного лимфоузла указала на наличие метастаза низкодифференцированной карциномы молочной железы (МЖ). Проведена МРТ МЖ с контрастированием, первичный очаг в МЖ так и не обнаружен и рак МЖ (РМЖ) расценен как оккультный.
На основании полученных данных неврологический диагноз был сформулирован как «вероятный паранеопластический БМС (паранеопластическая мозжечковая дегенерация), с выраженной статической и динамической мозжечковой атаксией и экстрацеребеллярной стволовой симптоматикой». Несмотря на обнаружение онкопатологии, отсутствие антител высокого или среднего риска в сыворотке крови и ЦСЖ пациентки не позволило (в соответствии с диагностическими критериями 2021 г.) установить «достоверный» диагноз ПарНС.
Пациентка направлена к онкологам для проведения лечения согласно соответствующему протоколу. Полихимиотерапия включала доксорубицин, циклофосфамид, доцетаксел. Больная также оставалась под наблюдением невролога, осуществлявшего симптоматическую терапию. На этот период времени пациентка находилась в ясном сознании, была ориентирована в месте, времени и личности, адекватно общалась, выполняла все инструкции, при этом была подавлена, высказывала суицидальные мысли. Для уменьшения выраженности тремора назначен клоназепам в суточной дозе 2 мг и в качестве антидепрессанта – вортиоксетин в дозе 10 мг/сут.
После второго курса полихимиотерапии у пациентки появилось онемение в руках и ногах и постепенно возникла гипотрофия мышц кистей и стоп, что было расценено как проявление индуцированной цитостатиками полиневропатии. В этой связи по согласованию с онкологами больной была назначена тиоктовая кислота в дозе 600 мг/сут.
После завершения 6 курсов полихимиотерапии через 15 мес от дебюта заболевания (август 2023 г.) больной повторно выполнена ПЭТ-КТ, результаты которой указали на уменьшение размеров ранее выявленного аксиллярного метастатического лимфатического узла справа. По данным повторной МРТ ГМ отмечалось снижение интенсивности МР-сигнала от очага в проекции зубчатого ядра мозжечка справа. По сравнению с тем состоянием, которое было до начала полихимиотерапии, у пациентки имелись положительные изменения в неврологическом статусе в виде исчезновения нистагма и пареза правого отводящего нерва, существенного уменьшения выраженности бульбарных нарушений и тремора туловища и головы, некоторого улучшения стато-локомоторных функций. Она восстановила способность сидеть, стоять и проходить небольшую дистанцию с посторонней помощью. За последующие 2 мес дополнительного улучшения не отмечалось, и при осмотре через 17 мес после манифестации заболевания (октябрь 2023 г.) сохранялась статическая и динамическая атаксия, и больная оставалась зависимой от посторонней помощи при стоянии и ходьбе.
Обсуждение
Впервые связь возникновения прогрессирующей дегенерации мозжечка с онкопатологией (рак яичника) описана более 100 лет назад, однако аутоантитела к веществу ГМ при данной патологии и других ПарНС начали изучаться лишь в 1980-е годы [9, 14, 15]. С этого времени стало развиваться представление о том, что патологическое воздействие на нервную систему у больных с БМС, ассоциированным с онкопатологией, имеет иммуноопосредованный характер и отличается по механизмам от непосредственного разрушения ГМ опухолевыми клетками [7, 14, 16].Аутоиммунные механизмы, лежащие в основе БМС (паранеопластической дегенерации мозжечка), в упрощенном виде описываются следующим образом [17, 18]. Аутоантитела у больных с данным синдромом нацелены на внутриклеточные антигены, которые имеют сходство с антигенами опухоли [15]. После гибели некоторых клеток опухоли ее поверхностные и внутриклеточные белки фагоцитируются и перерабатываются в дендритных клетках, которые мигрируют в периферические лимфатические узлы [7]. Эти клетки презентируют антигены опухоли (например, антиген Hu) и сенситизируют наивные CD4+ T-лимфоциты, которые после этого дифференцируются в антиген-специфичные CD4+ Т-хелперы. Некоторые из этих Т-хелперов затем выделяют цитокины и активируют CD8+ цитотоксические T-лимфоциты (Т-киллеры), которые, в свою очередь, распознают антигенный пептид в составе главного комплекса гистосовместимости первого класса и вызывают апоптоз презентирующих этот антиген клеток, в том числе и клеток нервной системы [17, 19]. Таким образом, гибель нейронов при БМС опосредована цитотоксическим действием
Т-лимфоцитов, а не прямой атакой на них аутоантител [15, 20]. Этим патогенез БМС как паранеопластического расстройства отличается от патогенеза тех аутоиммунных неврологических расстройств, при которых иммунный ответ опосредован В-клетками, и синтезируемые аутоантитела связываются непосредственно с антигенами клеточной поверхности [10, 21].
БМС может манифестировать в возрасте от 26 до 85 лет, но чаще всего – на шестом десятилетии жизни [4, 17]. У наблюдавшейся нами больной отмечалось достаточно раннее развитие данного синдрома, что отчасти послужило причиной первоначальной ошибочной диагностики рассеянного склероза (клинически изолированного синдрома).
Развитие БМС наиболее часто сопряжено с РМЖ, раком яичников, легких (мелкоклеточным и немелкоклеточным) и лимфомами [6, 7, 15]. Симптоматика у 30% больных возникает до проявлений онкопатологии [22]. В этом плане описываемый нами случай является характерным, поскольку БМС у пациентки был сопряжен с карциномой МЖ и манифестировал до возникновения каких-либо признаков онкопатологии.
БМС характеризуется возникающей подостро (за несколько дней/недель) быстро прогрессирующей, как правило, двусторонней тяжелой мозжечковой недостаточностью, приводящей к ограничению жизнедеятельности менее чем за 3 мес, при отсутствии существенной атрофии мозжечка на ранних стадиях заболевания [2, 6]. Гораздо реже в дебюте отмечаются односторонние нарушения, как в описываемом нами случае. В то же время гемиатаксия у наблюдавшейся пациентки вскоре сменилась билатеральной мозжечковой симптоматикой, при этом заболевание быстро прогрессировало, приведя к тяжелой инвалидизации уже через несколько месяцев. Весьма редко БМС имеет сверхострое или, напротив, малозаметное начало с медленным прогрессированием, имитирующее нейродегенеративную патологию [6].
Вначале единственным проявлением может быть статико-локомоторная атаксия – выраженная неустойчивость при стоянии и ходьбе, пошатывание в стороны, разная длина шага, широкая площадь опоры, как это и было в приводимом случае. Несколько позднее присоединяются атаксия и интенционный тремор в конечностях [1, 6, 23]. Характерна также «скандированная» речь ‒ невнятная, отрывистая, с разделением слов на отдельные, произносимые с разной громкостью слоги [5, 16, 17, 24].
В большинстве случаев признаки мозжечковой дисфункции сочетаются с экстрацеребеллярной, преимущественно стволовой симптоматикой. Больные нередко отмечают осциллопсию и диплопию (без явного окулопареза). Объективно выявляются нарушения движений глаз (вертикальный, преимущественно бьющий вниз нистагм; нестабильность произвольной фиксации взора за счет интрузивных микросаккад; прерывистость плавного слежения; гиперметрия произвольных саккад). Возможны пирамидный и бульбарный синдромы [23]. Экстрацеребеллярные нарушения объясняются тем, что поражение ГМ при БМС не ограничивается мозжечком, а распространяется и на связанные с ним структуры центральной нервной системы (ЦНС) [6, 17]. Развитие стволовой симптоматики у описываемой пациентки затруднило распознавание БМС. В этой связи стоит отметить, что изолированная мозжечковая симптоматика характерна преимущественно для больных, у которых выявляются антитела Yo (PCA-1) и Tr [6, 17].
Анализ ЦСЖ при БМС может быть в норме (как у описываемой больной) либо выявлять умеренный лимфоцитарный плеоцитоз, высокую концентрацию белка и/или патологический синтез олигоклонального IgG, указывающий на интратектальный синтез антител [3, 17, 23, 25].
МРТ ГМ на момент появления симптоматики БМС патологических изменений обычно еще не обнаруживает, хотя иногда (очень редко) возможно небольшое контрастное усиление листков мозжечка (лат. folia cerebelli), что требует дифференциального диагноза с лептоменингеальными метастазами. Со временем постепенно прогрессирует атрофия мозжечка, что следует учитывать при дифференциальной диагностике с наследственными мозжечковыми атаксиями [17]. Изменения выявляются прежде всего в режимах Т2-ВИ и FLAIR. При БМС, как и большинстве других паранеопластических неврологических расстройств, функция гематоэнцефалического барьера сохранена, поэтому пораженные области мозга редко накапливают контраст [21]. У описываемой больной при нейровизуализации через 2 мес после дебюта БМС выявлен очаг в зубчатом ядре мозжечка, распространявшийся на верхнюю мозжечковую ножку, однако его природу с позиций вышеизложенного интерпретировать сложно.
МР-спектроскопия выявляет снижение отношения N-ацетиласпартат/креатинин преимущественно в черве мозжечка [17].
Выявить собственно онкопатологию помогают целенаправленное клиническое, лабораторное и инструментальное обследования. Указывается на информативность ПЭТ всего тела с 18F-фтордезоксиглюкозой и исследований на сывороточные онкомаркеры [26]. В этой связи следует отметить, что именно ПЭТ позволила в описываемом случае обнаружить метастаз аденокарциномы МЖ; хотя первичный очаг так и не был найден, это не противоречит диагнозу РМЖ.
Патоморфологическое исследование ГМ при БМС указывает на обширную, иногда глобальную потерю клеток Пуркинье мозжечка, с возможной утратой также клеток зернистого (гранулярного) слоя и корзинчатых нейронов молекулярного слоя коры мозжечка [6].
Диагностика БМС осуществляется по принципам, применимым ко всем ПарНС, и основана на доказательстве причинно-следственной связи между имеющейся у пациента опухолью и клиническим фенотипом неврологического расстройства [6, 9, 10]. Такими доказательствами предложено считать наличие, во-первых, известной «эпидемиологической закономерности», а во-вторых – антител, для которых установлена их ассоциация с конкретными опухолями [19]. Под «эпидемиологической закономерностью» понимают часто встречающуюся (имеющую неслучайный характер, ожидаемую с высокой вероятностью) ассоциацию конкретного ПарНС с определенным злокачественным новообразованием. Для БМС такой закономерностью служит его связь с опухолями легких (анти-Hu, анти-CV2/CRMP5, анти-VGCC и анти-SOX1 антитела), яичников и МЖ (анти-Yo и анти-Ri антитела) и (несколько реже) с лимфомой Ходжкина (анти-Tr и анти-mGluR1 антитела) [20, 22]. На указанную закономерность могут влиять пол и возраст больных [27]. В частности, БМС у женщин в постменопаузе в большинстве случаев ассоциирован с РМЖ и яичников [6].
Другим доказательством БМС как паранеопластического феномена служит обнаружение в крови и/или ЦСЖ тех аутоантител, которые известны своей устойчивой связью с определенными первичными опухолями, при которых они чаще всего обнаруживаются, а также с определенными структурами ЦНС, на которые они оказывают избирательное действие [16, 17].
В 2021 г. консенсус экспертов предложил обозначать те антитела, которые с высокой вероятностью связаны с наличием у пациента опухоли, как антитела, «ассоциированные с высоким (>70%) риском онкопатологии» (ранее они именовались «онконевральными») [6]. Большинство антител высокого риска направлены против внутриклеточных антигенов и рассматриваются не как собственно патогенные агенты, а лишь как биомаркеры ПарНС [6, 9, 10].
В группу антител высокого риска включены антитела к таким белкам, как цитоплазматические антигены клеток Пуркинье (анти-Yo/PCA-1 антитела), Ma2 и/или Ma1 белки (анти-Ма2 и/или Ма1 антитела), MAP1B белок (анти-PCA-2 антитела), нейрональный ядерный антиген I типа (анти-Hu или ANNA-1 антитела), нейрональный ядерный антиген II типа (анти-Ri/ANNA-2 антитела), белок DNER (анти-Tr антитела), CRMP5 (CV2 антитела), белки амфифизин, SOX1 и KLHL11 [6]. Мозжечковая симптоматика как проявление аутоиммунного паранеопластического процесса возможна при наличии каждого из перечисленных АТ [1, 7, 21, 22, 28]. В то же время чаще всего у больных с БМС выявляются анти-Yo (PCA-1) (у 53% больных), анти-Hu (ANNA-1) (у 15% больных), анти-Tr (в 5% случаев), Anti-Ri (ANNA-2) (в 2% случаев) аутоантитела [3, 6, 12, 13, 17, 20, 22, 25]. Такие аутоантитела, как anti-Yo и anti-Tr, избирательно атакуют мозжечок, почти не вовлекая другие отделы ЦНС, поэтому клиническая симптоматика у больных ограничивается мозжечковыми нарушениями и не включает экстрацеребеллярных симптомов [4, 6, 13].
В группу среднего риска (в 30–70% случаев сопряженных с онкопатологией) включают антитела AMPAR, GABAbR, mGluR 5, P/Q VGCC, NMDAR и CASPR2 [6, 9]. Из их числа с БМС ассоциированы антитела к P/Q типам потенциалзависимых кальциевых каналов (англ. voltage gated calcium channels – VGCC) [6, 17, 29]. Хотя эти антитела наиболее характерны для миастенического синдрома Ламберта–Итона, они также могут обнаруживаться (в 2% случаев) у больных с паранеопластической мозжечковой недостаточностью [17].
Группу низкого риска (вероятность онкопатологии – менее 30%) составляют антитела mGluR1, GABAAR, CASPR2, GFAP, GAD65, LGI1, DPPX, GlyR, AQP4 и MOG. С мозжечковой симптоматикой при ПарНС из них ассоциированы mGluR1 и GAD65 антитела [3, 6, 17, 20]. Однако в большинстве случаев эти антитела не ассоциированы с опухолями, поэтому они и отнесены в группу низкого риска онкопатологии.
У больных с БМС могут выявляться также и другие аутоантитела, не включенные в настоящее время в перечень антител риска онкопатологии при ПарНС, например анти-ZIC4 (англ. zinc finger protein of the cerebellum 4 – белок цинкового пальца 4, экспрессируемый в мозжечке), антитела к белку Homer 3 и др. [16, 17].
Наличие определенных онконевральных аутоантител считается диагностическим признаком БМС, а также помогает определить тип новообразования, лежащего в его основе. В то же время указывается на то, что у 30–40% больных с мозжечковой дегенерацией антинейрональные антитела в крови не обнаруживаются. По этой причине отсутствие антинейрональных антител не исключает диагноза БМС, но снижает его вероятность [13]. Именно поэтому у наблюдавшейся нами пациентки диагноз БМС не мог быть установлен со 100%-й вероятностью.
В этой связи важно отметить, что диагноз БМС, как и любого другого ПарНС, может быть «определенным» («достоверным)», «вероятным» и «возможным». Уровень достоверности диагноза предложено определять по шкале PNS-Care (от англ. Paraneoplastic Neurologic Syndromes). Шкала PNS-Care включает три раздела, которые содержат данные, касающиеся:
1) клинического фенотипа неврологических расстройств;
2) типа выявленных у больного сывороточных антител;
3) наличия/отсутствия верифицированной онкопатологии и длительности периода наблюдения за больным.
В первом разделе оценка 3 балла выставляется за соответствие выявленного у больного синдрома фенотипу высокого риска, 2 балла – за соответствие фенотипу среднего риска и 0 баллов – за несоответствие указанным фенотипам (т.е. при отсутствии закономерной связи имеющегося у пациента синдрома с онкопатологией). Во втором разделе обнаружение у больного антител высокого риска оценивается в 3 балла, антител среднего риска – в 2 балла, антител низкого риска либо отсутствие антител – в 0 баллов. В третьем разделе 4 балла начисляется при наличии у пациента опухоли, которая соотносится с имеющимся клиническим синдромом и антителами (при их обнаружении), либо, в случае отсутствия такого соответствия, при установлении экспрессии опухолью антигена, против которого направлены обнаруженные антитела. Так, 1 балл начисляется при нераспознанной или несоответствующей клиническому фенотипу опухоли, если период наблюдения за больным составляет менее 2 лет; 0 баллов выставляется при отсутствии онкопатологии и продолжительности наблюдения за больным 2 года и более [6].
Диагнозу «определенного» («достоверного») ПарНС соответствует оценка 8 баллов и более, что предполагает наличие клинического фенотипа высокого либо среднего риска, выявление антител высокого либо среднего риска и обнаружение онкопатологии. «Вероятный» ПарНС диагностируется при суммарной оценке 6–7 баллов, а «возможный» – при оценке 4–5 баллов. При оценке 3 балла и менее диагноз ПарНС исключается [6, 10].
При подозрении на ПарНС необходимо незамедлительно провести целенаправленный диагностический поиск онкопатологии, руководствуясь клиническим фенотипом неврологических нарушений или типом выявленных антител.
Если первоначальный скрининг опухоли дает отрицательные результаты, его рекомендуется повторять каждые 4–6 мес в течение 2 лет у пациентов с клиническими фенотипами высокого риска, в том числе и БМС.
Поскольку чувствительность и специфичность анализа сыворотки или спинномозговой жидкости различаются для разных антител, рекомендуется выполнять тестирование на антитела и в крови, и в ликворе. Исследование ликвора считается обязательным лишь при подозрении на аутоиммунные энцефалиты, при которых антитела направлены против антигенов поверхности нейронов.
Дифференциальный диагноз БМС (прогрессирующей мозжечковой дегенерации) проводится с прямым неопластическим поражением ГМ (первичные опухоли, церебральные метастазы, карциноматозный менингит) и вторичными повреждениями мозжечка, обусловленными такими связанными с онкопатологией нарушениями, как коагулопатия, дефицит витаминов, побочные эффекты химиотерапии [6, 20, 30].
Наряду с этим в круг дифференциальной диагностики БМС включают неонкологические причины подостро развивающейся дисфункции мозжечка, прежде всего такие, как алкоголизм, дефицит витаминов В1 и Е, интоксикации лекарственными препаратами (в частности, антиконвульсантами), рассеянный склероз, а также иммуноопосредованные мозжечковые атаксии (ИМА) и синдром Миллера–Фишера [6].
ИМА рассматриваются как группа клинических синдромов, при которых мозжечок и связанные с ним структуры служат единственной или основной мишенью для аутоиммунной атаки [17]. В этой связи важно отметить, что БМС расценивается не только как ПарНС, но и ИМА. Другими формами ИМА, требующими дифференциации с БМС, признаны атаксия, ассоциированная с целиакией (глютеновая атаксия), постинфекционный церебеллит, синдром опсоклонуса-миоклонуса (может провоцироваться как онкопатологией, так и инфекционными заболеваниями), атаксия, ассоциированная с антителами к декарбоксилазе глутаминовой кислоты (анти-GAD антителами), и первичная аутоиммунная мозжечковая атаксия [17, 23, 31, 32].
Терапия больного с БМС направлена прежде всего на устранение злокачественного новообразования, в ином случае прогноз для жизни пациента неблагоприятен [19]. Для лечения собственно БМС показаны различные виды иммунотерапии (по отдельности или в комбинациях) с применением кортикостероидов, внутривенного введения Ig, проведение плазмафереза, назначение иммунодепрессантов и/или ритуксимаба [14, 19]. Более чувствительны к терапии церебеллярные синдромы, ассоциированные с анти-Tr и анти-mGluRI антителами, которые иногда формируются при лимфоме Ходжкина [17]. Но в целом БМС наиболее устойчив к терапии из всех паранеопластических синдромов и плохо отвечает на иммунотерапию. В большинстве случаев, несмотря на лечебные воздействия, у больных отмечается прогрессирование симптоматики или ее рецидив [17]. Однако быстро установленный диагноз и своевременное лечение опухоли и иммунотерапия могут привести к стабилизации состояния больного и предотвратить вовлечение других отделов ЦНС.
Заключение
БМС (подострая паранеопластическая мозжечковая дегенерации) является аутоиммунным неврологическим расстройством, более чем в 70% случаев ассоци-ированным с онкопатологией. Он характеризуется возникновением быстро прогрессирующей тяжелой двусторонней мозжечковой недостаточности, часто сочетающейся с симптомами поражения ствола ГМ и за несколько месяцев приводящей к выраженным ограничениям жизнедеятельности пациента.Представленный клинический случай демонстрирует трудности распознавания этого синдрома и диагностики того злокачественного новообразования, с которым он связан.
Достоверный диагноз БМС может быть установлен лишь при условии выявления у больного антител высокого или среднего риска и обнаружения такой опухоли, для которой известна ассоциация с этим синдромом.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Григорьева Вера Наумовна – д-р мед. наук, проф., зав. каф. нервных болезней, ФГБОУ ВО ПИМУ. Е-mail: vrgr@yandex.ru; ORCID: 0000-0002-6256-3429
Vera N. Grigoryeva – Dr. Sci. (Med.), Prof., Privolzhsky Research Medical University. Е-mail: vrgr@yandex.ru; ORCID: 0000-0002-6256-3429
Руина Екатерина Андреевна – канд. мед. наук, доц. каф. неврологии, психиатрии и наркологии фак-та дополнительного профессионального образования, ФГБОУ ВО ПИМУ. E-mail: ekaterina_ruina@mail.ru; ORCID: 0000-0003-4595-2614;
Ekaterina A. Ruina – Cand. Sci. (Med.), Privolzhsky Research Medical University. Е-mail: ekaterina_ruina@mail.ru; ORCID: 0000-0003-4595-2614
Баранцева Юлия Владимировна – клин. ординатор каф. неврологии, психиатрии и наркологии фак-та дополнительного профессионального образования, ФГБОУ ВО ПИМУ. Е-mail: yulia.baranceva@gmail.com; ORCID: 0009-0003-8271-9595
Yulia V. Baranceva – Clinical Resident, Privolzhsky Research Medical University. Е-mail: yulia.baranceva@gmail.com; ORCID: 0009-0003-8271-9595
Поступила в редакцию: 03.11.2023
Поступила после рецензирования: 10.11.2023
Принята к публикации: 16.11.2023
Received: 03.11.2023
Revised: 10.11.2023
Accepted: 16.11.2023
Список исп. литературыСкрыть список1. Нужный Е.П., Краснов М.Ю., Москаленко А.Н. и др. Паранеопластическая мозжечковая дегенерация. Российский неврологический журнал. 2023; 28 (4): 43–53. DOI: 10.30629/2658-7947-2023-28-4-43-53
Nuzhnyi EP, Krasnov MYu, Moskalenko AN et al. Paraneoplastic cerebellar degeneration. Russian Neurological Journal. 2023; 28 (4): 43–53. DOI: 10.30629/2658-7947-2023-28-4-43-53 (in Russian)
2. Loehrer PA, Zieger L, Simon OJ. Update on paraneoplastic cerebellar degeneration. Brain Sci. 2021; 11 (11): 1414. DOI: 10.3390/brainsci11111414
3. Klötzsch C, Böhmert M, Hermann R et al. Anti-Homer-3 antibodies in cerebrospinal fluid and serum samples from a 58-year-old woman with subacute cerebellar degeneration and diffuse breast adenocarcinoma. Neurol Res Pract. 2022; 4 (1): 29. DOI: 10.1186/s42466-022-00194-9
4. Greenlee J, Brashear HR. The discovery of Anti-Yo (Anti-PCA1) antibody in patients with paraneoplastic cerebellar degeneration: opening a window into autoimmune neurological disease. Cerebellum. 2023; 22 (4): 531–3. DOI: 10.1007/s12311-022-01446-9
5. Королева Е.С., Алифирова В.М., Рязанцева А.А., Кощавцева Ю.И. Паранеопластическая мозжечковая дегенерация у пациента с антителами anti-Yo и аденокарциномой простаты. Бюллетень сибирской медицины. 2017; 16 (3): 218–23. DOI: 10.20538/1682-0363-2017-3-218–223
Koroleva ES, Alifirova VM, Ryazantseva AA, Koshavtseva YuI. Paraneoplastic cerebellar degeneration in a patient with anti-Yo antibodies and prostate adenocarcinoma. Bulletin of Siberian Medicine. 2017; 16 (3): 218–23. DOI: 10.20538/1682-0363-2017-3-218-223 (in Russian)
6. Graus F, Vogrig A, Muñiz-Castrillo S et al. Updated diagnostic criteria for paraneoplastic neurologic syndromes. Neurol Neuroimmunol Neuroinflamm. 2021; 8 (4): e1014. DOI: 10.1212/NXI.0000000000001014
7. Devine MF, Kothapalli N, Elkhooly M, Dubey D. Paraneoplastic neurological syndromes: clinical presentations and management. Ther Adv Neurol Disord. 2021; 14: 1756286420985323. DOI: 10.1177/ 1756286420985323
8. Marsili L, Marcucci S, La Porta J et al. Paraneoplastic neurological syndromes of the central nervous system: pathophysiology, diagnosis and treatment. Biomedicines. 2023; 11 (5): 1406. DOI: 10.3390/biomedicines11051406
9. Binks S, Uy C, Honnorat J, Irani SR. Paraneoplastic neurological syndromes: a practical approach to diagnosis and management. Pract Neurol. 2022; 22 (1): 19–31. DOI: 10.1136/practneurol-2021-003073
10. Gilligan M, McGuigan C, McKeon A. Paraneoplastic neurologic disorders. Curr Neurol Neurosci Rep. 2023; 23 (3): 67–82. DOI: 10.1007/s11910-023-01250-w
11. Vogrig A, Gigli GL, Segatti S et al. Epidemiology of paraneoplastic neurological syndromes: a population-based study. J Neurol. 2020; 267 (1): 26–35. DOI: 10.1007/s00415-019-09544-1
12. Yan J, Chen Z, Liang Y et al. Anti-CV2/CRMP5 antibody-positive paraneoplastic neurological syndromes with chronic intestinal pseudo-obstruction in a small-cell lung cancer patient: a case report and literature review. J Int Med Res. 2020; 48 (12): 300060520974466. DOI: 10.1177/0300060520974466
13. Tazi R, Salimi Z, Fadili H et al. Anti-Ri-associated paraneoplastic neurological syndrome revealing breast cancer: A case report. Cureus. 2022; 14 (1): e21106. DOI: 10.7759/cureus.21106
14. Mitoma H, Manto M, Hampe CS. Immune-mediated cerebellar ataxias: practical guidelines and therapeutic challenges. Curr Neuropharmacol. 2019; 17 (1): 33–58. DOI: 10.2174/1570159X16666180917105033
15. Jitprapaikulsan J, Paul P, Thakolwiboon S et al. Paraneoplastic neurological syndrome: an evolving story. Neurooncol Pract. 2021; 8 (4): 362–74. DOI: 10.1093/nop/npab002
16. Joubert B, Rostásy K, Honnorat J. Immune-mediated ataxias. Handb Clin Neurol. 2018; 155: 313–32. DOI: 10.1016/B978-0-444-64189-2.00021-4
17. Mitoma H, Manto M, Hadjivassiliou M. Immune-mediated cerebellar ataxias: clinical diagnosis and treatment based on immunological and physiological mechanisms. J Mov Disord. 2021; 14 (1): 10–28. DOI: 10.14802/jmd.20040
18. Chung C, Allen E, Umoru G. Paraneoplastic syndromes: a focus on pathophysiology and supportive care. Am J Health Syst Pharm. 2022; 79 (22): 1988–2000. DOI: 10.1093/ajhp/zxac211
19. Fidahussain AA, Abid A, Paracha AA et al. An etiological investigation of paraneoplastic cerebellar degeneration in ovarian cancer patients: A systematic review. Cureus. 2022; 14 (11): e31154. DOI: 10.7759/cureus.31154
20. Sechi E, Flanagan EP. Antibody-mediated autoimmune diseases of the CNS: Challenges and approaches to diagnosis and management. Front Neurol. 2021; 12: 673339. DOI: 10.3389/fneur.2021.673339
21. Yshii L, Bost C, Liblau R. Immunological bases of paraneoplastic cerebellar degeneration and therapeutic implications. Front Immunol. 2020; 11: 991. DOI: 10.3389/fimmu.2020.00991
22. Sun X, Tan J, Sun H et al. Anti-SOX1 Antibodies in Paraneoplastic Neurological Syndrome. J Clin Neurol. 2020; 16 (4): 530–46. DOI: 10.3988/jcn.2020.16.4.530
23. Нужный Е.П., Краснов М.Ю., Клюшников С.А., Иллариошкин С.Н. Клиническая характеристика аутоиммунных мозжечковых атаксий. Бюллетень Национального общества по изучению болезни Паркинсона и расстройств движений. 2022; (2): 152–4. DOI: 10.24412/2226-079X-2022-12456
Nuzhnyi EP, Krasnov MYu, Kljushnikov SA, Illarioshkin SN. Clinical characteristics of autoimmune cerebellar ataxias. Bulletin of the National Parkinson's Disease and Movement Disorder Society. 2022; (2): 152–4. DOI: 10.24412/2226-079X-2022-12456 (in Russian)
24. Шурупова М.А., Анисимов В.Н., Латанов А.В., Касаткин В.Н. Особенности нарушений движений глаз при поражениях мозжечка различной локализации. Российский медико-биологический вестник им. акад. И.П. Павлова. 2016; (3): 154–63.
Shurupova MA, Anisimov VN, Latanov AV, Kasatkin VN. Features of eye movement disorders in cerebellar lesions of various localization. I.P. Pavlov Russian Medical Biological Herald. 2016; (3): 154–63 (in Russian)
25. Dubey D, Wilson MR, Clarkson B et al. Expanded clinical phenotype, oncological associations, and immunopathologic insights of paraneoplastic Kelch-like Protein-11 Encephalitis. JAMA Neurol. 2020; 77 (11): 1420–9. DOI: 10.1001/jamaneurol.2020.2231
26. Herdlevær I, Haugen M, Mazengia K et al. Paraneoplastic cerebellar degeneration: The importance of including CDR2L as a diagnostic marker. Neurol Neuroimmunol Neuroinflamm. 2021; 8 (2): e963.
DOI: 10.1212/NXI.0000000000000963
27. Kunchok A, McKeon A, Zekeridou A et al. Autoimmune/paraneoplastic encephalitis antibody biomarkers: frequency, age, and sex associations. Mayo Clin Proc. 2022; 97 (3): 547–59. DOI: 10.1016/j.mayocp. 2021.07.023
28. Gadoth A, Kryzer TJ, Fryer J et al. Microtubule-associated protein 1B: novel paraneoplastic biomarker. Ann Neurol. 2017; 81 (2): 266–77. DOI: 10.1002/ana.24872
29. Winklehner M, Bauer J, Endmayr V et al. Paraneoplastic cerebellar degeneration with P/Q-VGCC vs Yo autoantibodies. Neurol Neuroimmunol Neuroinflamm. 2022; 9 (4): e200006. DOI: 10.1212/NXI. 0000000000200006
30. Hameed S, Kumar M, Athwal PSS et al. Postinfectious cerebellar syndrome with paraneoplastic antibodies: an association or coincidence? Cureus. 2020; 12 (9): e10190. DOI: 10.7759/cureus.10190
31. Дегтерев Д.А., Дамулин И.В., Парфенов А.И. Неврологические расстройства, ассоциированные с чувствительностью к глютену. Терапевтический архив. 2017; 89 (2): 99 102. DOI: 10.17116/terarkh201789299-102
Degterev DA, Damulin IV, Parfenov AI. Neurological disorders associated with gluten sensitivity. Therapeutic Archive. 2017; 89 (2): 99 102. DOI: 10.17116/terarkh201789299-102 (in Russian)
32. Нужный Е.П., Краснов М.Ю., Ахмадуллина Д.Р. и др. Атаксия, ассоциированная с антителами к глутаматдекарбоксилазе. Неврология, нейропсихиатрия, психосоматика. 2020; 12 (5): 66–70. DOI: 10.14412/2074-2711-2020-5-66-70
Nuzhnyi EP, Krasnov MYu, Ahmadullina DR et al. Ataxia associated with anti-glutamic acid decarboxylase antibodies. Neurology, Neuropsychiatri, Psychosomatics. 2020; 12 (5): 66–70. DOI: 10.14412/ 2074-2711-2020-5-66-70 (in Russian)


