Клинический разбор в общей медицине №10 2023
Elena V. Kozhevnikova1, Marina A. Gladkikh1, Svetlana A. Rachina2, Leonid I. Dvoretsky2
1 War Veterans Hospital No3, Moscow, Russia;
2 Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russia;
3 Russian Medical Academy for Continuous Professional Education, Moscow, Russia
sshekshina@yahoo.com
Abstract
Research goal. To investigate the incidence of pressure ulcers and the structure of bacterial pathogens in young patients who have suffered severe trauma to the brain or spinal cord.
Materials and methods. The prospective observational study included 69 patients who had suffered a severe brain or spinal cord injury within 3 to 9 months prior to admission to the hospital. During the stay in the hospital, a microbiological study of biopsy specimens obtained during the surgical treatment of pressure ulcers was regularly carried out.
Results. All study participants were male. The age of the patients included in the study ranged from 19 to 52 years, mean – 31.4±7.8 years. Pressure ulcers were observed in 37 of 69 patients (53.6%). Initially, microbiological examination most often revealed Pseudomonas aeruginosa – 13 patients (35.1%), Staphylococcus aureus – 11 (29.7%), Enterococcus faecalis – 7 (18.9%), Proteus mirabilis – 5 (13.5%), Klebsiella pneumoniae – in 4 (10.8%), Acinetobacter baumannii – in 1 (2.7%). In total, 62.2% of patients were prescribed antibiotic therapy for the treatment of infected pressure ulcers, 37.8% did not receive antibiotic therapy or antibiotics were prescribed only for the purpose of perioperative antibiotic therapy (during plastic closure). Along with traditional therapy, 20 patients (54%), after necrectomy, were given a vacuum-asssisted dressing, from 1 to 7 sessions, lasting from 3 to 7 days. Against the background of the therapy, in 21 cases it was possible to achieve complete elimination of microorganisms, especially when infected with P. aeruginosa. During inpatient treatment, only two patients had the same microflora in pressure ulcers (S. aureus), other patients registered superinfection. In 15 patients accession of Enterococcus spp. was observed (1 has extremely resistant strains, 1 has polyresistant strains). In 10 patients, infection with K. pneumoniae was registered (in 3, extremely resistant strains, in 4, polyresistant, in 1, pan-resistant), in 9 – Proteus spp. (in 6 – extremely resistant strains, in 1 – pan-resistant, in 1 – multi-resistant), in 6 – S. aureus (in 4 – multi-resistant strains), in 3 – Escherichia coli (susceptible strains), in 3 – A. baumannii (in 2 – pan-resistant strains, in 1 – multi-resistant strains). During inpatient treatment, autodermoplasty was performed in 14 patients (37.8%), in 13 of these cases it was successful.
Conclusion. The results of a pilot study indicate the effectiveness of combination therapy with antibacterial drugs and VAC-therapy in young patients with infected pressure ulcers caused by severe injuries of the central nervous system.
Key words: pressure ulcers, young, infection, resistance, vacuum-asssisted-therapy, antibacterial drugs.
For citation: Bubman L.I., Topolyanskaya S.V., Lytkina K.A. et al. Microbial landscape of pressure ulcers in patients with severe injuries of the central nervous system. Clinical review for general practice. 2023; 4 (10): 51–59 (In Russ.). DOI: 10.47407/kr2023.4.10.00341
Пролежни представляют собой локальные области повреждения кожи и прилегающих структур, возникающие в результате постоянного давления и сдвига; при этом внешняя механическая нагрузка вызывает осевое давление и напряжение сдвига, которое, в свою очередь, приводит к глубокой деформации тканей и некрозу, а также порождает поверхностное трение рогового слоя кожи, нарушая барьерную функцию [1, 4]. Пролежни обычно возникают на костных выступах, где давление и деформация тканей максимальны, поэтому они наиболее часто образовываются на ягодицах, в крестцово-копчиковой и вертельной области, а также на затылке и пятках [1, 4].
Этиология пролежней является многофакторной и не ограничивается только следствием самого давления. Факторы риска возникновения пролежней включают в себя ограничение подвижности, мальнутрицию, снижение капиллярной перфузии, вегетативную дисрегуляцию и гипотензию, повышенную влажность кожи и сопутствующие заболевания [3, 5]. К группам высокого риска по возникновению пролежней относятся пациенты, перенесшие травмы спинного (СГ) и головного мозга (ГМ), а также пожилые люди [4]. Пациенты с черепно-мозговыми травмами и повреждением СМ подвержены риску развития пролежней в связи с гемодинамическими и метаболическими изменениями, неподвижностью, нарушениями чувствительности, потерей контроля над мочевым пузырем и кишечником, неадекватным питанием и неспособностью к самообслуживанию [2, 6]. Отсутствие защитной чувствительности и ограниченная подвижность у данной категории больных делают их особенно уязвимыми для развития пролежней [1, 3, 4]. Дополнительные факторы риска возникновения пролежней у пациентов с травмой СМ включают продолжительное время после травмы (более 1 года), пожилой возраст, мужской пол, квадриплегию, курение и более низкий уровень образования [7]. Распространенность пролежней у пациентов с травматическим повреждением СМ может достигать 27–46% [1, 7, 8]. По данным других авторов, частота возникновения пролежней увеличивается с течением времени после травмы, с 11,5% через 1 год после травмы до 21% через 15 лет после травмы [9].
Травматическое повреждение СМ и тяжелая черепно-мозговая травма являются серьезными проблемами общественного здравоохранения, поскольку они приводят к возникновению множества осложнений, наблюдающихся, как правило, у людей молодого возраста [1, 6]. Травма ГМ и СМ представляет собой опасную для жизни патологию с огромным непосредственным и долгосрочным влиянием на медицинские, социальные, психологические и экономические аспекты жизни пациентов, их близких и общества в целом [2]. Пролежни являются тяжелым, дорогостоящим и нередко пожизненным осложнением при этих видах травм и представляют собой одну из самых сложных клинических проблем в стационарах и серьезную задачу сестринского ухода во всем мире [2]. Недавний метаанализ показал, что 32% пациентов с травмой СМ имеют пролежни [2], а США тратят около 26,8 млрд долларов в год на их лечение [10]. В странах Африки на лечение пролежней приходится 25% всех расходов, связанных с лечением травмы СМ [1].
Хорошо известно, что бактериальная инфекция является наиболее частым осложнением, связанным с пролежнями. Инфицирование пролежней может привести к инфекциям мягких тканей и костей: флегмоне, абсцессу и остеомиелиту кости, лежащей в основании раневого ложа. Пролежни часто становятся источником бактериемии у пациентов с повреждением СМ [11]. Однако взаимосвязь между бактериальной колонизацией и заживлением пролежней изучена недостаточно. Учитывая немногочисленность данных по проблеме инфекции пролежней у молодых больных, перенесших тяжелую травму СМ или ГМ, нами предпринята попытка проведения собственного исследования, основной целью которого было изучение частоты встречаемости пролежней и структуры бактериальных возбудителей у молодых больных, перенесших тяжелую травму ГМ или СМ.
Посев клинического материала проводили в течение 2 ч после его взятия. Пробы с биоптатами засевали 5% кровяной агар, маннитол солевой агар, агар Эндо. Посевы инкубировали от 24 до 120 ч при 35–37°С. Видовая идентификация выделенных микроорганизмов проводилась с использованием биохимических тест-систем: СТАФИтест-16, НЕФЕРМтест24, Энтеротест16, ЭНТЕРО-РАПИД 24, ЭНКОККУСтест (Erba Lachema, Чехия) на микробиологическом анализаторе iEMS Reader MF (Labsistems, Финляндия).
Определение чувствительности к антимикробным препаратам (АМП) проводили полуавтоматическим методом путем определения минимальной подавляющей концентрации антибиотика на планшетах SensiLaTest MIC (Erba Lachema, Чехия) и диско-диффузионным методом с использованием дисков производства Bio-Rad, Франция. Для внутреннего контроля качества использовали штаммы Escherichia coli ATCC 25922, Staphylococcus aureus ATCC 29213, Pseudomonas aeruginosa ATCC 25853, Enterococcus faecalis ATCC 29212.
Интерпретация результатов выполнялась согласно клиническим рекомендациям «Определение чувствительности микроорганизмов к антимикробным препаратам», версия 2021-01 [12]. Спектр АМП для стафилококков включал цефокситин, ванкомицин, гентамицин, эритромицин, клиндамицин, линезолид, тетрациклин, хлорамфеникол, триметоприм/сульфаметаксозол, для энтерококков – ампициллин, ванкомицин, гентамицин (30 мкг), линезолид, тигециклин, норфлоксацин. Для грамотрицательных бактерий определялась чувствительность к ампициллину, ампициллину/ сульбактаму, амоксициллину/клавуланату, пиперациллину, пиперациллину/тазобактаму, цефотаксиму, цефтазидиму, цефепиму, меропенему, азтреонаму, амикацину, гентамицину, тигециклину, ципрофлоксацину. Чувствительность P. aeruginosa к колистину по техническим причинам не определялась. Полирезистентными считали микроорганизмы в случае их нечувствительности к ≥1 препарату 3 классов антибактериальных средств. Экстремально резистентными считали микроорганизмы в случае их нечувствительности к ≥1 препарату всех классов антибактериальных средств, за исключением 1–2, панрезистентными – при нечувствительности ко всем антибактериальным препаратам всех классов [13].
Оценивали также стандартные лабораторные показатели анализов крови (общий и биохимический) и мочи, проводили при необходимости анализ содержимого трахеобронхиального дерева.
Полученные данные анализировали с использованием программного обеспечения Statistica (версия 13). Для предоставления полученных данных использовали методы описательной статистики (среднее значение и стандартное отклонение – для количественных переменных, число и долю – для качественных переменных). При сравнении групп использовали непараметрические методы (критерий Манна–Уитни), проводили корреляционный анализ с помощью критерия Спирмена.
 В исследование включены 69 больных, перенесших тяжелую травму ГМ или СМ в сроки от 3 до 9 мес до поступления в стационар. Все участники исследования были мужчинами. Возраст включенных в исследование больных варьировал от 19 до 52 лет, в среднем составляя 31,4±7,8 года. Пролежни наблюдались у 37 из 69 (53,6%) пациентов. В группе больных с наличием пролежней средний возраст составлял 31,6±8,7 года, без пролежней – 31,1±6,8 года (р=0,9). Достоверных различий по изученным лабораторным и клиническим параметрам между группами больных с пролежнями и без пролежней не обнаружено. Средний период наблюдения за больными составил 112 дней.
В исследование включены 69 больных, перенесших тяжелую травму ГМ или СМ в сроки от 3 до 9 мес до поступления в стационар. Все участники исследования были мужчинами. Возраст включенных в исследование больных варьировал от 19 до 52 лет, в среднем составляя 31,4±7,8 года. Пролежни наблюдались у 37 из 69 (53,6%) пациентов. В группе больных с наличием пролежней средний возраст составлял 31,6±8,7 года, без пролежней – 31,1±6,8 года (р=0,9). Достоверных различий по изученным лабораторным и клиническим параметрам между группами больных с пролежнями и без пролежней не обнаружено. Средний период наблюдения за больными составил 112 дней.
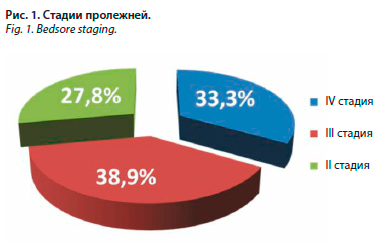
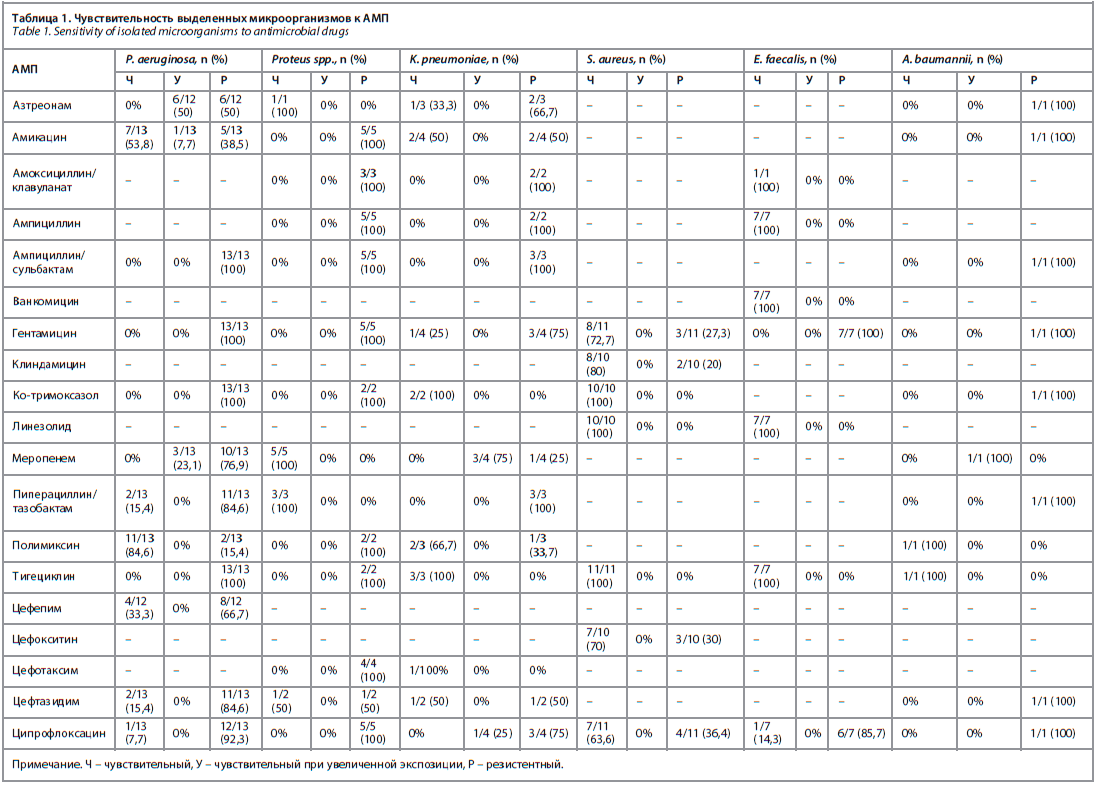
У 17 (45,9%) пациентов с пролежнями отмечалась одна локализация пролежня, у 7 (18,9%) – две локализации, у 13 (35,1%) больных – более двух. Пролежни наиболее часто локализовались в крестцово-копчиковой области – у 28 (75,7%) пациентов, реже – в вертельной области – у 14 (37,8%), на голенях – у 6 (16,2%), на стопах в целом – у 13 (35,1%), в пяточных областях – у 7 (18,9%). При поступлении у 70% больных отмечались наиболее тяжелые стадии пролежней (рис. 1) и лишь у 1 пациента пролежень был в стадии эпителизации. Клинические признаки локальной инфекции в области пролежня отсутствовали лишь у 3 пациентов. Исходно при МБИ наиболее часто выявлялись P. aeruginosa – 13 (35,1%) больных, S. aureus – 11 (29,7%), E. faecalis – 7 (18,9%), Proteus mirabilis – 5 (13,5%), реже Klebsiella pneumoniae – у 4 (10,8%) и Acinetobacter baumannii – у 1 (2,7%). У 2 (5,4%) пациентов роста микроорганизмов при МБИ содержимого пролежней не обнаружено. Результаты определения чувствительности выделенных при МБИ содержимого пролежней микроорганизмов к основным АМП приведены в табл. 1.
Распространенность резистентных штаммов микроорганизмов представлена в табл. 2.
Антибактериальная терапия (АБТ) для лечения инфицированных пролежней назначалась 62,2% больных, наиболее часто – тигециклин (рис. 2). В общей сложности 9 пациентов, все из которых находились в отделении реанимации, получали множество различных антибактериальных препаратов в комбинациях, не столько по поводу инфекций пролежней, сколько в связи с инфекциями бронхо-легочной системы, ГМ и кровотока. У 14 (37,8%) больных АБТ не проводилась или антибиотики назначались только с целью периоперационной АБТ (при проведении пластического закрытия).
Некрэктомия проведена у 21 (56,7%) больного; среднее число некрэктомий составило 2,75±3,2 (медиана – 1), максимальное число некрэктомий – 10. Наряду с традиционной консервативной терапией 20 (54%) больным после некрэктомии была наложена вакуум-ассистированная повязка (VAC), от 1 до 7 сеансов, продолжительностью от 3 до 7 дней. У 17 пациентов происходила неоднократная смена VAC (максимально – 7 раз, в среднем – 2 раза). У 7 пациентов с VAC антибактериальные препараты не применялись совсем или назначались только с целью периоперационной АБТ (при проведении пластического закрытия).
Результаты повторных МБИ содержимого пролежней были доступны у 24 больных. Во время стационарного лечения лишь у двух больных оставалась та же микрофлора в пролежнях (S. aureus), у других пациентов с серией последующих МБИ зарегистрирована суперинфекция (рис. 3). У 15 больных наблюдалось присоединение Enterococcus spp., у 10 – K. pneumoniae, у 9 – Proteus spp. (7 – P. mirabilis, 2 – P. vulgaris). У 6 пациентов в ходе наблюдения обнаружено инфицирование
S. aureus, у 3 – E. coli, еще у 3 – A. baumannii.
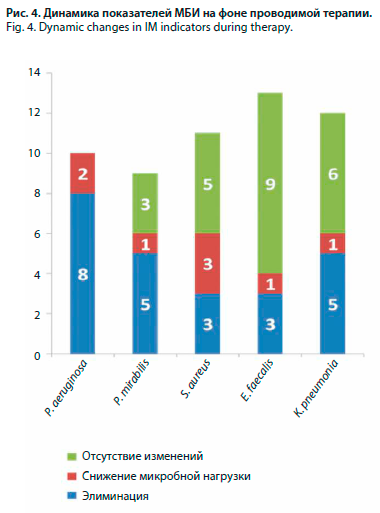 На фоне проводимой терапии у пациентов с инфицированием пролежней P. aeruginosa достигнута полная элиминация возбудителя или выраженное снижение микробной нагрузки (рис. 4). В случае инфицирования пролежней P. mirabilis в ходе наблюдения у 55,5% больных удалось добиться элиминации возбудителя, у 33,3% отсутствовали изменения в количественном составе, однако у этих пациентов был лишь минимальный рост (со среды накопления); см. рис. 4.
На фоне проводимой терапии у пациентов с инфицированием пролежней P. aeruginosa достигнута полная элиминация возбудителя или выраженное снижение микробной нагрузки (рис. 4). В случае инфицирования пролежней P. mirabilis в ходе наблюдения у 55,5% больных удалось добиться элиминации возбудителя, у 33,3% отсутствовали изменения в количественном составе, однако у этих пациентов был лишь минимальный рост (со среды накопления); см. рис. 4.
В двух случаях инфекции A. baumannii в ходе наблюдения роста микроорганизма не обнаружено. У более чем 1/2 больных с инфицированием пролежня S. aureus в последующем роста микроорганизмов не обнаружено или зарегистрировано снижение микробной нагрузки, у оставшихся пациентов отмечалось сохранение микроорганизмов в пролежне, но в минимальных количествах («со среды накопления»). В 5 случаях инфекции K. pneumoniae в ходе дальнейшего наблюдения зарегистрирована элиминация возбудителя, у оставшихся больных сохранялся минимальный рост микроорганизмов (см. рис. 3). При инфицировании пролежня E. faecalis у 9 больных сохранялся минимальный рост, у трех достигнута полная элиминация возбудителя (см. рис. 4).
В ходе стационарного лечения пластическое закрытие пролежней проведено у 14 (37,8%) больных, в 13 из этих случаев – успешно. У 8 из этих пациентов антибактериальные препараты не применялись совсем или использовались только с целью периоперационной АБТ (при проведении пластического закрытия). Всего 5 больных, перенесших пластическое закрытие пролежней, в последующем переведены в другие стационары, остальные продолжают стационарное лечение. Рецидив пролежня после пластики отмечен лишь у одного больного.
В изученной группе пациентов пролежни наиболее часто возникали в крестцово-копчиковой и вертельной области. Аналогично нашим данным, в других работах с участием больных, перенесших тяжелую травму СМ, основным местом расположения пролежней также была крестцовая область [14, 15]. Хотя при тяжелой травме СМ пролежни могут развиваться в любом месте, они все-таки имеют склонность к определенным зонам, что, как правило, зависит от сроков травмы. В ранние сроки после травмы наиболее частыми анатомическими областями возникновения пролежней являются крестец, вертельные области, седалищные кости и пяточные выступы. У пациентов с хронической травмой СМ наиболее распространенной зоной пролежней является таз, однако у людей с повышенной спастичностью пролежни могут развиваться и в области коленного сустава, медиального выступа большеберцовой кости и медиальной лодыжки [11].
По данным первого МБИ содержимого пролежней, у наших больных наиболее часто выявлялись P. aeruginosa, S. aureus, E. faecalis и P. mirabilis. Аналогично нашим результатам, в обзоре A. Dana и соавт., проанализировавших данные 11 исследований, посвященных бактериологии пролежней у пациентов с тяжелой травмой СМ, наиболее частыми микроорганизмами в пролежнях были S. aureus, P. mirabilis, P. aeruginosa и
E. faecalis [11]. Напротив, в иранском исследовании по изучению микробного состава в пролежнях больных с травмой СМ наиболее частым микроорганизмом, колонизировавшим, прежде всего, мелкие и поверхностные пролежни, была E. coli, в то время как более крупные очаги повреждения чаще были инфицированы S. epidermidis [15]. В этой работе лишь у 7,3% пациентов при МБИ содержимого пролежней не обнаружено роста микроорганизмов, тогда как в нашей группе больных – у 5,4% [15]. В исследовании I. Braga и соавт. пролежни были инфицированы в 83,3% случаев, а наиболее часто выделяемыми микроорганизмами стали Enterobacteriaceae (49%), за которыми следовали S. aureus (28%) и грамотрицательные бактерии (23%), в основном
P. aeruginosa и Acinetobacter spp. [16]. Из-за повреждения кожи пролежни могут быть колонизированы микробной флорой, которая может происходить из прилегающих участков кожи, желудочно-кишечного тракта и слизистой оболочки мочеполовой системы. У людей с травмой СМ более вероятно обнаружение грамотрицательных микроорганизмов; по данным ряда авторов, грамотрицательные кишечные микроорганизмы и энтерококки составляют более 1/2 бактериальных изолятов у мужчин с травмой СМ [11].
Однако бактериальные составляющие пролежней у людей с травмами СМ весьма разнообразны и не ограничиваются только грамотрицательными микроорганизмами [11]. Микробиота пролежней обычно является полимикробной и сложной и может включать в себя как грамотрицательные, так и полирезистентные грамположительные бактерии, как аэробы, так и ана-эробы [11, 16]. У многих больных пролежни содержат несколько микроорганизмов; по данным некоторых исследователей, у пациентов с пролежнями на фоне травмы СМ выявляется в среднем 1,2–5,8 микроорганизма на культуру [11]. В нашем исследовании лишь у
3 больных обнаружен один микроорганизм в пролежнях (во всех случаях это был S. aureus), у других больных была полимикробная флора.
Пролежни могут быть резервуарами для устойчивых микроорганизмов, а также становиться источником бактериемии у госпитализированных пациентов. В исследовании I. Braga и соавт. в 74% случаев в пролежнях обнаружена смешанная флора с преобладанием полирезистентных бактерий, включая K. pneumoniae (85%), E. coli (25%), P. aeruginosa (100%), Acinetobacter (60%) и метициллин-резистентный S. aureus (60,7%) [16].
В этой работе 82,9% бактерий, выявленных в инфицированных пролежнях, были полирезистентными [16].
В нашей группе больных в 92,3% случаев выявлены резистентные штаммы P. aeruginosa, при инфицировании P. mirabilis и A. baumannii – в 100%, K. pneumonia – в 50%. По данным различных исследований микроорганизмы, проникающие в пролежни, обладают множественной лекарственной устойчивостью, и их паттерны чувствительности к противомикробным препаратам могут сильно отличаться от чувствительности нормальной флоры [15, 16].
По нашим данным в 1/3 случаев обнаружено инфицирование пролежней S. aureus. В других исследованиях с участием пациентов с травмами СМ также обнаружено преобладание S. aureus, в том числе метициллин-резистентного [11]. Лица с травмами СМ подвержены повышенному риску инфицирования этим микроорганизмом, поскольку им часто требуется длительное пребывание в стационарах; кроме того, их могут регулярно переводить из одного лечебного или реабилитационного учреждения в другое, что может приводить к внутрибольничной передаче инфекции [11]. При этом колонизация пролежней S. aureus может сохраняться длительно, несмотря на АБТ и другое лечение [11]. В нашей работе у 6 пациентов в ходе наблюдения обнаружено инфицирование S. aureus, и к концу наблюдения в 45,5% случаев оставался тот же количественный состав данного микроорганизма в пролежнях.
На бактериальный состав пролежней может влиять и само состояние раны, глубина некроза, вовлечение в патологический процесс прилежащей кости, сухость или избыточная влажность. Так, по некоторым данным, соотношение анаэробных и аэробных бактерий у больных с пролежнями коррелирует с объемом некроза тканей, а присутствие анаэробов значительно уменьшается по мере заживления язвы. E. coli, Proteus spp. и Streptococcus spp. были наиболее распространенными микроорганизмами в пролежнях с некротизированной тканью, тогда как P. aeruginosa и S. aureus чаще всего выделялись из заживающих ран [11]. В нашей группе больных, напротив, исходно наиболее часто выявлялись P. aeruginosa и S. aureus, а по мере заживления –
E. faecalis.
В исследовании по изучению эволюции микробиоты пролежней исходно наиболее часто выявлялись Staphylococcus spp. (24,38%), Streptococcus (14,86%), Enterococcus (5,2%), Proteus (4,66%), Escherichia (3,96%) и Pseudomonas (3,96%), а к концу наблюдения (через 28 дней) произошло наибольшее увеличение распространенности Staphylococcus, Streptococcus и Enterococcus spp. [17]. Аналогично этим данным, в нашей группе больных тоже максимально увеличилась распространенность Enterococcus и Staphylococcus spp. [16]. Однако в этом исследовании была очень низкая доля инфекции Pseudomonas (3,96%), по сравнению с полученными нами результатами (35,1%) [17]. В указанном исследовании через 28 дней зарегистрирована колонизация пролежней Proteus spp. только в случае отсутствия динамики в состоянии раны, тогда как в пролежнях с положительной динамикой произошло значительное уменьшение данного микроорганизма [17]. Среди наших пациентов Proteus также длительно сохранялся, как правило, в обширных и глубоких пролежнях с выраженными клиническими и лабораторными признаками инфекции кожи и мягких тканей.
В нашем исследовании наряду с традиционной терапией у более чем 12 больных применялась VAC- cистема, способствующая заживлению ран, в основе которой лежит принцип создания отрицательного давления в ране [18]. VAC-система состоит из сетчатой полиуретановой или поливиниловой губки, адгезивного покрытия, источника вакуума с емкостью для сбора жидкости. При создании этой системой отрицательного давления в ране стимулируется деление клеток и пролиферация грануляционной ткани. Согласно результатам клинических и лабораторных исследований VAC-система способствует удалению интерстициальной жидкости из ран, уменьшению бактериальной колонизации и увеличению васкуляризации раны [18]. Хорошо известно, что в пролежнях, как и в других открытых ранах, наблюдается бактериальное заражение.
В свою очередь, микроорганизмы способны продуцировать факторы вирулентности (например, экзотоксины, эндотоксины и матриксные металлопротеиназы), которые оказывают неблагоприятное воздействие на заживление ран. Они уменьшают способность раны переходить в следующую стадию и останавливают ее в фазе хронического воспаления. Следовательно, удаление цитокинов с помощью VAC-системы и снижение бактериальной бионагрузки могут улучшить заживление трудно поддающихся лечению ран [19].
Однако результаты клинических исследований, изучавших микробиоту пролежней на фоне применения VAC-систем, достаточно противоречивы. Так, в исследовании C. Mouës и соавт. при использовании VAC-систем не было отличий в общей количественной бактериальной нагрузке по сравнению со стандартной терапией. Однако при использовании VAC-систем зарегистрировано значительное уменьшение грамотрицательных бактерий, тогда как наблюдалось значительное увеличение S. aureus [20]. Аналогичные результаты получены и в нашей работе. В исследовании A. Saadi и соавт. на фоне применения VAC-системы в 33% случаев достигнута полная элиминация микроорганизмов [21]. В исландском исследовании у тяжелых больных с инфицированием грудины после операции на сердце ранняя реинфекция обнаружена в 35% случаев в группе традиционного лечения и в 5% – в группе VAC-терапии [22]. T. Weed и соавт., изучавшие степень бактериальной бионагрузки при терапии острых и хронических ран (включая пролежни) отрицательным давлением, показали, что при применении VAC-системы в 43% случаев наблюдалось увеличение бактериальной бионагрузки, в 22% – снижение и в 35% динамика отсутствовала [23]. В этой работе у 12% больных на фоне применения VAC-системы отмечено увеличение размеров раны или усугубление некротических изменений [23]. Напротив, среди наших пациентов на фоне применения VAC-систем ни у кого не отмечено отрицательной динамики, лишь в 3 случаях отсутствовала положительная динамика или она была минимальной; все эти больные находились в крайне тяжелом состоянии в отделении реанимации и интенсивной терапии. У всех остальных пациентов наблюдалась выраженная положительная динамика в состоянии пролежней, вплоть до их полного заживления.
Несмотря на полученные клинически значимые результаты, в настоящем исследовании имеется ряд ограничений. Исследование носило несравнительный и нерандомизированный характер, в связи с чем нельзя было точно оценить вклад АБТ и применения VAC-систем в элиминацию микроорганизмов. Отсутствовало также длительное наблюдение, что не позволяет окончательно оценить долгосрочные исходы применения VAC-систем и пластического закрытия пролежней.
У нескольких, более легких, больных не удалось провести повторные МБИ содержимого пролежней.
обусловленными тяжелыми травмами ЦНС. Необходимы дальнейшие исследования по изучению роли VAC при лечении пролежней у больных молодого возраста с травмами ЦНС.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Бубман Леонид Игоревич – зав. 7 хирургическим отд-нием, ГБУЗ ГВВ №3. E-mail: bubmanleo@gmail.com; ORCID: 0000-0002-4195-3188
Leonid I. Bubman – Head of the 7 Surgical Department, War Veterans Hospital No3. E-mail: bubmanleo@gmail.com; ORCID: 0000-0002-4195-3188
Тополянская Светлана Викторовна – д-р мед. наук, врач-терапевт, ГБУЗ ГВВ №3, доц. каф. госпитальной терапии №2, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: sshekshina@yahoo.com; ORCID: 0000-0002-4131-8432
Svetlana V. Topolynskaya – Dr. Sci. (Med.), War Veterans Hospital No3, Sechenov First Moscow State Medical University (Sechenov University). E-mail: sshekshina@yahoo.com; ORCID: 0000-0002-4131-8432
Лыткина Каринэ Арнольдовна – канд. мед. наук, зам. глав. врача по терапии, ГБУЗ ГВВ №3. E-mail: lytkina.k@mail.ru; ORCID: 0000-0001-9647-7492
Karine A. Lytkina – Cand. Sci. (Med.), War Veterans Hospital No3. E-mail: lytki-na.k@mail.ru; ORCID: 0000-0001-9647-7492
Мелконян Георгий Геннадьевич – д-р мед. наук, проф., глав. врач, ГБУЗ ГВВ №3; должность, ФГБОУ ДПО РМАНПО. E-mail: gvv3@zdrav.mos.ru; ORCID: 0000-0002-4021-5044
Georgiy G. Melkonyan – Dr. Sci. (Med.), Prof., War Veterans Hospital No3, Russian Medical Academy for Continuous Professional Education. E-mail: gvv3@zdrav.mos.ru; ORCID: 0000-0002-4021-5044
Кожевникова Елена Вениаминовна – врач-бактериолог, ГБУЗ ГВВ №3
Elena V. Kozhevnikova – bacteriologist, War Veterans Hospital No3
Гладких Марина Александровна – биолог, ГБУЗ ГВВ №3
Marina A. Gladkikh – biologist, War Veterans Hospital No3
Рачина Светлана Александровна – д-р мед. наук, проф., зав. каф. госпитальной терапии №2, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: svetlana.ratchina@antibiotic.ru; ORCID: 0000-0002-3329-7846
Svetlana A. Rachina – Dr. Sci. (Med.), Prof., Sechenov First Moscow State Medical University (Sechenov University). E-mail: svetlana.ratchina@antibiotic.ru; ORCID: 0000-0002-3329-7846
Дворецкий Леонид Иванович – д-р мед. наук, проф, проф. каф. госпитальной терапии №2, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: dvoretski@mail.ru; ORCID: 0000-0003-3186-0102
Leonid I. Dvoretsky – Dr. Sci. (Med.), Prof., Sechenov First Moscow State Medical University (Sechenov University). E-mail: dvoretski@mail.ru; ORCID: 0000-0003-3186-0102
Поступила в редакцию: 16.10.2023
Поступила после рецензирования: 02.11.2023
Принята к публикации: 09.11.2023
Received: 16.10.2023
Revised: 02.11.2023
Accepted: 09.11.2023
Клинический разбор в общей медицине №10 2023
Микробный пейзаж пролежней у больных с тяжелыми травмами центральной нервной системы
Номера страниц в выпуске:51-59
Аннотация
Цель исследования. Изучить частоту встречаемости пролежней и структуру бактериальных возбудителей у молодых больных, перенесших тяжелую травму головного или спинного мозга.
Материалы и методы. В проспективное наблюдательное исследование включены 69 больных, перенесших тяжелую травму головного или спинного мозга в сроки от 3 до 9 мес до поступления в стационар. Во время пребывания в стационаре регулярно проводилось микробиологическое исследование биоптатов, полученных при хирургической обработке пролежней.
Результаты. Все участники исследования были мужчинами. Возраст включенных в исследование больных варьировал от 19 до 52 лет, в среднем составляя 31,4±7,8 года. Пролежни наблюдались у 37 из 69 пациентов (53,6%). Исходно при микробиологическом исследовании наиболее часто выявлялись Pseudomonas aeruginosa – 13 больных (35,1%), Staphylococcus aureus – 11 (29,7%), Enterococcus faecalis – 7 (18,9%), Proteus mirabilis – 5 (13,5%), Klebsiella pneumoniae – 4 (10,8%), Acinetobacter baumannii – 1 (2,7%). Всего 62,2% больных для лечения инфицированных пролежней назначалась антибактериальная терапия, у 37,8% антибактериальная терапия не проводилась или антибиотики назначались только с целью периоперационной антибиотикотерапии (при проведении пластического закрытия). Наряду с традиционной терапией 20 (54%) больным, после некрэктомии, была наложена вакуум-ассистированная повязка, от 1 до 7 сеансов, продолжительностью от 3 до 7 дней. На фоне проводимой терапии в 21 случае удалось достигнуть полной элиминации микроорганизмов, особенно при инфицировании P. aeruginosa. Во время стационарного лечения лишь у двух больных оставалась та же микрофлора в пролежнях (S. aureus), у других пациентов зарегистрирована суперинфекция. У 15 больных наблюдалось присоединение Enterococcus spp. (у 1 – экстремально резистентные штаммы, у 1 – полирезистентные). У 10 пациентов зарегистрировано инфицирование K. pneumoniae (у 3 – экстремально резистентные штаммы, у 4 – полирезистентные, у 1 – панрезистентные), у 9 – Proteus spp.
(у 6 – экстремально резистентные штаммы, у 1 – панрезистентные, у 1 – полирезистентные), у 6 – S. aureus (у 4 – полирезистентные штаммы), у 3 – Escherichia coli (чувствительные штаммы), у 3 – A. baumannii (у 2 – панрезистентные штаммы, у 1 – полирезистентные). В ходе стационарного лечения аутодермопластика проведена у 14 (37,8%) больных, в 13 из этих случаев – успешно.
Заключение. Результаты пилотного исследования свидетельствуют об эффективности комбинированной терапии антибактериальными препаратами в сочетании с вакуум-ассистированной повязкой у молодых больных с инфицированными пролежнями, обусловленными тяжелыми травмами центральной нервной системы.
Ключевые слова: пролежни, молодые, инфицирование, резистентность, вакуум-ассистированные повязки, антибактериальные препараты.
Для цитирования: Бубман Л.И., Тополянская С.В., Лыткина К.А. и др. Микробный пейзаж пролежней у больных с тяжелыми травмами центральной нервной системы. Клинический разбор в общей медицине. 2023; 4 (10): 51–59. DOI: 10.47407/kr2023.4.10.00341
Цель исследования. Изучить частоту встречаемости пролежней и структуру бактериальных возбудителей у молодых больных, перенесших тяжелую травму головного или спинного мозга.
Материалы и методы. В проспективное наблюдательное исследование включены 69 больных, перенесших тяжелую травму головного или спинного мозга в сроки от 3 до 9 мес до поступления в стационар. Во время пребывания в стационаре регулярно проводилось микробиологическое исследование биоптатов, полученных при хирургической обработке пролежней.
Результаты. Все участники исследования были мужчинами. Возраст включенных в исследование больных варьировал от 19 до 52 лет, в среднем составляя 31,4±7,8 года. Пролежни наблюдались у 37 из 69 пациентов (53,6%). Исходно при микробиологическом исследовании наиболее часто выявлялись Pseudomonas aeruginosa – 13 больных (35,1%), Staphylococcus aureus – 11 (29,7%), Enterococcus faecalis – 7 (18,9%), Proteus mirabilis – 5 (13,5%), Klebsiella pneumoniae – 4 (10,8%), Acinetobacter baumannii – 1 (2,7%). Всего 62,2% больных для лечения инфицированных пролежней назначалась антибактериальная терапия, у 37,8% антибактериальная терапия не проводилась или антибиотики назначались только с целью периоперационной антибиотикотерапии (при проведении пластического закрытия). Наряду с традиционной терапией 20 (54%) больным, после некрэктомии, была наложена вакуум-ассистированная повязка, от 1 до 7 сеансов, продолжительностью от 3 до 7 дней. На фоне проводимой терапии в 21 случае удалось достигнуть полной элиминации микроорганизмов, особенно при инфицировании P. aeruginosa. Во время стационарного лечения лишь у двух больных оставалась та же микрофлора в пролежнях (S. aureus), у других пациентов зарегистрирована суперинфекция. У 15 больных наблюдалось присоединение Enterococcus spp. (у 1 – экстремально резистентные штаммы, у 1 – полирезистентные). У 10 пациентов зарегистрировано инфицирование K. pneumoniae (у 3 – экстремально резистентные штаммы, у 4 – полирезистентные, у 1 – панрезистентные), у 9 – Proteus spp.
(у 6 – экстремально резистентные штаммы, у 1 – панрезистентные, у 1 – полирезистентные), у 6 – S. aureus (у 4 – полирезистентные штаммы), у 3 – Escherichia coli (чувствительные штаммы), у 3 – A. baumannii (у 2 – панрезистентные штаммы, у 1 – полирезистентные). В ходе стационарного лечения аутодермопластика проведена у 14 (37,8%) больных, в 13 из этих случаев – успешно.
Заключение. Результаты пилотного исследования свидетельствуют об эффективности комбинированной терапии антибактериальными препаратами в сочетании с вакуум-ассистированной повязкой у молодых больных с инфицированными пролежнями, обусловленными тяжелыми травмами центральной нервной системы.
Ключевые слова: пролежни, молодые, инфицирование, резистентность, вакуум-ассистированные повязки, антибактериальные препараты.
Для цитирования: Бубман Л.И., Тополянская С.В., Лыткина К.А. и др. Микробный пейзаж пролежней у больных с тяжелыми травмами центральной нервной системы. Клинический разбор в общей медицине. 2023; 4 (10): 51–59. DOI: 10.47407/kr2023.4.10.00341
Microbial landscape of pressure ulcers in patients with severe injuries of the central nervous system
Leonid I. Bubman1, Svetlana V. Topolyanskaya1,2, Karine A. Lytkina1, Georgiy G. Melkonyan1,3,Elena V. Kozhevnikova1, Marina A. Gladkikh1, Svetlana A. Rachina2, Leonid I. Dvoretsky2
1 War Veterans Hospital No3, Moscow, Russia;
2 Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russia;
3 Russian Medical Academy for Continuous Professional Education, Moscow, Russia
sshekshina@yahoo.com
Abstract
Research goal. To investigate the incidence of pressure ulcers and the structure of bacterial pathogens in young patients who have suffered severe trauma to the brain or spinal cord.
Materials and methods. The prospective observational study included 69 patients who had suffered a severe brain or spinal cord injury within 3 to 9 months prior to admission to the hospital. During the stay in the hospital, a microbiological study of biopsy specimens obtained during the surgical treatment of pressure ulcers was regularly carried out.
Results. All study participants were male. The age of the patients included in the study ranged from 19 to 52 years, mean – 31.4±7.8 years. Pressure ulcers were observed in 37 of 69 patients (53.6%). Initially, microbiological examination most often revealed Pseudomonas aeruginosa – 13 patients (35.1%), Staphylococcus aureus – 11 (29.7%), Enterococcus faecalis – 7 (18.9%), Proteus mirabilis – 5 (13.5%), Klebsiella pneumoniae – in 4 (10.8%), Acinetobacter baumannii – in 1 (2.7%). In total, 62.2% of patients were prescribed antibiotic therapy for the treatment of infected pressure ulcers, 37.8% did not receive antibiotic therapy or antibiotics were prescribed only for the purpose of perioperative antibiotic therapy (during plastic closure). Along with traditional therapy, 20 patients (54%), after necrectomy, were given a vacuum-asssisted dressing, from 1 to 7 sessions, lasting from 3 to 7 days. Against the background of the therapy, in 21 cases it was possible to achieve complete elimination of microorganisms, especially when infected with P. aeruginosa. During inpatient treatment, only two patients had the same microflora in pressure ulcers (S. aureus), other patients registered superinfection. In 15 patients accession of Enterococcus spp. was observed (1 has extremely resistant strains, 1 has polyresistant strains). In 10 patients, infection with K. pneumoniae was registered (in 3, extremely resistant strains, in 4, polyresistant, in 1, pan-resistant), in 9 – Proteus spp. (in 6 – extremely resistant strains, in 1 – pan-resistant, in 1 – multi-resistant), in 6 – S. aureus (in 4 – multi-resistant strains), in 3 – Escherichia coli (susceptible strains), in 3 – A. baumannii (in 2 – pan-resistant strains, in 1 – multi-resistant strains). During inpatient treatment, autodermoplasty was performed in 14 patients (37.8%), in 13 of these cases it was successful.
Conclusion. The results of a pilot study indicate the effectiveness of combination therapy with antibacterial drugs and VAC-therapy in young patients with infected pressure ulcers caused by severe injuries of the central nervous system.
Key words: pressure ulcers, young, infection, resistance, vacuum-asssisted-therapy, antibacterial drugs.
For citation: Bubman L.I., Topolyanskaya S.V., Lytkina K.A. et al. Microbial landscape of pressure ulcers in patients with severe injuries of the central nervous system. Clinical review for general practice. 2023; 4 (10): 51–59 (In Russ.). DOI: 10.47407/kr2023.4.10.00341
Введение
Пролежни – одна из немаловажных проблем здравоохранения, оказывающая значительное влияние как на самого больного и его близких, так и на систему оказания медицинской помощи в целом [1, 2]. Пролежни имеют серьезные последствия и существенно влияют на психологическое, физическое, социальное благополучие и качество жизни пациентов, приводят к повторным госпитализациям и удлинению сроков стационарного лечения, увеличению риска внутрибольничной инфекции, множественным операциям, тяжелым осложнениям, инвалидности и ранней смертности [1–3]. По оценкам Центров по контролю и профилактике заболеваний в США, около 2,5 млн человек ежегодно страдают от пролежней и примерно 60 тыс. больных умирают [3]. Пролежни возлагают значительное бремя расходов на системы здравоохранения [3]. Так, экономические затраты, связанные с лечением пролежней в США, составляют от 6 до 15 млрд долларов в год [1].Пролежни представляют собой локальные области повреждения кожи и прилегающих структур, возникающие в результате постоянного давления и сдвига; при этом внешняя механическая нагрузка вызывает осевое давление и напряжение сдвига, которое, в свою очередь, приводит к глубокой деформации тканей и некрозу, а также порождает поверхностное трение рогового слоя кожи, нарушая барьерную функцию [1, 4]. Пролежни обычно возникают на костных выступах, где давление и деформация тканей максимальны, поэтому они наиболее часто образовываются на ягодицах, в крестцово-копчиковой и вертельной области, а также на затылке и пятках [1, 4].
Этиология пролежней является многофакторной и не ограничивается только следствием самого давления. Факторы риска возникновения пролежней включают в себя ограничение подвижности, мальнутрицию, снижение капиллярной перфузии, вегетативную дисрегуляцию и гипотензию, повышенную влажность кожи и сопутствующие заболевания [3, 5]. К группам высокого риска по возникновению пролежней относятся пациенты, перенесшие травмы спинного (СГ) и головного мозга (ГМ), а также пожилые люди [4]. Пациенты с черепно-мозговыми травмами и повреждением СМ подвержены риску развития пролежней в связи с гемодинамическими и метаболическими изменениями, неподвижностью, нарушениями чувствительности, потерей контроля над мочевым пузырем и кишечником, неадекватным питанием и неспособностью к самообслуживанию [2, 6]. Отсутствие защитной чувствительности и ограниченная подвижность у данной категории больных делают их особенно уязвимыми для развития пролежней [1, 3, 4]. Дополнительные факторы риска возникновения пролежней у пациентов с травмой СМ включают продолжительное время после травмы (более 1 года), пожилой возраст, мужской пол, квадриплегию, курение и более низкий уровень образования [7]. Распространенность пролежней у пациентов с травматическим повреждением СМ может достигать 27–46% [1, 7, 8]. По данным других авторов, частота возникновения пролежней увеличивается с течением времени после травмы, с 11,5% через 1 год после травмы до 21% через 15 лет после травмы [9].
Травматическое повреждение СМ и тяжелая черепно-мозговая травма являются серьезными проблемами общественного здравоохранения, поскольку они приводят к возникновению множества осложнений, наблюдающихся, как правило, у людей молодого возраста [1, 6]. Травма ГМ и СМ представляет собой опасную для жизни патологию с огромным непосредственным и долгосрочным влиянием на медицинские, социальные, психологические и экономические аспекты жизни пациентов, их близких и общества в целом [2]. Пролежни являются тяжелым, дорогостоящим и нередко пожизненным осложнением при этих видах травм и представляют собой одну из самых сложных клинических проблем в стационарах и серьезную задачу сестринского ухода во всем мире [2]. Недавний метаанализ показал, что 32% пациентов с травмой СМ имеют пролежни [2], а США тратят около 26,8 млрд долларов в год на их лечение [10]. В странах Африки на лечение пролежней приходится 25% всех расходов, связанных с лечением травмы СМ [1].
Хорошо известно, что бактериальная инфекция является наиболее частым осложнением, связанным с пролежнями. Инфицирование пролежней может привести к инфекциям мягких тканей и костей: флегмоне, абсцессу и остеомиелиту кости, лежащей в основании раневого ложа. Пролежни часто становятся источником бактериемии у пациентов с повреждением СМ [11]. Однако взаимосвязь между бактериальной колонизацией и заживлением пролежней изучена недостаточно. Учитывая немногочисленность данных по проблеме инфекции пролежней у молодых больных, перенесших тяжелую травму СМ или ГМ, нами предпринята попытка проведения собственного исследования, основной целью которого было изучение частоты встречаемости пролежней и структуры бактериальных возбудителей у молодых больных, перенесших тяжелую травму ГМ или СМ.
Материалы и методы
Данная работа выполнена на клинической базе Госпиталя для ветеранов войн №3 (г. Москва) и представляла собой проспективное наблюдательное исследование. В исследование включали больных моложе 60 лет, перенесших тяжелую травму центральной нервной системы (ЦНС). Во время пребывания в стационаре регулярно проводилось микробиологическое исследование (МБИ) биоптатов, полученных при хирургической обработке пролежней, с посевом на питательные среды, идентификацией микроорганизмов в соответствии со стандартными методами и процедурами.Посев клинического материала проводили в течение 2 ч после его взятия. Пробы с биоптатами засевали 5% кровяной агар, маннитол солевой агар, агар Эндо. Посевы инкубировали от 24 до 120 ч при 35–37°С. Видовая идентификация выделенных микроорганизмов проводилась с использованием биохимических тест-систем: СТАФИтест-16, НЕФЕРМтест24, Энтеротест16, ЭНТЕРО-РАПИД 24, ЭНКОККУСтест (Erba Lachema, Чехия) на микробиологическом анализаторе iEMS Reader MF (Labsistems, Финляндия).
Определение чувствительности к антимикробным препаратам (АМП) проводили полуавтоматическим методом путем определения минимальной подавляющей концентрации антибиотика на планшетах SensiLaTest MIC (Erba Lachema, Чехия) и диско-диффузионным методом с использованием дисков производства Bio-Rad, Франция. Для внутреннего контроля качества использовали штаммы Escherichia coli ATCC 25922, Staphylococcus aureus ATCC 29213, Pseudomonas aeruginosa ATCC 25853, Enterococcus faecalis ATCC 29212.
Интерпретация результатов выполнялась согласно клиническим рекомендациям «Определение чувствительности микроорганизмов к антимикробным препаратам», версия 2021-01 [12]. Спектр АМП для стафилококков включал цефокситин, ванкомицин, гентамицин, эритромицин, клиндамицин, линезолид, тетрациклин, хлорамфеникол, триметоприм/сульфаметаксозол, для энтерококков – ампициллин, ванкомицин, гентамицин (30 мкг), линезолид, тигециклин, норфлоксацин. Для грамотрицательных бактерий определялась чувствительность к ампициллину, ампициллину/ сульбактаму, амоксициллину/клавуланату, пиперациллину, пиперациллину/тазобактаму, цефотаксиму, цефтазидиму, цефепиму, меропенему, азтреонаму, амикацину, гентамицину, тигециклину, ципрофлоксацину. Чувствительность P. aeruginosa к колистину по техническим причинам не определялась. Полирезистентными считали микроорганизмы в случае их нечувствительности к ≥1 препарату 3 классов антибактериальных средств. Экстремально резистентными считали микроорганизмы в случае их нечувствительности к ≥1 препарату всех классов антибактериальных средств, за исключением 1–2, панрезистентными – при нечувствительности ко всем антибактериальным препаратам всех классов [13].
Оценивали также стандартные лабораторные показатели анализов крови (общий и биохимический) и мочи, проводили при необходимости анализ содержимого трахеобронхиального дерева.
Полученные данные анализировали с использованием программного обеспечения Statistica (версия 13). Для предоставления полученных данных использовали методы описательной статистики (среднее значение и стандартное отклонение – для количественных переменных, число и долю – для качественных переменных). При сравнении групп использовали непараметрические методы (критерий Манна–Уитни), проводили корреляционный анализ с помощью критерия Спирмена.
Результаты
 В исследование включены 69 больных, перенесших тяжелую травму ГМ или СМ в сроки от 3 до 9 мес до поступления в стационар. Все участники исследования были мужчинами. Возраст включенных в исследование больных варьировал от 19 до 52 лет, в среднем составляя 31,4±7,8 года. Пролежни наблюдались у 37 из 69 (53,6%) пациентов. В группе больных с наличием пролежней средний возраст составлял 31,6±8,7 года, без пролежней – 31,1±6,8 года (р=0,9). Достоверных различий по изученным лабораторным и клиническим параметрам между группами больных с пролежнями и без пролежней не обнаружено. Средний период наблюдения за больными составил 112 дней.
В исследование включены 69 больных, перенесших тяжелую травму ГМ или СМ в сроки от 3 до 9 мес до поступления в стационар. Все участники исследования были мужчинами. Возраст включенных в исследование больных варьировал от 19 до 52 лет, в среднем составляя 31,4±7,8 года. Пролежни наблюдались у 37 из 69 (53,6%) пациентов. В группе больных с наличием пролежней средний возраст составлял 31,6±8,7 года, без пролежней – 31,1±6,8 года (р=0,9). Достоверных различий по изученным лабораторным и клиническим параметрам между группами больных с пролежнями и без пролежней не обнаружено. Средний период наблюдения за больными составил 112 дней.У 17 (45,9%) пациентов с пролежнями отмечалась одна локализация пролежня, у 7 (18,9%) – две локализации, у 13 (35,1%) больных – более двух. Пролежни наиболее часто локализовались в крестцово-копчиковой области – у 28 (75,7%) пациентов, реже – в вертельной области – у 14 (37,8%), на голенях – у 6 (16,2%), на стопах в целом – у 13 (35,1%), в пяточных областях – у 7 (18,9%). При поступлении у 70% больных отмечались наиболее тяжелые стадии пролежней (рис. 1) и лишь у 1 пациента пролежень был в стадии эпителизации. Клинические признаки локальной инфекции в области пролежня отсутствовали лишь у 3 пациентов. Исходно при МБИ наиболее часто выявлялись P. aeruginosa – 13 (35,1%) больных, S. aureus – 11 (29,7%), E. faecalis – 7 (18,9%), Proteus mirabilis – 5 (13,5%), реже Klebsiella pneumoniae – у 4 (10,8%) и Acinetobacter baumannii – у 1 (2,7%). У 2 (5,4%) пациентов роста микроорганизмов при МБИ содержимого пролежней не обнаружено. Результаты определения чувствительности выделенных при МБИ содержимого пролежней микроорганизмов к основным АМП приведены в табл. 1.

Распространенность резистентных штаммов микроорганизмов представлена в табл. 2.

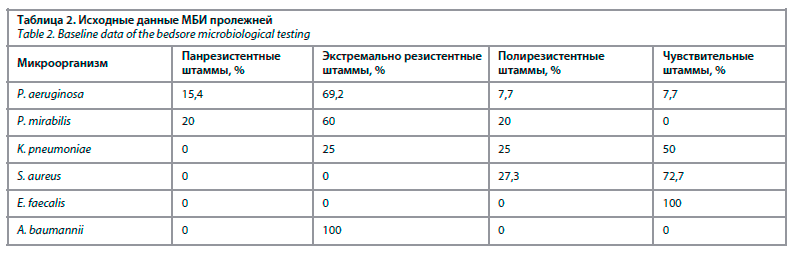
Антибактериальная терапия (АБТ) для лечения инфицированных пролежней назначалась 62,2% больных, наиболее часто – тигециклин (рис. 2). В общей сложности 9 пациентов, все из которых находились в отделении реанимации, получали множество различных антибактериальных препаратов в комбинациях, не столько по поводу инфекций пролежней, сколько в связи с инфекциями бронхо-легочной системы, ГМ и кровотока. У 14 (37,8%) больных АБТ не проводилась или антибиотики назначались только с целью периоперационной АБТ (при проведении пластического закрытия).

Некрэктомия проведена у 21 (56,7%) больного; среднее число некрэктомий составило 2,75±3,2 (медиана – 1), максимальное число некрэктомий – 10. Наряду с традиционной консервативной терапией 20 (54%) больным после некрэктомии была наложена вакуум-ассистированная повязка (VAC), от 1 до 7 сеансов, продолжительностью от 3 до 7 дней. У 17 пациентов происходила неоднократная смена VAC (максимально – 7 раз, в среднем – 2 раза). У 7 пациентов с VAC антибактериальные препараты не применялись совсем или назначались только с целью периоперационной АБТ (при проведении пластического закрытия).
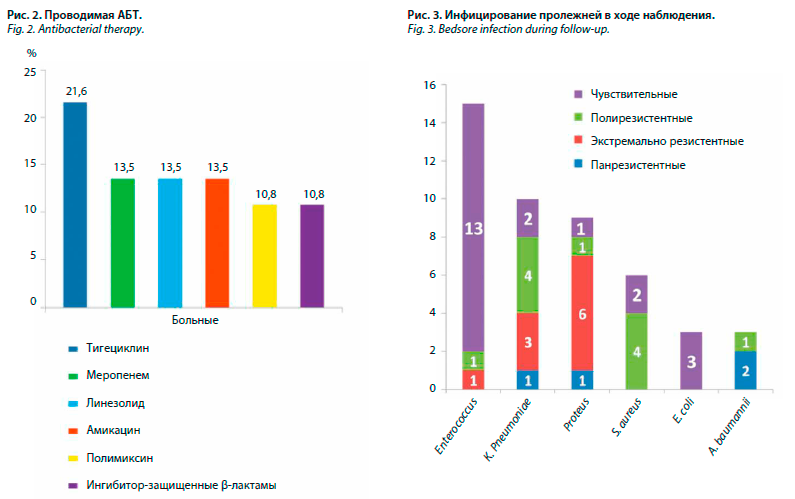
Результаты повторных МБИ содержимого пролежней были доступны у 24 больных. Во время стационарного лечения лишь у двух больных оставалась та же микрофлора в пролежнях (S. aureus), у других пациентов с серией последующих МБИ зарегистрирована суперинфекция (рис. 3). У 15 больных наблюдалось присоединение Enterococcus spp., у 10 – K. pneumoniae, у 9 – Proteus spp. (7 – P. mirabilis, 2 – P. vulgaris). У 6 пациентов в ходе наблюдения обнаружено инфицирование
S. aureus, у 3 – E. coli, еще у 3 – A. baumannii.
 На фоне проводимой терапии у пациентов с инфицированием пролежней P. aeruginosa достигнута полная элиминация возбудителя или выраженное снижение микробной нагрузки (рис. 4). В случае инфицирования пролежней P. mirabilis в ходе наблюдения у 55,5% больных удалось добиться элиминации возбудителя, у 33,3% отсутствовали изменения в количественном составе, однако у этих пациентов был лишь минимальный рост (со среды накопления); см. рис. 4.
На фоне проводимой терапии у пациентов с инфицированием пролежней P. aeruginosa достигнута полная элиминация возбудителя или выраженное снижение микробной нагрузки (рис. 4). В случае инфицирования пролежней P. mirabilis в ходе наблюдения у 55,5% больных удалось добиться элиминации возбудителя, у 33,3% отсутствовали изменения в количественном составе, однако у этих пациентов был лишь минимальный рост (со среды накопления); см. рис. 4.В двух случаях инфекции A. baumannii в ходе наблюдения роста микроорганизма не обнаружено. У более чем 1/2 больных с инфицированием пролежня S. aureus в последующем роста микроорганизмов не обнаружено или зарегистрировано снижение микробной нагрузки, у оставшихся пациентов отмечалось сохранение микроорганизмов в пролежне, но в минимальных количествах («со среды накопления»). В 5 случаях инфекции K. pneumoniae в ходе дальнейшего наблюдения зарегистрирована элиминация возбудителя, у оставшихся больных сохранялся минимальный рост микроорганизмов (см. рис. 3). При инфицировании пролежня E. faecalis у 9 больных сохранялся минимальный рост, у трех достигнута полная элиминация возбудителя (см. рис. 4).
В ходе стационарного лечения пластическое закрытие пролежней проведено у 14 (37,8%) больных, в 13 из этих случаев – успешно. У 8 из этих пациентов антибактериальные препараты не применялись совсем или использовались только с целью периоперационной АБТ (при проведении пластического закрытия). Всего 5 больных, перенесших пластическое закрытие пролежней, в последующем переведены в другие стационары, остальные продолжают стационарное лечение. Рецидив пролежня после пластики отмечен лишь у одного больного.
Обсуждение
Полученные нами результаты свидетельствуют о большой доле больных, перенесших тяжелую травму ЦНС, которые имеют пролежни (53,6%). Аналогично нашим данным, в бразильском исследовании с участием 240 пациентов с черепно-мозговой травмой пролежни наблюдались у 57,7% больных с тяжелым повреждением ГМ, тогда как при легком – у 6,6%, средней тяжести – у 35,5%. В этой работе, как и в нашей, большинство больных составляли мужчины (86,7%) в среднем возрасте 35 лет [6]. Вместе с тем в исследовании F. Rubulotta и соавт. с участием 1312 пациентов, поступивших в отделения интенсивной терапии Великобритании, доля лиц, имевших хотя бы один пролежень, составила лишь 16% [14]. В этом проекте более длительное пребывание в отделении интенсивной терапии было связано с более высоким риском возникновения пролежней [14]. Следует отметить, что в нашем исследовании принимали участие больные, находившиеся в различных стационарах в связи с тяжелыми травами ГМ и СМ в течение многих месяцев (от 3 до 9 мес).В изученной группе пациентов пролежни наиболее часто возникали в крестцово-копчиковой и вертельной области. Аналогично нашим данным, в других работах с участием больных, перенесших тяжелую травму СМ, основным местом расположения пролежней также была крестцовая область [14, 15]. Хотя при тяжелой травме СМ пролежни могут развиваться в любом месте, они все-таки имеют склонность к определенным зонам, что, как правило, зависит от сроков травмы. В ранние сроки после травмы наиболее частыми анатомическими областями возникновения пролежней являются крестец, вертельные области, седалищные кости и пяточные выступы. У пациентов с хронической травмой СМ наиболее распространенной зоной пролежней является таз, однако у людей с повышенной спастичностью пролежни могут развиваться и в области коленного сустава, медиального выступа большеберцовой кости и медиальной лодыжки [11].
По данным первого МБИ содержимого пролежней, у наших больных наиболее часто выявлялись P. aeruginosa, S. aureus, E. faecalis и P. mirabilis. Аналогично нашим результатам, в обзоре A. Dana и соавт., проанализировавших данные 11 исследований, посвященных бактериологии пролежней у пациентов с тяжелой травмой СМ, наиболее частыми микроорганизмами в пролежнях были S. aureus, P. mirabilis, P. aeruginosa и
E. faecalis [11]. Напротив, в иранском исследовании по изучению микробного состава в пролежнях больных с травмой СМ наиболее частым микроорганизмом, колонизировавшим, прежде всего, мелкие и поверхностные пролежни, была E. coli, в то время как более крупные очаги повреждения чаще были инфицированы S. epidermidis [15]. В этой работе лишь у 7,3% пациентов при МБИ содержимого пролежней не обнаружено роста микроорганизмов, тогда как в нашей группе больных – у 5,4% [15]. В исследовании I. Braga и соавт. пролежни были инфицированы в 83,3% случаев, а наиболее часто выделяемыми микроорганизмами стали Enterobacteriaceae (49%), за которыми следовали S. aureus (28%) и грамотрицательные бактерии (23%), в основном
P. aeruginosa и Acinetobacter spp. [16]. Из-за повреждения кожи пролежни могут быть колонизированы микробной флорой, которая может происходить из прилегающих участков кожи, желудочно-кишечного тракта и слизистой оболочки мочеполовой системы. У людей с травмой СМ более вероятно обнаружение грамотрицательных микроорганизмов; по данным ряда авторов, грамотрицательные кишечные микроорганизмы и энтерококки составляют более 1/2 бактериальных изолятов у мужчин с травмой СМ [11].
Однако бактериальные составляющие пролежней у людей с травмами СМ весьма разнообразны и не ограничиваются только грамотрицательными микроорганизмами [11]. Микробиота пролежней обычно является полимикробной и сложной и может включать в себя как грамотрицательные, так и полирезистентные грамположительные бактерии, как аэробы, так и ана-эробы [11, 16]. У многих больных пролежни содержат несколько микроорганизмов; по данным некоторых исследователей, у пациентов с пролежнями на фоне травмы СМ выявляется в среднем 1,2–5,8 микроорганизма на культуру [11]. В нашем исследовании лишь у
3 больных обнаружен один микроорганизм в пролежнях (во всех случаях это был S. aureus), у других больных была полимикробная флора.
Пролежни могут быть резервуарами для устойчивых микроорганизмов, а также становиться источником бактериемии у госпитализированных пациентов. В исследовании I. Braga и соавт. в 74% случаев в пролежнях обнаружена смешанная флора с преобладанием полирезистентных бактерий, включая K. pneumoniae (85%), E. coli (25%), P. aeruginosa (100%), Acinetobacter (60%) и метициллин-резистентный S. aureus (60,7%) [16].
В этой работе 82,9% бактерий, выявленных в инфицированных пролежнях, были полирезистентными [16].
В нашей группе больных в 92,3% случаев выявлены резистентные штаммы P. aeruginosa, при инфицировании P. mirabilis и A. baumannii – в 100%, K. pneumonia – в 50%. По данным различных исследований микроорганизмы, проникающие в пролежни, обладают множественной лекарственной устойчивостью, и их паттерны чувствительности к противомикробным препаратам могут сильно отличаться от чувствительности нормальной флоры [15, 16].
По нашим данным в 1/3 случаев обнаружено инфицирование пролежней S. aureus. В других исследованиях с участием пациентов с травмами СМ также обнаружено преобладание S. aureus, в том числе метициллин-резистентного [11]. Лица с травмами СМ подвержены повышенному риску инфицирования этим микроорганизмом, поскольку им часто требуется длительное пребывание в стационарах; кроме того, их могут регулярно переводить из одного лечебного или реабилитационного учреждения в другое, что может приводить к внутрибольничной передаче инфекции [11]. При этом колонизация пролежней S. aureus может сохраняться длительно, несмотря на АБТ и другое лечение [11]. В нашей работе у 6 пациентов в ходе наблюдения обнаружено инфицирование S. aureus, и к концу наблюдения в 45,5% случаев оставался тот же количественный состав данного микроорганизма в пролежнях.
На бактериальный состав пролежней может влиять и само состояние раны, глубина некроза, вовлечение в патологический процесс прилежащей кости, сухость или избыточная влажность. Так, по некоторым данным, соотношение анаэробных и аэробных бактерий у больных с пролежнями коррелирует с объемом некроза тканей, а присутствие анаэробов значительно уменьшается по мере заживления язвы. E. coli, Proteus spp. и Streptococcus spp. были наиболее распространенными микроорганизмами в пролежнях с некротизированной тканью, тогда как P. aeruginosa и S. aureus чаще всего выделялись из заживающих ран [11]. В нашей группе больных, напротив, исходно наиболее часто выявлялись P. aeruginosa и S. aureus, а по мере заживления –
E. faecalis.
В исследовании по изучению эволюции микробиоты пролежней исходно наиболее часто выявлялись Staphylococcus spp. (24,38%), Streptococcus (14,86%), Enterococcus (5,2%), Proteus (4,66%), Escherichia (3,96%) и Pseudomonas (3,96%), а к концу наблюдения (через 28 дней) произошло наибольшее увеличение распространенности Staphylococcus, Streptococcus и Enterococcus spp. [17]. Аналогично этим данным, в нашей группе больных тоже максимально увеличилась распространенность Enterococcus и Staphylococcus spp. [16]. Однако в этом исследовании была очень низкая доля инфекции Pseudomonas (3,96%), по сравнению с полученными нами результатами (35,1%) [17]. В указанном исследовании через 28 дней зарегистрирована колонизация пролежней Proteus spp. только в случае отсутствия динамики в состоянии раны, тогда как в пролежнях с положительной динамикой произошло значительное уменьшение данного микроорганизма [17]. Среди наших пациентов Proteus также длительно сохранялся, как правило, в обширных и глубоких пролежнях с выраженными клиническими и лабораторными признаками инфекции кожи и мягких тканей.
В нашем исследовании наряду с традиционной терапией у более чем 12 больных применялась VAC- cистема, способствующая заживлению ран, в основе которой лежит принцип создания отрицательного давления в ране [18]. VAC-система состоит из сетчатой полиуретановой или поливиниловой губки, адгезивного покрытия, источника вакуума с емкостью для сбора жидкости. При создании этой системой отрицательного давления в ране стимулируется деление клеток и пролиферация грануляционной ткани. Согласно результатам клинических и лабораторных исследований VAC-система способствует удалению интерстициальной жидкости из ран, уменьшению бактериальной колонизации и увеличению васкуляризации раны [18]. Хорошо известно, что в пролежнях, как и в других открытых ранах, наблюдается бактериальное заражение.
В свою очередь, микроорганизмы способны продуцировать факторы вирулентности (например, экзотоксины, эндотоксины и матриксные металлопротеиназы), которые оказывают неблагоприятное воздействие на заживление ран. Они уменьшают способность раны переходить в следующую стадию и останавливают ее в фазе хронического воспаления. Следовательно, удаление цитокинов с помощью VAC-системы и снижение бактериальной бионагрузки могут улучшить заживление трудно поддающихся лечению ран [19].
Однако результаты клинических исследований, изучавших микробиоту пролежней на фоне применения VAC-систем, достаточно противоречивы. Так, в исследовании C. Mouës и соавт. при использовании VAC-систем не было отличий в общей количественной бактериальной нагрузке по сравнению со стандартной терапией. Однако при использовании VAC-систем зарегистрировано значительное уменьшение грамотрицательных бактерий, тогда как наблюдалось значительное увеличение S. aureus [20]. Аналогичные результаты получены и в нашей работе. В исследовании A. Saadi и соавт. на фоне применения VAC-системы в 33% случаев достигнута полная элиминация микроорганизмов [21]. В исландском исследовании у тяжелых больных с инфицированием грудины после операции на сердце ранняя реинфекция обнаружена в 35% случаев в группе традиционного лечения и в 5% – в группе VAC-терапии [22]. T. Weed и соавт., изучавшие степень бактериальной бионагрузки при терапии острых и хронических ран (включая пролежни) отрицательным давлением, показали, что при применении VAC-системы в 43% случаев наблюдалось увеличение бактериальной бионагрузки, в 22% – снижение и в 35% динамика отсутствовала [23]. В этой работе у 12% больных на фоне применения VAC-системы отмечено увеличение размеров раны или усугубление некротических изменений [23]. Напротив, среди наших пациентов на фоне применения VAC-систем ни у кого не отмечено отрицательной динамики, лишь в 3 случаях отсутствовала положительная динамика или она была минимальной; все эти больные находились в крайне тяжелом состоянии в отделении реанимации и интенсивной терапии. У всех остальных пациентов наблюдалась выраженная положительная динамика в состоянии пролежней, вплоть до их полного заживления.
Несмотря на полученные клинически значимые результаты, в настоящем исследовании имеется ряд ограничений. Исследование носило несравнительный и нерандомизированный характер, в связи с чем нельзя было точно оценить вклад АБТ и применения VAC-систем в элиминацию микроорганизмов. Отсутствовало также длительное наблюдение, что не позволяет окончательно оценить долгосрочные исходы применения VAC-систем и пластического закрытия пролежней.
У нескольких, более легких, больных не удалось провести повторные МБИ содержимого пролежней.
Заключение
Результаты пилотного исследования свидетельствуют об эффективности комбинированной терапии антибактериальными препаратами в сочетании с VAC у молодых больных с инфицированными пролежнями,обусловленными тяжелыми травмами ЦНС. Необходимы дальнейшие исследования по изучению роли VAC при лечении пролежней у больных молодого возраста с травмами ЦНС.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Бубман Леонид Игоревич – зав. 7 хирургическим отд-нием, ГБУЗ ГВВ №3. E-mail: bubmanleo@gmail.com; ORCID: 0000-0002-4195-3188
Leonid I. Bubman – Head of the 7 Surgical Department, War Veterans Hospital No3. E-mail: bubmanleo@gmail.com; ORCID: 0000-0002-4195-3188
Тополянская Светлана Викторовна – д-р мед. наук, врач-терапевт, ГБУЗ ГВВ №3, доц. каф. госпитальной терапии №2, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: sshekshina@yahoo.com; ORCID: 0000-0002-4131-8432
Svetlana V. Topolynskaya – Dr. Sci. (Med.), War Veterans Hospital No3, Sechenov First Moscow State Medical University (Sechenov University). E-mail: sshekshina@yahoo.com; ORCID: 0000-0002-4131-8432
Лыткина Каринэ Арнольдовна – канд. мед. наук, зам. глав. врача по терапии, ГБУЗ ГВВ №3. E-mail: lytkina.k@mail.ru; ORCID: 0000-0001-9647-7492
Karine A. Lytkina – Cand. Sci. (Med.), War Veterans Hospital No3. E-mail: lytki-na.k@mail.ru; ORCID: 0000-0001-9647-7492
Мелконян Георгий Геннадьевич – д-р мед. наук, проф., глав. врач, ГБУЗ ГВВ №3; должность, ФГБОУ ДПО РМАНПО. E-mail: gvv3@zdrav.mos.ru; ORCID: 0000-0002-4021-5044
Georgiy G. Melkonyan – Dr. Sci. (Med.), Prof., War Veterans Hospital No3, Russian Medical Academy for Continuous Professional Education. E-mail: gvv3@zdrav.mos.ru; ORCID: 0000-0002-4021-5044
Кожевникова Елена Вениаминовна – врач-бактериолог, ГБУЗ ГВВ №3
Elena V. Kozhevnikova – bacteriologist, War Veterans Hospital No3
Гладких Марина Александровна – биолог, ГБУЗ ГВВ №3
Marina A. Gladkikh – biologist, War Veterans Hospital No3
Рачина Светлана Александровна – д-р мед. наук, проф., зав. каф. госпитальной терапии №2, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: svetlana.ratchina@antibiotic.ru; ORCID: 0000-0002-3329-7846
Svetlana A. Rachina – Dr. Sci. (Med.), Prof., Sechenov First Moscow State Medical University (Sechenov University). E-mail: svetlana.ratchina@antibiotic.ru; ORCID: 0000-0002-3329-7846
Дворецкий Леонид Иванович – д-р мед. наук, проф, проф. каф. госпитальной терапии №2, ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» (Сеченовский Университет). E-mail: dvoretski@mail.ru; ORCID: 0000-0003-3186-0102
Leonid I. Dvoretsky – Dr. Sci. (Med.), Prof., Sechenov First Moscow State Medical University (Sechenov University). E-mail: dvoretski@mail.ru; ORCID: 0000-0003-3186-0102
Поступила в редакцию: 16.10.2023
Поступила после рецензирования: 02.11.2023
Принята к публикации: 09.11.2023
Received: 16.10.2023
Revised: 02.11.2023
Accepted: 09.11.2023
Список исп. литературыСкрыть список1. Lessing NL, Mwesige S, Lazaro A et al. Pressure ulcers after traumatic spinal injury in East Africa: risk factors, illustrative case, and low-cost protocol for prevention and treatment. Spinal Cord Ser Cases. 2020; 6 (1): 48. DOI: 10.1038/s41394-020-0294-5
2. Shiferaw WS, Akalu TY, Mulugeta H et al. The global burden of pressure ulcers among patients with spinal cord injury: a systematic review and meta-analysis. BMC Musculoskelet Disord. 2021; 1: 1–11. DOI: 10.1186/s12891-020-03369-0
3. Balasuberamaniam P, Wasim A, Shrikumar M et al. Predictors of hospital-acquired pressure injuries in patients with complete spinal cord injury: a retrospective case-control study. BMC Musculoskelet Disord. 2023; 24 (1): 329. DOI: 10.1186/s12891-023-06369-y
4. Goldman RJ. Pressure ulcer management in disorders of the CNS. Available at: https://now.aapmr.org/pressure-ulcer-management-in-disorders-of-the-cns/ Assessed: 07.05.2023.
5. Prevention and Treatment of Pressure Ulcers/Injuries: Clinical Practice Guideline. Available at: https://www.internationalguideline.com/ Assessed: 07.05.2023.
6. Osis SL, de Oliveira AM, Marinho AR et al. Factors for the development of pressure ulcers in patients with traumatic brain injury. Crit Care. 2015; 19 (Suppl. 2): P86. DOI: 10.1186/cc14715
7. Eslami V, Saadat S, Habibi Arejan R et al. Factors associated with the development of pressure ulcers after spinal cord injury. Spinal Cord. 2012; 50 (12): 899–903. DOI: 10.1038/sc.2012.75
8. Zakrasek E, Creasey G, Crew J. Pressure ulcers in people with spinal cord injury in devel-oping nations. Spinal Cord. 2015; 53: 7–13. DOI: 10.1038/sc.2014.179
9. Chen Y, Devivo MJ, Jackson AB. Pressure ulcer prevalence in people with spinal cord in-jury: age-period-duration effects. Arch Phys Med Rehabil. 2005; 86 (6): 1208–13. DOI: 10.1016/j.apmr.2004.12.023
10. Morse S. Pressure ulcers cost the health system $26.8 billion a year, Healthcare Finance. 2019. Available at: https://www.healthcarefinancenews.com/news/pressure-ulcers-cost-health-system-268-billion-year. Assessed: 07.05.2023.
11. Dana AN, Bauman WA. Bacteriology of pressure ulcers in individuals with spinal cord injury: What we know and what we should know. J Spinal Cord Med. 2015; 38 (2): 147–60. DOI: 10.1179/ 2045772314Y.0000000234
12. Рекомендации «Определение чувствительности микроорганизмов к антимикробным препаратам. Версия 2021-01». Режим доступа: https://www.antibiotic.ru/files/321/clrec-dsma2021.pdf (дата обращения:)
13. Magiorakos A-P, Srinivasan A, Carey RB et al. Multidrug-resistant, extensively drug-resistant and pandrug-resistant bacteria: an international expert proposal for interim standard definitions for acquired resistance. Clin Microbiol Infect. 2012; 18: 268–81. DOI: 10.1111/j.1469-0691.2011.03570.x
14. Rubulotta F, Brett S, Boulanger C et al.; UK Collaborating Site Investigators; DecubICUs study team and the European Society of Intensive Care Medicine Trials’ Group UK Collaborators. Prevalence of skin pressure injury in critical care patients in the UK: results of a single-day point prevalence evaluation in adult critically ill patients. BMJ Open. 2022; 12 (11): e057010. DOI: 10.1136/bmjopen-2021-057010
15. Sadeghi Fazel F, Mohammadnejad A, Amanpour S et al. Bacteriology ans antimicrobial sensitivity of isolated bacteria from pressure ulcers after spinal cord injury. Arch Neurosci. 2019; 6 (2): e12446. DOI: 10.5812/ans.12446
16. Braga IA, Brito CS, Filho AD, et al. Pressure ulcer as a reservoir of multiresistant Gram-negative bacilli: risk factors for colonization and development of bacteremia. Braz J Infect Dis. 2017; 21 (2): 171–5. DOI: 10.1016/j.bjid.2016.11.007
17. Dunyach-Remy C, Salipante F, Lavigne JP et al. Pressure ulcers microbiota dynamics and wound evolution. Sci Rep. 2021; 18506. DOI: 10.1038/s41598-021-98073-x
18. Ploumis A, Mpourazanis G, Martzivanou C et al. The Role of Vacuum Assisted Closure in Patients with Pressure Ulcer and Spinal Cord Injury: A Systematic Review. World J Plast Surg. 2019; 8 (3): 279–84. DOI: 10.29252/wjps.8.3.279
19. Gabriel A, Shores J, Bernstein B et al. A clinical review of infected wound treatment with Vacuum Assisted Closure (V.A.C.) therapy: experience and case series. Int Wound J. 2009; 6 (Suppl. 2): 1–25. DOI: 10.1111/j.1742-481X.2009.00628.x
20. Mouës CM, Vos MC, van den Bemd GJ et al. Bacterial load in relation to vacuum-assisted closure wound therapy: a prospective randomized trial. Wound Repair Regen. 2004; 12 (1): 11–7. DOI: 10.1111/j.1067-1927.2004.12105.x
21. Saadi A, Perentes JY, Gonzalez M et al. Vacuum-assisted closure device: a useful tool in the management of severe intrathoracic infections. Ann Thorac Surg. 2011; 91: 1582.
22. Steingrimsson S, Gottfredsson M, Gudmundsdottir I et al. Negative-pressure wound therapy for deep sternal wound infections reduces the rate of surgical interventions for early re-infections. Interact Cardiovasc Thorac Surg. 2012; 15: 406.
23. Weed T, Ratliff C, Drake DB. Quantifying bacterial bioburden during negative pressure wound therapy: does the wound VAC enhance bacterial clearance? Ann Plast Surg. 2004; 52: 276.

