Клинический разбор в общей медицине №10 2023
1 Kazan State Medical Academy – branch of Russian Medical Academy of Continuous Professional Education, Kazan, Russia;
2 Institute of Health and Longevity "Razumed", Kazan, Russia;
3 City Clinical Hospital No7, Kazan, Russia
madina13@list.ru
Abstract
Cardiovascular disorders (CVD) in female population are the main cause of mortality, and an increase in the prevalence of myocardial infarction among women is observed in the recent decades, in contrast to the male population showing a decrease in this indicator. Certainly, the mechanisms underlying CVD in people of different sexes have much in common, however, one cannot ignore the differences associated with fundamental genetic determinants of ageing, different characteristics of metabolism and fundamentally different types of hormonal status. It has been found that realization of activity of sex hormones is among major factors ensuring protection against cardiovascular disorders in premenopausal women. The increase in the rate of cardiovascular disorders and the lack of menopausal hormone therapy (MHT) prescription to women in their post-reproductive stage may be partially correlated.
Aim. To analyze the data provided by advanced scientific research focused on prescription of menopausal hormone therapy (MHT) aimed at preventing cardiovascular disorders in the post-reproductive period.
Methods. Analytical review of domestic and foreign papers on the topic, including using PubMed, Elseviewer, Cochrane library, Elibrary databases.
Conclusions. Despite the fact that the issue of prevention and treatment of cardiovascular disorders attracts particular attention of global healthcare, CVDs still rank first in the world as the cause of deaths. In menopausal women, hypoestrogenism is among major pathogenetic links of cardiac abnormalities. To increase adherence of peri- and postmenopausal women to early diagnosis, general practitioners should give due consideration to referral of such women to obstetricians-gynecologists for timely correction of estrogen deficiency. It is also necessary to further study the issue in order to identify early diagnostic predictors of cardiovascular disorders.
Key words: menopausal syndrome, menopause, climacterium, cardiovascular disorders, MHT.
For citation: Mazitova M.I., Mardieva R.R., Faustova K.V. Role of menopausal hormone therapy in the issues of preventing cardiovascular disorders in women in their post-reproductive stage. Clinical review for general practice. 2023; 4 (10): 95–102 (In Russ.). DOI: 10.47407/kr2023.4.10.00348
Наравне с ожирением, артериальной гипертензией, курением и другими известными факторами риска кардиоваскулярной патологии мужской пол традиционно рассматривается в качестве значимого немодифицируемого фактора риска развития большинства ССЗ, а женский пол, наоборот, считается негласным фактором защиты и профилактики сердечных заболеваний [2]. При этом именно реализация действия половых гормонов относится к основным факторам, отвечающим за защиту от ССЗ у женщин, и актуальна лишь в репродуктивном периоде. Распространенность ССЗ у женщин в менопаузе и постменопаузальном периоде существенно выше, чем в репродуктивном периоде, причем в течение последних десятилетий наблюдается рост распространенности инфаркта миокарда среди женщин в отличие от мужской популяции, где данный показатель снижается. Безусловно, механизмы развития ССЗ у разных полов имеют много общего, но нельзя игнорировать отличия, связанные с фундаментальными генетическими детерминантами старения, разными характеристиками метаболизма и принципиально иными типами гормонального статуса. Рассматривая же половые различия в частоте ССЗ, абсолютное число случаев смерти от кардиологической патологии у женщин оказывается значительно выше, чем у мужчин. Согласно статистическим данным, в европейских странах 52% смертельных исходов среди женщин обусловлены ССЗ, по сравнению с 42% у мужчин [4].
В России на начало 2022 г. проживали около 36,7 млн женщин старше 45 лет [34]. Средний возраст наступления менопаузы у женщин в России составляет от 49 лет до 51 года (абсолютное большинство женщин проходит этот период в возрасте 45–55 лет) [35]. Средняя продолжительность жизни женщин в 2021 г. составила 73,8 лет, а в 2050 г. достигнет значения 79,8 лет [36]. Это означает, что одну треть своей жизни женщина проводит в менопаузе. Оценка демографических данных дает ясное указание на то, что кардинальное улучшение системы комплексного оказания медико-санитарной помощи – фундамент всей деятельности по повышению качества и продолжительности жизни женщин на территории Российской Федерации. Известно, что увеличение частоты ССЗ связано с возрастной недостаточностью функции яичников у женщин в пострепродуктивном периоде [3, 4], в связи с этим не вызывает сомнений актуальность профилактики сердечно-сосудистых событий у данной категории пациенток.
Прекращение гормональной активности яичников ввиду истощения фолликулярного аппарата и, как следствие, формирование состояния персистирующей гипоэстрогении – основная причина наступления менопаузы. Менопауза – важный этап в жизни женщин, приводящий ко многим физическим и социальным изменениям. В период менопаузального перехода в организме женщины угасает репродуктивная и гормональная функция яичников. Эстрогены регулируют реактивность сосудов, артериальное давление (АД), функцию эндотелия и ремоделирование сердца [37–41]. Значение ОХС эндокринного статуса, свойственное периоду менопаузы, ассоциировано с негативным влиянием на многие общеизвестные факторы риска ССЗ, такие как накопление и перераспределение жировой ткани, снижение толерантности к глюкозе, нарушение липидного обмена, повышение АД и симпатического тонуса, развитие эндотелиальной дисфункции и воспаления в сосудистой стенке, что может повлечь повышение риска атеросклеротических поражений [7].
Менопаузальная гормональная терапия (МГТ) сегодня является обоснованным способом купирования состояния гипоэстрогении и нежелательных симптомов климакса [8]. В частности, вазо- и кардиопротективные свойства эндогенных эстрогенов делают их применимыми с точки зрения профилактики развития ССЗ у женщин в периоде перименопаузального перехода и постменопаузе. В литературе имеются данные о способности МГТ улучшить профиль кардиоваскулярного риска благодаря своему положительному влиянию на сосудистую функцию, показатели липидного профиля и метаболизм глюкозы, способствуя также снижению частоты возникновения новых случаев сахарного диабета [9, 10].
Цель исследования – рассмотреть роль МГТ в поддержании кардиоваскулярного здоровья женщин в периоде пери- и ранней постменопаузы.
Пациентки были разделены на 2 группы: в основную группу вошли 34 женщины, которым была назначена МГТ (эстрадиол 1,0 мг + дидрогестерон 10 мг). В контрольную группу были включены 30 пациенток, отказавшихся от какой-либо терапии климактерического синдрома.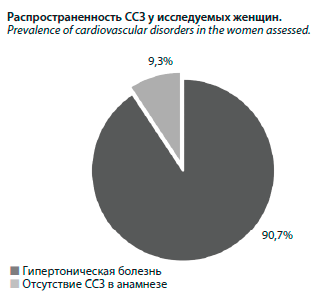
Перед началом терапии все пациентки были обследованы в соответствии с клиническим протоколом Минздрава России. Особое внимание было уделено сбору анамнеза и наличию жалоб и признаков, характерных для сердечно-сосудистой патологии. Исходно группы женщин не различались по возрастным характеристикам, менопаузальному статусу и данным лабораторных и инструментальных показателей, а также гинекологическому и соматическому анамнезу.
Для оценки влияния назначения МГТ на состояние эндотелия сосудов и биохимические параметры были проведены исследования: УЗИ сосудов шеи с оценкой толщины комплекса интима–медиа (КИМ), липидный профиль крови (общий холестерин, липопротеиды низкой плотности – ЛПНП, липопротеиды высокой плотности – ЛПВП, триглицериды), коагулограмма (протромбиновое время, протромбин (по Квику), международное нормализованное отношение, фибриноген, активированное частичное тромбопластиновое время, тромбиновое время). Анализируемые критерии оценивались у всех пациенток до начала исследования, и в последующем через 6, 9, 12, 18 мес. Общий срок наблюдения респонденток составил 1,5 года.
Были применены следующие методы статистического анализа:
• Программы Statistica 13.3 (разработчик – StatSoft. Inc) и Microsoft Office Excel 2016 применяли для анализа полученных данных. Анализ и визуализацию данных проводили с использованием среды для статистических вычислений R версии 4.0.4. (R Foundation for Statistical Computing, Вена, Австрия).
• Точный критерий Фишера применяли для анализа переменных и симптомов, анализа симптомов менопаузы и соматических заболеваний. При р-значении <0,05 выявлены статистически значимые различия между группами и проведено попарное сравнение групп.
Также нами был проведен аналитический обзор отечественных и зарубежных публикаций по теме, в том числе с использованием баз данных PubMed, Elseviewer, Cochrane Library, eLibrary.
Датское исследование DOPS, исследования KEEPS и ELITE продемонстрировали, что МГТ, начатая у женщин моложе 60 лет или в течение 10 лет после их последней менструации, оказывает нейтральное или положительное влияние на здоровье сердечно-сосудистой системы [15–17]. Кокрановский обзор рандомизированных клинических исследований по связи МГТ с профилактикой ССЗ также показал общее снижение риска ишемической болезни сердца и смертности от всех причин у женщин, начавших МГТ в течение 10 лет после менопаузы [18]. Эффективность раннего назначения МГТ связана еще и с тем, что более молодые женщины, как правило, имеют лучшее исходное сердечно-сосудистое здоровье с более низким риском ССЗ [14, 19], что подтверждают и полученные нами данные.
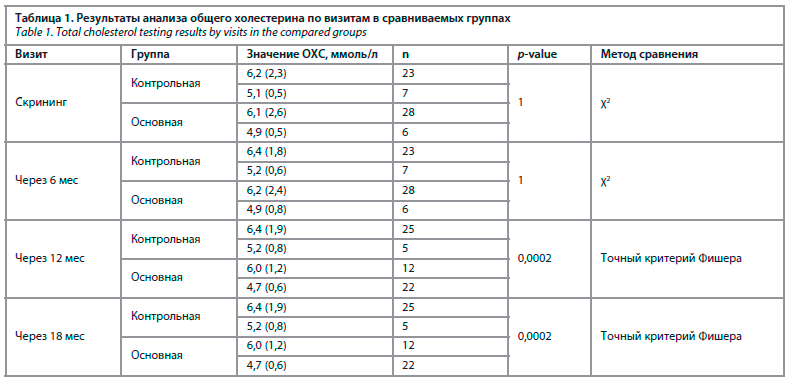
При анализе динамики липидного профиля крови у наших респонденток, было выявлено, что применение МГТ позволило сохранить исходные показатели общего холестерина в течение года у пациенток основной группы, тогда как уровень его у пациенток, не принимавших гормональную терапию, увеличился с 5,2 до 7,1 ммоль/л (р=0,0002); табл. 1.
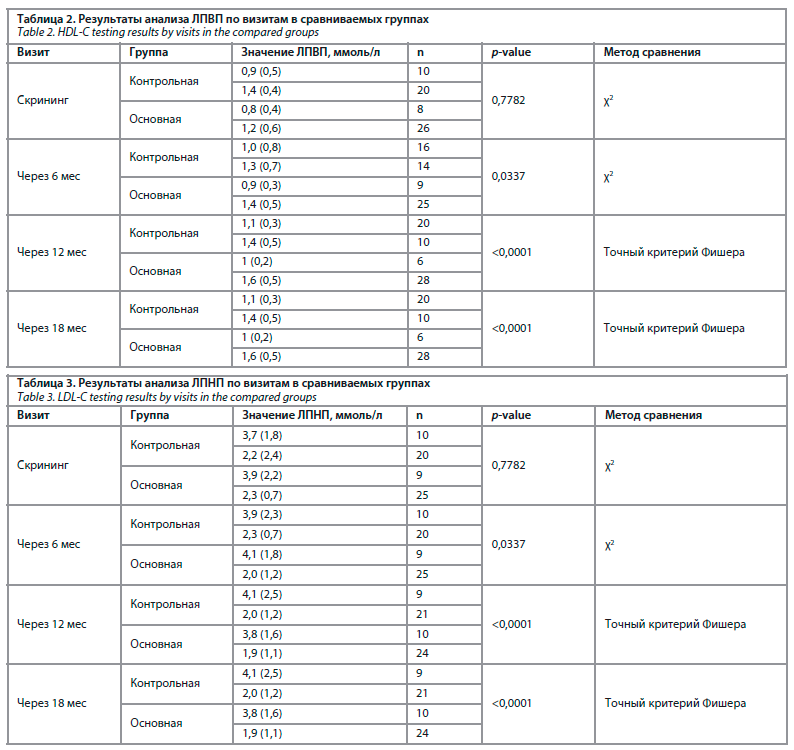
Полученные нами данные также подтверждают положительный эффект МГТ на липидный обмен. Применение комбинации эстрадиол 1,0 мг + дидрогестерон 10 мг позволило сохранить уровень фракций холестерина в пределах референсных значений (р<0,0001). В частности, удалось достигнуть снижения ЛПНП и триглицеридов, а также увеличения уровня ЛПВП. Анализ изменений липидного профиля у пациенток контрольной группы продемонстрировал увеличение ЛПНП и триглицеридов, а также уменьшение ЛПВП группы уже в течение первых полутора лет гипоэстрогенного состояния (табл. 2, 3).
Несмотря на то что гипоэстрогенное состояние для женщины в пери- и постменопаузе физиологично, оно ассоциировано с нарушением стероидного метаболизма и изменением соотношения «защитных» и проатерогенных холестериновых фракций. По данным исследования EUROASPIRE, у женщин в постменопаузе в среднем на 25% снижается уровень антиатерогенных липопротеидов – ЛПВП. Вместе с этим происходит увеличение концентрации проатерогенных фракций: ЛПНП и липопротеина (а) – ЛП(а) [20]. Результаты многочисленных исследований говорят о том, что повышенный уровень ЛПНП и ЛП(а) является наиболее распространенным ранним фактором риска манифестации ишемической болезни сердца, инфаркта миокарда и сердечной недостаточности [21, 22]. Также в литературе накоплена база доказательств значимого кардиопротективного эффекта МГТ, в частности для комбинированных препаратов. Показано, что применение комбинированной пероральной терапии эстрадиолом и дидрогестероном на протяжении 24 мес сопровождается значимым повышением уровня ЛПВП (+7%; 95% доверительный интервал – ДИ 1–14, p<0,05), снижением уровня ЛПНП (-11,8%; 95% ДИ 6,3–19, p<0,05) и ЛП(а) [23, 24].
На сегодня доказано, что дефицит эстрогенов является причинным фактором развития эндотелиальной дисфункции и хронического воспаления в сосудистой стенке у женщин в постменопаузе [25, 26]. Изменения в сосудах прежде всего связаны с нарушением метаболизма липидов и отложением на внутренней поверхности артериальных стенок атеросклеротических бляшек, основную часть которых выполняет холестерол. Поэтому при обнаружении дислипидемии у пациентки рациональным является применение УЗИ брахиоцефальных артерий (дуплексное сканирование артерий) для оценки структурно-функционального состояния эндотелия по величинам толщины КИМ сонных артерий [27]. При проведении УЗИ сосудов шеи, толщина КИМ у наших пациенток была не менее 1,0 мм на протяжении всего периода наблюдения, что соответствует нормальному значению, а значит, патологических изменений сосудов не обнаружено как исходно, так и по истечении 18 мес в обеих группах. Такая однородность данных по группам связана с коротким сроком наблюдения для данного параметра. Также в литературе приводятся многочисленные данные о способности МГТ профилактировать атерогенез в сосудистой стенке за счет эстрогенного компонента. Так, в исследовании ELITЕ установлено достоверное замедление утолщения КИМ стенки сонной артерии у женщин в ранней постменопаузе, получавших 17β-эстрадиол (на 0,0078 мм в год; р=0,008), по сравнению с плацебо (на 0,0044 мм в год; р>0,05) [28]. Что интересно, у женщин, находящихся в постменопаузе более 10 лет, различий в динамике толщины КИМ на фоне МГТ и без нее выявлено не было (0,0088 и 0,0100 мм в год соответственно; р=0,29). Такие выводы авторов подтверждают золотой стандарт тактики назначения МГТ «окно возможностей», согласно которой при длительности менопаузы более 10 лет МГТ не обладает протективным действием и не оказывает существенного влияния на показатели здоровья пациентки, а, наоборот, может быть ассоциирована с высоким риском осложнений – тромбоэмболических, онкологических и других [29–31].
При анализе данных лабораторных исследований пациенток было выявлено, что в обеих группах показатели коагулограммы остались неизменны в течение 18 мес. Стоит отметить, что в настоящее время доказаны преимущества 17β-эстрадиола перед другими существующими эстрогенными компонентами МГТ. Это касается и его профиля безопасности в первую очередь в отношении коагуляционного потенциала. Не менее важен с точки зрения безопасности и другой компонент МГТ – гестаген. В крупных рандомизированных исследованиях показано, что производные прегнана (дидрогестерон) не влияют на риск развития венозных тромбоэмболических осложнений (ВТЭО) (относительный риск – ОР 0,7, 95% ДИ 0,3–1,9; и ОР 0,9, 95% ДИ 0,4–2,3 соответственно), что делает их применение более оправданным с позиции безопасности по сравнению с производными непрегнанового ряда (дроспиренон), для которых показано 4-кратное повышение риска развития ВТЭО (ОР 3,9, 95% ДИ 1,5–10,0) [32, 33]. Профиль безопасности комбинации 17β-эстрадиола и дидрогестерона подтвержден ведущими профильными обществами РФ. Согласно Российским критериям МГТ, при использовании комбинации перорального эстрадиола с дидрогестероном риск ВТЭО не увеличивался ни при циклическом, ни при монофазном комбинированном режимах МГТ вне зависимости от дозы эстрадиола. Вне зависимости от ИМТ назначение комбинации перорального эстрадиола с дидрогестероном не было связано с увеличением риска ВТЭО. Сам дидрогестерон по механизму действия крайне схож с эндогенным прогестероном. Некоторые отличия в их химическом строении обеспечивают более высокую биодоступность дидрогестерона и его селективность к прогестероновым рецепторам, что снижает проявление эстрогенных, андрогенных и минералокортикоидных свойств, характерных для прогестерона. Основной рабочий метаболит дидрогестерона, 20-дигидродидрогестерон, имеет сильное антипролиферативное действие на эндометрий, что делает возможным его применение в комбинации с 17β-эстрадиолом. В свою очередь, дидрогестерон не оказывает влияния на всасывание и распределение 17β-эстрадиола и его метаболитов [23].
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Мазитова Мадина Ирековна – д-р мед. наук, проф. каф. акушерства и гинекологии, КГМА – филиал ФГБОУ ДПО РМАНПО; врач акушер-гинеколог, ООО «Институт здоровья и долголетия “Разумед”», Казань. E-mail: madina13@list.ru; ORCID: 0000-0002-9608-2076
Madina I. Mazitova – Dr. Sci. (Med.), Prof., Kazan State Medical Academy – branch of Russian Medical Academy of Continuous Professional Education; Obstetrician-gynecologist, Institute of Health and Longevity "Razumed". E-mail: madina13@list.ru; ORCID: 0000-0002-9608-2076
Мардиева Резеда Рубертовна – ассистент каф. акушерства и гинекологии, КГМА – филиал ФГБОУ ДПО РМАНПО, врач акушер-гинеколог, ГАУЗ ГКБ №7. E-mail: rezedamardieva@gmail.com; ORCID: 0000-0003-2568-0121
Rezeda R. Mardieva – Аssistant, Medical Resident, Kazan State Medical Academy – branch of Russian Medical Academy of Continuous Professional Education; Obstetrician-gynecologist, City Clinical Hospital No7, Kazan. E-mail: rezedamardieva@gmail.com; ORCID: 0000-0003-2568-0121
Фаустова Карина Валерьевна – врач-ординатор каф. акушерства и гинекологии, КГМА – филиал ФГБОУ ДПО РМАНПО. E-mail: faustova_rina@mail.ru; ORCID: 0000-0001-8702-0159
Karina V. Faustova – Medical Resident, Kazan State Medical Academy – branch of Russian Medical Academy of Continuous Professional Education. E-mail: faustova_rina@mail.ru; ORCID: 0000-0001-8702-0159
Поступила в редакцию: 07.11.2023
Поступила после рецензирования: 15.11.2023
Принята к публикации: 16.11.2023
Received: 07.11.2023
Revised: 15.11.2023
Accepted: 16.11.2023
Клинический разбор в общей медицине №10 2023
Роль менопаузальной гормональной терапии в вопросах профилактики сердечно-сосудистых заболеваний у женщин в пострепродуктивном периоде
Номера страниц в выпуске:95-102
Аннотация
В женской популяции сердечно-сосудистые заболевания (ССЗ) являются главной причиной смертности, причем в течение последних десятилетий наблюдается рост распространенности инфаркта миокарда среди женщин в отличие от мужской популяции, где данный показатель снижается. Безусловно, механизмы развития ССЗ у разных полов имеют много общего, но нельзя игнорировать отличия, связанные с фундаментальными генетическими детерминантами старения, разными характеристиками метаболизма и принципиально иными типами гормонального статуса. Было установлено, что реализация действия половых гормонов относится к основным факторам, отвечающим за защиту от ССЗ у женщин в пременопаузе. Увеличение частоты ССЗ и недостаточность назначения менопаузальной гормональной терапии (МГТ) у женщин в пострепродуктивном периоде могут быть частично связаны между собой.
Цель. Анализ данных, представленных в современных научных исследованиях, по теме назначения МГТ для профилактики ССЗ в пострепродуктивном периоде.
Материалы и методы. Аналитический обзор отечественных и зарубежных публикаций по теме, в том числе с использованием баз данных PubMed, Elseviewer, Cochrane Library, eLibrary.
Выводы. Несмотря на то что к проблеме профилактики и лечения ССЗ приковано пристальное внимание мирового здравоохранения, причина смертности от ССЗ по-прежнему занимает 1-е место в мире. У женщин в климактерическом периоде одним из ведущих звеньев патогенеза кардиологических нарушений является гипоэстрогения. С целью повышения приверженности пациенток в пери- и постменопаузе к проведению ранних диагностических мероприятий врачам общей практики необходимо уделять должное внимание направлению таких женщин к акушеру-гинекологу для своевременной коррекции дефицита эстрогенов. Необходимо дальнейшее изучение этого вопроса с целью выявления ранних диагностических предикторов ССЗ.
Ключевые слова: климактерический синдром, менопауза, перименопауза, постменопауза, сердечно-сосудистые заболевания, менопаузальная гормональная терапия.
Для цитирования: Мазитова М.И., Мардиева Р.Р., Фаустова К.В. Роль менопаузальной гормональной терапии в вопросах профилактики сердечно-сосудистых заболеваний у женщин в пострепродуктивном периоде. Клинический разбор в общей медицине. 2023; 4 (10): 95–102. DOI: 10.47407/kr2023.4.10.00348
В женской популяции сердечно-сосудистые заболевания (ССЗ) являются главной причиной смертности, причем в течение последних десятилетий наблюдается рост распространенности инфаркта миокарда среди женщин в отличие от мужской популяции, где данный показатель снижается. Безусловно, механизмы развития ССЗ у разных полов имеют много общего, но нельзя игнорировать отличия, связанные с фундаментальными генетическими детерминантами старения, разными характеристиками метаболизма и принципиально иными типами гормонального статуса. Было установлено, что реализация действия половых гормонов относится к основным факторам, отвечающим за защиту от ССЗ у женщин в пременопаузе. Увеличение частоты ССЗ и недостаточность назначения менопаузальной гормональной терапии (МГТ) у женщин в пострепродуктивном периоде могут быть частично связаны между собой.
Цель. Анализ данных, представленных в современных научных исследованиях, по теме назначения МГТ для профилактики ССЗ в пострепродуктивном периоде.
Материалы и методы. Аналитический обзор отечественных и зарубежных публикаций по теме, в том числе с использованием баз данных PubMed, Elseviewer, Cochrane Library, eLibrary.
Выводы. Несмотря на то что к проблеме профилактики и лечения ССЗ приковано пристальное внимание мирового здравоохранения, причина смертности от ССЗ по-прежнему занимает 1-е место в мире. У женщин в климактерическом периоде одним из ведущих звеньев патогенеза кардиологических нарушений является гипоэстрогения. С целью повышения приверженности пациенток в пери- и постменопаузе к проведению ранних диагностических мероприятий врачам общей практики необходимо уделять должное внимание направлению таких женщин к акушеру-гинекологу для своевременной коррекции дефицита эстрогенов. Необходимо дальнейшее изучение этого вопроса с целью выявления ранних диагностических предикторов ССЗ.
Ключевые слова: климактерический синдром, менопауза, перименопауза, постменопауза, сердечно-сосудистые заболевания, менопаузальная гормональная терапия.
Для цитирования: Мазитова М.И., Мардиева Р.Р., Фаустова К.В. Роль менопаузальной гормональной терапии в вопросах профилактики сердечно-сосудистых заболеваний у женщин в пострепродуктивном периоде. Клинический разбор в общей медицине. 2023; 4 (10): 95–102. DOI: 10.47407/kr2023.4.10.00348
Role of menopausal hormone therapy in the issues of preventing cardiovascular disorders in women in their post-reproductive stage
Madina I. Mazitova1,2, Rezeda R. Mardieva1,3, Karina V. Faustova11 Kazan State Medical Academy – branch of Russian Medical Academy of Continuous Professional Education, Kazan, Russia;
2 Institute of Health and Longevity "Razumed", Kazan, Russia;
3 City Clinical Hospital No7, Kazan, Russia
madina13@list.ru
Abstract
Cardiovascular disorders (CVD) in female population are the main cause of mortality, and an increase in the prevalence of myocardial infarction among women is observed in the recent decades, in contrast to the male population showing a decrease in this indicator. Certainly, the mechanisms underlying CVD in people of different sexes have much in common, however, one cannot ignore the differences associated with fundamental genetic determinants of ageing, different characteristics of metabolism and fundamentally different types of hormonal status. It has been found that realization of activity of sex hormones is among major factors ensuring protection against cardiovascular disorders in premenopausal women. The increase in the rate of cardiovascular disorders and the lack of menopausal hormone therapy (MHT) prescription to women in their post-reproductive stage may be partially correlated.
Aim. To analyze the data provided by advanced scientific research focused on prescription of menopausal hormone therapy (MHT) aimed at preventing cardiovascular disorders in the post-reproductive period.
Methods. Analytical review of domestic and foreign papers on the topic, including using PubMed, Elseviewer, Cochrane library, Elibrary databases.
Conclusions. Despite the fact that the issue of prevention and treatment of cardiovascular disorders attracts particular attention of global healthcare, CVDs still rank first in the world as the cause of deaths. In menopausal women, hypoestrogenism is among major pathogenetic links of cardiac abnormalities. To increase adherence of peri- and postmenopausal women to early diagnosis, general practitioners should give due consideration to referral of such women to obstetricians-gynecologists for timely correction of estrogen deficiency. It is also necessary to further study the issue in order to identify early diagnostic predictors of cardiovascular disorders.
Key words: menopausal syndrome, menopause, climacterium, cardiovascular disorders, MHT.
For citation: Mazitova M.I., Mardieva R.R., Faustova K.V. Role of menopausal hormone therapy in the issues of preventing cardiovascular disorders in women in their post-reproductive stage. Clinical review for general practice. 2023; 4 (10): 95–102 (In Russ.). DOI: 10.47407/kr2023.4.10.00348
Введение
Долгие годы сердечно-сосудистые заболевания (ССЗ) занимают 1-е место среди причин смертности как в нашей стране, так и за рубежом [1, 2]. На территории РФ реализуется немалое число программ здравоохранения по снижению распространенности ССЗ. Достигнуты определенные успехи, однако ситуация продолжает оставаться хуже, чем в других странах: ССЗ занимают в структуре причин смертности в нашей стране большую долю (55,7%), чем в среднем по Европе (46%), в частности 29,4% всех смертей в России приходится на ишемическую болезнь сердца [3].Наравне с ожирением, артериальной гипертензией, курением и другими известными факторами риска кардиоваскулярной патологии мужской пол традиционно рассматривается в качестве значимого немодифицируемого фактора риска развития большинства ССЗ, а женский пол, наоборот, считается негласным фактором защиты и профилактики сердечных заболеваний [2]. При этом именно реализация действия половых гормонов относится к основным факторам, отвечающим за защиту от ССЗ у женщин, и актуальна лишь в репродуктивном периоде. Распространенность ССЗ у женщин в менопаузе и постменопаузальном периоде существенно выше, чем в репродуктивном периоде, причем в течение последних десятилетий наблюдается рост распространенности инфаркта миокарда среди женщин в отличие от мужской популяции, где данный показатель снижается. Безусловно, механизмы развития ССЗ у разных полов имеют много общего, но нельзя игнорировать отличия, связанные с фундаментальными генетическими детерминантами старения, разными характеристиками метаболизма и принципиально иными типами гормонального статуса. Рассматривая же половые различия в частоте ССЗ, абсолютное число случаев смерти от кардиологической патологии у женщин оказывается значительно выше, чем у мужчин. Согласно статистическим данным, в европейских странах 52% смертельных исходов среди женщин обусловлены ССЗ, по сравнению с 42% у мужчин [4].
В России на начало 2022 г. проживали около 36,7 млн женщин старше 45 лет [34]. Средний возраст наступления менопаузы у женщин в России составляет от 49 лет до 51 года (абсолютное большинство женщин проходит этот период в возрасте 45–55 лет) [35]. Средняя продолжительность жизни женщин в 2021 г. составила 73,8 лет, а в 2050 г. достигнет значения 79,8 лет [36]. Это означает, что одну треть своей жизни женщина проводит в менопаузе. Оценка демографических данных дает ясное указание на то, что кардинальное улучшение системы комплексного оказания медико-санитарной помощи – фундамент всей деятельности по повышению качества и продолжительности жизни женщин на территории Российской Федерации. Известно, что увеличение частоты ССЗ связано с возрастной недостаточностью функции яичников у женщин в пострепродуктивном периоде [3, 4], в связи с этим не вызывает сомнений актуальность профилактики сердечно-сосудистых событий у данной категории пациенток.
Прекращение гормональной активности яичников ввиду истощения фолликулярного аппарата и, как следствие, формирование состояния персистирующей гипоэстрогении – основная причина наступления менопаузы. Менопауза – важный этап в жизни женщин, приводящий ко многим физическим и социальным изменениям. В период менопаузального перехода в организме женщины угасает репродуктивная и гормональная функция яичников. Эстрогены регулируют реактивность сосудов, артериальное давление (АД), функцию эндотелия и ремоделирование сердца [37–41]. Значение ОХС эндокринного статуса, свойственное периоду менопаузы, ассоциировано с негативным влиянием на многие общеизвестные факторы риска ССЗ, такие как накопление и перераспределение жировой ткани, снижение толерантности к глюкозе, нарушение липидного обмена, повышение АД и симпатического тонуса, развитие эндотелиальной дисфункции и воспаления в сосудистой стенке, что может повлечь повышение риска атеросклеротических поражений [7].
Менопаузальная гормональная терапия (МГТ) сегодня является обоснованным способом купирования состояния гипоэстрогении и нежелательных симптомов климакса [8]. В частности, вазо- и кардиопротективные свойства эндогенных эстрогенов делают их применимыми с точки зрения профилактики развития ССЗ у женщин в периоде перименопаузального перехода и постменопаузе. В литературе имеются данные о способности МГТ улучшить профиль кардиоваскулярного риска благодаря своему положительному влиянию на сосудистую функцию, показатели липидного профиля и метаболизм глюкозы, способствуя также снижению частоты возникновения новых случаев сахарного диабета [9, 10].
Цель исследования – рассмотреть роль МГТ в поддержании кардиоваскулярного здоровья женщин в периоде пери- и ранней постменопаузы.
Материалы и методы
В исследовании приняли участие 64 женщины. Критериями включения явились: возраст от 47 до 54 лет, уровень фолликулостимулирующего гормона ≥25 мМЕ/мл, отсутствие менструаций от 4 до 6 мес, отсутствие фолликулов на ультразвуковом исследовании (УЗИ) и соответствие клиническому портрету женщин периода менопаузального перехода по шкале STRAW-10 (-2), информированное согласие. Средний возраст респонденток составил 51 (0,3) год. Критериями исключения стали: наличие менструаций, несоответствие периоду менопаузального перехода по шкале STRAW-10 (-2), диагностированные или предполагаемые эстрогензависимые злокачественные новообразования, диагностированный или предполагаемый рак молочной железы, рак молочной железы в анамнезе, тромбозы в анамнезе, острые или хронические заболевания печени в настоящее время или в анамнезе, порфирия.Пациентки были разделены на 2 группы: в основную группу вошли 34 женщины, которым была назначена МГТ (эстрадиол 1,0 мг + дидрогестерон 10 мг). В контрольную группу были включены 30 пациенток, отказавшихся от какой-либо терапии климактерического синдрома.

Перед началом терапии все пациентки были обследованы в соответствии с клиническим протоколом Минздрава России. Особое внимание было уделено сбору анамнеза и наличию жалоб и признаков, характерных для сердечно-сосудистой патологии. Исходно группы женщин не различались по возрастным характеристикам, менопаузальному статусу и данным лабораторных и инструментальных показателей, а также гинекологическому и соматическому анамнезу.
Для оценки влияния назначения МГТ на состояние эндотелия сосудов и биохимические параметры были проведены исследования: УЗИ сосудов шеи с оценкой толщины комплекса интима–медиа (КИМ), липидный профиль крови (общий холестерин, липопротеиды низкой плотности – ЛПНП, липопротеиды высокой плотности – ЛПВП, триглицериды), коагулограмма (протромбиновое время, протромбин (по Квику), международное нормализованное отношение, фибриноген, активированное частичное тромбопластиновое время, тромбиновое время). Анализируемые критерии оценивались у всех пациенток до начала исследования, и в последующем через 6, 9, 12, 18 мес. Общий срок наблюдения респонденток составил 1,5 года.
Были применены следующие методы статистического анализа:
• Программы Statistica 13.3 (разработчик – StatSoft. Inc) и Microsoft Office Excel 2016 применяли для анализа полученных данных. Анализ и визуализацию данных проводили с использованием среды для статистических вычислений R версии 4.0.4. (R Foundation for Statistical Computing, Вена, Австрия).
• Точный критерий Фишера применяли для анализа переменных и симптомов, анализа симптомов менопаузы и соматических заболеваний. При р-значении <0,05 выявлены статистически значимые различия между группами и проведено попарное сравнение групп.
Также нами был проведен аналитический обзор отечественных и зарубежных публикаций по теме, в том числе с использованием баз данных PubMed, Elseviewer, Cochrane Library, eLibrary.
Результаты и обсуждение
К настоящему времени накоплены многочисленные доказательства того, что терапия эстрогенами может иметь кардиопротективную эффективность у женщин пострепродуктивного периода при условии, что МГТ начата в период, не превышающий 10 лет от последней самостоятельной менструации [11–13]. Также результаты многоцентровых исследований показывают, что максимальный положительный эффект от МГТ с позиции профилактики ССЗ возможен при своевременном старте (отсутствие менструации 6 мес и более при наличии жалоб на персистирующие климактерические проявления) и продолжительности терапии не менее 5 лет [14]. В то же время системная МГТ может причинять вред, если она начата позже «окна возможностей» (возраст более 60 лет, длительность постменопаузы более 10 лет) независимо от возраста наступления менопаузы [11]. В нашем исследовании приняли участие женщины в возрасте 47–54 лет, соответствующие периоду менопаузального перехода по шкале STRAW-10 (-2). При сборе анамнеза у респонденток было выявлено, что исследуемые женщины в большинстве случаев имели сохранное кардиоваскулярное здоровье к моменту прекращения менструаций, а установленные ССЗ (гипертоническая болезнь) встречались лишь у 6 женщин, что составило 9,3% от общего числа женщин (см. рисунок).Датское исследование DOPS, исследования KEEPS и ELITE продемонстрировали, что МГТ, начатая у женщин моложе 60 лет или в течение 10 лет после их последней менструации, оказывает нейтральное или положительное влияние на здоровье сердечно-сосудистой системы [15–17]. Кокрановский обзор рандомизированных клинических исследований по связи МГТ с профилактикой ССЗ также показал общее снижение риска ишемической болезни сердца и смертности от всех причин у женщин, начавших МГТ в течение 10 лет после менопаузы [18]. Эффективность раннего назначения МГТ связана еще и с тем, что более молодые женщины, как правило, имеют лучшее исходное сердечно-сосудистое здоровье с более низким риском ССЗ [14, 19], что подтверждают и полученные нами данные.
При анализе динамики липидного профиля крови у наших респонденток, было выявлено, что применение МГТ позволило сохранить исходные показатели общего холестерина в течение года у пациенток основной группы, тогда как уровень его у пациенток, не принимавших гормональную терапию, увеличился с 5,2 до 7,1 ммоль/л (р=0,0002); табл. 1.

Полученные нами данные также подтверждают положительный эффект МГТ на липидный обмен. Применение комбинации эстрадиол 1,0 мг + дидрогестерон 10 мг позволило сохранить уровень фракций холестерина в пределах референсных значений (р<0,0001). В частности, удалось достигнуть снижения ЛПНП и триглицеридов, а также увеличения уровня ЛПВП. Анализ изменений липидного профиля у пациенток контрольной группы продемонстрировал увеличение ЛПНП и триглицеридов, а также уменьшение ЛПВП группы уже в течение первых полутора лет гипоэстрогенного состояния (табл. 2, 3).

Несмотря на то что гипоэстрогенное состояние для женщины в пери- и постменопаузе физиологично, оно ассоциировано с нарушением стероидного метаболизма и изменением соотношения «защитных» и проатерогенных холестериновых фракций. По данным исследования EUROASPIRE, у женщин в постменопаузе в среднем на 25% снижается уровень антиатерогенных липопротеидов – ЛПВП. Вместе с этим происходит увеличение концентрации проатерогенных фракций: ЛПНП и липопротеина (а) – ЛП(а) [20]. Результаты многочисленных исследований говорят о том, что повышенный уровень ЛПНП и ЛП(а) является наиболее распространенным ранним фактором риска манифестации ишемической болезни сердца, инфаркта миокарда и сердечной недостаточности [21, 22]. Также в литературе накоплена база доказательств значимого кардиопротективного эффекта МГТ, в частности для комбинированных препаратов. Показано, что применение комбинированной пероральной терапии эстрадиолом и дидрогестероном на протяжении 24 мес сопровождается значимым повышением уровня ЛПВП (+7%; 95% доверительный интервал – ДИ 1–14, p<0,05), снижением уровня ЛПНП (-11,8%; 95% ДИ 6,3–19, p<0,05) и ЛП(а) [23, 24].
На сегодня доказано, что дефицит эстрогенов является причинным фактором развития эндотелиальной дисфункции и хронического воспаления в сосудистой стенке у женщин в постменопаузе [25, 26]. Изменения в сосудах прежде всего связаны с нарушением метаболизма липидов и отложением на внутренней поверхности артериальных стенок атеросклеротических бляшек, основную часть которых выполняет холестерол. Поэтому при обнаружении дислипидемии у пациентки рациональным является применение УЗИ брахиоцефальных артерий (дуплексное сканирование артерий) для оценки структурно-функционального состояния эндотелия по величинам толщины КИМ сонных артерий [27]. При проведении УЗИ сосудов шеи, толщина КИМ у наших пациенток была не менее 1,0 мм на протяжении всего периода наблюдения, что соответствует нормальному значению, а значит, патологических изменений сосудов не обнаружено как исходно, так и по истечении 18 мес в обеих группах. Такая однородность данных по группам связана с коротким сроком наблюдения для данного параметра. Также в литературе приводятся многочисленные данные о способности МГТ профилактировать атерогенез в сосудистой стенке за счет эстрогенного компонента. Так, в исследовании ELITЕ установлено достоверное замедление утолщения КИМ стенки сонной артерии у женщин в ранней постменопаузе, получавших 17β-эстрадиол (на 0,0078 мм в год; р=0,008), по сравнению с плацебо (на 0,0044 мм в год; р>0,05) [28]. Что интересно, у женщин, находящихся в постменопаузе более 10 лет, различий в динамике толщины КИМ на фоне МГТ и без нее выявлено не было (0,0088 и 0,0100 мм в год соответственно; р=0,29). Такие выводы авторов подтверждают золотой стандарт тактики назначения МГТ «окно возможностей», согласно которой при длительности менопаузы более 10 лет МГТ не обладает протективным действием и не оказывает существенного влияния на показатели здоровья пациентки, а, наоборот, может быть ассоциирована с высоким риском осложнений – тромбоэмболических, онкологических и других [29–31].
При анализе данных лабораторных исследований пациенток было выявлено, что в обеих группах показатели коагулограммы остались неизменны в течение 18 мес. Стоит отметить, что в настоящее время доказаны преимущества 17β-эстрадиола перед другими существующими эстрогенными компонентами МГТ. Это касается и его профиля безопасности в первую очередь в отношении коагуляционного потенциала. Не менее важен с точки зрения безопасности и другой компонент МГТ – гестаген. В крупных рандомизированных исследованиях показано, что производные прегнана (дидрогестерон) не влияют на риск развития венозных тромбоэмболических осложнений (ВТЭО) (относительный риск – ОР 0,7, 95% ДИ 0,3–1,9; и ОР 0,9, 95% ДИ 0,4–2,3 соответственно), что делает их применение более оправданным с позиции безопасности по сравнению с производными непрегнанового ряда (дроспиренон), для которых показано 4-кратное повышение риска развития ВТЭО (ОР 3,9, 95% ДИ 1,5–10,0) [32, 33]. Профиль безопасности комбинации 17β-эстрадиола и дидрогестерона подтвержден ведущими профильными обществами РФ. Согласно Российским критериям МГТ, при использовании комбинации перорального эстрадиола с дидрогестероном риск ВТЭО не увеличивался ни при циклическом, ни при монофазном комбинированном режимах МГТ вне зависимости от дозы эстрадиола. Вне зависимости от ИМТ назначение комбинации перорального эстрадиола с дидрогестероном не было связано с увеличением риска ВТЭО. Сам дидрогестерон по механизму действия крайне схож с эндогенным прогестероном. Некоторые отличия в их химическом строении обеспечивают более высокую биодоступность дидрогестерона и его селективность к прогестероновым рецепторам, что снижает проявление эстрогенных, андрогенных и минералокортикоидных свойств, характерных для прогестерона. Основной рабочий метаболит дидрогестерона, 20-дигидродидрогестерон, имеет сильное антипролиферативное действие на эндометрий, что делает возможным его применение в комбинации с 17β-эстрадиолом. В свою очередь, дидрогестерон не оказывает влияния на всасывание и распределение 17β-эстрадиола и его метаболитов [23].
Выводы
Таким образом, начало приема МГТ в перименопаузе и ранней постменопаузе продемонстрировало благоприятное влияние на кардиоваскулярное здоровье участниц исследования. Комбинация эстрадиол 1,0 мг + дидрогестерон 10 мг, которая неоднократно упоминается в литературе в качестве одной из самых рациональных для профилактики ССЗ, позволила нам улучшить показатели липидного профиля крови. В течение первых полутора лет приема МГТ у пациенток выявлена нормализация уровня общего холестерина, повышение содержания антиатерогенных липопротеидов высокой плотности (ЛПВП), а также снижение ЛПНП до нормальных значений. Говоря о состоянии сосудистой стенки, прием МГТ с дидрогестероном позволил сохранить толщину КИМ сосудов неизменным на протяжении всего периода наблюдения. По данным литературы, максимальный положительный эффект от МГТ наступает при продолжительности приема не менее 5 лет. Срок проведения нашего исследования составил 18 мес, в связи с этим необходимо его продление и дальнейшее наблюдение за состоянием здоровья пациенток.Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Мазитова Мадина Ирековна – д-р мед. наук, проф. каф. акушерства и гинекологии, КГМА – филиал ФГБОУ ДПО РМАНПО; врач акушер-гинеколог, ООО «Институт здоровья и долголетия “Разумед”», Казань. E-mail: madina13@list.ru; ORCID: 0000-0002-9608-2076
Madina I. Mazitova – Dr. Sci. (Med.), Prof., Kazan State Medical Academy – branch of Russian Medical Academy of Continuous Professional Education; Obstetrician-gynecologist, Institute of Health and Longevity "Razumed". E-mail: madina13@list.ru; ORCID: 0000-0002-9608-2076
Мардиева Резеда Рубертовна – ассистент каф. акушерства и гинекологии, КГМА – филиал ФГБОУ ДПО РМАНПО, врач акушер-гинеколог, ГАУЗ ГКБ №7. E-mail: rezedamardieva@gmail.com; ORCID: 0000-0003-2568-0121
Rezeda R. Mardieva – Аssistant, Medical Resident, Kazan State Medical Academy – branch of Russian Medical Academy of Continuous Professional Education; Obstetrician-gynecologist, City Clinical Hospital No7, Kazan. E-mail: rezedamardieva@gmail.com; ORCID: 0000-0003-2568-0121
Фаустова Карина Валерьевна – врач-ординатор каф. акушерства и гинекологии, КГМА – филиал ФГБОУ ДПО РМАНПО. E-mail: faustova_rina@mail.ru; ORCID: 0000-0001-8702-0159
Karina V. Faustova – Medical Resident, Kazan State Medical Academy – branch of Russian Medical Academy of Continuous Professional Education. E-mail: faustova_rina@mail.ru; ORCID: 0000-0001-8702-0159
Поступила в редакцию: 07.11.2023
Поступила после рецензирования: 15.11.2023
Принята к публикации: 16.11.2023
Received: 07.11.2023
Revised: 15.11.2023
Accepted: 16.11.2023
Список исп. литературыСкрыть список1. Mosca L, Hammond G, Mochari-Greenberger H et al. American Heart Association Cardiovascular Disease and Stroke in Women and Special Populations Committee of the Council on Clinical Cardiology, Council on Epidemiology and Prevention, Council on Cardiovascular Nursing, Council on High Blood. Fifteen-year trends in awareness of heart disease in women: results of a 2012 American Heart Association national survey. Circulation. 2013; 127 (11): 1254–63, e1-29. DOI: 10.1161/ CIR.0b013e318287cf2f
2. Чазова И.Е., Сметник В.П., Балан В.Е. и др. Ведение женщин с сердечно-сосудистым риском в пери- и постменопаузе: консенсус российских кардиологов и гинекологов. Системные гипертензии. 2008; (3): 26–39.
Chazova IE, Smetnik VP, Balan VE et al. Management of women with cardiovascular risk in peri- and postmenopausal women: consensus of Russian cardiologists and gynecologists. Systemic hypertension. 2008; (3): 26–39 (in Russian).
3. Погосова Н.В., Оганов Р.Г., Бойцов С.А. и др. Мониторинг вторичной профилактики ишемической болезни сердца в России и Европе: результаты российской части международного многоцентрового исследования EUROASPIRE IV. Кардиология. 2015; 55 (12): 99–107.
Pogosova NV, Oganov RG, Boitsov SA et al. Monitoring of secondary prevention of coronary heart disease in Russia and Europe: results of the Russian part of the international multicenter EUROASPIRE IV study. Cardiology. 2015; 55 (12): 99–107 (in Russian).
4. Benjamin EJ, Muntner P, Alonso A et al; on behalf of the American Heart Association Council on Epidemiology and Prevention Statistics Committee and Stroke Statistics Subcommittee. Heart disease and stroke statistics – 2019 update: a report from the American Heart Association. Circulation. 2019; 139: e56–e528. DOI: 10.1161/CIR. 0000000000000659
5. Сердечно-сосудистые заболевания. ВОЗ. URL: https://www.who. int/ru/news-room/fact-sheets/detail/cardiovascular-diseases-(cvds)
Cardiovascular diseases. World Health Organization. URL: https:// www.who.int/ru/news-room/fact-sheets/detail/cardiovascular-diseases-(cvds) (in Russian).
6. Пан Ги Мун. Послание по случаю Международного дня пожилых людей. URL: http://www.un.org/ ru/sg/messages/2013/olderpersonsday.shtml
Pan Gi Mun. Message on the occasion of the International Day of the Elderly. URL: http://www.un.org/ ru/sg/messages/2013/olderpersonsday.shtml (in Russian).
7. El Khoudary SR. Gaps, limitations and new insights on endogenous estrogen and follicle stimulating hormone as related to risk of cardiovascular disease in women traversing the menopause: a narrative review. Maturitas. 2017; 104: 44–53. DOI: 10.1016/j.maturitas.2017.08.003
8. The 2022 Hormone Therapy Position Statement of The North American Menopause Society Advisory Panel. The 2022 hormone therapy position statement of The North American Menopause Society. Menopause. 2022; 29: 767.
9. Lobo RA, Davis SR, de Villiers TJ et al. Prevention of diseases after menopause. Climacteric. 2014; 17: 540–56. DOI: 10.3109/13697137. 2014.933411
10. Hodis HN, Neves-e-Castro M. Menopausal hormone therapy and prevention of chronic diseases: IMS members react to the recent JAMA paper. Climacteric. 2014; 17 (1): 99–101. PMID: 24571029.
11. Menopause: diagnosis and management. NICE guideline [NG23]. Last updated: 05 December 2019.
12. Chester RC, Kling JM, Manson JE. What the Women's Health Initiative has taught us about menopausal hormone therapy. Clin Cardiol. 2018; 41 (2): 247–52. DOI: 10.1002/clc.22891
13. Naftolin F, Friedenthal J, Nachtigall R, Nachtigall L. Cardiovascular health and the menopausal woman: the role of estrogen and when to begin and end hormone treatment. F1000Res. 2019; 8: F1000 Faculty Rev-1576. DOI: 10.12688/f1000research.15548.1
14. The NAMS 2017 Hormone Therapy Position Statement Advisory Panel. The 2017 hormone therapy position statement of The North American Menopause Society. Menopause 2017; 24 (7): 728–53. DOI: 10.1097/GME.0000000000000921
15. Miller VM, Black DM, Brinton EA et al. Using basic science to design a clinical trial: baseline characteristics of women enrolled in the Kronos Early Estrogen Prevention Study (KEEPS). J Cardiovasc Transl Res. 2009; 2 (3): 228–39. DOI: 10.1007/s12265-009-9104-y
16. Mehta JM, Chester RC, Kling JM. The timing hypothesis: hormone therapy for treating symptomatic women during menopause and its relationship to cardiovascular disease. J Womens Health. 2019; 28 (5): 705–11. DOI: 10.1089/jwh.2018.7201
17. Moreau KL, Hildreth KL, Meditz AL et al. Endothelial function is impaired across the stages of the menopause transition in healthy women. J Clin Endocrinol Metab. 2012; 97 (12): 4692–700. DOI: 10.1210/jc.2012-2244
18. Boardman HM, Hartley L, Eisinga A et al. Hormone therapy for preventing cardiovascular disease in post-menopasual women. Cochrane Database Syst Rev. 2015.
19. Alonzo MD, Bounous VE, Villa M, Biglia N. Current evidence of the oncological benefit-risk profile of hormone replacement therapy. Medicina. 2019; 55: 573. DOI: 10.3390/medicina55090573
20. De Smedt D, De Bacquer D, De Sutter J et al. The gender gap in risk factor control: Effects of age and education on the control of cardiovascular risk factors in male and female coronary patients. The EUROASPIRE IV study by the European Society of Cardiology. Int J Cardiol. 2016; 209: 284–90.
21. Kamstrup PR, Nordestgaard BG. Elevated Lipoprotein(a) Levels, LPA Risk Genotypes, and Increased Risk of Heart Failure in the General Population. JACC Heart Fail. 2016; 4: 78–87. DOI: 10.1016/j.jchf. 2015.08.006
22. Гиперлипопротеидемия(а) как опасное генетически обусловленное нарушение липидного обмена и фактор риска атеротромбоза и сердечно-сосудистых заболеваний. Российский кардиологический журнал. 2019; 24 (5): 101–8. DOI: 10.15829/1560-4071- 2019-5-101-108
Hyperlipoproteidemia (a) as a dangerous genetically determined violation of lipid metabolism and a risk factor for atherothrombosis and cardiovascular diseases. Russ J Cardiol. 2019; 24 (5): 101–8. DOI: 10.15829/1560-4071- 2019-5-101-108 (in Russian).
23. Hanggi W, Lippuner K, Riesen W et al. Long term influence of different postmenopausal hormone replacement regimens on serum lipids and lipoprotein(a): a randomised study. Br J Obstet Gynaecol. 1997; 104: 708–17.
24. Pickar JH. Effects of lower doses of conjugated equine estrogens and medroxyprogesterone acetate on plasma lipids and lipoproteins, coagulation factors, and carbohydrate metabolism. Fertil Steril. 2001; 76 (1): 13–24. DOI: 10.1016/S0015-0282(01)01829-5
25. Kessler EL, Rivaud MR, Vos MA, Van Veen TA. Sex-specific influence on cardiac structural remodeling and therapy in cardiovascular disease. Biol Sex Differ. 2019; 10 (7).
26. Miller RJH, Mikami Y, Heydari B et al. Sex-specific relationships between patterns of ventricular remodelling and clinical outcomes. Eur Heart J Cardiovasc Imaging. 2020; 21: 983–990.
27. Sarri G, Pedder H, Dias S et al. Vasomotor symptoms resulting from natural menopause: a systematic review and network meta-analysis of treatment effects from the National Institute for Health and
Care Excellence guideline on menopause. BJOG. 2017; 124: 1514.
28. Hodis HN, Mack WJ, Henderson VW. Effects of early versus late postmenopausal treatment with estradiol. N Engl J Med. 2016; 374: 1221–31. DOI: 10.1056/ NEJMoa1505241
29. Collaborative Group on Hormonal Factors in Breast Cancer. Type and timing of menopausal hormone therapy and breast cancer risk: individual participant meta-analysis of the worldwide epidemiological evidence. Lancet. 2019; 394 (10204): 1159–68. DOI: 10.1016/S0140-6736(19)31709-X
30. Hodis HN, Mack WJ, Henderson VW. Effects of early versus late postmenopausal treatment with estradiol. N Engl J Med. 2016; 374: 1221–31. DOI: 10.1056/ NEJMoa1505241
31. Santen RJ. Use of cardiovascular age for assessing risks and benefits of menopausal hormone therapy. Menopause. 2017; 24: 589–95. DOI: 10.1097/GME.0000000000000847
32. Dinger J, Bardenheuer K, Heinemann К. Drospirenone plus estradiol and the risk of setious cardiovascular events in postmenopausal women. Climacteric. 2016; 19 (4): 349–56. DOI: 10.1080/13697137. 2016.1183624
33. Vinogradova Y, Coupland C, Hippisley-Cox J. Use of hormone replacement therapy and risk of venous thromboembolism: nested case-control studies using the QResearch and CPRD databases [published correction appears in BMJ. 2019 Jan 15;364:l162]. BMJ. 2019;364:k4810. Published 2019 Jan 9. doi:10.1136/bmj.k4810
34. Росстат. Численность населения Российской Федерации по полу и возрасту на 1 января 2022 г. М., 2022. URL: https:// rosstat.gov.ru/ compendium/document/13284 (accessed: 05.10.2022).
Rosstat. The population of the Russian Federation by gender and age as of 01.01.2022. Moscow, 2022. URL: ttps://rosstat.gov.ru/compendium/document/13284 (accessed: 05.10.2022) (in Russian)
35. Менопауза и климактерическое состояние у женщины. Клинические рекомендации РОАГ. КР117. М., 2021.
Menopause and menopause in women. Clinical Recommendations of the ROAG. CR 117. Moscow, 2021 (in Russian).
36. Our World in Data - Why do women live longer than men? Available at: https://ourworldindata.org/why-do-women-live-longer-than-men; Accessed: от 09.01.2022.
37. Miller VM, Duckles SP. Vascular actions of estrogens: functional implications. Pharmacol Rev 2008;60:210-241.
38. Menazza S, Murphy E. The expanding complexity of estrogen receptor signaling in the cardiovascular system. Circ Res. 2016; 118: 994–1007.
39. Turgeon JL, Carr MC, Maki PM, Mendelsohn ME, Wise PM. Complex actions of sex steroids in adipose tissue, the cardiovascular system, and brain: insights from basic science and clinical studies. Endocr Rev 2006; 27: 575–605.
40. Kovats S. Estrogen receptors regulate innate immune cells and signaling pathways. Cell Immunol 2015; 294: 63–69.
41. Klein SL, Flanagan KL. Sex differences in immune responses. Nat Rev Immunol. 2016; 16: 626–38.


