Клинический разбор в общей медицине №2 2024
Клинический разбор в общей медицине №2 2024
Критерии оценки эффективности антикоагулянтной терапии: роль суррогатных критериев
Номера страниц в выпуске:6-14
Аннотация
Статья посвящена проблеме использования косвенных показателей, или суррогатных критериев (СК), как в рандомизированных клинических, так и в обсервационных исследованиях. Рассматриваются основания для более широкого использования СК при оценке результатов клинических исследований. Обсуждаются возможные отрицательные последствия широкого применения косвенных показателей и необходимость информирования врачей о получении доказательной информации с помощью СК, а не истинных клинических исходов. Приводятся данные анализов, посвященных выявлению наиболее важных проблем использования СК при оценке эффективности определенных вмешательств. Отдельно рассматривается проблема использования СК при оценке эффективности и безопасности применения антикоагулянтов у пациентов с фибрилляцией предсердий или венозными тромбоэмболическими осложнениями. Приводятся необходимые условия, обеспечивающие возможность применения СК в исследованиях по оценке эффективности вмешательств. Рассматриваются примеры использования как обоснованного, так и недостаточно обоснованного использования СК по оценке эффективности антикоагулянтов в различных клинических ситуациях. Обсуждаются результаты рандомизированного клинического исследования по оценке эффективности приема антикоагулянта, основанного на выявлении СК фибрилляции предсердий с помощью имплантированных в сердце устройств. Отдельно рассматривается проблема использования СК при оценке риска развития кровотечений в исследованиях по оценке эффектов антикоагулянтов. Приводятся мнения экспертов, подчеркивающих необходимость осторожного использования СК при оценке частоты развития как венозных тромбоэмболических осложнений, так и кровотечений, так как в таких случаях результаты сопоставления пользы и риска от вмешательства могут быть существенно искажены.
Ключевые слова: суррогатные критерии, фибрилляция предсердий, венозные тромбоэмболические осложнения, апиксабан, ривароксабан, варфарин.
Для цитирования: Гиляревский С.Р. Критерии оценки эффективности антикоагулянтной терапии: роль суррогатных критериев. Клинический разбор в общей медицине. 2024; 5 (2): 6–14. DOI: 10.47407/kr2023.5.2.00382
Статья посвящена проблеме использования косвенных показателей, или суррогатных критериев (СК), как в рандомизированных клинических, так и в обсервационных исследованиях. Рассматриваются основания для более широкого использования СК при оценке результатов клинических исследований. Обсуждаются возможные отрицательные последствия широкого применения косвенных показателей и необходимость информирования врачей о получении доказательной информации с помощью СК, а не истинных клинических исходов. Приводятся данные анализов, посвященных выявлению наиболее важных проблем использования СК при оценке эффективности определенных вмешательств. Отдельно рассматривается проблема использования СК при оценке эффективности и безопасности применения антикоагулянтов у пациентов с фибрилляцией предсердий или венозными тромбоэмболическими осложнениями. Приводятся необходимые условия, обеспечивающие возможность применения СК в исследованиях по оценке эффективности вмешательств. Рассматриваются примеры использования как обоснованного, так и недостаточно обоснованного использования СК по оценке эффективности антикоагулянтов в различных клинических ситуациях. Обсуждаются результаты рандомизированного клинического исследования по оценке эффективности приема антикоагулянта, основанного на выявлении СК фибрилляции предсердий с помощью имплантированных в сердце устройств. Отдельно рассматривается проблема использования СК при оценке риска развития кровотечений в исследованиях по оценке эффектов антикоагулянтов. Приводятся мнения экспертов, подчеркивающих необходимость осторожного использования СК при оценке частоты развития как венозных тромбоэмболических осложнений, так и кровотечений, так как в таких случаях результаты сопоставления пользы и риска от вмешательства могут быть существенно искажены.
Ключевые слова: суррогатные критерии, фибрилляция предсердий, венозные тромбоэмболические осложнения, апиксабан, ривароксабан, варфарин.
Для цитирования: Гиляревский С.Р. Критерии оценки эффективности антикоагулянтной терапии: роль суррогатных критериев. Клинический разбор в общей медицине. 2024; 5 (2): 6–14. DOI: 10.47407/kr2023.5.2.00382
Review
Pirogov Russian National Research Medical University, Moscow, Russia
sgilarevsky@rambler.ru
Abstract
The article is devoted to the problem of using indirect indicators, or surrogate criteria, both in randomized clinical and observational studies. The reasons for the increasing frequency of using surrogate criteria in assessing the results of clinical trials are considered. The possible negative consequences of the widespread use of proxy measures and the need to educate clinicians to obtain evidence-based information using surrogate criteria rather than true clinical outcomes are discussed. Data from analyzes aimed at identifying the most important problems in the use of surrogate criteria in assessing the effectiveness of certain interventions are presented. The problem of using surrogate criteria in assessing the effectiveness and safety of the use of anticoagulants in patients with atrial fibrillation or venous thromboembolic complications is separately considered. The necessary conditions are provided to ensure the possibility of using surrogate criteria in studies assessing the effectiveness of interventions. Examples of the use of both justified and insufficiently justified use of surrogate criteria for assessing the effectiveness of anticoagulants in various clinical situations are considered. The results of a randomized clinical trial evaluating the effectiveness of an anticoagulant based on identifying surrogate criteria for atrial fibrillation using devices implanted in the heart are discussed. The problem of using surrogate criteria when assessing the risk of bleeding in studies assessing the effects of anticoagulants is discussed separately. The opinions of experts are presented, emphasizing the need for careful use of surrogate criteria when assessing the incidence of both venous thromboembolic complications and bleeding, since in such cases the results of comparing the benefits and risks of the intervention can be significantly distorted.
Keywords: surrogate criteria, atrial fibrillation, venous thromboembolic events, apixaban, rivaroxaban, warfarin.
For citation: Gilyarevsky S.R. Criteria for evaluation of the anticoagulant therapy efficacy: the role of «surrogate criteria». Clinical analysis in general medicine. 2024; 5 (2): 6–14. (In Russ.). DOI: 10.47407/kr2023.5.2.00382
СК могут использоваться в качестве как дополнительных [3], так и основных показателей [4]. В последнем случае СК применяют для достижения следующих целей:
1) для облегчения получения результатов исследования, так как такие показатели могут отмечаться чаще и легче зарегистрировать их большее число;
2) для подтверждения эффектов препарата в ранних небольших исследованиях по оценке эффективности его применения;
3) чтобы ускорить получение одобрения использования вмешательства или лекарственного препарата в тех случаях, когда есть потребность в их применении (например, при угрожающих жизни или необратимых тяжелых заболеваниях, особенно в отсутствие доказанного стандартного лечения) [2, 5]. Во время пандемии COVID-19 нередко одобрение к применению препаратов было основано на исследованиях, в которых оценивали только СК [6].
Использование СК может становиться единственным возможным критерием для оценки эффектов вмешательства в тех случаях, когда в целом невозможно добиться достаточной статистической мощности исследования для оценки частоты развития неблагоприятных исходов из-за небольшой выборки. Одним из примеров может быть исследование по сравнительной оценке эффективности приема варфарина и апиксабана у пациентов с тромбозом левого желудочка, обусловленного инфарктом миокарда [7]. В исследование были включены всего 35 пациентов: 18 – в группу апиксабана и 17 – в группу варфарина. Полученные результаты свидетельствовали о сходной частоте растворения тромба в обеих группах (т.е. о сходной частоте СК), которая при приеме апиксабана и варфарина достигала 94 и 93% соответственно. В ходе выполнения исследования в группе варфарина у 2 пациентов развилось тяжелое кровотечение и у 1 пациента в отсутствие международного нормализованного отношения в терапевтическом диапазоне развился эмболический инсульт. Несмотря на то, что такие данные о частоте клинических исходов представляются правдоподобными, так как в целом прием апиксабана по сравнению с варфарином в ходе выполнения крупных РКИ (ARISTOTLE, AMPLIFY) сопровождался меньшей частотой тяжелых кровотечений, трактовать частоту развития клинических исходов в таком небольшом исследовании невозможно в связи с его недостаточной статистической мощностью.
В то же время, несмотря на привлекательность и определенные преимущества СК, есть определенные опасения по поводу их широкого использования. Во-первых, сравнение результатов оценки вмешательств с помощью СК и клинических исходов свидетельствует о том, что косвенные показатели примерно на 46% переоценивают эффективность вмешательства [8]. Во-вторых, подтверждение эффективности вмешательств с помощью некоторых СК регуляторные органы используют для ускоренного одобрения вмешательства, что может приводить к внедрению в клиническую практику препарата, отрицательные эффекты которого могут преобладать над положительными, так как негативные эффекты не были в достаточной степени учтены в исследованиях с оценкой только СК [9–11].
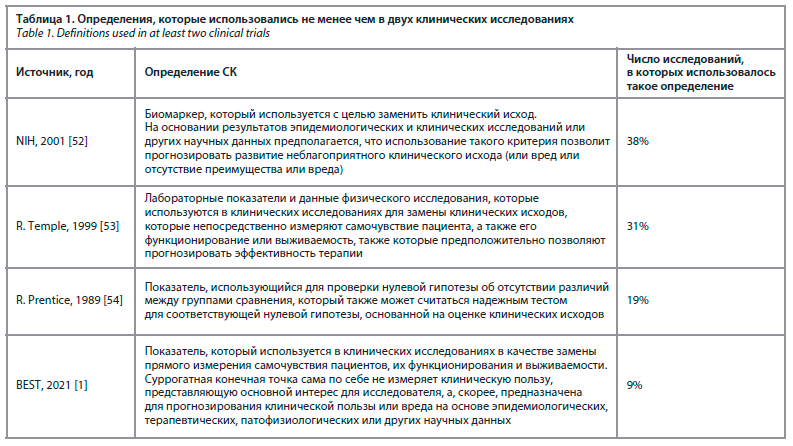
В ходе выполнения систематического обзора, опубликованного в 2023 г., оценивали использующиеся определения СК, а также качество представления результатов исследований с оценкой СК [2]. Авторы обзора выявили существенные различия между исследованиями по используемым определениям СК, а также по указаниям на то, какие клинические исходы заменяют суррогатные показатели и каково их прогностическое значение. В табл. 1 представлены примеры наиболее часто приводимых в исследованиях определений СК. Полученные результаты во многом совпадали с данными анализа, которые были опубликованы почти 15 лет назад [12]. Такие данные также свидетельствовали о большом числе определений СК, которое достигало восьми, и они также различались по измеряемым показателям и наличию обоснований их использования в качестве СК. Авторы анализа отметили ограничения использования СК, в том числе необходимость соблюдения осторожности при экстраполяции данных об обоснованности СК в одной клинической ситуации на другую, так как СК всегда определяются клиническим контекстом [12].
1) планирование и проведение исследований с одновременной оценкой как значимых клинических исходов, так и СК (в том числе и в подгруппах пациентов с определенными характеристиками);
2) обеспечение свободного доступа к таким данным [2].
Несмотря на трудности сбора дополнительной информации, считается важным получение доступа не только к результатам исследований в целом, но и к индивидуальным данным участников исследований с оценкой как СК, так и клинических исходов для более точной проверки степени соответствия таких показателей. Несмотря на то, что методы проверки соответствия СК и клинических исходов основываются в первую очередь на данных, полученных в РКИ [13], представляют интерес и результаты обсервационных исследований клинической практики и других нерандомизированных исследований.
Считается, что при проведении исследований с использованием только СК необходимо информировать участников о том, что цель исследования состоит именно в оценке частоты развития СК, а не значимых для пациента клинических исходов. В связи с этим сами исследователи должны иметь информацию о возможных ограничениях использования СК, которые обусловлены невозможностью на их основании предсказать клиническую пользу вмешательства или предоставить данные о безопасности вмешательства [2].
В исследовании ARISTOTLE [14] для оценки безопасности применения апиксабана по сравнению с приемом варфарина использовали показатель частоты развития тяжелых кровотечений (в соответствии с определением Международного общества специалистов по тромбозам и гемостазу такое кровотечение диагностируют при развитии клинически явного кровотечения, которое сопровождается снижением концентрации гемоглобина не менее чем на 2 г/дл или переливанием не менее 2 доз эритроцитной массы, а также при развитии кровотечения в жизненно важные органы или приведшем к смерти [16]. Комбинированный показатель частоты развития тяжелых и клинически значимых нетяжелых кровотечений в исследовании ARISTOTLE использовали только в качестве дополнительного показателя безопасности. Статистически значимые преимущества применения апиксабана по сравнению с варфарином были отмечены как по основному показателю тяжелых кровотечений (отношение риска – ОР 0,69 при 95% доверительном интервале – ДИ 0,60–0,80; p<0,001), так и по дополнительному комбинированному показателю безопасности (ОР 0,68; 95% ДИ 0,61–0,75; p<0,001). Так что данные о преимуществах приема апиксабана по показателям безопасности в соответствии с современными представлениями можно считать надежными даже по строгим формальным критериям, так как они были подтверждены с помощью значимого для пациента показателя частоты тяжелого кровотечения. Частота исходов, включенных в дополнительный комбинированный показатель безопасности, была почти в 2 раза выше, чем изолированная частота развития тяжелых кровотечений (в группе апиксабана 2,13 и 4,07% в год, в группе варфарина – 3,09 и 6,01% в год соответственно), что, впрочем, не повлияло на выявление статистически значимых преимуществ приема апиксабана.
В то же время в РКИ ROCKET в качестве главного показателя безопасности использовали комбинированный показатель частоты развития тяжелых и нетяжелых клинически значимых кровотечений (КЗК), т.е. показателя, в который был включен не только истинный клинический исход, но и СК. Полученные результаты свидетельствовали о том, что безопасность приема ривароксабана не отличалась от таковой при приеме варфарина (ОР 1,03; 95% ДИ 0,96–1,11; p=0,44). Более того, обращает на себя внимание, что верхняя граница ДИ в большей степени отклоняется вправо, чем нижняя граница – влево, т.е. была более отчетливая тенденция к увеличению риска развития кровотечений в группе ривароксабана. Таким образом, в исследовании ROCKET полученные данные о частоте развития кровотечений менее надежны, так как их оценивали с помощью основного комбинированного показателя безопасности, включающего не только частоту тяжелых кровотечений, но и СК частоты развития нетяжелых КЗК. Нельзя не отметить, что результаты анализа частоты развития тяжелых кровотечений были сходными с данными, полученными при анализе основного комбинированного показателя (ОР 1,04; 95% ДИ 0,90–1,20; p=0,58). И в данном случае отклонение 95% ДИ вправо от 1,0 было более выраженным, чем нижней границы влево, что может указывать на тенденцию к увеличению риска развития кровотечений при приеме ривароксабана по сравнению с применением варфарина.
Следует отметить, что при выполнении обсервационных исследований, основанных на анализе баз данных страховых заявок или других административных баз данных, а также данных регистров, обычно используют не СК, а клинические значимые исходы (смерть, инфаркт миокарда или инсульт), которые можно надежно оценить с использованием таких источников информации о пациентах.
Очевидно, что сравнение частоты развития кровотечений у пациентов с тяжелой хронической болезнью почек представляет наиболее трудную задачу, так как такие пациенты не включались в крупные РКИ. Недавно была предпринята попытка оценить риск развития кровотечений у таких пациентов при приеме апиксабана, ривароксабана и варфарина с целью профилактики тромбоэмболических осложнений у пациентов с ФП [17]. Исследование было основано на анализе информации, полученной в 2 базах данных страховых заявок и 2 других административных базах данных США. В анализ были включены данные о пациентах с ФП и хронической болезнью почек стадии 4/5, которые в период с 2013 по 2022 г. начинали прием апиксабана, ривароксабана или варфарина. Группы сравнения формировали с помощью метода propensity score-matched с целью максимального соответствия групп по основным демографическим и клиническим характеристикам (учитывали 80 характеристик пациентов). Оценку безопасности терапии проводили с помощью показателя частоты развития тяжелых кровотечений. Эффективность терапии оценивали с помощью показателя частоты развития инсульта. Когорта для сравнения эффектов апиксабана и варфарина включала 12 488 пациентов, а когорта для сравнения эффектов ривароксабана и апиксабана – 5720 пациентов.
Полученные результаты свидетельствовали о том, что прием варфарина по сравнению с приемом апиксабана сопровождался более высокой частотой развития не только тяжелых кровотечений (ОР 1,85; 95% ДИ 1,59–2,15), но и кровотечений из желудочно-кишечного тракта (ОР 1,86; 95% ДИ 1,53–2,25) и внутричерепных кровоизлияний (ОР 2,15; 95% ДИ 1,42–3,25). Прием ривароксабана по сравнению с приемом апиксабана также сопровождался более высоким риском развития тяжелых кровотечений (ОР 1,69; 95% ДИ 1,33–2,15).
Не было отмечено статистически значимых различий между группами по риску развития ишемического инсульта, но 95% ДИ для такого показателя были достаточно широкими, что могло быть обусловлено небольшим числом инсультов. Таким образом, полученные с помощью определенного клинического исхода частоты развития тяжелых кровотечений результаты свидетельствуют о более высокой безопасности приема апиксабана по сравнению с применением как варфарина, так и апиксабана у пациентов с более тяжелым нарушением функции почек, чем было нарушение функции почек у пациентов, включавшихся в крупные РКИ по оценке эффектов ПОАК по сравнению с эффектами варфарина у пациентов с ФП [17].
В ходе выполнения исследования ARTESIA (Apixaban for the Reduction of Thrombo-Embolism in Patients with Device-Detected Subclinical Atrial Fibrillation), результаты которого были опубликованы в 2024 г. [19], были получены данные о том, что у пациентов пожилого возраста (в среднем 76,8±7,6 года) с эпизодами субклинической ФП с продолжительностью эпизодов частого ритма предсердий от 6 мин до 24 ч и повышенным риском развития инсульта (средняя оценка по шкале CHA2DS2-VASc 3,9±1,1 балла) прием апиксабана по 5 мг 2 раза в сутки (или 2,5 мг 2 раза в сутки) был более эффективен по сравнению с приемом ацетилсалициловой кислоты (АСК) по 81 мг 1 раз в сутки для профилактики инсульта или эмболии сосудов большого круга кровообращения (ЭСБКК), несмотря на низкую в целом частоту развития таких исходов (ОР 0,63; 95% ДИ 0,45–0,88; p=0,007). Следует отметить, что, несмотря на использование СК субклинической ФП в качестве критерия включения в исследование, показатели эффективности и безопасности включали определенные значимые для пациента клинические исходы частоты развития инсульта/ЭСБКК и тяжелых кровотечений соответственно. Несмотря на то, что по сравнению с приемом АСК прием апиксабана сопровождался увеличением риска развития тяжелых кровотечений, увеличение риска было небольшим (на 0,42% на пациенто-лет) и достигало лишь пограничного уровня статистической значимости (ОР 1,36; 95% ДИ 1,01–1,82; p=0,04). Такие данные в целом совпадают с небольшим увеличением частоты развития кровотечений в другом исследовании по сравнительной оценке приема апиксабана и АСК у пациентов с ФП (0,2% в год в РКИ AVERROES [20]).
ВТЭО характеризуются высокой смертностью, заболеваемостью в отдаленные сроки после ее развития, высокой частотой госпитализаций и рецидивов, а также существенными расходами здравоохранения. Факторы риска развития ВТЭО были установлены во многих популяциях [23]. Было проведено большое число исследований по оценке различных методов профилактики ВТЭО в разных клинических ситуациях.
Очевидно, что выполнение РКИ остается основным подходом к оценке эффективности вмешательств, а их результаты занимают наивысшее положение в иерархии доказательств [24]. Однако принципиальным для получения результатов РКИ, которые можно использовать для определения показаний к использованию лекарственного препарата, является выбор критериев оценки, достаточно полно отражающих значимые для пациента клинические исходы. Определенные клинические исходы почти всегда используют в так называемых прагматических исследованиях, так как в таких исследованиях именно такие клинические исходы можно оценить с помощью соответствующих регистров и/или административных баз данных. В то же время в исследованиях, основанных на регистрах, а в последнее время и в РКИ, выполненных с использованием более совершенных протоколов, нередко используют СК, что позволяет (особенно при использовании анализа Win ratio) формально получать доказательства эффективности вмешательства даже в отсутствие статистически значимого влияния на риск развития клинических исходов [25]. Считается, что СК могут выступать в качестве альтернативы оценки клинических исходов в тех случаях, когда частота кинических исходов невысока и ее трудно измерить. Очевидно, что в таких случаях можно использовать комбинированные показатели, включающие как клинические исходы, так и СК [26]. Такой подход позволяет сократить размер выборки в РКИ, который необходим для достижения адекватной статистической мощности исследования.
Стандартные клинические исходы, которые оценивают в исследованиях по оценке эффективности вмешательств, включают частоту развития тромбоза глубоких вен (ТГВ) нижних конечностей и эмболии легочной артерии (ЭЛА) [27]. К другим оцениваемым в таких исследованиях показателям относят тромбоз, связанный с катетером, а также частоту развития ТГВ верхних конечностей и тромбоза вен внутренних органов [28–32].
К наиболее значимым для пациентов исходам в исследованиях по оценке эффективности применения антикоагулянтов при ВТЭО относят симптомные ВТЭО, развитие которых должно быть подтверждено с помощью методов визуализации. В качестве СК в таких случаях используют частоту развития бессимптомных ВТЭО, которые обычно регистрируются при обследовании в период амбулаторного наблюдения. Для увеличения частоты развития ВТЭО и уменьшения выборки исследования в ходе выполнения РКИ могут комбинировать оценку симптомных и бессимптомных ВТЭО. Однако обоснованность использования частоты развития бессимптомных ВТЭО и их клиническая значимость подвергаются сомнениям, особенно при сопоставлении пользы профилактики ВТЭО и риска развития кровотечений. В отличие от бессимптомных ВТЭО кровотечение обычно представляет собой клинически значимое осложнение даже в тех случаях, когда его выявляют с помощью периодически выполняемых лабораторных исследований (например, при периодической оценке концентрации гемоглобина в крови) [33].
С целью описания современных тенденций в использовании СК в РКИ по оценке эффективности вмешательств для профилактики ВТЭО был выполнен систематический обзор [27]. Поиск статей с отчетом о результатах РКИ по оценке эффектов вмешательств для профилактики развития ВТЭО выполняли в базах данных Ovid MEDLINE, Embase и Cochrane (CENTRAL), которые были опубликованы на английском языке в период с января 2000 г. по октябрь 2020 г. В анализ включали только исследования, включавшие более 150 пациентов.
В анализ было включено 209 РКИ. Медиана числа включенных в исследование пациентов достигала 662 человек (МКД от 318 до 1761). Эффекты медикаментозной профилактики ВТЭО изучали в 79,4% РКИ, эффекты механических методов профилактики – 13,9% и комбинированных методов – 6,7%. В группах контроля медикаментозная профилактика, механические методы профилактики, плацебо, отсутствие профилактики или комбинированные методы применяли в 59,3, 8,1, 20,6, 5,3 и 6,7% РКИ соответственно.
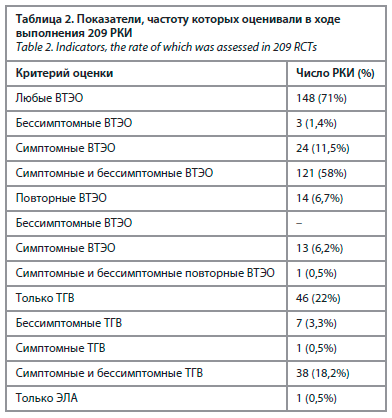
В ходе выполнения 209 РКИ оценивали частоту развития любых ВТЭО, повторных ВТЭО, только частоту ТГВ или только ЭЛА в 70,8, 6,7, 22 и 0,5% РКИ соответственно. В 4,8% исследованиях анализировали только бессимптомные ВТЭО, в 18,7% РКИ – только симптомные ВТЭО и в 76,6% – комбинированный показатель частоты развития как симптомных, так и бессимптомных ВТЭО (табл. 2).
Только в 34 (20%) из 170 отчетов об РКИ с использованием суррогатных или комбинированных показателей для оценки частоты развития ВТЭО такой подход был указан авторами в качестве возможного ограничения исследования. В 152 (89%) из 170 отчетов обсуждалось соотношение между риском развития кровотечения и тромбоза. Не было отмечено статистически значимой связи между использованием суррогатного показателя и числом цитирований статей (отношение шансов – ОШ 0,99; 95% ДИ 0,99–1,00; p=0,248) или размеров выборки (ОШ 0,99; 95% ДИ 0,99–1,00; p=0,320). Однако имелась статистически значимая связь между импакт-фактором журнала, в котором опубликована статья, и использованием суррогатного результата (ОШ 0,98; 95% ДИ 0,97–0,99; p<0,05).
Следует также отметить, что во многих исследованиях с использованием ультразвукового исследования для диагностики ТГВ не разделяли случаи тромбоза в проксимальных и дистальных глубоких венах. В то же время имеются данные о том, что тромбоз в проксимальных венах, а не дистальных, по данным ультразвукового исследования может считаться более надежным СК, так как при такой локализации ТГВ имеется более высокая вероятность прогрессирования до клинически значимых исходов [34].
Таким образом, авторы систематического обзора впервые количественно определили частоту использования СК при оценке результатов профилактики развития ВТЭО. Почему такие данные могут иметь важное значение как для врачей, так и для исследователей? Дело в том, что при сопоставлении риска развития кровотечений и риска развития тромбозов использование СК может ошибочно повышать предполагаемый риск клинически значимых тромботических осложнений.
В таких случаях сопоставление исходов становится особенно трудным, так как кровотечения редко используют в качестве СК. Тем не менее, по-видимому, в будущем СК или комбинированные показатели, включающие СК и клинические исходы, будут все чаще использовать при проведении РКИ, так как такой подход позволяет уменьшить объем выборки, который необходим для обеспечения статистической мощности исследования. Следует отметить, что в отчете о результатах исследования крайне важно указывать на ограничения исследования в связи с использованием СК, особенно в тех случаях, когда в выводах отмечаются результаты сопоставления риска тромботических осложнений и кровотечений.
В целом СК широко распространены в отчетах о результатах РКИ по оценке эффективности вмешательств для профилактики ВТЭО, но такое ограничение исследований редко признается авторами. Несмотря на это в отсутствие таких указаний в статьях часто обсуждается соотношение риска развития кровотечений и тромбоза. Считается, что при интерпретации результатов исследования и их использовании в клинической практике врачам следует осознавать такие ограничения, а исследователям необходимо указывать на использование СК при анализе результатов РКИ, особенно если они используются при подготовке клинических рекомендаций.
К преимуществам применения ПОАК перед традиционными профилактическими и терапевтическими тактиками относят их пероральный прием и отсутствие необходимости лабораторного контроля. Основная цель большинства исследований по оценке эффектов ПОАК состояла в подтверждении гипотезы о не менее высокой эффективности их использования по сравнению со стандартной тактикой, включающей АВK.
В связи с очень низкой частотой тяжелых кровотечений в группах сравнения такие исследования, как правило, не имели достаточной статистической мощности для выявления статистически значимых различий по частоте развития данного исхода. В то же время для оптимальной оценки соотношения пользы и риска вмешательства объем выборки в исследовании должен рассчитываться на основе анализа различий между частотой развития тромботических осложнений и частотой развития тяжелых кровотечений. Например, выборка в исследовании ARISTOTLE была рассчитана для обеспечения 90% статистической мощности исследования для оценки тромбоэмболических осложнений, а не кровотечений. Выполнение исследования с достаточной статистической мощностью для оценки частоты развития как тромбоэмболических осложнений, так и кровотечений может быть неприемлемо дорогостоящим.
В качестве компромисса в 2003 г. была предложена оценка не только риска развития тяжелых кровотечений, но и оценка риска КЗК, который в качестве СК должен был отражать частоту развития истинного исхода, т.е. тяжелого кровотечения [35]. КЗК включает как тяжелое кровотечение, так и клинически значимое небольшое кровотечение, определяемое как любое кровотечение, не отвечающее критериям тяжелого кровотечения, но связанное с необходимостью медицинского вмешательства [36].
Частота развития КЗК в ходе выполнения современных исследований по оценке эффективности применения антикоагулянтов в период выполнения ортопедических операций достигала не менее 3% [37–39], а исследований по оценке эффектов антикоагулянтов для лечения и профилактики развития ВТЭО или профилактики развития инсульта и ЭСБКК у пациентов с ФП – 8–12% [40, 41]. В то же время частота развития тяжелых кровотечений в таких исследованиях составляла лишь 1,5 и 2,5% соответственно [36, 42–46]. Считается, что использование СК для учета риска развития кровотечений может быть единственной возможностью оценить риск развития таких осложнений при проведении исследований фазы II, выполняемых для определения оптимальной дозы препарата по показателям как эффективности, так и безопасности. Если бы в исследованиях II фазы оценивали частоту развития тяжелых кровотечений, то вследствие недостаточно большой выборки нельзя было бы даже ориентировочно установить оптимальные дозы исследуемых антикоагулянтов.
Как уже указывалось ранее, для оценки результатов, полученных с помощью СК, необходимо предоставить данные о высокой и статистически значимой связи между частотой СК с частотой развития наиболее важных клинических исходов. Только в таком случае данные, полученные с использованием СК, позволят прогнозировать клиническую пользу терапии. Однако такая проверка никогда не выполнялась для кровотечений. В то же время было разработано несколько методов подтверждения обоснованности СК с помощью метааналитических подходов, основанных на оценке силы связи между влиянием терапии как на СК, так и на частоту развития истинных клинических исходов [47–50].
Был выполнен метаанализ РКИ III фазы для оценки эффективности применения антикоагулянтов по трем показаниям: профилактика ВТЭО в период выполнения ортопедических операций с большим объемом вмешательства, лечение пациентов в острой фазе ВТЭО и профилактика инсульта или ЭСБКК у пациентов с ФП [51]. Основная цель метаанализа состояла в оценке обоснованного использования КЗК в качестве СК, который позволяет прогнозировать развитие тяжелых кровотечений. В анализ были включены 32 РКИ, в которых для оценки риска развития кровотечений использовали частоту развития КЗК и тяжелых кровотечений. Из 32 РКИ 26 были двойными слепыми (n=125 828) и 6 – открытыми, но оценка клинических исходов выполнялась с использованием слепого метода (n=20 190).
Частота развития тяжелых кровотечений и КЗК в 13 исследованиях по оценке эффектов антикоагулянтов с целью профилактики ВТЭО в послеоперационном периоде составляла 1,12 и 3,56% соответственно, в 12 РКИ по оценке эффектов применения антикоагулянтов в острой фазе ВТЭО составляла 1,87 и 9,07% соответственно, а в 7 РКИ для оценки эффектов при ФП – 4,82 и 15,3% соответственно. На основании выполненного анализа авторы сделали вывод о том, что несмотря на отчетливые связи между частотой развития КЗК и тяжелых кровотечений, которые отмечались в ходе выполнения РКИ по оценке эффектов применения антикоагулянтов в период выполнения ортопедических операций с большим объемом вмешательства, а также у пациентов с ФП и в двойных слепых РКИ по оценке эффектов антикоагулянтов в острой фазе лечения ВТЭО, широкий диапазон ДИ для показателей такой связи позволяет предположить, что частота развития КЗК не может считаться надежным и обоснованным критерием оценки риска развития кровотечений в таких исследованиях [51].
Конфликт интересов. Статья подготовлена при поддержке компании «Пфайзер», но это не повлияло на результаты систематического обзора и мнение автора.
Conflict of interests. The article was prepared with the support of Pfizer, but this did not affect the results of the systematic review and the author's opinion.
Информация об авторе
Information about the author
Гиляревский Сергей Руджерович – вед. науч. сотр. ОСП «Российский геронтологический научно-клинический центр», ФГАОУ ВО «РНИМУ им. Н.И. Пирогова».
E-mail: sgilarevsky@rambler.ru; ORCID: 0000-0002-8505-1848;
SPIN-код: 1683-2709; RESEARCH ID: AAN-4179-2021
Sergey R. Gilyarevsky – Dr. Sci. (Med.), Professor, Russian Gerontological Clinical and Research Center of Pirogov Russian National Research Medical University. E-mail: sgilarevsky@rambler.ru; ORCID: 0000-0002-8505-1848;
SPIN code: 1683-2709; RESEARCH ID: AAN-4179-2021
Поступила в редакцию: 29.02.2024
Поступила после рецензирования: 06.03.2024
Принята к публикации: 07.03.2024
Received: 29.02.2024
Revised: 06.03.2024
Accepted: 07.03.2024
Criteria for evaluation of the anticoagulant therapy efficacy: the role of «surrogate criteria»
Sergey R. GilyarevskyPirogov Russian National Research Medical University, Moscow, Russia
sgilarevsky@rambler.ru
Abstract
The article is devoted to the problem of using indirect indicators, or surrogate criteria, both in randomized clinical and observational studies. The reasons for the increasing frequency of using surrogate criteria in assessing the results of clinical trials are considered. The possible negative consequences of the widespread use of proxy measures and the need to educate clinicians to obtain evidence-based information using surrogate criteria rather than true clinical outcomes are discussed. Data from analyzes aimed at identifying the most important problems in the use of surrogate criteria in assessing the effectiveness of certain interventions are presented. The problem of using surrogate criteria in assessing the effectiveness and safety of the use of anticoagulants in patients with atrial fibrillation or venous thromboembolic complications is separately considered. The necessary conditions are provided to ensure the possibility of using surrogate criteria in studies assessing the effectiveness of interventions. Examples of the use of both justified and insufficiently justified use of surrogate criteria for assessing the effectiveness of anticoagulants in various clinical situations are considered. The results of a randomized clinical trial evaluating the effectiveness of an anticoagulant based on identifying surrogate criteria for atrial fibrillation using devices implanted in the heart are discussed. The problem of using surrogate criteria when assessing the risk of bleeding in studies assessing the effects of anticoagulants is discussed separately. The opinions of experts are presented, emphasizing the need for careful use of surrogate criteria when assessing the incidence of both venous thromboembolic complications and bleeding, since in such cases the results of comparing the benefits and risks of the intervention can be significantly distorted.
Keywords: surrogate criteria, atrial fibrillation, venous thromboembolic events, apixaban, rivaroxaban, warfarin.
For citation: Gilyarevsky S.R. Criteria for evaluation of the anticoagulant therapy efficacy: the role of «surrogate criteria». Clinical analysis in general medicine. 2024; 5 (2): 6–14. (In Russ.). DOI: 10.47407/kr2023.5.2.00382
Что такое суррогатные критерии и для чего их используют в клинических исследованиях?
В соответствии с мнением членов рабочей группы по использованию биомаркеров Администрации США по контролю за качеством пищевых продуктов и лекар-ственных препаратов и Национального института здоровья использование косвенных (или так называемых суррогатных) показателей допустимо в ходе выполнения рандомизированных контролируемых исследований (РКИ) как замена критериев оценки, отражающих частоту развития значимых для пациента клинических исходов (например, таких как смерть или смерть от определенной причины, а также госпитализации, обусловленные определенными причинами) [1]. Однако для этого необходимо, чтобы такие критерии могли прогнозировать положительные или отрицательные последствия вмешательства. Выбор суррогатных критериев (СК) обычно основывается на результатах патофизиологических или эпидемиологических исследований, а также исследований по оценке терапевтических вмешательств или других источниках доказательной информации [2].СК могут использоваться в качестве как дополнительных [3], так и основных показателей [4]. В последнем случае СК применяют для достижения следующих целей:
1) для облегчения получения результатов исследования, так как такие показатели могут отмечаться чаще и легче зарегистрировать их большее число;
2) для подтверждения эффектов препарата в ранних небольших исследованиях по оценке эффективности его применения;
3) чтобы ускорить получение одобрения использования вмешательства или лекарственного препарата в тех случаях, когда есть потребность в их применении (например, при угрожающих жизни или необратимых тяжелых заболеваниях, особенно в отсутствие доказанного стандартного лечения) [2, 5]. Во время пандемии COVID-19 нередко одобрение к применению препаратов было основано на исследованиях, в которых оценивали только СК [6].
Использование СК может становиться единственным возможным критерием для оценки эффектов вмешательства в тех случаях, когда в целом невозможно добиться достаточной статистической мощности исследования для оценки частоты развития неблагоприятных исходов из-за небольшой выборки. Одним из примеров может быть исследование по сравнительной оценке эффективности приема варфарина и апиксабана у пациентов с тромбозом левого желудочка, обусловленного инфарктом миокарда [7]. В исследование были включены всего 35 пациентов: 18 – в группу апиксабана и 17 – в группу варфарина. Полученные результаты свидетельствовали о сходной частоте растворения тромба в обеих группах (т.е. о сходной частоте СК), которая при приеме апиксабана и варфарина достигала 94 и 93% соответственно. В ходе выполнения исследования в группе варфарина у 2 пациентов развилось тяжелое кровотечение и у 1 пациента в отсутствие международного нормализованного отношения в терапевтическом диапазоне развился эмболический инсульт. Несмотря на то, что такие данные о частоте клинических исходов представляются правдоподобными, так как в целом прием апиксабана по сравнению с варфарином в ходе выполнения крупных РКИ (ARISTOTLE, AMPLIFY) сопровождался меньшей частотой тяжелых кровотечений, трактовать частоту развития клинических исходов в таком небольшом исследовании невозможно в связи с его недостаточной статистической мощностью.
В то же время, несмотря на привлекательность и определенные преимущества СК, есть определенные опасения по поводу их широкого использования. Во-первых, сравнение результатов оценки вмешательств с помощью СК и клинических исходов свидетельствует о том, что косвенные показатели примерно на 46% переоценивают эффективность вмешательства [8]. Во-вторых, подтверждение эффективности вмешательств с помощью некоторых СК регуляторные органы используют для ускоренного одобрения вмешательства, что может приводить к внедрению в клиническую практику препарата, отрицательные эффекты которого могут преобладать над положительными, так как негативные эффекты не были в достаточной степени учтены в исследованиях с оценкой только СК [9–11].
В ходе выполнения систематического обзора, опубликованного в 2023 г., оценивали использующиеся определения СК, а также качество представления результатов исследований с оценкой СК [2]. Авторы обзора выявили существенные различия между исследованиями по используемым определениям СК, а также по указаниям на то, какие клинические исходы заменяют суррогатные показатели и каково их прогностическое значение. В табл. 1 представлены примеры наиболее часто приводимых в исследованиях определений СК. Полученные результаты во многом совпадали с данными анализа, которые были опубликованы почти 15 лет назад [12]. Такие данные также свидетельствовали о большом числе определений СК, которое достигало восьми, и они также различались по измеряемым показателям и наличию обоснований их использования в качестве СК. Авторы анализа отметили ограничения использования СК, в том числе необходимость соблюдения осторожности при экстраполяции данных об обоснованности СК в одной клинической ситуации на другую, так как СК всегда определяются клиническим контекстом [12].

Предлагаемые подходы к повышению обоснованности использования СК
На основании анализа данных об использовании СК в современных исследованиях были сформулированы два основных подхода к повышению обоснованности их использования в современных клинических исследованиях:1) планирование и проведение исследований с одновременной оценкой как значимых клинических исходов, так и СК (в том числе и в подгруппах пациентов с определенными характеристиками);
2) обеспечение свободного доступа к таким данным [2].
Несмотря на трудности сбора дополнительной информации, считается важным получение доступа не только к результатам исследований в целом, но и к индивидуальным данным участников исследований с оценкой как СК, так и клинических исходов для более точной проверки степени соответствия таких показателей. Несмотря на то, что методы проверки соответствия СК и клинических исходов основываются в первую очередь на данных, полученных в РКИ [13], представляют интерес и результаты обсервационных исследований клинической практики и других нерандомизированных исследований.
Считается, что при проведении исследований с использованием только СК необходимо информировать участников о том, что цель исследования состоит именно в оценке частоты развития СК, а не значимых для пациента клинических исходов. В связи с этим сами исследователи должны иметь информацию о возможных ограничениях использования СК, которые обусловлены невозможностью на их основании предсказать клиническую пользу вмешательства или предоставить данные о безопасности вмешательства [2].
Использование суррогатных показателей в исследованиях прямых пероральных антикоагулянтов у пациентов с фибрилляцией предсердий
Обсуждая проблему использования СК в РКИ, нельзя не остановиться на использовании таких критериев в крупных РКИ по оценке эффективности и безопасности приема прямых пероральных антикоагулянтов (ПОАК) по сравнению с антагонистами витамина K (АВK) у пациентов с фибрилляцией предсердий (ФП), в частности в таких ключевых РКИ, как ARISTOTLE [14] и ROCKET [15] по оценке эффектов апиксабана и ривароксабана соответственно.В исследовании ARISTOTLE [14] для оценки безопасности применения апиксабана по сравнению с приемом варфарина использовали показатель частоты развития тяжелых кровотечений (в соответствии с определением Международного общества специалистов по тромбозам и гемостазу такое кровотечение диагностируют при развитии клинически явного кровотечения, которое сопровождается снижением концентрации гемоглобина не менее чем на 2 г/дл или переливанием не менее 2 доз эритроцитной массы, а также при развитии кровотечения в жизненно важные органы или приведшем к смерти [16]. Комбинированный показатель частоты развития тяжелых и клинически значимых нетяжелых кровотечений в исследовании ARISTOTLE использовали только в качестве дополнительного показателя безопасности. Статистически значимые преимущества применения апиксабана по сравнению с варфарином были отмечены как по основному показателю тяжелых кровотечений (отношение риска – ОР 0,69 при 95% доверительном интервале – ДИ 0,60–0,80; p<0,001), так и по дополнительному комбинированному показателю безопасности (ОР 0,68; 95% ДИ 0,61–0,75; p<0,001). Так что данные о преимуществах приема апиксабана по показателям безопасности в соответствии с современными представлениями можно считать надежными даже по строгим формальным критериям, так как они были подтверждены с помощью значимого для пациента показателя частоты тяжелого кровотечения. Частота исходов, включенных в дополнительный комбинированный показатель безопасности, была почти в 2 раза выше, чем изолированная частота развития тяжелых кровотечений (в группе апиксабана 2,13 и 4,07% в год, в группе варфарина – 3,09 и 6,01% в год соответственно), что, впрочем, не повлияло на выявление статистически значимых преимуществ приема апиксабана.
В то же время в РКИ ROCKET в качестве главного показателя безопасности использовали комбинированный показатель частоты развития тяжелых и нетяжелых клинически значимых кровотечений (КЗК), т.е. показателя, в который был включен не только истинный клинический исход, но и СК. Полученные результаты свидетельствовали о том, что безопасность приема ривароксабана не отличалась от таковой при приеме варфарина (ОР 1,03; 95% ДИ 0,96–1,11; p=0,44). Более того, обращает на себя внимание, что верхняя граница ДИ в большей степени отклоняется вправо, чем нижняя граница – влево, т.е. была более отчетливая тенденция к увеличению риска развития кровотечений в группе ривароксабана. Таким образом, в исследовании ROCKET полученные данные о частоте развития кровотечений менее надежны, так как их оценивали с помощью основного комбинированного показателя безопасности, включающего не только частоту тяжелых кровотечений, но и СК частоты развития нетяжелых КЗК. Нельзя не отметить, что результаты анализа частоты развития тяжелых кровотечений были сходными с данными, полученными при анализе основного комбинированного показателя (ОР 1,04; 95% ДИ 0,90–1,20; p=0,58). И в данном случае отклонение 95% ДИ вправо от 1,0 было более выраженным, чем нижней границы влево, что может указывать на тенденцию к увеличению риска развития кровотечений при приеме ривароксабана по сравнению с применением варфарина.
Следует отметить, что при выполнении обсервационных исследований, основанных на анализе баз данных страховых заявок или других административных баз данных, а также данных регистров, обычно используют не СК, а клинические значимые исходы (смерть, инфаркт миокарда или инсульт), которые можно надежно оценить с использованием таких источников информации о пациентах.
Очевидно, что сравнение частоты развития кровотечений у пациентов с тяжелой хронической болезнью почек представляет наиболее трудную задачу, так как такие пациенты не включались в крупные РКИ. Недавно была предпринята попытка оценить риск развития кровотечений у таких пациентов при приеме апиксабана, ривароксабана и варфарина с целью профилактики тромбоэмболических осложнений у пациентов с ФП [17]. Исследование было основано на анализе информации, полученной в 2 базах данных страховых заявок и 2 других административных базах данных США. В анализ были включены данные о пациентах с ФП и хронической болезнью почек стадии 4/5, которые в период с 2013 по 2022 г. начинали прием апиксабана, ривароксабана или варфарина. Группы сравнения формировали с помощью метода propensity score-matched с целью максимального соответствия групп по основным демографическим и клиническим характеристикам (учитывали 80 характеристик пациентов). Оценку безопасности терапии проводили с помощью показателя частоты развития тяжелых кровотечений. Эффективность терапии оценивали с помощью показателя частоты развития инсульта. Когорта для сравнения эффектов апиксабана и варфарина включала 12 488 пациентов, а когорта для сравнения эффектов ривароксабана и апиксабана – 5720 пациентов.
Полученные результаты свидетельствовали о том, что прием варфарина по сравнению с приемом апиксабана сопровождался более высокой частотой развития не только тяжелых кровотечений (ОР 1,85; 95% ДИ 1,59–2,15), но и кровотечений из желудочно-кишечного тракта (ОР 1,86; 95% ДИ 1,53–2,25) и внутричерепных кровоизлияний (ОР 2,15; 95% ДИ 1,42–3,25). Прием ривароксабана по сравнению с приемом апиксабана также сопровождался более высоким риском развития тяжелых кровотечений (ОР 1,69; 95% ДИ 1,33–2,15).
Не было отмечено статистически значимых различий между группами по риску развития ишемического инсульта, но 95% ДИ для такого показателя были достаточно широкими, что могло быть обусловлено небольшим числом инсультов. Таким образом, полученные с помощью определенного клинического исхода частоты развития тяжелых кровотечений результаты свидетельствуют о более высокой безопасности приема апиксабана по сравнению с применением как варфарина, так и апиксабана у пациентов с более тяжелым нарушением функции почек, чем было нарушение функции почек у пациентов, включавшихся в крупные РКИ по оценке эффектов ПОАК по сравнению с эффектами варфарина у пациентов с ФП [17].
Использование СК ФП в исследованиях по оценке эффективности ПОАК
Обсуждая проблему использования СК в клинических исследованиях, нельзя не остановиться на использовании субклинической ФП в качестве СК клинически явной ФП (т.е. зарегистрированной с помощью стандартной электрокардиографии). Имплантированные в сердце устройства позволяют регистрировать эпизоды частого ритма предсердий, который предположительно может расцениваться как эпизоды ФП. Несмотря на то, что такой СК не всегда абсолютно точен, особенно при использовании двухкамерных устройств [18], тем не менее, по-видимому, использование такого СК клинически явной ФП в сочетании с оценкой дополнительных факторов риска помогает отобрать группу пациентов с субклинической ФП и имплантированными в сердце устройствами, у которых применение антикоагулянтов будет эффективно для профилактики развития инсульта.В ходе выполнения исследования ARTESIA (Apixaban for the Reduction of Thrombo-Embolism in Patients with Device-Detected Subclinical Atrial Fibrillation), результаты которого были опубликованы в 2024 г. [19], были получены данные о том, что у пациентов пожилого возраста (в среднем 76,8±7,6 года) с эпизодами субклинической ФП с продолжительностью эпизодов частого ритма предсердий от 6 мин до 24 ч и повышенным риском развития инсульта (средняя оценка по шкале CHA2DS2-VASc 3,9±1,1 балла) прием апиксабана по 5 мг 2 раза в сутки (или 2,5 мг 2 раза в сутки) был более эффективен по сравнению с приемом ацетилсалициловой кислоты (АСК) по 81 мг 1 раз в сутки для профилактики инсульта или эмболии сосудов большого круга кровообращения (ЭСБКК), несмотря на низкую в целом частоту развития таких исходов (ОР 0,63; 95% ДИ 0,45–0,88; p=0,007). Следует отметить, что, несмотря на использование СК субклинической ФП в качестве критерия включения в исследование, показатели эффективности и безопасности включали определенные значимые для пациента клинические исходы частоты развития инсульта/ЭСБКК и тяжелых кровотечений соответственно. Несмотря на то, что по сравнению с приемом АСК прием апиксабана сопровождался увеличением риска развития тяжелых кровотечений, увеличение риска было небольшим (на 0,42% на пациенто-лет) и достигало лишь пограничного уровня статистической значимости (ОР 1,36; 95% ДИ 1,01–1,82; p=0,04). Такие данные в целом совпадают с небольшим увеличением частоты развития кровотечений в другом исследовании по сравнительной оценке приема апиксабана и АСК у пациентов с ФП (0,2% в год в РКИ AVERROES [20]).
Использование СК при оценке эффективности профилактики венозных тромбоэмболических осложнений
Венозные тромбоэмболические осложнения (ВТЭО) занимают третье место среди наиболее частых тяжелых осложнений сердечно-сосудистых заболеваний после инфаркта миокарда и инсульта, а частота развития ВТЭО в западных странах достигает 1–2 случая на 1 тыс. человеко-лет [21, 22].ВТЭО характеризуются высокой смертностью, заболеваемостью в отдаленные сроки после ее развития, высокой частотой госпитализаций и рецидивов, а также существенными расходами здравоохранения. Факторы риска развития ВТЭО были установлены во многих популяциях [23]. Было проведено большое число исследований по оценке различных методов профилактики ВТЭО в разных клинических ситуациях.
Очевидно, что выполнение РКИ остается основным подходом к оценке эффективности вмешательств, а их результаты занимают наивысшее положение в иерархии доказательств [24]. Однако принципиальным для получения результатов РКИ, которые можно использовать для определения показаний к использованию лекарственного препарата, является выбор критериев оценки, достаточно полно отражающих значимые для пациента клинические исходы. Определенные клинические исходы почти всегда используют в так называемых прагматических исследованиях, так как в таких исследованиях именно такие клинические исходы можно оценить с помощью соответствующих регистров и/или административных баз данных. В то же время в исследованиях, основанных на регистрах, а в последнее время и в РКИ, выполненных с использованием более совершенных протоколов, нередко используют СК, что позволяет (особенно при использовании анализа Win ratio) формально получать доказательства эффективности вмешательства даже в отсутствие статистически значимого влияния на риск развития клинических исходов [25]. Считается, что СК могут выступать в качестве альтернативы оценки клинических исходов в тех случаях, когда частота кинических исходов невысока и ее трудно измерить. Очевидно, что в таких случаях можно использовать комбинированные показатели, включающие как клинические исходы, так и СК [26]. Такой подход позволяет сократить размер выборки в РКИ, который необходим для достижения адекватной статистической мощности исследования.
Стандартные клинические исходы, которые оценивают в исследованиях по оценке эффективности вмешательств, включают частоту развития тромбоза глубоких вен (ТГВ) нижних конечностей и эмболии легочной артерии (ЭЛА) [27]. К другим оцениваемым в таких исследованиях показателям относят тромбоз, связанный с катетером, а также частоту развития ТГВ верхних конечностей и тромбоза вен внутренних органов [28–32].
К наиболее значимым для пациентов исходам в исследованиях по оценке эффективности применения антикоагулянтов при ВТЭО относят симптомные ВТЭО, развитие которых должно быть подтверждено с помощью методов визуализации. В качестве СК в таких случаях используют частоту развития бессимптомных ВТЭО, которые обычно регистрируются при обследовании в период амбулаторного наблюдения. Для увеличения частоты развития ВТЭО и уменьшения выборки исследования в ходе выполнения РКИ могут комбинировать оценку симптомных и бессимптомных ВТЭО. Однако обоснованность использования частоты развития бессимптомных ВТЭО и их клиническая значимость подвергаются сомнениям, особенно при сопоставлении пользы профилактики ВТЭО и риска развития кровотечений. В отличие от бессимптомных ВТЭО кровотечение обычно представляет собой клинически значимое осложнение даже в тех случаях, когда его выявляют с помощью периодически выполняемых лабораторных исследований (например, при периодической оценке концентрации гемоглобина в крови) [33].
С целью описания современных тенденций в использовании СК в РКИ по оценке эффективности вмешательств для профилактики ВТЭО был выполнен систематический обзор [27]. Поиск статей с отчетом о результатах РКИ по оценке эффектов вмешательств для профилактики развития ВТЭО выполняли в базах данных Ovid MEDLINE, Embase и Cochrane (CENTRAL), которые были опубликованы на английском языке в период с января 2000 г. по октябрь 2020 г. В анализ включали только исследования, включавшие более 150 пациентов.
В анализ было включено 209 РКИ. Медиана числа включенных в исследование пациентов достигала 662 человек (МКД от 318 до 1761). Эффекты медикаментозной профилактики ВТЭО изучали в 79,4% РКИ, эффекты механических методов профилактики – 13,9% и комбинированных методов – 6,7%. В группах контроля медикаментозная профилактика, механические методы профилактики, плацебо, отсутствие профилактики или комбинированные методы применяли в 59,3, 8,1, 20,6, 5,3 и 6,7% РКИ соответственно.
В ходе выполнения 209 РКИ оценивали частоту развития любых ВТЭО, повторных ВТЭО, только частоту ТГВ или только ЭЛА в 70,8, 6,7, 22 и 0,5% РКИ соответственно. В 4,8% исследованиях анализировали только бессимптомные ВТЭО, в 18,7% РКИ – только симптомные ВТЭО и в 76,6% – комбинированный показатель частоты развития как симптомных, так и бессимптомных ВТЭО (табл. 2).

Только в 34 (20%) из 170 отчетов об РКИ с использованием суррогатных или комбинированных показателей для оценки частоты развития ВТЭО такой подход был указан авторами в качестве возможного ограничения исследования. В 152 (89%) из 170 отчетов обсуждалось соотношение между риском развития кровотечения и тромбоза. Не было отмечено статистически значимой связи между использованием суррогатного показателя и числом цитирований статей (отношение шансов – ОШ 0,99; 95% ДИ 0,99–1,00; p=0,248) или размеров выборки (ОШ 0,99; 95% ДИ 0,99–1,00; p=0,320). Однако имелась статистически значимая связь между импакт-фактором журнала, в котором опубликована статья, и использованием суррогатного результата (ОШ 0,98; 95% ДИ 0,97–0,99; p<0,05).
Следует также отметить, что во многих исследованиях с использованием ультразвукового исследования для диагностики ТГВ не разделяли случаи тромбоза в проксимальных и дистальных глубоких венах. В то же время имеются данные о том, что тромбоз в проксимальных венах, а не дистальных, по данным ультразвукового исследования может считаться более надежным СК, так как при такой локализации ТГВ имеется более высокая вероятность прогрессирования до клинически значимых исходов [34].
Таким образом, авторы систематического обзора впервые количественно определили частоту использования СК при оценке результатов профилактики развития ВТЭО. Почему такие данные могут иметь важное значение как для врачей, так и для исследователей? Дело в том, что при сопоставлении риска развития кровотечений и риска развития тромбозов использование СК может ошибочно повышать предполагаемый риск клинически значимых тромботических осложнений.
В таких случаях сопоставление исходов становится особенно трудным, так как кровотечения редко используют в качестве СК. Тем не менее, по-видимому, в будущем СК или комбинированные показатели, включающие СК и клинические исходы, будут все чаще использовать при проведении РКИ, так как такой подход позволяет уменьшить объем выборки, который необходим для обеспечения статистической мощности исследования. Следует отметить, что в отчете о результатах исследования крайне важно указывать на ограничения исследования в связи с использованием СК, особенно в тех случаях, когда в выводах отмечаются результаты сопоставления риска тромботических осложнений и кровотечений.
В целом СК широко распространены в отчетах о результатах РКИ по оценке эффективности вмешательств для профилактики ВТЭО, но такое ограничение исследований редко признается авторами. Несмотря на это в отсутствие таких указаний в статьях часто обсуждается соотношение риска развития кровотечений и тромбоза. Считается, что при интерпретации результатов исследования и их использовании в клинической практике врачам следует осознавать такие ограничения, а исследователям необходимо указывать на использование СК при анализе результатов РКИ, особенно если они используются при подготовке клинических рекомендаций.
Оценка риска развития кровотечений с помощью СК
В ходе выполнения большого числа РКИ эффекты приема ПОАК для профилактики ВТЭО сравнивали с эффектами стандартной тактики лечения с помощью низкомолекулярного гепарина и АВK или с отсутствием профилактики.К преимуществам применения ПОАК перед традиционными профилактическими и терапевтическими тактиками относят их пероральный прием и отсутствие необходимости лабораторного контроля. Основная цель большинства исследований по оценке эффектов ПОАК состояла в подтверждении гипотезы о не менее высокой эффективности их использования по сравнению со стандартной тактикой, включающей АВK.
В связи с очень низкой частотой тяжелых кровотечений в группах сравнения такие исследования, как правило, не имели достаточной статистической мощности для выявления статистически значимых различий по частоте развития данного исхода. В то же время для оптимальной оценки соотношения пользы и риска вмешательства объем выборки в исследовании должен рассчитываться на основе анализа различий между частотой развития тромботических осложнений и частотой развития тяжелых кровотечений. Например, выборка в исследовании ARISTOTLE была рассчитана для обеспечения 90% статистической мощности исследования для оценки тромбоэмболических осложнений, а не кровотечений. Выполнение исследования с достаточной статистической мощностью для оценки частоты развития как тромбоэмболических осложнений, так и кровотечений может быть неприемлемо дорогостоящим.
В качестве компромисса в 2003 г. была предложена оценка не только риска развития тяжелых кровотечений, но и оценка риска КЗК, который в качестве СК должен был отражать частоту развития истинного исхода, т.е. тяжелого кровотечения [35]. КЗК включает как тяжелое кровотечение, так и клинически значимое небольшое кровотечение, определяемое как любое кровотечение, не отвечающее критериям тяжелого кровотечения, но связанное с необходимостью медицинского вмешательства [36].
Частота развития КЗК в ходе выполнения современных исследований по оценке эффективности применения антикоагулянтов в период выполнения ортопедических операций достигала не менее 3% [37–39], а исследований по оценке эффектов антикоагулянтов для лечения и профилактики развития ВТЭО или профилактики развития инсульта и ЭСБКК у пациентов с ФП – 8–12% [40, 41]. В то же время частота развития тяжелых кровотечений в таких исследованиях составляла лишь 1,5 и 2,5% соответственно [36, 42–46]. Считается, что использование СК для учета риска развития кровотечений может быть единственной возможностью оценить риск развития таких осложнений при проведении исследований фазы II, выполняемых для определения оптимальной дозы препарата по показателям как эффективности, так и безопасности. Если бы в исследованиях II фазы оценивали частоту развития тяжелых кровотечений, то вследствие недостаточно большой выборки нельзя было бы даже ориентировочно установить оптимальные дозы исследуемых антикоагулянтов.
Как уже указывалось ранее, для оценки результатов, полученных с помощью СК, необходимо предоставить данные о высокой и статистически значимой связи между частотой СК с частотой развития наиболее важных клинических исходов. Только в таком случае данные, полученные с использованием СК, позволят прогнозировать клиническую пользу терапии. Однако такая проверка никогда не выполнялась для кровотечений. В то же время было разработано несколько методов подтверждения обоснованности СК с помощью метааналитических подходов, основанных на оценке силы связи между влиянием терапии как на СК, так и на частоту развития истинных клинических исходов [47–50].
Был выполнен метаанализ РКИ III фазы для оценки эффективности применения антикоагулянтов по трем показаниям: профилактика ВТЭО в период выполнения ортопедических операций с большим объемом вмешательства, лечение пациентов в острой фазе ВТЭО и профилактика инсульта или ЭСБКК у пациентов с ФП [51]. Основная цель метаанализа состояла в оценке обоснованного использования КЗК в качестве СК, который позволяет прогнозировать развитие тяжелых кровотечений. В анализ были включены 32 РКИ, в которых для оценки риска развития кровотечений использовали частоту развития КЗК и тяжелых кровотечений. Из 32 РКИ 26 были двойными слепыми (n=125 828) и 6 – открытыми, но оценка клинических исходов выполнялась с использованием слепого метода (n=20 190).
Частота развития тяжелых кровотечений и КЗК в 13 исследованиях по оценке эффектов антикоагулянтов с целью профилактики ВТЭО в послеоперационном периоде составляла 1,12 и 3,56% соответственно, в 12 РКИ по оценке эффектов применения антикоагулянтов в острой фазе ВТЭО составляла 1,87 и 9,07% соответственно, а в 7 РКИ для оценки эффектов при ФП – 4,82 и 15,3% соответственно. На основании выполненного анализа авторы сделали вывод о том, что несмотря на отчетливые связи между частотой развития КЗК и тяжелых кровотечений, которые отмечались в ходе выполнения РКИ по оценке эффектов применения антикоагулянтов в период выполнения ортопедических операций с большим объемом вмешательства, а также у пациентов с ФП и в двойных слепых РКИ по оценке эффектов антикоагулянтов в острой фазе лечения ВТЭО, широкий диапазон ДИ для показателей такой связи позволяет предположить, что частота развития КЗК не может считаться надежным и обоснованным критерием оценки риска развития кровотечений в таких исследованиях [51].
Заключение
Таким образом, обеспечение обоснованного использования СК представляет собой одну из важных задач современной доказательной медицины. Такие показатели используются все чаще, так как позволяют уменьшить объем выборки РКИ и, соответственно, сократить период включения пациентов в исследование, а также уменьшить расходы на его выполнение. Однако в каждом случае использования таких критериев необходимо предоставлять данные о том, что СК позволяют более или менее точно прогнозировать развитие истинных клинически значимых для пациентов исходов. РКИ, в которых для оценки эффективности и безопасности терапии используют клинические исходы, а не СК или комбинированные показатели, включающие клинические исходы и СК, предоставляют более обоснованную доказательную информацию.Конфликт интересов. Статья подготовлена при поддержке компании «Пфайзер», но это не повлияло на результаты систематического обзора и мнение автора.
Conflict of interests. The article was prepared with the support of Pfizer, but this did not affect the results of the systematic review and the author's opinion.
Информация об авторе
Information about the author
Гиляревский Сергей Руджерович – вед. науч. сотр. ОСП «Российский геронтологический научно-клинический центр», ФГАОУ ВО «РНИМУ им. Н.И. Пирогова».
E-mail: sgilarevsky@rambler.ru; ORCID: 0000-0002-8505-1848;
SPIN-код: 1683-2709; RESEARCH ID: AAN-4179-2021
Sergey R. Gilyarevsky – Dr. Sci. (Med.), Professor, Russian Gerontological Clinical and Research Center of Pirogov Russian National Research Medical University. E-mail: sgilarevsky@rambler.ru; ORCID: 0000-0002-8505-1848;
SPIN code: 1683-2709; RESEARCH ID: AAN-4179-2021
Поступила в редакцию: 29.02.2024
Поступила после рецензирования: 06.03.2024
Принята к публикации: 07.03.2024
Received: 29.02.2024
Revised: 06.03.2024
Accepted: 07.03.2024
Список исп. литературыСкрыть список1. FDA-NIH Biomarker Working Group. BEST (biomarkers, endpoints, and other tools) resource; 2016. Available at: https://www.ncbi.nlm. nih.gov/books/NBK326791. Accessed: 06.08.2023.
2 Manyara AM, Davies P, Stewart D et al. Definitions, acceptability, limitations, and guidance in the use and reporting of surrogate end points in trials: a scoping review. J Clin Epidemiol 2023;160:83-99. DOI: 10.1016/j.jclinepi.2023.06.013
3. Olivotto I, Oreziak A, Barriales-Villa R et al; EXPLORER-HCM study investigators. Mavacamten for treatment of symptomatic obstructive hypertrophic cardiomyopathy (EXPLORER-HCM): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 2020;396:759-69. DOI: 10.1016/S0140-6736(20)31792-X
4. Mann DL, Greene SJ, Givertz MM et al; LIFE Investigators. Sacubitril/Valsartan in Advanced Heart Failure With Reduced Ejection Fraction: Rationale and Design of the LIFE Trial. JACC Heart Fail 2020;8(10):789-99. DOI: 10.1016/j.jchf.2020.05.005
5. Spertus JA, Fine JT, Elliott P et al. Mavacamten for treatment of symptomatic obstructive hypertrophic cardiomyopathy (EXPLORER-HCM): health status analysis of a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 2021;397(10293):2467-75. DOI: 10.1016/S0140-6736(21)00763-7
6. Gautret P, Lagier JC, Parola P et al. Hydroxychloroquine and azithromycin as a treatment of COVID-19: results of an open-label non-randomized clinical trial. Int J Antimicrob Agents 2020;56(1):105949. DOI: 10.1016/j.ijantimicag.2020.105949
7. Alcalai R, Butnaru A, Moravsky G et al. Apixaban vs. warfarin in patients with left ventricular thrombus: a prospective multicentre randomized clinical trial‡. Eur Heart J Cardiovasc Pharmacother 2022;8(7):660-7. DOI: 10.1093/ehjcvp/pvab057
8. Ciani O, Buyse M, Garside R et al. Comparison of treatment effect sizes associated with surrogate and final patient relevant outcomes in randomised controlled trials: meta-epidemiological study. BMJ 2013;346:f457. DOI: 10.1136/bmj.f457
9. Cohen D. Rosiglitazone: what went wrong? BMJ 2010;341:c4848. DOI: 10.1136/bmj.c4848
10. Fleming TR, DeMets DL. Surrogate end points in clinical trials: are we being misled? Ann Intern Med 1996;125(7):605-13. DOI: 10.7326/0003-4819-125-7-199610010-00011
11. Kumar S, Rajkumar SV. Surrogate endpoints in randomised controlled trials: a reality check. Lancet 2019;394(10195):281-3. DOI: 10.1016/S0140-6736(19)31711-8
12. Shi Q, Sargent DJ. Meta-analysis for the evaluation of surrogate endpoints in cancer clinical trials. Int J Clin Oncol 2009;14(2):102-11. DOI: 10.1007/s10147-009-0885-4
13. Ciani O, Buyse M, Drummond M et al. Time to Review the Role of Surrogate End Points in Health Policy: State of the Art and the Way Forward. Value Health 2017;20(3):487-95. DOI: 10.1016/j.jval.2016.10.011
14. Granger CB, Alexander JH, McMurray JJ et al; ARISTOTLE Committees and Investigators. Apixaban versus warfarin in patients with atrial fibrillation. N Engl J Med 2011;365(11):981-92. DOI: 10.1056/NEJMoa1107039
15. Patel MR, Mahaffey KW, Garg J et al; ROCKET AF Investigators. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med 2011;365(10):883-91. DOI: 10.1056/NEJMoa1009638
16. Schulman S, Kearon C; Subcommittee on Control of Anticoagulation of the Scientific and Standardization Committee of the International Society on Thrombosis and Haemostasis. Definition of major bleeding in clinical investigations of antihemostatic medicinal products in non-surgical patients. J Thromb Haemost 2005;3(4):692-4. DOI: 10.1111/j.1538-7836.2005.01204.x
17. Fu EL, Desai RJ, Paik JM et al. Comparative Safety and Effectiveness of Warfarin or Rivaroxaban Versus Apixaban in Patients With Advanced CKD and Atrial Fibrillation: Nationwide US Cohort Study. Am J Kidney Dis 2024;83(3):293-305.e1. DOI: 10.1053/j.ajkd.2023.08.017
18. Noseworthy PA, Kaufman ES, Chen LY et al. Subclinical and device-detected atrial fibrillation: pondering the knowledge gap: a scientific statement of the American Medical Association. Circulation 2019;140: e944-963. DOI: 10.1161/CIR.0000000000000740
19. Healey JS, Lopes RD, Granger CB et al; ARTESIA Investigators. Apixaban for Stroke Prevention in Subclinical Atrial Fibrillation. N Engl J Med 2024;390(2):107-17. DOI: 10.1056/NEJMoa2310234
20. Connolly SJ, Eikelboom J, Joyner C et al; AVERROES Steering Committee and Investigators. Apixaban in patients with atrial fibrillation. N Engl J Med 2011;364(9):806-17. DOI: 10.1056/NEJMoa1007432
21. Heit JA. The epidemiology of venous thromboembolism in the community. Arterioscler Thromb Vasc Biol 2008;28(3):370-2. DOI: 10.1161/ATVBAHA.108.162545
22. Wendelboe AM, Raskob GE. Global Burden of Thrombosis: Epidemiologic Aspects. Circ Res 2016;118(9):1340-7. DOI: 10.1161/CIRCRESAHA.115.306841
23. Cushman M. Epidemiology and risk factors for venous thrombosis. Semin Hematol 2007;44(2):62-9. DOI: 10.1053/j.seminhematol.2007.02.004
24. Burns PB, Rohrich RJ, Chung KC. The levels of evidence and their role in evidence-based medicine. Plast Reconstr Surg 2011;128(1):305-10. DOI: 10.1097/PRS.0b013e318219c171
25. James S, Erlinge D, Storey RF et al. Dapagliflozin in myocardial infarction without diabetes or heart failure. NEJM Evid 2024;3(2):
EVIDoa2300286. DOI: 10.1056/EVIDoa2300286
26. Heerspink HJL, Stefánsson BV, Correa-Rotter R et al; DAPA-CKD Trial Committees and Investigators. Dapagliflozin in Patients with Chronic Kidney Disease. N Engl J Med 2020;383(15):1436-46. DOI: 10.1056/NEJMoa2024816
27. Eshaghpour A, Li A, Park J et al. Assessing Use of Surrogate Outcome Measures in Randomized Controlled Trials Investigating Venous Thromboembolism Prophylaxis [abstract]. Res Pract Thromb Haemost 2021;5(Suppl 2). DOI: 10.21203/rs.3.rs-1582705/v1
28. Agnelli G, Buller HR, Cohen A et al. Apixaban for extended treatment of venous thromboembolism. N Engl J Med 2013;368:699-708. DOI: 10.1056/NEJMoa1207541
29. Carrier M, Abou-Nassar K, Mallick R et al. Apixaban to prevent venous thromboembolism in patients with cancer. New England Journal of Medicine 2019;380(8):711-9. DOI: 10.1056/NEJMoa1814468.
30. Khorana AA, Soff GA, Kakkar AK et al. Rivaroxaban for thromboprophylaxis in high-risk ambulatory patients with cancer. New England Journal of Medicine 2019;380(8):720-8. DOI: 10.1056/NEJMoa1814630
31. Agnelli G, Becattini C, Meyer G et al. Apixaban for the treatment of venous thromboembolism associated with cancer. New England Journal of Medicine 2020;382(17):1599-607. DOI: 10.1056/NEJMoa1915103
32. Kumar S, Sarr MG, Kamath PS. Mesenteric venous thrombosis. New England Journal of Medicine 2001;345(23):1683-8. DOI: 10.1056/NEJMra010076
33. Kassaï B, Shah NR, Leizorovicza A et al. The true treatment benefit is unpredictable in clinical trials using surrogate outcome measured with diagnostic tests. J Clin Epidemiol 2005;58(10):1042-51. DOI: 10.1016/j.jclinepi.2005.02.024
34. Robert-Ebadi H, Righini M. Should we diagnose and treat distal deep vein thrombosis? Hematology Am Soc Hematol Educ Program 2017;2017(1):231-6. DOI: 10.1182/asheducation-2017.1.231
35. Büller HR, Davidson BL, Decousus H et al; Matisse Investigators. Subcutaneous fondaparinux versus intravenous unfractionated heparin in the initial treatment of pulmonary embolism. N Engl J Med 2003;349(18):1695-702. DOI: 10.1056/NEJMoa035451. Erratum in: N Engl J Med 2004;350(4):423.
36. Kaatz S, Ahmad D, Spyropoulos AC, Schulman S; Subcommittee on Control of Anticoagulation. Definition of clinically relevant non-major bleeding in studies of anticoagulants in atrial fibrillation and venous thromboembolic disease in non-surgical patients: communication from the SSC of the ISTH. J Thromb Haemost 2015;13(11):2119-26. DOI: 10.1111/jth.13140
37. Loke YK, Kwok CS. Dabigatran and rivaroxaban for prevention of venous thromboembolism – systematic review and adjusted indirect comparison. J Clin Pharm Ther 2011;36:111-24. DOI: 10.1111/j.1365-2710.2010.01162.x
38. Raskob GE, Gallus AS, Pineo GF et al. Apixaban versus enoxaparin for thromboprophylaxis after hip or knee replacement: pooled analysis of major venous thromboembolism and bleeding in 8464 patients from the ADVANCE-2 and ADVANCE-3 trials. J Bone Joint Surg Br 2012;94:257-64. DOI: 10.1302/0301-620x.94b2.27850
39. Nieto JA, Espada NG, Merino RG, Gonzalez TC. Dabigatran, rivaroxaban and apixaban versus enoxaparin for thomboprophylaxis after total knee or hip arthroplasty: pool-analysis of phase III randomized clinical trials. Thromb Res 2012;130:183-91. DOI: 10.1016/j.thromres.2012.02.011
40. Burgess S, Crown N, Louzada ML et al. Clinical performance of bleeding risk scores for predicting major and clinically relevant non-major bleeding events in patients receiving warfarin. J Thromb Haemost 2013;11:1647-54. DOI: 10.1111/jth.12352
41. Camm AJ, Amarenco P, Haas S et al; XANTUS Investigators. XANTUS: a real-world, prospective, observational study of patients treated with rivaroxaban for stroke prevention in atrial fibrillation. Eur Heart J 2016;37:1145-53. DOI: 10.1093/eurheartj/ehv466
42. Wells PS, Forgie MA, Simms M et al. The outpatient bleeding risk index: validation of a tool for predicting bleeding rates in patients treated for deep venous thrombosis and pulmonary embolism. Arch Intern Med 2003;163:917-20. DOI: 10.1001/archinte.163.8.917
43. Lopes LC, Spencer FA, Neumann I et al. Bleeding risk in atrial fibrillation patients taking vitamin K antagonists: systematic review and meta-analysis. Clin Pharmacol Ther 2013;94:367-75. DOI: 10.1038/ clpt.2013.99
44. You JJ, Singer DE, Howard PA et al; American College of Chest Physicians. Antithrombotic therapy for atrial fibrillation: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest 2012;141(2 Suppl.):e531S-75S. DOI: 10.1378/chest.11-2304
45. Guyatt GH, Eikelboom JW, Gould MK et al; American College of Chest Physicians. Approach to outcome measurement in the prevention of thrombosis in surgical and medical patients: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest 2012;141(2 Suppl.):e185S-94S. DOI: 10.1378/chest.11-2289
46. Kearon C, Akl EA, Comerota AJ et al; American College of Chest Physicians. Antithrombotic therapy for VTE disease: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest 2012;141(2 Suppl.):e419S-94S. DOI: 10.1378/chest.11-2301
47. Buyse M, Molenberghs G, Burzykowski T et al. The validation of surrogate endpoints in meta-analyses of randomized experiments. Biostatistics 2000;1:49-67. DOI: 10.1093/biostatistics/1.1.49
48. Institute for Quality and Efficiency in Health Care: Executive Summaries [Internet]. Cologne, Germany: Institute for Quality and Efficiency in Health Care (IQWiG); 2005–. Validity of surrogate endpoints in oncology: Executive summary of rapid report A10-05, Version 1.1. 2011 Nov 21.
49. Burzykowski T, Buyse M. Surrogate threshold effect: an alternative measure for meta-analytic surrogate endpoint validation. Pharm Stat 2006;5:173-86. DOI: 10.1002/pst.207. PMID: 17080751.
50. Buyse M, Sargent DJ, Grothey A et al. Biomarkers and surrogate end points – the challenge of statistical validation. Nat Rev Clin Oncol 2010;7:309-17. DOI: 10.1038/nrclinonc.2010.43
51. Laporte S, Chapelle C, Bertoletti L et al. Assessment of clinically relevant bleeding as a surrogate outcome for major bleeding: validation by meta-analysis of randomized controlled trials. J Thromb Haemost 2017;15(8):1547-58. DOI: 10.1111/jth.13740
52. Biomarkers Definitions Working Group. Biomarkers and surrogate endpoints: preferred definitions and conceptual framework. Clin Pharmacol Ther 2001;69(3):89-95. DOI: 10.1067/mcp.2001.113989
53. Temple R. Are surrogate markers adequate to assess cardiovascular disease drugs? JAMA 1999;282(8):790-5. DOI: 10.1001/jama.282.8.790
54. Prentice RL. Surrogate endpoints in clinical trials: definition and operational criteria. Stat Med 1989;8(4):431-40. DOI: 10.1002/sim. 4780080407
28 марта 2024
Количество просмотров: 473

