Клинический разбор в общей медицине №2 2024
Omsk State Medical University, Omsk, Russia
dmitry_trukhan@mail.ru
Abstract
Dyslipidemia – increased blood levels of cholesterol, triglycerides and atherogenic lipoproteins and/or decreased levels of anti-atherogenic high-density lipoproteins. Dyslipidemia is considered one of the main biological risk factors for chronic non-communicable diseases, along with overweight and obesity, arterial hypertension and hyperglycemia. The initial stage of correction of dyslipidemia begins with dietary recommendations, in which omega-3 polyunsaturated fatty acids occupy an important place. The effects of the main substances included in the combined nutraceutical Cholesterol Control are considered: omega-3 polyunsaturated fatty acids, including eicosapentaenoic and docosahexaenoic acids, red yeast rice, coenzyme Q10, which allows us to consider it the nutraceutical of choice for low and moderate risk individuals with moderately elevated cholesterol and triglycerides, no indications for taking statins or the presence of contraindications to taking them. Periodontitis is the sixth most common disease in the world (second among dental pathologies after caries) and the leading cause of tooth loss in adults. At the beginning of the 21st century, the concept of “periodontal medicine” was formed, within the framework of which the bidirectional connection of periodontal pathology with systemic diseases of the body is considered. We searched the PubMed and Scopus information databases for articles published before 02/15/2024 that examined the relationship between dyslipidemia and periodontal pathology. The results obtained indicate the presence of a bidirectional relationship between dyslipidemia and periodontal pathology. The analysis showed the positive effect of omega-3 polyunsaturated fatty acids and coenzyme Q10 on the inflammatory process in periodontal tissue and allows us to consider the nutraceutical Cholesterol Control as an adjuvant therapy in comorbid patients with dyslipidemia and periodontal pathology, as well as for the prevention of lipid disorders in patients with periodontal diseases.
Keywords: dyslipidemia, cholesterol, triglycerides, omega-3 polyunsaturated fatty acids, eicosapentaenoic acid, docosahexaenoic acid, coenzyme Q10, red yeast rice, prevention, nutraceutical, periodontal pathology, periodontitis, comorbidity.
For citation: Trukhan D.I., Sulimov A.F., Trukhan L.Yu. Comorbidity of dyslipidemia and periodontal diseases. Clinical analysis in general medicine. 2024; 5 (2): 21–30 (In Russ.). DOI: 10.47407/kr2023.5.2.00384
Дислипидемии – повышенное содержание в крови холестерина (ХС), триглицеридов (ТГ) и атерогенных липопротеинов и/или снижение содержания антиатерогенных липопротеинов высокой плотности [1].
В клинических рекомендациях «Нарушения липидного обмена» понятие дислипидемии подразумевает состояния, когда концентрации липидов и липопротеинов крови выходят за пределы нормы [2]. В Национальном руководстве «Профилактика хронических неинфекционных заболеваний в Российской Федерации» [3] дислипидемии относят к основным биологическим факторам риска хронических неинфекционных заболеваний наряду с избыточной массой тела и ожирением, артериальной гипертензией и гипергликемией [3]. Роль повышенного уровня ХС, входящего в состав липопротеинов низкой плотности (ЛПНП) и др., апопротеин В содержащих липопротеинов, в развитии сердечно-сосудистых заболеваний (ССЗ) не вызывает сомнения, поскольку убедительно продемонстрирована генетическими, наблюдательными и интервенционными исследованиями [3, 4].
Наиболее актуальные данные о распространенности нарушений липидного обмена в Российской Федерации получены в ходе многоцентрового исследования ЭССЕ-РФ: распространенность гиперхолестеринемии составила 58,4% (уровень общего ХС≥5,0 ммоль/л), а гипертриглицеридемии – 30,2% у мужчин и 20,1% у женщин [2].
Решение о тактике лечения рекомендуется принимать в зависимости от исходного уровня сердечно-сосудистого риска [2]. Начальный этап коррекции дислипидемии начинается с диетических рекомендаций [2, 3], в которых важное место занимают омега-3 полиненасыщенные жирные кислоты (ПНЖК). Наблюдательные исследования подтверждают рекомендации о том, что потребление рыбы по крайней мере дважды в неделю и омега-3-ПНЖК в низких дозах в качестве пищевой добавки могут снижать риск сердечно-сосудистой смерти и инсульта в первичной профилактике без влияния на метаболизм липопротеинов плазмы [2, 5].
Низкое потребление ПНЖК связано с более высокой частотой внезапной смерти, тогда как при потреблении ПНЖК отмечается значительное снижение риска (на 45–70%) [3]. Снижение риска ишемической болезни сердца связано с увеличением доли ПНЖК в рационе на 25% [3, 6].
Наиболее важными омега-3-ПНЖК являются эйкозапентаеновая кислота (ЭПК) и докозагексаеновая кислота (ДГК). Организм человека не способен синтезировать эти жирные кислоты из более простых веществ, накопление длинноцепочечных ЭПК и ДГК в тканях происходит в результате непосредственного поступления их из пищи [7, 8].
В качестве возможного выбора мы предлагаем рассмотреть биологически активную добавку к пище ГОЛД'Н АПОТЕКА Холестерол Контрол (GOLD'N APOTHEKA Cholesterol Control). В ее состав входят омега-3-ПНЖК, в том числе ЭПК и ДГК, ферментированный красный рис (монаколин или красный дрожжевой рис), коэнзим Q10 – CoQ10 (убихинон).
Исследования последнего десятилетия продемонстрировали высокую частоту атеросклеротических ССЗ у пациентов с гиперлипидемией и гипертриглицеридемией, несмотря на использование статинов. Учитывая связь высоких уровней ТГ с повышенным уровнем ХС и низким уровнем ХС липопротеинов высокой плотности, рекомендации Американской кардиологической ассоциации (AHA) и Американского колледжа кардиологов (ACC) рекомендуют рассматривать повышенные уровни ТГ как «повышающий риск фактор» для профилактики и лечения атеросклеротических ССЗ и использование омега-3-ПНЖК у пациентов со стойко повышенным уровнем тяжелой гипертриглицеридемии [9].
В последнем метаанализе показано значительное влияние омега-3-ПНЖК на некоторые исходы ССЗ, особенно на фатальные и тотальные инфаркты миокарда. Несмотря на наиболее интенсивные исследования омега-3 жирных кислот при ССЗ, было продемонстрировано, что их преимущества распространяются на множество систем и патологий, включая аутоиммунные заболевания, инфекционные заболевания, хронические заболевания почек, заболевания центральной нервной системы и, совсем недавно, пандемию COVID-19 [9]. Лечение гиперхолестеринемии статинами приводит к значительному снижению сердечно-сосудистого риска; однако люди с хорошо контролируемым уровнем ХС ЛПНП, но сохраняющимся высоким уровнем ТГ, остаются в группе повышенного риска. Генетические и эпидемиологические исследования показали, что повышенные уровни ТГ натощак связаны с сердечно-сосудистыми событиями. В эффективных дозах омега-3-ПНЖК, такие как ЭПК и ДГК, снижают уровень ТГ, но могут обладать дополнительными атеропротекторными свойствами по сравнению с другими препаратами, снижающими ТГ, такими как ниацин и фибраты [10].
В обзоре 2023 г. отмечается, что проспективные когортные исследования демонстрируют связь между более высоким потреблением ЭПК+ДГК или более высокими уровнями ЭПК и ДГК в организме и более низким риском развития ССЗ, особенно ишемической болезни сердца и инфаркта миокарда, а также сердечно-сосудистой смертности среди населения в целом. Кардиопротекторный эффект ЭПК и ДГК обусловлен благоприятной модуляцией ряда факторов риска ССЗ [11]. ЭПК высокой степени очистки одобрена Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) для профилактики ССЗ у пациентов с высоким риском [12]. Это одобрение основано на 25% снижении риска сердечно-сосудистых событий, наблюдаемом при ее применении в заранее определенной первичной комбинированной конечной точке (сердечно-сосудистая смерть, нефатальный инфаркт миокарда, нефатальный инсульт, коронарная реваскуляризация или госпитализация по поводу нестабильной стенокардии) в знаковом исследовании REDUCE-IT (Reduction of Cardiovascular Events with Icosapent Ethyl-Intervention Trial) [13].
К пищевым добавкам, влияющим на липидный профиль, относится красный дрожжевой рис (монаколин), действие которого, как и статинов, связано с ингибированием ГМГ-КоА-редуктазы [2, 14]. Основными компонентами красного дрожжевого риса, снижающими уровень ХС, являются монаколины, в частности монаколин К, который структурно идентичен ловастатину и нацелен на тот же ключевой фермент биосинтеза ХС. Прием монаколина снижает уровень ХС ЛПНП примерно на 15–25% по сравнению с плацебо с эффектом, аналогичным эффекту низких доз статинов I поколения у пациентов с легкой и умеренной дислипидемией [14, 15]. Красный дрожжевой рис также продемонстрировал полезное снижение ХС ЛПНП до 45% по сравнению с плацебо [15, 16]. Красный дрожжевой рис в дозе, обеспечивающей около 3 мг/сут монаколина К, хорошо переносится, а профиль нежелательных явлений аналогичен таковому у статинов в низких дозах [15, 17].
Ряд исследований показывают, что использование красного дрожжевого риса связано с улучшением функции эндотелия и жесткости артерий, тогда как долгосрочные исследования подтверждают его роль в
предотвращении сердечно-сосудистых событий [15, 18]. Несмотря на статиноподобный механизм действия, риск, связанный с приемом от 3 до 10 мг монаколина К в день, минимален (легкая миалгия у пациентов с тяжелой непереносимостью статинов) [18]. Монаколин К можно применять, с учетом доказанной клинической эффективности и безопасности, у лиц низкого и умеренного риска с умеренно повышенным ХС ЛПНП и отсутствием показаний для приема статинов [15, 18].
В итальянском двойном слепом рандомизированном плацебо-контролируемом клиническом исследовании с параллельными группами проверяли эффект 8-недельного приема мягких таблеток, содержащих красный дрожжевой рис (2,8 мг монаколинов) и омега-3-ПНЖК (588 мг рыбьего жира, стандартизировано по ПНЖК: 350 мг ЭПК, 45 мг ДГК) по сравнению с плацебо [19]. Испытываемый комбинированный нутрицевтик очень хорошо переносился, и после 8 нед приема он сопровождался снижением уровня ХС ЛПНП на 17,3±3,4%, общего ХС – на 12,1±2,2%, апопротеина В – на 22,3±4,3% и С-реактивного белка – на 14,9±1,8%, а также значительным улучшением объема пульса – на 5,0±0,9%.
CoQ10 является незаменимым липидом, выполняющим множество клеточных функций, таких как транспорт электронов для клеточного дыхания, антиоксидантная защита, окислительно-восстановительный гомеостаз и подавление ферроптоза [20]. В недавнем обзоре британских ученых отмечено, что вторичные нарушения CoQ10 распространены и могут возникать по разным причинам. К ним относятся мутации в генах, не связанные напрямую с синтетическим путем, снижение уровня CoQ10, вызванное окислительным стрессом, и эффекты фармакологических агентов, таких как статины. CoQ10 имеет ключевое значение в клеточном метаболизме [20, 21]. Помимо своей роли в окислительном фосфорилировании митохондрий, он является основным эндогенным антиоксидантом и играет роль в метаболизме сульфидов, липидов и аминокислот. Вторичный дефицит CoQ10 связан с широким спектром заболеваний.
CoQ10 рассматривается в качестве эффективного дополнительного средства при лечении целого ряда заболеваний, прежде всего при патологических расстройствах сердечно-сосудистой системы, таких как атеросклероз и дислипидемии, острая и хроническая ишемическая болезнь сердца, недостаточность кровообращения различной этиологии – кардиомиопатии, артериальная гипертония (включая диастолическую дисфункцию сердца вследствие гипертонии и других причин) [22]. Эффективность применения CoQ10 в кардиологической практике отмечена в многочисленных публикациях [23–25].
В рамках исследования Q-SYMBIO [26] был проведен анализ эффекта добавок CoQ10 в европейской когорте.
У этих пациентов относительный риск серьезных неблагоприятных сердечно-сосудистых событий (MACE) снизился на 67%, сердечно-сосудистой смертности – на 53% и смертности от всех причин – на 55%; кроме того, фракция выброса левого желудочка значительно улучшилась (на 6%), чего не наблюдалось в оригинальном исследовании, хотя уровни NT-proBNP существенно не изменились.
Таким образом, входящие в состав биологически активной добавки к пище Холестерол Контрол компоненты способствуют поддержанию здоровья сердечно-сосудистой системы, снижению повышенных уровней ХС и ТГ, увеличению энергетического потенциала и антиоксидантной защите организма. Холестерол Контрол можно рассматривать в качестве нутрицевтика выбора у лиц низкого и умеренного риска с умеренно повышенными ХС ЛПНП и ТГ, отсутствием показаний для приема статинов или наличием противопоказаний к их приему.
Американская академия пародонтологии рассматривает пародонтит как воспалительное заболевание бактериального происхождения [30]. Пародонтит часто ошибочно воспринимается исключительно как стоматологическое заболевание, является хроническим заболеванием, характеризующимся воспалением опорных структур зуба и связанным с хроническим системным воспалением и эндотелиальной дисфункцией [31]. Пародонтит является фактором риска развития системного воспаления в результате попадания в кровь бактерий и воспалительных/провоспалительных цитокинов, что, соответственно, может влиять на другие органы и системы организма.
В качестве вероятной биологической связи с повышенным сердечно-сосудистым риском рассматривается системное воспаление низкой (слабой) степени (низкосортное, низкоуровневое системное воспаление) [32–34].
В многочисленных эпидемиологических и клинических исследованиях продемонстрирована тесная двунаправленная связь заболеваний пародонта с дислипидемией, а также с метаболическим синдромом и его другими компонентами: абдоминальным ожирением, инсулинорезистентностью, гипергликемией, сахарным диабетом, артериальной гипертонией, что рассмотрено в наших предыдущих обзорах [29, 35–40].
Результаты клинических исследований свидетельствуют, что дислипидемия может быть связана с патологией пародонта у соматически здоровых людей [41–47]. Так, в иранском исследовании [44] средние значения общего ХС (группа пародонтита – 218,11±29,77, контрольная группа – 162,31±48,4) и ТГ (группа пародонтита – 209,77±44,30, контрольная группа – 125,60±44,16) были значительно выше у пациентов с пародонтитом (р<0,001). Частота патологических значений общего ХС и ТГ были значительно выше в группе пародонтита по сравнению с лицами со здоровым пародонтом (р=0,002 и р=0,015 соответственно). В индийском исследовании [45] у пациентов с хроническим пародонтитом отмечено существенное повышение уровня общего ХС и ХС ЛПНП (р<0,05) по сравнению с лицами со здоровым пародонтом. Ассоциация пародонтита и дислипидемии также получила подтверждения в последних метаанализах [48, 49]. При нехирургическом лечении заболеваний пародонта отмечается улучшение показателей липидного профиля у больных пародонтитом [50, 51].
Американский консенсус по пародонтиту и атеросклеротическим ССЗ рекомендует информировать пациентов с умеренным и тяжелым пародонтитом о вероятном повышенном риске ССЗ и необходимости пройти кардиологическое обследование [52]. Заболевания полости рта могут представлять собой модифицируемый фактор риска системного хронического воспаления и, следовательно, кардиометаболических нарушений [53].
В испанском исследовании [54] общее количество жирных кислот плазмы, насыщенных, n-6 полиненасыщенных и мононенасыщенных жирных кислот, индекс перекисной способности, растворимый VCAM (молекула сосудистой клеточной адгезии), фактор некроза опухоли α, общий ХС, ХС липопротеинов очень низкой плотности и ТГ были значительно выше в группе с пародонтитом по сравнению с группой без пародонтита. Авторы указывают на наличие взаимосвязи между пародонтитом, профилем жирных кислот плазмы и увеличением метаболических факторов риска ССЗ.
 Австралийские ученые [55] отмечают, что прием внутрь омега-3-ПНЖК, в том числе ДГК и ЭПК, приводит к их включению в мембранные фосфолипиды, которые могут изменить выработку эйкозаноидов после стимуляции во время иммунного ответа. Эти эйкозаноиды способствуют уменьшению хронического воспаления, что привело к предположению, что омега-3-ПНЖК являются возможным модулятором воспаления и могут снизить тяжесть заболеваний пародонта. Американские ученые [56] указывают, что омега-3-ПНЖК участвуют в модуляции иммуновоспалительных реакций при пародонтите.
Австралийские ученые [55] отмечают, что прием внутрь омега-3-ПНЖК, в том числе ДГК и ЭПК, приводит к их включению в мембранные фосфолипиды, которые могут изменить выработку эйкозаноидов после стимуляции во время иммунного ответа. Эти эйкозаноиды способствуют уменьшению хронического воспаления, что привело к предположению, что омега-3-ПНЖК являются возможным модулятором воспаления и могут снизить тяжесть заболеваний пародонта. Американские ученые [56] указывают, что омега-3-ПНЖК участвуют в модуляции иммуновоспалительных реакций при пародонтите.
В американском двойном слепом плацебо-контролируемом параллельном исследовании [57] продолжительностью 3 мес отмечено, что пероральный прием ДГК уменьшал среднюю глубину карманов (-0,29±0,13; р=0,03) и десневой индекс (-0,26±0,13; q=0,04). Значительные различия были обнаружены между ДГК и контролем как для уровня С-реактивного белка десневой жидкости (-5,3 нг/мл, p=0,03), так и для интерлейкина-1β (-20,1 пг/мл, p=0,02),
В обзоре американских ученых [58] отмечено, что ДГК используется для лечения ряда различных заболеваний, включая заболевания пародонта и воспалительные заболевания кишечника. Благотворно изменяя выработку цитокинов и рекрутирование макрофагов, состав кишечной микробиоты и целостность кишечника, воспаление, вызванное липополисахаридами и жирами, а также передачу сигналов инсулина, ДГК может быть ключевым инструментом в предотвращении метаболического синдрома.
В обзоре бразильских ученых [59] указывается на профилактический эффект, связанный с уровнями ДГК и ЭПК в плазме, против прогрессирования заболеваний пародонта. Этот эффект может быть связан с антибактериальной активностью ДГК и ЭБК против планктонных и биопленочных форм пародонтальных патогенов Porphyromonas gingivalis, Fusobacterium nucleatum [60] и Streptococcus mutans [61], продемонстрированных китайскими учеными. Бразильские ученые [62] идентифицировали 165 белков пародонтопатогенов, которые могут взаимодействовать с ДГК и ЭПК.
В египетском параллельном двойном клиническом исследовании [63] оценивали включение в базовое лечение пародонтита омега-3-ПНЖК, включая ДГК и ЭПК, с добавлением ацетилсалициловой кислоты по сравнению с плацебо. Исследователи отметили значительное уменьшение глубины пародонтального кармана (PРD) и усиление клинического прикрепления (CAL) через 3 и 6 мес в группе омега-3 по сравнению с исходным уровнем и контрольной группой (p<0,05). Авторы рекомендуют пищевые добавки с омега-3-ПНЖК для усиления базовой пародонтальной терапии. В иранском рандомизированном клиническом исследовании [64] показатели CAL и PРD при приеме омега-3-ПНЖК (в том числе 180 мг ЭПК, 120 мг ДПГ) значительно улучшились через 3 мес по сравнению с исходным уровнем (p=0,001) и контрольной группой (p=0,001).
В польском рандомизированном клиническом исследовании [65] через 3 мес в группе, получавшей омега-3-ПНЖК, в том числе ДГК и ЭПК, по сравнению с контрольной группой наблюдались статистически значимое снижение кровотечения при зондировании (bleeding on probing – BoP) и улучшение CAL. Более того, статистически значимо более высокий процент закрытых карманов (глубина зондирования ≤4 мм без BoP) был достигнут в группе дополнительного лечения по сравнению с контрольной группой после 3 мес лечения.
В индийском рандомизированном контролируемом исследовании [66] эффективности омега-3 ПНЖК, включая ДГК и ЭПК, статистический анализ продемонстрировал значительное уменьшение PРD (t=65,56, p=0,000 и t=51,69, p=0,000) через 1 и 3 мес соответственно в тестовой группе по сравнению с исходной и контрольной группой. Наблюдалось значительное увеличение уровня CAL (t=63,29, p=0,000 и t=31,03, p=0,000) через 1 и 3 мес соответственно в тестовой группе по сравнению с исходной и контрольной группой.
Результаты клинических исследований обобщены в целом ряде метаанализов, опубликованных в последние годы. В немецком метаанализе [67] показано, что омега-3-ПНЖК оказывают положительное влияние на заживление пародонтальных ран в отношении уменьшения PPD и увеличения уровня CAL. Британский метаанализ [68, 69] показал статистически значимое уменьшение PPD, увеличение CAL и снижение BoP при вмешательствах, связанных с применением омега-3-ПНЖК.
В метаанализе ученых из Нидерландов [70] показано, что дополнительное использование омега-3-ПНЖК к нехирургическому лечению пародонтита привело к снижению PPD на 0,39 мм (95% доверительный интервал – ДИ -0,58–-0,21) и увеличению CAL на 0,41 мм (95% ДИ -0,63–-0,19). В южнокорейском метаанализе [71] также показаны статистически значимое уменьшение PPD (стандартизованная средняя разница – SMD -0,81, абсолютная средняя разница – MD -0,44 мм), увеличение CAL (SMD -0,77, MD -0,51 мм) и снижение BoP (SMD -0,65, MD -9,45%) для вмешательств с использованием омега-3-ПНЖК.
В бельгийском метаанализе [72] отмечена статистически значимая разница в снижении PPD (SMD -0,78; 95% ДИ -1,02–-0,54; p<0,0001) и уменьшении потери CAL (SMD -0,80; 95% ДИ -1,04–-0,56; p<0,0001) при использовании омега-3-ПНЖК в качестве вспомогательного средства при нехирургическом лечении пародонтита.
В бразильском [73] и индийском [74] метаанализах также наглядно показано, что использование омега-3-ПНЖК в качестве адъювантной терапии пародонтита оказывает значительное позитивное влияние на уровень CAL и PРD через 3 и 6 мес терапии.
В систематическом обзоре немецких стоматологов, опубликованном в 2023 г., отмечается, что диетические вмешательства (прежде всего применение нутрицевтиков) в настоящее время становятся важным дополнением к нехирургической пародонтальной терапии [75]. Следовательно, нутрицевтики, содержащие в составе омега-3-ПНЖК, в том числе длинноцепочечные ЭПК и ДГК, целесообразно использовать в качестве адъювантной терапии при лечении заболеваний пародонта.
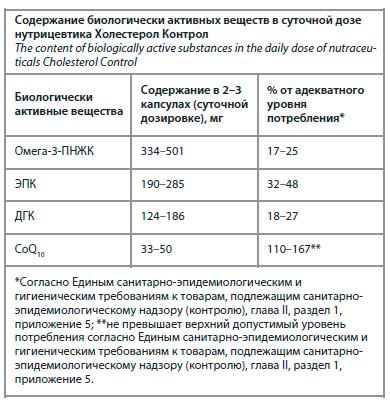
В качестве нутрицевтика выбора у больных с заболеваниями пародонта можно рассматривать биологически активную добавку к пище ГОЛД'Н АПОТЕКА Холестерол Контрол (GOLD'N APOTHEKA Cholesterol Control). Рекомендации по применению: взрослым принимать по 2–3 капсулы в день во время еды. Суточное содержание омега-3-ПНЖК, в том числе ЭПК и ДГК, в нутрицевтике Холестерол Контрол в большинстве случаев соответствует рассмотренным в клинических исследованиях и метаанализах, посвященных изучению влияния омега-3-ПНЖК на ткани пародонта (см. таблицу).
В британском обзоре [77] отмечается, CoQ10 имеет потенциальное значение при заболеваниях пародонта, поскольку обладает мощным антибактериальным, антиоксидантным и противовоспалительным действием. В нескольких исследованиях был выявлен дефицит CoQ10 в биопсиях десен пораженной ткани по сравнению с биопсиями, взятыми из здоровых участков у тех же пациентов [77]. При нехирургическом лечении пародонтита системный CoQ10 применяется 2 или 3 раза в день в течение 6 нед до 4 мес [78]. Чаще CoQ10 при пародонтитах применяется местно.
В метаанализе [79], изучавшем эффективность местного применения геля CoQ10 у пациентов с пародонтитом, показано, что CoQ10 может значительно снизить индекс зубного налета (SMD -0,64; 95% ДИ -1,03–-0,26, p=0,002; I2 85,7%), ВоР (SMD -1,05; 95% ДИ -1,70–-0,41; p=0,001; I2 89,5%), PРD (SMD -0,96; 95% ДИ -1,35–-0,58, p<0,001, I2 84,7%), CAL (SMD -0,73; 95% ДИ от -1,23–-0,22; p=0,005; I2 87,8%) и десневой индекс (SMD -0,63; 95% ДИ -0,97–-0,28; p=0,001; I2=72,8%) при пародонтите. Анализ подгрупп показал, что CoQ10 имел более сильный эффект снижения при внутрикарманном введении, а не при местном применении.
Таким образом, CoQ10 также может оказывать позитивный эффект при патологии пародонта и дополнять позитивные эффекты омега-3-ПНЖК в нутрицевтике Холестерол Контрол.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Трухан Дмитрий Иванович – д-р мед. наук, доц., проф. каф. поликлинической терапии и внутренних болезней, ФГБОУ ВО ОмГМУ. E-mail: dmitry_trukhan@mail.ru;
ORCID: 0000-0002-1597-1876
Dmitry I. Trukhan – Dr. Sci. (Med.), Professor, Omsk State Medical University. E-mail: dmitry_trukhan@mail.ru;
ORCID: 0000-0002-1597-1876
Сулимов Анатолий Филиппович – д-р мед. наук, проф., зав. каф. челюстно-лицевой хирургии, ФГБОУ ВО ОмГМУ.
E-mail: afsulimov@yandex.ru.
Anatoly F. Sulimov – Dr. Sci. (Med.), Professor, Omsk State Medical University. E-mail: afsulimov@yandex.ru.
Трухан Лариса Юрьевна – канд. мед. наук, врач-стоматолог, ФГБОУ ВО ОмГМУ. E-mail: larissa_trukhan@mail.ru;
ORCID: 0000-0002-4721-6605
Larisa Yu. Trukhan – Cand. Sci. (Med.), Omsk State Medical University. E-mail: larissa_trukhan@mail.ru;
ORCID: 0000-0002-4721-6605
Поступила в редакцию: 17.03.2024
Поступила после рецензирования: 22.03.2024
Принята к публикации: 28.03.2024
Received: 17.03.2024
Revised: 22.03.2024
Accepted: 28.03.2024
Клинический разбор в общей медицине №2 2024
Коморбидность дислипидемии и заболеваний пародонта
Номера страниц в выпуске:21-30
Аннотация
Дислипидемии – повышенное содержание в крови холестерина, триглицеридов и атерогенных липопротеинов и/или снижение содержания антиатерогенных липопротеинов высокой плотности. Дислипидемии относят к основным биологическим факторам риска хронических неинфекционных заболеваний наряду с избыточной массой тела и ожирением, артериальной гипертензией и гипергликемией. Начальный этап коррекции дислипидемии начинается с диетических рекомендаций, в которых важное место занимают омега-3 полиненасыщенные жирные кислоты. Рассмотрены эффекты основных веществ, входящих в состав комбинированного нутрицевтика Холестерол Контрол: омега-3 полиненасыщенных жирных кислот, в том числе эйкозапентаеновой и докозагексаеновой кислот, красного дрожжевого риса, коэнзима Q10, – которые позволяют считать его нутрицевтиком выбора у лиц низкого и умеренного риска с умеренно повышенными холестерином и триглицеридами, отсутствием показаний для приема статинов или наличием противопоказаний к их приему. Пародонтит является шестым по распространенности заболеванием в мире (среди стоматологической патологии – вторым после кариеса) и первой причиной потери зубов у взрослых. В начале XXI в. сформировалась концепция «пародонтальной медицины», в рамках которой рассматривается двунаправленная связь патологии пародонта с системными заболеваниями. Мы провели поиск в информационных базах PubMed и Scopus статей, опубликованных до 15.02.2024, в которых рассматривалась взаимосвязь дислипидемии и патологии пародонта. Полученные результаты свидетельствуют о наличии двунаправленной взаимосвязи между дислипидемией и патологией пародонта. Проведенный анализ показал позитивное влияние омега-3 полиненасыщенных жирных кислот и коэнзима Q10 на воспалительный процесс в ткани пародонта, что позволяет рассматривать нутрицевтик Холестерол Контрол в качестве адъювантной терапии у коморбидных пациентов с дислипидемией и патологией пародонта, а также профилактики липидных нарушений у больных с заболеваниями пародонта.
Ключевые слова: дислипидемия, холестерин, триглицериды, омега-3 полиненасыщенные жирные кислоты, эйкозапентаеновая кислота, докозагексаеновая кислота, коэнзим Q10, красный дрожжевой рис, профилактика, нутрицевтик, патология пародонта, пародонтит, коморбидность.
Для цитирования: Трухан Д.И., Сулимов А.Ф., Трухан Л.Ю. Коморбидность дислипидемии и заболеваний пародонта. Клинический разбор в общей медицине. 2024; 5 (2): 21–30. DOI: 10.47407/kr2023.5.2.00384
Дислипидемии – повышенное содержание в крови холестерина, триглицеридов и атерогенных липопротеинов и/или снижение содержания антиатерогенных липопротеинов высокой плотности. Дислипидемии относят к основным биологическим факторам риска хронических неинфекционных заболеваний наряду с избыточной массой тела и ожирением, артериальной гипертензией и гипергликемией. Начальный этап коррекции дислипидемии начинается с диетических рекомендаций, в которых важное место занимают омега-3 полиненасыщенные жирные кислоты. Рассмотрены эффекты основных веществ, входящих в состав комбинированного нутрицевтика Холестерол Контрол: омега-3 полиненасыщенных жирных кислот, в том числе эйкозапентаеновой и докозагексаеновой кислот, красного дрожжевого риса, коэнзима Q10, – которые позволяют считать его нутрицевтиком выбора у лиц низкого и умеренного риска с умеренно повышенными холестерином и триглицеридами, отсутствием показаний для приема статинов или наличием противопоказаний к их приему. Пародонтит является шестым по распространенности заболеванием в мире (среди стоматологической патологии – вторым после кариеса) и первой причиной потери зубов у взрослых. В начале XXI в. сформировалась концепция «пародонтальной медицины», в рамках которой рассматривается двунаправленная связь патологии пародонта с системными заболеваниями. Мы провели поиск в информационных базах PubMed и Scopus статей, опубликованных до 15.02.2024, в которых рассматривалась взаимосвязь дислипидемии и патологии пародонта. Полученные результаты свидетельствуют о наличии двунаправленной взаимосвязи между дислипидемией и патологией пародонта. Проведенный анализ показал позитивное влияние омега-3 полиненасыщенных жирных кислот и коэнзима Q10 на воспалительный процесс в ткани пародонта, что позволяет рассматривать нутрицевтик Холестерол Контрол в качестве адъювантной терапии у коморбидных пациентов с дислипидемией и патологией пародонта, а также профилактики липидных нарушений у больных с заболеваниями пародонта.
Ключевые слова: дислипидемия, холестерин, триглицериды, омега-3 полиненасыщенные жирные кислоты, эйкозапентаеновая кислота, докозагексаеновая кислота, коэнзим Q10, красный дрожжевой рис, профилактика, нутрицевтик, патология пародонта, пародонтит, коморбидность.
Для цитирования: Трухан Д.И., Сулимов А.Ф., Трухан Л.Ю. Коморбидность дислипидемии и заболеваний пародонта. Клинический разбор в общей медицине. 2024; 5 (2): 21–30. DOI: 10.47407/kr2023.5.2.00384
Comorbidity of dyslipidemia and periodontal diseases
Dmitry I. Trukhan, Anatoly F. Sulimov, Larisa Yu. TrukhanOmsk State Medical University, Omsk, Russia
dmitry_trukhan@mail.ru
Abstract
Dyslipidemia – increased blood levels of cholesterol, triglycerides and atherogenic lipoproteins and/or decreased levels of anti-atherogenic high-density lipoproteins. Dyslipidemia is considered one of the main biological risk factors for chronic non-communicable diseases, along with overweight and obesity, arterial hypertension and hyperglycemia. The initial stage of correction of dyslipidemia begins with dietary recommendations, in which omega-3 polyunsaturated fatty acids occupy an important place. The effects of the main substances included in the combined nutraceutical Cholesterol Control are considered: omega-3 polyunsaturated fatty acids, including eicosapentaenoic and docosahexaenoic acids, red yeast rice, coenzyme Q10, which allows us to consider it the nutraceutical of choice for low and moderate risk individuals with moderately elevated cholesterol and triglycerides, no indications for taking statins or the presence of contraindications to taking them. Periodontitis is the sixth most common disease in the world (second among dental pathologies after caries) and the leading cause of tooth loss in adults. At the beginning of the 21st century, the concept of “periodontal medicine” was formed, within the framework of which the bidirectional connection of periodontal pathology with systemic diseases of the body is considered. We searched the PubMed and Scopus information databases for articles published before 02/15/2024 that examined the relationship between dyslipidemia and periodontal pathology. The results obtained indicate the presence of a bidirectional relationship between dyslipidemia and periodontal pathology. The analysis showed the positive effect of omega-3 polyunsaturated fatty acids and coenzyme Q10 on the inflammatory process in periodontal tissue and allows us to consider the nutraceutical Cholesterol Control as an adjuvant therapy in comorbid patients with dyslipidemia and periodontal pathology, as well as for the prevention of lipid disorders in patients with periodontal diseases.
Keywords: dyslipidemia, cholesterol, triglycerides, omega-3 polyunsaturated fatty acids, eicosapentaenoic acid, docosahexaenoic acid, coenzyme Q10, red yeast rice, prevention, nutraceutical, periodontal pathology, periodontitis, comorbidity.
For citation: Trukhan D.I., Sulimov A.F., Trukhan L.Yu. Comorbidity of dyslipidemia and periodontal diseases. Clinical analysis in general medicine. 2024; 5 (2): 21–30 (In Russ.). DOI: 10.47407/kr2023.5.2.00384
Дислипидемии – повышенное содержание в крови холестерина (ХС), триглицеридов (ТГ) и атерогенных липопротеинов и/или снижение содержания антиатерогенных липопротеинов высокой плотности [1].
В клинических рекомендациях «Нарушения липидного обмена» понятие дислипидемии подразумевает состояния, когда концентрации липидов и липопротеинов крови выходят за пределы нормы [2]. В Национальном руководстве «Профилактика хронических неинфекционных заболеваний в Российской Федерации» [3] дислипидемии относят к основным биологическим факторам риска хронических неинфекционных заболеваний наряду с избыточной массой тела и ожирением, артериальной гипертензией и гипергликемией [3]. Роль повышенного уровня ХС, входящего в состав липопротеинов низкой плотности (ЛПНП) и др., апопротеин В содержащих липопротеинов, в развитии сердечно-сосудистых заболеваний (ССЗ) не вызывает сомнения, поскольку убедительно продемонстрирована генетическими, наблюдательными и интервенционными исследованиями [3, 4].
Наиболее актуальные данные о распространенности нарушений липидного обмена в Российской Федерации получены в ходе многоцентрового исследования ЭССЕ-РФ: распространенность гиперхолестеринемии составила 58,4% (уровень общего ХС≥5,0 ммоль/л), а гипертриглицеридемии – 30,2% у мужчин и 20,1% у женщин [2].
Решение о тактике лечения рекомендуется принимать в зависимости от исходного уровня сердечно-сосудистого риска [2]. Начальный этап коррекции дислипидемии начинается с диетических рекомендаций [2, 3], в которых важное место занимают омега-3 полиненасыщенные жирные кислоты (ПНЖК). Наблюдательные исследования подтверждают рекомендации о том, что потребление рыбы по крайней мере дважды в неделю и омега-3-ПНЖК в низких дозах в качестве пищевой добавки могут снижать риск сердечно-сосудистой смерти и инсульта в первичной профилактике без влияния на метаболизм липопротеинов плазмы [2, 5].
Низкое потребление ПНЖК связано с более высокой частотой внезапной смерти, тогда как при потреблении ПНЖК отмечается значительное снижение риска (на 45–70%) [3]. Снижение риска ишемической болезни сердца связано с увеличением доли ПНЖК в рационе на 25% [3, 6].
Наиболее важными омега-3-ПНЖК являются эйкозапентаеновая кислота (ЭПК) и докозагексаеновая кислота (ДГК). Организм человека не способен синтезировать эти жирные кислоты из более простых веществ, накопление длинноцепочечных ЭПК и ДГК в тканях происходит в результате непосредственного поступления их из пищи [7, 8].
В качестве возможного выбора мы предлагаем рассмотреть биологически активную добавку к пище ГОЛД'Н АПОТЕКА Холестерол Контрол (GOLD'N APOTHEKA Cholesterol Control). В ее состав входят омега-3-ПНЖК, в том числе ЭПК и ДГК, ферментированный красный рис (монаколин или красный дрожжевой рис), коэнзим Q10 – CoQ10 (убихинон).
Исследования последнего десятилетия продемонстрировали высокую частоту атеросклеротических ССЗ у пациентов с гиперлипидемией и гипертриглицеридемией, несмотря на использование статинов. Учитывая связь высоких уровней ТГ с повышенным уровнем ХС и низким уровнем ХС липопротеинов высокой плотности, рекомендации Американской кардиологической ассоциации (AHA) и Американского колледжа кардиологов (ACC) рекомендуют рассматривать повышенные уровни ТГ как «повышающий риск фактор» для профилактики и лечения атеросклеротических ССЗ и использование омега-3-ПНЖК у пациентов со стойко повышенным уровнем тяжелой гипертриглицеридемии [9].
В последнем метаанализе показано значительное влияние омега-3-ПНЖК на некоторые исходы ССЗ, особенно на фатальные и тотальные инфаркты миокарда. Несмотря на наиболее интенсивные исследования омега-3 жирных кислот при ССЗ, было продемонстрировано, что их преимущества распространяются на множество систем и патологий, включая аутоиммунные заболевания, инфекционные заболевания, хронические заболевания почек, заболевания центральной нервной системы и, совсем недавно, пандемию COVID-19 [9]. Лечение гиперхолестеринемии статинами приводит к значительному снижению сердечно-сосудистого риска; однако люди с хорошо контролируемым уровнем ХС ЛПНП, но сохраняющимся высоким уровнем ТГ, остаются в группе повышенного риска. Генетические и эпидемиологические исследования показали, что повышенные уровни ТГ натощак связаны с сердечно-сосудистыми событиями. В эффективных дозах омега-3-ПНЖК, такие как ЭПК и ДГК, снижают уровень ТГ, но могут обладать дополнительными атеропротекторными свойствами по сравнению с другими препаратами, снижающими ТГ, такими как ниацин и фибраты [10].
В обзоре 2023 г. отмечается, что проспективные когортные исследования демонстрируют связь между более высоким потреблением ЭПК+ДГК или более высокими уровнями ЭПК и ДГК в организме и более низким риском развития ССЗ, особенно ишемической болезни сердца и инфаркта миокарда, а также сердечно-сосудистой смертности среди населения в целом. Кардиопротекторный эффект ЭПК и ДГК обусловлен благоприятной модуляцией ряда факторов риска ССЗ [11]. ЭПК высокой степени очистки одобрена Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) для профилактики ССЗ у пациентов с высоким риском [12]. Это одобрение основано на 25% снижении риска сердечно-сосудистых событий, наблюдаемом при ее применении в заранее определенной первичной комбинированной конечной точке (сердечно-сосудистая смерть, нефатальный инфаркт миокарда, нефатальный инсульт, коронарная реваскуляризация или госпитализация по поводу нестабильной стенокардии) в знаковом исследовании REDUCE-IT (Reduction of Cardiovascular Events with Icosapent Ethyl-Intervention Trial) [13].
К пищевым добавкам, влияющим на липидный профиль, относится красный дрожжевой рис (монаколин), действие которого, как и статинов, связано с ингибированием ГМГ-КоА-редуктазы [2, 14]. Основными компонентами красного дрожжевого риса, снижающими уровень ХС, являются монаколины, в частности монаколин К, который структурно идентичен ловастатину и нацелен на тот же ключевой фермент биосинтеза ХС. Прием монаколина снижает уровень ХС ЛПНП примерно на 15–25% по сравнению с плацебо с эффектом, аналогичным эффекту низких доз статинов I поколения у пациентов с легкой и умеренной дислипидемией [14, 15]. Красный дрожжевой рис также продемонстрировал полезное снижение ХС ЛПНП до 45% по сравнению с плацебо [15, 16]. Красный дрожжевой рис в дозе, обеспечивающей около 3 мг/сут монаколина К, хорошо переносится, а профиль нежелательных явлений аналогичен таковому у статинов в низких дозах [15, 17].
Ряд исследований показывают, что использование красного дрожжевого риса связано с улучшением функции эндотелия и жесткости артерий, тогда как долгосрочные исследования подтверждают его роль в
предотвращении сердечно-сосудистых событий [15, 18]. Несмотря на статиноподобный механизм действия, риск, связанный с приемом от 3 до 10 мг монаколина К в день, минимален (легкая миалгия у пациентов с тяжелой непереносимостью статинов) [18]. Монаколин К можно применять, с учетом доказанной клинической эффективности и безопасности, у лиц низкого и умеренного риска с умеренно повышенным ХС ЛПНП и отсутствием показаний для приема статинов [15, 18].
В итальянском двойном слепом рандомизированном плацебо-контролируемом клиническом исследовании с параллельными группами проверяли эффект 8-недельного приема мягких таблеток, содержащих красный дрожжевой рис (2,8 мг монаколинов) и омега-3-ПНЖК (588 мг рыбьего жира, стандартизировано по ПНЖК: 350 мг ЭПК, 45 мг ДГК) по сравнению с плацебо [19]. Испытываемый комбинированный нутрицевтик очень хорошо переносился, и после 8 нед приема он сопровождался снижением уровня ХС ЛПНП на 17,3±3,4%, общего ХС – на 12,1±2,2%, апопротеина В – на 22,3±4,3% и С-реактивного белка – на 14,9±1,8%, а также значительным улучшением объема пульса – на 5,0±0,9%.
CoQ10 является незаменимым липидом, выполняющим множество клеточных функций, таких как транспорт электронов для клеточного дыхания, антиоксидантная защита, окислительно-восстановительный гомеостаз и подавление ферроптоза [20]. В недавнем обзоре британских ученых отмечено, что вторичные нарушения CoQ10 распространены и могут возникать по разным причинам. К ним относятся мутации в генах, не связанные напрямую с синтетическим путем, снижение уровня CoQ10, вызванное окислительным стрессом, и эффекты фармакологических агентов, таких как статины. CoQ10 имеет ключевое значение в клеточном метаболизме [20, 21]. Помимо своей роли в окислительном фосфорилировании митохондрий, он является основным эндогенным антиоксидантом и играет роль в метаболизме сульфидов, липидов и аминокислот. Вторичный дефицит CoQ10 связан с широким спектром заболеваний.
CoQ10 рассматривается в качестве эффективного дополнительного средства при лечении целого ряда заболеваний, прежде всего при патологических расстройствах сердечно-сосудистой системы, таких как атеросклероз и дислипидемии, острая и хроническая ишемическая болезнь сердца, недостаточность кровообращения различной этиологии – кардиомиопатии, артериальная гипертония (включая диастолическую дисфункцию сердца вследствие гипертонии и других причин) [22]. Эффективность применения CoQ10 в кардиологической практике отмечена в многочисленных публикациях [23–25].
В рамках исследования Q-SYMBIO [26] был проведен анализ эффекта добавок CoQ10 в европейской когорте.
У этих пациентов относительный риск серьезных неблагоприятных сердечно-сосудистых событий (MACE) снизился на 67%, сердечно-сосудистой смертности – на 53% и смертности от всех причин – на 55%; кроме того, фракция выброса левого желудочка значительно улучшилась (на 6%), чего не наблюдалось в оригинальном исследовании, хотя уровни NT-proBNP существенно не изменились.
Таким образом, входящие в состав биологически активной добавки к пище Холестерол Контрол компоненты способствуют поддержанию здоровья сердечно-сосудистой системы, снижению повышенных уровней ХС и ТГ, увеличению энергетического потенциала и антиоксидантной защите организма. Холестерол Контрол можно рассматривать в качестве нутрицевтика выбора у лиц низкого и умеренного риска с умеренно повышенными ХС ЛПНП и ТГ, отсутствием показаний для приема статинов или наличием противопоказаний к их приему.
Патология пародонта и дислипидемия
Пародонтит – заболевание зубочелюстной системы, характеризующееся развитием острого или хронического воспалительного процесса, деструкцией тканей пародонта и атрофией костной ткани альвеол [27]. По данным Всемирной организации здравоохранения, заболеваниями полости рта страдают почти 3,5 млрд человек [28]. Среди стоматологической патологии хронические воспалительные заболевания пародонта (гингивит, пародонтит) занимают после кариеса второе место по распространенности. Признаки хронического воспаления десен отмечаются у более 60% населения европейских стран и примерно 50% населения США [29].Американская академия пародонтологии рассматривает пародонтит как воспалительное заболевание бактериального происхождения [30]. Пародонтит часто ошибочно воспринимается исключительно как стоматологическое заболевание, является хроническим заболеванием, характеризующимся воспалением опорных структур зуба и связанным с хроническим системным воспалением и эндотелиальной дисфункцией [31]. Пародонтит является фактором риска развития системного воспаления в результате попадания в кровь бактерий и воспалительных/провоспалительных цитокинов, что, соответственно, может влиять на другие органы и системы организма.
В качестве вероятной биологической связи с повышенным сердечно-сосудистым риском рассматривается системное воспаление низкой (слабой) степени (низкосортное, низкоуровневое системное воспаление) [32–34].
В многочисленных эпидемиологических и клинических исследованиях продемонстрирована тесная двунаправленная связь заболеваний пародонта с дислипидемией, а также с метаболическим синдромом и его другими компонентами: абдоминальным ожирением, инсулинорезистентностью, гипергликемией, сахарным диабетом, артериальной гипертонией, что рассмотрено в наших предыдущих обзорах [29, 35–40].
Результаты клинических исследований свидетельствуют, что дислипидемия может быть связана с патологией пародонта у соматически здоровых людей [41–47]. Так, в иранском исследовании [44] средние значения общего ХС (группа пародонтита – 218,11±29,77, контрольная группа – 162,31±48,4) и ТГ (группа пародонтита – 209,77±44,30, контрольная группа – 125,60±44,16) были значительно выше у пациентов с пародонтитом (р<0,001). Частота патологических значений общего ХС и ТГ были значительно выше в группе пародонтита по сравнению с лицами со здоровым пародонтом (р=0,002 и р=0,015 соответственно). В индийском исследовании [45] у пациентов с хроническим пародонтитом отмечено существенное повышение уровня общего ХС и ХС ЛПНП (р<0,05) по сравнению с лицами со здоровым пародонтом. Ассоциация пародонтита и дислипидемии также получила подтверждения в последних метаанализах [48, 49]. При нехирургическом лечении заболеваний пародонта отмечается улучшение показателей липидного профиля у больных пародонтитом [50, 51].
Американский консенсус по пародонтиту и атеросклеротическим ССЗ рекомендует информировать пациентов с умеренным и тяжелым пародонтитом о вероятном повышенном риске ССЗ и необходимости пройти кардиологическое обследование [52]. Заболевания полости рта могут представлять собой модифицируемый фактор риска системного хронического воспаления и, следовательно, кардиометаболических нарушений [53].
В испанском исследовании [54] общее количество жирных кислот плазмы, насыщенных, n-6 полиненасыщенных и мононенасыщенных жирных кислот, индекс перекисной способности, растворимый VCAM (молекула сосудистой клеточной адгезии), фактор некроза опухоли α, общий ХС, ХС липопротеинов очень низкой плотности и ТГ были значительно выше в группе с пародонтитом по сравнению с группой без пародонтита. Авторы указывают на наличие взаимосвязи между пародонтитом, профилем жирных кислот плазмы и увеличением метаболических факторов риска ССЗ.
Омега-3-ПНЖК, в том числе ЭПК и ДГК, при заболеваниях пародонта
 Австралийские ученые [55] отмечают, что прием внутрь омега-3-ПНЖК, в том числе ДГК и ЭПК, приводит к их включению в мембранные фосфолипиды, которые могут изменить выработку эйкозаноидов после стимуляции во время иммунного ответа. Эти эйкозаноиды способствуют уменьшению хронического воспаления, что привело к предположению, что омега-3-ПНЖК являются возможным модулятором воспаления и могут снизить тяжесть заболеваний пародонта. Американские ученые [56] указывают, что омега-3-ПНЖК участвуют в модуляции иммуновоспалительных реакций при пародонтите.
Австралийские ученые [55] отмечают, что прием внутрь омега-3-ПНЖК, в том числе ДГК и ЭПК, приводит к их включению в мембранные фосфолипиды, которые могут изменить выработку эйкозаноидов после стимуляции во время иммунного ответа. Эти эйкозаноиды способствуют уменьшению хронического воспаления, что привело к предположению, что омега-3-ПНЖК являются возможным модулятором воспаления и могут снизить тяжесть заболеваний пародонта. Американские ученые [56] указывают, что омега-3-ПНЖК участвуют в модуляции иммуновоспалительных реакций при пародонтите.В американском двойном слепом плацебо-контролируемом параллельном исследовании [57] продолжительностью 3 мес отмечено, что пероральный прием ДГК уменьшал среднюю глубину карманов (-0,29±0,13; р=0,03) и десневой индекс (-0,26±0,13; q=0,04). Значительные различия были обнаружены между ДГК и контролем как для уровня С-реактивного белка десневой жидкости (-5,3 нг/мл, p=0,03), так и для интерлейкина-1β (-20,1 пг/мл, p=0,02),
В обзоре американских ученых [58] отмечено, что ДГК используется для лечения ряда различных заболеваний, включая заболевания пародонта и воспалительные заболевания кишечника. Благотворно изменяя выработку цитокинов и рекрутирование макрофагов, состав кишечной микробиоты и целостность кишечника, воспаление, вызванное липополисахаридами и жирами, а также передачу сигналов инсулина, ДГК может быть ключевым инструментом в предотвращении метаболического синдрома.
В обзоре бразильских ученых [59] указывается на профилактический эффект, связанный с уровнями ДГК и ЭПК в плазме, против прогрессирования заболеваний пародонта. Этот эффект может быть связан с антибактериальной активностью ДГК и ЭБК против планктонных и биопленочных форм пародонтальных патогенов Porphyromonas gingivalis, Fusobacterium nucleatum [60] и Streptococcus mutans [61], продемонстрированных китайскими учеными. Бразильские ученые [62] идентифицировали 165 белков пародонтопатогенов, которые могут взаимодействовать с ДГК и ЭПК.
В египетском параллельном двойном клиническом исследовании [63] оценивали включение в базовое лечение пародонтита омега-3-ПНЖК, включая ДГК и ЭПК, с добавлением ацетилсалициловой кислоты по сравнению с плацебо. Исследователи отметили значительное уменьшение глубины пародонтального кармана (PРD) и усиление клинического прикрепления (CAL) через 3 и 6 мес в группе омега-3 по сравнению с исходным уровнем и контрольной группой (p<0,05). Авторы рекомендуют пищевые добавки с омега-3-ПНЖК для усиления базовой пародонтальной терапии. В иранском рандомизированном клиническом исследовании [64] показатели CAL и PРD при приеме омега-3-ПНЖК (в том числе 180 мг ЭПК, 120 мг ДПГ) значительно улучшились через 3 мес по сравнению с исходным уровнем (p=0,001) и контрольной группой (p=0,001).
В польском рандомизированном клиническом исследовании [65] через 3 мес в группе, получавшей омега-3-ПНЖК, в том числе ДГК и ЭПК, по сравнению с контрольной группой наблюдались статистически значимое снижение кровотечения при зондировании (bleeding on probing – BoP) и улучшение CAL. Более того, статистически значимо более высокий процент закрытых карманов (глубина зондирования ≤4 мм без BoP) был достигнут в группе дополнительного лечения по сравнению с контрольной группой после 3 мес лечения.
В индийском рандомизированном контролируемом исследовании [66] эффективности омега-3 ПНЖК, включая ДГК и ЭПК, статистический анализ продемонстрировал значительное уменьшение PРD (t=65,56, p=0,000 и t=51,69, p=0,000) через 1 и 3 мес соответственно в тестовой группе по сравнению с исходной и контрольной группой. Наблюдалось значительное увеличение уровня CAL (t=63,29, p=0,000 и t=31,03, p=0,000) через 1 и 3 мес соответственно в тестовой группе по сравнению с исходной и контрольной группой.
Результаты клинических исследований обобщены в целом ряде метаанализов, опубликованных в последние годы. В немецком метаанализе [67] показано, что омега-3-ПНЖК оказывают положительное влияние на заживление пародонтальных ран в отношении уменьшения PPD и увеличения уровня CAL. Британский метаанализ [68, 69] показал статистически значимое уменьшение PPD, увеличение CAL и снижение BoP при вмешательствах, связанных с применением омега-3-ПНЖК.
В метаанализе ученых из Нидерландов [70] показано, что дополнительное использование омега-3-ПНЖК к нехирургическому лечению пародонтита привело к снижению PPD на 0,39 мм (95% доверительный интервал – ДИ -0,58–-0,21) и увеличению CAL на 0,41 мм (95% ДИ -0,63–-0,19). В южнокорейском метаанализе [71] также показаны статистически значимое уменьшение PPD (стандартизованная средняя разница – SMD -0,81, абсолютная средняя разница – MD -0,44 мм), увеличение CAL (SMD -0,77, MD -0,51 мм) и снижение BoP (SMD -0,65, MD -9,45%) для вмешательств с использованием омега-3-ПНЖК.
В бельгийском метаанализе [72] отмечена статистически значимая разница в снижении PPD (SMD -0,78; 95% ДИ -1,02–-0,54; p<0,0001) и уменьшении потери CAL (SMD -0,80; 95% ДИ -1,04–-0,56; p<0,0001) при использовании омега-3-ПНЖК в качестве вспомогательного средства при нехирургическом лечении пародонтита.
В бразильском [73] и индийском [74] метаанализах также наглядно показано, что использование омега-3-ПНЖК в качестве адъювантной терапии пародонтита оказывает значительное позитивное влияние на уровень CAL и PРD через 3 и 6 мес терапии.
В систематическом обзоре немецких стоматологов, опубликованном в 2023 г., отмечается, что диетические вмешательства (прежде всего применение нутрицевтиков) в настоящее время становятся важным дополнением к нехирургической пародонтальной терапии [75]. Следовательно, нутрицевтики, содержащие в составе омега-3-ПНЖК, в том числе длинноцепочечные ЭПК и ДГК, целесообразно использовать в качестве адъювантной терапии при лечении заболеваний пародонта.
В качестве нутрицевтика выбора у больных с заболеваниями пародонта можно рассматривать биологически активную добавку к пище ГОЛД'Н АПОТЕКА Холестерол Контрол (GOLD'N APOTHEKA Cholesterol Control). Рекомендации по применению: взрослым принимать по 2–3 капсулы в день во время еды. Суточное содержание омега-3-ПНЖК, в том числе ЭПК и ДГК, в нутрицевтике Холестерол Контрол в большинстве случаев соответствует рассмотренным в клинических исследованиях и метаанализах, посвященных изучению влияния омега-3-ПНЖК на ткани пародонта (см. таблицу).
CoQ10 при заболеваниях пародонта
Заболевания пародонта – это воспалительный процесс, возникающий в результате взаимодействия бактериальной атаки и воспалительной реакции хозяина. Считается, что массивы молекул в тот или иной момент опосредуют воспалительную реакцию, среди них свободные радикалы и активные формы кислорода (АФК). Пародонтальные патогены могут вызывать перепроизводство АФК и, таким образом, вызывать разрушение коллагена и клеток пародонта. Когда АФК удаляются антиоксидантами, деградация коллагена может уменьшиться. Убихинол (восстановленная форма CoQ10) служит эндогенным антиоксидантом, который увеличивает концентрацию CoQ10 в пораженной десне и эффективно подавляет прогрессирующее воспаление пародонта [76].В британском обзоре [77] отмечается, CoQ10 имеет потенциальное значение при заболеваниях пародонта, поскольку обладает мощным антибактериальным, антиоксидантным и противовоспалительным действием. В нескольких исследованиях был выявлен дефицит CoQ10 в биопсиях десен пораженной ткани по сравнению с биопсиями, взятыми из здоровых участков у тех же пациентов [77]. При нехирургическом лечении пародонтита системный CoQ10 применяется 2 или 3 раза в день в течение 6 нед до 4 мес [78]. Чаще CoQ10 при пародонтитах применяется местно.
В метаанализе [79], изучавшем эффективность местного применения геля CoQ10 у пациентов с пародонтитом, показано, что CoQ10 может значительно снизить индекс зубного налета (SMD -0,64; 95% ДИ -1,03–-0,26, p=0,002; I2 85,7%), ВоР (SMD -1,05; 95% ДИ -1,70–-0,41; p=0,001; I2 89,5%), PРD (SMD -0,96; 95% ДИ -1,35–-0,58, p<0,001, I2 84,7%), CAL (SMD -0,73; 95% ДИ от -1,23–-0,22; p=0,005; I2 87,8%) и десневой индекс (SMD -0,63; 95% ДИ -0,97–-0,28; p=0,001; I2=72,8%) при пародонтите. Анализ подгрупп показал, что CoQ10 имел более сильный эффект снижения при внутрикарманном введении, а не при местном применении.
Таким образом, CoQ10 также может оказывать позитивный эффект при патологии пародонта и дополнять позитивные эффекты омега-3-ПНЖК в нутрицевтике Холестерол Контрол.
Заключение
Приведенные в обзоре данные свидетельствуют о наличии двунаправленной связи между дислипидемией и патологией пародонта и позволяют вести речь об их коморбидности. Позитивное влияние омега-3-ПНЖК и CoQ10 на воспалительный процесс в ткани пародонта позволяет рассматривать Холестерол Контрол не только как нутрицевтик выбора для профилактики и лечения дислипидемии у лиц с умеренно повышенными ХС ЛПНП и ТГ, но и у коморбидных пациентов с дислипидемией и заболеваниями пародонта, и у пациентов с пародонтитом без дислипидемии в качестве адъювантной терапии и профилактики дислипидемии.Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах
Information about the authors
Трухан Дмитрий Иванович – д-р мед. наук, доц., проф. каф. поликлинической терапии и внутренних болезней, ФГБОУ ВО ОмГМУ. E-mail: dmitry_trukhan@mail.ru;
ORCID: 0000-0002-1597-1876
Dmitry I. Trukhan – Dr. Sci. (Med.), Professor, Omsk State Medical University. E-mail: dmitry_trukhan@mail.ru;
ORCID: 0000-0002-1597-1876
Сулимов Анатолий Филиппович – д-р мед. наук, проф., зав. каф. челюстно-лицевой хирургии, ФГБОУ ВО ОмГМУ.
E-mail: afsulimov@yandex.ru.
Anatoly F. Sulimov – Dr. Sci. (Med.), Professor, Omsk State Medical University. E-mail: afsulimov@yandex.ru.
Трухан Лариса Юрьевна – канд. мед. наук, врач-стоматолог, ФГБОУ ВО ОмГМУ. E-mail: larissa_trukhan@mail.ru;
ORCID: 0000-0002-4721-6605
Larisa Yu. Trukhan – Cand. Sci. (Med.), Omsk State Medical University. E-mail: larissa_trukhan@mail.ru;
ORCID: 0000-0002-4721-6605
Поступила в редакцию: 17.03.2024
Поступила после рецензирования: 22.03.2024
Принята к публикации: 28.03.2024
Received: 17.03.2024
Revised: 22.03.2024
Accepted: 28.03.2024
Список исп. литературыСкрыть список1. Трухан Д.И., Филимонов С.Н., Темникова Е.А. Болезни сердечно-сосудистой системы: клиника, диагностика и лечение. Гериатрические аспекты в кардиологии. СПб.: СпецЛит, 2022. Режим доступа: https://elibrary.ru/item.asp?id=48110916
Trukhan D.I., Filimonov S.N., Temnikova E.A. Diseases of the cardiovascular system: clinical picture, diagnosis and treatment. Geriatric aspects in cardiology. Saint Petersburg: SpetsLit, 2022. Available at: https: //elibrary.ru/item.asp?id=48110916 (in Russian).
2. Клинические рекомендации. Нарушения липидного обмена. Одобрено на заседании Научно-практического совета Министерства здравоохранения Российской Федерации (заседание от 27.12.2022). Режим доступа: https://cr.minzdrav.gov.ru/recomend/752_1
Clinical recommendations. Lipid metabolism disorders. Approved at a meeting of the Scientific and Practical Council of the Ministry of Health of the Russian Federation (meeting dated December 27, 2022). Available at: https://cr.minzdrav.gov.ru/recomend/752_1 (in Russian).
3. Профилактика хронических неинфекционных заболеваний в Российской Федерации. Национальное руководство 2022. Кардиоваскулярная терапия и профилактика. 2022;21(4):3235. DOI: 10.15829/1728-8800-2022-3235
Prevention of chronic non-communicable diseases in the Russian Federation. National guidelines 2022. Cardiovascular therapy and prevention. 2022;21(4):3235. DOI: 10.15829/1728-8800-2022-3235 (in Russian).
4. Ference BA, Ginsberg HN, Graham I et al. Low-density lipoproteins cause atherosclerotic cardiovascular dis ease. 1. Evidence from genetic, epidemiologic, and clinical studies. A consensus statement from the European Atherosclerosis Society Consensus Panel. Eur Heart J 2017;38(32):2459-72. DOI: 10.1093/eurheartj/ehx144
5. Mozaffarian D, Lemaitre RN, King IB et al. Plasma Phospholipid Long-Chain – 3 Fatty Acids and Total and Cause-Specific Mortality in Older Adults. Ann Intern Med 2013;158(7):515-25. DOI: 10.7326/0003-4819-158-7-201304020-00003
6. Yang Q, Zhang Z, Gregg EW et al. Added sugar intake and cardiovascular diseases mortality among US adults. JAMA Intern Med 2014;174(4):516-24. DOI: 10.1001/jamainternmed.2013.13563
7. Abdelhamid AS, Brown TJ, Brainard JS et al. Omega-3 fatty acids for the primary and secondary prevention of cardiovascular disease. Cochrane Database Syst Rev 2020;3(3):CD003177. DOI: 10.1002/ 14651858.CD003177.pub5
8. Watanabe Y, Tatsuno I. Omega-3 polyunsaturated fatty acids focusing on eicosapentaenoic acid and docosahexaenoic acid in the prevention of cardiovascular diseases: a review of the state-of-the-art. Expert Rev Clin Pharmacol 2021;14(1):79-93. DOI: 10.1080/17512433.2021. 1863784
9. Rodriguez D, Lavie CJ, Elagizi A, Milani RV. Update on Omega-3 Polyunsaturated Fatty Acids on Cardiovascular Health. Nutrients 2022;14(23):5146. DOI: 10.3390/nu14235146
10. Mason RP, Libby P, Bhatt DL. Emerging Mechanisms of Cardiovascular Protection for the Omega-3 Fatty Acid Eicosapentaenoic Acid. Arterioscler Thromb Vasc Biol 2020;40(5):1135-47. DOI: 10.1161/ATVBAHA.119.313286
11. Djuricic I, Calder PC. Pros and Cons of Long-Chain Omega-3 Polyunsaturated Fatty Acids in Cardiovascular Health. Annu Rev Pharmacol Toxicol 2023;63:383-406. DOI: 10.1146/annurev-pharmtox-051921-090208
12. Trivedi K, Le V, Nelson JR. The case for adding eicosapentaenoic acid (icosapent ethyl) to the ABCs of cardiovascular disease prevention. Postgrad Med 2021;133(1):28-41. DOI: 10.1080/00325481.2020.1783937
13. Bhatt DL, Steg PG, Miller M et al; REDUCE-IT Investigators Cardiovascular Risk Reduction with Icosapent Ethyl for Hypertriglyceridemia. N Engl J Med 2019;380(1):11-22. DOI: 10.1056/NEJMoa1812792
14. Cicero AFG, Fogacci F, Banach M. Red Yeast Rice for Hypercholesterolemia. Methodist Debakey Cardiovasc J 2019;15(3):192-9. DOI: 10.14797/mdcj-15-3-192
15. Cicero AFG, Fogacci F, Stoian AP, Toth PP. Red Yeast Rice for the Improvement of Lipid Profiles in Mild-to-Moderate Hypercholesterolemia: A Narrative Review. Nutrients 2023;15(10):2288. DOI: 10.3390/nu15102288
16. Lu Z, Kou W, Du B et al. Effect of Xuezhikang, an Extract From Red Yeast Chinese Rice, on Coronary Events in a Chinese Population With Previous Myocardial Infarction. Am J Cardiol 2008;101(12):1689-93. DOI: 10.1016/j.amjcard.2008.02.056
17. Mazza A, Schiavon L, Rigatelli G et al. The short-term supplementation of monacolin K improves the lipid and metabolic patterns of hypertensive and hypercholesterolemic subjects at low cardiovascular risk. Food Funct 2018;9(7):3845-52. DOI: 10.1039/c8fo00415c
18. Cicero AFG, Fogacci F, Zambon A. Red Yeast Rice for Hypercholesterolemia: JACC Focus Seminar. J Am Coll Cardiol 2021;77(5):620-8. DOI: 10.1016/j.jacc.2020.11.056
19. Fogacci F, Giovannini M, Di Micoli V et al. Evaluation of the effect of a dietary supplementation with a red yeast rice and fish oil-containing nutraceutical on lipid pattern, high sensitivity C-reactive protein, and endothelial function in moderately hypercholesterolaemic subjects: a double-blind, placebo-controlled, randomized clinical trial. Arch Med Sci Atheroscler Dis 2023;8:e182-e189. DOI: 10.5114/amsad
/177444
20. Mantle D, Turton N, Hargreaves IP. Depletion and Supplementation of Coenzyme Q10 in Secondary Deficiency Disorders. Front Biosci (Landmark Ed) 2022;27(12):322. DOI: 10.31083/j.fbl2712322
21. Hargreaves I, Heaton RA, Mantle D. Disorders of Human Coenzyme Q10 Metabolism: An Overview. Int J Mol Sci 2020;21(18):6695. DOI: 10.3390/ijms21186695
22. Аронов Д.М. Применение коэнзима Q10 в кардиологической практике. РМЖ. 2004;15:905. Режим доступа: https://www.rmj.ru/articles/kardiologiya/Primenenie_koenzima_Q10_v_kardiologicheskoy_praktike/#ixzz8UcUZtEBA
Aronov D.M. Application of coenzyme Q10 in cardiological practice. RMJ. 2004;15:905. Available at: https://www.rmj.ru/articles/kardiologiya/Primenenie_koenzima_Q10_v_kardiologicheskoy_praktike/#ixzz8UcUZtEBA (in Russian).
23. Медведев О.С., Каленикова Е.И., Городецкая Е.А., Шашурин Д.А. Коэнзим Q10 в кардиологической практике – теоретические основы и результаты клинических исследований. РМЖ. 2009; 18: 1177. Режим доступа: https://www.rmj.ru/articles/kardiologiya/Koenzim_Q10_v_kardiologicheskoy_praktike__teoreticheskie_osnovy_i_rezulytaty__klinicheskih_issledovaniy/#ixzz8UcZmFdtQ
Medvedev O.S., Kalenikova E.I., Gorodetskaya E.A., Shashurin D.A. Coenzyme Q10 in cardiological practice – theoretical foundations and results of clinical studies. RMJ. 2009; 18: 1177. Available at: https://www.rmj.ru/articles/kardiologiya/Koenzim_Q10_v_kardiologicheskoy_praktike__teoreticheskie_osnovy_i_rezulytaty__klinicheskih_issledovaniy/#ixzz8UcZmFdtQ (in Russian).
24. Дзугкоев С.Г., Гармаш О.Ю., Дзугкоева Ф.С. Патогенетическое обоснование применения ингибитора 3-гидрокси-3-метилглутарил-коэнзим А редуктазы и антиоксиданта коэнзима Q10 в лечении и профилактике сердечно-сосудистой патологии. Кардиоваскулярная терапия и профилактика. 2021;20(6):2793. DOI: 10.15829/ 1728-8800-2021-2793
Dzugkoev S.G., Garmash O.Yu., Dzugkoeva F.S. Pathogenetic rationale for using an inhibitor of 3-hydroxy-3-methylglutaryl coenzyme A reductase and an antioxidant coenzyme Q10 in the treatment and prevention of cardiovascular disease. Cardiovascular Therapy and Prevention. 2021;20(6):2793. DOI: 10.15829/1728-8800-2021-2793 (in Russian).
25. Мареев В.Ю., Мареев Ю.В., Беграмбекова Ю.Л. Коэнзим Q10 в лечении больных с хронической сердечной недостаточностью и сниженной фракцией выброса левого желудочка: систематический обзор и мета-анализ. Кардиология. 2022;62(6):3-14. DOI: 10.18087/cardio.2022.6.n2050
Mareev V.Yu., Mareev Yu.V., Begrambekova Yu.L. Coenzyme Q10 in the treatment of patients with chronic heart failure and reduced left ventricular ejection fraction: a systematic review and meta-analysis. Cardiology. 2022;62(6):3-14. DOI: 10.18087/cardio.2022.6.n2050 (in Russian).
26. Mortensen AL, Rosenfeldt F, Filipiak KJ. Effect of coenzyme Q10 in Europeans with chronic heart failure: A sub-group analysis of the
Q-SYMBIO randomized double-blind trial. Cardiology Journal 2019;(26):147-6.
27. Клинические рекомендации (протоколы лечения) при диагнозе пародонтит. Режим доступа: http://www.e-stomatology.ru/director/protokols_30-09-2014/
Clinical guidelines (treatment protocols) in the diagnosis of periodontitis. Available at: http://www.e-stomatology.ru/director/protokols_30-09-2014 (in Russian).
28. Всемирная организация здравоохранения. Информационные бюллетени. Охрана здоровья полости рта. Режим доступа: https://www.who.int/ru/news-room/fact-sheets/detail/oral-health
World Health Organization. Oral health. Available at: https://www. who.int/ru/news-room/fact-sheets/detail/oral-health (in Russian).
29. Трухан Д.И., Трухан Л.Ю. Взаимоотношения болезней пародонта и сердечно-сосудистых заболеваний. Международный журнал сердца и сосудистых заболеваний. 2016;(11):15-24. DOI: 10.24412/2311-1623-2016-11-15-24
Trukhan D.I., Trukhan L.Yu. Relationship between periodontal and cardiovascular diseases. International Heart and Vascular Disease Journal. 2016;(11):15-24. DOI: 10.24412/2311-1623-2016-11-15-24 (in Russian).
30. Van Dyke TE, Starr JR. Unraveling the link between periodontitis and cardiovascular disease. J Am Heart Assoc 2013;2(6):e000657. DOI: 10.1161/JAHA.113.000657
31. O'Dwyer MC, Furgal A, Furst W et al. The Prevalence of Periodontitis Among US Adults with Multimorbidity Using NHANES Data 2011-2014. J Am Board Fam Med 2023;36(2):313-24. DOI: 10.3122/jabfm.2022.220207R1
32. Pietropaoli D, Cairo F, Citterio F et al. Italian working group on Hypertension and Periodontitis (Hy-Per Group). Practical Guidelines for Patients with Hypertension and Periodontitis. High Blood Press Cardiovasc Prev 2023;30(1):7-16. DOI: 10.1007/s40292-022-00553-2
33. Del Pinto R, Landi L, Grassi G et al; Italian working group on Hypertension, Periodontitis (Hy-Per Group). Hypertension and periodontitis: A joint report by the Italian society of hypertension (SIIA) and the Italian society of periodontology and implantology (SIdP). Oral Dis 2023;29(2):803-14. DOI: 10.1111/odi.14009
34. Трухан Д.И., Сулимов А.Ф., Трухан Л.Ю. Коморбидность ревматоидного артрита и заболеваний пародонта. Медицинский совет. 2024;18(5):60-9. DOI: 10.21518/ms2024-079
Trukhan D.I., Sulimov A.F., Trukhan L.Yu. Comorbidity of rheumatoid arthritis and periodontal diseases. Meditsinskiy Sovet. 2024;18(5):60-9. DOI: 10.21518/ms2024-079 (in Russian).
35. Трухан Д.И., Трухан Л.Ю. Пародонтит и сердечно-сосудистые заболевания: параллельно или в одной связке? Consilium Medicum. 2015;17(5):73-9. Режим доступа: https://elibrary.ru/item.asp? id=23762074
Trukhan D.I., Trukhan L.Yu. Periodontal and cardiovascular diseases: In parallel or in a bundle? Consilium Medicum. 2015;17(5):73-9. Available at: https://elibrary.ru/item.asp?id=23762074 (in Russian).
36. Трухан Д.И., Трухан Л.Ю. Некоторые аспекты коморбидности пародонтита и сердечно-сосудистых заболеваний. Медицинский совет. 2015;(17):12-6. Режим доступа: https://elibrary.ru/item.asp?id= 25450351
Trukhan D.I., Trukhan L.Yu. Some aspects of comorbidity of periodontitis and cardiovascular diseases. Medical advice. 2015;(17):12-6. Available at: http://elibrary.ru/item.asp?id=25450351 (in Russian).
37. Трухан Д.И., Трухан Л.Ю., Иванова Д.С. Коморбидность заболеваний сердечно-сосудистой системы и болезней органов пищеварения с изменениями органов и тканей полости рта. Клинический разбор в общей медицине. 2021;(3):6-17. DOI: 10.47407/kr2021.2.3. 00044
Trukhan D.I., Trukhan L.Yu, Ivanova D.S. Comorbidity of diseases of the cardiovascular system and diseases of the digestive organs with changes in organs and tissue of the oral cavity. Clinical review for general practice. 2021;(3):6-17. DOI: 10.47407/kr2021.2.3.00044 (in Russian).
38. Трухан Д.И., Сулимов А.Ф., Трухан Л.Ю. Возможные ассоциации патологии пародонта и новой коронавирусной инфекции (COVID-19). Клинический разбор в общей медицине. 2022;(2):6-12. DOI: 10.47407/kr2022.3.2.00120
Trukhan D.I., Sulimov A.F., Trukhan L.Yu. Possible associations of periodontal pathology and new coronavirus infection (COVID-19). Clinical review for general practice. 2022;(2):6-12. DOI: 10.47407/kr2022. 3.2.00120 (in Russian).
39. Трухан Д.И., Сулимов А.Ф., Трухан Л.Ю. Коморбидность артериальной гипертензии и пародонтита: стоматологическая гипертензия. Клинический разбор в общей медицине. 2023;4(6):62-8. DOI: 10.47407/kr2023.4.5.00273
Trukhan D.I., Sulimov A.F., Trukhan L.Yu. Comorbidity of arterial hypertension and periodontitis: dental hypertension. Clinical review for general practice. 2023;4(6):62-8. DOI: 10.47407/kr2023.4.5.00273 (in Russian).
40. Трухан Д.И., Сулимов А.Ф., Трухан Л.Ю. Ассоциация артериальной гипертензии и патологии пародонта: обзор новых данных. Фарматека. 2023;30(9-10):40-51. DOI: 10.18565/pharmateca.2023.9-10.40-51
Trukhan D.I., Sulimov A.F., Trukhan L.Yu. Association of arterial hypertension and periodontal disease: a review of new data. Farmateka. 2023;30(9-10):40-51. DOI: 10.18565/pharmateca.2023.9-10.40-51 (in Russian).
41. Zhang DH, Yuan QN, Zabala PM et al. Diabetic and cardiovascular risk in patients diagnosed with periodontitis. Aust Dent J 2015;60(4):455-62. DOI: 10.1111/adj.12253
42. Salvi GE, Carollo-Bittel E, Lang NP. Effects the diabetes mellitus on periodontal and peri-implant conditions: update on associations and risks. J Clin Periodontol 2008;35(8 Suppl):398-409. DOI: 10.1111/j.1600-051X.2008.01282.x
43. Vieira CL, Cury PR, Miname MH et al. Severe periodontitis is associated with diastolic blood pressure elevation in individuals with heterozygous familial hypercholesterolemia: a pilot study. J Periodontol 2011;82(5):683-8. DOI: 10.1902/jop.2010.100496
44. Golpasand Hagh L, Zakavi F, Hajizadeh F, Saleki M. The association between hyperlipidemia and periodontal infection. Iran Red Crescent Med J 2014;16(12):e6577. DOI: 10.5812/ircmj.6577
45. Sandi RM, Pol KG, Basavaraj P et al. Association of Serum Cholesterol, Triglyceride, High and Low Density Lipoprotein (HDL and LDL) Levels in Chronic Periodontitis Subjects with Risk for Cardiovascular Disease (CVD): A Cross Sectional Study. J Clin Diagn Res 2014;8(1):214-6. DOI: 10.7860/JCDR/2014/6686.3927.
46. Vieira RW. Cardiovascular and periodontal diseases. Rev Bras Cir Cardiovasc 2014;29(1):VII-IX. DOI: 10.5935/1678-9741.20140003
47. Zeigler CC, Wondimu B, Marcus C, Modéer T. Pathological periodontal pockets are associated with raised diastolic blood pressure in obese adolescents. BMC Oral Health 2015;15(1):41. DOI: 10.1186/s12903-015-0026-6
48. Lianhui Y, Meifei L, Zhongyue H, Yunzhi F. Association between chronic periodontitis and hyperlipidemia: a Meta-analysis based on observational studies. Hua Xi Kou Qiang Yi Xue Za Zhi 2017;35(4):419-26. DOI: 10.7518/hxkq.2017.04.015
49. Xu J, Duan X. Association between periodontitis and hyperlipidaemia: A systematic review and meta-analysis. Clin Exp Pharmacol Physiol 2020;47(11):1861-73. DOI: 10.1111/1440-1681.13372
50. Leite AC, Carneiro VM, Guimarães Mdo C. Effects of periodontal therapy on C-reactive protein and HDL in serum of subjects with periodontitis. Rev Bras Cir Cardiovasc 2014;29(1):69-77. DOI: 10.5935/1678-9741.20140013
51. Caúla AL, Lira-Junior R, Tinoco EM, Fischer RG. The effect of periodontal therapy on cardiovascular risk markers: a 6-month randomized clinical trial. J Clin Periodontol 2014;41(9):875-82. DOI: 10.1111/jcpe.12290
52. Friedewald VE, Kornman KS, Beck JD et al. The American Journal of Cardiology and Journal of Periodontology editors' consensus: periodontitis and atherosclerotic cardiovascular disease. J Periodontol 2009;(80):1021-32. DOI: 10.1902/jop.2009.097001
53. Salminen A, Määttä AM, Mäntylä P et al. Systemic Metabolic Signatures of Oral Diseases. J Dent Res 2024;103(1):13-21. DOI: 10.1177/00220345231203562
54. Ramirez-Tortosa MC, Quiles JL et al. Periodontitis is associated with altered plasma fatty acids and cardiovascular risk markers. Nutr Metab Cardiovasc Dis 2010;20(2):133-9. DOI: 10.1016/j.numecd.2009. 03.003
55. Sculley DV. Periodontal disease: modulation of the inflammatory cascade by dietary n-3 polyunsaturated fatty acids. J Periodontal Res 2014;49(3):277-81. DOI: 10.1111/jre.12116
56. Panezai J, van Dyke T. Polyunsaturated Fatty Acids and Their Immunomodulatory Actions in Periodontal Disease. Nutrients 2023;15(4):821. DOI: 10.3390/nu15040821
57. Naqvi AZ, Hasturk H, Mu L et al. Docosahexaenoic Acid and Periodontitis in Adults: A Randomized Controlled Trial. J Dent Res 2014;93(8):767-73. DOI: 10.1177/0022034514541125
58. Tabbaa M, Golubic M, Roizen MF, Bernstein AM. Docosahexaenoic acid, inflammation, and bacterial dysbiosis in relation to periodontal disease, inflammatory bowel disease, and the metabolic syndrome. Nutrients 2013;5(8):3299-310. DOI: 10.3390/nu5083299
59. Azzi DV, Viafara JAS, Zangeronimo MG et al. n-3 Ingestion may modulate the severity of periodontal disease? Systematic review. Crit Rev Food Sci Nutr 2018;58(11):1937-42. DOI: 10.1080/10408398. 2017.1278677
60. Sun M, Zhou Z, Dong J et al. Antibacterial and antibiofilm activities of docosahexaenoic acid (DHA) and eicosapentaenoic acid (EPA) against periodontopathic bacteria. Microb Pathog 2016;99:196-203. DOI: 10.1016/j.micpath.2016.08.025
61. Sun M, Dong J, Xia Y, Shu R. Antibacterial activities of docosahexaenoic acid (DHA) and eicosapentaenoic acid (EPA) against planktonic and biofilm growing Streptococcus mutans. Microb Pathog 2017;107:212-8. DOI: 10.1016/j.micpath.2017.03.040
62. Sette-de-Souza PH, Silva Bezerra WMD, Gomes Dantas MK et al. Identification of docosahexaenoic and eicosapentaenoic acids multiple targets facing periodontopathogens. Microb Pathog 2021;161(Pt A):105266. DOI: 10.1016/j.micpath.2021.105266
63. El-Sharkawy H, Aboelsaad N, Eliwa M et al. Adjunctive treatment of chronic periodontitis with daily dietary supplementation with omega-3 Fatty acids and low-dose aspirin. J Periodontol 2010;81(11):1635-43. DOI: 10.1902/jop.2010.090628
64. Maybodi FR, Fakhari M, Tavakoli F. Effects of omega-3 supplementation as an adjunct to non-surgical periodontal therapy on periodontal parameters in periodontitis patients: a randomized clinical trial. BMC Oral Health 2022;22(1):521. DOI: 10.1186/s12903-022-02569-5
65. Stańdo M, Piatek P, Namiecinska M et al. Omega-3 Polyunsaturated Fatty Acids EPA and DHA as an Adjunct to Non-Surgical Treatment of Periodontitis: A Randomized Clinical Trial. Nutrients 2020;12(9):2614. DOI: 10.3390/nu12092614
66. Kujur SK, Goswami V, Nikunj AM et al. Efficacy of omega 3 fatty acid as an adjunct in the management of chronic periodontitis: A randomized controlled trial. Indian J Dent Res 2020;31(2):229-35. DOI: 10.4103/ijdr.IJDR_647_18
67. Kruse AB, Kowalski CD, Leuthold S et al. What is the impact of the adjunctive use of omega-3 fatty acids in the treatment of periodontitis? A systematic review and meta-analysis. Lipids Health Dis 2020;19(1):100. DOI: 10.1186/s12944-020-01267-x
68. Wadia R. Periodontitis and omega-3 fatty acids. Br Dent J 2022;232(8):533. DOI: 10.1038/s41415-022-4212-z
69. Wadia R. Omega 3 fatty acids for periodontitis patients. Br Dent J 2022;233(2):122. DOI: 10.1038/s41415-022-4516-z
70. Van Ravensteijn MM, Timmerman MF, Brouwer EAG, Slot DE. The effect of omega-3 fatty acids on active periodontal therapy: A systematic review and meta-analysis. J Clin Periodontol 2022;49(10):1024-37. DOI: 10.1111/jcpe.13680
71. Heo H, Bae JH, Amano A et al. Supplemental or dietary intake of omega-3 fatty acids for the treatment of periodontitis: A meta-analysis. J Clin Periodontol 2022;49(4):362-77. DOI: 10.1111/jcpe.13603
72. Miroult C, Lasserre J, Toma S. Effects of Omega-3 as an adjuvant in the treatment of periodontal disease: A systematic review and meta-analysis. Clin Exp Dent Res 2023;9(4):545-56. DOI: 10.1002/cre2.736
73. Castro Dos Santos NC, Furukawa MV, Oliveira-Cardoso I et al. Does the use of omega-3 fatty acids as an adjunct to non-surgical periodontal therapy provide additional benefits in the treatment of periodontitis? A systematic review and meta-analysis. J Periodontal Res 2022;57(3):435-47. DOI: 10.1111/jre.12984
74. Chatterjee D, Chatterjee A, Kalra D et al. Role of adjunct use of omega 3 fatty acids in periodontal therapy of periodontitis. A systematic review and meta-analysis. J Oral Biol Craniofac Res 2022;12(1):55-62. DOI: 10.1016/j.jobcr.2021.10.005
75. Woelber JP, Reichenbächer K, Groß T et al. Dietary and Nutraceutical Interventions as an Adjunct to Non-Surgical Periodontal Therapy-A Systematic Review. Nutrients 2023;15(6):1538. DOI: 10.3390/ nu15061538
76. Prakash S, Sunitha J, Hans M. Role of coenzyme Q(10) as an antioxidant and bioenergizer in periodontal diseases. Indian J Pharmacol 2010;42(6):334-7. DOI: 10.4103/0253-7613.71884
77. Mantle D, Turton N, Hargreaves IP. Depletion and Supplementation of Coenzyme Q10 in Secondary Deficiency Disorders. Front Biosci (Landmark Ed) 2022;27(12):322. DOI: 10.31083/j.fbl2712322
78. Merle CL, Lenzen C, Schmalz G, Ziebolz D. Systematic Review on Protocols of Coenzyme Q10 Supplementation in Non-Surgical Periodontitis Therapy. Nutrients 2023;15(7):1585. DOI: 10.3390/nu15071585
79. Rasoolzadeh EA, Shidfar F, Rasoolzadeh RA, Hezaveh ZS. The effect of coenzyme Q10 on periodontitis: a systematic review and meta-analysis of clinical trials. J Evid Based Dent Pract 2022;22(2):101710. DOI: 10.1016/j.jebdp.2022.101710

